© Clovis Boibessot, 2021
Caractérisation du dialogue entre macrophages et
cellules cancéreuses dans le microenvironnement
tumoral du cancer de la prostate
Thèse
Clovis Boibessot
Doctorat en microbiologie-immunologie
Philosophiæ doctor (Ph. D.)
Caractérisation du dialogue entre macrophages et
cellules cancéreuses dans le microenvironnement
tumoral du cancer de la prostate
Thèse
Clovis Boibessot
Sous la direction de :
Dr. Paul Toren, directeur de recherche
Dr. Alain Bergeron, codirecteur de recherche
ii
Résumé
Avec une incidence de 23 300 nouveaux cas en 2020 (ce qui représente 20% de tous les nouveaux cas de cancer chez l’homme) et de 4200 décès (10% de tous les décès par cancer chez l’homme), le cancer de la prostate est le cancer le plus fréquemment diagnostiqué chez l’homme au Canada. Il s’agit d’un cancer hormono-dépendant, traité depuis plus de 70 ans par thérapie anti-androgénique. Le succès des nouvelles immunothérapies basées sur la réactivation des lymphocytes T dans certaines pathologies cancéreuses (vessie, poumon, peau, etc.) et leur échec retentissant dans d’autres (incluant le cancer de la prostate) poussent la communauté scientifique à explorer l’impact de la composante innée du système immunitaire dans la réponse aux immunothérapies. Les tumeurs évoluent en tant qu'écosystèmes complexes, constitués entre autres de cellules tumorales, stromales et de cellules immunitaires. Longtemps considéré comme une tumeur « froide », caractérisée par une faible infiltration immunitaire et comme cancer peu immunogènique, une population de cellules d’origine myéloïdes, les macrophages, sont depuis quelques années reconnus pour leur rôle majeur dans cet écosystème. Dans un premier temps ils seraient impliqués dans une séquence inflammatoire qui favoriserait le développement de la tumeur, puis, une fois la tumeur installée, les macrophages associés aux tumeurs (Tumor-associated macrophages – TAM) grâce à leur très grande plasticité, favoriseraient un environnement immunosuppresseur, l’angiogenèse, l’invasion de cellules tumorales et la formation de niche pré-métastatiques tout en supprimant la réponse des lymphocytes T cytotoxiques. On parle alors de rééducation du système immunitaire par la tumeur. De plus, de solides évidences ont montré l’implication des macrophages dans la résistance à la chimiothérapie et à la radiothérapie dans le cancer de la prostate.
Basé sur ces observations, nous avons, dans un premier temps, étudié la rééducation de macrophages, au départ à vocation anti-tumorale, en TAM dans le microenvironnement du cancer de la prostate. Nous avons ainsi pu montrer par que les TAM qui apportent le plus d’information sur la progression de la maladie semblent localisés en dehors de la tumeur, dans le tissu adjacent d’apparence normale. Nous avons ainsi pu mettre en place un nouveau système de culture ex vivo de biopsies de patients et trouvé que des TAM avec un phénotype mixte M1 (CCR7+) /M2 (CD163+) étaient présents en grande quantité dans les cancers de prostate agressifs. Nous avons finalement recréé artificiellement dans un modèle de co-culture une façon innovante d’obtenir des macrophages avec le même phénotype et observé qu’indépendamment de leur phénotype de polarisation de base (M1 ou M2), les cellules de cancer de la prostate changeaient ces macrophages pour leur donner une fonction identique tout en les empêchant d’être rééduqués en macrophage M1. Le séquençage des différents macrophages subvertis nous a permis de déterminer que la ré-éducation des macrophages M2 vers un M1 en présence de cellules cancéreuses était accompagnée d’un changement dans le réseau de chimiokines transcrites vers un profil de chimiokines qui favorisent le recrutement de neutrophiles et le remodelage tissulaire et osseux.
iii
Dans un second temps, nous avons utilisé les informations sur la localisation spatiale des TAM pour inclure plus de tissu adjacent d’apparence normale dans notre système de culture ex vivo. Nous avons alors évalué l’impact d’un traitement actuellement utilisé en clinique, l’enzalutamide, sur la composante immune du microenvironnement tumoral, plus précisément sur les macrophages. Nous avons pu déterminer que l’observation seule de marqueurs à la surface des macrophages via une dichotomie positive/négative ne permettait pas de visualiser de changements. À l’inverse, l’utilisation de sous-populations basées sur la forte/faible expression de marqueurs (CD163, CCR7, CD206) nous permettait d’observer un changement dans la composition du type de macrophages associé à une augmentation de points de contrôle immunologique à leur surface (PD-L1, PD-L2 et B7-H3). Une forte proportion de macrophages PD-L1+ était associée à un plus faible volume tumoral et un ratio neutrophiles/lymphocytes plus élevé tandis qu’une forte proportion de macrophages B7-H3+ était associée avec la présence de carcinome intracanalaire de la prostate, une forme agressive du cancer de la prostate.
Ce projet nous a aussi permis de mettre en exergue l’importance de l’utilisation de la cytométrie de flux multiparamétrique comme technique de phénotypage de ces macrophages dans des échantillons biologiques mais surtout l’utilité de cibler à l’aide du multimarquage des sous-populations définies par l’expression de biomarqueurs spécifiques afin de mieux caractériser cette composante importante du microenvironement tumoral prostatique. Enfin, ce travail permet de mieux comprendre la plasticité des macrophages dans un contexte de cancer de prostate agressif ainsi que l’ontogénie des macrophages pro-tumoraux recrutés ou subvertis. Il permet d’amener une approche nouvelle sur l’obtention de macrophages pro-tumoraux et leur utilisation comme modèle pour mimer in vitro les TAM.
iv
Abstract
With an incidence of 23,300 new cases in 2020 (representing 20% of all new cancer cases in humans) and of 4,200 deaths (10% of all cancer deaths in humans), prostate cancer is the non-cutaneous cancer most frequently diagnosed in men in Canada. It is a hormone-dependent cancer, treated for over 70 years with anti-androgen therapy. The success of new immunotherapies based on the reactivation of T lymphocytes in certain cancers (bladder, lung, skin, etc.) and their failure of checkpoint immunotherapy in prostate cancers and others have prompted further exploration of the impact of the innate component of the immune system in the response to immunotherapies. Tumors evolve as a complex ecosystem, mainly made up of tumor cells, stromal cells, and immune cells. Long considered as a "cold" tumor characterized by low immune cell infiltration and poorly immunogenic, the role of innate immune cells such as macrophages within the prostate tumor ecosystem remain to be fully defined. Initially, macrophages may be involved in an inflammatory sequence which promotes tumor development. Later, tumor-associated macrophages (TAMs) due to their very high plasticity, may play a role in promoting an immunosuppressive environment, angiogenesis, tumor cell invasion and pre-metastatic niche formation while suppressing the response of cytotoxic T cells. These activities mediated by TAMS which are effectively re-educated o by the tumor. This is consistent with the association of macrophages and resistance to chemotherapy and radiotherapy in prostate cancer.
Based on these observations, first, we studied the re-education of macrophages, particularly thoses which first present with an anti-tumor phenotype within the prostate cancer microenvironment. We show that the TAMs, which coincide most strongly with clinical outcomes are in fact located peripherally to the tumor in the adjacent-normal tissue. We developed a novel system for ex vivo culture of patient biopsies and observed in aggressive prostate cancers that TAMs with a mixed M1 (CCR7+) / M2 (CD163+) phenotype were present in larger quantities. We modeled in a co-culture system an innovative way to obtain TAMs with this same phenotype and observed that regardless of their starting polarization phenotype (M1 or M2), prostate cancer cells changed these macrophages to give them an identical function while preventing them from being re-educated as M1 macrophage. The sequencing of the different subverted macrophages allowed us to determine that the re-education of M2 macrophages to M1 in the presence of cancer cells was accompanied by a change in the chemokine network transcribed towards a profile of chemokines that promote the recruitment of neutrophils and tissue and bone remodeling.
Second, we used the information on the spatial location of the TAMs to include more adjacent, apparently normal tissue in our ex vivo culture system. We then evaluated the impact of a treatment currently used in the clinic, enzalutamide, on the immune composition of the tumor microenvironment, more specifically on TAMs We were able to determine that the observation of markers on the surface of macrophages alone via a dichotomous
v
classification did not permit identification of any induced changes. However, with macrophage subpopulations based on the high/low expression of markers (CD163, CCR7, CD206), we observed a change in the composition of the type of macrophages associated with an increase in immune checkpoints on their surface (PD-L1, PD-L2 and B7-H3). A high proportion of PD-L1+ macrophages was associated with a lower tumor volume and a high neutrophil to lymphocyte ratio with a high proportion of B7-H3+ macrophages was associated with the presence of intracanal carcinoma of the prostate, an aggressive form of prostate cancer.
This project allowed us to highlight the importance of the use of multiparametric flow cytometry as a technique of phenotyping on these macrophages in biological samples but above all the usefulness of targeting, using multiple markers, subpopulations defined by expression of specific biomarkers in order to better characterize this important component of the tumor microenvironment. Finally, this work allows us to better understand the plasticity of macrophages in a context of aggressive PCa as well as the ontogeny of recruited or subverted pro-tumoral macrophages. It provides a new approach to obtain human pro-pro-tumoral macrophages and an in vitro model which mimics TAMs.
vi
Table des matières
Résumé ... ii
Abstract ... iv
Table des matières ... vi
Liste des figures ... ix
Liste des tableaux ... xi
Liste des abréviations ... xii
Remerciements ... xvi Avant-propos ... xvii Introduction ... 1 1) Le cancer de la prostate ... 1 a. Épidémiologie ... 1 b. Facteurs de risque ... 1 i. Âge ... 1
ii. Antécédents familiaux ... 1
iii. Ethnicité ... 1
c. Histologie physiologique de la prostate ... 2
i. La prostate saine ... 2
ii. Architecture de la prostate ... 2
iii. Progression vers un PCa ... 3
d. Le récepteur aux androgènes dans la prostate ... 3
i. Stéroïdogénèse et voies de signalisation ... 3
ii. AR, PSA et PCa ... 4
e. Diagnostic du PCa ... 5
i. Dépistage précoce ... 5
ii. Bilan clinique ... 5
iii. Bilan biochimique ... 5
iv. Imagerie à visée diagnostique ... 6
v. Bilan d’extension et imagerie ... 7
vi. Les biopsies de prostate ... 8
f. Anatomopathologie du PCa ... 8
vii
ii. Système de classification selon le score de Gleason ... 10
g. Arbre de traitements du PCa ... 11
i. Les traitements de surveillance ... 12
ii. Les traitements localisés ... 12
iii. Les traitements systémiques - Hormonothérapies ... 13
iv. Les traitements systémiques - Chimiothérapies ... 14
v. Les traitements systémiques - Thérapies par produits radioactifs ... 15
2) Le système immunitaire : clé de voûte de la progression tumorale ... 16
a. « The Hallmarks of cancer » ... 16
b. L’immunité antitumorale ... 17
i. Les cellules de l’immunité innée ... 17
ii. Les cellules présentatrices d’antigènes ... 19
iii. Les lymphocytes et la réponse adaptative ... 20
iv. Le cycle « cancer – immunité » ... 23
c. Naissance du concept d’immunosurveillance des tumeurs ... 24
i. La genèse et les preuves du concept ... 24
ii. De la controverse à la renaissance du concept ... 25
d. La théorie des 3 « E » de Dunn & Schreiber : l’immunoediting ... 25
i. Phase d’élimination : quand réponses innées et adaptatives coopèrent ... 26
ii. Phase d’équilibre dynamique et dormance cellulaire ... 27
iii. Phase d’échappement ou l’échec de l’immunosurveillance ... 27
e. Les points de contrôle immunologiques ... 29
i. Définition ... 29
ii. Les inhibiteurs de PCI dans le PCa ... 30
iii. Place des autres immunothérapies dans le PCa ... 30
f. Immunogénicité des cancers ... 31
i. Généralités ... 31
ii. Mort cellulaire immunogénique et non-immunogénique. ... 34
iii. Immunogénicité du cancer de la prostate et infiltration immunitaire ... 35
3) Macrophages et TAM ... 36
a. Origine et fonctions ... 36
i. Du monocyte au macrophage ... 36
viii
iii. Paradigme M1/M2 et modèle mutuellement exclusif ... 37
b. (Plasticité cellulaire) x (microenvironnement tumoral) = TAM ... 39
i. Les TAM, des macrophages ambigus ... 39
ii. Fonctions des TAM au sein du TME ... 40
iii. Importance des TAM dans le paysage immunologique du PCa ... 42
4) Problématique ... 43
5) Hypothèse, objectifs et description de la recherche ... 44
Chapitre 1 : Macrophage re-education in prostate cancer: subversion of inflammatory macrophages to a mixed immunosuppressive tumor-associated macrophage phenotype ... 46
1.1 Résumé ... 47
1.2 Abstract ... 48
1.3 Introduction ... 48
1.4 Material and methods ... 50
1.5 Results ... 56
1.6 Discussion ... 68
1.7 Conclusion ... 70
1.8 References ... 70
1.9 Supplementals ... 71
Chapitre 2 : Ex vivo culture of prostate needle biopsies to assess macrophage immune phenotype changes following exposure to therapeutic drugs ... 83
2.1 Résumé ... 84
2.2 Abstract ... 85
2.3 Introduction ... 86
2.4 Material and methods ... 87
2.5 Results ... 89 2.6 Discussion ... 98 2.7 Conclusion ... 100 2.8 References ... 100 2.9 Supplementals ... 102 Discussion générale ... 105 Conclusion ... 114 Bibliographie ... 115
ix
Liste des figures
Introduction
Figure 1 : Anatomie générale de la prostate………..………2
Figure 2 : Histologie générale de la prostate……….………3
Figure 3 : Voie génomique canonique de l’AR………..………..4
Figure 4 : Schéma de prise de biopsies……….…………9
Figure 5 : Illustration adaptée du score de Gleason………..………….13
Figure 6 : Arbre de décision simplifié pour traiter les patients avec un PCa non métastatique (M0) au Québec……….17
Figure 7 : Les 10 caractéristiques ou « Hallmarks » du cancer……….…………..19
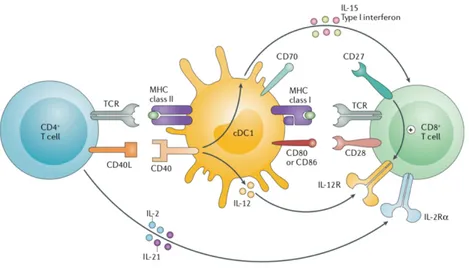
Figure 8 : Optimisation de la présence antigénique et de l’amorçage des CTL………..………..24
Figure 9 : Le cycle « cancer – immunité »………..…………..26
Figure 10 : Les 3 phases de l’immunoéditing du cancer………..………..28
Figure 11 : Mécanisme d’échappement des cellules tumorales au système immunitaire………..…………..31
Figure 12 : Points de contrôle immunologiques (liste non exhaustive)………..……….32
Figure 13 : Mutations, néoantigènes et immunogénicité………..……….34
Figure 14 : Fréquence des mutations somatiques observées dans les exomes de 3083 paires de tissus normal/tumoral………35
Figure 15 : Les différents phénotypes « cancer – immunité »………...……36
Figure 16 : Présentation antigénique simplifiée pour des antigènes endogènes (a) ou exogènes (b)………….39
Figure 17 : Paradigme de la polarisation M1/M2………..…..40
Figure 18 : Spectre de polarisation des macrophages……….42
Figure 19 : Stimuli du TIME et du TME amenant à un TAM………43
Figure 20 : Fonctions de régulation directe (a) et indirecte (b) des TAM sur les composants du TIME et du TME………..44
Figure 21 : Densité des macrophages et implications cliniques………..……….45
Chapitre 1
Figure 1 : TAMs expressing CD163 within the surrounding tumor environment predict poor prognosis…….…...56x
Figure 2 : Prostate tumors and adjacent normal tissues contain macrophages expressing both M1 and M2 characteristics……….58 Figure 3 : M1 macrophages are re-educated by PCa cells with loss of cytotoxic function……….………...60 Figure 4 : M1 and M2 macrophages can switch their phenotypes to M2 and M1 phenotypes, respectively……...62 Figure 5 : MR49C cells inhibit M2 into M1 macrophage reprogramming to favor TAM phenotype……….….64 Figure 6 : MR49C cells induce macrophage reprogramming of chemokine network during re-education…….…66
Chapitre 2
Figure 1 : Effect of enzalutamide on the ratio of CD163+/CD68+ cells in ex vivo cultured prostate tumor specimens………89 Figure 2 : Short-term enzalutamide treatment of ex vivo cultured prostate cancer biopsies induces no changes in macrophage-associated markers within immune population………92 Figure 3 : Short-term enzalutamide treatment of ex vivo cultured prostate cancer biopsies induces no changes in macrophage phenotype……….93 Figure 4 : short-term enzalutamide treatment of prostate cancer biopsies induces changes in macrophage landscape ………95
xi
Liste des tableaux
Introduction
Tableau 1 : Classification TNM……….……….9 Tableau 2 : Définition histologique de chacun des groupes du nouveau système de gradation GGG (ISUP, 2014)……….11
Chapitre 2
Tableau 1 : Baseline characteristics of the cohorts………...91 Tableau 2 : Spearman interpatient correlation between clinico-pathological characteristics and macrophage-associated markers within total immune cell population………96 Tableau 3 : Spearman interpatient correlation between clinico-pathological characteristics and macrophage-associated markers within macrophage population………...97 Tableau 4 : Spearman interpatient correlation between clinico-pathological characteristics and mean fluorescence intensity of macrophage-associated markers within macrophage population………98
xii
Liste des abréviations
ADCC Cytotoxicité à médiation cellulaire dépendante des anticorps ADN acide désoxyribonucléique
APC Antigen presenting cell
AR Androgen receptor
ARE Androgen-response element ATP Adénosine triphosphate
BPH Hypertrophie bénigne de la prostate CAF Cancer-associated fibroblast CCLx Chemokine (C-C motif) ligand-x CD Cluster de différenciation
CDC Cytotoxicité cellulaire dépendante du complément CKI Checkpoint inhibitor
CLR C-type lectin receptors
CMH Complexe majeur d’histocompatibilité CTL Lymphocyte T cytotoxique
CXCLx C-X-C motif chemokine ligand-x
DAMP Damaged-associated molecular patterns
DC Dendritic cells
DHT Dihydrotestostérone DRE Digital Rectal Examination
ESUR European Society of Urogenital Radiology ETR Échographie transrectale
FDG Fluorodeoxyglucose
GGG Gleason Grade Group
GM-CSF Granulocyte-monocyte colony stimulating factor GnRH Gonadotrophin Releasing Hormone
xiii
HSP Heat shock protein
ICI Immune checkpoint inhibitor IFN-g Interferon gamma
IL Interleukine
ISUP International Society of Urological Pathology KIR Killer-cell immunoglobulin-like receptor
LT Lymphocyte T
LB Lymphocyte B
LH Luteinizing hormone
LMP Low molecular mass polypeptide
LPS Lipopolysaccharide
MAPK Mitogen-activated protein kinase MDSC Monocyte-derived suppressor cells MICA/B MHC class I chain-related molecules A/B MMR Mismatch repair
MRI Imagerie par résonnance magnétique M-CSF Monocyte colony stimulating factor
NK Natural killer
NKT Natural killer T-cell
NLR Neutrophil-to-lymphocyte ratio NOS Nitric oxyde species
OMS Organisation mondiale de la santé PAMP Pathogen-associated molecular pattern PAP Phosphatase acide prostatique
PCa Prostate Cancer
PCI Points de contrôle immunologiques PD-L1/2 Programmed death ligand-1 ou 2
PIRADS Prostate Imaging-Reporting and Data System PIN Néoplasie intra-épithéliale
xiv PR Prostatectomie radicale
PRR Pattern recognition receptors PSA Prostate specific antigen RAG Recombination-activating genes ROS Reactive oxygen species
RT Radiothérapie
STAT Signal transducer and activator of transcription TAA Tumor-associated antigen
TAM Tumor-associated macrophage
TAP1 Transporter associated with antigen processing 1 TCGA The Cancer Genome Atlas
TCR T-Cell receptor
TEP Tomographie par émission de positrons TGF Tumor growth factor
TMB Tumor mutational burden TME Tumor microenvironment TNF Tumor necrosis factor TNM Tumor, node, metastasis
TRAIL Tumor-necrosis-factor related apoptosis inducing ligand TSA Tumor-specific antigen
UICC Union International Contre le Cancer VEGF Vascular endothelial growth factor
xv
«
Don’t worry. As long as you hit that wire with the connecting hook at precisely eighty-eight miles per hour the instant the lightning strikes the tower… Everything will be fine. »xvi
Remerciements
Dans tout travail de recherche il y a de l’autonomie, un investissement personnel immense mais aussi et surtout des collègues qui sont là pour nous épauler et nous guider pendant nos périodes sombres.
Dans un premier temps, je tiens à remercier le Dr. Paul Toren qui m’a offert la chance de travailler dans son laboratoire. Vous n’avez pas hésité à me laisser une grande liberté dans mes travaux de recherche et ce fut un plaisir de travailler avec vous. Je souhaite remercier chaleureusement le Dr. Alain Bergeron qui a accepté de me prendre en co-direction, qui m’a épaulé dans les moments importants et qui m’a beaucoup aidé durant ces derniers mois. Vous êtes deux personnes avec beaucoup de patience, d’humanité et dans mon travail de recherche cela a beaucoup joué.
Je remercie également les membres du Jury pour avoir accepté d’évaluer ma thèse.
Un grand merci au Rotary Clubs de Gray et de Québec pour m’avoir accueilli, aidé et soutenu durant mes quatre années de doctorat.
J’ai forcément une pensée pour les piliers du LUOE (Bertrand, Gabriel, Karine, Valérie). Vous donnez une grande bouffée de science fraiche dans ce laboratoire et vous m’avez énormément apporté que ce soit amicalement ou scientifiquement.
À tous les autres membres du côté fondamental et clinique qui fournissent un très gros travail : merci à toutes et tous.
Le Canada a été une rude épreuve semée de froid et de résultats négatifs. Sans Denise, sans Pascale et sans Marjorie, le Canada aurait, en plus, été semé de mauvaises soirées! Merci à vous les filles d’avoir apporté beaucoup de fous rires dans mon aventure.
Merci aux trois mousquetaires mexicains : Oscar (Pablo), Juan (Johan) et Felippe (Philipe) sans oublier Chef Jeff. Merci pour avoir été mes amis de tous les jours et surtout des vendredis et samedis soir. Grâce à vous mon intégration s’est faite rapidement.
Je tiens à remercier particulièrement mes parents, Luc et Myriam, ma tante Karine, mon frère Thomas, ma sœur Eva qui m’ont toujours soutenu, peu importe les échecs que j’ai essuyé. Ça a été compliqué mais je suis arrivé au bout.
Enfin, il me reste à remercier ma femme, mon amie, ma confidente. Sans toi Delphine, sans ta joie de vivre et ton soutien, cela aurait été une expérience sans saveur. Merci d’avoir tout quitté pour tenter l’aventure.
xvii
Avant-propos
Ce travail de thèse porte sur la compréhension des mécanismes de subversion des macrophages dans le cancer de la prostate et l’impact clinique de la présence de macrophages dans le microenvironnement tumoral de la prostate.
Le premier chapitre est une introduction subdivisée en trois sous-parties. La première traite de la fonction générale de la glande prostatique et du phénomène de carcinogénèse prostatique. La seconde aborde l’avancée des connaissances dans l’immunité anti-tumorale et l’importance de l’immunosubversion. Finalement, la troisième décrit la place des macrophages dans cette immunité anti-tumorale.
Le second et le troisième chapitre correspondent à des articles scientifiques. Ma contribution est détaillée entre parenthèse et correspond dans l’ordre : au design de l’expérience, à la réalisation des expériences, à l’analyse des données ainsi qu’à l’écriture de l’article.
Le second chapitre correspond à un article scientifique dont je suis le premier auteur et qui s’intitule « Macrophage re-education in prostate cancer: subversion of inflammatory macrophages to a mixed immunosuppressive tumor associated-macrophage phenotype ». Les auteurs sont : Clovis Boibessot, Oscar Molina, Gabriel Lachance, Christophe Tav, Audrey Champagne, Bertrand Neveu, Jean-François Pelletier, Fréderic Pouliot, Vincent Fradet, Steve Bilodeau, Yves Fradet, Alain Bergeron, et Paul Toren (80%, 80%, 50%, 50%). Cet article est en préparation pour être soumis dans Nature communications.
Le troisième chapitre correspond à un article scientifique dont je suis le premier auteur et qui s’intitule « Ex vivo culture of prostate needle biopsies as a novel method to assess changes in macrophages after exposure to therapeutic drugs ». Les auteurs sont Clovis Boibessot, France-Hélène Joncas, Aerin Park, Jean-François Pelletier, Alain Bergeron et Paul Toren (80%, 80%, 60%, 50%). Cet article a été soumis dans Prostate Cancer and Prostatic Diseases.
Le quatrième chapitre contient la discussion et la conclusion.
L’annexe A correspond à un article de revue qui s’intitule « Sex steroids in the tumor microenvironment and prostate cancer progression », dont le Dr, Toren et moi-même sommes les deux auteurs. J’ai pu contribuer à l’écriture de toute la partie microenvironnement tumoral et influence des hormones sexuelles stéroïdiennes. Cet article a été publié en Mars 2018 dans la revue Endocrine-Related Cancer.
1
Introduction
1) Le cancer de la prostate
a. Épidémiologie
Au Canada, le cancer de la prostate (PCa) était en 2019 le cancer le plus souvent diagnostiqué chez l’homme, représentant environ un nouveau cas de cancer sur 5 (20 %). Il était estimé qu’il y aurait 23 300 nouveaux cas de PCa et que 9 % de ces hommes en décèderaient éventuellement [1]. Le PCa est un cancer tardif à l’évolution lente dont le taux de mortalité ne cesse de diminuer depuis les années 1990, notamment grâce à l’amélioration des techniques de diagnostic ainsi que des traitements [2].
b. Facteurs de risque
Les principaux facteurs de risque connus sont l’âge, les antécédents familiaux et l’origine ethnique [3]. Il existe cependant d’autres facteurs de risques moins connus ou débattus, tels que certains facteurs environnementaux (e.g. pesticides/insecticides oestrogéniques) ou reliés à l’alimentation (e.g. surconsommation de protéines animales et/ou de produits laitiers)[4-6].
i. Âge
Il est estimé que moins de 1% des PCa diagnostiqués surviendraient avant l’âge de 50 ans, cependant, le risque augmente d’année en année après 50 ans. Finalement, plus de 70% des cancers diagnostiqués surviennent chez des personnes de plus de 65 ans [7, 8].
ii. Antécédents familiaux
Il est reconnu que 25% des hommes diagnostiqués avec un PCa possèdent un historique familial de PCa. La forme héréditaire du PCa se développe généralement 6 à 7 ans avant la forme sporadique [9]. De plus, la probabilité de développer un PCa est deux à trois plus élevée quand un parent du premier degré est déjà atteint de la maladie [10, 11]. Viennent s’ajouter à cela l’importance des mutations génétiques (e.g. dans les gènes BRCA1/BRCA2 mais aussi HOXB13 vG84E) ainsi que l’expression aberrante de certains gènes impliqués dans la réparation des dommages à l’ADN [12-15].
iii. Ethnicité
L’origine ethnique joue une part importante dans la prévalence du PCa. Ce cancer est plus fréquent chez les hommes d’origine afro-américaine et afro-caribéenne. Aux États-Unis, un homme d’origine afro-américaine aura respectivement une incidence et une mortalité accrue de 58% et de 144% par rapport à un homme d’origine caucasienne [16-18]. En revanche, la prévalence du PCa est plus faible chez les hommes d’origine asiatique.
2
Cependant, il ne faut pas oublier que les habitudes de vie sont reliées à l’origine ethnique et ainsi il faut donc considérer l’effet de l’ethnicité de manière multifactorielle. Par exemple, des hommes Japonais vivants aux États-Unis depuis une génération, vont présenter quarante fois plus de risques de développer un PCa que des Japonais restés au pays du soleil levant [19].
c. Histologie physiologique de la prostate
i. La prostate saine
La prostate est une glande exocrine de système génito-urinaire masculin située dans le petit bassin, sous la vessie, en avant du rectum et en arrière du pubis. La glande prostatique mesure environ 3 cm de long sur 4 cm de large et pèse environ 20 grammes. La majeure partie de la glande est entourée par une capsule fibro-musculaire (Figure 1). Deux lobes latéraux se réunissent en avant par un isthme, en arrière par un lobe médian. Ce lobe médian se situe au-dessus des canaux éjaculateurs qui permettent l’acheminement du sperme dans l’urètre prostatique. Le lobe médian a tendance se développer de manière intra-vésicale avec l’âge tandis que les lobes latéraux auront tendance à augmenter de volume.
ii. Architecture de la prostate
L’épithélium prostatique est composé de plusieurs types cellulaires : les cellules épithéliales, les cellules neuroendocrines, les cellules intermédiaires, les cellules basales ainsi que des cellules immunes (Figure 2).
Les cellules épithéliales bordent la lumière des canaux de la glande prostatique, expriment fortement le récepteur aux androgènes (Androgen Receptor – AR)[20] et sécrètent les constituants du liquide séminal. Elles sont aussi connues pour sécréter deux protéines; la phosphatase acide prostatique (Prostatic Acid Phosphatase – PAP) et l’antigène spécifique de la prostate (Prostate Specific Antigen – PSA), aussi connu sous le nom de kallikrein-3 (KLK3).
Les cellules neuroendocrines font partie de l’épithélium sécrétoire et possèdent des fonctions autocrine et paracrine impliquées dans la croissance et la différenciation de l’épithélium et n’expriment pas l’AR [20, 21].
Figure 1. Anatomie générale de la prostate.
Coupe sagitale de la prostate. SV: Vésicules séminales (gris), B: Vessie (gris), CZ: Zone central (vert), U: Urètre, TZ: Zone de transition (jaune), AFS: Stroma fibromusculaire antérieur (bleu) et PZ: zone périphérique (rose). Tiré de Am J Surg Pathol 1988 Aug;12:619–33
3
Les cellules basales permettent le maintien et la régénération de l’épithélium prostatique, elles possèdent une faible expression de l’AR [20, 21].
Le stroma prostatique se compose d’un ensemble de fibroblastes, de matrice extracellulaire, de capillaires sanguins, de cellules endothéliales lymphatiques et de cellules musculaires lisses [22].
iii. Progression vers un PCa
Durant le développement d’un PCa, la prostate saine évoluera vers une histologie pathologique correspondant pour 95% du temps à de l’adénocarcinome et pour 5% à de la néoplasie prostatique intra-épithéliale (Prostatic Intraepithelial Neoplasia – PIN). Au fur et à mesure de l’avancement du PCa la proportion de cellules basales diminue, se traduisant par la perte progressive de l’architecture glandulaire, une dédifférenciation cellulaire et tissulaire utilisée lors du diagnostic pour classer les différents stades du PCa [22].
d. Le récepteur aux androgènes dans la prostate
Les androgènes appartiennent à la classe des hormones sexuelles stéroïdiennes. Ils possèdent un rôle essentiel dans le développement et le maintien des structures et caractères sexuels secondaires [23-25].
i. Stéroïdogénèse et voies de signalisation
La stéroïdogénèse est un processus biologique permettant la synthèse de cinq classes différentes de stéroïdes (androgènes, œstrogènes, progestatifs, glucocorticoïdes et minéralocorticoïdes). La testostérone, principale source de carburant de la prostate, est produite majoritairement par les cellules testiculaires (environ 90%) mais aussi par les glandes surrénaliennes et la prostate pathologique elle-même (10%). La testostérone (sous sa forme bio-disponible) est réduite en son métabolite actif; la dihydrotestostérone (DHT) par la 5α-reductase. Les protéines de choc thermique (Heat Shock Proteins – HSP) maintiennent dans le cytoplasme l’AR dans son état actif. Une fois activé par la DHT (ou moindrement par la testostérone), il s’homodimérise pour être transloqué
Figure 2. Histologie générale de la prostate. Les glandes exocrines sont formées de deux couches de cellules. Les cellules luminales (au centre) délimitent le lumen et forment la zone de sécrétion. Les cellules basales sont en contact avec la lame basale (en périphérie) et forme ainsi la base des glandes. De rares cellules neuroendocrines se retrouvent dispersées à travers les cellules basales. Autour des glandes, du tissu musculaire, abondant, avec présence de cellules souches, de cellules fibroblastiques et de vaisseaux sanguins.
4
au noyau et se fixe sur des séquences appelées « éléments de réponse aux androgènes » (Androgen-Response Element – ARE) au niveau du promoteur, induisant la transcription de gènes cibles (Figure 3).
Il existe aussi une voie alternative permettant l’activation de l’AR, dite non génomique, plus rapide. Elle est caractérisée par la capacité de l’AR à interagir avec de multiples partenaires dans le cytoplasme (sans translocation nucléaire) pour activer des voies de signalisation, telles que celle des MAPK ou AKT [26-28].
ii. AR, PSA et PCa
Le PCa est souvent associé au PSA. La principale raison de cette association découle de la voie de signalisation génomique de l’AR. En effet, les cellules épithéliales prostatiques, qui possèdent une forte expression de l’AR, sous l’effet de la DHT (et dans une moindre mesure de la testostérone), voient leur activité transcriptionnelle augmenter. L’AR activé se fixe spécifiquement sur une séquence ARE sur le promoteur proximal du PSA (-600 to +12) et sur la région 5’ en amont de la séquence enhancer (-3875 to -4325) du gène du PSA, induisant la transcription puis la synthèse de la protéine [29]. Lors de la perte d’architecture normale de la prostate, le PSA, normalement déversé dans les canaux glandulaires, fuit dans le liquide extracellulaire et se retrouver dans le sérum, permettant d’être dosé pour en faire un biomarqueur du PCa.
Figure 3. Voie génomique canonique de l’AR
1. La testostérone provenant de la circulation sanguine diffuse à travers la membrane plasmique des cellules prostatiques. 2. La testostérone est convertie en DHT par la 5a-reductase cytoplasmique. 3. La DHT se fixe sur l‘AR libéré des HSP. 4.
La fixation de la DHT induit l’activation du récepteur par autophosphorylation et homodimérisation. 5. L’AR activé est transloqué au noyau, se fixe sur les séquences ARE et induit la synthèse des gènes cibles.
Cellule prostatique 5α-reductase Testostérone AR DHT AR AR 1 2 3 4 5 Noyau Vaisseaux sanguins Stroma Cytoplasme HSP HSP HSP
5
e. Diagnostic du PCa
i. Dépistage précoce
Le dépistage précoce du PCa consiste à recherche la maladie de façon systématique dans une population dite asymptomatique. Il s’agit d’un examen individuel basé sur l’identification des facteurs de risque, le toucher rectal (Digital Rectal Examination – DRE) ainsi que le dosage du PSA, qui s’instaure dès 50 ans en absence de facteurs de risque (45 ans en cas de facteurs de risque familiaux/ethniques) à la suite d’un dialogue entre le praticien et le patient. Bien que le dépistage précoce fasse toujours l’objet de débats, il demeure important de diagnostiquer tôt la maladie puisque le taux de survie à 5 ans pour un PCa bien différencié et localisé est proche de 100% tandis qu’il chute à 30% lors qu’il est métastatique [30].
ii. Bilan clinique
Le PCa trouvé par dépistage est généralement asymptomatique. Dans le cas où des symptômes sont ressentis par le patient, cela pourrait évoquer la présence d’un PCa localement avancé, voire métastatique. Les symptômes les plus communs sont la présence de troubles à la miction liés à un rétrécissement du canal de l’urètre par la prostate qui prend du volume, une hémospermie, une infection du tractus urinaire, une dysfonction érectile, la présence de douleurs d’origine osseuse ou encore une extrême fatigue [31].
Afin de valider la présence de cancer, le praticien évalue le volume, la forme, mais aussi la consistance de la prostate par DRE. Toute irrégularité éventuelle orientera le praticien à demander des biopsies de la prostate. La présence d’irrégularités (nodule dur, irrégulier, envahissement de la capsule, des vésicules séminales, atteinte des organes avoisinants) se traduit souvent par un cancer de stade avancé [32, 33]. Il demeure cependant obligatoire de combiner cet examen digital à des techniques d’imagerie, au dosage sérique de marqueurs biochimiques (tel que le PSA) et de biopsies afin de ne pas passer à côté d’un cancer localisé, précoce, non-palpable et asymptomatique.
iii. Bilan biochimique
Le PSA est une enzyme participant activement à la liquéfaction du sperme. Elle clive la semenogelin, une protéine produite par les vésicules séminales qui induit la coagulation spermatique [34]. Le PSA, en clivant la semenogelin, stimule la motilité et la maturation des spermatozoïdes. Cette enzyme est principalement produite dans la prostate et relarguée dans le sperme. Elle est présente dans la circulation sanguine en très petite quantité (< 4 ng/ml) dans des conditions physiologiques normales, mais augmente en quantité lors d’un PCa puisque la dédifférenciation des cellules cancéreuses induit un remodelage de la barrière tissulaire prostatique favorisant le relargage du PSA dans le sang. L’utilisation du dosage de PSA comme outil diagnostic, couplé avec un DRE, permet au praticien d’orienter le patient pour la prise de biopsies en vue de confirmer le diagnostic de cancer [35-37]. Il faut cependant garder à l’esprit que ce biomarqueur demeure associé à la glande
6
prostatique et non pas au cancer, ce qui tend à alimenter la controverse sur son utilisation pour diagnostiquer un PCa à cause de son manque de spécificité.
En effet, avec l’âge, les niveaux de PSA varient, de même que le volume prostatique. Différentes mesures sont alors à prendre en considération pour utiliser le dosage du PSA le plus efficacement possible, comme le recommande l’Association des Urologues du Canada (CUA – Canadian Urological Association)[38]. Malgré toutes les controverses, aujourd’hui, ce test figure parmi les outils de référence pour le dépistage du PCa, comme classificateur de risques (risques de récidive par rapport à la PSA préopératoire) ou encore comme biomarqueur de progression de la maladie.
iv. Imagerie à visée diagnostique
Les caractéristiques biologiques de la tumeur et son évolution sont des phénomènes complexes à évaluer. L’imagerie médicale est un outil permettant à la fois le diagnostic, mais aussi le suivi de la maladie. Différentes techniques sont utilisées :
L’échographie transrectale (ETR) utilise des ondes sonores à hautes fréquences (comprises entre 5 et 10 MHz) afin de produire une image de la prostate pour guider l’aiguille lors de la biopsie. Elle permet d’évaluer le volume prostatique, mais aussi des régions où l’écho est diminué, traduisant la présence d’un tissu potentiellement cancéreux (les cellules cancéreuses dédifférenciées modifient l’architecture prostatique et dévient l’écho sonore, produisant une tâche plus sombre sur l’échographe)[39].
L’imagerie par résonnance magnétique multiparamétrique (IRMmp) est utilisée pour faire un bilan d’extension locale du cancer et parfois pour des bilans d’extension ganglionnaire (via des coupes abdominopelviennes) et osseux [39]. La tumeur prostatique est définie comme une zone nodulaire en hyposignal T2. Cette technique est couplée à au moins deux séquences fonctionnelles discriminantes. La séquence d’imagerie par diffusion qui évalue la densité cellulaire (via les mouvements de diffusion des molécules d’eau) et la séquence d’imagerie par contraste pour la néoangiogénèse tumorale (via la diffusion du chélate de gadolinium dans l’espace extracellulaire extravasculaire). La tumeur de la prostate peut alors être décrite comme une zone nodulaire en hyposignal T2 avec restriction de diffusion et prise de contraste intense et précoce.
L’IRMmp est particulièrement recommandée suite à un résultat de biopsie négative lorsqu’il y a suspicion persistante de PCa afin d’effectuer un suivi et déterminer si d’autres biopsies sont nécessaires tout en indiquant les zones à biopsier.
Un protocole de standardisation visant à améliorer l’efficacité de cette méthode d’imagerie a été publié par la Société Européenne de Radiologie Urogenitale (European Society of Urogenital Radiology – ESUR.). Il est appelé PI-RADS (Prostate Imaging-Reporting and Data System)[40]. Ce système, dans sa deuxième version
7
[41], permet de prédire la probabilité d’un cancer qui est cliniquement significatif, lequel est défini par n’importe laquelle des 3 caractéristiques suivantes :
o Un score de Gleason ³ 7 (incluant le 3+4 avec patron 4 non prédominant)
o Un volume tumoral supérieur à 0,5 mL
o La présence d’une extension extraprostatique
Chaque lésion est évaluée et décrite avec un score allant de 1 à 5. Les lésions ayant un score de 4 ou 5 doivent être considérées comme étant possiblement cancéreuses et nécessitent une biopsie pour confirmer la présence de cancer (3 restant équivoque).
v. Bilan d’extension et imagerie
La tomodensitométrie axiale calculée par ordinateur (Computed Tomography-Scan - CT-SCAN) est utilisée afin de fournir une image en trois dimensions de la prostate et des structures avoisinantes telles que les ganglions sentinelles et les autres structures abdomino-pelviennes.
La tomographie par émission de positrons couplée à un scanner (Positron Emission Tomography-Scan - PET-SCAN) se base sur l’utilisation d’un CT scanner conjuguée à un radiotraceur à très courte durée de vie. D’ordinaire utilisé avec du glucose radiomarqué (18F-fluorodeoxyglucose – 18FDG), suite à l’observation de l’effet Warburg [42] qui consiste en une augmentation du métabolisme du glucose dans les tumeurs comparé au tissu sain, son utilisation dans le PCa s’est vu contrasté par sa faible activité glycolytique, spécialement dans les cancers faiblement avancés. Ces cancers présentent un chevauchement d’absorption du 18FDG avec des pathologies telles que la prostatite ou l’hypertrophie bénigne de la prostate, ce qui nuit à l’efficacité diagnostique du PET-scan [43-45]. La choline radiomarquée 11C ou 18F s’est avérée être un marqueur plus utile pour le PCa mais présentant aussi des limites de par son ambiguïté d’absorption avec la BPH [43, 46]. Cette technique peut être utilisée à la fois pour diagnostiquer un PCa de risque intermédiaire ou élevé de récidive en permettant d’apprécier des extensions locales ganglionnaires et osseuses.
La scintigraphie osseuse aux phosphonates permet de déceler la présence de cellules cancéreuses dans les os. Elle est préconisée pour des patients avec une tumeur de risque intermédiaire ou élevé, qui présentent des douleurs osseuses lors du diagnostic, un dosage du PSA très élevé (> 20 ng/mL) ou si les dosages de la PAP ou la calcémie sont anormalement élevés. Cette technique repose sur l’utilisation d’un isotope faiblement radioactif (comme pour la PET-SCAN), qui va se fixer sur les zones à forte activité métabolique (métabolisme du calcium impliqué dans l’ostéoblastogénèse).
8
Toutes ces techniques sont dépendantes des caractéristiques biologiques de la tumeur (changement anatomique du tissu, densité cellulaire, néoangiogénèse ou métabolisme cellulaire). Elles permettent un bilan pré-thérapeutique local, régional et à distance qui oriente le praticien dans son choix de traitement.
vi. Les biopsies de prostate
Si un DRE anormal couplé à un niveau de PSA élevé sont décelés chez un patient, il est nécessaire de confirmer le diagnostic de PCa en évaluant le degré d’agressivité (grade) et de propagation locale ou à distance (stade). Une séance de biopsie étendue comprenant le prélèvement au total de 6 à 12 carottes (17mm x 0,5mm) à l’aide une aiguille 18 Gauge dans les différentes zones de la prostate est alors réalisée.
f. Anatomopathologie du
PCa
Le PCa est un cancer dit phénotypiquement hétérogène et multifocal ce qui signifie que toutes les lésions cancéreuses ne présentent pas le même état de dédifférenciation cellulaire et que plusieurs foyers cancéreux sont présents au sein d’une même structure [47-49]. La place des pathologistes dans la prise en charge du PCa est majeure. L’analyse histopathologique des biopsies permet de poser un diagnostic précis, de rechercher des critères pronostiques et d’adapter les traitements. L’adénocarcinome de la prostate représente 95% des cancers néodiagnostiqués. Il s’agit d’un cancer présentant un large spectre histopathologique, allant d’une structure bien différenciée ressemblant à une glande saine, jusqu’à une architecture dédifférenciée, sans aucune organisation glandulaire. Plusieurs systèmes de classification ont été mis en place, dont la classification TNM (Tumor, Node, Metastasis) et, les groupes de grades de Gleason (GGG).
Figure 4. Schéma de prise de biopsies.
La prostate est divisée en 5 régions (base droite et gauche, région médiane droite et gauche et apex). Les prélèvements se font au tiers supérieur, à la base (a), au tiers moyen, au milieu (b), et au tiers inférieur, à l’apex (c). Les prélèvements se font au niveau de chaque secteur postérieur, à mi-distance entre bord latéral et milieu de la prostate, (site médiolobaire) et latéralement (site latéral). Les biopsies latérales prélèvent uniquement la zone périphérique (en rose). Les biopsies médiolobaires prélèvent la zone périphérique et la zone de transition antérieure (en bleu). D’après les recommandations pour la bonne pratique des biopsies prostatiques
9 i. Le stade tumoral TNM
Le système de classification TNM mis en place par l’UICC (Union International Contre le Cancer) permet d’évaluer la progression tumorale. D’abord introduite en 1943 par le professeur P. F. Denoix puis généralisée
Tableau 1. Classification TNM 2002 (6ième édition) [50].
T - Tumeur primitive
Tx Tumeur primitive non évaluée T0 Tumeur primitive non retrouvée
T1 Tumeur ni palpable au toucher rectal (TR) ni visible en imagerie T1a : tumeur occupant moins de 5 % du tissu réséqué
T1b : tumeur occupant plus de 5 % du tissu réséqué
T1c : tumeur découverte sur une biopsie prostatique en raison d’une élévation du taux des PSA. T2 Tumeur limitée à la prostate
T2a : tumeur atteignant la moitié d’un lobe ou moins
T2b : tumeur atteignant plus de la moitié d’un lobe mais sans atteindre les deux lobes T2c : tumeur atteignant les deux lobes
T3 Extension au-delà de la capsule
T3a : extension extra-capsulaire uni- ou bilatérale T3b : extension aux vésicules séminales uni- ou bilatérale
T4 Tumeur fixée ou atteignant d’autres structures que les vésicules séminales (sphincter externe, rectum, muscles releveurs de l’anus ou paroi pelvienne) N - Ganglions lymphatiques régionaux
Nx Ganglions régionaux non évalués
N0 Absence de métastase ganglionnaire régionale N1 Atteinte ganglionnaire régionale
M - Métastases à distance
Mx Métastases à distance non évaluées M0
M1
Absence de métastases à distance Métastases à distance
10
en 1971 par A. H. Sellers [51], cette classification a été définitivement adoptée sur la scène internationale dans sa quatrième édition de 1987 [52, 53] où elle est approuvée à la fois par l’AJCC (American Joint Committee on Cancer) et l’UICC. Le « T » représente la tumeur initiale, codé de « T0 » en absence de tumeur à « T4 » tumeur étendue au-delà de la capsule. Le « N » représente l’infiltration dans les ganglions lymphatiques de la prostate, codé de « N0 » qui ne représente pas d’atteinte ganglionnaire à « N1 » pour atteinte métastatique ganglionnaire. Finalement, le « M » représente le degré de propagation du cancer aux organes distants, soit « M0 » pour l’absence de métastases ou « M1 » pour la présence. Le stade le plus avancé fait office de score. Le tableau 1 décrit les détails de la classification actuelle TNM pour le PCa.
Il est important de se souvenir que la stadification du PCa est soumise à modification. Le premier bilan, qui est effectué sur biopsies (12 en général, comme décrit plus haut), s’appelle le stade clinique. Si le patient subit une prostatectomie radicale (Radical Prostatectomy – RP), ce stade sera soumis à de possibles mises à jour pour en donner une version définitive par appréciation de l’ensemble de l’organe, ce sera le stade pathologique.
ii. Système de classification selon le score de Gleason
Il s’agit d’un système de classification histologique simple prenant en compte l’éventail des aspects architecturaux que peut représenter l’adénocarcinome de la prostate et leur mode d’association afin d’obtenir un grade histopronostique. Le travail original du Dr. Donald Gleason a permis, dès 1966, de poser les bases d’une classification sous forme de score de 1 à 5, représentant le niveau de dédifférenciation cellulaire et architecturale de la glande observable en microscopie optique [54]. Les dernières modifications ont finalement été apportées en 2016. La figure 4 se base sur les recommandations de l’Organisation Mondiale de la Santé (OMS) [50] et de l’ISUP [55]. Chaque patient se voit attribuer lors de l’examen un score de Gleason, somme des deux patrons prédominants (sauf exceptions), ce qui rend compte du degré d’agressivité du PCa. Ce score ne peut cependant plus être évalué après certaines thérapies, notamment à cause du changement d’architecture de la glande post-thérapie.
C’est en 2014 qu’apparaît aussi pour la première les groupes de grades de Gleason (Gleason Grade Groups – GGG) (Tableau 2). Ces groupes permettent de mieux discriminer les patients en fonction de leur pronostic. Les patients qui ont un cancer du groupe 1 et qui ont un contexte clinique favorable (bas taux du PSA, bas stade clinique, faible pourcentage de cancer à la biopsie) seront de bons candidats pour de la surveillance active (cf. section traitements).
11
g. Arbre de traitements du PCa
Le PCa possède à l’heure actuelle un large spectre de traitements. Le choix du traitement se fait en fonction de l’âge du patient, de son état de santé, du stade du cancer (localisé, localement avancé ou métastatique) tout en prenant en compte des facteurs tels que la présence de comorbidités, les antécédents familiaux ainsi que le souhait du patient. Les traitements sont basés sur les modalités de traitement habituelles telles que la chirurgie,
Groupe de Gleason
Score de
Gleason Description
1 ≤ 6 Seulement des glandes individuelles bien formées
2 7 = 3+4 Majoritairement des glandes individuelles bien formées avec une petite composante de glandes mal formées/fusionnées/cribriformes
3 7 = 4+3 Majoritairement des glandes mal formées/fusionnées/cribriformes avec une petite composante de glandes individuelles bien formées
4 8 = 4+4;
3+5; 5+3 Seulement des glandes mal formées/fusionnées/cribriformes ou majoritairement des glandes individuelles bien formées avec une petite composante d’éléments sans structure glandulaire b ou majoritairement des éléments sans structure glandulaire avec une petite composante des glandes individuelles bien formées 5 9 – 10 Éléments sans structure glandulaire (ou avec nécroses) avec ou sans des glandes
mal formées/fusionnées/cribriformes
Tableau 2. Définition histologique de chacun des groupes du nouveau système de gradation GGG (ISUP, 2014)[56].
Small, uniform glands More space (stroma) between glands Distinctly infiltration of cells from glands
and margin
Irregular masses of neoplastic cells with few glands
Lack of (or occasional) glands, sheets of cells Well differentiated cells Poorly differentiated, anaplastic cells 1 2 3 4 5
Figure 5. Illustration adaptée du score de Gleason [53].
12
la radiothérapie, la chimiothérapie, mais aussi, puisque le PCa est un cancer hormono-dépendant, l’hormonothérapie. Par contre, à cause de la lente évolution de certains PCa, il n’est pas toujours approprié de traiter immédiatement la maladie.
Les traitements au Canada sont divisés comme suit ;
- Traitement dit « de surveillance » (surveillance active ou Watchful waiting)
- Traitements localisés (chirurgie ou radiothérapie)
- Traitements systémiques (hormonothérapies, chimiothérapies et thérapies par produits radioactifs)
i. Les traitements de surveillance
La surveillance active émerge dans les années 1990 comme option thérapeutique pour les patients présentant un PCa localisé de faible risque [57, 58]. Généralement, il est accepté que les patients présentant un cancer de GGG 1 ont un faible risque de mourir du PCa. Ainsi, il est possible de simplement suivre leur maladie et traiter que lorsque la maladie progresse à un état qui nécessite une intervention. La surveillance active est une option moins douloureuse physiquement et psychologiquement, mais aussi économiquement parlant [59, 60]. Pour les patients qui rencontrent les critères d’éligibilité, le traitement consiste simplement à faire un suivi régulier de la maladie en effectuant un dosage de PSA, un DRE et de l’imagerie couplé à des biopsies de la prostate. Si le patient progresse, les soins seront transformés en soins curatifs incluant d’autres stratégies thérapeutiques.
Le « watchful waiting » ou phase d’abstention thérapeutique est recommandée aux patients ayant un cancer asymptomatique mais une espérance de vie limitée (inférieure à 10 ans) à cause de facteurs extérieurs (autre pathologie primant sur le PCa, âge avancé). Les patients peuvent se voir proposer des traitements de confort en cas d’apparition de symptômes sans traiter de manière curative le cancer [61, 62].
ii. Les traitements localisés
La prostatectomie radicale (Radical Prostatectomy – RP) est le traitement de référence pour soigner les PCa localisés. Il s’agit d’un des traitements les plus anciens (décrit pour la première fois vers 1900), amélioré tout au long du XXe siècle par l’augmentation des connaissances sur l’anatomie périprostatique [63]. Cette chirurgie peut être effectuée ouverte, par laparoscopie ou assistée par robot, par voie antérograde ou rétrograde. C’est dans les années 1990 que la préservation des bandelettes neuro-vasculaires qui s’étendent le long du fascia et de la capsule prostatique a été abordée. Cette préservation, lorsqu’elle ne compromet pas le contrôle carcinologique, permet d’améliorer la récupération de la fonction érectile post RP [64]. Elle peut être accompagnée d’un curage ganglionnaire, de l’ablation des vésicules séminales et de l’ablation de ces bandelettes neuro-vasculaires si le cancer a envahi (ou est à risque d’avoir envahi) ces structures. La RP est
13
proposée aux patients présentant un PCa localisé (stade T1 ou T2) et plus récemment au PCa localement avancé (T3 voir T4), de moins de 75 ans, avec une espérance de vie d’au moins 10 ans.
La castration chirurgicale, bien que peu utilisée de nos jours, a longtemps été une technique chirurgicale utilisée pour diminuer les taux de testostérone produits par les testicules (environ 90 à 95% de la testostérone circulante). Deux techniques étaient utilisées; l’orchidectomie bilatérale (ou ablation testiculaire et de l’épididyme) ou la pulpectomie (retrait de la pulpe testiculaire, responsable de la sécrétion des hormones).
La radiothérapie (RT) est une technique utilisant des rayons X dirigés contre la tumeur (et moindrement les structures saines avoisinantes). Il existe différents types de radiothérapie; la radiothérapie externe (External-Beam Radiation Therapy – EBRT) et la curiethérapie (ou radiothérapie interne). L’ERBT utilise un accélérateur linéaire émettant un faisceau de haute énergie dirigé contre la tumeur tandis que la curiethérapie utilise des grains implantés dans la tumeur prostatique directement. Les grains peuvent être de faible radioactivité (125I) pour permettre une diffusion continue de quelques semaines à quelques mois (curiethérapie à bas débit de dose) tandis que l’utilisation d’une substance plus radioactive par injection intraprostatique dispense une dose plus élevée de rayonnement sur une durée plus courte. La radiothérapie est souvent administrée chez des patients de moins de 70 ans qui présentent un trop gros risque de complications chirurgicales. Elle peut aussi être proposée à des patients en complément d’un traitement chirurgical (Figure 6).
iii. Les traitements systémiques - Hormonothérapies
Le PCa est un cancer dit « androgéno-dépendant » ce qui le caractérise par sa dépendance aux androgènes (dans son stade initial encore naïf à tout traitement d’hormonothérapie) et donc par sa capacité à être traité par des anti-androgènes. Chez l’homme, l’hormone lutéinisante (Luteinizing hormone – LH) est indispensable à la production de testostérone testiculaire. La production hypophysaire de LH est dépendante de la sécrétion pulsatile de la gonadolibérine (Gonadotrophin Releasing Hormone – GnRH). Il existe différentes classes d’hormonothérapie.
Les agonistes des récepteurs de l’hormone GnRH agissent par sur-stimulation des récepteurs hypophysaires. Cette sur-stimulation des récepteurs va induire dans un premier temps l’augmentation brutale des androgènes circulants (effet flair-up), pouvant augmenter temporairement les symptômes du PCa. Cette augmentation laisse place, après quelques semaines, à la diminution de la testostérone circulante par rétrocontrôle négatif.
Les antagonistes des récepteurs de l’hormone GnRH induisent un effet anti-androgénique immédiatement par inhibition compétitive du récepteur et diminution drastique de la concentration de LH sans effet « flair up ».
14
Malheureusement, l’inhibition de l’axe hypothalamo-hypophysaire ne permet pas de contrôler la sécrétion d’androgènes imputable aux glandes cortico-surrénaliennes ainsi qu’à la tumeur elle-même. Il a donc fallu attendre l’avènement de thérapies antiandrogéniques de secondes générations axées sur l’AR et sa signalisation pour contrôler de manière plus efficace la testostérone.
Les antiandrogènes de première génération agissent au niveau de l’AR en empêchant la fixation de son ligand. Ils peuvent être de nature stéroïdienne (acétate de cyprotérone) ou non stéroïdienne (bicalutamide).
Les antiandrogènes de seconde génération sont des composés qui bloquent le fonctionnement de l’AR de trois possibles façons:
- Ils empêchent la fixation des androgènes sur l’AR
- Ils inhibent la translocation nucléaire de l’AR activé
- Ils empêchent la fixation de l’AR sur la séquence ARE ainsi que le recrutement de cofacteurs activateurs
Différents médicaments sont autorisés aux Canada dont l’acétate d’abiratérone (un inhibteur du CYP17A1, approuvé en 2011), l’enzalutamide (2012) et l’apalutamide (2018) ou le darolutamide (2020). Au départ réservées aux patients présentant un PCa ayant progressé sous hormonothérapie préalable (agonistes et antagonistes GnRH) ou aux patients inéligibles à la chimiothérapie, ces thérapies sont maintenant utilisées de plus en plus tôt dans le parcours de la maladie et souvent en combinaison, suite aux résultats favorables d’essais cliniques récents (CHAARTED, LATITUDE) [65, 66].
iv. Les traitements systémiques - Chimiothérapies
Avant de décrire les différentes chimiothérapies autorisées au Canada pour traiter le PCa, il faut s’intéresser au terme de « résistance à la castration ». Un patient qui présente un PCa résistant à la castration (Castrate-Resistant Prostate Cancer – CRPC) est un patient caractérisé par l’absence d’efficacité des thérapies curatives et de la première ligne de traitement par agonistes/antagonistes de la GnRH (Figure 6). Ces patients vont voir leur taux de PSA augmenter au-dessus du « nadir » (valeur la plus basse de PSA au cours du temps, e.g. après traitement par RP ou RT). Ces patients se verront alors proposer des thérapies ayant pour but de réduire la douleur, en diminuant les métastases (patients CRPC métastatiques) et ou en ralentissant la récidive locale.
Le docetaxel (approuvé en 2004) ainsi que le cabazitaxel (approuvé en 2010) sont actuellement les deux chimiothérapies cytotoxiques approuvées pour traiter les patients avec un PCa. Ces agents de chimiothérapie appartenant à la famille des taxanes, sont des poisons du fuseau mitotique. Ils agissent en stabilisant les
15
microtubules, inhibant la migration des chromosomes et donc la réplication cellulaire. Faute de coûts élevés du cabazitaxel comparativement au docétaxel et l’absence de gain net de survie [67], les patients au Québec ne peuvent bénéficier du cabazitaxel qu’après échec de traitement par le docétaxel (Figure 6).
v. Les traitements systémiques - Thérapies par produits radioactifs À l’heure actuelle, un seul traitement est indiqué pour traiter les patients avec un CRPC métastatique qui présentent des douleurs osseuses, le Radium-223 dichloride, un émetteur de particules alpha qui remplace le calcium dans le métabolisme des métastases osseuses [68]. Ce traitement a été le seul approuvé par la FDA en 2013 pour ce genre de cancer.
6 CaP M0 PR Agoniste / antagoniste LH-RH Échec Métastase confirmée Imagerie Chimio Inhibiteur du AR Abiratérone Enzalutamide Apalutamide Progression ou intolérance Radium 223 2èmeligne de chimio Chimio jusqu’à jusqu’à Diagnostique CRPC 6 Temps
Sensible Résistant à la castration (CRPC) Non-métastatique Métastatique Asymptomatique Symptomatique Vo lu m e tu m or al e t t au x de P SA Progression ou intolérance RT RT * PR Curatifs Paliatifs Inhibiteur du AR Abiratérone Enzalutamide Apalutamide
Figure 6. Arbre de décision simplifié non exhaustif pour traiter les patients présentant un PCanon métastatique (M0) au Québec.
Un patient qui présente un PCa M0 (qui se traduit par une élévation de la PSA systémique, courbe en rouge) non éligible à de la surveillance active peut se voir proposer en traitement de première intention une prostatectomie radicale (PR), une radiothérapie (RT), les deux, ou l’une après l’autre (si échec de la première). Toutes ces thérapies ont une visée curative. Dans le cas d’échec à ces thérapies, le praticien proposera au patient un traitement antiandrogénique de première génération par inhibition de l’axe hypothalamo-hypophysaire (agoniste / antagoniste GnRH). À partir de ce moment, les thérapies ne sont plus à visée curative, mais palliative. Lors d’une récidive locale ou de l’apparition de métastases, un diagnostic de cancer CRPC sera établi. Le patient, qui demeure toujours hormono-sensible, mais qui aura progressé sous thérapie antiandrogénique, se verra proposer deux bras de traitements. Un premier qui consiste en l’administration d’une chimiothérapie (docétaxel) jusqu’à la progression de la maladie ou l’intolérance à ce traitement. On changera alors pour un inhibiteur de l’AR (apalutamide, enzalutamide ou abiratérone), une seconde chimiothérapie (cabazitaxel) ou encore du radium-223, si la présence de métastases osseuses est confirmée. Le second bras s’organisera autour d’une première thérapie à base d’inhibiteurs de l’AR jusqu’à la progression de la maladie ou l’intolérance à ce traitement. Le patient qui échoue à cette thérapie sera alors qualifié de hormono-résistant (i.e. il ne répond plus à aucune manipulation androgénique) se verra alors offrir soit une chimiothérapie (docétaxel), soit du radium 223 comme précédemment.

![Tableau 1. Classification TNM 2002 (6 ième édition) [50].](https://thumb-eu.123doks.com/thumbv2/123doknet/2752870.65521/27.918.115.810.154.993/tableau-classification-tnm-ième-édition.webp)
![Tableau 2. Définition histologique de chacun des groupes du nouveau système de gradation GGG (ISUP, 2014)[56]](https://thumb-eu.123doks.com/thumbv2/123doknet/2752870.65521/29.918.125.792.169.451/tableau-définition-histologique-groupes-nouveau-système-gradation-isup.webp)