UNIVERSITE MOHAMMED V - AGDAL
FACULTE DES SCIENCES
Rabat
: : : : : :Mme Jalila Bensaid
2009
N° d’ordre :
RESUME
:
Le but de ce travail a consisté en l’étude de l’élimination de la matière
organique (MO) , minérale et colorée grâce au procédé d’électrocoagulation par des
électrodes d’aluminium , et par adsorption sur une structure R , synthétisée par ce
même procédé , afin de comparer les deux méthodes à plusieurs pH ,ainsi qu’en
l’analyse des métaux lourds présents en solution . Notre intérêt a aussi porté sur la
synthèse de structures adsorbantes à différents pH et à leur analyse par ICP et
Diffractions aux rayons X. Le constituant principal de ces structures étant l’hydroxyde
d’aluminium , les analyses ont révélé par ailleurs la présence en plus ou moins
grande proportion d’autres structures particulièrement adsorbantes telles que
Al
45O
45(OH)
45Cl et AlCl(OH)
2, , L’étude des pertes de masse aux électrodes au
cours du procédé d’électrocoagulation, en fonction de la tension imposée , du pH
dans la cellule à deux électrodes et dans le réacteur à huit électrodes, ainsi que l’
influence de l’ électrolyte support sur cette perte de masse ont aussi été effectués
Mots- clefs : Elimination , électrodes , aluminium , électrocoagulation , adsorption ,
colorant
THESE DE DOCTORAT D’ETAT
Discipline : Chimie
Spécialité :Electrochimie et Chimie Analytique Présentée par
Mme Jalila BENSAID
05 03 2009
devant le jury
Président :
Professeur à la Professeur à l’ Professeur à la Professeur à la Professeur à l’ Professeur à l’ M M M M Mme M
AVANT-PROPOS
Le présent travail a été réalisé au laboratoire Electrochimie et Chimie
Analytique de la Faculté des Sciences de Rabat, sous la direction de
Messieurs les Professeurs S Belcadi et K El Kacemi.
La partie expérimentale a été réalisée au Laboratoire Sciences de l Eau
et de l’Environnement à la Faculté des Sciences Ain Chock de
Casablanca, sous l’encadrement du Professeur B.Lekhlif et du
Professeur F.Zidane, en collaboration avec l’Institut National de
Recherche Scientifique « Eau Terre et Environnement », au Québec,
sous le co-encadrement du Professeur J.F Blais.
Je tiens à remercier, Monsieur le Professeur S Belcadi, Directeur du
Centre National pour la Recherche Scientifique et Technique, qui m’a
donné l’opportunité de poursuivre mon travail de Thèse d’ Etat.
Que Monsieur K. El Kacemi, Professeur à la Faculté des Sciences de
Rabat, Directeur du Laboratoire d’ Electrochimie et Chimie Analytique,
trouve ici l’expression de mes respectueux remerciements pour les
précieux conseils et encouragements prodigués au cours de ce travail.
Monsieur B. Lekhlif, Professeur à l’école Hassania des Ingénieurs, par
ses orientations judicieuses et sa précieuse aide à l’élaboration aussi
bien de fond que de forme a permis l aboutissement de cette étude.
Je ne saurai assez remercier Mme F Zidane, Professeur à la Faculté des
Sciences de Casablanca, sans qui je n’ aurais pu reprendre courage
pour mener à terme le travail de recherche, pour son soutien
scientifique, moral et financier en m’ impliquant dans le projet AUF.
Monsieur J.F Blais, en nous faisant profiter d’ une part de sa
compétence et d’ autre part, en mettant à notre disposition les moyens
humains ,matériels et financiers de son laboratoire, a permis à la
présente étude de voir le jour.
Monsieur P .Drogui, membre du laboratoire cité ci-dessus, a contribué,
par son aide expérimentale et par ses conseils judicieux à une bonne
orientation du présent travail.
Je tiens également à remercier Mr A Touzani, Professeur à l’école
Mohammedia des Ingénieurs, d’ avoir bien voulu juger ce travail
Mes remerciements vont aussi à tous ceux qui ont contribué de prés ou
de loin à la réalisation de ce dernier.
Sommaire :
Résumé : ... 1 I Innttrroodduuccttiioon ... 2 n P Paarrttiieebbiibblliiooggrraapphhiiqquue ... 4 e I- Rappels sur les techniques de coagulation et floculation : ... 61. Solutions colloïdales : ... 6
1.1. Classification granulométrique des colloïdes : ... 6
1.2. Caractérisation des colloïdes : ... 7
2. Théorie de la double couche électrochimique (DCE) (modèle de Stern) : ... 7
3. Stabilité des colloïdes : ... 10
4.1.1. Coagulation par compression de la double couche : ... 11
4.1.3. Hétéro coagulation : ... 18
4.1.4. Coagulation par ajout d’adjuvants : ... 18
4.1.5. Paramètres influençant la coagulation ... 19
4.1.6. Mode d’action des coagulants sur la matière organique : ... 20
5. Floculation : ... 21
5.1. Différents types de floculants ou adjuvants de floculation : ... 23
a. Les polychlorures d’Aluminium : ... 23
b. Les argiles : ... 24
5.2. Détermination des seuils de floculation : ... 27
5.3. Mode d’action des floculants sur la Matière Organique (MO) : ... 28
5.4.1. La floculation rapide ou péricinétique : ... 28
5.4.2. La floculation orthocinétique : ... 30
5.4.3. Déplacement des particules et courant électrique : ... 30
5.5. Stabilité des sols : ... 31
6. Phénomènes d’adsorption dans un réacteur discontinu : ... 32
6.1. Introduction : ... 32
6.2. Phénomènes d’adsorption sur les particules colloïdales : ... 33
6.2.1. Structure et caractéristiques des adsorbants : ... 33
6.2.2. Facteurs influençant l’adsorption : ... 35
6.3. Action des additifs sur le phénomène d’adsorption : ... 36
6.3.1. Action des tensioactifs sur le phénomène d’adsorption : ... 36
6.3.2. Action des sels métalliques sur l’adsorption : ... 36
6.3.3. Adsorption des alcools sur le charbon actif : ... 37
7. Rappel sur les matières colorantes artificielles : ... 37
8. Modèles d’adsorption : ... 38
8.1. Isotherme d’adsorption de Langmuir : ... 38
8.2. Isotherme de Freundlich : ... 41
9. Rappels sur la filtration par coagulation de contact : ... 41
9.1. Propriétés physico chimiques des oxydes métalliques formant les membranes : ... 42
9.2. Effets des sels : ... 43
9.3. Effet du pH : ... 43
II- Théorie de l’électrocoagulation : ... 45
1. Origine et évolution du procédé d’électrocoagulation : ... 45
3. Différents réacteurs utilisés dans le procédé d’électrocoagulation ... 48
3.1. Différents modes de circulation : ... 48
3.2. Différents modes de connexion électriques : ... 49
4. Lois régissant l’électrolyse : seconde loi de Faraday : ... 50
5. Rendement de Faraday et rendement énergétique : ... 50
6. Principe de l’électroflottation : ... 51
Description du processus d’électroflottation : ... 52
7. Principe de l’électroprécipitation : ... 54
8. Principe de l’éléctrofloculation : ... 54
9. Différentes réactions aux électrodes : ... 55
10. L’aluminium dans le procédé d’électrocoagulation : ... 56
10.1. Diagramme potentiel pH de l’aluminium : ... 56
10.2. Espèces prédominantes en fonction du pH : ... 58
10.3. Comportement de l’aluminium dans le processus coagulation- floculation : ... 60
10.3.1. Comportement de l’aluminium comme anode lors du procédé d’électrocoagulation : ... 62
10.3.2. Comportement de l’électrode d’aluminium en tant que cathode : ... 63
11. Evaluation de la tension imposée aux bornes de la cellule d’électrolyse : ... 64
12. Comparaison des deux procédés : électrocoagulation et coagulation-floculation classique : ... 65
12.1. Avantages de la technique d’électrocoagulation par rapport à celle de la coagulation floculation classique : ... 65
12.2. Inconvénients de la technique d’électrocoagulation : ... 65
III- Synthèse de structures solides adsorbants : ... 66
1. Préparation de poudres par condensation : ... 66
2. Synthèses des ferrates : ... 67
2.1. Préparation des sels de Fe VI : ... 67
2.2. Quelques utilisations des sels de fer VI : ... 68
I- Montage expérimental ... 70
I-1. Réacteur à deux électrodes ... 70
I-2. Réacteur à 8 électrodes ... 71
II- Technique analytique ... 72
II-1. Mesures de pH ... 72
II-2. Protocole du Jar Test ... 73
II-3. Mesures d’absorbance ... 74
II-4. Analyses des métaux lourds ... 74
A l’aide du dispositif suivant : ... 74
III- Produits et préparation des solutions ... 75
I- Introduction ... 78
II- Etude du comportement des électrodes d’aluminium dans des solutions synthétiques en fonction du pH dans NaCl ... 79
II.1. Effet du pH et de NaCl ... 79
II- 2. Mode opératoire ... 79
II-3. Résultats expérimentaux ... 79
II-4. Interprétations des résultats ... 80
III. Comportement des électrodes d’aluminium en présence de glucose et de chlorure de sodium ... 80
IV- Comportement des électrodes d’aluminium en présence d’acétate de sodium et de
chlorure de sodium ... 82
IV-1. Mode opératoire ... 82
IV-2 Résultats expérimentaux ... 83
IV-3. Interprétations des résultats ... 84
V-1. Mode Opératoire ... 85
V-2. Analyse du surnageant ... 85
V-3. Analyse de la masse solide ... 85
VI- Préparation des produits d’adsorption ... 86
VI-1. Solutions utilisées ... 86
VI-1-2. Dans le réacteur à huit électrodes ... 86
VI-2. Résultats expérimentaux et interprétations ... 87
VI-2.1. Dans la cellule à deux électrodes ... 87
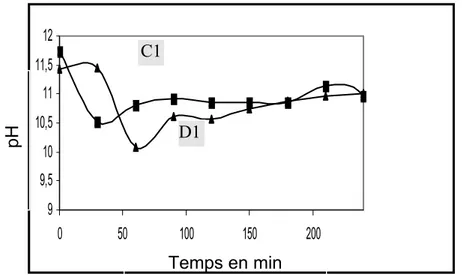
VI-2.1.1 pH ... 87
VI.2.1.2 Conductivité ... 92
VI-2.2. Dans un réacteur à huit électrodes ... 93
VI-2.2.1. pH ... 93
VI-2.2.2. Conductivité ... 94
VI-3. Etude des différentes structures aux RX ... 96
VI-3.1. Mode opératoire ... 96
VI-3.2. Résultats expérimentaux ... 96
VI-3.3. Interprétation des Résultats ... 101
VI-4. Conclusion ... 101
I- Traitement d’un colorant synthétique ... 104
I-1. Traitement par électrocoagulation ... 105
I-1.1. pH ... 105
I-1.2. Conductivité ... 107
I-1.3. Absorbance ... 107
I-2. Traitement par adsorption sur les structures synthétisées en fonction du temps ... 108
I-2.1. Evolution du pH ... 108
I-2.2. Absorbance ... 110
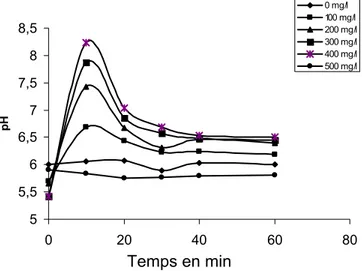
I-3. Traitement par adsorption sur la structure adsorbante R2 en fonction de la concentration ... 114
I-3.1. pH ... 115
I-3.2. Absorbance ... 116
II- Traitement de rejets de tannerie ... 117
II-1. Introduction ... 117
II-2.1. pH ... 117
II-2.2. DCO ... 118
II-2.3. Conductivité et concentration d’Aluminium en solution ... 118
II-2.4. Absorbance ... 119
II-3. Traitement d’un colorant de tannerie par adsorption sur la structure R synthétisée ... 120
II-3.1. Essai à 0, 3 g/l de R2 ... 120
II-3.1.3. Aluminium en solution ... 122
II-3.2. Essai à 3 g/l de R2 ... 123
III- Etude de l’adsorption des colorants. ... 125
III-1. Courbe d’étalonnage du colorant synthétique. ... 125
III-2. Mode opératoire ... 126
III-3.1. Résultats expérimentaux ... 126
III-3.2. Interprétations des résultats ... 128
III-4. Application de l’isotherme de Freundlich au colorant synthétique HE7B ... 128
III-4.1 Résultats expérimentaux ... 128
III-4.2. Interprétations des résultats ... 129
III-6. Cinétique d’adsorption du colorant synthétique HE7B dans le cas du réacteur discontinu à 8 électrodes (électrocoagulation) ... 130
III-6.1. Résultats expérimentaux ... 130
III-6.2. Interprétations des résultats ... 130
III-7. Cinétique d’adsorption du colorant de tannerie en réacteur discontinu à 8 électrodes ... 131
III-7.1 Résultats expérimentaux ... 131
III-7.2. Interprétations des résultats ... 131
III-7.3. Capacité ultime d’adsorption ou capacité à saturation dans le cas des colorants synthétiques ... 132
III-7.4. Ordre de la cinétique d’adsorption ... 133
III-7.4.1. Résultats expérimentaux ... 133
III-7.4.2. Interprétations des résultats ... 134
III-8. Conclusion ... 134
IV- Traitement des métaux lourds d’un colorant de tannerie ... 135
Le rejet étudié est récupéré à la fin de l’opération de corroyage- finissage. Il est rougeâtre, chargé en matière organique et en métaux.lourds. Son à pH est acide (pH = 3,36). ... 135
IV-1. Par électrocoagulation ... 135
IV- 2. Par adsorption sur R ... 137
V- Traitement d’un rejet de pelanage de tannerie ... 137
V-1.1. pH ... 137
V-1.2 DCO ... 138
V- 1.3. Aluminium en solution ... 139
V-1.4. Conductivité ... 140
V-2. Traitement d’un rejet de pelanage de tannerie par adsorption sur la structure R (Jar Test) ... 140
V-2.1. pH ... 141
V-2.2. DCO ... 141
V-2.3. Concentration en aluminium dissous ... 142
V- Traitement des métaux lourds du rejet pelanage de tannerie ... 142
V-1. Par électrocoagulation ... 143
V-2. Par adsorption sur la structure adsorbante R. ... 143
Le procédé d’électrocoagulation ne permet pas l’élimination significative de ces éléments (S, Na), la matière organique en quantité excessive, créant, probablement une saturation des sites d’adsorption. ... 143
VI- Elimination des métaux lourds et de la DCO des rejets d’une unité de traitement de surface ... 143
VI-1. Rappels sur les rejets de traitement de surface ... 143
VI-2. Traitement d’un rejet à pH très acide (pH = 0,31) ... 143
VI-2.1. Par électrocoagulation ... 144
VI-2.2. Par adsorption sur la structure adsorbante R ... 144
VI-3. Traitement d’un rejet à pH neutre (pH =7,69) ... 147
VI-4.1. Par électrocoagulation ... 149
VI-4.1.1. Elimination de la DCO ... 150
VI-4.2.1. Elimination de la DCO ... 150
VI-4.2.4. Elimination des métaux lourds ... 151
VI-4.2.4.1. Résultats expérimentaux ... 151
VI-4.2.4.2. Interprétations des résultats ... 152
VI- 5. Conclusion ... 152
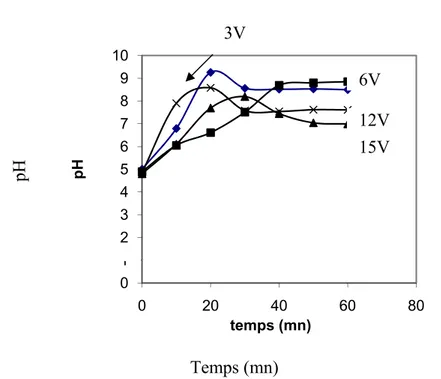
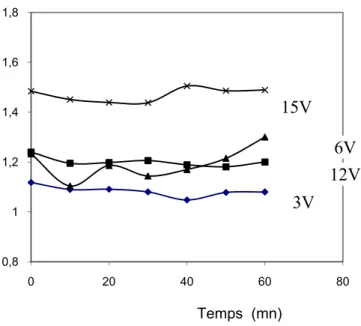
V-1. Influence de la tension imposée sur la perte de masse ... 157
V-1.1. Mode Opératoire ... 157
V-1.2. Résultats Expérimentaux ... 157
V-1.3. Interprétations des résultats ... 159
V-2. Influence du pH sur la perte de masse ... 160
V-2.1. Mode Opératoire ... 160
V-2.2. Résultats expérimentaux ... 161
V-2.3. Interprétation des résultats ... 162
V-3. Influence de l’électrolyte support sur la perte de masse ... 163
V-3.1. Mode Opératoire ... 163
V-3.2. Résultats expérimentaux ... 163
V-4. Variation de la perte de masse aux électrodes en fonction du pH dans le réacteur à 8 électrodes. ... 165
V-4.1. Mode Opératoire ... 165
V-4-3. Conclusion ... 167
CONCLUSION GENERALE ... 168
Résumé :
Le présent travail se propose d’étudier l’élimination de la matière organique (MO), minérale et colorée grâce au procédé d’électrocoagulation par des électrodes d’aluminium, et par adsorption sur une structure R synthétisée par ce même procédé afin de comparer les deux méthodes à plusieurs pH.
Nous procéderons tout d’abord dans une première partie à l’étude du comportement des électrodes d’Aluminium, au cours du procédé d’électrocoagulation, dans des solutions synthétiques.
Nous nous sommes intéressés par la suite à la synthèse de structures adsorbantes à différents pH et à leur analyse par ICP et Diffractions aux rayons X. Les résultats de ces analyses ont montré que ces structures comportaient en majorité de l’aluminium pur (1/3), le reste étant partagé entre du Magnésium, du Calcium et du Manganèse etc.. qui , lorsqu’ils sont en solution, favorisent la fixation des particules et que leur constituant principal était l’hydroxyde d’aluminium. Ces analyses révèlent par ailleurs la présence en plus ou moins grande proportion de structures particulièrement adsorbantes telles que Al45O45(OH)45 Cl et
AlCl(OH)2.2H2O.
Dans une deuxième partie, nous avons effectué une comparaison de l’élimination de la pollution organique par électrocoagulation et par adsorption sur la structure synthétisée R , avérée comme la plus adsorbante , à l’aide d’ un colorant synthétique, de rejets de tannerie ,l’un coloré (acide) et l’autre de pelanage (basique) et sur des rejets d’ une usine de traitement de surface à différents pH.
Une analyse des métaux lourds a été effectuée par la même occasion au cours de cette comparaison.
L’étude des isothermes de Langmuir et Freundlich a montré que l’adsorption sur la structure adsorbante R obéit à ces modèles.
Une troisième partie sera consacrée à l’étude des pertes de masses aux électrodes au cours du procédé d’électrocoagulation, en fonction de la tension imposée, du pH dans la cellule à deux électrodes et dans le réacteur à huit électrodes, ainsi que l’ influence de l’ électrolyte support sur cette perte de masse.
Summary
The present work aims to study the removal of organic matter (OM), mineral and colorfully by the method of electrocoagulation with aluminum electrodes, and by adsorption on R structure synthesized by the same process and even to compare both methods at several pH.
We first proceed to the study of the behavior of electrodes of aluminum in the process of electrocoagulation, in synthetic solutions.
We are interested next to the synthesis of adsorbent structures at different pH and to their analysis by ICP and X-ray Diffractions .The results of these analyzes showed that the structures involved in the majority of pure aluminum (1/3), the remainder being divided between the Magnesium, Calcium and Manganese etc. .. which, when being in solution, facilitate the fixing of the particles and that their main component was aluminum hydroxide. These analyzes also reveal the presence in greater or lesser proportion of particularly adsorbent structures such as Al45O45 (OH) 45 Cl and AlCl (OH) 2.2H2O.
In a second part, we make a comparison of the elimination of organic pollution by
electrocoagulation and by adsorption on the synthesized structure R proven as the most adsorbent structure, with the help of a synthetic dye, tannery waste, one color (acid) and other liming (basic) and the release of a treatment plant surface at different pH.
An analysis of heavy metals has been effected by the same occasion during this comparison.
The study of Langmuir and Freundlich isotherms showed that the adsorption of the adsorbent structure R obeys to these models.
A third part will be devoted to the study of mass losses to the electrodes in the
electrocoagulation of the process, depending on the imposed voltage, the pH in the cell with two electrodes and in the reactor with eight electrodes and the influence of this supporting electrolyte loss in mass.
I
I
n
n
t
t
r
r
o
o
d
d
u
u
c
c
t
t
i
i
o
o
n
n
Les effluents urbains ou industriels sont chargés de matières polluantes de différents types : organique, minérale, physique etc., …Ceci confère à ces effluents un caractère agressif et nuisible pour le milieu récepteur. Pour s'affranchir de la pollution responsable de nombreux dégâts infligés à l'écosystème et à la ressource en eau dont les utilisations sont multiples (alimentation en eau potable, pisciculture, besoins des industries en eau, agriculture, etc.), de nombreux procédés sont mis en œuvre. Parmi celles-ci, les techniques d'épuration électrochimiques, telles que l'électrocoagulation et l'électro flottation prennent de plus en plus d'importance [1-3]. Ces techniques prometteuses ont été étudiées pour le traitement de divers rejets industriels, tels que par exemples les effluents des industries de textile et des industries agroalimentaires [1-2]. Ces procédés peuvent être utilisés pour éliminer les matières en suspension, la DCO, la couleur des effluents, les émulsions huileuses, les germes pathogènes, etc. [3-4].
L'électrocoagulation est une technique dérivée de la coagulation classique. Elle permet d'éliminer les particules colloïdales et la pollution dissoute grâce à la production in situ de flocs d'hydroxydes obtenus par dissolution anodique d'électrodes solubles (Fe, Al) [3]. Les flocs d'hydroxydes générés par voie électrochimique sont plus compacts que ceux obtenus par la méthode chimique [5]. En outre, l'électrocoagulation requiert moins de réactifs et permet de réduire le volume de boues générées comparativement à la coagulation chimique qui nécessite des concentrations élevées de réactifs, entraînant ainsi une augmentation du volume de boues [3].
L'utilisation d'électrodes solubles d'aluminium permet de produire à l'anode des ions Al3+ qui réagiront par la suite en solution avec les ions OH- pour former des hydroxyde d'aluminium Al(OH)3. Le passage de l'ion aluminium en solution dans le solide recouvre, en
effet, des phénomènes complexes qui sont de véritables réactions de polymérisation ou polycondensation inorganiques [6] En effet, l'aptitude de l'ion aluminium à se condenser et à précipiter dépend des conditions physico-chimiques du milieu. Ainsi, aux pH acides pH < 4 l'hydroxyde d'aluminium se dissout et donne lieu aux ions hydrolysés d’aluminium : Al3+, Al(OH)22+ …… A pH > 4, l'aluminium peut exister sous la forme solide Al(OH)3, ou sous la
(ou de substitution) à la surface des particules d'hydroxydes ou par des phénomènes d'interaction ou d'attraction électrostatique []. Au cours des réactions d'addition, le polluant peut agir comme un ligand (L) et se lier à la surface du complexe métallique suivant la réaction:
L-H + (OH)(OH)2Al(s) L-(OH)2AI + H2O
Quant aux phénomènes électrostatiques, ils peuvent être attribués à la présence de particules d'hydrate ou d'hydroxyde d'aluminium chargées positivement ou négativement, tels que [Al(OH)2]63+, [Al(OH)4]- et [Al(OH)4(OH)2]-, susceptibles d'attirer les charges
contraires des polluants en fonction des conditions physico-chimiques du milieu.
L'étude de ce procédé appliqué à des rejets industriels a pour objectif d'optimiser les paramètres opératoires (pH et conductivité), régissant le phénomène de l'électrocoagulation et quantifier leurs effets sur le processus en faisant ressortir les éléments techniques et économiques permettant de dimensionner convenablement le procédé d'électrocoagulation.
Une étude bibliographique nous a permis de mettre en évidence les caractéristiques du procédé et les particularités liées à l’utilisation des électrodes d’aluminium. Nous avons étudié le comportement des électrodes d’aluminium dans des solutions synthétiques en mettant en relief l’influence des conditions expérimentales et particulièrement du pH de la composition de la solution de la température du potentiel sur le procédé d’électrocoagulation. Le pH est le paramètre essentiel qui s’est dégagé de cette étude, comme cela était cité auparavant par plusieurs auteurs (Picard [8-11]. Une structure adsorbante qui semble se former aux pH basiques pourrait s’avérer à l’origine de la diminution de la DCO pour des solutions synthétiques.
Nous nous sommes aussi intéressés à la synthèse de cette structure par électrocoagulation à l’aide d’électrodes d’aluminium à différents pH puis à son analyse aux RX. Nous avons par la suite évalué les quantités de structures obtenues par évaluation de la perte de masse aux électrodes.
Notre travail a ensuite porté sur l’efficacité d’adsorption de la structure synthétisée grâce aux tracés des isothermes d’adsorption de Langmuir et Freundlich.
Nous avons par la suite testé la structure adsorbante formée sur plusieurs rejets de traitement de surface, d’industrie textile et de tannerie.
P
P
a
a
r
r
t
t
i
i
e
e
b
b
i
i
b
b
l
l
i
i
o
o
g
g
r
r
a
a
p
p
h
h
i
i
q
q
u
u
e
e
:
:
Une des opérations physico-chimiques les plus utilisées en matière de traitement des eaux, aussi bien industrielles que domestiques est la coagulation. C’est un processus qui permet l’élimination de particules colloïdales grâce à leur déstabilisation chimique, par addition d’un électrolyte. Elle est suivie de leur agrégation en particules plus grosses ou
flocs…( floculation), puis de leur précipitation sous forme d’hydroxydes. La coagulation peut, d’autre part, être induite par l’action d’un champ électrique, dans
une cellule électrolytique et donner lieu à l’électrocoagulation (déstabilisation électrochimique), accompagnée souvent d’électroflottation. Le courant électrique permet la dissolution d’anodes solubles entraînant la coagulation et la floculation des particules en favorisant la migration et le transport de celles-ci.
I- Rappels sur les techniques de coagulation et floculation : 1. Solutions colloïdales :
Les solutions colloïdales présentent des propriétés intermédiaires entre celles d’une solution moléculaire ou ionique et celles d’un système solide. Elles diffèrent par leur taille, les plus fines étant les plus difficiles à éliminer, c'est-à-dire que ces dispersions colloïdales dépendent de la dispersion granulométrique et de la forme des particules mais aussi des forces d’interactions entre ces particules, ce qui se traduit par des collisions générées par un mouvement brownien important du fait de leur infime dimension. L’efficacité de ces collisions entraine une stabilité ainsi que d’autres propriétés de dispersions menant à l’agrégation. La dispersion est infiniment stable si toutes les collisions sont inefficaces.
Ces phénomènes se présentent dans une très grande partie des eaux naturelles et surtout des eaux usées qui contiennent des particules affectant leur consommation ou leur réutilisation. Ces dernières sont soit des impuretés dissoutes ou des sels minéraux, des molécules organiques, des colloïdes ou des solides en suspension.
1.1. Classification granulométrique des colloïdes :
La classification par taille, est une étape importante, dans l’étude des colloïdes. Elle est considérée comme base dans le choix de la technique adéquate pour chaque classe de taille concernée. Quatre familles de particules sont généralement utilisées pour distinguer les différents contaminants des eaux usées urbaines [11-12] :
La fraction soluble composée de particules de tailles inférieures à 0,001 µm.
La fraction colloïdale composée de particules de taille comprise entre 0.001 et 1 µm ;
La fraction sédiment able ou décan table composée de particules de taille supérieure à 100 µm.
Audinos et al (1986) répartissent les particules en fonction de leur dimension en : Colloïdes moléculaires
Colloïdes macromoléculaires Colloïdes micellaires
1.2. Caractérisation des colloïdes :
Béchac et al [13] classent quant à eux les colloïdes en deux catégories en fonction de leur affinité vis-à-vis de l’eau. Ils distinguent les colloïdes hydrophiles et les colloïdes hydrophobes.
Les colloïdes hydrophiles ont, comme leur nom l'indique, une grande affinité pour l'eau et adsorbent donc une couche d'eau protectrice qui se fixe à la matière solide par des liaisons physico-chimiques avec des groupements OH-, -NH2-, -COOH-, totalement ou
partiellement ionisés. Dans cette catégorie on trouve les protéines, les carbohydrates et les produits organiques généralement présents dans les eaux.
Les colloïdes hydrophobes qui n'ont aucune affinité pour l'eau, n'ont pas de couche protectrice. Leur stabilité est due à la charge électrique développée par les particules qui engendrent une répulsion mutuelle empêchant toutes agrégations. Ils proviennent des substances peu ou pas solubles tels que les produites minéraux et en particulier les métaux, leurs oxydes et leurs hydroxydes dont la stabilité dépend de l'interaction entre deux particules mettant en jeu deux forces contraires. Une force de répulsion qui dépend de la charge électrique entre deux particules de même signe et une force d'attraction (type de Van Der Waals) qui tend à rassembler les particules afin d'atteindre une énergie potentielle minimale , fonction de la distance interarticulaire.
Entre ces deux catégories hydrophobe et hydrophile, on trouve les détergents synthétiques tels que les savons qui appartiennent à la catégorie des agents de surface avec des affinités opposées pour l'eau, dont une partie hydrophile ou polaire et une partie hydrophobe ou apolaire.
Pour déstabiliser les colloïdes et entraîner ainsi leur agglomération en flocs, on peut augmenter la force ionique du milieu par l'introduction d'un électrolyte. Ceci a pour effet de diminuer l'épaisseur de la double couche électrochimique en abaissant la barrière du potentiel existant autour du colloïde et faciliter cette agglomération. On peut aussi augmenter l'énergie cinétique des particules.
2. Théorie de la double couche électrochimique (DCE) (modèle de Stern) :
Les théories de Helmholtz et de Gouy Chapman ont permis de mettre au point la théorie de la double couche suivant le modèle de STERN (figure 1).
Une particule colloïdale est caractérisée par sa charge électrique de surface (voir figure 1). Cette charge électrique superficielle est le plus souvent négative, due à l'adsorption préférentielle de certains ions du fait de l'ionisation partielle d'un ou plusieurs groupements
constituant les matières colloïdales. La charge électrique des agrégats résulte d'une adsorption sur les particules, d'ions d'un électrolyte, elles mêmes par des ions de charge opposée, présents dans la phase dispersée conduisant à la formation de micelles. Lorsque le système est en équilibre, c'est à dire à la neutralité, les charges électriques portées par les micelles sont compensées par les charges de signe oppose du milieu environnant.
Figure 1 : Etat de surface des colloïdes selon la théorie de la double couche
Il y a équilibre physico-chimique entre les ions de la surface et ceux du liquide interstitiel à l'interface solide-liquide. Les particules sont alors entourées d'une double couche électrochimique, l'une fermement fixée à la particule solide, l'autre mobile diffuse du fait de l'agitation thermique qui tend à la répartir uniformément dans le milieu suivant les lois statistiques, mais de charge électrique égale en grandeur et de signe opposé à la première. Ce qui montre bien que l'épaisseur de la double couche dépend aussi bien de l'attraction électrostatique que des phénomènes de diffusion. Ce modèle suppose que la charge électrique est répartie uniformément sur la surface des micelles mais en réalité, il tient compte de la répartition topographique des ions adsorbés préférentiellement sur les centres actifs (arêtes, angles, irrégularités du réseau et de la surface). (14)
Le plan intérieur d’Helmotz, dans lequel se trouvent les centres des anions et constitué d'hydrates
un plan constitué de cations hydrates et maintenus au contact du premier par des forces électrostatiques.
Les deux plans constituent la couche fixe de Stern.
Une couche diffuse appelée de couche de Gouy se trouve entre cette couche fixe et la phase liquide. Elle est le siège de transfert d'anions et de cations entre les deux dernières du fait des résultantes des forces contraires d'attraction et de répulsion électrique. Sa densité de charge globale diminue avec la distance à l'interface.
Figure 2 : Stabilité des colloïdes selon la théorie DVLO Une particule colloïdale possède ainsi deux potentiels :
un potentiel de surface ou potentiel thermodynamique de Nernst, se situant au plan de cisaillement noté Ψ. Gouy montre que celui-ci diminue suivant une loi exponentielle jusqu'à une certaine valeur prise au sein du liquide.
un potentiel électrocinétique situé au niveau de la couche fixe appelé potentiel Zêta ξ.
Avec :
e q
4
ξ : représente le potentiel Zêta,
e : l’épaisseur effective de la couche à partir du centre de la particule jusqu’au plan de cisaillement.
q : la charge de l’entité mobile et ε : la permittivité du milieu.
Le potentiel Zêta des particules hydrophobes varie généralement entre 50 et 100mV (19).
Les charges électriques des particules permettent leur déplacement dans un champ électrique par électrophorèse. Elles son réparties uniformément à la surface de celles-ci. Il n'y a donc pas de variation de potentiel dans la couche qui leur est attachée. Par contre dans la couche diffuse le potentiel diminue progressivement jusqu'à s’annuler, au sein du liquide dispersant. Cette variation du potentiel correspond au potentiel électrocinétique ξ définit précédemment. Il varie avec l'épaisseur de la double couche, la nature des ions constituant la structure des particules, la concentration et la valence des ions composant le liquide intercellulaire. Il est responsable de l'intensité des forces répulsives interparticulaires et dépend du potentiel thermodynamique Ψ. Celles ci diminuent l'épaisseur de la double couche, ainsi que la vitesse de migration électro phorétique et par conséquent la stabilité des agrégats.
Le potentiel ξ s'annule pour une certaine concentration appelée PCN (point de charge nulle) pour laquelle la charge de la surface est totalement neutralisée.
3. Stabilité des colloïdes :
Plusieurs auteurs ont étudié les différents facteurs régissant la stabilité des colloïdes, particulièrement Deryagin et Landau en URSS [15],Verwey et Overbeek en Hollande [16].Ils ont mis au point une théorie, appelée théorie DVLO reliant la charge de surface et la stabilité des suspensions colloïdales et faisant intervenir deux forces:
Les forces d'attraction de London- Van Der Waals : appelé énergie Wa, faisant intervenir la structure, la forme des colloïdes et la matière du milieu. Wa est fonction de la distance inter particulaire lorsque les particules sont mises en contact par leur déplacement aléatoire au sein de la solution (mouvement brownien).
Les forces de répulsion électrostatiques de Coulomb Wr liées aux charges superficielles des colloïdes.
L'énergie potentielle totale du système colloïdale W est l'énergie résultant de l'action des ces deux forces Wa et Wr. Wa.
des espèces ioniques à l'interface de la particule colloïdale, et de la force ionique du milieu environnant. Wa est inversement proportionnel au carré de la distance interparticulaire.
4. Déstabilisation des particules colloïdales - Coagulation et floculation : 4.1. Coagulation :
La coagulation est la déstabilisation des particules colloïdales. Elle se produit lorsque les forces attractives entre les particules sont supérieures aux forces répulsives et entrainent ainsi la neutralisation de la charge de celles-ci. Elle permet en conséquence la diminution de la barrière énergétique W, favorisant la floculation (agrégation des particules en flocs). Celle-ci peut être obtenue de différentes manières. On distingue :
La coagulation électrostatique par addition d'électrolytes quelconques qui diminuent les forces électrostatiques et compriment le nuage ionique autour de la particule (Double couche électrique).
La coagulation par adsorption d'ions de signes contraires qui diminuent le potentiel Zêta à la limite de la couche de Stern.
La coagulation par entraînement survenant dans les solutions diluées ou "sweep coagulation" qui consiste en la précipitation rapide des particules ;
La coagulation ou adsorption de macromolécules ou de polyélectrolytes susceptibles de former des ponts interparticulaires.
4.1.1. Coagulation par compression de la double couche :
L'épaisseur du nuage ionique entourant les particules est donnée par la formule de Debye-Huckel par la relation suivante :
2 31
, 0
CZ
C : concentration molaire de chaque espèce Z : valence de l'ion
On remarque que plus Z augmente, plus δ diminue et qu'ainsi un ion trivalent ou divalent aura plus d'effet qu'un ion monovalent. Ceci explique l'impact des ions Al3+ et Fe3+ sur la coagulation. Ceci a été mis en évidence par la règle de Schulze et Hardy. Cette règle n'est que qualitative car d'autres facteurs jouent également leur rôle comme le pH, la température, le comportement particulier du cation (hydratation, polymérisation, hydrolyse) et la nature de l'anion correspondant. Comme nous l'avons cité auparavant l'augmentation de
la concentration des ions de charges opposées à celle de la particule colloïdale augmente la force ionique du milieu et diminue le domaine de répulsion interparticulaire et par conséquent le volume de la couche diffuse nécessaire à l’électroneutralité diminue [17].
Le potentiel de la couche diffuse s’abaisse petit à petit avec la diminution des charges jusqu’à s’annuler au sein du liquide dispersant. Entourées de leur propre double couche, les particules peuvent se superposer lors de leur rapprochement. On observe aussi une diminution de la vitesse de migration électrophorétique, il y a alors compression de la double couche vers la surface des particules. Pour une valeur critique du potentiel électrocinétique où la répulsion électrostatique est nulle il y a floculation. Celle-ci a lieu au point isoélectrique et à une vitesse d’électrophorèse nulle.
Les ions interagissant avec la surface peuvent être des ions indifférents qui n'ont pas d'influence sur le point de charge nulle de la suspension. Leur action est alors purement électrostatique avec la surface. Ils permettent d'abaisser la valeur absolue de la DCE lorsque leur concentration en solution augmente.
L'efficacité des électrolytes ajoutés (appelés électrolytes indifférents) augmente avec la valeur de l'ion commun, comme prévue par la règle de Schulze et Hardy, ainsi les ions Al3+ ont un effet supérieur aux ions Ca2+ et aux ions Na+ sur la compression de la double couche, et l'agglomération des particules colloïdales. Les ions concernés ne subissent pas d'hydratation et fonctionnent par interactions électrostatiques.
4.1.2. Coagulation par adsorption d'ions :
Une série de phénomènes intéressants peut résulter de l’ajout d’un polymère à une dispersion colloïdale. La dispersion peut être stabilisé ou déstabiliser si le polymère s’adsorbe sur les particules. Si pendant l’approche des particules les unes des autres, l’interaction entre les polymères adsorbés conduit à une répulsion stérique ou électrostatique suivant le mécanisme dominant. Ces polymères peuvent partiellement recouvrir les particules et former un pont entre deux particules simultanément et entrainer la floculation.
a. Principe :
Certains ions de charge opposée à celle de la particule peuvent ainsi réagir à sa surface, se complexer avec des atomes de sa structure et réduire la charge superficielle nette à zéro, et même en inverser le signe.
phénomène de pontage ou liaisons inter particulaires par des espèces polymériques du coagulant ;
Inclusion (survenant dans les suspensions diluées) du colloïde dans un précipité d'hydroxydes métalliques ou "sweep floc" qui provoque l'ennoiement de celui-ci et la précipitation rapide des particules.
La concentration minimale nécessaire pour avoir une vitesse d'agrégation mesurable est beaucoup plus faible, pour les ions chargés (adsorption) que pour les ions indifférents (action purement électrostatique) et dépend de la surface disponible de la particule.
La coagulation peut survenir par adsorption d'ions de coagulant ou de produits de leur réaction par l'eau. La partie non adsorbée peut contribuer à la floculation par coagulation électrostatique.
L'addition de la dose de coagulant obéit à une relation stœchiométrique. Tout excès de réactif mène à une re-stabilisation de la suspension. La nature même de l'adsorption fait que la dose optimale ne coïncide pas nécessairement avec le potentiel Zêta nul.
L'adsorption étant d'autre part proportionnelle à 1/T, elle se déroule théoriquement mieux à froid qu'à chaud [18] .L'adsorption étant un phénomène exothermique, les résultats sont meilleurs à froid. La vitesse d'adsorption est une fonction de type d'Arrhénius. On cite cependant une application intéressante de l'action de la température dans l'épuration des eaux de teinturerie, pour obtenir une adsorption sélective des colorants en présence des détergents.
Les particules colloïdales peuvent être déstabilisées par emprisonnement dans un floc. Lorsque le pH de l’eau se trouve dans une plage neutre ou acide, les molécules d’hydroxyde l’Aluminium constituant le floc sont habituellement de charges positives. Les anions présents dans les particules colloïdales peuvent accélérer la formation de précipités en jouant le rôle de noyaux.
b. Différents coagulants utilisés dans la coagulation par adsorption :
Les deux coagulants les plus utilisés, sont en général, le Fe3+ et l’Al3+, qui tous deux s’hydrolysent et se polymérisent sous différentes formes suivant le pH. Le tableau I présente les différentes formes hydrolysées des deux métaux.
Espèce dissoute pH Fe Al M(H2O)6+++ < 3 < 4.5 [M(H2O)5OH]++ - 4.8 [M(H2O)4OH2]+ - 5.3 [M(H2O)3OH3] 4.5 5.5 -7.5 [M(H2O)2OH4]- 5 9.5 [M(H2O)OH5]-- > 7 > 10
Tableau I : Différentes formes hydrolysées du fer et de l’aluminium [19]
Rappelons que les cations Mz+ en solution aqueuse forment des hydro-complexes avec les molécules d’eau selon la réaction suivante :
Mz+ + n H
2O M(H2O)z+n (1)
Pour la plupart des cations l’indice de coordination n est compris entre 0 ou 6. Dès qu’une molécule d’eau se coordonne à un cation, ses propriétés changent. Le complexe métal/molécules d’eau a tendance à libérer des protons. Ce processus est appelé protolyse ou hydrolyse du complexe (Réaction 2) :
Le métal cationique Mz+ attire les électrons de la liaison OH de H2O, affaiblit ces
liaisons et facilite leur rupture.
L’acidité de l’eau varie donc selon la charge du cation et inversement selon son rayon ionique.
Suivant le pH et la charge du cation on peut rencontrer successivement les complexes suivants :
M(H2O)z+n M(H2O)x(OH)y(z-y)+] M(OH)fOg(z-f-2g)+] MOn(z-2m)+ (2)
Figure 3 : Types de complexes (aquo,hydroxo,oxo) :variation avec le pH et avec la charge du cation
Si on considère un aquo-complexe donné à l’équilibre, il a tendance à évoluer vers un hydroxo puis un oxo complexe.
M(H2O)z+n (H2O)n-1M (OH)] z-1 + H+ (3)
Souvent il existe en solution des espèces autres que les complexes mononucléaires, ces complexes sont polynucléaires. Dans le cas d’une dimérisation par exemple on obtient :
2 (H2O)n-1M (OH)] z-1 (H2O)n-2M M(H2O)n-2 2(z-1) + 2 H2O (4) O H O H K 2 monomères (Complexe mononucléaire) Dimère (Complexe binucléaire)
On peut facilement concevoir une répétition de ce genre de condensation comprenant le dimère puis une troisième molécule du monomère et ainsi de suite. Ceci aboutit à la formation d’un polymère. Dès que l’on excède la limite de saturation on formera des hydroxo-colloïdes et éventuellement des précipités.
Ces complexes polynucléaires peuvent être considérés comme intermédiaires dans l’état de transition avec des ions libres vers un précipité solide. La formation des complexes polynucléaires et les condensations subséquentes sont des processus lents (favorisés dans le cas de l’électrocoagulation par l’élévation du pH.
c. Cas particulier de Fe3+ et Al3+ :
Plus particulièrement Fe3+ et Al3+ se lient en milieu acide à 6 H2O (coquille
d’hydratation de Al (figure 4) et s’ionisent au fur et à mesure que le pH s’élève et que les molécules d’eau sont peu à peu substituées par OH- .
Figure 4 : Coquille d’hydratation de l’aluminium [19]
D’après l’étude de Parks [19], une partie importante de Al3+ est complexée en solution par fixation de OH- dans des relations de type:
Al3+ + nOH- Al(OH)n(3-n)+ (5)
Avec 1 n 4 ce qui inclut Al(OH)03 molécule libre d’alumine restant en solution. Les valeurs
numériques des constantes d’équilibre de formation des complexes données par l’auteur sont reproduites dans le tableau II, et permettent de calculer les constantes d’équilibre des réactions d’hydrolyse.
Al3+ + OH- Al(OH)2+ 109 Al3+ + 2 OH- Al(OH)2+ 1019.3
Al3+ + 3 OH- Al(OH)3 1026.8
Parks [20] considère d’autre part, dans son étude sur la déphosphoration que les complexes polymériques de type Alm(OH)q(3m-q)+ correspondant à la réaction générale[17]
sont en quantité très faibles ,pour jouer un rôle dans cette déphosphoration et propose de les négliger, considérant qu’ils ne s’observent qu’en solution sursaturée, et sont précurseurs de l’amorce de la précipitation de l’alumine.
m Al3+ +q H2O Alm(OH)q(3m-q)+ + q H+ (6)
Fessinger [20] à la suite de Hsu et Bates [11], considèrent les complexes polymériques comme des précurseurs de la formation du floc de Al(OH)3 et accorde une
importance particulière à la série : Al6(OH)126+,12H2O; Al10(OH)228+ ,16H2O ;
Al10(OH)2412+ ,24 H2O et Al54(OH)14418+ ,36 H2O.
Hsu a observé que l’ion Al3+ n’est présent qu’à des pH très bas (pH<4). Au dessus de celui-ci, Al3+ est complexé. Au dessus du pH neutre, l’existence de ces complexes est remise en question par la formation d’alumines.
Recht et Ghassem [22] ont montré, toujours dans le cas de la déphosphoration par Al3+ que les réactions sont activées en moins d’une seconde et que le degré de dispersion des précipités et la turbidité résiduelle du surnageant après décantation et filtration sont très liée au pH.
La courbe de la figure 5 montre en particulier une diminution notable de la turbidité à pH 6 et de nouveau à partir du pH 8 à 10.
Figure 5 : Evolution de la turbidité d’une solution déphosphorée par Al3+ après filtration et après décantation en fonction du pH [22].
O O
Le pH étant un facteur prédominant dans la formation et la charge des espèces précipitées et dissoutes, on remarque qu'en milieu acide pH< 4.5 pour le Fer et pH < 7.5 pour l'Aluminium, l'espèce dissoute est positive. Les formes multinucléaires électropositives de Al [19] ont pour formule :Alx (OH)0.5x+2.5x
Parmi elles on trouve les différents polymères suivant le pH [27]. Al7 (OH)+++17 à pH > 5
Al8 (OH)+++20 à pH = 6 (Octomère)
Al6 (OH)+++15
Le dimère Al2(OH)2+++ est obtenu par un processus de polynucléation entre deux
monomères, le ligand pénétrant dans la couche de solvatation expulsant les molécules d'eau. Grohmann et al [24] donnent pour le Fer la structure suivante :
2[Fe(OH)5OH++] [(H2O)4 Fe Fe(H2O)4]4+ + H2O (7)
Plus les concentrations en métal et en OH- sont élevées plus le processus de
polynucléation est rapide, plus la solubilité des polymères est faible.
4.1.3. Hétéro coagulation :
L’hétéro coagulation est aussi une forme de coagulation par adsorption dans laquelle deux particules différentes avec des charges différentes ont une affinité mutuelle. Par exemple un précipité de Mg(OH)2 de charge positive pourra être attiré par SO2 de charge négative. Le
potentiel Zêta de ce dernier passe d’une valeur de –70 mV à 40 mV lors du mélange.
4.1.4. Coagulation par ajout d’adjuvants :
Dans le cas de suspensions trop diluées, les conditions cinétiques pour la coagulation sont défavorables car le nombre de charges étant trop réduit, le potentiel n’a plus de signification. On renforce alors la suspension à floculer par un colloïde négatif à grande surface appelé adjuvant afin de diminuer la dose de coagulant à employer qui augmente lorsque le nombre de particules à floculer diminue.
Les deux principaux adjuvants utilisés sont la bentonite et la silice activée. L’addition de ces dernières permet de se retrouver dans le cas de la coagulation par adsorption avec des doses économiques de Fer et d’Aluminium.
La silice activée a été découverte pour la première par Baylis (1936). C’est une silice colloïdale électronégative. Le noyau de SiO2 amorphe réagit par sa surface avec de l’eau pour
former H2SiO3 qui s’ionise en SiO3-. La silice activée améliore le mécanisme en créant des
macromolécules fibrillaires très négatives qui en font des amorces idéales analogues aux polyélectrolytes (utilisée à pH 7). Elle est associée à l’alumine à une dose de 1/20 de celle-ci.
4.1.5. Paramètres influençant la coagulation
On recherche particulièrement les formes multinucléaires positives pour favoriser la coagulation. Bien que l’Al et le Fe sont tous deux amphotères, on n'utilise guère leur forme négative. Le pH optimal est assez étroitement fixé à 7.2 pour l’Al, alors qu'il comporte une large plage, allant de 5.5 à 8.5, pour le Fe.
La présence de matière dissoute organique ou minérale a une grande influence sur la coagulation des particules. Fettig et al. [25] ont montré qu'une présence importante de substrats humiques dans les eaux domestiques peut gêner la coagulation et par la suite, la floculation. La force ionique du milieu ayant une forte influence sur le pH, a un effet sur la coagulation.
La température joue un rôle non négligeable, du fait de son impact à la fois sur le pH et la solubilité (figure 6).
On constate que la température modifie le comportement de l'Aluminium (dissout) et peut donc avoir un effet sur sa concertation résiduelle dans l'eau traitée.
Les doses de coagulants sont toujours supérieures aux solubilités des hydroxydes. Dans le cas de M2 (SO4)3, xH2Oces dosesvarient de 5 à 200mg/l alors que les valeurs de
solubilités sont beaucoup plus petites.
4.1.6. Mode d’action des coagulants sur la matière organique :
Généralement les coagulants sont plus efficaces pour éliminer les composés hydrophobes (ex : acides humiques et fulviques, protéines, hydrocarbones) que les composés hydrophiles (sucre, polysaccharides, acides aminés) ; Ils éliminent aussi plus facilement les composés organiques de haut poids moléculaires plutôt que ceux à bas poids moléculaires (Edzwald [26]). En ce qui concerne la fraction dissoute et colloïdale Zuckerman et Molof [27] ont suivi la l’évolution de la DCO de la fraction organique inférieure à 0,45 m, soit celle de la fraction colloïdale soluble et ceci par traitements physico-chimiques à la chaux d’eaux usées urbaines. Ils ont montré que les molécules à haut poids moléculaires, sont soit éliminées, soit hydrolysées en plus petites molécules organiques. Ceci confirme les hypothèses selon lesquelles l’addition de coagulants pourrait permettre de casser ou d’hydrolyser les molécules organiques de haut poids moléculaires. Elles sont, soit éliminées par adsorption sur les flocs, soit hydrolysées en plus petit poids moléculaire.
Les ions organiques monovalents comme certains colorants et les alcaloïdes, subissent en particulier une adsorption importante qui leur confère une action floculante. Mais ces cas d’exception se manifestent surtout lorsqu’interviennent des facteurs susceptibles d’influencer les compositions chimiques des colloïdes. Ainsi, lorsque les ions ajoutés réagissent chimiquement avec les ions de la double couche pour former un composé insoluble, le seuil de floculation s’abaisse fortement.
Si l’on compare l’action floculante des ions de même valence, on constate qu’elle augmente dans l’ordre inverse du degré d’hydratation des ions. Dans les séries des sels à anion commun, le premier floculant est celui à plus grand poids atomique. En ce qui concerne les ions halogénures, leur pouvoir floculant augmente de Cl- à I- vis à vis des sols positifs d’oxyde d’Al ou Fe, mais décroît dans le même ordre par rapport aux sols négatifs.
Il existe un cas extrême présenté par certains détergents ioniques où l’adsorption l’emporte sur la répulsion électrostatique, ce qui entraîne une stabilisation du sol plutôt que sa floculation.
La présence de non électrolytes, comme les alcools, les éthers, les phénols augmente généralement la sensibilité des sols aux électrolytes, d’autant plus que leurs chaînes hydrocarbonées sont plus longues. Leur adsorption à la surface des colloïdes, donnerait naissance à une couche de constante diélectrique plus faible, il en résulte une répulsion entre les ions de l’électrolyte adsorbés suivie d’une désorption, d’un abaissement de la charge électrique et d’une perte de stabilité du sol.
Finalement, on peut dire que la floculation d’un sol résulte d’une interaction entre les doubles couches électriques de 2 agrégats moléculaires au moment ou les sphères ioniques s’interpénètrent, il y a, alors, compensation des charges électriques modifiant l’état des doubles couches et entraînant l’instabilité du système.
5. Floculation :
Un autre exemple de la coagulation par adsorption est la floculation ou l'adsorption par addition d'un poly électrolyte ou d’une macromolécule. Les polyélectrolytes sont caractérisés par un poids moléculaire (PM) et une densité de charge (DC).
On distingue les poly anions, les poly cations et les non ioniques. Un poly cation se fixe facilement sur les particules naturelles qui sont en général chargées négativement. La fixation des poly anions sur ces particules nécessite l'apport d’un cation métallique. Eisenhauer et al[28]suggèrent un mécanisme illustré par les figures 8 et 9.
Figure 7: a) Action des polymères vis-à-vis des particules [19].
La déstabilisation est obtenue lorsque, prés de la moitié de la surface est occupée par des trains de polyanions plats et solides. Pour cela il faut un PM élevé et une DC faible, et ainsi qu’une affinité d’adsorption pas trop forte avec la particule.
Les non ioniques augmentent par le même mécanisme par un phénomène de pontage.
5.1. Différents types de floculants ou adjuvants de floculation :
Les floculants utilisés sont, comme nous l’avons vu précédemment, les sels d’Al3+ et de Fe3+, mais aussi les chlorures ferriques FeCl3 et FeClSO4, qui floculent à un pH compris
entre 4 et 11.
A.G. El Samrani et al [28] utilisent FeCl3 lors de leur étude par coagulation floculation
de l’épuration d’eaux usées ; des sulfates et des phosphates sont utilisées comme coagulants. Ils remarquent que les phosphates sont fortement complexés au fer(III) contrairement aux sulfates.
H.A Arafat [30] utilise, pour l’épuration des eaux de lavages des textiles, le chlorure ferrique, le sulfate ferreux additionnée de chaux, le sulfate d’Aluminium et le sulfate d’Aluminium additionné de chaux. Il constate que les sulfates d’Aluminium sont plus efficaces que les Fe Cl3.
Les doses de floculants utilisées varient de 20 à 200 mg/l d’après la valence de l’ion obéissant à la règle de Schulze-Hardy. L’alumine Al2(SO4)3 18 H2O (PM =666 g) reste le
floculant le plus utilisé.
La réaction suivante, permet d’obtenir Al(OH)3 au dépend de la dureté de l’eau lors
de la préparation d’eau potable par addition de sulfate d’Aluminium.
Al2(SO4)3 + 3 Ca(HCO3) 3 CaSO4 + 2 Al(OH)3 + 6 CO2 (8)
Le CO2 qui apparaît rend le milieu corrosif et acide. Il est préférable d’utiliser le
procédé AFLOC qui permet par une double coagulation d’éviter la formation de celui-ci en utilisant un coagulant alcalin Na2Al2O4 ultérieure à l’alumine.
Na2Al2O4 + 4 CO2 + 4H2O 2 NaHCO3 + 2 Al(OH)3 (9)
a. Les polychlorures d’Aluminium :
Dans le traitement des eaux, l’utilisation de l’ALUN est déficiente dans ses performances en eau froide car il nécessite un milieu alcalin. Des alternatives ont été recherchées du coté des composés d’Aluminium partiellement neutralisées. Ces derniers sont partiellement hydrolysés et ont pour formules brutes : (Al)a(OH)b(X)c
Quand X représente l’ion sulfates il s’agit des polyaluminium-sulfates ou PAS. Quand X est un chlorure on distingue des polyaluminium-chlorures ou PAC.
La préparation des polyaluminium-sulfates a lieu par neutralisation partielle du sulfate d’Aluminium jusqu’à un pH préférable de 3.8 avec des produits alcalin tels que la chaux, la soude caustique de carbonate de sodium ou l’hydroxyde d’ammonium.
Des travaux récents [31] effectués pour éviter la précipitation probable de ces solution d’alun basique après quelques jours, ont permis la mise au point d’un nouvel alun basique stabilisé par les silicates appelé PASS composé de polymère représenté selon la formule suivante : (Al)a(OH)b(SO4)c(SiOx)d.
Cette technique est aussi à l’origine de la synthétisation du WAC (Water Aluminium Chloride) des polymère comportant une certaine proportion de SO42- de formule
(Al)a(OH)b(SO4)c(Cl)3a-b-2C dont l’ utilisation se situe dans une gamme de pH allant de 6 à 7.5
(optimum 6.5).
Le PAC, dont a été inspiré notre synthèse, est un polychlorure basique dont la formule brute est Ala(OH)bCl3a-b dans laquelle b/3a est compris entre 0.45 et 0.6. Il se présente sous la
forme d’un liquide dont la teneur en Al2O3 est d’environ 10%. Associés à certaines argiles les
polychlorures d’Aluminium ont une grande efficacité d’adsorption.
Akitt et al. ont publié une méthode standard de synthèse d’un PAC où le rapport r(OH)/Al exprime le degré de basicité des PASS est des PAC. Le rapport r(Si)/Al exprime quand à lui la proportion de Silicate dans les PASS.
D’autre polymères peuvent être utilisés tels que :
Les polymères naturels à base d’amidon, ils sont d’autant plus actifs qu’ils sont riches en esters mono phosphoryles (pomme de terre, tapioca, mais) ;
Les polymères synthétiques. Ils sont préparés à tout Poids Moléculaire (PM) . Les molécules formées peuvent en toute Densité de Charge (DC) porter jusqu’à 120000 groupes actifs sur une longueur de 40 m.
b. Les argiles :
Les argiles sont caractérisés par la finesse de la particule (< quelques µm) qui leur confère des propriétés dites colloïdales.
Ces propriétés sont :
la charge et la structure
Les argiles sont caractérisées de par leur structure, par une très grande surface spécifique permettant une grande capacité d’adsorption. Les ions minéraux, les molécules organiques et les molécules d’eau peuvent ainsi s’y insérer en quantités parfois importantes (hydratation). Ces propriétés sont quantifiées par un paramètre appelé Capacité d’Echange Cationique (CEC).
Grâce à la présence des charges électriques, elles possèdent la possibilité de fixation et d’échange ionique et des propriétés de floculation et de dispersion.
Les argiles sont constituées de lamelles très fines de petites dimensions à contours irréguliers. La montmorillonite par exemple est constituée de 3 couches avec une grande proportion de silicium.
La structure cristalline d’un minéral idéal, sans substitution, serait caractérisée par l’électroneutralité. Toute interruption du réseau cristallin sur les faces de l’argile fera apparaître des valences non satisfaites ou liaisons rompues en bordure des feuillets. Les sites (Si-O, Al-OH, Al-O) correspondant aux liaisons rompues sont caractérisés par la présence d’hydroxydes amphotères résultant de la conversion des liaisons rompues par hydratation de la surface, lors de l’immersion du minéral dans l’eau.
Lorsque le pH varie, les hydroxydes amphotères peuvent donner soit des charges positives ou négatives selon les réactions qui peuvent avoir lieu et qui dépendent de la nature du milieu.
En milieu acide du fait de l’action des ions H3O+ les particules se chargent positivement.
La réaction ci-dessous a lieu :
SOH (Surface) + H3O+ SOH2+ +H2O (19)
En milieu basique sous l’action des OH- les particules se chargent négativement : SOH (Surface) + OH- SO- +H2O (20)
S : représentant le site cationique (Al3+, Si4+,…)
En l’absence d’ions spécifiquement adsorbables dans la solution, il existe une valeur de pH, pour laquelle la densité d’adsorption de H3O+ est égale à celle de OH-, c’est le Point de
Charge Nulle (PCN). Les activités de SOH2+ et SO- sont alors égales.
La connaissance du pH au point de charge nulle permet de déterminer les domaines de pH correspondant aux charges positives (pH < PCN) et négatives (pH > PCN) de la surface de SOH.
Les PCN des oxydes purs peuvent être déterminés expérimentalement soit par l’étude du potentiel électrocinétique en fonction du pH, soit par la différence de densité d’adsorption de H3O+ et OH- en fonction du pH.
Gallinari [32] a augmenté de façon significative l’efficacité de la séparation par flottation d’une solution de bentonite (65 à plus de 75%) en ajoutant un floculant (SC 581) au WAC. Le floculant augmenterait l’efficacité de la flottation en provoquant, d’une part, des pontages qui réunissent plusieurs flocs entre eux, accroissant de cette façon les dimensions moyennes des flocs, et d’autre part, en augmentant l’hydrophobicité des flocs.
B. Bouchikhi et al. [33] ont utilisé de la bentonite associée à un polyhydroxyaluminium (PHA1) pour traiter des eaux usées, riches en matière organique. L’association du (PHA1) et de la bentonite modifiée augmente l’espace entre les feuillets de celle-ci. Cette modification est due à une opération d’échange cationique qui lui donne une capacité plus grande d’adsorption, intéressante surtout vis-à-vis de grosses molécules organiques. Le traitement de ces eaux par PHA1 seul a donné 68.82%, par la bentonite seule 60.12% et la bentonite modifiée par PHA1 donne un taux supérieur à 72%.
Wen –Yan Sheng et al [34] utilisent le PACl en présence d’Al afin de réduire la turbidité des eaux de pluies.
Gerhard Furrer et al [35] montrent que l’utilisation de la montmorillonite intercalée par Al13 permet la complexation de métaux lourds comme Cu(II) et Cd(II) et réduit ainsi leur
solubilité dans les sols.
En effet, en dessous de pH 4, l’espèce présente en solution aqueuse est principalement Al(III) monomérique. Ces même auteurs montrent qu’à des concentrations de 10-5 mol/l à des pH de l’ordre de 5.4 à 6 plus de la moitié de Al(III) monomère est transformé en Al13O4(OH)24(H2O)127+ polynucléaire (appelé Al13). Si la neutralisation se poursuit à pH > 6
elle conduit à la déprotonation de Al13, à la précipitation [25] et à la formation de Al(OH)4-. A
des concentrations en Aluminium total élevées la formation de Al13 a lieu vers des pH plus
bas. Dans un sol acide, en présence de carbonaceous bedrock Al13 métastable peut se former
même en présence de Gibbsite [35] La surface du complexe Al13 est constituée de 12
AlO1/4(OH)4/2(H2O)0.54 unités chacune d’elle portant un ligand aqueux terminal. Le polymère
se comporte comme un acide polyprotique. La déprotonation des ligands terminaux montrent des caractéristiques de pontage similaires à celles des surfaces des hydroxydes d’Aluminium. Ludwig [26] a montré que la complexation de Cu(II) de concentration égale à 48 mole/l,
présence de Al13 d’immobiliser le Cu(II) complexé. L’addition de MgCl2 à Al13 montre une
remise en solution, comparée au cas Al13-montmorillonite seul.
Dong Sheni Wang et al [37] ont étudié l’effet de l’ion sulfate sur la coagulation en présence de polychlorures d’aluminium (PACl), grâce à une méthode optique et à la méthode conventionnelle du Jar-test et à des mesures de mobilité électrophorétique.
Ces auteurs ont étudié l’effet du pH et du rapport SO42-/ Al sur la coagulation. Ils ont
montré l’impact significatif du sulfate sur la coagulation du PACl, d’après la formation des produits d’hydrolyse formés, où la neutralisation et la précipitation jouent un rôle important dans le processus de coagulation. La vitesse de coagulation croît avec l’augmentation du rapport SO42-/Al, ceci pouvant être expliqué par l’effet de la neutralisation des charges au fur
et à mesure que l’adsorption et la complexation du sulfate augmente, contribuant, par ailleurs, à augmenter l’effet des collisions des particules. Plusieurs essais ont été entrepris à différentes valeurs du rapport OH /Al.
En absence de OH- et en présence des ions sulfates, avec principalement des monomères d’Al, la précipitation de l’hydroxyde tend à être accélérée par la présence du sulfate qui provoque la coagulation des espèces hydrolysées par effet électrostatique.. S. Kacha et al ont utilisé un polyhydroxyaluminium associé à une bentonite très fine, peu coûteuse pour éliminer 2 familles dei colorants utilisés dans l’industrie textile. La première est constituée de colorants acides : d’une part, le jaune supranol 464 et le vert Nylomine et la seconde de colorants dispersifs: le Rouge Foron RDGL et le Violet FORON S3RL. Ils montrent alors que la bentonite seule ou les sels d’aluminium seuls présentent des efficacités d’absorption insuffisantes, mais que l’association Bentonite–Aluminium (PHA1) permet d’éliminer la quasi totalité des colorants avec une excellente décanlabilité. La concentration d’Al3+ utilisée est de 13 mg/l et celle de bentonite de 250 mg/l sur des concentrations de colorants de 50 mg/l.
5.2. Détermination des seuils de floculation :
Le seuil de floculation est la concentration en électrolyte suffisante pour provoquer la floculation d’un sol déterminé. Elle permet de différencier l’action floculante de divers électrolytes.
La floculation des colloïdes positifs dépend principalement des anions et celles des colloïdes négatifs des cations, quant au pouvoir de précipitation des ions il est surtout fonction de leur valence.


![Figure 5 : Evolution de la turbidité d’une solution déphosphorée par Al 3+ après filtration et après décantation en fonction du pH [22]](https://thumb-eu.123doks.com/thumbv2/123doknet/2187644.11080/26.892.196.697.722.1056/figure-evolution-turbidite-solution-dephosphoree-filtration-decantation-fonction.webp)