THESE DE DOCTORAT
Présentée par Nabih ZERKI
Discipline : Chimie Physique
Spécialité : Chimie Physique Générale des Matériaux, Nano- Matériaux et Environnement
Titre
APPORT DE LA CHIMIOMETRIE POUR L’ANALYSE ET L’INTERPRETATION DE QUELQUES PARAMETRES
PHYSICO-CHIMIQUES INFLUENÇANT LA REPARTITION DES METAUX LOURDS, DES ELEMENTS NUTRITIFS ET DES ANIONS DANS LES
EAUX DE L’OUED DE BOUREGREG
Soutenue le 07/05/2013 devant le jury :
A. BOUHAOUSS : Professeur à la Faculté des Sciences de Rabat ………...……….... Président du jury
R. BCHITOU : Professeur à la Faculté des Sciences de Rabat ………. Directeur de thèse S. HACHIMI : Professeur à l’École Nationale de l'Industrie Minérale de Rabat...………...Examinateur
K. MARAKCHI : Professeur à la Faculté des Sciences de Rabat ……….…. Examinateur M. BOULMANE : Chercheur et Responsable du Laboratoire de Pédologie, (CRF) de Rabat…....Examinateur
Faculté des Sciences, 4 Avenue Ibn Battouta B.P. 1014 RP, Rabat – Maroc Tél +212 (0) 37 77 18 34/35/38, Fax: +212 (0) 37 77 42 61, http://www.fsr.ac.ma
RABAT
FSR Page 1 Les travaux présentés dans cette thèse ont été réalisés dans le Laboratoire de Chimie Physique Générale des Matériaux, Nanomatériaux et Environnement à la Faculté des Sciences de l’Université Mohammed V- Agdal à Rabat, dirigé par Monsieur le Professeur A. BOUHAOUSS.
Je tiens tout d’abord à exprimer mes remerciements les plus sincères à Madame R. BCHITOU Professeur à la Faculté des Sciences de Rabat, ma directrice de recherche, pour m’avoir conseillé, encouragé et soutenu tout au long de la thèse avec patience et disponibilité, et pour la confiance qu’elle m’a accordé.
Je tiens aussi à remercier Monsieur le Professeur A. BOUHAOUSS, pour m’avoir accueilli au sein du laboratoire CPGMNE pour réaliser ce travail et de m’avoir fait l’honneur de présider le jury de cette thèse et pour ses précieux conseils et ses discussions scientifiques intéressantes dans le suivi et la réalisation de mes travaux de recherche.
Mes remerciements s’adressent à Madame K. MARAKCHI, Professeur à la Faculté des Sciences de Rabat, pour avoir accepté d’examiner mon document de thèse et d’avoir apporté son regard sur mon travail.
Je tiens à remercier Monsieur S. HACHIMI, Professeur à l’École Nationale de l'Industrie Minérale de Rabat, d’avoir aimablement accepté d’examiner et de faire partie du jury de cette thèse malgré tous ses engagements et ses nombreuses occupations.
Je suis sensible à l’honneur que me fait Monsieur M. Boulmane, Responsable du laboratoire de pédologie de Centre de Recherche Forestière de Rabat (CRF), en acceptant d’être parmi le jury de cette thèse. Qu’il trouve ici l’expression de ma respectueuse gratitude.
FSR Page 2 travail.
Mes remerciements vont également aux enseignants-chercheurs et mes collègues du Laboratoire de Chimie Physique Générale, Matériaux, Nanomatériaux et Environnement de la Faculté des Sciences de Rabat, qui m’ont aidé directement ou indirectement à réaliser ce travail, en particulier : F. MOHAMMED, K. ACHELHI.
Enfin, merci à toutes les personnes qui ont contribué, de près ou de loin, à la réalisation de ce travail.
FSR Page 3
Je dédie ce travail
A mes parents
Toutes les lettres ne sauraient trouver les mots qu’il Faut…
Tous les mots ne sauraient exprimer la gratitude, l’amour Le respect, la reconnaissance…
Aussi, c’est tout simplement que Je souhaite que Dieu vous préserve une longue vie.
A mes sœurs et mes frères
A eux tous, je souhaite un avenir plein de joie et de bonheur
A tous les membres de ma famille
A tous mes amis
FSR Page 4
Titre : Apport de la chimiométrie pour l’analyse et l’interprétation de quelques paramètres physico-chimiques influençant la répartition des métaux lourds, des éléments nutritifs et des anions dans les eaux de l’Oued de Bouregreg
PRENOM ET NOM : Nabih ZERKI
SPECIALITE : Chimie Physique Générale des Matériaux, Nanomatériaux et Environnement
L’objectif de ce travail est de déterminer, en premier temps la répartition de quelques métaux lourds et éléments nutritifs en deux groupes de sites, en amont (S1i) et en aval (S2i), pour caractériser le degré de pollution de l’Oued Bouregreg. Pour cela plusieurs prélèvements ont été réalisés en amont et en aval de ce fleuve pour analyser les teneurs en métaux lourds (Cr, Cd, Hg et Pb) et en éléments nutritifs (P, N) dans l’eau et le sédiment correspondant. En effet, l’étude de la variation des paramètres physico-chimiques tels que la température de l’eau, la conductivité et le pH a montré une grande importance de la répartition des métaux lourds et éléments nutritifs étudiés. Afin d'évaluer le potentiel de l'ICP-AES dans le domaine des eaux naturelles, la caractérisation physico-chimique surtout celle liée aux métaux lourds s’est avérée nécessaire. Dans le but d’interpréter ces données analytiques et d’extrapoler des informations résultantes et nécessaires sur la pollution de l’Oued Bouregreg en particulier le moyen Bouregreg, nous avons utilisé une méthode d’analyse multidimensionnelle statistique, qui est l’analyse en composantes principales (ACP).
En deuxième temps, la détermination de l’effet des anions chlorures (Cl-), sulfates (SO42-), hydrogénocarbonates (HCO3-) et les nitrates (NO3-) sur la conductivité de trois types
d’eaux (eau ultra pure, eau naturelle de Bouregreg, eau usée) simultanément a été réalisée en utilisant la méthode de l’ACP. Les résultats de cette méthode ont montré les différentes corrélations entre la conductivité des anions dans les différentes eaux. Par ailleurs, l'application de la méthode des plans d'expériences, en s’appuyant principalement sur la modélisation et l’optimisation, a permis de déterminer les modèles mathématiques de la conductivité en fonction de ces quatre facteurs dans les trois types d’eaux afin de déterminer les différents optimums.
Mots-clés: Eaux, Métaux lourds, Anions, Corrélation, Modélisation, Optimisation, ACP, ICP-AES, Oued Bouregreg.
FSR Page 5 PUBLICATIONS
N. Zerki*, R. Bchitou, A. Bouhaouss, (2011), Characterization of some trace elements in natural waters of the Bouregreg estuary (Rabat, Morocco) by a chemometric study, Physical
and Chemical News, 59, 121-126.
N. Zerki*, A. Bouhaouss, R. Bchitou, (2012), Modeling and optimization the effect of some anions on the water conductivity, Australian Journal of Basic and Applied Sciences, 6(10):
396-402.
COMMUNICATIONS ORALES
N. Zerki, R. Bchitou, A. Bouhaouss Traitement et épuration des eaux
1ère édition de la journée des doctorants (J-DOC 2010)
Faculté des Sciences de Rabat, Université Mohammed V-Agdal, (31 Décembre 2010)
N. Zerki, R. Bchitou, A. Bouhaouss
Etude et modélisation de la qualité des eaux naturelles de l'estuaire de bouregreg
1er Workshop Marocco-Tunisien, Traitement et valorisation des eaux usées et des déchets organiques biodégradables
Faculté des Sciences Ain-Chock, Casablanca Université Hassan II. Maroc (21-23 Mars 2011)
N. Zerki, R. Bchitou, A. Bouhaouss
Caractérisation de quelques éléments traces dans les eaux et les sédiments de la vallée de bouregrag (Rabat, Maroc)
10ème édition de la Semaine Nationale de la Science, Sciences et développement durable au quotidien, Rabat (23 au 28 avril 2012)
N. Zerki, R. Bchitou, A. Bouhaouss
Caractérisation de quelques métaux lourds et éléments nutritifs dans les eaux naturelles de l'Oued Bouregreg par la méthode de l’ACP
Quatrième Conférence Sur les Techniques Analytiques Nucléaires et Conventionnelles et leurs Applications, Institut Agronomique et Vétérinaire Hassan II, Rabat, (22 et 23 Octobre 2012) (TANCA)
COMMUNICATIONS AFFICHEES
N. Zerki, R. Bchitou, A. Bouhaouss, F. Mohammed, G. Mouhcine
Apport de la chimiométrie à l’interprétation des données de la spectroscopie atomique ICP-AES : caractérisation des métaux lourds dans les eaux destinées à l’alimentation humaine.
4ème Rencontre Internationale sur l’Analyse & la Chimiométrie (RENACQ-4) Faculté des Sciences et Techniques Béni Mellal (12 et 13 Mars 2010)
N. Zerki, R. Bchitou, A. Bouhaouss and F. Mohammed
Characterization of the load metallic in natural waters of Rabat by a chemometric study
First African European Conference on Chemometrics
Data modelling in biological sciences and industrial processing
FSR Page 6
Modeling and optimization the effect of some anions on the water conductivity
First African European Conference on Chemometrics
Data modelling in biological sciences and industrial processing
Mining School of Rabat, Rabat, Morocco, (20th to 24th of September 2010)
N. Zerki, R. Bchitou, A. Bouhaouss
Optimisation des données analytique des eaux ultrapure, potable et usée
1er Workshop Marocco-Tunisien, Traitement et valorisation des eaux usées et des déchets organiques biodégradables
Faculté des Sciences Ain-Chock, Casablanca Université Hassan II. Maroc (21-23 Mars 2011)
N. Zerki, R. Bchitou, A. Bouhaouss
Caractérisation de quelques éléments traces dans les eaux et les sédiments de la vallée de Bouregreg (Rabat, Maroc)
2ème Colloque International sur Chimie, Environnement et Développement Durable Faculté des Sciences de Rabat (20 et 21 Octobre 2011)
N. Zerki, R. Bchitou, A. Bouhaouss
Caractérisation de quelques éléments traces dans les eaux et les sédiments de la vallée de Bouregreg
Journées Internationales, Substances Naturelles et Développement Durable, Faculté des Sciences - Rabat (22 et 23 Juin 2012)
N. Zerki, R. Bchitou, A. Bouhaouss
Modélisation et optimisation de la conductivité des eaux naturelles de l'Oued Bouregreg (Rabat, Maroc) en fonction de quelques anions (Cl-, SO42-, HCO3- et NO3-)
1èr Colloque international REZAS12, Ressources en eau dans les zones arides et semi-arides. Enjeux et perspectives. Cas du continent africain,
FSR Page 7
SOMMAIRE
SOMMAIRE ... 7
INTRODUCTION ... 11
PARTIE I ... 16
Chapitre I : SYNTHESE BIBLIOGRAPHIQUE ... 17
I -1- Différents types d’eau pour la consommation humaine ... 18
I -1-1 - Les eaux naturelles ... 18
I -1-1 -1- Les eaux souterraines ... 19
I -1 -1-2- Les eaux de surface ... 21
I -1-1 -3- Les eaux de mer ... 21
I-2 – Répartition de l’azote et du phosphore dans l’environnement... 22
I-2 -1- Le phosphore dans l’environnement ... 22
I-2-1-1- Cycle global du phosphore ... 23
I-2-1-2- Le phosphore dans les milieux aquatiques ... 24
I-2-2- L’azote dans l’environnement ... 26
I-2-2-1- Formes d’azote dans l’eau ... 27
I-2-3- L’eutrophisation ... 28
I-3 - Pollution des eaux ... 29
I-3-1 Substances polluantes de l’eau ... 29
I-3-2- Consommation de l’eau au Maroc ... 29
I-3-3- Rejets liquides des unités industrielles marocaines ... 30
I-3-4- Pollution des eaux par l’utilisation des engrais et pesticides ... 31
I-4- Généralités sur les polluants métalliques ... 32
I-4-1- Les métaux dans l’environnement ... 33
I-4-2-Transfert des métaux lourds dans l’eau ... 34
I-4-3- Remobilisation des métaux lourds à partir des sédiments ... 35
I-4-4- Présentation des métaux lourds analysés ... 35
I-5- Etude de la conductivité ... 38
I-5-1- Identification de quelques anions indicateurs de la composition minérale ... 41
I-5-1-1- Chlorures ... 41
I-5-1-2- Sulfates... 41
FSR Page 8
I-6- Généralités sur la chimiométrie ... 43
I-6-1- Analyse de données et méthodes chimiométriques ... 43
I-6-2- Méthodologie des plans d’expériences ... 45
PARTIE II ... 47
CHAPITRE II : CARACTERISATION DES PARAMETRES PHYSICO-CHIMIQUES DE L'ESTUAIRE DU BOUREGREG ... 48
II-1- L’estuaire du Bouregreg ... 49
II-2 - Etude des variations des paramètres physico-chimiques ... 53
II-2 -1- Paramètres physico-chimiques ... 54
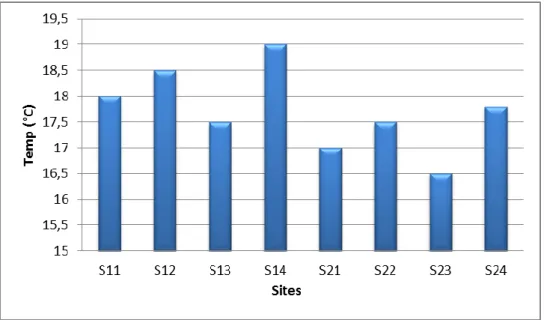
II-2-1-1- Variation de la température ... 54
II-2-1-1-2- Variation de la conductivité ... 56
II-2-1-1-3- Variation du pH (Potentiel Hydrogène)... 57
II-3- Conclusion ... 60
CHAPITRE III : REPARTITION DES ELEMENTS NUTRITIFS ET DES METAUX LOURDS ENTRE LES SEDIMENTS ET LES EAUX DE L’ESTUAIRE DE BOUREGREG ... 61
III-1- Choix des éléments nutritifs et les métaux lourds ... 62
III-2- Traitement des échantillons ... 62
III-3- Analyse chimique des échantillons ... 63
III-3-1- Utilisation de la méthode ICP-AES ... 63
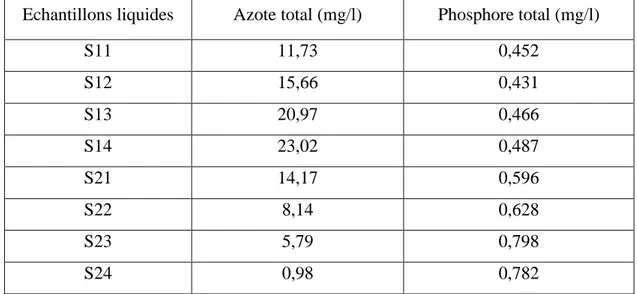
III-4- Variation des teneurs en azote et phosphore dans l’eau et les sédiments de Bouregreg... 63
III-4-1- Variation des teneurs en azote total et en phosphore total dans l’eau naturelle ... 64
III-4-1-1- Variation de la teneur en azote total dans les eaux ... 64
III-4-1-2- Variation de la teneur en phosphore total dans les eaux ... 65
III-4-2- Variation de la teneur en phosphore total dans les sédiments ... 66
III-5- Variation des teneurs en métaux lourds dans l’eau et les sédiments ... 68
III-5-1- Variation des teneurs en métaux lourds dans l’eau naturelle ... 69
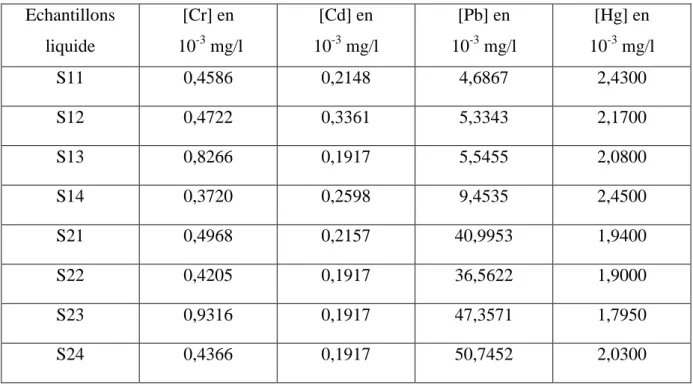
III-5-1-1- Variation de la teneur en chrome dans les eaux ... 69
III-5-1-2- Variation de la teneur en cadmium dans les eaux ... 70
III-5-1-3- Variation de la teneur en mercure dans les eaux ... 72
III-5-1-4- Variation de la teneur en plomb dans les eaux ... 73
III-5-2- Variation des teneurs en métaux lourds dans les sédiments ... 73
III-5-2-1- Variation de la teneur en chrome dans les sédiments ... 74
III-5-2-2- Variation de la teneur en cadmium dans les sédiments ... 75
FSR Page 9
III-5-2-4- Variation de la teneur en mercure dans les sédiments ... 77
III-6- Traitement statistique des résultats ... 77
III-6-1- Traitement des données ... 77
III-6-2- Résultats et discussions ... 79
III-7- Conclusion... 83
PARTIE III ... 85
CHAPITRE IV : VARIATION DE L’EFFET DE QUELQUES ANIONS SUR LA CONDUCTIVITE DE L’EAU ULTRA PURE ... 86
IV-1-Effet des chlorures sur la conductivité ... 87
IV-1-1- Protocole expérimental ... 87
IV-2- Effet des sulfates sur la conductivité ... 90
IV-2-1- Protocole expérimental ... 91
IV-3- Effet des hydrogénocarbonates sur la conductivité ... 93
IV-3-1-Protocole expérimental ... 94
IV-4- Effet des nitrates sur la conductivité ... 96
IV-4-1- Protocole expérimental ... 96
IV-5- Conclusion ... 98
CHPITRE V : MODELISATION ET OPTIMISATION DE LA CONDUCTIVITE D’EAU EN FONCTION DE QUELQUES ANIONS ... 100
V-1- Etude de la corrélation entre les anions à différentes concentrations dans les trois eaux étudiées ... 101
V-1-1- Conditions expérimentales ... 102
V-1-2- Résultats et discussions ... 105
V-2- Modélisation et optimisation de la conductivité d’eau Ultra pure ... 106
V-2-1- Modélisation de la conductivité d’eau Ultra pure ... 106
V-2-1-1- Choix du plan ... 106
V-2-1-2- Domaine expérimental ... 107
V-2-1-3- Résultats expérimentaux... 109
V-2-1-4- Interprétation des résultats ... 110
V-2-2- Optimisation de la conductivité d’eau ultra pure ... 112
V-2-2-1- Optimisation de la teneur en chlorures et la teneur en sulfates ... 112
V-2-2-2- Optimisation de la teneur en chlorures et la teneur en hydrogénocarbonates ... 113
V-2-2-3- Optimisation de la teneur en sulfates et la teneur en hydrogénocarbonates ... 114
V-3- Modélisation et optimisation de la conductivité d’eau naturelle de Bouregreg ... 115
FSR Page 10
V-3-1-2- Résultats expérimentaux... 116
V-3-1-3- Interprétation des résultats ... 117
V-3-2- Optimisation de la conductivité d’eau naturelle de Bouregreg ... 119
V-3-2-1- Optimisation de la teneur en chlorures et la teneur en sulfates ... 120
V-3-2-2- Optimisation de la teneur en chlorures et la teneur en hydrogénocarbonates ... 121
V-3-2-3- Optimisation de la teneur en sulfates et la teneur en hydrogénocarbonates ... 121
V-4- Modélisation et optimisation de la conductivité d’eau usée ... 122
V-4-1- Modélisation de la conductivité d’eau usée ... 122
V-4-1-1- Protocole expérimental ... 122
V-4-1-2- Résultats expérimentaux... 123
V-4-1-3- Interprétation des résultats ... 124
V-4-2- Optimisation de la conductivité d’eau usée ... 126
V-4-2-1- Optimisation de la teneur en chlorures et la teneur en sulfates ... 126
V-4-2-2- Optimisation de la teneur en chlorures et la teneur en hydrogénocarbonates ... 127
V-4-2-3- Optimisation de la teneur en sulfates et la teneur en hydrogénocarbonates ... 128
V-5- Domaine optimum des anions étudiés ... 129
V-6- Conclusion ... 130
CONCLUSIONS GENERALES ... 132
REFERENCES BIBLIOGRAPHIQUES ... 137
FSR Page 11
FSR Page 12 des activités industrielles et agricoles ainsi qu’à une augmentation rapide de la population et la croissance du niveau de vie. Ces activités ont introduit dans les hydrosystèmes (estuaires, nappes souterraines, cours d’eau, lacs, lagunes, océans…) des substances polluantes qui ont des répercussions néfastes sur l’environnement et par suite sur la santé humaine. En effet, quelques produits chimiques peuvent être à l’origine de la disparition de certaines espèces animales et/ou végétales et par conséquent, entraînent le dysfonctionnement de la chaîne trophique [1]. Parmi ces polluants, on trouve les métaux lourds qui peuvent être nocifs voire même mortels, quelques anions et quelques sels nutritifs tels que l’azote et le phosphore lorsqu’ils dépassent les seuils recommandés. A forte teneur, ces derniers accentuent le développement algal, l’eau étant alors privée d’oxygène, entraîne la mort des poissons et des autres formes de vie marine. Le Maroc n’échappe pas à cette réalité.
L’Oued Bouregreg principal cours d’eau traversant les deux villes Rabat et Salé et débouchant sur l’océan atlantique connaît depuis plusieurs années une dégradation notable causée par plusieurs facteurs. Parmi ces facteurs apparaissent :
- La construction de l’ensemble de complexes résidentiels, commerciaux et touristiques qui a bouleversé l’équilibre de l’Oued.
- Exploitation des carrières.
- Rejets des déchets spéciaux des poteries, gravats et produits de démolition.
- Rejets des eaux usées domestiques et industrielles (plusieurs émissaires d’égouts au sein de l’estuaire tels que le port, Oudaya, décharge d’Akreuch, la marina...).
FSR Page 13 L'ensemble de ces nuisances fait que la situation actuelle de la Vallée du Bouregreg est préoccupante à multiples égards.
Parmi les formes de pollution que connaissent les eaux de ce fleuve figurent le phénomène d’eutrophisation et la contamination par les métaux lourds (chrome, cadmium, mercure,…) qui résultent des différents rejets émis par les différents secteurs urbain, industriel et agricole d’une part, et des eaux de ruissellement d’autre part.
Toutefois, l’évaluation du degré de la pollution des rivières au moyen des seules analyses de l’eau, se heurte à de nombreux problèmes du fait de la variation rapide dans le temps et dans l’espace de la composition de l’eau. Ainsi, l’analyse de l’eau exige l’utilisation des techniques analytiques performantes et couteuses pour la détermination des substances chimiques polluantes dont les concentrations sont souvent proches ou dépassent les limites de détection [2].
Par ailleurs, plusieurs études ont montré que la majeure partie de ces métaux qui sont couramment déversés dans les milieux aquatiques, se retrouve toujours plus ou moins associée aux sédiments de fond et que sous l’influence des variations des propriétés physico-chimiques du milieu, ces métaux peuvent de nouveau repasser dans la phase aqueuse [3-5]. Certains travaux de recherches ont été entamés, soit dans le but de développer des outils et des modèles pour mieux cerner et quantifier cette pollution [3,6], soit de définir à l’aide de ces modèles, des procédés servant à réduire les teneurs en métaux à des niveaux acceptables [4,7,8].
A la suite de ces travaux, l’analyse et l’interprétation de quelques paramètres physico-chimiques influençant la répartition des métaux lourds, des éléments nutritifs et des anions dans les eaux de l’Oued de Bouregreg pour pouvoir déterminer des modèles d’optimisation de ces éléments nous ont
FSR Page 14 comportement physico-chimique du chrome, du plomb, du cadmium et du mercure et leur répartition entre l’eau et le sédiment correspondant.
La mise en œuvre de l’eau naturelle pour l’approvisionnement public en eau potable nécessite toujours un traitement physico-chimique, plus ou moins poussé. Après utilisation et lorsqu’elle est rejetée sans traitement préalable, l’eau contient évidemment des substances polluantes et d’autres éléments qui sont gênants surtout ceux qui touchent la composition minérale. Cette composition se détermine par la conductivité qui donne une indication de la minéralisation d’eau qui est fonction non seulement de la quantité d’ions présents mais également de leur charge spécifique, de leur mobilité ainsi que la température de l’eau.
Notre travail a eu donc pour but, en premier temps, d’étudier la répartition des éléments nutritifs qui sont le phosphore (P) et l’azote (N) et des métaux lourds : chrome (Cr), plomb (Pb), cadmium (Cd) et mercure (Hg) dans les eaux et les sédiments de l’estuaire Bouregreg en amont et en aval. Ceci a été réalisé en faisant une analyse spatio-temporelle à l’aide d’un traitement statistique des résultats analytiques recueillis qui a permis de caractériser les différentes corrélations entre les différents éléments analysés à l’interface eau-sédiment dans l’Oued Bouregreg afin d’établir un modèlede teneurs en ces éléments avec les meilleures conditions physico-chimiques. En deuxième temps, l’étude de corrélation de la conductivité entre les anions tels que Cl-, SO4
2-, HCO3
et NO3
-à différente concentration s’est avérée nécessaire pour modéliser et optimiser la conductivité dans trois types d’eaux : eau ultra pure, eau naturelle du Bouregreg et eau usée.
FSR Page 15 Notre étude comporte donc cinq chapitres:
Le premier chapitre présente une synthèse bibliographique rassemblant, dans un premier temps, les données essentielles sur les eaux destinées à la consommation humaine : les substances polluantes et les anions indicateurs de la composition minérale. Dans un deuxième temps, des généralités sur les méthodes chimiométriques.
Le deuxième chapitre est consacré à la caractérisation des paramètres physico-chimiques de l’estuaire de Bouregreg.
Le troisième chapitre concerne la répartition de quelques métaux lourds et éléments nutritifs dans les eaux naturelles de l'estuaire de Bouregreg d’une part et à l’étude de la corrélation de ces éléments entre la phase liquide et solide d’autre part.
Le quatrième chapitre explique la variation de l’effet de quelques anions sur la conductivité de l’eau.
Le cinquième chapitre est consacré à la détermination des différentes corrélations de la conductivité entre les anions étudiés à différentes concentrations, ainsi qu’à la modélisation et l’optimisation de la conductivité des eaux : ultra pure, naturelle du Bouregreg et usée.
FSR Page 16
FSR Page 17
CHAPITRE I :
FSR Page 18 Ce chapitre est consacré à la synthèse bibliographique où nous allons présenter en premier temps les différents types des eaux destinées à l’alimentation humaine, ainsi que les secteurs responsables de la pollution qui modifie la qualité de ces eaux. Cette qualité est en relation avec la teneur des éléments nutritifs et les métaux lourds qui représentent les principaux éléments utilisés surtout dans l’agriculture (les engrais, les pesticides...) et l’industrie. En deuxième temps, quelques généralités sur la conductivité et la détermination de la minéralisation globale à partir de cette grandeur dans l’eau naturelle sont données puis nous présentons les méthodes de planification expérimentale.
I-1 - Différents types d’eau pour la consommation humaine I-1 -1 - Les eaux naturelles
Les eaux destinées à la consommation humaine sont les eaux de distribution publique (eau du robinet), eaux conditionnées (les eaux de source, les eaux minérales naturelles et les eaux rendues potables par traitement), et les eaux de puits privés utilisées pour la boisson.
L'eau prélevée des milieux naturels n'est généralement pas utilisable directement pour la consommation humaine. Elle doit subir des traitements selon les exigences réglementaires de qualité en tous points du réseau, pour pouvoir être consommée sans danger par l'ensemble de la population.
Toutes les eaux de consommation n’ont pas la même composition chimique, puisqu’elles ne contiennent pas toutes les mêmes substances minérales considérées comme des paramètres spatio-temporels.
Avec l’accroissement de la population mondiale et le développement économique de la planète, la consommation d'eau a presque doublé au cours de ces cinquante dernières années [9].
FSR Page 19 Généralement, les réserves des eaux naturelles sont constituées des eaux de surfaces qui comprennent les eaux courantes des rivières et des canaux, des eaux de surfaces stagnantes ou plan d’eau (les lacs, retenues de barrages, étangs …) des eaux des mers et des océans et des eaux souterraines provenant de l’infiltration des eaux de pluie dans le sol qui constituent les nappes.
I -1 -1-1- Les eaux souterraines
Les eaux souterraines sont les eaux de sous-sol qui constituent une provision d'eau potable inestimable pour l'humanité.
Les eaux souterraines sont en interaction avec les autres types de masses d'eau, d'une part les eaux douces continentales (cours d'eau, zones humides, lacs…) et d'autre part avec les eaux marines en bordure littorale. Le sens de ces transferts peut varier au cours de l’année ainsi qu'en fonction des conditions hydrologiques. Elles assurent souvent le débit de base des systèmes d'eaux continentales superficielles et de ce fait influencent leur qualité. En d'autres termes, les effets de l'activité humaine sur la qualité des eaux souterraines et les débits des nappes peuvent se répercuter sur la pérennité et la qualité écologique des écosystèmes aquatiques associés et des écosystèmes terrestres directement dépendants [10].
Les sources et les eaux souterraines sont traditionnellement les ressources en eau privilégiées pour l’eau potable, car plus à l’abri des pollutions que les eaux de surface [11].
La protection des eaux souterraines est devenue un objectif majeur dès les années 1970 [12]. Les eaux souterraines représentent près de 20% des ressources en eau mobilisables au Maroc et jouent un rôle important dans le développement socio-économique du pays [13].
FSR Page 20 En outre, les eaux souterraines assurent le débit de base des réseaux hydrographiques de surface, en alimentant ces réseaux tout au long de l'année. La figure I.1 représente la répartition du potentiel en eau souterraine au Maroc pour un total en eau de 4025 Mm3 [14].
Figure I.1 : Répartition du potentiel en eau souterraine au Maroc en Mm3
La composition et la qualité des eaux souterraines sont à l’origine liées à la nature géologique du terrain. Ils ont un impact direct sur celle des eaux de surface, ainsi que sur les écosystèmes aquatiques et terrestres associés.
Les eaux souterraines sont moins sensibles aux pollutions accidentelles [15], mais la croissance démographique et la modernisation de l’agriculture ainsi que le développement industriel entraînent un grand problème de détérioration de la qualité de cette source souterraine, déjà en quantité limitée.
Les eaux usées domestiques et industrielles souvent déversées directement dans les oueds, participent fortement au changement de la qualité des eaux souterraines [16].
FSR Page 21
I -1-1 -2- Les eaux de surface
Les eaux de surface (douce) sont l’eau qui coulent ou qui stagnent à la surface du sol (rivières, lacs, étangs, barrages,…). Elles ont pour origine, soit des nappes souterraines dont l’émergence constitue une source, soit les eaux de ruissellement. Leur composition chimique dépend de la nature des terrains rencontrés durant leur parcours [12].
Ces eaux sont le siège, dans la plus part des cas, d’un développement d’une vie microbienne à cause des déchets rejetés dedans et de l’importante surface de contact avec l’extérieur.
Les ressources en eau douce sont essentielles pour l’homme qui les sollicite fortement, notamment dans le cadre de ses activités agricoles [17]. Les estuaires sont des milieux de grande importance écologique et économique [18].
Au Maroc la qualité globale des eaux de surface observée durant l’année 2000-2001, a été bonne au niveau de 46 % des stations et moyenne au niveau de 9 %. Par contre, elle a été dégradée au niveau de 45 % des stations échantillonnées [19]. En général, les eaux de surface sont rarement potables sans aucun traitement.
I -1-1 -3- Les eaux de mer
Les mers sont les grandes masses d'eau salée qui recouvrent les deux-tiers de la surface du globe terrestre, et elles représentent près de 97,4 % de la capacité des grands réservoirs d'eau à la surface de la terre [20].
La teneur moyenne en sel varie en fonction de l’arrivée d’eau douce (pluies et fleuves), plus il y a d’eau douce, moins il y a de sel.
FSR Page 22 Le dessalement de l'eau de mer et celui des eaux saumâtres constitue, aux dernières années, la solution à la pénurie d'eau dans de nombreuses parties du monde. Cependant, le coût de dessalement demeure encore trop élevé.
Le Maroc a acquis une expérience réelle par la réalisation et l'exploitation de plusieurs unités de dessalement dans les provinces sahariennes depuis près d'une vingtaine d'années [21].
I-2-Répartition de l’azote et du phosphore dans l’environnement
La variation des teneurs en phosphore et en azote dans les eaux naturelles provient principalement du drainage des terres agricoles, de l’utilisation des détergents ainsi que des eaux usées provenant de déchets humains ou domestiques.
Toutefois, un excès de phosphore et d’azote peut provoquer des résultats indésirables, comme la prolifération des plantes dans les milieux aquatiques, une telle surabondance peut entraîner l’eutrophisation du milieu.
I-2-1- Le phosphore dans l’environnement
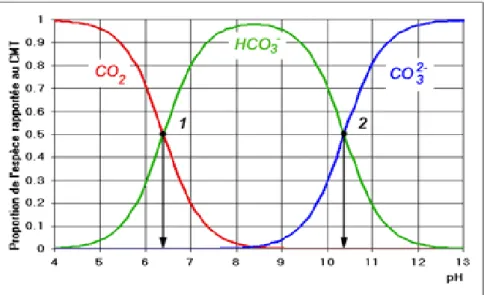
La lithosphère est la source ultime de tout le phosphore de la biosphère. Bien que l’apatite soit l’un des minéraux primaires les plus facilement altérés, le phosphore est parmi les minéraux les moins biodisponibles. Ceci est du au fait que les formes du phosphore dans la biosphère (différentes formes ioniques selon le pH : H2PO4 -, HPO4 2-, PO4
; complexes minéraux, dits occlus : Al-P, Fe-P, Ca-P, Si-P, et le phosphore organique) sont faiblement solubles, immobiles ou rendues inaccessibles pour d’autres raisons [22].
FSR Page 23
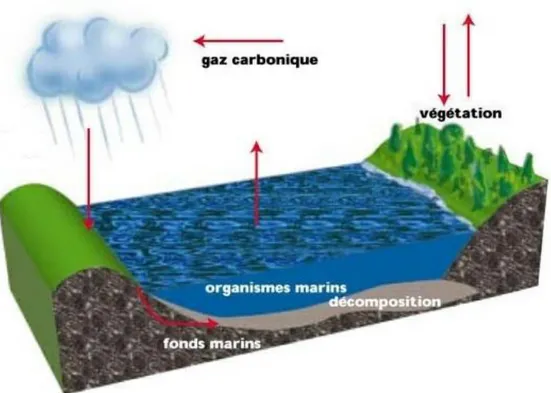
I-2-1-1- Cycle global du phosphore
Le cycle du phosphore (Schéma I.1) ne possède pas de composante gazeuse en quantité significative.Par conséquent, seul le phosphure d’hydrogène PH3 n’affecte pratiquement pas l’atmosphère.
Ce cycle est appelé cycle sédimentaire puisqu’il s’effectue principalement entre les océans et les continents.
Le phosphore est transformé dans les écosystèmes terrestres et aquatiques, en phosphore organique par le métabolisme des êtres vivants est ainsi absorbé par les plantes et transféré aux animaux par leur alimentation.
Une autre partie est transportée vers les océans où une fraction est utilisée par les organismes marins pour fabriquer leur squelette.
Une partie retourne aux sols à partir des excréments des animaux et de la matière organique morte.
Une autre fraction du phosphore se dépose au font de l’océan sous forme d’organismes morts ou de particules et est intégrée aux sédiments. Ces derniers sont transformés progressivement en roches sédimentaires par l’enfouissement ; et plus tard, ces roches sont ramenées à la surface par les mouvements tectoniques et le cycle recommence.
FSR Page 24 Schéma I.1 : Cycle simplifié du phosphore sur la terre et la mer
respectivement en 109t et 109 t/a (rapporté à P) [23].
Généralement, le phosphate total des sédiments se trouve sous forme de molécules qui se décomposent ou s’associent avec des acides [24]. Par conséquent, l’adsorption des phosphates sur les sédiments est influencée par la température, le pH, la nature de sédiment et sa granulométrie [25,26].
Ainsi, le pH, le potentiel rédox et la température sont les facteurs les plus importants à affecter la mobilisation du phosphore à partir des sédiments [27,28].
I-2-1-2- Le phosphore dans les milieux aquatiques
Le phosphore apporté aux milieux aquatiques peut, selon sa concentration et les caractéristiques du milieu, s’accumuler en quantité élevée dans les
FSR Page 25 sédiments [29]. En général, le phosphore dans l’eau est sous forme inorganique particulaire et soluble, et sous forme organique.
Le phosphore inorganique soluble présent en solution sous forme d’orthophosphate provenant de l’hydrolyse de l’acide phosphorique selon les réactions : H3PO4 + H2O H2PO4 + H3O + H2PO4- + H2O HPO42- + H3O+ HPO4 + H2O PO4 + H3O +
Le phosphore inorganique particulaire est constitué par l’apatite, la variscite, les oxydes de fer et d’aluminium et la calcite. Le phosphore organique est représenté par la matière organique animale et végétale (la faune et la flore) vivante dans le milieu aquatique [2].
Plusieurs études ont montré que, le phosphore total des sédiments se trouve lié sous forme de molécules phosphatées. Ces dernières se décomposent ou s’associent avec des acides [30] et que leur adsorption sur les sédiments se fait par des liaisons de type Van Der Waals par échange des ligands OH- des hydroxydes métalliques (FeOOH)n et (AlOOH)n [31], et elle est influencée par la température, le pH ainsi que la nature du sédiment et sa granulométrie [32,33].
Par ailleurs, plusieurs recherches ont montré que le pH, la température et le potentiel-rédox sont les facteurs les plus importants qui agissent sur la mobilisation du phosphore à partir des sédiments [34-36].
FSR Page 26
I-2-2-L’azote dans l’environnement
L’azote (N) est l’un des éléments essentiels à la vie. C’est aussi l’élément le plus abondant dans l’atmosphère, l’hydrosphère et la biosphère du système terrestre [37].
Le cycle biogéochimique de l’azote décrit la succession des modifications subies par les différentes formes de l'azote qui sont : azote gazeux, nitrate, nitrite, ammoniac, azote organique dont le processus est formalisé comme suit :
la fixation d'azote gazeux (N2) : réduction enzymatique de N2 en azote ammoniacal, NH3 par des bactéries libres ou symbiotiques, selon la réaction :
2N2 (g) + 3(CH2O) + 3H2O 4NH3 + 3CO2
Dans les écosystèmes où le pH est élevé, l’ammonium se transforme en ammoniac gazeux :
NH
4 ++ OH
-NH
3(g) + H
2O
La nitrification : transformation d'ions ammonium/ammoniac en nitrites puis en nitrates par des bactéries dites nitrifiantes. La réaction en chaîne est de type: NH4 + NO2 NO3 -Soit: 2NH4 + + 3O2 2NO2 - + 2H2O + 4H + 2NO2 - + O2 2NO3
-FSR Page 27 La dénitrification : retour de l’azote à l’atmosphère sous sa forme moléculaire N2, avec comme produit secondaire du dioxyde de carbone
CO2 et de l’oxyde d’azote N2O, un gaz à effet de serre contribuent à
détruire la couche d’ozone dans la stratosphère. Il s’agit d’une réaction de réduction de NO3
par l’intermédiaire des bactéries transformant la matière organique. La réaction est de type :
4NO3 -
+ 5(CH2O) + 4H +
2N2(g) + 5CO2(g) + 7H2O
I-2-2-1- Formes d’azote dans l’eau
Le schéma ci-dessous présente le cycle global de l’azote dans l’environnement : Oxydation Oxydation Réduction Réduction
Schéma I.2 : le cycle de l’azote [2]
La forme d’azote dans les eaux de surface dépend de plusieurs facteurs qui sont : le pH, la concentration d’oxygène dissous et les communautés
- Décharges Electriques - Fabriques d’engrais NITRATES NO3 -NH3 Ammoniaque NH4+ AZOTE ATMOSPHERIQUE N2 Industrie Chimique NO2 -Nitrites
FSR Page 28 biologiques présentes. Toutes les formes d’azote libérées dans les eaux de surface peuvent se transformer en nitrates sous l’action des bactéries.
Des nitrates peuvent également aboutir directement dans les eaux de surface par les dépôts atmosphériques, le ruissellement superficiel et l’infiltration d’eau souterraine dans les cours d’eau et les lacs.
Une plus grande quantité d’azote (sous forme de nitrates) pénètre dans les eaux de surface beaucoup plus par des sources diffuses, comme les dépôts atmosphériques et le ruissellement des eaux agricoles et domestiques, que par des sources ponctuelles comme les effluents d’eaux usées municipales ou les rejets industriels.
Dans les eaux naturelles, on distingue la forme réduite correspondant à l’azote total de Kjeldahl (NTK) et la forme réduite qui correspond à NO3- et
NO2
[2].
I-2-3- L’eutrophisation
Le phénomène d’eutrophisation est dû à l’enrichissement du milieu aquatique en éléments nutritifs (nitrates, phosphates).
La présence de ces deux composants chimiques (azote et phosphore) dans les eaux naturelles, favorise la croissance des végétaux aquatiques entraînant une prolifération d'algues microscopiques, principalement dans la partie supérieure des eaux.
Le processus d’eutrophisation peut résulter des épandages agricoles (engrais riches en azote et phosphore), de l'accroissement des rejets industriels, urbains ou agricoles excessivement riches en nutriments et en matière organique [38].
Les algues se développent selon le processus de la photosynthèse durant le jour, par absorption opérée par la chlorophylle, de l'énergie lumineuse et solaire.
FSR Page 29 Les algues en se décomposant, consomment d'énormes quantités d'oxygène dissous dans l'eau.
I-3 - Pollution des eaux
I-3-1 Substances polluantes de l’eau
Les substances polluantes de l’eau sont celles qui la rendent impropre à la consommation ou qui dégradent certaines de ses propriétés [39]. Parmi ces composés, outre certains composés biologiquement dégradables comme les substances nutritives, on compte aussi de nombreux polluants difficilement voire pas dégradables, par exemple ceux qui contiennent des huiles minérales, des résidus de pesticides, des métaux ou des hydrocarbures halogénés. Dans le cas idéal, les déchets organiques se décomposent par autoépuration biologique jusqu'à minéralisation complète pour finir sous forme de substances inorganiques. D’autres polluants, introduits dans l’environnement par l’industrie, sont pratiquement réfractaires à toute forme de dégradation par voie biologique. Leur teneur augmente dans les eaux, les sédiments et les organismes aquatiques [40,41].
I-3-2- Consommation de l’eau au Maroc
D’après le ministère du commerce et de l’industrie (MCI), cinq secteurs industriels consomment une grande quantité d’eau évaluée à 1.1 milliards en m3 dont 81% est d’origine de l’eau de mer. Le reste (19%) est réparti en eau superficielle avec 14 %, l’eau potable avec 4% et l’eau de forage avec 1% [42].
L’industrie chimique et parachimique utilise plus d’un milliard de m3
, ce qui représente 97% du volume total. Cependant, les industries de textile et de
FSR Page 30 cuir consomment 11 millions de m3 dont 83% sont des eaux potables et 17% consommatrices d’eau. Cette quantité atteint 1,4 millions de m3
/an [42].
La production industrielle de la région de Rabat-Salé-Zemmour-Zaer, est moyenne (4,3%) et dominée par l’industrie du textile et du cuir [42].
I-3-3- Rejets liquides des unités industrielles marocaines
La pollution industrielle peut avoir un effet toxique sur les organismes vivants, ou causer l'accumulation de certains éléments dans la chaîne alimentaire (métaux, pesticides, radioactivité...).
Cette pollution touche les pays en développement les moins préoccupés et moins sensibilisés par les risques sanitaires [43].
Les rejets liquides industriels véhiculent une importante pollution organique et toxique. Il s’agit des différents déchets provenant des industries diverses qui sont principalement installées au niveau du rivage à la fois pour se débarrasser des déchets directement et pour faire refroidir leurs machines (industrie alimentaire, industrie agricole, tannerie et textile, papeterie, industrie chimique, industrie pétrochimie) [44]. Le tableau I.1 représente le flux de pollution industrielle en tonnes pour l’année 1993 et les prévisions pour l’année 2020.
Tableau I.1 : Flux de pollution industrielle (en tonnes) [45] 1993 2020
Matières oxydables 72000 220000 Azote total 3300 9000 Phosphore total 200 600 Chrome 110 1200
FSR Page 31 D’après le tableau I.1, on estime qu’en 2020, la pollution véhiculée par les rejets liquides industriels sera de l’ordre de 9000 tonnes d’azote et 600 tonnes de phosphore et 1200 tonnes de chrome.
L’impact des rejets industriels sur la qualité de l’eau est fonction de leur affinité avec l’oxygène, de la quantité de solides en suspension, et de leurs teneurs en substances organiques et inorganiques.
I-3-4- Pollution des eaux par l’utilisation des engrais et pesticides
De façon générale, l’agriculture est une grande consommatrice d’eau. Dans les conditions arides et semi arides, les exploitants agricoles sont amenés à utiliser différentes sources d’eaux pour l’arrosage de leurs cultures.
L’agriculture utilise également des quantités importantes de produits agrochimiques, comme des insecticides, des pesticides, des herbicides, des fongicides, des fertilisants et des produits vétérinaires [46], qui sont responsables du rejet de nombreux polluants organiques et inorganiques dans les eaux de surface et souterraines.
Ces contaminants comprennent à la fois des sédiments provenant de l’érosion des terres agricoles, des éléments nutritifs et des métaux lourds issus des déchets animaux et des engrais commerciaux.
L’utilisation des pesticides peut entraîner la présence de résidus dans les denrées végétales récoltées et dans les aliments d’origine animale mais également dans l’eau de distribution [47]. Ainsi pour les années 2003 et 2004, on a noté la présence des pesticides sur 96% des points de mesure des cours d’eau et 61% des points de mesure des eaux souterraines [48], avec des niveaux de contamination significatifs. La figure I.3 représente les mécanismes de transferts et de transformations des pesticides dans les milieux de l’environnement.
FSR Page 32 Figure I.3 : Mécanismes de transferts et de transformations des pesticides
dans les milieux de l’environnement [47].
I-4- Généralités sur les polluants métalliques
La contamination des eaux de surface et des sols par les métaux lourds croit de plus en plus avec le temps. Les métaux lourds ne sont pas biodégradables et la pollution de ces milieux est essentiellement liée à l'activité humaine. C’est un problème environnemental majeur et le traitement de ces effluents s’avère de plus en plus capitale et il est nécessaire de développer des techniques pour décontaminer les sites pollués. Les sources de pollution et les méthodes de traitement diffèrent selon la nature et l’origine de l’eau à traiter.
Aujourd’hui, les métaux lourds représentent un groupe d’éléments qui a simultanément un poids économique considérable, mais un potentiel polluant indéniable. Certains métaux et plus particulièrement ceux que l'on regroupe parmi les métaux lourds constituent une préoccupation majeure dans le domaine
FSR Page 33 de l'environnement. Ils sont toxiques même à faible concentration et ont la capacité de s'accumuler tout au long de la chaîne alimentaire. Parmi ces éléments, on peut distinguer les éléments traces comme le chrome (Cr), le plomb (Pb), le cadmium (Cd) et le mercure (Hg) [49-52]. Ces éléments sont présents en faibles concentrations dans l’environnement et l’augmentation de leur teneur résulte généralement des activités humaines. La majorité de ces éléments est toxique à forte concentration, mais certains d’entre eux sont très toxiques même lorsqu’ils sont en traces comme les ions Pb2+
et Cr6+ [53-56]. Par conséquent, il est recommandé de réduire ou d’éliminer totalement ces polluants des écosystèmes [57].
Afin de protéger la population humaine des effets de la contamination des milieux poreux et aquatiques par les métaux lourds, des seuils critiques à partir desquels des effets dangereux peuvent être observés ont été établis [58]. Cependant, la capacité des organismes à assimiler les métaux traces et la toxicité de ces derniers dépend des formes chimiques sous lesquelles se présentent ces métaux [59-61].
Différents solides poreux sont actuellement utilisés ou en phase de développement pour stabiliser des déchets provenant de diverses origines : cations métalliques, déchets nucléaires …
I-4-1- Les métaux dans l’environnement
Les processus d’érosion naturels sont des sources importantes de la délivrance des ions métalliques qui peuvent être transportés vers les eaux de surface. De plus, la production de déchets par l'ensemble des activités humaines est en augmentation constante.
La prise de conscience du problème des polluants minéraux dans les eaux destinées à la consommation humaine a conduit les pouvoirs publics à mettre en
FSR Page 34 place des législations de plus en plus sévères vis-à-vis des rejets d'origines diverses. Ces polluants minéraux sont essentiellement les métaux lourds dotés de propriétés chimiques particulières leur conférant une réelle toxicité aussi bien vis à vis de l'être humain qu'à l'égard des organismes vivants du règne animal et végétal.
I-4-2-Transfert des métaux lourds dans l’eau
La plus grande partie des métaux lourds dissous transportés par les systèmes aquatiques naturels est sous des conditions physicochimiques normales, fixée sur la matière en suspension sous l’effet du phénomène d'adsorption. Ces métaux immobilisés dans les sédiments n'y restent pas définitivement mais peuvent se retrouver en solution dans l'eau sous l’action d'un acide dans le milieu, par exemple.
A propos des teneurs métalliques dans la matière en suspension, des études ont montré une relation linéaire entre les teneurs en métaux lourds et la taille des particules pour des tailles inférieures à 16 μm dans des échantillons récoltés au même endroit. Il a été noté que, dans la plupart des rivières, l'équilibre ne peut être complètement établi entre les deux phases solide et aqueuse à cause de la courte durée d'existence des métaux en solution et que ces derniers peuvent s'éliminer progressivement de la phase aqueuse en fonction de la distance parcourue [63-65].
Ainsi, les chlorures (à l'exception de ceux d'Ag, Pb et Mg) et les sulfates de tous les métaux lourds sont rapidement solubles alors que les carbonates, hydroxydes et sulfates se dissolvent très difficilement. La solubilité varie avec la forme chimique considérée. En effet, les formes hydroxydes sont converties progressivement en des formes stables et inactives ; tandis que, les formes sulfures sont pratiquement insolubles à pH neutre. Pour les formes carbonates,
FSR Page 35 leur solubilité dépend de la pression partielle en CO2, exemple la solubilité du
carbonate de Pb (PbCO3) dans l'eau qui peut être augmentée par la présence du
gaz carbonique.
I-4-3- Remobilisation des métaux lourds à partir des sédiments
Les métaux lourds une fois associés aux sédiments, peuvent être relargués à la suite de certains changements chimique des milieux [66]. Il en est de même lors de l'augmentation de la teneur en sel, dans le milieu, ainsi les cations alcalins et alcalinoterreux peuvent être en compétition avec les métaux lourds liés aux particules solides.
Dans le cas des changements dans le potentiel Redox dus à la diminution de la quantité d'oxygène dissous, les hydroxydes de fer et de manganèse sont partiellement ou complètement dissous ainsi que les métaux lourds qui sont incorporées. Les métaux lourds peuvent être relargués à la suite d'une diminution de pH ce qui permet d'une part de remettre en solution les métaux précipités sous forme de carbonates ou d'hydroxydes et d'autre part d'augmenter la désorption des métaux liés aux particules solides.
Les bactéries peuvent également intervenir dans la remobilisation des métaux lourds à partir des sédiments. En effet, certaines bactéries sont capables de transporter le mercure contenu dans les sédiments par méthylation et de le remettre ainsi en solution [67].
I-4-4- Présentation des métaux lourds analysés
Les métaux lourds étudiés au cours de ce travail sont :
- Le Plomb : la forme la plus fréquente dans les milieux naturels est Pb2+, ses caractéristiques physico-chimiques le rapprochent des alcalino-terreux (Ca2+ et
FSR Page 36 Ba2+). Parmi les métaux lourds, le plomb a le plus grand rayon ionique (1.75 Å). Il n’est pas essentiel pour les organismes et sa présence à des taux élevés est toxique. Le plomb est connu pour entraver la fabrication de l’hémoglobine et modifier la composition du sang. Il agit également sur le système nerveux central et provoque le saturnisme. Il provient essentiellement du carburant, des batteries et de la peinture. A l’état naturel il se trouve dans la galène (PbS). Il peut être également rencontré sous la forme d’anglésite (PbSO4) et de cérusite
(PbCO3). La concentration en Pb dans la croûte terrestre est d’environ 17 mg/kg
[68], mais dans les zones urbaines et industrielles, elle se situe à des teneurs comprises entre 100 et 500 mg/kg [69]. Le Pb est généralement considéré comme étant fortement retenu dans les sols et donc peu mobile, en particulier en conditions réductrices [70]. Cet élément peut être associé aux sulfates et aux carbonates mais aussi aux argiles et à la matière organique suivant le pH. Cet élément a beaucoup d’affinités avec le cadmium Cd et le zinc Zn. Lors de l’altération de minéraux primaires, le Pb peut être fixé par des argiles comme la kaolinite [71].
- Le chrome : Il provient généralement des résidus de galvanoplastie, des tanneries, des raffineries et de l’industrie de textile [72]. Il est toxique surtout sous forme de Cr VI (chromate), il passe sous forme de Cr III (sels chromiques) en milieu naturel. Le Cr VI est mutagène et cancérogène [73]. Les quantités de chrome détectées dans les écosystèmes sont liées à des émissions d'origine industrielle. Les déchets contenant du chrome sont considérés comme des problématiques en raison de leur comportement dans les couches profondes du sol lorsqu'ils sont stockés dans des décharges. En milieu alcalin, on estime que la stabilité des chromates peut atteindre 50 ans, et qu'ils peuvent migrer vers les nappes aquifères, même au travers de sols cohérents. La combustion de boues contenant des composés chromiques cause la pollution atmosphérique et par la
FSR Page 37 suite affecte les milieux aquatiques via les précipitations. Dans les systèmes aquatiques, la toxicité des dérivés solubles du chrome varie en fonction de la température, du pH, de la dureté de l'eau et de la présence d’espèces bactériennes aquatiques. Les chromates ont une bonne solubilité dans l'eau, mais dans le milieu naturel, ils se transforment aisément en présence de matières organiques oxydables, en composés de chrome (III), lesquels sont relativement stables et de moindre hydrosolubilité.
- Mercure : Le mercure est un élément chalcophile de la troisième série de transition. Il possède trois degrés d’oxydation : 0, +I et +II et dans l’environnement, il est présent sous forme dissoute dans les eaux minérale et gazeuse. Dans la croûte terrestre, la concentration en Hg est de l’ordre de 50-150 μg/kg [74], principalement sous forme de minerai de sulfure de mercure HgS (cinabre). Il est souvent rencontré dans les zones supérieures des gisements de soufre, où il est le plus souvent associé à la marcassite (FeS2). Dans les sols et les sédiments, le Hg se concentre principalement dans la fraction fine en se liant avec les argiles, les hydroxydes de Fe ou la matière organique [75].
- Cadmium : Le cadmium est un élément chalcophile, ce qui favorise son association avec Zn et Hg et dans une moindre mesure avec Pb et Cu [76]. L’abondance naturelle de Cd dans l’écorce terrestre est de 0.11 mg/kg [68,76]. Le Cd possède 2 états de valence (0, +II), mais n’est présent dans les eaux naturelles que sous sa forme divalente. Près de 95 % du Cd transporté par les rivières serait sous forme particulaire et associé à des molécules d’hydratation et des carbonates [77,78]. Le cadmium naturel est présent à l’état de traces, il provient aussi des résidus de placage électronique et des engrais chimiques [79]. Le cadmium peut être transporté sur de longues distances lorsqu'il est absorbé par les boues. Ces boues riches en cadmium peuvent polluer aussi bien les eaux de surface que les sols [80].
FSR Page 38
I-5- Etude de la conductivité
La conductivité de l’eau est une mesure de sa capacité à conduire le courant électrique. L’unité de mesure communément utilisée est (µS/cm). Elle est directement proportionnelle à la quantité des sels minéraux dissous dans l’eau et constitués de cations et d'anions.
La mesure de la conductivité permet d'apprécier rapidement mais très approximativement la minéralisation de l’eau et de suivre son évolution. Comme la conductivité donne une indication sur la qualité d’eau et sa minéralisation globale, cette minéralisation est liée à la conductivité à 20°C comme il est indiqué sur le tableau I.2.
Tableau I.2 : Rapport entre la conductivité et la minéralisation [81]
Conductivité Minéralisation 0-100 μS/cm Minéralisation très faible 100-200 μS/cm Minéralisation faible
200-333 μS/cm Minéralisation moyenne accentuée 333-666 μS/cm Minéralisation accentuée
666-1000 μS/cm Minéralisation importante > 1000 μS/cm Minéralisation élevée
En effet, comme le montre ce tableau, la conductivité augmente avec la minéralisation à une température bien déterminée.
En outre, la minéralisation de la plupart des eaux est dominée par les ions majeurs, qui sont : le calcium, le magnésium, le sodium, le potassium, le chlorure, les sulfates, les nitrates et les hydrogénocarbonates.
FSR Page 39 Toutefois, la détermination de la teneur de ces ions dans l’eau directement à partir de la conductivité semble complexe vu la forte variation de la teneur en ces ions.
La conductivité électrique, en tant que paramètre brut, mesure la concentration en ions d’une solution. Plus il y a de sels, d’acides ou de bases dissociés dans une solution, plus sa conductivité est élevée. Dans l’eau, il s’agit surtout d’ions de sels dissous. La conductivité exprime ainsi la charge en sels de l’eau ou le degré de pureté d’une eau.
La conductivité est le produit de la conductance de la solution par la constante géométrique de la cellule de mesure. Pour les solutions aqueuses l’échelle commence avec une conductivité de 0,05 μS/cm (25 °C) pour l’eau la plus pure. La conductivité des eaux naturelles comme les eaux potables ou des eaux superficielles est comprise dans la plage 100 - 1000 μS/cm. En haut de l’échelle de la figure I.4, on trouve certains acides et bases [82].
FSR Page 40 Figure I.4 : Plage de conductivité de solutions aqueuses [82].
La conductivité varie en fonction de la température [83]. Elle est reliée à la concentration et à la nature des substances dissoutes. En général, les sels minéraux sont de bons conducteurs, par opposition à la matière organique et colloïdale, qui conduisent peu.
La conductivité est un paramètre dont on ne peut plus se passer enanalyse moderne des eaux et permet d'évaluer rapidement le degré de minéralisation d'une eau et d'estimer le volume d'échantillon nécessaire pour certaines déterminations chimiques.
FSR Page 41
I-5-1- Identification de quelques anions indicateurs de la composition minérale
I-5-1-1- Chlorures
Généralement, les chlorures servent à désinfecter l’eau, la valeur directive est limitée à 750 mg/L [84]. Pour des concentrations supérieures à cette valeur, le chlorure donne un mauvais goût à l'eau et aux boissons préparées à partir d'eau. La présence de cet ion dans les eaux naturelles est due soit au lessivage des roches et des sols sédimentaires, soit à la désinfection des eaux domestiques et des procédés industriels qui emploient le chlore comme agent de blanchissement, des agents de nettoyage domestique et du sel répandu sur les routes en hiver.
I-5-1-2- Sulfates
Les ions sulfates proviennent de la dissolution du gypse (CaSO4, 2H2O)
et par l’oxydation des sulfures en sulfates dans les déchets miniers. Les principales sources industrielles sont les effluents des tanneries, des ateliers de décapage métallique, des usines de textile et des fabriques de pâtes et papiers.
Les ions sulfates sont très solubles et leur concentration est très variable dans les eaux naturelles. La norme marocaine pour les sulfates est de 400 mg/L [84]. La présence de ces ions en quantité supérieure à 300 mg/L peut entraîner dans certaines conditions une attaque du béton et accélérer la corrosion du fer. Des teneurs limites en sulfates sont nécessaires pour certaines industries, ainsi des concentrations élevées en ces ions peuvent poser des problèmes en agriculture, pour l’irrigation et l’abreuvage. Une teneur supérieure à 480 mg/L rend l’eau impropre à l’agriculture.
FSR Page 42
I-5-1-3- Nitrates
Les nitrates sont les formes d’azote les plus solubles dans l’eau. Par conséquent, leurs concentrations varient selon les événements hydrologiques atteignant ou dépassant parfois leurs critères respectifs de qualité pour l’eau brute d’alimentation humaine [2].
La présence de ces ions dans une eau est un indicateur de la pollution de cette eau. Ces ions proviennent soit naturellement du sol, soit de la pollution par l’industrie chimique, des décharges électriques ou des engrais azotés.
Les eaux naturelles contiennent normalement des nitrates à des doses variant selon les saisons. Les concentrations de ces ions d’origine naturelle dans les eaux de surface et souterraines sont généralement de quelques milligrammes par litre. Dans de nombreuses eaux souterraines et de surfaces, on observe aujourd’hui une augmentation de la concentration de ces ions. La valeur maximale admissible en cet ion, d’après les normes marocaines relatives à la qualité des eaux d’alimentation humaine, est de 50 mg/L [84].
I-5-1-4- Hydrogénocarbonates
Une concentration trop élevée en carbonate de potassium dans l'eau est susceptible d'avoir une incidence négative mais réversible sur la potabilité de l'eau.
Les ions hydrogénocarbonates sont dosés pour connaitre leur effet dans la canalisation et les risques de corrosion du réseau de distribution qu’ils peuvent provoquer.
Les ions bicarbonates HCO3- et carbonates CO32- constituent le tampon
principal des systèmes d’eaux douces [85]. Ils permettent le rétablissement des conditions initiales en cas de pollution par des déversements acides [86].
FSR Page 43 Le matériel et les méthodes utilisées pour déterminer les paramètres physico-chimiques sont donnés en annexe I.
I-6- Généralités sur la chimiométrie
Néologisme apparu aux débuts des années 70, nous pouvons définir la Chimiométrie comme l’ensemble des méthodes mathématiques appliquées à la genèse, à la collecte et au traitement de l’information expérimentale, leur mise en œuvre étant rendue possible grâce à l’outil informatique [87]. Plusieurs études basées sur les techniques chimiométriques faites dans les domaines de chimie de l’environnement, l’écologie, le contrôle de qualité… [2,8,43,52,88-95].
I-6-1- Analyse de données et méthodes chimiométriques
L’ensemble des techniques d’analyse de données relevant de la chimiométrie est présenté d’une part par l’organigramme reporté en figure I.5, d’autres part par le tableau I.3 qui rassemble les techniques et les domaines d’applications correspondants.
FSR Page 44 Figure I.5 : Techniques d’analyse de données [87]
FSR Page 45 Tableau I.3 : Méthodes chimiométriques [87]
THEMES METHODES DOMAINES D’APPLICATIONS
Analyse de données - analyse statistique - analyse factorielle -analyse en composantes principales (ACP) - régression PLS – PCR - réseaux neuronaux - relations structure-propriétés
Analyses NIR, IR-TF, UV Chromatographies HPLC
Spectrométrie de Masse, Fluorescence Cinétique, Propriétés physicochimiques Analyse des eaux, Archéologie,
Biotechnologie, Géochimie
Huiles essentielles, Pharmacie, Pollution Calibration - régression RLM, PCR, PLS
- réseaux neuronaux - ACP
- validation croisée
UV, IR-TF, NIR Fluorescence Médicament, Analyse chimique
I-6-2- Méthodologie des plans d’expériences
Pour mieux quantifier les effets des facteurs étudiés ainsi que leurs interactions sur la réponse étudiée, nous avons cherché la forme de cette influence en établissant une équation mathématique qui permet de décrire les variations de la réponse étudiée en fonction des facteurs influents : c’est le processus de la modélisation. La représentation de cette équation dans l’espace des variables nous permet de définir les meilleures conditions expérimentales des facteurs étudiés : c’est ce qu’on appelle l’optimisation. L’ensemble, modélisation et optimisation, permet de mieux représenter et expliquer le système, et donc de prévoir la réponse recherchée en un point ou aucune expérience n’a été faite [2].
La modélisation permet donc de définir un modèle mathématique qui représente le phénomène dans le domaine expérimental étudié. Il doit décrire les variations de la réponse en fonction des différents facteurs susceptibles d’influer
FSR Page 46 sur cette dernière. Ce modèle s’écrit d’une manière générale sous la forme suivante:
Y=b0+ΣbiXi+ΣbiiXi 2+Σb
ijXiXj Où : Xi et Xj représentent les facteurs étudiés ;
XiXj représentent l’interaction entre les facteurs.
Cette équation générale peut être simplifiée en éliminant les termes non significatifs pour obtenir une équation réduite. Ceci dépend du choix de l’expérimentateur selon le niveau de confiance qu’il veut donner au modèle.
L’interprétation de la modélisation commence donc par l’établissement d’un modèle mathématique et la vérification de sa validité suivant les étapes suivantes :
Calcul des coefficients ; Tests statistiques ;
FSR Page 47
FSR Page 48

![Tableau I.1 : Flux de pollution industrielle (en tonnes) [45] 1993 2020](https://thumb-eu.123doks.com/thumbv2/123doknet/2188964.11260/31.892.94.799.903.1097/tableau-flux-pollution-industrielle-tonnes.webp)
![Tableau I.2 : Rapport entre la conductivité et la minéralisation [81]](https://thumb-eu.123doks.com/thumbv2/123doknet/2188964.11260/39.892.96.798.584.846/tableau-rapport-conductivite-mineralisation.webp)