Rev Med Liege 2005; 60 : 9 : 691-694 IN T RO D U C T I O N
Le lentigo malin (LM), anciennement appelé mélanose du Dubreuilh ou mélanose de Hutchin-son, est un néoplasme cutané se présentant clini-quement comme une macule pigmentée irrégulière en contours et en couleurs. Sur le plan dermatopathologique, il est formé de mélano-cytes atypiques, en partie regroupés en thèques au niveau de la jonction dermo-épidermique. Le LM touche généralement des personnes au-delà de la cinquantaine. Il se localise au niveau des zones photo-exposées de la face. Il évolue lentement, mais sa transformation en un mélanome invasif est possible, ce qui implique un traitement pré-coce (1).
Le traitement de choix du LM est l’exérèse chi-rurgicale respectant des marges de sécurité de 0,5 à 1 cm. La cryochirurgie ainsi que la chirurgie selon Mohs sont également envisageables avec de
bons résultats. La difficulté de l’exérèse chirurgi-cale réside dans le fait que les limites cliniques ne correspondent pas souvent aux limites dermato-pathologiques. Ceci étant, un délabrement tissu-laire important est généralement réalisé avec les conséquences esthétiques que cela entraîne (1, 2). D’autres thérapeutiques ont été employées précé-demment avec des résultats variables (cryothéra-pie, dinitrochlorobenzène (DNCB), acide azélaïque, 5-fluoro-uracil…) (2-4). L’application d’une crème à 5% d’imiquimod (Aldara®, 3M Pharmaceuticals) a aussi été proposée (1, 2, 5-8).
HI S T O I R E C L I N I Q U E
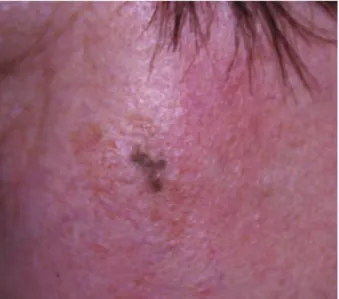
Une patiente, âgée de 48 ans et sans antécé-dent particulier, a développé en quelques mois une macule pigmentée hétérogène au niveau de la joue gauche. Cette lésion mesurait 1/1,5 cm (Fig.1a). La patiente s’exposait avec assiduité aux rayonnements ultraviolets depuis l’adoles-cence. Une biopsie a été réalisée. A l’examen histologique, on notait la présence de mélano-cytes atypiques regroupés en thèques au niveau de la jonction dermo-épidermique (Fig. 2a). Une élastose actinique était également présente, ainsi que de nombreux mélanophages (macrophages non néoplasiques chargés de mélanine) dans le
(1) Assistant clinique, CHR hutois, Service de Derma-tologie, Huy
(2) Chercheur qualifié, (3) Chef de Laboratoire adjoint, (4) Chargé de Cours, Chef de Service, CHU du Sart Tilman, Service de Dermatopathologie
COMMENT JE TRAITE …
un lentigo malin par l’imiquimod topique (Aldara
®)
RÉSUMÉ : Le lentigo malin est une forme particulière de méla-nome cutané in situ développé sur le visage de sujets âgés. L’im-munostimulant topique imiquimod peut détruire ce néoplasme avant qu’il n’exprime son potentiel invasif. Une surveillance cli-nique régulière de la zone traitée doit être poursuivie pendant au minimum 5 ans afin de déceler rapidement tout signe de récidive.
MOTS-CLÉS: Cancer - Imiquimod - Lentigo malin - Mélanome
How I treat… lentigo maligna by imiquimod SUMMARY : Lentigo maligna is a special form of in situ cuta-neous melanoma that develops on the face of sun worshipers. The topic immunostimulator imiquimod can destroy the neo-plasm before it expresses its invasive potential. A strict clinical follow-up of the treated zone must be observed at least 5 years to detect any early sign of recurrence.
KEYWORDS: Cancer - Imiquimod - Lentigo maligna - Melanoma
R. B
OURGUIGNON(1), P. P
AQUET(2), P. Q
UATRESOOZ(3), G.E. P
IÉRARD(4)
691 Fig 1a : Aspect clinique d’un lentigo malin avant traitement par
imi-quimod
Fig. 1b : Aspect clinique d’une réaction inflammatoire sévère au cours du traitement par imiquimod
derme superficiel. Il s’agissait donc d’un lentigo malin de la face.
Etant donné les séquelles esthétiques prévi-sibles d’une chirurgie large au niveau du visage, un traitement par imiquimod 5% a été proposé à raison de 3 applications par semaine pendant une durée de 3 mois. Le traitement topique a amené une réaction inflammatoire locale intense avec sensations de brûlure et suintements, nécessitant l’arrêt de l’application pendant 2 semaines en cours de traitement (Fig. 1b). Après trois mois de traitement, on notait une diminution de la surface de la lésion ainsi qu’une réduction partielle de sa pigmentation (Fig. 1c). L’examen dermatopatholo-gique à la fin du traitement a démontré une dispa-rition totale des mélanocytes atypiques, mais avec
persistance de quelques mélanophages (Fig. 2b). L’immunomarquage pour le facteur XIIIa (mar-queur des dendrocytes dermiques) s’est révélé particulièrement positif (Fig. 3) tandis que celui pour le HMB 45 (marqueur de mélanocytes néo-plasiques) s’avérait négatif. Le diagnostic retenu était celui d’une mélanodermie post-inflamma-toire sans néoplasie mélanocytaire résiduelle. Lors de la visite de contrôle après 6 mois, aucune réci-dive néoplasique n’a été mise en évidence.
DI S C U S S I O N
Les cancers cutanés sont les plus fréquents de tous les cancers humains. Leur incidence conti-nue à croître dans nos contrées (9-12), en particu-lier pour le mélanome.
L’imiquimod 5% en crème est une thérapeu-tique topique indiquée et remboursée par l’INAMI pour le traitement des condylomes acuminés (13-15). Ses capacités immunostimulantes en font un candidat potentiel pour le traitement de cancers
R. BOURGUIGNON ET COLL.
Rev Med Liege 2005; 60 : 9 : 691-694 692
Fig 1c : Aspect clinique d’une mélanodermie résiduelle non néopla-sique à l’issue du traitement par imiquimod
Fig 2a : Aspect dermatologique d’un lentigo malin avant traitement
Fig 2b : Aspect dermatologique d’une mélanodermie résiduelle sans néoplasie à l’issue du traitement par imiquimod.
Fig 3 : Immunomarquage pour le facteur XIIIa révélant la présence de nombreux dendrocytes dans le derme superficiel.
cutanés superficiels (8, 16). C’est par l’activation de récepteurs Toll-like que l’imiquimod entraîne une synthèse accrue des cytokines pro-inflamma-toires (INF, TNF, IL 12, …) par les cellules den-dritiques. Quand la cascade cytokinique est amorcée, l’imiquimod engendre un accroissement de la réponse immunitaire et, in fine, affecte les cellules tumorales. Sur le plan immunohistolo-gique, l’immunomarquage pour le facteur XIIIa a une grande importance dans le suivi du lentigo malin. En effet, le facteur XIIIa est présent en abondance dans les cellules dendritiques der-miques de type I qui jouent un rôle central indis-pensable dans la réaction immunitaire et dans le contrôle de la croissance de cancers (17). Il existe une relation de proportionnalité entre la quantité de dendrocytes présents et la réponse thérapeu-tique que l’on peut attendre (18-21). L’immuno-marquage pour le facteur XIIIa pourrait donc constituer un facteur pronostic d’efficacité lors du traitement par imiquimod. Sur le plan clinique, une réaction inflammatoire importante est égale-ment corrélée à une bonne réponse thérapeutique. Si l’imiquimod fait partie de l’arsenal antican-céreux en dermatologie (8), la prudence reste cependant de mise (15, 22). Des régressions néo-plasiques sont incontestablement obtenues, mais des récurrences locales ne sont pas à exclure au cours des mois et années qui suivent. Dans le cadre du mélanome, la place exacte de l’imiqui-mod reste à définir. La progression naturelle de ce cancer suit en effet un cheminement complexe (23, 24) qui se termine encore trop souvent de manière dramatique. Dans ce contexte, l’imiqui-mod topique a démontré ses effets curatifs contre le lentigo malin (1, 2, 5-8) et même contre des métastases cutanées de mélanome (25-29).
Dans une étude portant sur 12 patients atteint d’un LM confirmé, le schéma d’applications 3 fois par semaine a été choisi avec accroissement à une application quotidienne s’il n’y avait pas de réponse clinique suffisante (7). Après 6 semaines, 83% de guérison clinique et histologique (10/12) ont été obtenus dont 3 cas avec une pigmentation résiduelle due aux mélanophages. Un taux de 93% de guérison clinique et histologique sur une série de 28 patients a été obtenu avec un régime d’une application quotidienne pendant 3 mois (6). Le follow-up à un an n’a révélé aucune récidive. Ce n’est cependant que le recul à 5 ans qui per-mettra de comparer la valeur de ce traitement avec d’autres modalités.
Dans une autre étude, 5 patientes souffrant d’un LM récurrent, ont été traitées quotidienne-ment par imiquimod pendant une durée de 6 à 12 semaines en fonction de la tolérance au médica-ment (5). Dans tous les cas, une guérison totale ou partielle a été observée.
Les effets secondaires de l’imiquimod dépen-dent de la fréquence d’application. Des réactions locales sévères avec sensation de brûlure, picote-ment, prurit, douleur, sont fréquentes. La conta-mination bactérienne est parfois rencontrée, mais reste localisée en superficie et répond très bien à un traitement antibactérien topique. Rarement, des réactions systémiques peuvent se manifester (céphalées, malaise, douleurs abdominales, fièvre,…). Ces effets secondaires nécessitent de diminuer la fréquence d’application ou d’inter-rompre momentanément le traitement.
Dans le cas ici rapporté, deux réflexions peu-vent être faites au-delà du traitement par l’imi-quimod. La première concerne le comportement de la patiente face à l’exposition solaire. Elle fait partie des héliophiles pour lesquels l’attirance vers les ardeurs actiniques est sans limite (30). Certains effets des ultraviolets sont cumulatifs et induisent des lésions qui vont du stade infracli-nique au cancer (31-33). Développer un LM avant d’atteindre la cinquantaine est l’indice que le risque de développer d’autres cancers photo-induits est bien présent chez cette patiente qui bénéficierait beaucoup d’un suivi clinique régu-lier. Une modification comportementale vis-à-vis du Soleil et le respect d’une photoprotection stricte sont souhaitables (34).
La deuxième réflexion a trait à l’aspect de la peau. Certes, le LM a été détruit, mais il persiste une mélanodermie résiduelle qui représente l’équivalent d’un tatouage par la mélanine. Les produits cosmétiques dépigmentants sont ineffi-caces pour éclaircir une telle lésion (35). En revanche, un traitement physique par lumière pulsée ou laser à pigmentation estomperait vrai-semblablement cette mélanodermie (36, 37).
CO N C L U S I O N
L’imiquimod 5% (Aldara®) pour le traitement du LM est une alternative à envisager dans les cas où la sanction chirurgicale est contre-indiquée, ou implique des séquelles esthétiques mutilantes. Un examen histologique est impératif avant d’entre-prendre le traitement. Il doit être répété en cas de persistance d’une pigmentation. Le follow-up reste indispensable pendant une période prolongée.
RÉ F É R E N C E S
1. Chapman MS, Spencer SK, Brennick JB.— Histologic resolution of melanoma in situ (lentigo maligna) with 5% imiquimod cream. Arch Dermatol, 2003, 139, 943-944.
2. Ahmed I, Berth-Jones J.— Imiquimod : a novel treat-ment for lentigo maligna. Br J Dermatol, 2000, 143, 843-845.
COMMENT JE TRAITE...
3. Henry C, Lapière M, Franchimont C, et al.— Immuno-therapy by dinitrochlorobenzene of melanomas of the skin. I- Methods, clinical effects and survivial rates. In :
Pathology of malignant melanoma. Ed. A.B. Ackerman,
Publ. Masson, New York, 1981, 367-371.
4. Piérard GE, Henry C, Franchimont C, et al.— Immuno-therapy by dinitrochlorobenzene of melanomas of the skin. II- Histology of the cytotoxic effect. In : Pathology
of malignant melanoma. Ed. A.B. Ackerman, Publ.
Masson, New York, 1981, 373-385.
5. Ormond P, Blasdale C, Leondard N, et al.— Treatment of lentigo maligna with imiquimod. Br J Dermatol, 2002, 147, S57-S59.
6. Naylor MF, Crowson N, Kuwahara R, et al.— Treatment of lentigo maligna with topical imiquimod. Br J
Derma-tol, 2003, 149, 66-69.
7. Powell AM, Russell-Jones R, Barlow J.— Topical imi-quimod immunotherapy in the management of lentigo maligna. Clin Dermatol, 2004, 29, 15-21.
8. Urosevic M, Dummer R.— Role of imiquimod in skin cancer treatment. Am J Clin Dermatol, 2004, 5, 453-458.
9. Piérard-Franchimont C, Arrese JE, Cornil F, et al.— Les mélanomes cutanés, un spectre de cancers émergents chez la femme en région wallonne. Rev Med Liège, 1999, 4, 495-499.
10. Diepgen TL, Mahler V.— The epidemiology of skin can-cer. Br J Dermatol, 2002, 146, S1-S6.
11. Quatresooz P, Uhoda I, Fumal I, et al.— Revisiting the gender-linked melanoma burden. Dermatology, 2004,
209, 197-201.
12. Uhoda I, Quatresooz P, Fumal I, et al.— Updating trends in cutaneous cancers in south-east Belgium. Oncol
Reports, 2004, 12, 111-114.
13. Slade HB.— Cytokine induction and modifying the immune response to human papilloma virus with imi-quimod. Eur J Dermatol, 1998, 8, S13-S16.
14. Slade HB, Owens ML, Tomai MA, et al.— Imiquimod 5% cream (Aldara). Exp Opin Invest Drugs, 1998, 7, 437-442.
15. Hermanns-Lê T, Nikkels AF, Uhoda I, et al.— L’imiqui-mod (Aldara®
) : un immunomodulateur pour la peau.
Rev Med Liège, 2002, 57, 116-118.
16. Uhoda I, Quatresooz P, Piérard-Franchimont C, et al.— Nudging epidermal field cancerogenesis by imiquimod.
Dermatology, 2003, 206, 357-360.
17. Piérard-Franchimont C, Arrese JE, Nikkels AF, et al.— Factor XIIIa-positive dermal dendrocytes and prolifera-tive activity of cutaneous cancers. Virchows Arch, 1996,
429, 43-48.
18. Arrese JE, Paquet P, Claessens N, et al.— Dermal den-dritic cells in anogenital warty lesions unresponsive to an immune-response modifier. J Cutan Pathol, 2001, 28, 131-134.
19. Hermanns-Lê T, Paquet P, Nikkels AF, et al.— Prolon-ged imiquimod treatment and graft-versus-host reaction : histological mimicry in the pattern of monocyte macro-phage-dendrocyte lineage skin infiltration.
Dermato-logy, 2003, 206, 361-365.
20. Quatresooz P, Piérard GE.— Imiquimod- responsive basal cell carcinomas and factor XIIIa-enriched dendro-cytes. Clin Exp Dermatol, 2003, 28, S27-S29.
21. Michalopoulos P, Yawalkar N, Brönnimann M, et al.— Characterization of the cellular infiltrate during success-ful topical treatment of lentigo maligna with imiquimod.
Br J Dermatol, 2004, 151, 903-906.
22. Zitelli JA.— Use of imiquimod for treating skin cancer.
J Am Acad Dermatol, 2005, 52, 177.
23. Quatresooz P, Arrese JE, Piérard-Franchimont C, et al.— Immunohistochemical aid at risk stratification of melanocytic neoplasms. Int J Oncol, 2004, 24, 211-216. 24. Claessens N, Piérard GE, Piérard-Franchimont C, et al.— Immuno-histochemical detection of incipient melanoma micrometastases. Relationship with sentinel lymph node involvement. Melanoma Res, sous presse. 25. Steinmann A, Funk JO, Schuler G, et al.— Topical
imi-quimod treatment of a cutaneous melanoma metastasis.
J Am Acad Dermatol, 2000, 43, 555-556.
26. Bong AB, Bonnekoh B, Franke I, et al.— Imiquimod, a topical immune response modifier, in the treatment of cutaneous metastases of malignant melanoma.
Dermato-logy, 2002, 205, 135-138.
27. Ugurel S, Wagner A, Pfohler C, et al.— Topical imiqui-mod eradictes skin metastases of malignant melanoma but fails to prevent rapid lymphogenous metastatic spread. Br J Dermatol, 2002, 147, 621-624.
28. Vereecken P, Mathieu A, Laporte M, et al.— Manage-ment of cutaneous locoregional recurrences of mela-noma : a new therapeutic perspective with imiquimod.
Dermatology, 2003, 206, 279-280.
29. Wolf IH, Smolle J, Binder B, et al.— Topical imiquimod in the treatment of metastatic melanoma to skin. Arch
Dermatol, 2003, 139, 273-276.
30. Quatresooz P, Uhoda I, Piérard-Franchimont C, et al.— Héliodermie, héliophiles et héliophobes. Rev Med Liège, 2005, 60, S53-S55.
31. Petit L, Fogouang L, Uhoda I, et al.— Regional variabi-lity in mottled photo-induced melanoderma in the elderly. Exp Gerontol, 2003, 38, 327-331.
32. Quatresooz P, Petit L, Uhoda I, et al.— Mosaic subclini-cal melanoderma. An Achilles heel for UV-related epi-dermal carcinogenesis ? Int J Oncol, 2004, 25, 1763-1768.
33. Uhoda I, Quatresooz P, Rorive A, et al.— Photocancéro-genèse cutanée. Rev Med Liège, 2005, 60, S84-S93. 34. Henry F, Piérard-Franchimont C, Piérard GE.—
Photo-protection cutanée. Rev Med Liège, 2005, 60, S98-S103. 35. Petit L, Piérard GE.— Skin-lightening products
revisi-ted. Int J Cosmet Sci, 2003, 25, 169-181.
36. Paquet P, Piérard GE.— Intense pulsed light treatment of persistent facial hypermelanosis following drug-induced toxic epidermal necrolysis. Dermatol Surg, 2004, 30, 1522-1525.
37. Paquet P, Piérard-Franchimont C, Henry F, et al.— Trai-tements par lasers et lumière pulsée. Rev Med Liège, 2005, 60, S113-S119.
R. BOURGUIGNON ET COLL.
Rev Med Liege 2005; 60 : 9 : 691-694 694
L e s d e m a n d e s d e t i r é s à p a r t s o n t à a d r e s s e r a u P r o f G . E . P i é r a r d , S e r v i c e d e D e r m a t o p a t h o l o g i e , CHU du Sart Tilman, 4000 Liège.