Université de Sherbrooke
Développement d’inhibiteurs pharmacologiques de PACE4 pour le traitement du cancer de la prostate
Par
Christine Levesque Programme de Biochimie
Thèse présentée à la Faculté de médecine et des sciences de la santé en vue de l’obtention du grade de philosophiae doctor (Ph.D.)
en Biochimie
Sherbrooke, Québec, Canada Janvier 2015
Membres du jury d’évaluation
Robert Day, département de Chirurgie (Service d’Urologie) Martin Bisaillon, département de Biochimie
Philippe Sarret, département d’Anatomie et Biophysique Amina Zoubeidi, Vancouver Prostate Cancer Center
Développement d’inhibiteurs pharmacologiques de PACE4 pour le traitement du cancer de la prostate
Par
Christine Levesque Programmes de Biochimie
Thèse présentée à la Faculté de médecine et des sciences de la santé en vue de l’obtention du diplôme de philosophiae doctor (Ph.D.) en Biochimie, Faculté de médecine et des sciences de la santé, Université de Sherbrooke, Sherbrooke, Québec, Canada, J1H 5N4 La protéolyse par les proprotéines convertases (PC) représente une étape cruciale de maturation pour de nombreux peptides et protéines destinés aux voies de sécrétions cellulaires. Parmi ces substrats des PC, de nombreuses molécules participent aux étapes clés de progression tumorale. L’enzyme PACE4, une des PC, est d’ailleurs surexprimée dans le cancer de la prostate et des études antérieures réalisées dans notre laboratoire démontrent que cette protéase occupe un rôle essentiel et non redondant dans la progression du cancer de la prostate. Puisque PACE4 représente une cible thérapeutique potentielle pour le traitement du cancer de la prostate, l’objectif principal des travaux présentés dans cette thèse vise à développer un inhibiteur pharmacologique de PACE4 et d’évaluer son potentiel thérapeutique. Le développement d’inhibiteur spécifique à la PACE4 représente un défi de taille, puisque le site actif des PC démontre un fort niveau d’homologie. Bien que les sous-sites S1 à S4 des PC soient hautement conservés, la littérature suggère qu’il existe des déterminants moléculaires exploitables au sein des sous-sites S5 à S8. Ainsi, ces observations suggèrent qu’une sélectivité d’inhibition pourrait provenir de courts peptides. En analysant les profils d’inhibition obtenus pour divers peptides inhibiteurs des PC, la séquence Ac-LLLLRVKR-NH2, nommée Multi-Leu, a été identifiée comme inhibiteur permettant d’obtenir une préférence d’inhibition 20 fois plus importante pour PACE4 que pour Furine. Dans le but d’améliorer les propriétés pharmacocinétiques du composé et permettre son utilisation comme inhibiteur pharmacologique, des études de relation structure-activité ont été conduites. Ces études ont permis de déterminer que le peptide Multi-Leu est sujet à une dégradation par des exopeptidases, et par conséquent l’addition d’acides aminés non naturels aux extrémités N et C-terminales permet d’augmenter la stabilité du composé. Suivant cette étude, la modification amidinobenzylamide (Amba) a été introduite en position P1, permettant d’augmenter la puissance d’inhibition du composé, ainsi qu’un stéréoisomère D-Leucine en position P8. La caractérisation du potentiel inhibiteur du peptide Ac-[DLeu]LLLRVK-Amba démontre l’efficacité du peptide in vivo alors qu’une administration par voie intra veineuse du composé parvient à freiner la progression tumorale dans un modèle de xénogreffes de cancer de la prostate. Dans ce modèle, l’analogue du peptide Multi-Leu parvient à bloquer la néovascularisation tumorale en plus d’induire la quiescence et l’apoptose dans les tumeurs traitées.
Mots clés : Inhibiteur de PACE4, peptide Multi-Leucine (Multi-Leu), Cancer de la prostate, Peptidomimétique.
S
UMMARYDevelopment of Pharmacological PACE4 Inhibitors for Prostate Cancer Therapy By
Christine Levesque Biochemistry Program
Thesis presented at the Faculty of medicine and health sciences for the obtention of Doctor degree diploma philosophiae doctor (Ph.D.) in Biochemistry, Faculty of medicine and
health sciences, Université de Sherbrooke, Sherbrooke, Québec, Canada, J1H 5N4 Numerous secreted peptides or proteins require a proteolytic activation by the proprotein convertases (PC) to fully gain their biologic activities. Among substrates of the PC family, there exist various cancer-related molecules. The enzyme PACE4, one of the seven kexin-like PC has been demonstrated to be overexpressed in prostate cancer and to have a non-redundant role in prostate cancer progression. Since PACE4 is a validated therapeutic target for prostate cancer, the main aim of this thesis was to develop a pharmacologic PACE4 inhibitor and to evaluate its therapeutic potential.
The development of PACE4 specific inhibitors represents a challenge since PC share an important homology level within their active site. Whereas S1 to S4 subsites appear to be highly homologous within the PC family, litterature suggests that significant differences exist in subsites S5 and beyond, suggesting that peptide compound could result in specific inhibitors. In this thesis, the Multi-Leu peptide (Ac-LLLLRVKR-NH2) was identified as a selective PACE4 inhibitor, which displays a 20-fold inhibitory preference toward PACE4 over furin. In order to improve Multi-Leu peptide pharmacokinetic profile, structure-activities relationship studies were performed and allowed for the identification of two modifications that increase both inhibitory properties and stability of this molecule. Peptide resulting from introduction of an arginine mimetic residue amidinobenzylamide (Amba) in P1 and a stereoisomer D-Leucine in position P8 displayed an improved pharmacokinetic profile. Futhermore, intravenous administration of the compound Ac-[DLeu]LLLRVK-Amba significantly inhibited prostate cancer progression in a LNCaP xenograft model of prostate cancer. This Multi-Leu peptide analog also inhibited tumor neovascularisation along with inducing cell quiescence and apoptosis in tumors of treated animals.
Keywords : PACE4 inhibitors, Multi-Leucine (Multi-Leu) peptide, Prostate cancer, Peptidomimetic,
Résumé ... iii
Summary ... iv
Table des matières ... v
Liste des figures ... viii
Liste des schémas ... x
Liste des tableaux ... xi
Liste des abréviations ... xii
1 Introduction ... 1
Biologie et fonctions des proprotéines convertases ... 1
Structure et activation des proprotéines convertases ... 2
Domaines structuraux ... 3
Activation des proprotéines convertases ... 4
Patrons d’expression des proprotéines convertases ... 6
Distribution tissulaire et cellulaire ... 6
Localisation subcellulaire ... 8
Fonctions des proprotéines convertases ... 9
Mécanisme enzymatique des proprotéines convertases ... 10
Fonctions uniques et redondantes des proprotéines convertases ... 11
Implications des proprotéines convertases en conditions pathologiques ... 16
Implication des proprotéines convertases dans le cancer ... 16
Substrats des proprotéines convertases liés à la progression tumorale ... 16
Expression des proprotéines convertases dans les cancers humains ... 19
Potentiel thérapeutique des proprotéines convertases ... 21
Le cancer de la prostate ... 22
Thérapies associées au cancer de la prostate ... 23
Implication de la proprotéine convertase PACE4 dans le cancer de la prostate ... 27
Développement d’inhibiteurs des proprotéines convertases ... 34
Inhibiteurs existants des proprotéines convertases ... 34
Petites molécules organiques ... 34
Polypeptides et protéines ... 35
Courts peptides inhibiteurs ... 38
Hypothèse/problématique ... 43
Résultats ... 46
Article 1 : The Multi-‐Leu peptide Inhibitor Discriminate Between PACE4 and Furin And Exhibits Antiproliferative Effects On Prostate Cancer Cells ... 46
Summary ... 47
Introduction ... 48
Results ... 49
Discussion and conclusion ... 60
Experimental Section ... 66
Acknowledgment ... 70
Supporting Information ... 71
Article 2 : Design, Synthesis and Structure-‐Activity Relationship Studies of a Potent PACE4 Inhibitor ... 75
Summary ... 76
Introduction ... 77
Results ... 79
Discussion and conclusion ... 93
Experimental Section ... 97
Acknowledgment ... 103
Supporting information ... 104
Article 3 : Molecular Determinants for Furin and PACE4 Using Positional Scan of High Affinity Multi-‐Leucine Inhibitor ... 108
Summary ... 109
Introduction ... 110
Experimental section ... 112
Results ... 118
Discussion and conclusion ... 128
Article 4 : PACE4 Inhibitors and Peptidomimetics Analogs Block Prostate Cancer Progression Through Quiescence Induction, Increase Apoptosis and Impaired Neovascularisation ... 134
Summary ... 135
Introduction ... 136
Results ... 137
Discussion and conclusion ... 150
Acknowledgments ... 161
Supporting Information ... 162
Discussion ... 163
Identification d’inhibiteur sélectif de PACE4 ... 163
Optimisation du profil pharmacologique de l’inhibiteur Multi-‐Leu ... 165
Approche peptidomimétique ... 165
Analyse des déterminants moléculaires dans le peptide Ac-‐LLLLRVK-‐Amba ... 168
Effets pharmacologiques du peptide Multi-‐Leu ... 170
Inhibition de PACE4 in vivo ... 173
Conclusions et perspectives ... 177
Remerciements ... 179
Liste des références ... 180
Figure 1 : Représentation schématique des proprotéines convertases ... 2
Figure 2 : Maturation des proprotéines convertases – modèle de l’enzyme furine ... 6
Figure 3 : Localisation sub-cellulaire des proprotéines convertases ... 9
Figure 4 : Motifs de reconnaissance des proprotéines convertases ... 10
Figure 5 : Mécanisme enzymatique des proprotéines convertases ... 11
Figure 6 : Implication des proprotéines convertases dans la progression tumorale ... 17
Figure 7 : Synthèse des androgènes et cibles de la thérapie hormonale ... 25
Figure 8 : Expression des proprotéines convertases dans le cancer de la prostate ... 29
Figure 9 : Analyse par IHC de PACE4 sur coupes de tissus et analyse par grade clinique . 30 Figure 10 : Rôle des proprotéines convertases dans le cancer de la prostate ... 33
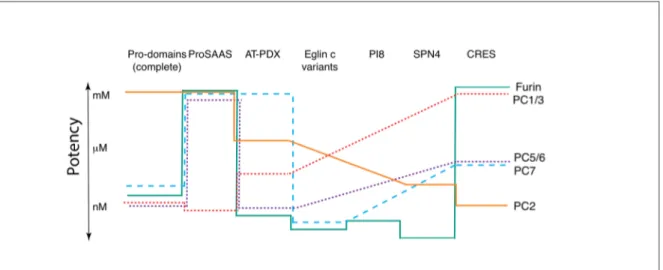
Figure 11 : Puissance et sélectivité des inhibiteurs polypeptidiques des proprotéines convertases ... 38
Figure 12 : Modèle pour le développement d’inhibiteur de PACE4 ... 42
Figure 13 : PC prodomains as PACE4 inhibitors ... 51
Figure 14 : Use of SP-SPCL to profile PC-inhibitor recognition ... 53
Figure 15 : Multi-Leucine peptides ... 54
Figure 16 : ML-peptide as an inhibitor of prostate cancer cell proliferation ... 56
Figure 17 : ML targets intracellular PACE4 to inhibit prostate cancer cell lines proliferation ... 58
Figure 18 : Cell viability and cell cycle analyses of ML-peptide treated LNCaP ... 59
Figure 19 : Homology model of PACE4 ... 64
Figure 20 : Supporting informations; Confocal microscopy of FITC-β-Ala-ML-peptide treated cells ... 71
Figure 21 : Supporting informations; Polybasic peptide Ac-RARRRKKRT-NH2 is a poor inhibitor of prostate cancer proliferation ... 72
Figure 22 : Proposed modifications of the Multi-Leu peptide inhibitor ... 79
Figure 23 : Structure of arginine mimetics used in the present study ... 80
Figure 24 : Inhibition constant against PACE4 for analogues modified at Multi-Leu core . 84 Figure 25 : Specificity ratio for PACE4/furin of ML analogues modified at Multi-Leu core ... 85
Figure 26 : Stability profile of the selected Multi-Leu analogues ... 89
Figure 27 : Antiproliferative activity and cytotoxicity of the selected Multi-Leu inhibitors on prostate cancer cell lines ... 91
Figure 28 : Cellular uptake of the fluorescent ML analogues by DU145 cells ... 92
Figure 29 : Positional scanning in leucine extension of lead compound ... 112
Figure 30 : Screening of P5 to P8 libraries with recombinant PACE4 and furin ... 120
Figure 31 : Selectivity index toward PACE4 ... 122
Figure 32 : Inhibitory potency of peptides on DU145 cell proliferation ... 126
Figure 33 : Inhibitory potency of peptidomimetic analogs ... 139
Figure 34 : Stability of peptidomimetic inhibitors ... 140
Figure 35 : In vivo inhibitory potency of peptidomimetic inhibitors ... 142
Figure 36 : Pharmacokinetic profile of peptide Ac-[DLeu]LLLRVK-Amba ... 145
Figure 37 : Systemic administration of peptide Ac-[DLeu]LLLRVK-Amba in vivo ... 147
Figure 38 : Immunohistochemistry analyses on harvested tumors ... 149
Figure 39 : Vue détaillée des interactions entre le site actif de la furine et le groupement Amba ... 168
Figure 40 : Détermination du pharmacophore dans le peptide Multi-Leu ... 170
L
ISTE DES SCHÉMASSchéma 1 : Synthesis of inhibitor 17,18 ... 81
Schéma 2 : Synthesis of Amba 2HCl (4-Amidinobenzylamine 2HCl; IV) ... 82
Schéma 3 : Synthesis of ΔAgm(Boc)2 (N-(2-butenyl) guanine-(Boc)2; IX) ... 83
Schéma 4 : Synthesis of P5 library of inhibitors ... 115
Schéma 5 : Synthesis of analogues using chloro-(2’chloro)trityl resin ... 116
Tableau 1 : Distribution des proprotéines convertases ... 8
Tableau 2 : Phénotypes associés à la délétion des proprotéines convertases in vivo ... 15
Tableau 3 : Expression des proprotéines convertases dans les cancer humains ... 21
Tableau 4 : Analyse différentielle de l’expression de PACE4 selon la base de données Oncomine ... 31
Tableau 5 : Inhibiteur peptidiques des PC validés in vivo ... 40
Table 6 : Supporting informations; Inhibitory potency of Multi-Leucine peptides towards PCs ... 71
Table 7 : Supporting informations; Physicochemical properties of peptides ... 73
Table 8 : Supporting informations; qPCR Primers used in this study ... 74
Table 9 : Supplementary informations; Physicochemical properties of the peptides ... 104
Table 10 : Supplementary informations; Physicochemical properties of the peptides ... 105
Table 11 : Supplementary informations; Inhibitory potency of the selected ML analogues towards related PCs ... 106
Table 12 : Supplementary informations; Enzyme and substrate concentrations used in assays. ... 107
Table 13 : IC50 calculated from dose-response curves toward DU145 and LNCaP cell lines ... 128
Table 14 : Physicochemical properties of the peptides ... 162
Table 15 : Instrument parameters used for pharmacokinetic studies using mass spectrometry ... 162
Table 16 : Quantification parameters used for pharmacokinetic studies using mass spectrometry ... 162
9-‐Cl-‐HOBt 1-‐hydroxy-‐6-‐chloro-‐benzotriazole Ac Acétyl
ACTH adrénocorticotrophine
ADAM A Disintegrin And Metalloproteinase
ADAM-‐TS A Disintegrin And Metalloproteinase with thrombospondin motif
Amba Amidinobenzylamide APS Antigène prostatique sérique Azaβ3-‐R Azaβ3-‐arginine
BMP Bone Morphogenic Protein C8 Octanoyl
CCK Cholécystokinine CMK Chlorométhyl cétone
COMU 1-‐cyani-‐2-‐ethoxy-‐2-‐oxoethylidenaminooxy dimethylamino-‐ morpholini-‐carbenium hexafluorophosphate CRH Corticolibérine DCM Dichlorométhane dec Decanoyl DIPEA N,N-‐diisopropylethylamine DMF Diméthyl formamide
FACS Cytomètre en flux / fluorescence-‐activated cell sorter FITC Fluorescein isothiocyanate
GDF11 Growth differentation factor 11 GHRH Growth hormone releasing hormone Gpa 4-‐guanidino-‐ι-‐phenylalanine
HATU O-‐(7-‐azabenzotriazole-‐1-‐yl)-‐N,N,N’,N’-‐Tetramethyluronium Hexafluorophosphate
HFIP Hexafluoro-‐2-‐propanol
HRMS Spectrométrie de masse en haute résolution / High resolution mass spectrometry
HSPG Complexe Protéoglycane et Sulfate d’héparan / Heparan Sulfate Proteoglycan
IC50 Concentration inhibitrice médiane IGF Insulin-‐like growth factor
IHC Immunohistochimie IGFR Récepteur à l’IGF KI Constante d’inhibition KO Knock out
LH hormone lutéinisante
LHRH hormone de libération des gonadotrophines hypophysaires Maldi-‐TOF MS Matric-‐assisted laser desorption/ionization Time of flight mass
spectrometry
ML Peptide Multi-‐Leu Ac-‐LLLLRVKR-‐NH2 MT-‐MMP Membrane-‐type matrix metalloproteinase Nle Norleucine
NMM N-‐methylmorpholine
PC Proprotéine convertase PCa Prostate cancer
PDGF Platelet-‐derived growth factor
PEG8 Polyéthylèneglycol 8, α-‐amine-‐ω-‐propionic acid octaethylene glycol
POMC Pro-‐opiomélanocortine
PyBOP Benzotriazole-‐1-‐yl-‐oxy-‐tris-‐pyrrolidino-‐phosphonium hexafluorophosphate
RSL Reactive side loop
Seldi-‐TOF MS Surface-‐enhanced laser desorption/ionization time of flight mass spectrometry
shRNA Short hairpin RNA
SPPS Synthèse peptidique en phase solide Str-‐3 Stromelysine-‐3
T½ Demi-‐vie
TFA Acide trifluoroacétique
TGFβ Transforming growth factor beta TGN Réseau trans golgien
TIMP Tissue inhibitor of metalloproteinase TIS triisopropysilane
VEGF Vascular endothelial growth factor ΔAgm 2,3-‐dehydroagmatine
Suivant la traduction protéique, un polypeptide peut subir différentes modifications post-traductionnelles. Ces modifications ont pour rôle de réguler l’activité biologique, la localisation, la conformation, l’affinité, ou de déclencher une signalisation cellulaire. Elles peuvent faire intervenir des réactions enzymatiques ou survenir spontanément. Parmi les modifications post-traductionnelles, on retrouve l’ajout ou le retrait de groupements fonctionnels divers, l’isomérisation, la formation de liens intramoléculaire, et la protéolyse (Mann et Jensen 2003).
Dans les voies de sécrétions cellulaires, de nombreux polypeptides sont produits sous forme de zymogènes, ou proprotéines, et nécessitent une étape d’activation par protéolyse avant d’atteindre leur pleine activité biologique. Cette synthèse sous forme de zymogène a été décrite pour la première fois en 1967, par l’identification de la proinsuline (Steiner et Oyer 1967) suggérant une activation par un clivage enzymatique à des sites de résidus dibasiques. Près de vingt ans plus tard, les activités enzymatiques responsables de cette activation dans les granules de sécrétion ont été isolées à partir d’un insulinome, démontrant l’activation compartimentale de la proinsuline et le principe d’activation protéolytique des proprotéines (Davidson et al. 1988). On reconnait à ce jour l’importance de ce mécanisme finement régulé dans les processus cellulaires, permettant une régulation spatiale et temporale de l’activité biologique de ces protéines. Dans les voies de sécrétions cellulaires, les proprotéines convertases (PC) sont responsables de la maturation de nombreux zymogènes, générant une ou plusieurs entités bioactives par précurseur.
Biologie et fonctions des proprotéines convertases
Les PC représentent 9 protéases à sérine de la famille des subtilases soit furine, PC1/3, PC2, PC4, PC5/6, PC7, PACE4, PCSK9 et SP1/SKI-1 (Fugère et Day 2005; Couture et al. 2011) (Figure 1). Ces enzymes peuvent être divisées en trois sous-familles selon le motif de reconnaissance caractérisant leurs substrats (Seidah et al. 2006; Seidah et Prat 2012). Les sept premiers membres clivent leurs substrats suivant un motif dibasique, similaire à l’homologue kexine chez la levure. L’enzyme SP1/SKI-1 reconnait plutôt des substrats
classée dans la sous-famille pyrolysine (Seidah et al. 1999). La protéine PCSK9, classée dans la sous-famille protéinase K, quant à elle n’effectue qu’un seul clivage, au niveau de son prodomaine et n’exerce aucune activité enzymatique en trans (Seidah et al. 2003). Le présent ouvrage se concentre sur les PC exerçant un clivage similaire à kexine.
Figure 1 : Représentation schématique des proprotéines convertases
Structure et activation des proprotéines convertases
Comme la majorité des protéines adressées vers les voies de sécrétions cellulaires, les PC subissent de nombreuses modifications post-traductionnelles suivant leur traduction. Parmi
La famille des PC regroupe 7 protéases dont l’activité est similaire aux enzymes kexine. Les PC présentent une structure N-terminale hautement similaire ainsi qu’une région C-terminale plus variable. La PC5/6 existe sous deux isoformes distincts issus d’épissage alternatif. Adapté de (Seidah et Prat 2012)
ces modifications post-traductionnelles, on retrouve des glycosylations et phosphorylations mais également une protéolyse. De façon générale, les membres de la famille des PC ont une structure similaire, avec quatre domaines N-terminaux présentant un fort degré d’homologie et une région C-terminale plus variable (Figure 1). La détermination de la structure de l’enzyme furine avec un inhibiteur covalent dans la fente catalytique a permis d’approfondir les connaissances sur la structure de furine et d’en déduire des informations sur les autres PC (Henrich et al. 2003; Henrich et al. 2005).
Domaines structuraux
Le premier domaine, le peptide signal a pour rôle de diriger l’enzyme vers les voies de sécrétions cellulaires lors de la traduction. Ce domaine est clivé par une peptidase signal de façon co-traductionnelle, dès la translocation de la chaine polypeptidique en cours de synthèse dans le reticulum endoplasmique (Fugère et Day 2005; Seidah et Prat 2012).
Suivant le peptide signal, on retrouve un prodomaine au sein des PC. Cette région agit comme chaperonne et est donc essentielle au repliement de l’enzyme (Fugère et Day 2005; Seidah et Prat 2012). Lors de la synthèse des PC, le prodomaine occupe la fente catalytique et agit donc comme inhibiteur en cis de l’enzyme nouvellement traduite. La maturation de l’enzyme, qui sera discutée plus en détail, s’accompagne d’un clivage autocatalytique du prodomaine. Les prodomaines des PC, de courts fragments de 10 à 12 kDa, ont également été décrits dans la littérature en tant qu’inhibiteurs en trans non sélectifs des PC (Zhong et al. 1999; Fugère et al. 2002; Basak et Lazure 2003).
La région la plus conservée dans la famille des PC est le domaine catalytique, qui présente de 50 à 70% d’homologie (Fugère et Day 2005). Cette région, hautement chargée négativement, est responsable de la reconnaissance et du clivage des substrats. Le site actif des PC, présent au sein du domaine catalytique est formé de la triade catalytique Asp, His et Ser et comprend également un résidu Asn conservé (Asp chez PC2) requis pour la stabilisation de l’oxyanion formé durant la réaction d’hydrolyse (Henrich et al. 2003; Rockwell et Thorner 2004). Des sites de coordination contenant un ion calcium sont présents dans le site actif, dont un au niveau du sous site S1. Cet ion calcium identifié dans la structure cristalline de la furine, serait absent chez la subtilase, et aurait pour rôle de
stabiliser la pochette catalytique, conformément à l’activité calcium-dépendante des PC in vitro (Henrich et al. 2003).
En C-terminal du domaine catalytique est retrouvé le domaine P. Des constructions des PC dont le domaine P a subi des mutations ont démontré l’importance de cette région dans les propriétés enzymatiques (c.-à-d.; stabilité, dépendance au calcium et pH optimal) (Zhou et al. 1998). Une autre preuve de l’importance de ce domaine est apportée par la lignée cellulaire humaine d’adénocarcinome LoVo. Dans cette lignée, dite déficiente en furine, chacun des allèles présente une mutation au sein du domaine P et la furine produite n’est pas en mesure de cliver son prodomaine, ni de quitter le reticulum endoplasmique pour être adressée vers l’appareil de golgi (Takahashi et al. 1993; Takahashi et al. 1995). Une analyse de la structure de la furine, obtenue par cristallographie, suggère que le domaine P, dont le repliement est indépendant, aurait pour rôle de stabiliser le domaine catalytique via une surface d’interaction hydrophobe et la présence de liaisons ioniques (Henrich et al. 2003).
La région C-terminale des PC est plus variable d’une enzyme à l’autre. Dans cette région, on retrouve différents motifs, tels que des régions riches en cystéines, des domaines transmembranaires et cytosoliques ainsi que des motifs de triage (Seidah et Prat 2012). Ces séquences ont pour rôle de réguler entre autres, la localisation sub-cellulaire des PC.
Activation des proprotéines convertases
Les PC sont elle-mêmes produites sous forme de zymogènes, nécessitant une activation par clivage endoprotéolytique. La maturation des PC a d’abord été démontrée à l’aide de la protéine furine (Anderson et al. 1997; Anderson et al. 2002). Selon ce modèle classique de sécrétion des PC, la pro-furine subit un premier clivage autocatalytique au niveau du réticulum endoplasmique, compartiment cellulaire à pH neutre. (Figure 2) Ce premier clivage, qui a lieu à proximité du domaine catalytique au niveau du site R-T-K-R107,est essentiel afin de permettre le routage de l’enzyme et sa sortie du réticulum endoplasmique. Lors des étapes subséquentes de routage, la furine effectue un second clivage de son prodomaine dans l’environnement acidifié du réseau trans-golgi au site R-G-V-T-K-R75. (Anderson et al. 1997; Anderson et al. 2002; Thomas 2002). Le mécanisme par lequel le
second clivage est dépendant de l’acidification de l’environnement implique le résidu His69, qui agit à titre de sonde à pH. Une étude de modélisation moléculaire a suggéré que le résidu His69 n’est pas directement impliqué dans des interactions prodomaine-site catalytique au sein de la furine, mais est plutôt retrouvé dans une boucle au niveau de la structure du prodomaine. La protonation de ce résidu serait impliquée dans la relaxation de la boucle permettant un mouvement favorisant l’accessibilité du second site de clivage (Williamson et al. 2013). Bien que le cas de la furine soit le modèle classique d’activation des PC, les mécanismes d’activation divergent au sein de la famille. Alors que la majorité des PC subissent un premier clivage autocatalytique au niveau du réticulum endoplasmique, PC2 fait exception à ce modèle puisque ce clivage à lieu dans les granules de sécrétion immatures (Seidah et al. 2008). Quant au compartiment cellulaire où a lieu le second clivage, qui a pour effet de libérer le site actif des PC, les enzymes PC1/3 et PC2 divergent du modèle d’activation classique alors que ces deux enzymes sont activées dans les granules de sécrétion plutôt qu’au niveau du reticulum endoplasmique (Seidah et al. 2008). Récemment, deux études rapportent la présence du prodomaine de PC5/6 à la membrane cytoplasmique de façon endogène et suggèrent une activation extracellulaire de cette enzyme (Mayer et al. 2008; Maret et al. 2012). Bien qu’il s’agisse de résultats préliminaires, obtenus avec une seule lignée cellulaire, cette maturation différente du modèle classique pourrait avoir une implication physiologique dans le clivage de substrats présents à la membrane, alors que l’activation de PC5/6 coïncide avec le clivage extracellulaire de certains précurseurs, notamment la molécule pro-lefty (Mayer et al. 2008). Cette synthèse sous forme inactive des PC, représente un mécanisme de contrôle de l’activité enzymatique. Ainsi, le rythme d’activation précis et coordonné de ces enzymes fait en sorte que les PC ne sont activées seulement alors qu’elles ont rejoint le compartiment cellulaire ciblé (Seidah et al. 2008).
Figure 2 : Maturation des proprotéines convertases – modèle de l’enzyme furine
Patrons d’expression des proprotéines convertases Distribution tissulaire et cellulaire
La distribution tissulaire des PC a été l’objet de plusieurs études et leur profil d’expression s’est révélé être très variable, allant d’une expression ubiquitaire, pour l’enzyme furine à une expression plus confinée pour d’autres PC (Tableau 1) (Seidah et al. 1994; Bergeron et
Le prodomaine des PC agit comme chaperonne intramoléculaire et inhibiteur de l’activité enzymatique lors de la traduction de ces enzymes. Selon le modèle d’activation de la furine, un premier clivage a lieu dans le reticulum endoplasmique et un second clivage survient dans l’environnement acide du système trans golgien. Inspirée de (Thomas 2002)
al. 2000; Seidah et Prat 2012). Par exemple, les enzymes PC1/3 et PC2 sont principalement retrouvées au niveau des cellules neurales (eg. système nerveux central, hypothalamus), des tissus à fonctions endocrines (eg. hypophyse, pancréas, thyroide, médulla de la glande surrénale) (Seidah et al. 1993; Seidah et al. 1994) et dans les cellules du système immunitaire (eg. Macrophages et monocytes) (Lansac et al. 2006; Refaie et al. 2012; Gagnon et al. 2013). La PC4 est plûtot restreinte aux tissus à fonction reproductrice, tels que les cellules germinales testiculaires (Seidah et al. 1994), les tissus ovariens (Tadros et al. 2001) et le placenta (Qiu et al. 2005). Quant aux enzymes PACE4, PC5/6 et PC7, elles ont une distribution largement répandue. L’enzyme PACE4 est retrouvée de façon abondante dans le cervelet, la moelle épinière, le lobe antérieur de l’hypophyse, le tractus gastro-intestinal, le cœur, le foie, les reins, les ovaires ainsi que la prostate (Seidah et al. 1994). La PC5/6 est plutôt exprimée dans les neurones du système nerveux central, les cellules du système digestif, au niveau du cortex surrénalien, dans les tissus ovariens ainsi que dans les cellules de Sertoli des tubes séminifères et dans les cellules germinales testiculaires (Seidah et al. 1993; Seidah et al. 1994). Quant à l’enzyme PC7, elle est retrouvée à des niveaux élevés dans le système nerveux central, dans les tissus reproductifs, dans les cellules intestinales, au niveau des glandes surrénales, des reins, du foie, des poumons, du pancréas, de la rate ainsi que dans les cellules immunitaires (Seidah et al. 1996; Decroly et al. 1997). Tel que précédemment mentionné, la furine est la seule PC à expression ubiquitaire et donc est retrouvée dans tous les tissus à des niveaux variables (Seidah et al. 1993). D’une façon générale, un tissu ou une cellule exprime plus d’une PC à la fois et présente plutôt un ensemble des PC. Cette distribution unique à chacune PC représente un mécanisme important de régulation de l’activité enzymatique.
Tableau 1 : Distribution des proprotéines convertases
PC Distribution tissulaire
PC1 Neurones du système nerveux central, cellules endocrines en péripherie et cellules immunitaires
PC2 Neurones du système nerveux central, cellules endocrines en péripherie et cellules immunitaires
furine Ubiquitaire, mais exprimée à des niveaux variables
PC5/6 Neurones du système nerveux central, système disgestif, cortex surrénalien, ovaires, cellules de Sertoli et cellules germinales testiculaires.
PACE4 Cervelet, moële épinière, hypophyse, système digestif, tissu cardiac, foie, reins, ovaires et prostate
PC7 Système nerveux central, système reproducteur, intestin grêle et colon, glande surrénale, Rein, Poumon, foie, Pancréas, rate, cellules immunitaires
PC4 Cellules germinales testiculaires, ovaires et placenta
Figure inspirée de (Seidah et al. 1994; Bergeron et al. 2000; Thomas 2002; Taylor et al. 2003; Seidah et Prat 2012)
Localisation subcellulaire
Les patrons de localisation cellulaire sont distincts entre les PC et permettent un niveau de spécificité additionnel pour leurs substrats respectifs (Figure 3). Ainsi, les enzymes PC1/3 et PC2 présentes principalement au sein des granules de sécrétion immatures et matures ont pour substrats des hormones peptidiques et neuropeptides (Couture et al. 2011; Seidah et Prat 2012). Les enzymes furine, PC7 et PC5/6B possèdent un domaine transmembranaire permettant leur localisation à la surface cellulaire (Couture et al. 2011; Seidah et Prat 2012). Une des particularités de ces enzymes est leur capacité à effectuer un cycle au travers du système endosomal vers la membrane, puis ensuite d’effectuer un retour de la surface cellulaire vers le réseau trans-golgien (Molloy et al. 1998; Molloy et al. 1999; Thomas 2002). Ces enzymes possédant un domaine transmembranaire auraient donc la capacité de cliver des substrats dans les voies de sécrétion cellulaires, mais également des polypeptides présents à la surface cellulaire (Molloy et al. 1999; Seidah et al. 2008). Les enzymes PACE4 et PC5/6A possèdent quant à elles une région riche en cystéines permettant un attachement à la membrane via des interactions avec les TIMP (tissue inhibitors of metalloproteases) et les HSPG (Heparan sulfate proteoglycans) présents à la surface cellulaire (Tsuji et al. 2003; Nour et al. 2005; Mayer et al. 2008). Bien que
l’importance biologique de cette récente découverte demeure à élucider, l’association de PACE4 et PC5/6A avec les TIMP et HSPG suggère un rôle physiologique permettant le clivage de différents substrats au niveau extracellulaire. Par exemple, le substrat pro-lefty a été suggéré comme substrat de PC5/6 nécessitant une liaison aux HSPG pour pouvoir être clivé (Mayer et al. 2008).
Figure 3 : Localisation sub-cellulaire des proprotéines convertases
Fonctions des proprotéines convertases
Les PC ont pour rôle de participer à l’activation, et parfois à l’inactivation de différents précurseurs protéiques issus des voies de sécrétion cellulaires. Parmi ces substrats, on retrouve différentes hormones peptidiques, récepteurs, molécules d’adhésion, enzymes et
Les PC ont des patrons de localisation sub-cellulaire distincts. Les PC sont retrouvées dans les voies de sécrétion constitutives et régulées. Certaines PC peuvent être localisées à la membrane via un domaine transmembranaire ou par une interaction avec des protéines membranaires. Adapté de (Couture et al. 2011)
protéines d’origine virale ou bactérienne (Seidah et Chretien 1999; Couture et al. 2011; Seidah 2011). Les PC similaires à la kexine reconnaissent et clivent leurs substrats selon le motif minimal consensus (K/R)-(X)0,2,4,6-(K/R)ê, où ê représente le site de clivage et X représente l’ensemble des acides aminés (Figure 4). Suivant le clivage par les PC, les résidus basiques nouvellement exposés en C-terminal sont séquentiellement enlevés par des carboxypeptidases (Bergeron et al. 2000).
Figure 4 : Motifs de reconnaissance des proprotéines convertases
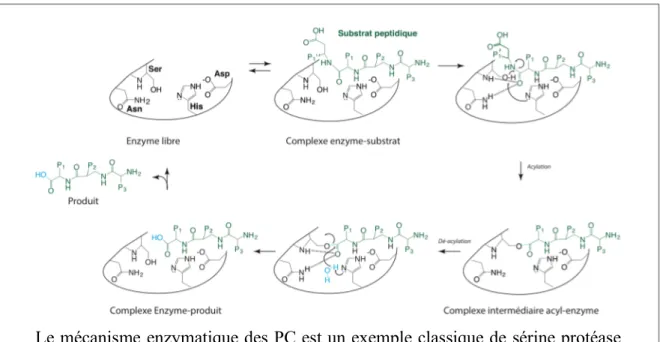
Mécanisme enzymatique des proprotéines convertases
Comme la majorité des sérines protéases de la famille des subtilisines, les PC clivent le lien peptidique ciblé via un mécanisme classique faisant intervenir la triade catalytique Ser, His et Asp (Rockwell et Thorner 2004) (Figure 5). Suivant la liaison du substrat par affinité avec la fente catalytique de l’enzyme et la formation d’un complexe enzyme-substrat non covalent, une réaction d’acylation a lieu rapidement (Hedstrom 2002). Dans cette réaction, l’histidine retire un proton de la sérine alors que l’asparagine permet la stabilisation de l’histidine nouvellement protonée. Alors que le groupement nucléophile hydroxyl de la sérine, dont le caractère nucléophile est augmenté par sa déprotonation, attaque le groupe carbonyl du lien peptidique au niveau du substrat, un lien ester covalent est formé entre la sérine de l’enzyme et le produit de clivage N-terminal. À cette étape, le produit de clivage C-terminal est libéré, comprenant une extrémité N-terminale nouvellement formée. L’intermédiaire acylenzyme est ensuite hydrolysé par une molécule d’eau, générant le
Les PC clivent leurs substrats en C-terminal d’un motif dibasique. La nomenclature pour les substrats des protéases identifie chaque position par un numéro en référence au site de clivage. Ainsi, en N-terminal du site de clivage on retrouve les positions P1, P2, P3 et les suivantes alors qu’en C-terminal du site de clivage ses positions sont nommées P1’, P2’, etc.
produit N-terminal de clivage. Durant l’acylation et la déacylation du substrat, le résidu asparagine hautement conservé entre les PC participe au clivage en stabilisant l’oxyanion de l’intermédiaire et en permettant la stabilisation du complexe enzyme-substrat. Cette dernière étape de déacylation du complexe serait l’étape limitante, puisque l’énergie d’activation y est supérieure (Hedstrom 2002; Rockwell et Thorner 2004).
Figure 5 : Mécanisme enzymatique des proprotéines convertases
Fonctions uniques et redondantes des proprotéines convertases
Le clivage par les PC est un processus finement régulé et spécifique. La notion de spécificité de clivage des substrats par les PC fait référence à différents niveaux de complexité.
Le mécanisme enzymatique des PC est un exemple classique de sérine protéase faisant intervenir la triade catalytique Asp-His-Ser dans un relais de charge. Inspirée de (Rockwell et Thorner 2004)
Le premier niveau représente la spécificité de séquence. Pour qu’un clivage survienne, le polypeptide doit comporter le motif consensus de clivage et ce motif doit être localisé dans une région accessible de la chaîne polypeptidique. Ainsi, il a été reconnu que deux régions accessibles au solvant d’environ 10 résidus de part et d’autre de la séquence de reconnaissance sont généralement présentes dans les substrats naturels des PC (Tian et al. 2011).
Puisque les PC présentent une forte homologie au sein de leur site actif et puisqu’ils reconnaissent le même motif consensus, il est possible d’observer que plus d’une PC clive le même substrat in vitro, selon une cinétique variable (Taylor et al. 2003; Remacle et al. 2008; Seidah et Prat 2012; Seidah et al. 2013). Bien que le motif consensus de clivage soit conservé entre ces sept membres, plusieurs évidences démontrent un certain niveau de spécificité de clivage additionnel pour chaque PC en conditions cellulaires. Ainsi, la régulation spatiotemporelle de l’activation des PC, ainsi que leur localisation cellulaire influence leur capacité à cliver un substrat donné et représente le deuxième niveau de spécificité de clivage (Seidah et al. 2013). Le troisième niveau de spécificité représente l’expression tissulaire des PC. Les PC ont des patrons de distribution variable, allant de tissus spécialisés (PC1/3, PC2 et PC4) à une expression large (PC5/6, PC7 et PACE4) voir même ubiquitaire (furine) (Tableau 1). Ce niveau de complexité supplémentaire dicte dans une certaine mesure, l’identité des substrats pouvant être clivés par une PC.
Alors que les PC à activité similaire à kexine partagent le même motif canonique de reconnaissance de substrats et que les patrons de localisation sub-cellulaire et de distribution tissulaire se chevauchent entre les membres des PC, un niveau important de redondance fonctionnelle a été observé dans la famille des PC. L’étude des phénotypes des animaux transgéniques a d’ailleurs révélé des informations cruciales sur les rôles physiologiques de certaines PC.
Phénotypes des animaux transgéniques
Le clivage par un ou des membres de la famille des PC est un processus finement régulé. La spécificité de séquence, la localisation spatiotemporelle et le patron d’expression d’un
substrat représentent tous des niveaux de régulation de l’activité protéolytique pour une PC donnée. Ainsi, bien que plus d’une enzyme de cette famille puisse cliver un même substrat in vitro, il est possible que ces observations ne représentent pas la maturation du substrat en conditions physiologiques. Les observations phénotypiques réalisées à l’aide d’animaux transgéniques ont révélé plusieurs informations sur le rôle des PC in vivo (Tableau 2). Le phénotype des souris déficientes en PC1/3 ou PC2 démontre leur implication dans la croissance et le métabolisme, ce qui est constant avec leur expression au sein des tissus neuroendocriniens et leur localisation au niveau des voies de sécrétion régulées. Ainsi, chez les souris PC1/3 KO, une mort périnatale importante a été observée et les animaux homozygotes survivants ont démontré un retard de croissance, des diarrhées importantes, une hyperproinsulinémie ainsi qu’une altération dans la maturation du GHRH, du proglucagon, de la proinsuline et une maturation partielle du peptide POMC (Zhu et al. 2002a; Zhu et al. 2002b). Les souris PC2 KO, bien que viables à la naissance démontrent un retard de croissance par la suite ainsi qu’une hypoglycémie à jeun corrélée avec des niveaux circulants de glucagons inférieurs à la normale (Furuta et al. 1997). Nombreuses études ont caractérisé la maturation de différents précurseurs neuroendocriniens et ont révélé une maturation altérée des peptides proCCK (Rehfeld et al. 2002), proneurotensine (Villeneuve et al. 2002), prodynorphine (Berman et al. 2000), pro-nociceptin et POMC (Allen et al. 2001). L’étude du phénotype des souris déficientes en PC4 a également permis de confirmer l’implication de cette enzyme, exprimée au niveau des cellules germinales dans les processus liés à la reproduction. Ainsi, les souris PC4 KO démontrent une fertilité réduite et le peptide Pro-Pituitary Adenylate Cyclase- Activating Peptide a été identifié comme substrat unique à PC4 (Li et al. 2000).
Les modèles d’animaux transgéniques ont également démontré un rôle important des PC lors de l’embryogenèse. Par exemple, les souris présentant une mutation perte-de-fonction au niveau de la furine décèdent entre les jours e10,5 et e11,5 démontrant l’importance de cette enzyme au courant du développement prénatal (Roebroek et al. 1998). Des animaux KO conditionnels, dont l’expression de furine n’est altérée que dans certains tissus ont ensuite été élaborés afin d’étudier le rôle de furine dans ces tissus. Dans un modèle de souris dont l’expression de la furine est inhibée spécifiquement dans les cellules endothéliales, les souris hétérozygotes présentent des défauts importants au niveau du
développement cardiaque et ce phénotype est létal dès les premières heures post-partum (Kim et al. 2012). Cette étude a identifié les molécules proendothéline-1, pro-adrénomédulline et proTGFβ-1 comme substrats uniques à la furine dans les cellules endothéliales (Kim et al. 2012). À l’opposé, l’élaboration d’un KO partiel aux cellules hépatiques a permis de révéler des fonctions redondantes de la furine dans ce tissu, puisqu’aucun phénotype n’a été observé chez ces souris transgéniques (Roebroek et al. 2004). L’inactivation de l’enzyme PC5/6 est quant à elle létale lors du développement embryonnaire, dès le jour e4,5 (Essalmani et al. 2006) alors qu’un KO confiné à l’épiblaste mais non aux tissus extraembryonnaires s’est avéré létal dès les premières heures de naissance (Essalmani et al. 2008). Les souris PC5/6 KO présentent des défauts de développement, attribuables à une maturation altérée du substrat GDF11 (Essalmani et al. 2008).
Chez la PACE4, une PC fortement homologue à PC5/6, le KO a des conséquences variables selon la souche (background) de la souris. Chez une souche hybride 129S6 x C57BL, les souris KO sont viables à 75% mais présentent des malformations craniofaciales selon une pénétrance variable (Constam et Robertson 2000). Par contre, chez la souche C57BL, ce phénotype est grandement atténué et les souris sont peu affectées. (Couture et al. 2011; Malfait et al. 2012) Aucun substrat de PACE4 n’a été clairement identifié par ces études, ce qui suggère une fonction redondante de cette enzyme avec d’autres membres de la famille des PC (Scamuffa et al. 2006). Une autre étude a récemment démontré une réponse à la douleur altérée chez les souris PACE4 KO en réponse à la substance P, mais non en réponse aux stimulus mécaniques ou thermiques, ce qui suggère l’importance de cette PC dans la signalisation en réponse à la substance P (Malfait et al. 2012). Cette même étude a également observé un polymorphisme chez l’humain dans le gène PCSK6 atténuant la douleur chez les patients atteints d’ostéoarthrite.
Les animaux PC7 KO semblent quant à eux démontrer une redondance fonctionnelle importance pour cette enzyme. Mis à part une réponse altérée au stress ainsi que des troubles de l’apprentissage et de la mémoire, ces souris ne présentent aucune altération physique (Seidah et Prat 2012; Wetsel et al. 2013). Alors que l’enzyme PC7 est largement répandue, ceci suggère un rôle unique de PC7 au niveau du système neuronal et des fonctions physiologiques redondantes dans les autres tissus (Seidah et Prat 2012).
L’élaboration des souris KO a permis de démontrer qu’il existe des substrats uniques pour chaque PC. Par contre, l’absence de phénotype clair chez certaines souris démontre également qu’il existe des chevauchements dans les rôles physiologiques in vivo. Bien que l’étude du phénotype des animaux KO ont permis d’identifier certains substrats des PC, il est important de comprendre que le phénotype observé peut être influencé par une multitude de substrats. De plus, le rôle critique de certaines PC dans le développement embryonnaire peut freiner l’étude du rôle de ces enzymes chez l’adulte. Bien que les animaux KO apportent des pistes d’études intéressantes sur le rôle des PC in vivo, d’autres études seront nécessaires afin d’étudier les substrats des PC in vivo.
Tableau 2 : Phénotypes associés à la délétion des proprotéines convertases in vivo Proprotéine
convertase Phénotype Substrats impliqués
PC1 Mortalité péri-natale partielle,
Microsomie, Troubles gastro-intestinaux, hyperproinsulinémie
GHRH, POMC, Proinsuline, Proglucagon
PC2 Viable et normale à la naissance, retard
de croissance, hypoglycémie Proinsulin, proglucagon, prosomatostatin, proCCK, neurotensine/ neuromedin N,
prodynorphine, pronociceptin, POMC
Furine Létalité embryonnaire jour e10,5-11,5 Létalité post-partum si KO dans cellules endothéliales
Aucun phénotype si KO dans cellules hépatiques
proendothéline-1, pro-adrénomédulline et proTGFβ-1 dans les cellules endothéliales.
PC5/6 Létalité embryonnaire jour e4,5-7,5 Létalité post-partum si KO dans l’épiblaste
Non identifiés. Substrats proposés incluent la famille des PDGF, BMP et Lefty
PACE4 Viabilité de 75% et malformations craniofaciales chez les souris 129S6xC57BL. Le phénotype est plus léger chez les souris C57BL
Famille du TGFβ, et BMP
PC7 Physiologie normale. Perte de
l’anxiété. Troubles de l’apprentissage et de la mémoire
Pro-facteur neurotrophique dérivé du cerveau (pro-Brain-derived neurotrophic factor)
PC4 Fertilité réduite Pro-PACAP (Pituitary Adenylate
Cyclase- Activating Peptide) Résumé des phénotypes observés à partir des modèles de souris KO pour les PC. Figure adaptée de (Taylor et al. 2003; Scamuffa et al. 2006; Seidah et Prat 2012)
Implications des proprotéines convertases en conditions pathologiques
Les PC occupent un rôle important dans le maintien de l’homéostasie. Cependant, les enzymes de la famille des PC ont également été identifiées comme molécules clés dans différentes pathologies et ont été suggérées comme cibles thérapeutiques pour différentes applications. Celles-ci incluent des maladies neurodégénératives, l’ostéoarthrite, les infections et le cancer (Artenstein et Opal 2011; Couture et al. 2011; Seidah et Prat 2012). De façon générale, les PC sont impliquées directement ou indirectement dans l’activation de nombreuses molécules permettant l’apparition ou l’évolution de ces pathologies.
Implication des proprotéines convertases dans le cancer
Substrats des proprotéines convertases liés à la progression tumorale
En condition saine, l’équilibre entre les signaux de prolifération et d’apoptose est finement régulé et intervient dans les processus de croissance, de guérison et d’homéostasie. Chez la cellule cancéreuse, une perturbation de cet équilibre entraine une prolifération désordonnée, une survie cellulaire ainsi que la capacité de se disséminer et former des métastases (Reynolds et Kyprianou 2006). En condition néoplasique, nombreux facteurs de croissance, cytokines, molécules d’adhésion ou protéases sont surexprimés (Hanahan et Weinberg 2011). Ces molécules pourront avoir une action autocrine sur la cellule cancéreuse ou encore engendrer des changements au niveau de l’environnement tumoral, par une action paracrine sur d’autres types cellulaires. Parmi ces molécules, nombreuses sont produites sous forme de zymogène nécessitant une activation protéolytique par les PC (Khatib et al. 2002; Bassi et al. 2005a; Couture et al. 2011). Cette implication dans l’activation de nombreuses molécules clés suggère un rôle important de cette famille d’enzymes dans l’évolution du cancer. La Figure 6 illustre des exemples de substrats validés des PC ainsi que leur rôle au niveau de la progression tumorale. Ces substrats peuvent être divisés en trois grandes catégories : Les facteurs de croissance et leurs récepteurs, les protéases ainsi que les molécules d’adhésion.
Figure 6 : Implication des proprotéines convertases dans la progression tumorale
Les facteurs de croissance et leurs récepteurs ont un rôle important dans la progression tumorale et représente d’ailleurs une cible thérapeutique pour le traitement de nombreux cancers (Witsch et al. 2010). Ces molécules sont souvent impliquées dans des boucles d’activation alors que l’expression des facteurs de croissance et de leurs récepteurs est augmentée dans les cellules néoplasiques (Witsch et al. 2010; Hanahan et Weinberg 2011). Les facteurs de croissance et récepteurs clivés par la famille des PC incluent la famille du Pro-IGF (Duguay et al. 1998), Pro-IGFR (Khatib et al. 2001), Pro-PDGF (Siegfried et al. 2003b), Pro-TGFβ1 et autres précurseurs de la famille du TGF (Dubois et al. 1995; Constam 2014), Pro-VEGF (Siegfried et al. 2003a) et nombreux autres facteurs de croissance validés ou prédits (Bassi et al. 2000; Khatib et al. 2002). Ces molécules ont des rôles diversifiés dans la progression tumorale. Ils peuvent intervenir au niveau de la
Parmis les substrats des PC, de nombreuses molécules favorisent la tumorigénèse, la progression tumorale et/ou les processus de dissémination et métastases. Inspirée de (Artenstein et Opal 2011)
prolifération, de la différenciation, de la survie cellulaire et de la résistance à l’apoptose. Ils peuvent également avoir une action chemotaxique et participer à l’angiogenèse ou la lymphangiogénèse (Witsch et al. 2010).
Les PC sont également connues pour activer différentes métalloprotéinases, (e.g. Str-3, MT1-MMP, ADAM, ADAM-TS) (Khatib et al. 2002; Bassi et al. 2005a; Artenstein et Opal 2011). Ces molécules ont des rôles reconnus dans les processus de métastases puisqu’ils participent à la dégradation de la membrane basale ou la matrice extracellulaire, favorisant la dissémination ou le remodelage du tissu nouvellement colonisé (Vihinen et Kahari 2002; Hadler-Olsen et al. 2013). Elles auraient également un rôle au niveau des processus de néovascularisation en participant au relargage de différentes molécules ayant un effet angiogénique, par exemple, le VEGF-A qui est initialement retenu par les HSPG présents à la membrane et dans la matrice extracellulaire (Harris et Achen 2013). L’expression de ces métalloprotéinases est d’ailleurs corrélée à un stade avancé et à un faible pronostique dans de nombreux cancers (Vihinen et Kahari 2002).
La troisième catégorie de substrats des PC liés au cancer représente les molécules d’adhésion. Les PC sont impliquées dans la maturation de la chaine α des intégrines (Lissitzky et al. 2000; Bergeron et al. 2003) ainsi que dans le clivage des cadhérines (Posthaus et al. 1998; Posthaus et al. 2003; Muller et al. 2004). Les intégrines sont des récepteurs hétérodimerique permettant la reconnaissance de différents motifs de liaison (ex : RGD) présents au sein de molécules de la matrice extracellulaire. La composition de l’hétérodimère pouvant être formé à partir d’une combinaison de 18 sous-unités α ainsi que 8 sous-unités β dicte la spécificité de liaison au ligand. Ainsi, la variété d’intégrines présentes à la membrane influence la capacité de liaison d’une cellule à la matrice extracellulaire (Desgrosellier et Cheresh 2010). Cette famille de molécules d’adhésion participe à la progression tumorale en favorisant l’établissement des micrométastases au sein de niches nouvellement colonisées, mais est également impliquée dans les processus de survie cellulaire et de prolifération (Desgrosellier et Cheresh 2010). D’ailleurs, les intégrines représentent une cible thérapeutique et certains inhibiteurs sont actuellement en développement clinique pour une application dans le traitement du cancer (Goodman et Picard 2012). Les PC participent également à la maturation protéolytique des molécules de
la famille des cadhérines (Posthaus et al. 1998; Posthaus et al. 2003; Muller et al. 2004). Ces molécules sont des récepteurs impliqués dans l’adhésion entre cellules et une perte de la fonction des cadhérines est correlée au niveau d’agressivité des tumeurs (Muller et al. 2004). Ainsi, la maturation des cadhérines, principalement effectuée par furine, favorise le maintien de l’architecture tissulaire et diminue le potentiel invasif chez les lignées cellulaires observées (Muller et al. 2004). Une étude a cependant démontré un rôle contradictoire des PC alors qu’en condition maligne, PC5/6 serait en mesure d’effectuer un second clivage, à un site alternatif, menant à l’inactivation de la N-cadhérine et à l’augmentation des capacités de migration cellulaire (Maret et al. 2012). Ceci démontre que ces enzymes ont un rôle important dans de nombreuses fonctions cellulaires, mais pointe également vers un rôle des PC dans la transformation maligne.
Nombreux substrats des PC ont un rôle reconnu dans la progression tumorale. Ces substrats ont des effets au niveau de la croissance et de la prolifération cellulaire, des processus d’angiogenèse ainsi dans le remodelage tissulaire permettant la dissémination et l’établissement de métastases. Bien que le rôle individuel des PC dans la maturation de ces précurseurs reste à définir, ces observations démontrent l’implication de la famille des PC dans le processus complexe du développement des tumeurs humaines.
Expression des proprotéines convertases dans les cancers humains
Les processus néoplasiques sont complexes et reposent sur une série de changements phénotypiques permettant la transformation maligne progressive d’une cellule ou une population de cellules. Lors de cette évolution, l’altération de l’expression de diverses protéines permet de moduler la prolifération et la survie cellulaire, la communication entre cellules et le remodelage du microenvironnement (Hanahan et Weinberg 2000; Hanahan et Weinberg 2011). Puisque de nombreuses protéines impliquées dans ces changements phénotypiques requièrent une maturation par les PC, il est postulé que le clivage par cette famille d’enzyme représente une étape cruciale dans la progression tumorale (Khatib et al. 2002; Bassi et al. 2005a; Couture et al. 2011). Ainsi, l’altération de l’expression des PC dans le cancer a été le sujet de nombreuses études, dans le but de comprendre l’implication de ces enzymes dans la pathologie du cancer et afin d’identifier un ou plusieurs membres des PC comme cible thérapeutique potentielle.
La Tableau 3 résume les études qui ont évaluées les transcrits des PC dans des tissus humains. Alors que l’expression des enzymes PC1/3 et PC2 est généralement restreinte aux cancers d’origine neuroendocrine, les PC des voies de sécrétion constitutives semblent être surexprimées dans de nombreux cancers (Tableau 3). Ces études démontrent qu’une ou plusieurs PC peuvent agir de concert afin de promouvoir la prolifération tumorale et que l’expression des PC dans les cancers semble être tissu spécifique. Alors que PACE4 est surexprimée dans le cancer de la prostate (D'Anjou et al. 2011) et le cancer du sein (Cheng et al. 1997), cette enzyme démontre des niveaux réduits dans les cancers du poumon (Mbikay et al. 1997). Le même phénomène est observé pour l’enzyme PC7, dont la surexpression semble impliquée dans le cancer du sein (Cheng et al. 1997) et de l’ovaire (Page et al. 2007; Longuespée et al. 2014). Quant à l’enzyme furine, l’aberration de son expression semble être un phénomène plus généralisé, alors que cette enzyme est impliquée dans le cancer du poumon (Schalken et al. 1987; Mbikay et al. 1997), du sein (Cheng et al. 1997), de la tête et du cou (Bassi et al. 2001b) et de l’ovaire (Page et al. 2007; Longuespée et al. 2014). De plus, il est intéressant de noter que l’expression de la furine à été corrélée à l’agressivité des tumeurs, alors que son expression augmente dans les adénocarcinomes de la tête et du cou à des stades avancés (Bassi et al. 2001b). Une étude a également proposé que l’expression de la furine puisse représenter un marqueur pronostique pour le cancer de l’ovaire, alors que des hauts nivaux de furine corrèlent avec une faible survie sur 5 ans (Page et al. 2007). Par contre, la valeur pronostique de la furine est limitée à certains types de cancer seulement, puisque l’expression de cette enzyme est corrélée avec une meilleure survie postopératoire chez les patients atteints de carcinome hépatocellulaire (Huang et al. 2012). Ceci démontre la complexité des processus de progression tumorale et met de l’avant la pertinence d’étudier la contribution individuelle de chaque PC pour différents types de cancer.
Tableau 3 : Expression des proprotéines convertases dans les cancer humains
Cancer Expression des PC
Adénome hypophysaire PC1/3 et PC2 surexprimées
Poumon
(Schalken et al. 1987) (Creemers et al. 1992) (Mbikay et al. 1997)
Furine : Surexpression (adénocarcinome)
PACE4 : Expression diminuée (Tout types de cancers)
PC1/3 et PC2 : Surexpression dans les carcinomes d’origine neuroendocrine (Carcinome à petites cellules et tumeur carcinoïde)
Sein
(Cheng et al. 1997) Surexpression de PC1/3, furine, PACE4 et PC7 dans tous les tissus néoplasiques observés. PC2 et PC5/6 non détectés dans ces tissus.
tête et cou
(Bassi et al. 2001b) Furine surexprimée dans les carcinomes métastatiques Prostate
(D'Anjou et al. 2011) (Klee et al. 2012) (Kang et al. 2014)
Expression de PACE4 augmentée dans les tissus néoplasiques PC7 et furine : Niveaux d’expression inchangés
PACE4 détectée dans le sang de patients atteints du cancer de la prostate
Ovaire
(Fu et al. 2003) (Page et al. 2007)
(Longuespée et al. 2014)
Expression de furine fortement corrélée avec un faible pronostique
Expression de PACE4 diminuée, niveaux de furine et PC7 inchangésa
Niveaux augmentés de PACE4a, furine, PC5/6 et PC7 dans les tumeurs primaires, ascites et métastases
Les niveaux d’expression des PC ont été évalués dans différents tissus humains. Ces études démontrent que les profils d’expression des PC diffèrent pour chaque pathologie ou même selon l’avancement de la maladie.
a.Les études réalisées sur les tissus issus du cancer de l’ovaire démontrent des disparités. Alors que Fu et al et Longuespée et al rapportent une surexpression de furine ou plusieurs PC, l’étude par Page et al semble démontrer une sous-expression de PACE4. L’interrogation de la base de donnée OncomineTM démontre quand à elle une grande variabilité de l’expression des PC dans le cancer de l’ovaire mais semble pointer vers une augmentation générale du profil des PC.
Potentiel thérapeutique des proprotéines convertases
Outre les études réalisées sur des tissus humains, l’étude des fonctions pathophyiologiques des PC à été effectuée à l’aide de lignées cellulaires ou de modèles animaux. Récemment, il a été démontré que la surexpression de PACE4 au niveau de l’épiderme de souris transgénique augmente la susceptibilité de développer un carcinome épidermoïde en réponse à une exposition aux rayonnements UV ou à des agents carcinogènes (Bassi et al. 2005b; Fu et al. 2013; Bassi et al. 2014). Dans ce modèle d’étude, un inhibiteur à large
spectre des PC appliqué de façon locale parvient à diminuer la croissance tumorale ainsi que le nombre de métastases (Bassi et al. 2010). Cet exemple démontre non seulement le rôle des PC dans l’initiation et la prolifération au sein des tumeurs, mais illustre également le potentiel thérapeutique des inhibiteurs des PC pour le traitement de ce type de cancer.
Afin d’exploiter la famille des PC comme cibles thérapeutiques, il est pertinent d’étudier la contribution individuelle de chaque enzyme en conditions néoplasiques. Par une inhibition de l’expression de chaque PC, différentes études ont étudié le rôle individuel des membres de cette famille d’enzyme dans la progression tumorale (Scamuffa et al. 2008; D'Anjou et al. 2011; Couture et al. 2012; Fu et al. 2014; Longuespée et al. 2014). Ces études ont permis de relever certaines fonctions uniques des PC. Par exemple, il a été démontré avec des techniques d’ARN interférent que l’enzyme furine est la seule PC permettant la maturation de l’IGF-R dans les lignées de cancer colorectal HT29 et CT26 (Scamuffa et al. 2008). Cependant, tout comme pour les observations réalisées avec les tissus humains, ces études démontrent que le rôle de chaque PC dans la progression tumorale est différent pour chaque type de cancer.
Le cancer de la prostate
La prostate est une glande du système reproducteur masculin à fonction exocrine. Située sous la vessie, elle est impliquée dans la production du liquide séminal. La prostate comprend un épithélium sécrétoire, un épithélium basal et des cellules stromales incluant des cellules musculaires lisses, fibroblastes, cellules endothéliales et des cellules inflammatoires. La grande majorité des cancers de la prostate sont des adénocarcinomes, affectant les cellules épithéliales de la prostate (Humphrey 2012). Bien que des facteurs environnementaux ou héréditaires aient été associés au cancer de la prostate, l’âge est le principal facteur de risque associé au cancer de la prostate (Leitzmann et Rohrmann 2012). Ce cancer est détecté lors d’examen de routine par une palpation de la prostate (Ro et al. 2012). Le dosage de l’antigène prostatique sérique (APS), une protéine sécrétée par les cellules saines ou tumorales de la prostate, est également un test utilisé au Canada. Puisqu’un dosage élevé de l’APS peut indiquer une condition non cancéreuse (ex :
hyperplasie, prostatite) et n’est pas exclusif aux conditions néoplasiques (D'Amico et al. 2003), le diagnostic sera confirmé par une biopsie de la prostate (Ro et al. 2012).
Le cancer de la prostate est classifié selon le grade histopathologique et le stade clinique. Le grade histopathologique est représentatif de l’agressivité du cancer et est quantifié par la cote de Gleason, attribuée par un pathologiste suivant la biopsie (Kantoff et al. 2002; Ro et al. 2012). Le stade clinique est quant à lui représentatif de l’étendue du cancer dans l’organisme (Kantoff et al. 2002). Alors que le cancer de la prostate peut se présenter comme une pathologie à progression lente, certains cancers progressent davantage et s’étendent aux organes reproducteurs avoisinants, tels que les vésicules séminales, l’urètre, la vessie et le rectum et aux nœuds lymphatiques pelviens pour ensuite former des métastases dans des tissus distants, notamment les os (Kantoff et al. 2002).
Thérapies associées au cancer de la prostate
La décision des options thérapeutiques à envisager pour chaque patient est guidée par le stade pathologique, représentatif de l’étendue de la maladie dans l’organisme et par le grade histopathologique et parfois par les taux de l’APS (D'Amico et al. 2003).
Chez les patients à faible risque, la surveillance active est une option thérapeutique généralement envisagée pour les hommes chez lesquels des traitements plus intensifs seraient jugés risqués, notamment en raison de l’âge avancé ou l’existence d’une autre pathologie existante (Kantoff et al. 2002). La prostatectomie radicale est une option de traitement chirurgicale, visant à éliminer la tumeur primaire en retirant la prostate (Ro et al. 2012). Une radiothérapie peut également être administrée de façon concomitante à la chirurgie ou encore comme traitement principal afin de limiter la survie de cellules cancéreuses au site primaire. Alors qu’il y a des indications de récurrence suivant une thérapie initiale ou si la pathologie est associée avec un risque plus élevé de récurrence, la thérapie hormonale est alors envisagée.
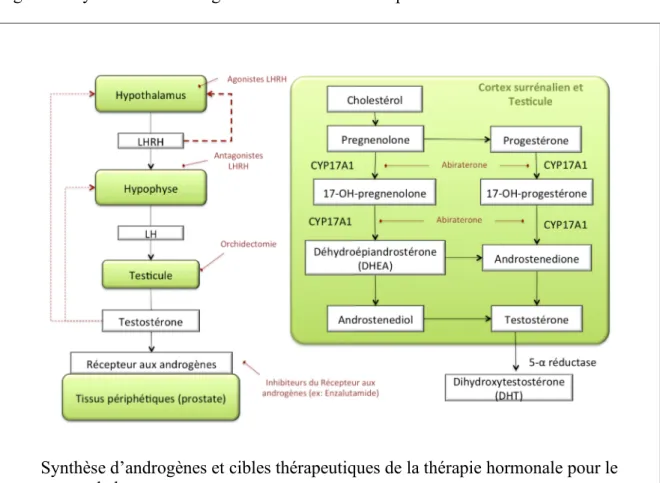
Les hormones androgéniques sont essentielles pour le développement et le maintient de l’homéostasie de la prostate (Amaral et al. 2012). Durant les phases initiales du développement et lors de l’évolution du cancer de la prostate, les cellules néoplasiques sont dépendantes de l’activité normale du récepteur androgénique. Les androgènes exercent leurs fonctions cellulaires via la liaison au récepteur androgène, un facteur de transcription faisant partie de la famille des récepteurs nucléaires stéroïdiens (Kantoff et al. 2002). La testostérone, la principale hormone masculine circulante, est produite par le testicule suivant une stimulation par le système LHRH/LH de l’axe hypothalamo-hypophysaire (Figure 7) ou par le cortex surrénalien par une stimulation du système CRH/ACTH. Le phénomène de synthèse d’androgènes par les cellules tumorales a également été écrit (McNamara et al. 2013). La testostérone peut ensuite être transformée en dihydroxytestostérone un analogue de forte affinité pour le récepteur androgène, par l’action de la 5-α-réductase dans les tissus périphériques, dont la prostate (Figure 7).
Figure 7 : Synthèse des androgènes et cibles de la thérapie hormonale
Différentes stratégies thérapeutiques actuellement utilisées en clinique visent à interférer avec l’action des androgènes afin de réduire la progression tumorale du cancer de la prostate (Figure 7). L’orchidectomie (ablation chirurgicale des testicules) a été la première forme de thérapie hormonale décrite pour le cancer de la prostate (Hellerstedt et Pienta 2002; Ro et al. 2012). De nos jours, les thérapies hormonales pharmacologiques sont tout aussi efficaces que l’orchidectomie et sont donc généralement privilégiées (Hellerstedt et Pienta 2002). La première forme de thérapie hormonale généralement administrée est l’utilisation d’antagonistes du LHRH, qui agit directement sur l’axe hypothalamo-hypophysaire afin de prévenir la relâche de LH et la production subséquente d’hormone androgène dans le testicule (Amaral et al. 2012). Alternativement, un agoniste LHRH peut être administré et a pour effet d’engager un mécanisme de rétro-inhibition au niveau de l’hypothalamus et bloquer la sécrétion de LHRH dans cet organe. Puisque les agonistes
Synthèse d’androgènes et cibles thérapeutiques de la thérapie hormonale pour le cancer de la prostate.