يملعلا ثحبلاو يلاعلا ميلعتلا ةرازو
Ministère de l’enseignement supérieur et de la recherche scientifique
Université Badji Mokhtar - Annaba
ةبانع
-
راتخم يجاب ةعماج
Badji Mokhtar University - AnnabaAnnée / 2019
Faculté des Sciences Département de Chimie
THÈSE
Présentée en vue de l’obtention du diplôme de Doctorat en Sciences
Option
Chimie-physique des matériaux
Par
Mme OULABBAS Amel
Devant le jury
Président :
Mr. Nasser Eddine BELIARDOUH Professeur Université Badji Mokhtar Annaba Rapporteur :
Mme. Sihem ABDERRAHMANE Professeur Université Badji Mokhtar-Annaba Examinateurs :
Mr. Tahar DOUADI Professeur Université Ferhat Abbas Sétif 1 Mr. Ahmed ZOUAOUI Professeur Université Ferhat Abbas Sétif 1
Effets des inhibiteurs verts sur la corrosion des
3
R E S U M E
L’extrait de cladodes de l’Opuntia Ficus Indica (O.F.I.) présent à l’Est Algérien (Annaba) et celui de l’Aloe Vera importé de l’Amérique du nord, ont fait l’objet de notre travail dans le but d’étudier leurs efficacités inhibitrices sur deux aciers ordinaires différents et dans trois milieux acides, 1M H3PO4 , 0.5M H3PO4 et 0.5M H2SO4.
Plusieurs méthodes d’analyses ont été utilisées, telles que la gravimétrie, les méthodes électrochimiques stationnaires (la polarisation potentiodynamique et la chronoampérométrie), transitoires (Spectroscopie d’Impédance électrochimique (SIE) et la méthode du Potentiel à Zéro Charge (PZC)) ainsi que des méthodes de caractérisation de la surface de l’acier telle que la méthode de mesure de l’angle de contact et la Microscopie Electronique à Balayage (MEB).
Les efficacités inhibitrices obtenues avec la même concentration de 10%(v/v) d’O.F.I seul et d’Aloe Vera seule sont 97.6% et 80.9% respectivement.
Les deux inhibiteurs verts agissent comme inhibiteur mixte, avec les valeurs de résistance de polarisation qui augmentent avec l’augmentation de la concentration en inhibiteur. La synergie des deux extraits avec et sans ajout du KI comme additif, améliore l’efficacité inhibitrice avec l’augmentation de la résistance de polarisation. Nous sommes en présence d’une physisorption pour les deux inhibiteurs, séparément et en synergie. Les caractérisations de l’état de surface des deux aciers confirment les résultats obtenus.
4
A B S T R A C T
The cladodes extract of Opuntia Ficus Indica (O.F.I) wich is found in eastern of Algeria (Annaba) and Aloe Vera brought from North America, were the object of our work with the aim of studying their inhibitory efficiencies, on two different mild steels, and in three acidic environments, 1M H3PO4, 0.5M H3PO4 and 0.5M H2SO4.
To do so, several analytical methods were used, such as gravimetry, stationary electrochemical methods (potentiodynamic polarization and chronoamperometry), transient electrochemical impedance spectroscopy (EIS) and the Zero-Charge Potential (PZC) method. Moreover, we used steel surface characterization methods, as the contact angle measurement method and Scanning Electron Microscopy (SEM).
The obtained results, related to the inhibitory efficiency, were 97.6% and 80.9% respectively for O.F.I and Aloe Vera, separately used at 10% (v / v) of concentration.
Whereas together, these two green inhibitors act as a mixed inhibitor and increase the polarization resistance, while increasing the inhibitor concentration.
The synergy of the two extracts with and without the addition of KI, as an additive, improves the inhibitory efficiency by the increase of the polarization resistance.
Then, based on the above experiments, we may quality this inhibitors case as physisorption of the tows inhibitors when used separately as well as in synergy. The characterizations of the surface condition of the two mild steel samples confirm the obtained results.
5
ص خ ل م
لا صلختسملا
نم جرختسم
بوأ
ايتن
سوكيف
( اكيدنإ
O
.
F
.
I
)
ملا
ت
و
ا
دج
)ةبانع( رئازجلا قرش يف
و
راَبَّصلا
دروتسملا
،ةيلامشلا اكيرمأ نم
ناك
روحم ا
ىلع ةطبثملا ةءافكلا ةسارد لجأ نم انلمع
يتنيع
ن
نم
ذلاوفلا
يداعلا
و
اتعضو ناتللا
ثلاث يف
تائيب
ةيضمح
1
M
4PO
3H
،
5.0
M
4PO
3H
و
5.0
M
4
SO
2H
ثيح
تلل بيلاسأ ةدع تمدختسا
سايق لثم ،ليلح
ةلتكلا نادقف ةقيرطب لقثلا
رهكلا قرطلا ،
ةيئايميكو
لا
ةتباث
،
و
ةيئايميكورهكلا قرطلا
ةددرتملا
و
اضيا
ةيواز سايق ةقيرط لثم بلصلا حطس فيصوت قرط
و لاصتلاا
لا ةقيرط اضيا
صحف
ب
( ينورتكللإا بوكسوركيملا
SEM
.)
اهيلع لوصحلا مت يتلا ةطبثملا ةءافكلا
ل
زيكرتلا سفن
15
٪
)ت / ت(
O.F.I
و
راَبَّصلا
ىدح ىلع لك
يه
6..9
٪
و
95.6
٪
.يلاوتلا ىلع
نا اضيا تزربا اهيلع لصحتملا جئاتنلا
نم لك
هده
ءارضخلا تاطبثملا
لمعت
، طلتخم طبثمك
ك
كلذ
زيكرت ةدايز
طبثملا
ديزي
نم
ةمواقم ميق
باطقتسلاا
.
ىرخا ةهج نم
,
رزآتلا
نيب
امهتسارد تمت نيدلا نيطبثملا
ةفاضإ نودبو عم
KI
ةيلاعف ززعي ةفاضم ةدامك
.باطقتسلاا ةمواقم ةدايز عم طبثملا
سسحتلا ةرهاظ ماما نحن
نيطبثملل ةبسنلاب
تلا يفو ةدح ىلع ،
.رزآ
فيصوت قرط
حطسلا ةلاح صئاصخ
عم ةساردلا هده يف ةمدختسملا
صحلا مت يتلا جئاتنلا دكؤت نيذلاوفلا
لو
.اهيلع
تاملكلا
ةيحاتفملا
:
ءارضخلا تاطبثملا
,
يداعلا ذلاوفلا
,
SIE ,
O.F.I
,
, لكاتلا
وللأا
ف
اري
,
6
Dédicace
A ma défunte mère et mon très cher père
A mon mari
A ma douce princesse LINA
A toute ma famille
A tous mes collègues et amis(es)
A tous ceux qui me sont chers.
7
R E M E R C I E M E N T S
Ce travail de thèse a été réalisé au Laboratoire d’Ingénierie des Surfaces (L.I.S) de l’Université Badji Mokhtar - ANNABA sous la direction de Madame ABDERRAHMANE Sihem, Professeur à l’Université Badji Mokhtar-ANNABA. Tout D’abord, je tiens à lui exprimer ma profonde gratitude pour la confiance qu’elle m’a accordée .Je la remercie pour son soutien et son encadrement scientifique nécessaire à l’accomplissement de ce travail, pour sa disponibilité ainsi que pour son enthousiasme.
Je tiens à adresser mes plus vifs remerciements au Pr. Ramazan Solmaz, de l’université de Bingöl-Turquie, pour m’avoir accueilli dans son laboratoire pour un stage de deux mois, sa disponibilité et ses discussions constructives.
J’exprime ma gratitude au Pr. Nasser Eddine BELIARDOUH, de l’Université Badji Mokhtar-ANNABA, pour avoir accepté de présider mon jury de thèse.
J'exprime également ma reconnaissance aux Pr. Ahmed ZOUAOUI et Pr. Tahar DOUADI, de l’Université Ferhat Abbas Sétif 1, pour avoir accepté d’examiner mon travail de recherche et de faire partie de mon jury de thèse.
Je remercie tous les membres du Laboratoire d’Ingénierie de Surfaces (L. I. S.). Et qu’ils reçoivent l’expression de ma profonde gratitude pour l’ambiance agréable.
Je n’oublie pas de remercier mes chers collègues de l’Unité de Recherche URASM-CRTI,Annaba.
Je tiens aussi à remercier toute personne, qui m’a aidé de près ou de loin pour la réalisation de cette thèse.
8
Table des matières
INTRODUCTION ... 15
CHAPITRE I ... 17
I. SYNTHESE BIBLIOGRAPHIQUE 17 I.1 NOTIONS DE CORROSION DES ACIERS ORDINAIRES ... 18
I.1.1 Introduction ... 18
I.1.2 Les types de corrosion ... 19
I.1.3 Les formes de corrosion ... 19
I.1.4 Corrosion des aciers ordinaires dans les milieux acides ... 24
I.1.5 Lutte contre la corrosion ... 25
I.1.6 Protection de la corrosion par les inhibiteurs ... 26
I.1.6.1 Généralités ... 26
I.1.6.2 Classification des inhibiteurs ... 26
I.1.6.3 Mécanismes et principes d’action ... 30
I.1.6.4 Efficacité d’un inhibiteur de corrosion ... 30
I.1.6.5 Domaines d’emploi des inhibiteurs ... 31
I.2 LES INHIBITEURS VERTS ... 32
I.2.1 La biodégradabilité des inhibiteurs verts ... 45
CHAPITRE II ... 46
II. MATERIAUX ET METHODES ... 46
II.1 PROTOCOLE EXPERIMENTAL ... 47
II.1.1 Composition chimique des aciers ordinaires ... 47
II.1.2 Milieux d’étude ... 48
II.1.3 Inhibiteurs verts utilisés ... 48
II.1.3.1 Préparation des inhibiteurs ... 48
II.2 TECHNIQUE GRAVIMETRIQUE ... 51
II.3 TECHNIQUES ELECTROCHIMIQUES ... 51
II.3.1 Potentiel à circuit ouvert ... 51
II.3.2 Méthode stationnaire (Polarisation potentiodynamique) ... 51
II.3.3 Méthode transitoire (Spectroscopie d’impédance électrochimique (SIE)) ... 52
II.3.4 Méthode du potentiel à zéro charge (PZC) ... 59
II.3.5 La chronoampérométrie ... 60
II.3.5.1 Isothermes d’adsorption ... 60
II.3.6 Méthode de mesure de l’angle de contact... 61
II.3.7 Microscopie électronique à balayage (MEB) ... 62
CHAPITRE III... 64
III. RESULTATS ET DISCUSSION ... 64
III.1 CARACTERISATION COMPARATIVE DES PROPRIETES INHIBITRICES ENTRE L’O.F.I ET L’ALOE VERA SUR L’ACIER XC52 DANS 1M H3PO4 ... 66
III.1.1 Introduction ... 66
9
III.1.3 Polarisation potentiodynamique ... 70
III.1.3.1 Enthalpie libre standard d’adsorption ... 76
III.1.4 Spectroscopie d’impédance électrochimique ... 77
III.1.5 Caractérisation de la surface par Microscopie à Balayage Electronique (MEB) ... 80
III.2 ETUDE COMPARATIVE DES PROPRIETES INHIBITRICES DE L’O.F.I ET L’ALOE VERA SUR UN ACIER ORDINAIRE DANS 0.5 M H3PO4 ... 83
III.2.1 Introduction ... 83
III.2.2 Suivi du potentiel libre ... 83
III.2.3 Polarisation potentiodynamique ... 84
III.2.1 Spectroscopie d’impédance électrochimique ... 87
III.2.2 Méthode du potentiel à zéro charge ... 89
III.2.3 La chronoampérométrie ... 91
III.2.3.1 Isotherme d’adsorption et paramètres thermodynamiques ... 93
III.2.3.2 Enthalpie libre standard d’adsorption ... 96
III.2.4 Caractérisation de la surface par la mesure de l’angle de contact ... 97
III.3 CARACTERISATION COMPARATIVE DES PROPRIETES INHIBITRICES ENTRE L’O.F.I ET L’ALOE VERA SUR L’ACIER ORDINAIRE DANS 0.5 M H2SO4 ... 100
III.3.1 Suivi du potentiel libre ... 100
III.3.2 Polarisation potentiodynamique ... 101
III.3.3 Spectroscopie d’impédance électrochimique ... 104
III.3.4 Isothermes d’adsorption et paramètres thermodynamiques ... 107
III.3.1 Méthode de mesure de l’angle de contact... 111
III.3.2 Caractérisation de la surface par microscope électronique à balayage ... 112
III.4 INFLUENCE DE L’IODURE DE POTASSIUM SUR LES PROPRIETES INHIBITRICES DE L’O.F.I ET DE L’ALOE VERA DANS 0.5 M H3PO4 ... 114
III.4.1 Polarisation potentiodynamique ... 114
III.4.1 Spectroscopie d’impédance électrochimique ... 116
III.4.2 Méthode du potentiel à zéro charge (PZC) ... 118
III.4.3 Méthode de mesure de l’angle de contact... 120
III.5 INFLUENCE DE L’AJOUT DE L’IODURE DE POTASSIUM SUR LES PROPRIETES INHIBITRICES DE L’O.F.I ET L’ALOE VERA DANS 0.5 M H2SO4 ... 123
III.5.1 Polarisation potentiodynamique ... 123
III.5.2 Spectroscopie d’impédance électrochimique ... 125
III.5.3 La chronoampérométrie ... 126
III.5.1 Méthode de la mesure de l’angle de contact... 128
III.6 ETUDE DE L’EFFET SYNERGIQUE DES DEUX INHIBITEURS (O.F.I + ALOE VERA) SANS ET AVEC LE KI SUR LA CORROSION DE L’ACIER ORDINAIRE DANS 0.5M H3PO4 ... 131
III.6.1 Polarisation potentiodynamique ... 131
III.6.2 Spectroscopie d’impédance électrochimique ... 132
III.7 ETUDE DE L’EFFET SYNERGIQUE DES DEUX INHIBITEURS (O.F.I + ALOE VERA) SANS ET AVEC LE KI SUR LA CORROSION DE L’ACIER ORDINAIRE DANS 0.5M H2SO4. ... 136
III.7.1 Polarisation potentiodynamique ... 136
III.7.2 Spectroscopie d’impédance électrochimique ... 138
IV. CONCLUSION GENERALE ... 141
PERSPECTIVES ... 146
10
Liste des illustrations
Figure I.1 Corrosion par piqûres ... 15
Figure I.2.Amorçage (a) et propagation (b) d'une piqûre ... 15
Figure I.3. Représentation schématique d'une pile de corrosion ...16
Figure I.4. Corrosion intergranulaire. ... 17
Figure I.5. Corrosion sélective . ... 17
Figure I.6. Corrosion caverneuse . ... 18
Figure I.7. Corrosion filiforme ... 19
Figure I.8. Corrosion sous contrainte ... 20
Figure I.9 Diagrammes d’Evans montrant le déplacement du potentiel de corrosion dû à la présence d’un inhibiteur de corrosion . ... 20
Figure I.10. Le mécanisme d’action d’un inhibiteur organique agissant par adsorption des molécules inhibitrices sur la surface du métal. ... 21
Figure II.1. Montage de l’extraction Soxhlet (a) et le Rotavapeur (b) ... 49
Figure II.2. La chaine industrielle de production de la pulpe d’Aloe Vera... 50
Figure II.3. Dispositif pour les mesures gravimétriques, A) sans inhibiteur, B) avec inhibiteur. ... 51
Figure II.4. Montage électrochimique. ... 52
Figure II.5. Système électrochimique non linéaire soumis à une perturbation sinusoïdale ... 53
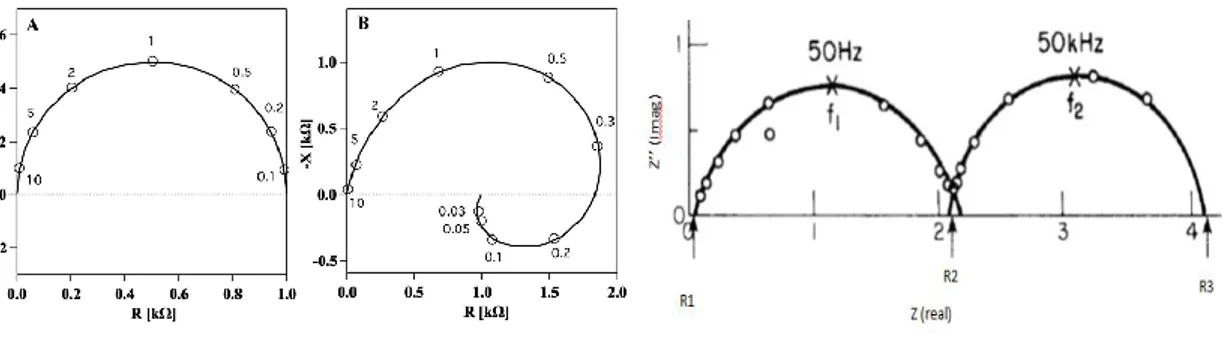
Figure II.6. Courbe de Nyquist et Circuit équivalent correspondant ... 56
Figure II.7. Diagramme d’impédance dans le cas des réactions hétérogènes ... 56
Figure II.8. Impédance du circuit équivalent de Randles: cas d’une couche de diffusion d’épaisseur infinie ... 57
Figure II.9. Modèle électrique équivalent d’un revêtement poreux avec formation d’une double couche à la surface du métal. ... 58
Figure II.10. Schéma électrique équivalent du système électrochimique lors d’un processus de transport de charge et de matière ... 59
Figure II.11. Appareil de mesure de l’angle de contact. ... 62
Figure II.12. Microscope Electronique à Balayage (MEB) ... 63
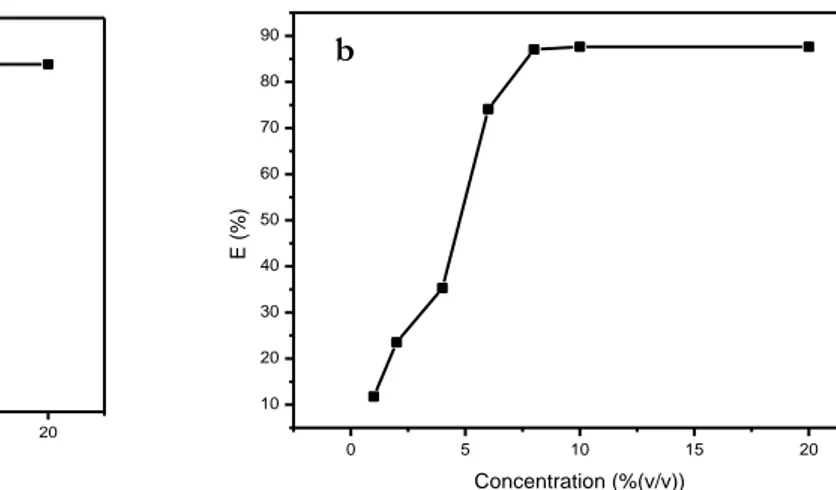
Figure III.1 Efficacités inhibitrices de la corrosion de l’acier XC 52 dans 1M H3PO4 par l’O.F.I. (a) et l’Aloe Vera (b) en fonction du temps d’immersion ... 65
Figure III.2 Efficacités inhibitrices de la corrosion de l’acier XC 52 dans 1M H3PO4 en fonction de la concentration de l’O.F.I. (a) et de l’Aloe Vera (b) . ... 66
Figure III.3 Variation de C/Ɵ en fonction de la concentration de (a) : l’O.F.I et (b) : l’Aloe Vera sur l’acier XC52 dans 1M H3PO4 ... 68
Figure III.4 Courbes de polarisation de l’acier XC52 dans 1M H3PO4 en absence et en présence de (a) : l’O.F.I. et (b) : l’Aloe Vera à différentes concentrations. ... 69
Figure III.5 Tracés de la variation de C/Ɵ en fonction de la concentration de (a) l’O.F.I et (b) l’Aloe Vera. ... 73
11
Figure III.6 Diagrammes d’impédance électrochimique (Nyquist) de l’acier XC52 dans 1M H3PO4, en absence et en présence de (a) l’O.F.I et (b) l’Aloe Vera à différentes concentrations. ... 74 Figure III.7 Circuit équivalent de l’acier immergé dans 1M H3PO4
en absence et en présence de 1, 2, 4 et 6% (v/v) de l’O.F.I. ... 76 Figure III.8 Circuit équivalent de l’acier immergé dans 1M H3PO4
aux concentrations 8 et 10 % (v/v) de l’O.F.I. ... 77 Figure III.9 Circuit équivalent de l’acier immergé dans 1M H3PO4
en présence de l’Aloe Vera aux différentes concentrations.78
Figure III.10 Micrographies MEB de l’acier XC52, dans 1M H3PO4 (a) en absence de l’O.F.I et (b) en présence de l’O.F.I. ... 80 Figure III.11. Suivi du potentiel en circuit ouvert de l’acier ordinaire immergé dans H3PO4 à 0.5M à différentes concentrations de l’O.F.I ... 83 Figure III.12 . Courbes de polarisation de l’acier ordinaire dans 0.5M H3PO4
en absence et en présence de l’O.F.I. (a) et de l’Aloe Vera (b) à différentes concentrations. ... 85 Figure III.13. Diagrammes de Nyquist de l’acier ordinaire dans 0.5 M H3PO4,
en absence et en présence de l’O.F.I (a) et de l’Aloe Vera (b) aux différentes concentrations. ... 86 Figure III.14. Circuit électrique équivalent, obtenu pour l’acier immergé
dans 0.5 M H3PO4, en absence et en présence de l’O.F.I et de l’Aloe Vera à différentes concentrations. ... 90
Figure III.15. Les courbes PZC de l’acier ordinaire dans 0.5 M H3PO4 (a), en présence de 1000ppm O.F.I (b) et en présence de 20% Aloe Vera (c). ... 92 Figure III.16. Variation du courant anodique et cathodique en fonction
du temps en absence et en présence de l’Aloe Vela et l’ O.F.I dans 0.5 M H3PO4 ... 93
Figure III.17.Isothermes d’adsorption en présence de l’O.F.I (a) et de l’Aloe Vera(b). ... 95
Figure III.18. Suivi du potentiel en circuit ouvert de l’acier ordinaire immergé dans H2SO4 à 0.5M à différentes concentrations de l’O.F.I ... 100 Figure III.19 .Courbes de polarisation de l’acier ordinaire dans
0.5M H2SO4 en absence et en présence de l’O.F.I. (a) et l’Aloe Vera (b) à différentes concentrations. ... 102 Figure III.20 Diagrammes d’impédance électrochimique (Nyquist)
de l’acier ordinaire dans 0.5M H2SO4, en absence et en présence de (a) l’O.F.I et (b) l’Aloe Vera à différentes concentrations. ... 103 Figure III.21. Circuit électrique équivalent, obtenu pour l’acier
immergé dans 0.5 M H2SO4, en absence et en présence de l’O.F.I seul et de l’Aloe Vera seule à différentes concentrations. ... 105
Figure III.22. Tracés de la variation de C/θ en fonction de C avec (a) O.F.I et (b) Aloe Vera. ... 106 Figure III.23. Micrographies MEB de l’acier immergé dans 0.5 M H2SO4
(a) et dans 0.5 M H2SO4+ 1000 ppm O.F.I (b). ... 108
Figure III.24. Courbes de polarisation de l’acier ordinaire dans 0.5M H3PO4 en présence de l’O.F.I (a) et l’Aloe Vera (b) sans et avec le KI...109
12
Figure III.25. Diagrammes d’impédance électrochimique (Nyquist) de l’acier ordinaire dans 0.5M H3PO4 en absence et en présence de (a) l’O.F.I et (b) l’Aloe Vera sans et avec ajout de KI...110 Figure III.26. Circuit équivalent de l’acier ordinaire en présence
de KI avec chaque inhibiteur seul. ... 111 Figure III.27. Les courbes PZC de l’acier ordinaire dans 0.5 M H3PO4
en présence de 1000ppm O.F.I +1000 ppm KI (a) et de 20%(v/v) Aloe Vera +1000ppm KI (b). ... 112
Figure III.28. Courbes potentiodynamiques de l’acier ordinaire dans 0.5M H2SO4 en absence et en présence de l’O.F.I.(a) et de l’Aloe Vera (b) sans et avec ajout de KI ... 115 Figure III.29. Nyquists de l’acier ordinaire dans 0.5 M H2SO4,
en absence et en présence de l’O.F.I (a) et de l’Aloe Vera (b) sans et avec ajout de KI. ... 116 Figure III.30 .Variation du courant anodique et cathodique en fonction
du temps en absence et en présence de l’O.F.I sans et avec ajout de KI dans 0.5 M H2SO4 ... 117
Figure III.31. Courbes de polarisation de l’acier ordinaire dans 0.5M H3PO4 en absence et en présence des inhibiteurs d’étude et de leurs synergies. ... 118
Figure III.32. Diagrammes d’impédance électrochimique de l’acier ordinaire dans 0.5 M H3PO4 en absence et en présence des inhibiteurs d’étude et leurs synergies. ... 119
Figure III.33. Circuit électrique équivalent de l’acier immergé dans 0.5 M H3PO4 en présence de la synergie (1000ppmO.F.I+20%(v/v) Aloe Vera) sans et avec ajout de 1000ppm KI. ... 120
Figure III.34. Courbes de polarisation de l’acier ordinaire dans 0.5 M H2SO4 en absence et en présence des inhibiteurs d’étude et leurs synergies………..122 Figure III.35 Diagrammes d’impédance électrochimique de l’acier ordinaire
dans 0.5 M H2SO4 en absence et en présence des inhibiteurs d’étude et leurs synergies. ... 124
Figure III.36. Circuit électrique équivalent de l’acier immergé dans 0.5 M H2SO4 en présence de la synergie (1000ppmO.F.I+20%(v/v) Aloe Vera) sans et avec ajout de 1000ppm KI. ... 125
13
Liste des tableaux
Tableau I.1. L’effet inhibiteur de corrosion des extraits naturels de plantes sur les aciers dans différents milieux acides... 11
Tableau II.1. Composition chimique en % massique de l’acier ordinaire XC 52. ... 24 Tableau II.2. Composition chimique en % massique du second acier ordinaire... 24
Tableau III.1. Vitesses de corrosion et efficacités inhibitrice calculées en présence de l’O.F.I et l’Aloe Vera de l’acier XC52 dans H3PO4 1M en fonction du temps
d’immersion……… 67 Tableau III.2. Vitesses de corrosion et efficacités inhibitrice calculées
en présence de l’O.F.I et l’Aloe Vera de l’acier XC52 dans H3PO4 1M en fonction du temps d’immersion ... 68
Tableau III.3 Paramètres électrochimiques déduits des courbes de polarisation de l’acier XC52 dans 1M H3PO4 en absence et en présence de l’O.F.I. et de l’Aloe Vera à différentes concentrations et efficacités inhibitrices calculées. ... 70 Tableau III.4 Modélisation des courbes de polarisation de l’acier XC52 dans
1M H3PO4 en présence de l’O.F.I et de l’Aloe Vera par différentes isothermes d'adsorption... 81 Tableau III.5. Paramètres électrochimiques déduits des Nyquist de l’acier
XC52 dans 1M H3PO4 en absence et en présence de l’O.F.I seul et de l’Aloe Vera seule et efficacités inhibitrices calculées. ... 85 Tableau III.6 Paramètres électrochimiques déduits des courbes de Tafel
de l’acier ordinaire en absence et en présence de l’O.F.I. et de l’Aloe Vera aux différentes concentrations ainsi que les efficacités inhibitrices calculées. ... 90
Tableau III.7. Paramètres électrochimiques de l’O.F.I et de l’Aloe Vera déduits des courbes de Nyquist et efficacités inhibitrices calculées. ... 108
Tableau III.8. Les valeurs du potentiel d’Antropov calculées de l’acier
ordinaire dans 0.5M H3PO4 en absence et en présence de l’Aloe Vera et de l’O.F.I. ... 110
Tableau III.9 . Variation du taux de recouvrement en fonction de la concentration ... 115
Tableau III.10. Mesures de l’angle de contact dans 0.5 M H3PO4 aprés 1h de temps d’immersion en absence et en présence de l’O.F.I seul et de l’Aloe Vera seul. ... 120
Tableau III.11 Paramètres déduits à partir des courbes de polarisation de l’acier ordinaire en absence et en présence de différentes concentrations
de l’O.F.I et de l’Aloe Vera. ... 121
Tableau III.12 Paramètres électrochimiques de l’O.F.I et de l’Aloe Vera déduits des courbes de Nyquist et efficacités inhibitrices calculées. ... 125
Tableau III.13 . Variation du taux de recouvrement en fonction de la concentration ... 126
Tableau III.14. Mesures de l’angle de contact avec image correspondantes en absence et en présence de l’O.F.I seul et de l’Aloe Vera seule...128
Tableau III.15. Paramètres électrochimiques déduits des courbes de polarisation de l’acier ordinaire en présence de l’O.F.I. seul et de l’Aloe Vera seule sans et avec le KI. ... 130
14
Tableau III.16. Paramètres électrochimiques déduits des courbes de Nyquist en présence de l’O.F.I seul et de l’Aloe Vera seule sans et avec ajout de KI et efficacités inhibitrices calculées. ... 131
Tableau III.17. Les valeurs du potentiel d’Antropov calculées de l’acier ordinaire dans 0.5M H3PO4 en absence et en présence de 1000ppm O.F.I et de 20% (v/v) Aloe Vera sans et avec ajout de 1000 ppm KI . ... 132 Tableau III.18. Mesure de l’angle de contact moyen avec image correspondantes
en absence et en présence de l’O.F.I seul et de l’Aloe Vera seul, avec ajout de KI. ... 133
Tableau III.19 Paramètres électrochimiques déduits des courbes de polarisation de l’acier ordinaire en présence de l’O.F.I. ou de l’Aloe Vera sans et avec ajout de KI et efficacités inhibitrices calculées. ... 134
Tableau III.20. Paramètres électrochimiques déduits des Nyquists de l’acier ordinaire dans 0.5 M H2SO4 ,en présence de l’O.F.I et de l’Aloe Vera, sans et avec ajout de KI et efficacités inhibitrices calculées. ... 135
Tableau III.21. Valeurs de l’angle de contact moyen avec images en présence de l’O.F.I ou de l’Aloe Vera, avec ajout de KI. ... 136
Tableau III.22. Paramètres électrochimiques déduits des courbes de polarisation de l’acier ordinaire dans 0.5 M H3PO4 en présence des différents inhibiteurs et leurs synergies, et efficacités inhibitrices calculées. ... 138
Tableau III.23 . Paramètres électrochimiques déduits des courbes de Nyquist de l’acier
ordinaire dans 0.5M H3PO4 en absence et en présence des inhibiteurs d’étude et de leurs synergies, et efficacités inhibitrices calculées. ... 140
Tableau III.24. Paramètres électrochimiques déduits des courbes de polarisation de l’acier ordinaire dans 0.5 M H2SO4 en présence des différents inhibiteurs et leurs synergies, et efficacités inhibitrices calculées. ... 142 Tableau III.25 . Paramètres électrochimiques déduits des courbes de Nyquist de
l’acier ordinaire dans 0.5M H2SO4 en absence et en présence des inhibiteurs d’étude et de leurs synergies, et efficacités inhibitrices calculées. ... 146
15
INTRODUCTION
Tous les aciers ordinaires tendent à se dégrader superficiellement lorsqu'ils sont soumis à des milieux corrosifs et spécialement des milieux acides qui sont largement utilisés. La corrosion est la détérioration des matériaux par des interactions physico-chimiques avec leur environnement, entraînant des modifications de propriétés du métal souvent accompagnées d’une dégradation fonctionnelle de ce dernier (altération de ses propriétés mécaniques, électriques,…..etc.). Les mécanismes mis en jeu sont divers et conduisent à des formes différentes de corrosion. Les aciers ordinaires sont utilisés dans l’industrie pétrolière pour les pipelines en premier lieu et d’autres installations industrielles, d’où l’ampleur des dégâts. Selon la thermodynamique, les métaux ne sont pas stables au contact de l’air et de l’eau, à quelques exceptions près. Mais, si la vitesse des réactions de corrosion est lente et si on emploie des techniques de protection adéquates, ils peuvent remplir leur fonction pendant la durée de vie prévue pour une réalisation technique.
En matière de protection, les inhibiteurs constituent un moyen original pour lutter contre la corrosion. Un inhibiteur est un composé chimique que l’on ajoute, en faible quantité, au milieu pour diminuer la vitesse de corrosion des matériaux. Il peut être destiné à une protection permanente de la pièce, ou provisoire (notamment lorsque la pièce est particulièrement sensible à la corrosion). Sachant que les inhibiteurs verts font l’objet d’une grande attention dans le monde de l’industrie et vue leurs non toxicité et efficacité dans le domaine de la corrosion, notre travail c’est basé sur l’utilisation de deux extraits de plantes, le premier à base des cladodes de figuier de barbarie connu en botanique sous le nom d’Opuntia Ficus Indica (O.F.I), et le second à base des feuilles de l’Aloe Vera.
L’O.F.I. est très répandu en Algérie, souvent sous forme de clôtures limitant les parcelles des vergers. Les meilleures plantations se trouvent plutôt sur les zones côtières telles que la ville de Annaba située à l’Est Algérien.
L’Aloe Vera, qui est de la même famille que l’O.F.I, est une plante ornementale, connue depuis l’antiquité et se cultive dans toutes les régions chaudes du monde.
16
Ces deux plantes grasses, ont été largement ignorées par les scientifiques jusqu’au début des années 80, où l’intérêt, à leurs multifonctionnalités, attire leurs attention. L’O.F.I comme l’Aloe Vera, deviennent de plus en plus visés pour leurs intérêt écologique, environnemental et socioéconomique, sans oublié le domaine industriel, médicinal, pharmaceutique et cosmétique.
Au cours de ce travail, nous avons déterminer les efficacités inhibitrices de l’O.F.I et de l’Aloe Vera, séparément et en synergies ,avec l’iodure de potassium comme additif , sur deux aciers ordinaires dans différents milieux acides, H3PO4 à 1M, H3PO4 à 0.5M et H2SO4 à 0.5M, en utilisant plusieurs techniques à savoir gravimétrique , électrochimiques stationnaires ( la polarisation potentiodynamique et la chronoampérométrie) et transitoires (la Spectroscopie d’Impédance Electrochimique (SIE) et la méthode du Potentiel à Charge Zéro (PZC)) , ainsi que des méthodes de caractérisation de la surface telles que la méthode de mesure de l’angle de contact et la Microscopie Electronique à balayage (MEB).
Ce mémoire de thèse est constitué d’une introduction, de trois chapitres et d’une conclusion. Le premier chapitre est consacré à une présentation générale relative à la corrosion des aciers ordinaires dans les milieux acides, particulièrement avec une bibliographie exhaustive sur les inhibiteurs verts de corrosion dans les milieux acides.
Le second chapitre présente les conditions expérimentales de l’étude ainsi que les techniques gravimétriques et électrochimiques mises en œuvre avec les méthodes de caractérisation de la surface de l’acier.
Les résultats expérimentaux sont présentés dans le troisième chapitre, dans lequel, nous avons mis en évidence l’efficacité des deux inhibiteurs verts séparément et en synergies sans et avec ajout de l’iodure de potassium comme additif.
17
CHAPITRE I
I. SYNTHESE
18 I.1 Notions de corrosion des aciers ordinaires I.1.1 Introduction
La corrosion est la détérioration des matériaux par interaction physico-chimique avec leur environnement, entraînant des modifications des propriétés du métal souvent accompagnées d’une dégradation fonctionnelle de ce dernier (altération de ses propriétés mécaniques, électriques, etc.) [1]. Comme tous les matériaux, l'acier ordinaire tend à se dégrader superficiellement lorsqu'il est soumis à des milieux corrosifs comme le sol, l'air et le milieu marin. Plusieurs produits de corrosion (lépidocrocite, goethite, magnétite…..) sont susceptibles de se former et peuvent jouer un rôle actif de barrière plus ou moins efficace selon leur nature. Cependant, ces couches sont minces, pas toujours homogènes dans leur épaisseur, et leur nature
[2-4].
La corrosion est un phénomène électrochimique qui se produit par la formation des piles à la surface de l'acier, dans lesquelles une des électrodes appelée « anode », se consomme au bénéfice de l'autre « cathode », qui reste intacte. L'électrolyte est constitué principalement d’eau, plus ou moins conductrice et oxygénée. En pratique, ces piles se forment dès qu'il y’ a hétérogénéité à la surface de l'acier en formant des zones anodiques et cathodiques, dans lesquelles se produisent deux réactions électrochimiques élémentaires (oxydation et réduction). Exemple :
- L’oxydation de l’acier (assimilée ici à celle du fer) ;
- Réduction d’espèces oxydantes (oxygène dissous) présentes au sein de la solution : Fe Fe2+ + 2 e- I.1
Fe2+ Fe3+ + 1e- I.2
Dans l’eau pure, les réactions cathodiques associées sont :
O2 + 2 H2 O + 4e- 4 OH- I.3 2H+ + 2 e- H2 (gaz) I.4
19
Les couches de produits de corrosion formées lors de la dégradation de l’acier dans de l’eau aérée agissent comme une barrière de diffusion vis–à-vis de l’oxygène et de l’eau [5,6].
I.1.2 Les types de corrosion
La corrosion peut se développer [7] suivant différents processus induisant plusieurs types de corrosion:
Corrosion chimique
Il s'agit d'une réaction purement chimique entre la surface d'un matériau et un gaz ou un liquide non électrolyte. Par exemple, l'oxydation de l'acier ordinaire à haute température par l'oxygène de l'air est une corrosion chimique.
Corrosion électrochimique
C’est une réaction électrochimique entre la surface d'un matériau et un liquide électrolyte. Elle est accompagnée de la formation de piles qui sont le siège de circulation de courant électrique telle que la dégradation de l'aluminium par l'acide sulfurique dilué.
Corrosion biochimique
C’est l'attaque bactérienne des matériaux métalliques, en particulier dans les canalisations enterrées et les réservoirs. En effet, le métabolisme du développement de certaines bactéries provoque la formation d'acide sulfurique qui attaque le métal.
Corrosion accompagnée d'usure
Lorsque les produits de corrosion forment un dépôt adhérant et uniforme sur la surface du métal, ils ralentissent la vitesse de corrosion. Cette couche peut être éliminée en certains points par usure abrasive ou érosive. Il y’ a alors accélération de la corrosion parce que la surface du métal est mise à nu.
I.1.3 Les formes de corrosion
Plusieurs formes de corrosion peuvent être dénombrées, caractérisées par des modifications de propriétés physiques du métal [8,9].
20 Corrosion uniforme
La corrosion uniforme est une perte de matière plus ou moins régulière sur toute la surface. Le métal dans ce cas est dans l’état actif. Elle est aisément contrôlable par des mesures de perte de poids ou la diminution d’épaisseur du métal [10].
Corrosion par piqûres
Figure I.1 Corrosion par piqûres [11]
La corrosion par piqûres est caractérisée par une attaque très localisée en certains points de la surface et provoque des piqûres. Cette forme de corrosion est produite par certains anions, notamment les halogénures (chlorures…), sur les métaux protégés par un film d’oxyde mince. Elle induit typiquement des cavités de quelques dizaines de micromètres de diamètre. La corrosion par piqûres affecte en particulier les métaux ou les alliages passivés (aciers inoxydables, les alliages d’aluminium).Cette forme de corrosion comprend au moins deux étapes, l’amorçage qui se produit lors de la rupture locale de la passivité et la croissance ou propagation (Figure I.2).
21 Corrosion galvanique
Contrairement à certaines formes de corrosion, la corrosion galvanique est largement indépendante des données métalliques des matériaux. Ce type de corrosion résulte du couplage électrique de deux métaux différents et immergés dans la solution.
La polarisation des surfaces métalliques par couplage galvanique a pour conséquence l’accroissement de la résistance à la corrosion de l’alliage le plus noble (la cathode) et la réduction de la résistance à la corrosion de l’alliage le moins noble (l’anode). Elle résulte de la formation d’une pile qui conduit à une hétérogénéité de l’attaque (Figure I.3).
Figure I.3. Représentation schématique d'une pile de corrosion [13].
Corrosion intergranulaire
Cette forme de corrosion se manifeste aux joints de grains. Ce phénomène microscopique (invisible dans les étapes initiales) peut provoquer des fissures qui affaiblissent les caractéristiques mécaniques du métal. Certains aciers inoxydables et alliages (fer, chrome, nickel) sont très affectés par ce mode de corrosion qui réduit leur résistance mécanique.
Milieu M2+ Matériau 2H+ + 2 e- H2 Ou 2H2O+ O2 + 4 e- 4 OH-
22
Figure I.4. Corrosion intergranulaire [14]. Corrosion sélective
Elle est très dangereuse parce qu’elle est indétectable. Elle consiste en la dissolution sélective d’un élément d’alliage, les autres éléments restent non attaqués. Le métal devient poreux et perd sa résistance.
Figure I.5.Corrosion sélective [15]. Corrosion caverneuse
Elle est due à une différence d’accessibilité de l’oxygène entre deux parties d’une structure créant ainsi une pile électrochimique. Cette attaque sélective du métal est observée dans les fissures et autres endroits peu accessibles à l’oxygène. Souvent, la corrosion caverneuse est associée à la présence de petits volumes de solution corrosive stagnante dans des cavités et des surfaces jointives ou dans des dépôts discontinus.
Grains Joints de
grains Attaque sélective
23
Figure I.6. Corrosion caverneuse [16]. Corrosion filiforme
Elle est souvent associée à la présence d’un revêtement protecteur (peinture, vernis,…) semi perméable à l’oxygène et à l’eau. L’attaque se manifeste par des filaments émis dans toutes les directions, à partir des défauts du revêtement, qui peut affecter divers matériaux tels que le fer et l’aluminium lorsqu’ils sont soumis à des atmosphères humides entre 20°C et 30°C. L’oxygène et l’eau sont les réactifs nécessaires au développement de la corrosion filiforme [17]. La présence d’ions agressifs tels que Cl-, SO
42- et CO32- favorise l’initiation de cette corrosion en développant une acidification locale. D’après les mesures du potentiel et du pH, le fil de corrosion filiforme est composé d’une tête contenant une solution aqueuse acide et d’une queue alcaline contenant des produits de corrosion. Les conditions alcalines favorisent le décollement du revêtement
[18,19].
24 Corrosion sous contraintes
C’est une fissuration du métal qui résulte de l’action commune d’une contrainte mécanique et d’une réaction électrochimique. Le processus se déroule en deux phases successives, d’initiation et de propagation. Ce processus dépend essentiellement de l’intensité des contraintes imposées, de la nature du matériau (composition chimique et structure), de l’état de surface, du milieu corrosif et de la température.
Figure I.8. Corrosion sous contrainte [21]. I.1.4 Corrosion des aciers ordinaires dans les milieux acides
Les milieux acides sont largement utilisés dans l’industrie pétrolière. La plupart des problèmes de corrosion graves rencontrés dans les industries de transformation impliquent aussi des acides. Ces environnements sont naturellement corrosifs et constituent des milieux agressifs pour les métaux et alliages. Le métal se dissout au niveau des zones anodiques par la réaction d’oxydation d’atomes de métal devenant des ions métalliques en solution. La réaction de réduction d'équilibrage au niveau des cathodes est la consommation des ions hydrogène dans l'acide avec le dégagement d'hydrogène.
Dans l’acide sulfurique (H2SO4) et l’acide phosphorique (H3PO4), la surface du métal est considérée comme exempté de toutes couches protectrices (oxydes, hydroxydes). Cependant, avec le temps, elle peut être recouverte d’hydrogène atomique uniformément adsorbé et de couches de produits de corrosion insolubles. La corrosion du fer dans les milieux acides est due à l’oxydation du fer et la réduction du dioxygène, avec l’intervention du couple O2/H2O [22].
25
Fe Fe+2 + 2e- I.5
O2 +4H+ +4 e- 2H2O I.6 2Fe + O2 + 4 H+ 2Fe2+ + 2 H2O I.7
Le taux d'oxydation ou de corrosion du métal est souvent contrôlé par le taux de réaction de réduction. Dans un acide à concentration, il existe un grand transfert d'électrons et donc activation de la réaction de corrosion.
Le comportement d’un acier immergé dans un milieu acide dépend de la concentration et de la température de ce dernier [23].
Les acides chlorhydrique, sulfurique et nitrique sont tous des ac ides forts. La tendance à la passivation de l'acier dans l’acide et le pouvoir oxydant de ce dernier, sont deux éléments clés pour comprendre cette diversité de comportements.
I.1.5 Lutte contre la corrosion
Différentes mesures sont prises pour protéger les matériaux métalliques contre l’action destructive par corrosion des milieux acides. La protection la plus fiable immédiate est la prévention à la corrosion par le choix des métaux ou alliages résistants aux milieux agressifs. La protection contre la corrosion doit être considérée, dès la phase de conception d’une installation, pour éviter de nombreux problèmes et garantir une certaine durée de vie. La solution adoptée doit être compatible avec les prescriptions concernant la protection de l’environnement et permettre le recyclage ou l’élimination des différents composants à la fin de leur utilisation. Il existe plusieurs techniques de protection:
• Prévention par une forme adaptée des pièces. • Prévention par un choix judicieux des matériaux. • Protection par revêtements.
• Protection par inhibiteurs. • Protection électrochimique.
26
Dans notre étude, nous nous sommes intéressées à la protection de la corrosion par l’utilisation d’inhibiteurs verts.
I.1.6 Protection de la corrosion par les inhibiteurs I.1.6.1 Généralités
Conformément à la définition donnée par la National Association of Corrosion Engineers (NACE) « un inhibiteur c’est une substance qui retarde la corrosion lorsqu’elle est ajoutée à un environnement en faible concentration » [24].La diminution de la vitesse de corrosion est réalisée soit en limitant les réactions chimiques ou électrochimiques, en agissant sur le processus anodique, cathodique ou mixte, soit en modifiant l’agressivité de l’électrolyte à l’interface matériau/milieu [25]. La protection de la surface du matériau par un inhibiteur de corrosion peut être, une protection permanente ou temporaire (pendant le stockage par exemple) [26]. Ainsi, l’inhibiteur doit obéir à plusieurs exigences telles que la diminution de la vitesse de corrosion d’un métal, sans affecté les caractéristiques physiques ; une bonne efficacité inhibitrice à faible concentration et une stabilité en présence des autres constituants du milieu ou aux différentes températures d’utilisation. Comme les normes européennes sont très strictes en ce qui concerne la toxicité, un inhibiteur doit être aussi compatible avec celle-ci et, bien sûr, d’un point de vue économique. Le choix des inhibiteurs de corrosion à des fins pratiques, est basé sur la connaissance de leur mécanisme d'action.
I.1.6.2 Classification des inhibiteurs
De nombreuses substances présentent une action inhibitrice et se distinguent selon plusieurs critères [27,28] :
Selon leur composition chimique
Les inhibiteurs organiques représentent un groupe très important d’inhibiteurs de corrosion, leur efficacité est liée à la structure, à la concentration et aux propriétés chimiques de la couche formée, leur action réside dans le résultat de leur adsorption à la surface du matériau qui ralenti simultanément les processus anodiques et cathodiques. Leur utilisation est préférable pour des raisons d’écotoxicité. L’effet de l’inhibiteur augmente souvent avec son poids moléculaire.
27
En revanche les inhibiteurs inorganiques (minéraux) sont utilisés en milieux alcalins et presque jamais en milieux acides. Les chromates, les molybdates, les silicates, les phosphates sont les plus fréquemment utilisés. Maintenant, l’emploi de la plupart de ces produits est réglementé à cause des problèmes qu’ils engendrent à l’environnement.
Selon leur mode d’action
a). Inhibiteurs d’adsorption : Ils se basent sur deux types de liaisons : liaison
électrostatique (physisorption) et liaison chimique (chimisorption) [29]. Le blocage de la surface est réalisé sans modifier l’énergie d’activation et les réactions élémentaires anodique et cathodique sur les parties non recouvertes. Un recouvrement neutre de la surface représente un recouvrement purement géométrique, sans préférence de l’adsorbant pour des sites particuliers de la surface. Dans ce cas le taux de recouvrement θ est:
θ = 𝜸𝜸
𝒔 Éq. I.1
Où: γ est le nombre de sites bloqués par l’espèce inhibitrice , γs est le nombre total de sites de surface disponibles (recouvrement à saturation) .
Dans d’autres cas le 𝛾𝛾
𝑠 blocage peut être limité aux seuls sites actifs anodiques ou cathodiques:
θ = 𝜸𝜸
𝒂,𝒔 avec γa, s <γs Éq. I.2
D’après les valeurs de θ , nous pouvons procéder à l’étude des isothermes d’adsorption de l’espèce inhibitrice et calculer certaines grandeurs thermodynamiques caractérisant l’interaction métal-inhibiteur.
L'équation (Éq.I.3) indique que les constantes de vitesse chimique, des réactions de transfert de charge anodique et cathodique, ne dépendent pas du taux de recouvrement θ, et qu’il n’y a pas d’interactions entre les espèces adsorbées à la surface.
𝜽
𝟏−𝜽= 𝑩𝑪𝒊 Éq. I.3 Où:
28
θ : le taux de recouvrement de la surface par l’inhibiteur (0< θ<1); Ci : la concentration de l’inhibiteur.
b). Inhibiteurs passivant : Ils forment des films de passivation tridimensionnels entre la
surface du métal et les molécules inhibitrices. Ils sont également incorporés dans les couches barrières et ainsi ces molécules inhibitrices conduisent à des réseaux homogènes et denses présentant de fait une faible porosité et une bonne stabilité [30].
Il existe deux catégories d’inhibiteurs passivant:
Les ions oxydants comme CrO4 2- qui peuvent passiver l’acier en absence d’oxygène, Les ions non oxydants (MoO4 2- , W O4 2- , P O4 3- ,, B4 O72- ) qui nécessitent la présence
d’oxygène et déplacent la réaction cathodique de réduction de ce dernier en favorisant son adsorption à la surface du métal.
La concentration requise en inhibiteur passivant est souvent de l’ordre de 10-3 à 10-4 mol/L, et elle dépend en fait de nombreux facteurs tels que la température, le pH, la présence d’ions dépassivant comme Cl- ou réducteurs comme S-2.
Selon la nature électrochimique du processus
a) Les inhibiteurs anodiques : ils sont très nombreux. Ce sont des substances inorganiques comme les orthophosphates, les silicates et les chromates. Leur mode d'action consiste à déplacer le potentiel de corrosion du matériau vers des valeurs plus nobles afin d’obtenir un film passif protecteur sur l’anode [31]. Même si les inhibiteurs anodiques sont très efficaces et souvent utilisés, ils ont généralement une propriété indésirable: si la teneur en inhibiteur est/ou devient progressivement abaissée, la surface métallique n'est plus entièrement couverte, et elle fonctionnera comme anode, obtenant ainsi une combinaison dangereuse, une petite anode et une grande cathode, conduisant à la corrosion par piqûres. Dans ce cas, l'inhibiteur fait plus de mal que de bien. C’est pour cela que les inhibiteurs anodiques sont souvent désignés comme dangereux. Un autre mécanisme fait intervenir une modification de la cinétique de dissolution anodique par absorption de l’inhibiteur. Il n’y a pas un simple blocage des sites préférentiels de dissolution du métal, il y a aussi une intervention de l’inhibiteur au niveau des intermédiaires réactionnels accompagnants les différentes étapes de la dissolution du métal.
29
b) les inhibiteurs cathodiques : l’action de ces inhibiteurs se traduit par une diminution de la vitesse de la réaction cathodique et donc par un déplacement du potentiel de corrosion vers des valeurs moins nobles. Ce sont généralement des cations qui peuvent migrer vers la surface cathodique, où ils précipitent sous formes de sels basiques ou d'hydroxydes, formant des films adhérents et compacts. Les inhibiteurs cathodiques incluent des combinaisons de zinc, de nickel, de magnésium, des phosphates alcalins, des combinaisons d'arsenic. D’après leur mode d’action, on observe qu'ils sont utiles dans les environnements très acides.
Figure I.9 Diagrammes d’Evans montrant le déplacement du potentiel de
corrosion dû à la présence d’un inhibiteur de corrosion [22].
c) Les inhibiteurs mixtes : seuls quelques-uns des inhibiteurs mentionnés ci-dessus peuvent devenir pleinement effectifs en liaison avec l'oxygène dissous ou avec les sels de calcium. L'ajout simultané de deux inhibiteurs peut donner comme résultat la croissance d’effet inhibiteur et il peut aussi éliminer aux faibles concentrations le risque à la corrosion par piqûres. Un tel inhibiteur consiste souvent en une combinaison d'agent oxydant, comme le nitrate ou les chromates, et un agent non oxydant, mais qui précipite comme orthophosphate ou silicate. Des exemples de tels inhibiteurs sont le mélange nitrate et benzoate, qui est l'inhibiteur le plus répandu et efficace pour les radiateurs d’automobile et le mélange orthophosphate et chromate, qui est très efficace même en eau salée. Dans d'autres cas, l’inhibiteur mixte est un mélange entre un inhibiteur cathodique et un inhibiteur anodique, tels que les polyphosphates et chromate. Le schéma d’Evans synthétise les divers cas de ces types d’inhibiteurs (Figure I.9).
30 I.1.6.3 Mécanismes et principes d’action
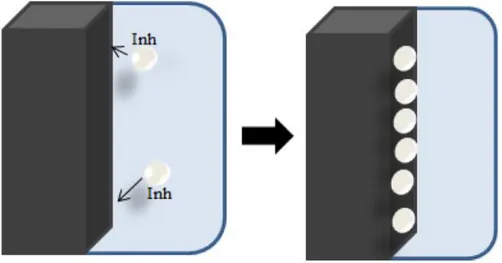
Les inhibiteurs de corrosion n’ont pas un mode d’action propre, unique, mais ils sont liés au système de corrosion. Un inhibiteur peut agir comme une barrière entre le métal et le milieu corrosif, et celle-ci peut être préexistante (couche d’oxyde ou d’hydroxyde déjà formée). Dans ce cas les mécanismes font intervenir le plus souvent des processus d’adsorption et de blocage de surface (Figure I.10). Le mode d’action peut aussi être de nature cinétique, l’inhibiteur peut alors ralentir la vitesse de la réaction cathodique ou de la réaction anodique ou agir simultanément sur les deux. L’inhibition peut aussi résulter de la formation d’un composé insoluble qui colmate les zones sensibles et la vitesse de corrosion diminue alors avec le temps.
Figure I.10. Le mécanisme d’action d’un inhibiteur organique agissant par adsorption des molécules inhibitrices sur la surface du métal.
I.1.6.4 Efficacité d’un inhibiteur de corrosion
Les expressions les plus couramment utilisées pour exprimer l’efficacité d’un inhibiteur de corrosion sont les suivantes :
-Taux d’inhibition
𝜏 =
−𝑢+𝑢031 Coefficient d’inhibition
𝜸 =
𝒖𝟎𝒖
Éq. I.5
Où : u0 : la mesure de corrosion exprimée en perte de masse ou en intensité de corrosion en absence d’inhibiteur;
u : la mesure de corrosion en présence d’inhibiteur.
I.1.6.5 Domaines d’emploi des inhibiteurs
Leur domaine d'utilisation couvre les milieux acides, la vapeur, et les eaux de refroidissement. Il n’existe pas de système inhibiteur universel et chaque situation doit faire l’objet d’une analyse englobant l’ensemble des matériaux présents, la teneur en sels, le pH et la concentration en oxygène.
Nous allons dans ce paragraphe passer en revue quelques situations courantes en citant les types d’inhibiteurs classiquement utilisés. Dans le cas d’un circuit véhiculant de l’eau déminéralisée (peu corrosive compte tenu de sa résistivité élevée), des concentrations minimes d’inhibiteurs minéraux comme les chromates, nitrites, polyphosphates, benzoates ou borax permettent d’obtenir une bonne protection. En présence d’oxygène, il suffit généralement d’abaisser sa teneur à moins de 0,1 ppm par dégazage ou par ajout d’un désoxygénant. On peut également, suivant les matériaux, utiliser un inhibiteur passivant. Toutefois, lorsque le circuit contient des chlorures, l’acier peut se révéler difficile à passiver. Pour de fortes concentrations de chlorures (ainsi qu’en présence de sulfates), nous ferons donc plutôt appel à des inhibiteurs non passivant. Dans les systèmes de réfrigération en circuit fermé, en éliminant l’oxygène, la corrosion est alors contrôlée par un simple ajustement du pH à une valeur suffisamment élevée. Les chromates et les nitrites sont efficaces dans ce cas. Il faut toutefois s’abstenir d’employer les nitrites, si les canalisations sont à base de cuivre (ou alliage) car la formation d’ammoniaque est incompatible avec ces matériaux.
32 I.2 Les inhibiteurs verts
Sachant que les inhibiteurs verts font l’objet d’une grande attention dans le monde de l’industrie et vue leurs non toxicité et efficacité dans le domaine de la corrosion.
Un grand nombre, de composés organiques, a été étudié pour examiner leur potentiel d’inhibition de la corrosion. Toutes ces recherches révèlent que les composés organiques, en particulier ceux qui contiennent les atomes N, S et O, ont montré une efficacité d’inhibition significative, la plupart de ces composés sont non seulement couteux mais aussi toxiques pour les êtres vivants. Ces effets toxiques ont conduit à envisager l’utilisation de produits naturels écologiques et inoffensifs comme des agents anticorrosifs. De nombreuses substances écologiques inhibitrices de la corrosion ont été développées, allant des terres rares [32,33] aux composés organiques [34].
A ce jour, plus de 4000 articles ont traité des extraits naturels de différentes parties de plantes (tiges, feuilles et graines), comme inhibiteurs de corrosion, des métaux et leurs alliages, dans différents milieux corrosifs [35].
Le Tableau I.1, regroupe quelques études faites dernièrement sur l’effet anti corrosion des inhibiteurs verts.
Tableau I.1. L’effet inhibiteur de corrosion des extraits naturels de plantes sur les aciers dans différents milieux acides.
Réf. Inhibiteur Milieu Métal Techniques E
(%) Année
Milieu HCl
[36] OLEA EUROPAEA 2M HCl Acier au carbone Gravimétrie , PPD, VC 93% à 900ppm 200733 [37] MURRAYA KOENIGII 1M HCl Acier ordinaire Gravimétrie , PPD, SIE 84.6% 2010 [38] SIPARUNA GUIANENSIS 0.1M HCl Acier au carbone SIE, PPD, SR Feuilles : 79% à 50mg/L 2011 Tiges : 86% à 50mg/L [39] ARGANIA SPINOSA 1M HCl Acier ordinaire Gravimétrie , SIE, PPD 97,3% à 5 g/L 2012
34 [40] ACALYPHA TORTA 1M HCl Acier ordinaire Gravimétrie , SIE, PPD 91% à 1000ppm 2013 [41] GEISSOSPERMUM 1M HCl Acier au carbone SIE, PPD, MEB 92% à 100 mg/L 2015 [42] PHOENIX DACTYLIFERA 1M HCl Acier au carbone Gravimétrie , PPD, SIE, MEB. 88.08% à 2g/L 2015
35 [43] TABERNAEMONTANA DIVARICAT 1M HCl Acier au carbone Gravimétrie , SIE, PPD, MEB, EDX 95% à 500ppm 2016 [44] THYMUS VULGARI 1M HCl acier inoxydable SIE, PPD, EH 62.15% à 2% (v/v) 2017 [45] ROLLINIA OCCIDENTALIS 1M HCl Acier au carbone Gravimétrie , SIE, PPD, MEB 85.7% à 1g/L 2018
36 [46] CANNON AMURICATA 0.5M H2SO4 Acier au carbone Gravimétrie , PPD, SIE 95.1% 2018 1M HCl 94.1%
37
Milieu H
2
SO
4
[47] COMBRETUM BRACTEOSUM LEAVES H2SO4 Acier ordinaire Gravimétrie, HE 74.76% à 4g/L 2009 [48] RUTA CHALEPENSI 2 M H2SO4 Acier ordinaire HE, gravimétrie, PPD, SIE, MEB 99.86% à1.6 10-1 (m/v) 2010 [49] NAUCLEA LATIFOLIA 1M H2SO4 Acier ordinaire Gravimétrie feuille : 94.26% 2013 écorce : 91.58% racine : 75.26% à 0.4 g/l38
[50]
NYPA FRUTICANS WURMB
0.1M H2SO4 Acier ordinaire Gravimétrie 74.47% à 0.5 g/L 2014 [51] TAGETES ERECTA 0.5M H2SO4 Acier ordinaire Gravimétrie, SIE, PPD 98.19% à 1 g/L 2014 [52] ALOE VERA 1M H2SO4 Acier inoxydab le BE,SIE, PPD MEB , HPLC 98% à 30%v/v 2015
39 [53] NICOTIANA TABACUM 2M H2SO4 Acier ordinaire Gravimétrie, DFT 94.13% à 10g/L 2015 80.92% à 10g/L [54] CASSIA TORA 0.5M H2SO4 Acier ordinaire Gravimétrie, FTIR, MEB 95.44% à 400 ppm 2016 [55]
POUPARTIA BIRREA BACK
0.5M H2SO4
Acier
ordinaire Gravimétrie 70%
40 [56] SIDA CORDIFOLIA 0.5M H2SO4 Acier ordinaire Gravimétrie , SIE, PPD, MEB, AFM 98.96% à 500 mg/L 2018 [57] LANNEA COROMANDELICA 1M H2SO4 Acier ordinaire Gravimétrie , SIE, PPD, FTIR, MEB, AFM 93.8% à 250 mg/L 2017 [58] AGAVE AMERICANA 0.5 M H2SO4 Acier ordinaire Gravimétrie, PPD, SIE, FT-IR, MEB 81.87% à 2000 ppm 2019
41
Milieu H
3
PO
4
[59] ZENTHOXYLUM ALATUM 20 %(v/v) 50 %(v/v) 88%(v/v) H3PO4 Acier ordinaire Gravimétrie, SIE, PPD, FT-IR, XPS 98% à 3200 ppm 2004 [60] ARTEMISIA 2M H3PO4 Acier au carbone Gravimétrie, PPD, SIE 79% à 6g/l 2006 [61] ROSEMARY 2M H3PO4 Acier au carbone Gravimétrie , PPD, SIE 73% à 10g/L 200642 [62] MANGROVE TANNINS NaCl et H3PO4 Acier au carbone PPD, XRD, MEB 90.1% 2008 [63] TRIBULUS TERRESTRIS L 1N H3PO4 Acier ordinaire Gravimétrie, FT-IR, PPD 83.2% 2010 [64] ACALYPHA INDICA L. ALCOHOLIC 1N H3PO4 Acier ordinaire Gravimétrie, FT-IR, PPD 90.38% à 5mg à 30°C 2010
43 [65] BAMBOO 0.1M H3PO4 Acier au carbone Gravimétrie, PPD, SIE, Chimie Quantique 95.7% à 100 mgL-1 2014 [66] EUPHORBIA FALCATA.L 1N H3PO4 Acier au carbone Gravimétrie, 93% à 3g.L-1 à 40°C 2015 [67] MUSA ACUMINATA 1N H3PO4 Acier ordinaire Gravimétrie 62% à 2 %(v/v) 2015
44 [68] RED ONION 0.75M H3PO4 Acier au carbone HE, gravimétrie, MEB 86.18% à 5 ml 2016 [69] ZIZIPHUS LOTUS 5.5M H3PO4 Acier au carbone PPD, SIE 70.5% à 3g/L 2018 [70] BORAGO OFFICINALIS. L 1M H3PO4 Acier ordinaire HE, gravimetrie, PPD SEM-EDX 84.29% à1g.L-1 2018
45
Cette synthèse bibliographique ( Tableau I.1) , nous a permis de conclure que les extraits de plantes sont des substances parfaites pour remplacer les produits organiques synthétisés et d’autres inorganiques coûteux et toxiques. Les extraits de plantes contiennent plusieurs constituants et substances phytochimiques pouvant facilement être adsorbés et inhibent la corrosion des aciers ordinaires. Plusieurs parties des plantes, telles que les feuilles, les racines, les tiges…etc., ont été examinées en tant qu’inhibiteurs verts de la corrosion des aciers ordinaire, des aciers au carbone et des métaux et leurs alliages dans des milieux acides (HCl, H2SO4, H3PO4). Nous pouvons conclure que la feuille est la partie la plus riche de la plante où se déroule la synthèse phytochimique. L’utilisation de la synergie a également été étudiée en particulier en présence d'ions halogénures (KF ; KCl ; KBr et KI), qui a donné une amélioration significative de l’efficacité inhibitrice.
I.2.1 La biodégradabilité des inhibiteurs verts
Un produit est dit biodégradable si après usage, il peut être décomposé naturellement. La biodégradabilité est un des paramètres les plus importants pour caractériser l’impact environnemental d’un produit organique. Elle dépend d'une part de la faculté d'être dégradée et d'autre part de la vitesse de la décomposition du produit dans le milieu biologique. Par exemple, une feuille de plante est biodégradable à 100% en quelques semaines alors qu'une bouteille plastique nécessite environ 4 mille ans.
La biodégradation se traduit chimiquement par un processus de simplification progressive de la structure chimique d'un composé organique avec la minéralisation du carbone (sous forme de dioxyde de carbone) et l'obtention de métabolites de plus faible poids moléculaire .Toutefois, la capacité de l'écosystème à absorber les produits biodégradables est limitée, créant ainsi un risque d'engorgement comme par exemple l'eutrophisation des étangs (pollution aux nitrates en raison d'un excès de matières biodégradables azotées).
46
CHAPITRE II
47 II.1 Protocole expérimental
II.1.1 Composition chimique des aciers ordinaires
Dans notre étude, nous nous sommes intéressées à la corrosion de deux aciers ordinaires, dont le XC 52, qui est produit dans le plus grand respect des normes de qualité, de référence standard API 5L (American Petroléum Institute).
Les principales caractéristiques des aciers des pipelines d’Arcelor Mittal sont leur très haute résistance à la rupture et leur excellente ténacité à très basse température.
Les plaques d’aciers utilisées sont coupées en forme cylindrique et enrobées par une résine laissant une surface de contact de 4.52 cm2 pour le premier acier (XC52), et 3.14 cm2 pour le deuxième acier ordinaire. La conductivité électrique est assurée par un câble de cuivre directement en contact avec l’acier. Le polissage de la surface a été effectué à l’aide du papier abrasif de carbure de silicium (d’un grade allant de 350 à 4400µm). Un bain d’éthanol dans la cuve à ultrasons permet d’éliminer toutes traces liées aux impuretés dues au polissage, notamment les grains de carbure de silicium. Les échantillons sont ensuite rincés soigneusement à l’eau déminéralisée puis séchés à l’air comprimé.
La composition chimique en % massique des deux aciers ordinaires utilisés est faite par spectrométrie de fluorescence aux rayons X et spectrométrie Infra rouge, les résultats sont présentés dans les Tableaux II.1 et II.2.
Tableau II.1.Composition chimique en % massique de l’acier ordinaire XC 52.
Tableau II.2. Composition chimique en % massique du second acier ordinaire.
Eléments C S Mo Cu Ni Mn Cr V Si Fer Teneur en % massique 0.154 0.004 0.028 0.111 0.057 1.280 0.045 0.003 0.412 97.906 Elément C O Al Si P Cr Mn Ni Cu Mo Sn Fer Teneur en % massique 1.270 0.115 0.173 0.133 0.052 0.057 0.704 0.115 0.144 0.204 0.126 96.457
48 II.1.2 Milieux d’étude
Nous avons utilisés trois milieux agressifs à savoir :
- Une solution d’acide sulfurique H2SO4 à 0.5M préparée à partir d’une solution concentrée à 95-98 % m/v de marque Sigma-Aldrich.
- Une solution d’acide phosphorique H3PO4 à 0.5M préparée à partir d’une solution concentrée à 98 % m/v, de marque Sigma-Aldrich.
- Une solution d’acide phosphorique H3PO4 à 1M préparée à partir d’une solution concentrée à 98 % m/v, de marque Sigma-Aldrich.
II.1.3 Inhibiteurs verts utilisés
Dans notre étude, nous avons utilisé deux inhibiteurs verts à savoir les feuilles d’Aloe Vera provenant de l’Amérique et les cladodes du figuier de barbarie appelé en botanique Opuntia Ficus Indica (O.F.I) provenant de l’Est Algérien (Chétaibi- Annaba).
II.1.3.1 Préparation des inhibiteurs
Opuntia Ficus Indica (O.F.I)
Les cladodes de l’Opuntia Ficus Indica ont été désépinées, lavées à l’eau distillée puis coupées en petits morceaux, ensuite, nous avons procédé à leur extraction en utilisant le montage de Soxhlet représenté dans la Figure II.1.a. L’appareil porte le nom de son inventeur : Franz Von Soxhlet. L’extraction par l’appareil Soxhlet (appelé Soxhlet) est une méthode simple et convenable, qui nous permet de répéter infiniment le cycle d’extraction avec du solvant frais jusqu'à épuisement complet du soluté dans la matière première, d'où vient son efficacité élevée. Cependant, le Soxhlet possède quelques inconvénients comme, par exemple, le temps d’extraction relativement lent, la possibilité de dégradation des composés à cause d’une surchauffe locale, le choix limité du solvant, les difficultés d’utilisation de mélanges de solvants,…… etc.
L’installation de Soxhlet est composée d'un corps en verre, dans lequel est placée une cartouche en papier-filtre épais (une matière pénétrable pour le solvant), d'un tube siphon et d'un tube de distillation. L’extracteur est placé sur un ballon contenant le solvant d'extraction. Le ballon est chauffé afin de pouvoir faire bouillir son contenu. La cartouche contenant le solide à extraire est
49
insérée dans l'extracteur, au-dessus duquel est placé un réfrigérant servant à liquéfier les vapeurs du solvant.
Le ballon étant chauffé, le liquide est amené à ébullition, les vapeurs du solvant passent par le tube de distillation puis dans le réfrigérant pour être liquéfiées. Ensuite, le condensat retombe dans le corps de l'extracteur sur la cartouche, faisant ainsi macérer le solide dans le solvant. Le solvant condensé s'accumule dans l'extracteur jusqu'au niveau du sommet du tube-siphon, suivi par le retour dans, le ballon du liquide de l’extracteur accompagné de substances extraites. Ainsi le solvant dans le ballon s'enrichit progressivement en composants solubles. L’extraction continue jusqu’à l’épuisement de la matière solide chargée dans la cartouche. La séparation du solvant de l’extrait est faite à l’aide de l’appareil appelé Rotavapeur (Figure II.1.b). Dans le Rotavapeur, nous réalisons une évaporation sous vide en utilisant une pompe à vide avec une vanne de contrôle. Pendant l’évaporation le ballon est mis en rotation et plongé dans un bain liquide chauffé. L’appareil est muni d'un réfrigérant avec un ballon-collecteur de condensat. La rotation du ballon crée une surface d’échange plus grande et renouvelée permettant donc d’effectuer une évaporation rapide. L’abaissement de la pression permet d’évaporer le solvant à température réduite, évitant ainsi la dégradation thermique éventuelle des composés. C’est une méthode d’évaporation simple, utile, douce et rapide.
(a) (b)



![Figure II.5. Système électrochimique non linéaire soumis à une perturbation sinusoïdale [74]](https://thumb-eu.123doks.com/thumbv2/123doknet/2024075.3608/52.893.232.662.149.533/figure-ii-systeme-electrochimique-lineaire-soumis-perturbation-sinusoidale.webp)
![Figure II.8. Impédance du circuit équivalent de Randles: cas d’une couche de diffusion d’épaisseur infinie [80]](https://thumb-eu.123doks.com/thumbv2/123doknet/2024075.3608/56.893.186.718.533.789/figure-impedance-circuit-equivalent-randles-diffusion-epaisseur-infinie.webp)