Université de Montréal
Caractérisation des structures de Septines hautement
organisées chez la Drosophile et leur interaction avec le
cytosquelette d’Actine
Zlatina Dragieva
Département de Biologie Moléculaire
Faculté de Médecine
Mémoire présenté à la faculté de Médecine en vue de l’obtention du grade du
Maître en Science en Biologie Moléculaire et Maladies Complexes
08 Juin, 2016
© Zlatina Dragieva 2016
Université de Montréal
Ce mémoire intitulé :
Caractérisation des structures de Septines hautement
organisées chez la Drosophile et leur interaction avec le
cytosquelette d’Actine
Présenté par :
Zlatina Dragieva
Résumé
Les septines sont des GTPases conservées dérégulées dans le cancer et les maladies neurodégénératives. Elles servent de protéines d’échafaudage et forment une barrière de diffusion à la membrane plasmique et au corps central lors de la cytokinèse. Elles interagissent avec l’actine et s’organisent en complexes qui polymérisent et forment des structures hautement organisées (anneaux et filaments). Leur dynamique d’assemblage et leur rôle dans la cellule restent à être élucidés. La Drosophile est un modèle simple pour l’étude des septines puisqu’on n’y retrouve que 5 gènes (sep1, sep2, sep4, sep5, peanut) comparativement aux 13 gènes chez l’humain.
À l’aide d’un anticorps contre Pnut, nous avons identifié des structures tubulaires dans 30% des cellules S2 de Drosophile. Mon projet a comme but de caractériser ces tubes en élucidant leurs constituants, leur comportement et leurs propriétés pour mieux clarifier le mécanisme par lequel les septines forment des structures hautement organisées et interagissent avec le cytosquelette d’actine.
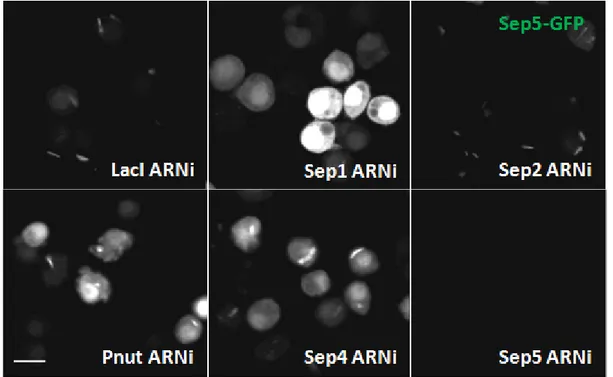
Par immunofluorescence, j’ai pu démontrer que ces tubes sont cytoplasmiques, en mitose ou interphase, ce qui suggère qu’ils ne sont pas régulés par le cycle cellulaire. Pour investiguer la composition et les propriétés dynamiques de ces tubes, j’ai généré une lignée cellulaire exprimant Sep2-GFP qui se localise aux tubes et des ARNi contre les cinq septines. Trois septines sont importantes pour la formation de ces tubes et anneaux notamment Sep1, Sep2 et Pnut. La déplétion de Sep1 cause la dispersion du signal GFP en flocons, tandis que la déplétion de Sep2 ou de Pnut mène à la dispersion du signal GFP uniformément dans la cellule. Des expériences de FRAP sur la lignée Sep2-GFP révèlent un signal de retour très lent, ce qui indique que ces structures sont très stables.
J’ai aussi démontré une relation entre l’actine et les septines. Le traitement avec la Latrunculin A (un inhibiteur de la polymérisation de l’actine) ou la Jasplakinolide (un stabilisateur des filaments d’actine) mène à la dépolymérisation rapide (< 30 min) des tubes en anneaux flottants dans le cytoplasme, même si ces tubes ne sont pas reconnus suite à un marquage de la F-actine. L’Actin05C-mCherry se localise aux tubes, tandis que le mutant déficient de la polymérisation, Actin05C-R62D-mCherry perd cette localisation. On observe aussi que la déplétion de la Cofiline et de l’AIP1 (ce qui déstabilise l’actine) mène au même
phénotype que le traitement avec la Latrunculine A ou la Jasplakinolide. Alors on peut conclure qu’un cytosquelette d’actine dynamique est nécessaire pour la formation et le maintien des tubes de septines.
Les futures études auront comme but de mieux comprendre l’organisation des septines en structures hautement organisées et leur relation avec l’actine. Ceci sera utile pour l’élaboration du réseau d’interactions des septines qui pourra servir à expliquer leur dérégulation dans le cancer et les maladies neurodégénératives.
Abstract
Septins are highly conserved GTP-binding proteins deregulated in diseases such as cancer and neurodegenerative diseases. Septins scaffold other proteins and act as diffusion barriers at the plasma membrane and midbody during cytokinesis. They interact with the actin cytoskeleton and have been observed to form ordered complexes that can polymerize into higher-order structures such as filaments and rings. The principles of assembly and disassembly of such filaments and rings and their cellular roles are yet to be elucidated. Drosophila offers a simple system, as there are only 5 septin genes: peanut, sep1, sep2, sep4, and sep5 in contrast to 13 found in humans.
We have previously found that Drosophila S2 cells contain unusual tubular structures that label with Peanut antibody. The goal of my Master’s project has been to characterise these structures, by defining their constituents, behaviours and properties, in the hope that this will shed light on the mechanisms by which septins can form higher-ordered structures and how they interact with other cytoskeletal elements such as actin.
Using fluorescence microscopy, I show that these tubes are cytoplasmic and present in 30% of cells, both during mitosis and interphase, suggesting they are not cell cycle regulated. To investigate their composition and dynamic properties, I generated S2 cell lines stably expressing Sep2-GFP, which localizes to septin tubes and double stranded RNAs against all septins. The products of three septin genes were found to be essential for the assembly of septin tubes: Sep1, Sep2, and Pnut. The depletion of Sep1 led to the dispersal of the GFP signal into cytoplasmic clumps, whereas the depletion of Sep2 and Pnut led to its uniform distribution through the cell. FRAP analysis of Sep2-GFP revealed only slow recovery after many hours, indicating that the structures are very stable.
I also discovered an unusual relationship between septin tubes and the actin cytoskeleton. Although the tubes did not label with conventional F-actin probes (Phalloidin, LifeAct), treatment with inhibitors of F-actin assembly (Latrunculin A) or disassembly (Jasplakinolide) led to their rapid (<30 min) dispersal into scattered rings. Furthermore, overexpressed Actin05C-mCherry localised to the septin tubes, while a polymerization-deficient mutant Actin05C-R62D-mCherry did not. Depletion of the actin severing protein Cofilin and the actin capping protein AIP1 also disrupted septin tubes dispersing them into cytoplasmic rings. A dynamic actin
cytoskeleton is thus required for the formation and/or maintenance of higher ordered structures such as rings and tubes.
Conclusion and Relevance: Ongoing studies aim to further elucidate how septins organize into
such ordered structures and how actin regulates the process. This will clarify the septin network of interactions and facilitate the comprehension of their implication in cancer and neurodegenerative diseases.
Table des matières
Résumé ... iii
Abstract ... v
Liste des tableaux ... 1
Liste des figures ... 2
Liste des Abréviations... 4
Remerciements ... 5
1. Introduction ... 8
1.1 Le cytosquelette cellulaire ... 9
1.1.1 Les microtubules ... 9
1.1.2 Les filaments intermédiaires ... 9
1.1.3 L’actine ... 10
1.1.4 Les septines ... 13
1.2 Les septines dans les organismes modèles ... 14
1.2.1 Les septines chez la levure bourgeonnante ... 14
1.2.2 Les septines chez l’humain ... 17
1.2.3 Les septines chez la Drosophile ... 17
1.3 Structure ... 19
1.3.1 Motifs et Domaines protéiques ... 19
1.3.2 Interfaces G et NC ... 20
1.3.3 Le rôle du GTP/GDP dans la polymérisation des septines ... 22
1.3.4 Modifications post traductionnelles ... 23
1.4 La relation avec l’actine ... 23
1.4.1 Les septines et le cytosquelette d’actine lors de la division ... 23
1.4.2 Les septines comme modulateurs de l’actine ... 24
1.4.3 Les drogues qui influencent le cytosquelette d’actine ... 25
1.4.4 Lien entre les septines et le cytosquelette d’actine ... 26
1.4.5Expression différentielle des septines ... 27
1.6 Le Forchlorophenuron (FCF) ... 29
1.7 Les septines et leur rôle dans la cellule ... 29
1.7.1 Protéines d’échafaudage ... 30
1.7.2 Barrière de diffusion ... 31
1.8 Dérégulation des septines et pathologies ... 31
1.8.1 Le cancer ... 32
1.8.2 Maladies neurodégénératives ... 34
1.8.3 Ciliopathies et Infertilité ... 34
2. Projet de recherche ... 35
2.1 Problématique et hypothèse ... 35
2.2 Procédures expérimentales et objectifs ... 35
3. Matériels et Méthodes ... 37
Clonage et Mutagénèse ... 37
Les ARN interférants (ARNis) ... 39
Culture cellulaire ... 42
Les cellules ont été passées dans des plaques de 24, 12 ou 6 puits dans du milieu de Schneider supplémenté de 10% de sérum de veau fœtal (Invitrogen) et de la pénicilline/streptomycine chaque semaine pour maintenir une bonne croissance. ... 42
Transfections et lignées cellulaires ... 42
L’immunobuvardage de type Western ... 42
Microscopie... 43
Immunofluorescence ... 44
Récupération de fluorescence après photo-blanchissement ... 45
4. Résultats ... 46
4.1 Pnut est essentiel pour les structures de septines ... 46
4.2 Les septines forment des anneaux et des tubes cytoplasmiques ... 47
4.4 Il peut y avoir de l’hétérogénéité dans la formation des complexes de septines ... 54
4.5 Les tubes de septines ne sont pas régulés par le cycle cellulaire, mais les anneaux disparaissent pendant la mitose ... 55
4.6 Les tubes de septines sont stables ... 56
4.7 Un cytosquelette d’actine dynamique est nécessaire pour le maintien des tubes ... 57
4.7.1 La Jasplakinolide ... 58
4.7.2 La Latrunculin A ... 58
4.8 Le traitement avec le forchlorfenuron induit la formation de structures anormales de septines ... 61
4.9 Les sondes de F-actine ne se localisent pas aux tubes et aux anneaux de septines ... 62
4.9.1 La phalloidine ... 62
4.9.2 LifeAct ... 62
4.10 L’Actin05C-mCH se localise aux tubes, mais pas aux anneaux ... 64
4.11 La capacité de l’actine à polymériser est essentielle pour sa localisation aux tubes de septines ... 65
4.11.1 Le mutant Actin05C R62D ... 65
4.11.2 Le mutant Actin05C R62D se localise mal aux lamellipodes riches en actine ... 65
4.11.3 Le mutant Actin05C R62D se localise mal aux tubes de septines ... 66
4.11.4 Le mutant Actin05C R62D forme des punctas ... 67
4.12 La stabilisation de l'actine avec la Jasplakinolide induit une perte précoce de Sep2 des tubes ... 68
4.13 La déplétion d’AIP1 et de la cofiline mène à la déstabilisation des tubes ... 70
4.13.1 La cofiline ... 70
4.13.2 L’AIP1 ... 70
4.14 L’actine marquée avec mCH s’intègre moins bien dans les structures de septines ... 71
5. Discussion ... 73
5.1 Les septines forment des tubes et des anneaux hautement organisés dans les cellules S2 de Drosophile... 73
5.3 Les tubes de septines ne sont pas nécessaires pour la cytokinèse ... 75
5.4 Les tubes de septines sont stables ... 75
5.5 La Latrunculine A, le Cytochalasin D et la Jasplakinolide déstabilisent le cytosquelette de septines ... 76
5.6 La déplétion de l’AIP1 et de la cofiline déstabilise le cytosquelette de septines ... 76
5.7 L’actine se localise aux tubes de septines ... 77
5.8 La capacité de polymérisation de l’actine est essentielle pour sa localisation aux tubes de septines ... 77
5.9 L’actine endogène est nécessaire pour le maintien des structures de septines ... 78
5.10 Futures expériences et perspectives ... 78
Conclusion ... 80
Liste des tableaux
Tableau I. L’expression et l’implication des septines dans le cancer
Tableau II. Les amorces utilisées pour la construction des lignées cellulaires Tableau III. Les amorces utilisées pour la construction des différents ARNis
Liste des figures
Figure 1. Le cytosquelette cellulaire
Figure 2. Les modulateurs de la polymérisation de l’actine Figure 3. Les septines chez la levure bourgeonnante
Figure 4. Structure cristalline de l’hexamère de septines purifié chez l’humain
Figure 5. L’hexamère de base et la formation des structures hautement organisées de septines chez la Drosophile.
Figure 6. La structure élémentaire et les interfaces d’interaction des septines
Figure 7. L’effet des septines sur l’organisation de l’actine (in vivo) dans les canaux du sillon lors de la cellularisation chez la Drosophile
Figure 8. L’effet stabilisant de la phalloidine sur les filaments d’actine Figure 9. Les structures de septines sont cytoplasmiques
Figure 10. La déplétion de Pnut déstabilise les structures de septines observées
Figure 11. Les septines forment des anneaux et des tubes cytoplasmiques dans les cellules S2 de Drosophile
Figure 12. Les tubes et les anneaux de septines présentent des diamètres similaires Figure 13. Effet de la déplétion des différentes septines sur les anneaux et tubes Figure 14. Sep1, Sep2 et Pnut colocalisent aux tubes de septines
Figure 15. La déplétion de Sep1 diminue les niveaux d’expression de Pnut à moins de 25 % Figure 16. Sep5 se localise dans des filaments de septines
Figure 17. Effet de la déplétion des différentes septines sur les filaments
Figure 18. Les tubes de septines persistent pendant la division cellulaire, tandis que les anneaux disparaissent
Figure 19. Les tubes de septines sont stables sur des longues périodes de temps Figure 20. Les tubes de septines requièrent un cytosquelette d’actine intact Figure 21 FCF induit la formation des structures anormales de septines
Figure 22. Les sondes de F-actine ne reconnaissent pas les tubes ni les anneaux de septines Figure 23. L’Actin05C colocalise avec Sep2 aux tubes de septines, mais pas aux anneaux
Figure 24. La capacité de l’actine à se polymériser est essentielle pour sa localisation aux tubes de septines
Figure 25. Le mutant forme des punctas qui sont différents des anneaux de septines observés
Figure 26. Sep2-GFP se localise aux tubes et pars en premier après le traitement avec la Jasplakinolide
Figure 27. La déplétion de Cofilin/AIP1 déstabilise les tubes de septines
Figure 28. La déplétion de l’actine endogène déstabilise les tubes de septines et augmente l'expression de l’Actine-mCH exogène qui est sous contrôle du promoteur actin05C
Liste des Abréviations
ARNi : Acide Ribonucléique interférent ARNdb : Acide Ribonucléique double brin ATP: Adénosine Triphosphate
GTP : Guanine Triphosphate CC : Coiled-Coil
GTPBD : Guanine Triphosphate Binding domain SUE : Septin Unique Element
PH : Pleckstrine Homology Pnut : Peanut Sep1 : Septine 1 Sep2 : Septine 2 Sep4 : Septine 4 Sep5 : Septine 5 LatA : Latrunculin A Jasp : Jasplakinolide FH1 : formin homology 1 FH2 : formin homology 2 Arp2 : actin related protein 2 AIP 1: actin interacting protein 1
Remerciements
J’aimerais remercier tout d’abord mon directeur de recherche Gilles Hickson de m’avoir accueilli dans son laboratoire de recherche autant pour mon stage que pour ma maîtrise. Merci de m’avoir donné l’opportunité de découvrir le monde de la Drosophile et de la microscopie pendant ces années, tout en me donnant tout le support nécessaire. J’ai beaucoup appris pendant mon séjour et j’apprécie énormément tous les conseils et idées partagées pendant les présentations, préparations d’affiches et rencontres.
Je remercie Nour El Amine de m’avoir supervisée pendant mon stage et de m’avoir donné tous les outils nécessaires pour poursuivre mes études à la maîtrise. Il a été pour moi un modèle à suivre, mais aussi un ami vers qui j’ai pu me tourner autant dans les moments difficiles que dans les moments de célébrations. Merci d’avoir été là pour moi et pour tout le chocolat et la crème glacée partagés tout au cours de ces années.
Je remercie Yvonne Ruella, une personne inoubliable. Merci, Yvonne, pour toute ton aide et ton amitié; je n’aurais pas pu le faire sans toi! Tu as toujours cru en moi et tu as su comment remonter mon moral. Merci aussi pour les gommes, le chocolat et les gâteaux. Merci d’être restée au laboratoire après toutes les péripéties rencontrées. Merci d’être toi-même! Woot Woot, j’ai presque fini! :)
Je remercie Amel Kechad pour tous les moments partagés. Pour les ordres du jour et les photos et vidéos de Maniloup. Merci pour ton aide avec ma lettre de motivation et mon CV qui m’ont valu mon nouveau travail. Ce fut un plaisir de travailler avec toi. Ne lâche pas, tu as bientôt fini!!!
J’aimerais remercier Silvana Jananji d’avoir été là pour répondre à toutes mes questions et pour me guider pendant ma maitrise! Merci d’avoir bien géré le laboratoire, une tâche qui n’est pas facile!
J’aimerais remercier Mélanie Diaz pour toutes les conversations de films, repas et voyages. Merci d’avoir été aux cours de maitrise avec moi, ce fut un plaisir de te connaître. Tu es très talentueuse, ne laisses jamais personne te dire autrement!
J’aimerais remercier tous les étudiants d’été Roberto Diaz, Louis Philippe Picard et Élisabeth. Merci, Roberto, pour ton aide et ton attitude positive!
J’aimerais aussi remercier quelques autres personnes que j’ai rencontrées à l’hôpital Sainte Justine. Merci à Lina et Maude d’avoir été là. Merci à l’équipe de volleyball et aux membres de l’association étudiante. Vous avez rendu mon passage à la maitrise beaucoup plus agréable.
Je tiens aussi à remercier la Fondation des étoiles du CHU Sainte Justine pour la bourse attribuée.
1. Introduction
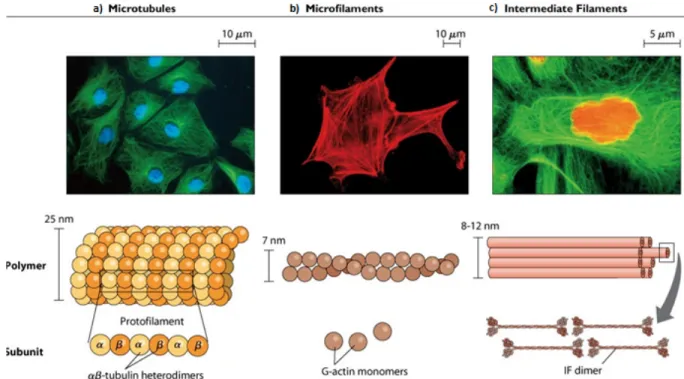
La morphologie cellulaire a évolué pour mieux maintenir les fonctions des divers types cellulaires composant les tissus des différents organes d’un organisme. On retrouve une grande diversité de cellules comme les cellules neuronales, les cellules de macrophages, les cellules épithéliales, etc. 3. Chaque tissu présente des cellules spécialisées, caractérisées par leur forme, rigidité, polarité, et expression génique. La forme, la rigidité et le mouvement d’une cellule sont fortement régulés par son cytosquelette composé d’actine, de microtubules, et de filaments intermédiaires, tel qu’illustré à la Figure 1 4. Ces composantes structurales organisent un réseau de filaments dynamiques dans le cytoplasme de la cellule qui s’assemble, ou se désassemble, suite à des signaux externes spécifiques comme des facteurs solubles, la présence d’autres cellules ou les interactions avec la matrice extracellulaire 4.
Le cytosquelette de la cellule est composé des A) Microtubules B) Microfilaments d’actine C) Filaments intermédiaires. Ensemble, ces composantes forment un réseau élaboré de filaments qui est important pour la migration cellulaire, la forme et la rigidité de la cellule 4.
1.1 Le cytosquelette cellulaire
1.1.1 Les microtubules
Les microtubules sont des longs tubes qui jouent un rôle important dans l’organisation et dans la structure de la cellule, la division et le transport cellulaire 3. Ils se composent d’hétérodimères de tubuline alpha et tubuline bêta (50 kDa) qui polymérisent et forment des protofilaments, tel qu’illusté à la Figure 1, A . Treize protofilaments peuvent ensuite s’assembler latéralement pour former des structures cylindriques (tubes) d’un diamètre d’environ 25 nm qu’on appelle les microtubules 5. Ces tubes possèdent une extrémité positive dynamique et une extrémité négative moins dynamique. Une instabilité dynamique est observée dans la cellule lorsque les microtubules s’effondrent (catastrophe) ou s’allongent très rapidement (sauvetage). L’alpha tubuline et la bêta tubuline lient toutes deux le GTP, mais seulement la tubuline bêta est capable de l’hydrolyser en GDP 5.
1.1.2 Les filaments intermédiaires
Les filaments intermédiaires sont des filaments non polaires d’un diamètre d’environ 11 nm, formés de tétramères de dimères antiparallèles surenroulées qui se chevauchent au milieu de la structure, tel qu’illustré à la Figure 1, C 5. Huit de ces tétramères s’assemblent pour former une nouvelle unité (ULF : unit length filament) qui peut polymériser longitudinalement pour donner place à des longs filaments 5. Ces filaments sont spécifiques à certains tissus et jouent un rôle dans le support et l’intégrité structurale de la cellule en participant dans l’organisation de la membrane nucléaire 3. Par contre, certaines cellules d’insectes comme celles de la Drosophile ne présentent pas de filaments intermédiaires cytoplasmiques, malgré le fait qu’elles expriment certaines lamines nucléaires conservées retrouvées aussi dans les cellules de mammifères 6.
1.1.3 L’actine
L’actine est une protéine (40 kDa) du cytosquelette cellulaire qui se retrouve sous deux formes distinctes soient, sous forme globulaire (G-actin) ou filamenteuse (F-actine). Le cytosquelette d’actine est une structure très dynamique ou les deux formes d’actines coexistent dans la cellule sous une stricte balance. La F-actine est la forme polymérisée de l’actine qui se compose de la G-actine assemblée en filaments qui, enroulés deux par deux dans une hélice, forment des microfilaments d’actine d’un diamètre d’environ 7 nm, tel qu’illustré à la Figure 1, B. Ces microfilaments possèdent une extrémité positive où l’ajout de monomères d’actine est favorisé et une extrémité négative où la perte des monomères d’actine est favorisée7. Cet échange est contrôlé par l’hydrolyse de l’ATP en ADP 7. La F-actine est caractérisée par la liaison au GTP tandis que les monomères de G-actine lient plutôt le GDP7. Des mutations spécifiques peuvent causer des défauts de polymérisation. Ces mutations déstabilisent les interactions entre les monomères de G-actine ou perturbent l’hydrolyse de l’ATP en ADP 8. Les filaments d’actine jouent un rôle important dans l’organisation de la membrane plasmique et donnent la forme à la cellule3. Ces filaments peuvent aussi interagir avec la myosine et fournissent ainsi une activité contractile importante pour le fonctionnement des muscles et pour la division cellulaire 3.
1.1.3.1 La dynamique des filaments d’actine
L’actine est une protéine hautement conservée qu’on retrouve en abondance dans les cellules. La polymérisation de ces filaments dépend tout d’abord de la concentration ionique et la présence d’ATP/ADP2. Chaque unité de G-actine est capable de lier une molécule d’ATP, ou d’ADP, et un ion Mg2+7. Sans la liaison du nucléotide à son site de liaison, on observe la dénaturation rapide de la G-actine 3. La polymérisation de l’actine peut être observée in vitro où l’ajout de cation (Mg2+, K+, Na+) favorise la forme filamenteuse3.
La polymérisation de l’actine in vitro peut être séparée en 3 phases : la nucléation, l’élongation et l’état stable3. La nucléation est la phase déterminante de la vitesse d’assemblage
et est caractérisée par l’assemblage lent des sous-unités de G-actine en dimères et trimères 7. Les trimères peuvent alors servir de noyau et permettent l’élongation, qui aboutit à l’ajout des monomères d’actine aux deux extrémités9. La concentration de monomères de G-actine dans le cytoplasme diminue ainsi jusqu’à l’atteinte d’un équilibre, caractérisé par l’échange continu de monomères aux extrémités des filaments sans variation dans leur taille3. La concentration critique est alors atteinte lors de cet équilibre 7. Cette concentration est différente aux deux extrémités, et un effet de « tapis roulant » est observé à l’état stable. L’ATP-actine est donc préférentiellement ajouté à l’extrémité positive, sans qu’il n’y ait un changement dans la vitesse de dissociation à l’extrémité négative 3.
Les monomères d’actine gardent tous la même orientation lors de l’assemblage d’un filament et on observe alors une polarité où une des extrémités est différente de l’autre (extrémités positive et négative comme mentionnée plus haut). Des monomères d’ATP-G-actine s’ajoutent presque 10 fois plus rapidement à l’extrémité positive comparativement à l’extrémité négative 3.
1.1.3.2 Les modulateurs de la polymérisation des filaments d’actine
Le processus de « tapis roulant » peut être accéléré in vivo à l’aide des protéines modulatrices comme la profiline et la cofiline. La profiline se lie à la G-actine et favorise l’échange de l’ADP pour de l’ATP, tel qu’illustré à la Figure 2 7. Le complexe profiline-ATP-actine peut se lier uniquement à l’extrémité positive ou barbue, car la liaison de la profiline bloque le site de liaison nécessaire à l’ajout des monomères d’actine à l’extrémité négative ou pointue 7. Une fois que le complexe se lie à l’extrémité positive, la profiline se dissocie à l’ajout d’une nouvelle sous-unité, tel qu’illustré à la Figure 2. Cette protéine augmente ainsi le réservoir d’actine liée à l’ATP disponible dans le cytoplasme 7. De plus, la profiline peut lier simultanément des séquences riches en prolines sur d’autres protéines modulatrices 7.
La cofiline lie spécifiquement les sous-unités de F-actine liées à l’ADP (sous-unités plus vieilles dans un filament proche de l’extrémité négative 7. La cofiline se lie en faisant un pont entre deux sous-unités d’actine, ce qui induit un changement dans l’enroulement du filament suivi d’une cassure, tel qu’illustré à la Figure 2 7. Ceci mène à une plus grande abondance
d’extrémités négatives libres, et augmente ainsi la vitesse de désassemblage 3. De cette manière, ces deux protéines peuvent modifier la vitesse critique de l’actine dans la cellule 3. De plus, la protéine AIP1, qui lie aussi l’actine, peut contribuer à la déstabilisation des filaments d’actine. Cette protéine se lie aux extrémités positives des fragments générés par la cofiline et empêche leur élongation, tel qu’illustré à la Figure 2 10.
Il existe des protéines qui facilitent l’étape de nucléation lors de la polymérisation de l’actine. Les formines sont une famille diverse de protéines qui possèdent un domaine FH2 conservé (formin homology 2), capable de se dimériser qui aide l’ajout de sous-unités d’actine à l’extrémité positive du filament naissant 11. Les formines possèdent aussi un domaine FH1 (formin homology 1) adjacent riche en résidus proline qui peut faciliter l’élongation du filament en interagissant avec la profiline 9. Des longs filaments non ramifiés sont ainsi formés qui jouent un rôle dans la formation des fibres de stress, les filopodes et l’anneau contractile lors de la division cellulaire 11.
Il existe d’autres protéines comme le complexe Arp2/3 qui permettent la nucléation des filaments d’actine ramifiés. Le complexe Arp2/3 est formé de 7 sous-unités et est activé en interagissant avec un facteur de promotion de la nucléation (NPF) 11. Une fois activé, le complexe Arp2/3 lie le côté d’un filament d’actine préexistant et permet le branchement et l’élongation du nouveau filament sous un angle spécifique de 70° 11. Ce type de filament joue un rôle important dans la motilité intracellulaire utilisée par certaines bactéries comme Listeria 9.
Figure 2. Les modulateurs de la polymérisation de l’actine
On retrouve certaines protéines in vivo qui peuvent influencer les dynamiques d’assemblage et de désassemblage des filaments d’actine. La profiline favorise l’élongation de l’extrémité positive (l’extrémité barbue), tandis que la cofiline et la protéine AIP1 agissent ensemble en déstabilisant les filaments d’actine12.
1.1.3.3 Le mutant non polymérisable de l’actine
L’actine, composée de quatre sous-domaines, s’organise en deux lobes séparés par une fente qui peut accommoder la liaison du nucléotide et un ion divalent. Sa conformation s’adapte à la liaison de l’ATP ou de l’ADP13,14. La liaison de l’ATP stabilise la forme polymérisée de l’actine (F-actine), tandis que la liaison de l’ADP favorise la forme monomérique de l’actine (G-actine 13. Certaines mutations de la β-actine mènent à des défauts dans la polymérisation. Ces mutations perturbent l’interaction entre les sous-domaines d’actine lors de la polymérisation en mutant soit des résidus de surface, soit l’architecture de la poche de liaison à l’ATP/ADP. Deux mutants avec des forts défauts de polymérisation ont été identifiés par le laboratoire de Richard Treisman. Le mutant R62D, aussi connu comme le mutant de charge inversée, présente des défauts dans un pont de sel entre les sous-domaines deux et quatre et le mutant G13-S/T14-G15, qui affecte la poche de liaison du nucléotide, et perturbe les changements conformationnels nécessaires à l’hydrolyse de l’ATP. Ces deux mutants sont complètement solubles in vivo et ne se localisent pas la actine, ce qui indique qu’ils ne sont pas intégrés dans les réservoirs de F-actine de la cellule8.
1.1.4 Les septines
Les septines sont vues comme une quatrième composante du cytosquelette cellulaire à cause de leur apparence filamenteuse. Elles forment aussi des complexes hétéro-oligomériques qui peuvent polymériser et former des filaments, des anneaux, et des tamis 5. De plus, elles interagissent avec plusieurs protéines, la membrane plasmique, les microtubules et le cytosquelette d’actine. Ces protéines agissent comme protéines d’échafaudage et comme barrière
de diffusion (cils, spermatozoïdes, membrane plasmique). Elles sont aussi impliquées dans la division cellulaire.
1.2 Les septines dans les organismes modèles
1.2.1 Les septines chez la levure bourgeonnante
Une nouvelle composante du cytosquelette a émergé, découverte il y a 40 ans, chez la levure bourgeonnante : Saccharomyces cerevisiae 5. Cette découverte est au nom de Lee Hartwell qui s’intéressait à des gènes possiblement impliqués dans la division cellulaire. Il a identifié 4 nouveaux gènes (cdc3, cdc11, cdc12, cdc13) en utilisant des mutants sensibles aux changements de température. Ces gènes s’avèrent indispensables pour la dernière étape de la division cellulaire, appelée la cytokinèse 15. Les mutants délétères de ces gènes progressent normalement pendant la réplication de l’ADN et la division nucléaire, mais démontrent des défauts dans les phases terminales de la division 16. John Pringle a ensuite étudié la localisation des protéines transcrites à partir de ces gènes en microscopie à fluorescence. Elles se localisent au site de division, ce qui leur a valu le nom : septines 17. Les septines forment un anneau (septum) au site de division pendant la phase de croissance isotropique (croissance uniforme) qui sert comme barrière de diffusion au cou du bourgeon. Cette barrière sert à définir les compartiments membranaires distincts et la localisation de différents facteurs, ce qui induit la croissance anistropique (croissance non uniforme) du bourgeon 18. Suite à la division nucléaire et à la répartition des organelles, le septum se sépare en deux et la cytokinèse a lieu, tel qu’illustré à la Figure 3, C 18. Les septines sont alors importantes pour l’établissement et le maintien de la polarité cellulaire pendant la division cellulaire chez la levure. Des mutations dans ces gènes perturbent le fonctionnement des septines nécessaire pour surmonter le point de contrôle, permettant le passage de la phase de croissance isotropique à la phase de croissance anistropique 17. Ces mutants sont caractérisés par des bourgeons allongés binuclés qui ne sont pas capables de compléter la cytokinèse 17. Le cou du bourgeon a une apparence striée en microscopie électronique et se compose de filaments d’environ 10 nm d’épaisseur, Figure 3, B 19. Les septines semblent jouer un rôle dans l’organisation de ces filaments et l’organisation de la
surface cellulaire tout en orchestrant les interactions entre la membrane plasmique et les composantes du cytosquelette20. La mutation des différentes septines (cdc3, cdc11, cdc12 ou cdc13) mène au même phénotype, ce qui suggère la formation d’un complexe. J. Frazer s’est intéressé à cette possibilité et a réussi à purifier et caractériser un tel complexe chez la levure21. À l’aide d’un anticorps PVP contre 14 acides aminés à l’extrémité C terminal de Cdc3p, il a isolé un complexe de septines contenant 4 protéines de poids moléculaires différents (70 kDa, 63 kDa, 50 kDa et 37 kDa21. Elles ont été identifiées par spectrométrie de masse : Cdc3, Cdc10p, Cdc11p et Cdc10p respectivement21. Ces quatre septines s’assemblent en ratios stœchiométriques (1 :1 :1 :1) et forment des complexes octamériques linéaires qui possèdent 2 copies de chaque septine organisées dans l’ordre suivant : Cdc11-Cdc12-Cdc3-Cdc10-Cdc10-Cdc3-Cdc12-Cdc11, tel qu’illustré à la Figure 3, D21. Ces complexes sont donc symétriques et peuvent s’assembler bout à bout pour former des filaments non polaires à des concentrations salines basses qu’on retrouve physiologiquement (≤100mM)21. De tels filaments chez la levure sont caractérisés par un diamètre entre 7-9 nm et par une périodicité à chaque 32 nm, correspondant à la longueur du complexe de base21. On peut alors se demander si la formation de ces filaments est nécessaire pour le fonctionnement des septines. Il est connu que des mutants Δcdc3 et Δcdc12 (délétères pour ces gènes) ne sont pas viables chez la levure et présentent des défauts de cytokinèse 22. Par contre, des mutants Δcdc10 et Δcdc11 présentent des défauts de polymérisation, mais restent viables 22. Ces septines ne sont donc pas essentielles, mais il a été démontré qu’elles ont un rôle à jouer lors de la sporulation22,23. Ces mutants causent des filaments perturbés au site de bourgeonnement et des anneaux de septines diffus et discontinus ou même parfois absents 22. Par contre, dans les cas où les septines s’y localisent proprement, il y a recrutement de protéines importantes pour la spécification du site de division, comme Bud4p, et un bourgeonnement axial normal, ce qui suggère que leur localisation peut suffire pour permettre la progression de la cytokinèse 22.
Figure 3. Les septines chez la levure bourgeonnante
A) et B) Image en microscopie électronique du collier de septines au site de division composé de filaments hautement organisés et compactés C) Les septines forment un collier au site de division, qui se sépare en 2 anneaux lors de la cytokinèse ce qui permet la séparation des deux cellules D) Octamère de septines, non polaire, composé de Cdc11, Cdc12, Cdc3 et Cdc10 chez la levure bourgeonnante 24-26.
(c)
Figure 4. La structure cristalline de l’hexamère de septines purifié
chez l’humain
Deux copies de chaque septine s’organisent d’une manière symétrique pour donner un hexamère27.
1.2.2 Les septines chez l’humain
Les septines peuvent être classifiées dans 4 catégories différentes selon l’homologie de leurs séquences. Ces catégories portent le nom des septines fondatrices : Sept2, Sept3, Sept6 et Sept7. Sept7 est le seul membre de sa catégorie et est exprimé uniformément dans toutes les cellules. Tous les vertébrés présentent des protéines homologues28,29. Un complexe de septines a aussi été purifié chez l’humain comme illustré à la Figure 4. L’organisation des septines dans ce complexe est conservée comme décrite plus haut. Il se compose de Sept2, Sept6 et Sept7, qui forment un hexamère. La structure crystalline de ce complexe a été résolue avec une résolution de 4 Å. Il semble aussi que Sept9 peut se lier aux extrémités du complexe pour former un octamère30-32. Il n’est pas encore clair ce qui détermine l’assemblage de l’hexamère par rapport à l’octamère, ni s’ils ont des rôles différents. De plus, on peut penser que les composantes du complexe sont interchangeables avec des septines du même groupe et qu’il existe une diversité de complexes hétérogènes dans les tissus. Les septines humaines peuvent aussi polymériser et former des structures hautement organisées. Leur polymérisation est induite par des signaux cellulaires comme ceux qu’on observe lors des points de contrôle pendant la division cellulaire.
1.2.3 Les septines chez la Drosophile
Le grand nombre de gènes de septines, leurs profils d’expression variables selon les tissus et le grand nombre d’isoformes suite à un épissage alternatif complexe, compliquent énormément leur étude 18. La Drosophile est un organisme modèle simple où on retrouve seulement 5 gènes de septines (Sep1, Sep2, Pnut, Sep4, Sep5) et seulement 2 de ces gènes
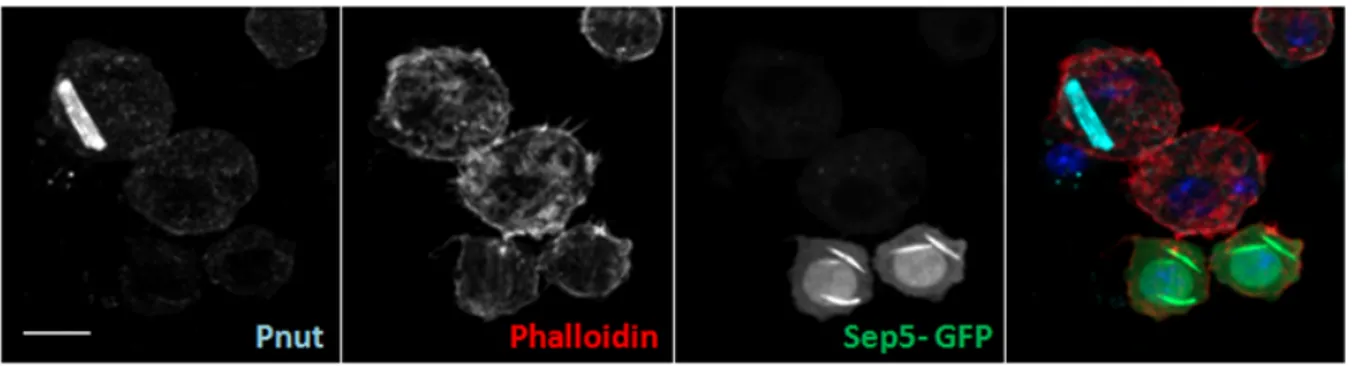
présentent une isoforme (Sep2 PA et PB ; Sep4 PA et PG). Christine Field a été la première à purifier un complexe de base chez la Drosophile à partir des préparations embryonnaires purifiées ou à partir des embryons isolés. Comme chez la levure, des mutations dans le gène pnut (expression ubiquitaire) mènent à des défauts de cytokinèse. Un complexe hexamère a été isolé par immunoaffinité, à l’aide d’un anticorps KEKK contre 14 acides aminés au C-terminal de Pnut (NVDGKKEKKKKGLF). Cette séquence est spécifique à la septine Pnut et a été utilisée comme marqueur spécifique pour le sillon de clivage lors de la division cellulaire. Trois septines participent au complexe de base chez la Drosophile : Pnut (60 kDa), Sep1 (38 kDa) et Sep2 (46 kDa). Par immunobuvardage, on peut voir qu’elles y sont présentes en ratio stœchiométrique (1 :1 :1). Ces septines sont concentrées à 90%-100% dans le précipité suite à l’ajout de PEG, cosédimentent à 8 +/- 0.2 S suite à une sédimentation par gradient de sucrose, et éluent simultanément dans un pic, à partir d’une colonne de chromatographie sur gel, ce qui supporte fortement l’hypothèse de la formation d’un complexe. La masse du complexe est estimée à 340 kDa (2 copies de chaque septine20. Ces complexes peuvent aussi polymériser et former des filaments linéaires de 7-9 nm de diamètre avec une périodicité de 26 nm, qui correspond à la longueur du complexe de base. Ces filaments peuvent aussi former des structures hautement organisées comme des câbles et agrégats à des hautes concentrations de septines. De telles structures peuvent être observées dans des cellules S2 de Drosophile, non transfectées, fixées avec du formaldéhyde et marquées en immunofluorescence à l’aide d’un anticorps contre Pnut. Ce marquage permet d’observer des structures massives de haute intensité dans le cytoplasme de ces cellules, tel que démontré par la Figure 5, A, B. Pnut se localise aussi au sillon de clivage, où elle interagit avec l’extrémité C terminal de l’anilline qui permet son recrutement (Kechad, Jananji, Ruella et Hickson, 2012), à proximité de la membrane plasmique et de la myosine pour permettre la bonne organisation du corps central, tel qu’illustré à la Figure 5, A, B.
Figure
hautem
A et B, P Cellules l’anilline septine (S1.3 St
1.3.1 M
L les plant cytokinès de septin sept chez au long d avec acti A ou G1 permet d directeme 5. L’h
ment orga
Pnut se local S2 non tra e (vert) et Pn Sep1, Sep2 etructure
Motifs et
Les septines es 18. Ceci p se observée nes varie énoz la levure et de leur séqu vité GTPase 1 (GxxGxGK de se lier au ent avec le n
hexamère
anisées d
lise au sillon ansfectées fi nut; objectif et Pnut) orgae
Domaine
sont hautem peut être ex chez les pla ormément d t douze chez ence d’acide e possédant u KST), B ou u GTP et d nucléotide, te de ba
e septine
n de clivage xées au for 63X, échelle anisées d’unes protéiq
ment conserv xpliqué par l antes qui pos’un organism z l’humain. C es aminés. E une boucle-P u G3 (DxxG e l’hydrolys tandis que le
se et la
es chez la
et dans des s rmaldéhyde e 5 μm c) H ne manière syques
vées chez lesla formation ssèdent une me à un autr Ces protéine Elles font par
P. Cette bouc G) et motif s ser 17. Le m es motifs G3
a forma
a Drosoph
structures m et marquée Hexamère com ymétrique33,3 s eucaryotes n de phragm paroi cellul re de seulem s présentent rtie de la lar cle, caractér spécifique a motif G1 for 3 et G4 sonttion des
hile.
massives de h es avec des mposé de 2 34. s 17, mais so moplastes, vo laire 18. Le ment deux ch t au moins 2 rge superfam risée par les m au GTP ou G rme la bouc t essentiels p Cs structu
haute intensit anticorps c copies de ch ont absentes oie alternativ nombre de g hez C. elega 26% d’homo mille de prot motifs de W G4 (xKxD), cle P et inte pour la liaisoures
té contre haque chez ve de gènes ans, à ologie téines Walker , leur eragit on auMg2+ et confèrent la spécificité de liaison au GTP plutôt qu’à d’autres nucléotides29. Plus spécifiquement, les septines appartiennent à la sous-division TRAFAC, car elles contiennent une thréonine conservée essentielle à la propre hydrolyse du GTP en GDP 18. Par contre, elles se distinguent par le fait qu’elles ne possèdent pas d’asparagine à la position 1 de leur motif C (AKAD ou GKAD). Il n’est pas encore clair si la fonction GTPase des septines module leurs fonctions dans la cellule en régulant leur assemblage en complexes et leur polymérisation en filaments. Chaque septine contient aussi un élément unique aux septines composé de 50 acides aminés fortement conservés importants à l’association des monomères27. La plupart des septines possèdent aussi un domaine surenroulé C-terminal d’environ 50-100 acides aminésqui sert aux interactions protéiques et pourrait aussi être important en synergie avec le domaine de liaison au GTP pour la polymérisation des septines en filaments. Ces protéines possèdent aussi un domaine polybasique qui leur permet d’interagir avec la membrane plasmique à travers les phospholipides.
1.3.2 Interfaces G et NC
La structure du domaine de liaison au GTP de Sept2 chez l’humain a servi comme modèle pour l’étude des interactions retrouvées lors de la polymérisation du complexe de base (Sept2-Sept6-Sept7). Sept2 recombinant, doté d’une troncation dans le domaine surenroulé C-terminal, a été purifié de bactéries (E. coli) et se retrouve sous forme de dimère (72 kDa) ou de monomère (36 kDa)27. La même chose est observée suite à la purification du Sep2 recombinant de Xenopus à partir des bactéries 35. Il semble que la formation des complexes de septines ne requière pas nécessairement plusieurs septines différentes35,36. Il a aussi été suggéré que certaines septines sont interchangeables dans le complexe, et plusieurs complexes hétérogènes peuvent exister dans un même organisme selon leur disponibilité.
Deux interfaces de liaison sont possibles lors de la dimérisation de Sept2 : l’interface G et l’interface NC, tel qu’illustré à la Figure 6, C. L’interface G se compose de la boucle P qui stabilise les phosphates, négativement chargés, et le motif AKAD, qui interagit avec la guanine spécifiquement. L’interface NC se compose des extrémités N (variable) et C (domaine surenroulé) terminales. Seulement des mutations dans l’interface G (Phe156Asp, Trp260Ala +
His270A dimère et dépend a GppNHp In Ce comp ensemble dimère. interagiss interface
Figure
septine
Asp) déstabil t monomère aussi de la p (hydrolyse n vivo, Sept2 plexe est asyme par l’inter Sept2 et S sent par leu s).
e 6. La st
es
lisantes pour . Cette inter nature du n lente) favor 2 participe p métrique et e rface NC de Sept6 intera urs interfacetructure
r la liaison face permet nucléotide p rise la forme lutôt dans un est formé de e Sept2, co agissent par es NC, tel qélémenta
du GTP/GD donc la dim plutôt que d dimère ou m n complexe e deux trimèr ntrairement r leurs inte que démontaire et les
DP déplacen mérisation de de sa présen monomère re hexamère (2 res (Sept2-S à ce qu’on erfaces G, t tré par la Fs interfa
nt l’équilibr e Sept2 in vi nce. L’ajout espectiveme 285kDa) ave Sept6-Sept7) n observe p tandis que Figure 6, Cces d’int
re entre la f tro. Cet équ t de GDP o ent. ec Sept6 et S ) qui interagi plus haut av Sept6 et S (alternationeraction
forme uilibre ou de Sept7. issent vec le Sept7 n desdes
A) Structure élémentaire des septines B) Familles de septines C) Interfaces NC (extrémités N et C terminales) et G (GTP-binding domain)
1.3.3 Le rôle du GTP/GDP dans la polymérisation des septines
Ces hexamères lient le GDP et GTP dans un ratio de 2 :1 et contient donc du GDP et du GTP 35. Chez l’humain, Sept2 et Sept7 tiennent une molécule de GDP hydrolysée, tandis que Sept6 ne possède pas la capacité d’hydrolyser le GTP en GDP et reste lié au GTP non hydrolysé. Ceci ne déstabilise pas son interaction avec les septines avoisinantes dans le complexe. De plus, la délétion des domaines surenroulés C-terminaux (Sept2 1-308, Sept6 1-310, Sept 1-305) ne perturbe pas la formation du complexe hexamérique humain. Par contre, des mutants Δ cc-Sep2 de Xenopus présentent une diminution de leur efficacité de polymérisation 35. Ces hexamères s’assemblent bout à bout et forment des anneaux, et des filaments (4-5 nm larges) à des concentrations salines basses et des filaments courts et uniformes à des hautes concentrations salines chez l’humain. Ces complexes ne sont pas parfaitement linéaires et sont donc assez flexibles pour permettre la formation des anneaux et filaments courbés. L’interaction entre Sept7 d’un complexe et celui d’un autre est clé dans la formation de ces structures hautement organisées. Cette interaction par leur interface G est sensible aux variations salines, contrairement aux interactions observées entre les autres septines du complexe. Ceci peut être expliqué par le fait que l’interface G dans un dimère (i.e. : Sept7-Sept7) est moins stable qu’une interface G dans un hetérodimère (i.e. : Sept6-Sept7), ou par la nature du nucléotide lié, soit GDP-GDP ou au GTP-GDP respectivement. La formation des filaments par d’autres protéines comme l’actine et les microtubules est dépendante de l’échange et l’hydrolyse du nucléotide lié soie ATP/ADP ou GTP/GDP 35. Dans le cas des septines, la formation de filaments requiert la présence du GTP ou un analogue non hydrolysable (GTP gamma S). La présence du GTPγS déplace l’équilibre vers la formation de polymères, et la présence de GDP fait le contraire 35. Ceci peut être expliqué de deux façons, soit que la liaison du GTP a un effet stabilisant par rapport à la liaison du GDP, ou les monomères liés au GTP ont une plus grande affinité de liaison aux filaments existants par rapport aux monomères liés au GDP en solution 35. L’hydrolyse du GTP n’est donc pas nécessaire pour la polymérisation des septines 35.
1.3.4 Modifications post traductionnelles
Plusieurs modifications post-transcriptionnelles ont été observées chez les septines. Elles sont acétylées, phosphorylées et peuvent être SUMOylées. Ces modifications ne semblent pas être conservées sur des résidus spécifiques entre les différentes septines. Celles d’entre elles les plus conservées se situent dans l’interface G, et modulent l’assemblage des polymères de septines et leur stabilité. Les autres modifications sont aléatoirement distribuées dans les séquences N terminales et C terminales variables, et régulent la formation des structures hautement organisées spécifiques aux différents organismes 26.
1.4 La relation avec l’actine
1.4.1 Les septines et le cytosquelette d’actine lors de la division
Le rôle des septines pendant la cytokinèse et leur mécanisme d’action ne sont pas très bien compris. Les septines interagissent avec l’anilline (protéine qui lie l’actine au sillon de clivage) à travers son domaine PH et sont alors recrutées au sillon contractile lors de la division. On y retrouve aussi toute la machinerie contractile composée de la myosine et des filaments d’actine. Ces filaments d’actine dans l’anneau contractile permettent le pincement de la membrane plasmique et ainsi la séparation des deux cellules filles. Plusieurs rôles sont possibles dans le cas des septines : elles peuvent servir de barrière de diffusion entre les deux cellules filles, elles peuvent servir à ancrer la machinerie contractile à la membrane plasmique par leur interaction avec l’anilline, ou encore, elles peuvent servir à organiser et plier les filaments d’actine dans l’anneau contractile. Une interaction directe entre la F-actine et les septines a été démontrée récemment34,37 ce qui suggère un lien entre les deux. Le mécanisme d’interaction entre ces deux protéines est présentement sujet à plusieurs études.
1.4.2 Les septines comme modulateurs de l’actine
La cellularisation chez l’embryon de Drosophile est un processus très semblable à la cytokinèse cellulaire. Lors de la cellularisation, on observe l’invagination de la membrane plasmique entre les noyaux du syncytium embryonnaire pour former un grand nombre de cellules épithéliales polarisées20,38. Le front de la membrane plasmique est constitué de l’anilline, la myosine II (non musculaire), les septines et la F-actine qui composent aussi l’anneau contractile pendant la division cellulaire. Les septines peuvent lier l’anilline, la membrane plasmique et la myosine II39,40. Des mutants nuls pour pnut présentent un délai d’invagination pendant la phase rapide avec une diminution des niveaux de myosine et un délai dans l’accumulation de l’actine au front membranaire. Ces mutants présentent des défauts dans l’organisation de l’actine, qui forme des structures polygonales et des filaments peu étanches à la place des anneaux au front membranaire en absence de septines. Les septines permettent l’organisation et la compaction du cytosquelette d’actine lors de l’événement de cellularisation34. Des complexes de septines recombinantes DSep1-DSep2-Pnut/hSep7 purifiés de bactéries sont capables de lier les filaments d’actine (F-actine) avec une constante de dissociation de 1,2 +/- 0,5 µM. Cette constante est semblable à celle de certains modulateurs de l’actine comme le Fascin, la Filamine et l’alpha-Actinin (0,1 à 1,5 µM), ce qui supporte l’idée des septines en tant que modulateurs de l’actine. En absence de septines l’actine forme des filaments linéaires. La présence des septines (plus grand que 0,05 µM) permet leur compaction et assemblage de structures sphériques comme des anneaux, des boucles et des lassos. Les septines en solution sous forme non polymérisée (concentration saline 300 mM KCl ; concentration septines « 0,2 µM) décorent et plient les filaments d’actine in vitro. À des concentrations de septines plus hautes, on observe un mélange de filaments d’actine droits et pliés.
Figure 7. L’effet des septines sur l’organisation de l’actine (in vivo)
dans les canaux du sillon lors de la cellularisation chez la Drosophile
Le mutant nul de pnut cause un cytosquelette d’actine désorganisé et éparpillé34.1.4.3 Les drogues qui influencent le cytosquelette d’actine
Il existe plusieurs drogues qui peuvent soit stabiliser ou déstabiliser le cytosquelette d’actine. Ici on se concentre sur le mécanisme d’action de deux d’entre elles soit, la Latrunculin A et la Jasplakinolide.
La Latrunculine A est isolée à partir de l’éponge de mer rouge Latrunculia magnificans qui relâche une substance rouge capable de tuer un poisson en quelques minutes. Cette molécule affecte le cytosquelette d’actine spécifiquement avec un temps d’action très rapide. Cet effet est réversible après lavage de la drogue. Cette drogue présente un mécanisme significativement plus simple que les drogues traditionnellement utilisées comme le Cytochalsin D. Contrairement au Cytochalsin-D qui affecte la cinétique de polymérisation des filaments d’actine, la Latrunculin A lie les monomères de G-actine ce qui empêche leur polymérisation. Il est possible de rendre l’actine résistante à cette drogue en introduisant un nombre de mutations dans un site à proximité du site de liaison à l’ATP/ADP. Cette interaction semble empêcher l’échange de nucléotide et les changements conformationnels nécessaires lors de l’assemblage de l’actine en filaments41.
La Jasplakinolide est un peptide cyclique, isolé à partir de l’éponge de mer Jaspis
johnstoni, qui stabilise le cytosquelette d’actine in vitro. Cette drogue augmente le taux de nucléation de l’actine en diminuant la taille de l’oligopeptide nécessaire à l’initiation de ce processus. Trois sous unités d’actine à la place de quatre sont alors suffisantes pour permettre la polymérisation des filaments d’actine. La Jasplakinolide lie l’interface de ces trois monomères d’actine ce qui facilite la nucléation. Ainsi, la concentration de G-actine diminue significativement. In vivo, le traitement avec la Jasplakinolide empêche le marquage de F-actine à l’aide de la sonde phalloidine, car elles se lient compétitivement à l’actine42,43.
1.4.4 Lien entre les septines et le cytosquelette d’actine
Sept2 peut être observée dans des structures granulaires ou fibreuses proches des structures d’actine dans les fibres de stress, les lamellipodes et les filopodes qu’on retrouve dans les fibroblastes mammifères et les cellules de neuroblastome de souri, N18 44. La déstabilisation des fibres d’actine par mutation de Ras, un apport nutritif bas, un traitement avec le Cytochalasin D ou le Botulinus C3 exo-enzyme mènent tous à la déstabilisation des septines sous forme fibreuse seulement. Normalement, les septines colocalisent avec les fibres linéaires, les arcs au cortex et des fibres épaisses en dessous de l’enveloppe nucléaire. Cette colocalisation est perturbée rapidement après l’ajout du Cytochalasin D ou de la Jasplakinolide, inhibiteurs de la polymérisation d’actine. Les septines se réorganisent en anneaux cytoplasmiques d’un diamètre de 0,66 +/- 0,08 µm, qui semblent être une forme de stockage que les septines adoptent naturellement. Ce processus est réversible 20 minutes après lavage des drogues. Un complexe de base a aussi été isolé chez les mammifères, à partir des cellules HeLa et des cerveaux de souris, composé de Sep2, Sep6 et Sep7. Ces protéines peuvent aussi être co-exprimées dans des cellules d’insecte par infection virale (baculovirus) et peuvent être purifiées en complexe (2 :2 :2) dans des ratios stœchiométriques comme chez la Drosophile 20 et la levure21. Ces complexes forment des courts filaments d’un diamètre d’environ 7 nm à des concentrations salines entre 0,1-0,5 M KCl, mais forment des structures surenroulées et des anneaux à des concentrations salines plus élevées (Kinoshita, Field, Coughlin, Straight et Mitchison, 2002). Ces anneaux présentent un diamètre de 0.68 +/- 0.09 µm quand examinés par fluorescence, et un diamètre de 0.51 +/- 0.07 µm quand examinés par microscopie électronique. Ces complexes ne présentent pas une forte
affinité pour les filaments d’actine, ce qui suggère un recrutement indirect, coordonné par une protéine adaptatrice. L’Anilline a été proposée comme médiateur de cette interaction, car cette protéine peut à la fois compacter les filaments d’actine linéaires et recruter les complexes de septines. Le domaine PH à l’extrémité C terminal de l’anilline est responsable de son interaction avec les septines, tandis qu’une région à l’extrémité N terminale est importante pour sa liaison avec l’actine. Cette protéine se trouve à être nucléaire dans des cellules en interphase et ne peut donc promouvoir l’interaction entre les septines et l’actine que lors de la division cellulaire au clivage du sillon. Des expériences avec ARNi dans des cellules NIH3T3 indiquent un rôle des septines dans la stabilisation des filaments d’actine, surtout dans les fibres épaisses en dessous de la membrane nucléaire. De plus, leur activité GTPase semble aussi être importante pour leur organisation, car des mutations dans les domaines G1, G2, G3 et l’injection du GTPγS (non- hydrolysable) mènent à la formation des agrégats cytoplasmiques, ou à un signal cytoplasmique diffus44.
1.4.5Expression différentielle des septines
Les niveaux d’expression des septines varient selon les différents tissus. Sept4 est fortement exprimé dans le cerveau, mais son expression n’est pas spécifique aux cellules neuronales, car une expression modérée est associée à la rate, les reins, les poumons et les testicules (niveaux d’expression bas détectés dans le pancréas, le foie et le cœur). Par contre, les profils d’expression des différentes septines ne sont pas toujours identiques. Sept2 est exprimé dans tous les tissus avec une forte expression dans le cerveau et très peu dans le cœur. Les différents profils d’expression suggèrent des rôles distincts pour les septines. Sept4 et Sept2 ne forment pas un complexe ensemble, malgré qu’elles colocalisent à l’anneau contractile lors de la division cellulaire et dans les fibres de stress d’actine. Sept4 colocalise parfaitement avec le marquage à la phalloidine, tandis que Sept2 était absent au cortex et n’était pas présent sur toute la longueur des filaments d’actine. La perturbation du cytosquelette d’actine par Latrunculin B ou Cytochalasin D cause l’agrégation des septines en punctas cytoplasmiques proches de la membrane plasmique. Les agrégats de Sept4 colocalisent parfaitement avec le marquage à la phalloidine, tandis que Sept2 a été observé dans des structures irrégulières et dans des anneaux
avec une colocalisation partielle avec l’actine. Sept2 se retrouve dans la fraction membranaire, tandis que Sept4 est présent autant dans la fraction membranaire que la fraction contenant les protéines associées au cytosquelette d’actine. La perturbation de l’actine par Latruculin B ne change pas leur distribution, ce qui indique que leur forme filamenteuse n’est pas nécessaire pour leur association avec la membrane plasmique ou avec le cytosquelette d’actine 45. Les septines ressemblent aux filaments intermédiaires, dû au fait qu’elles forment des filaments non polaires. Par contre, leur rôle n’est pas clairement élucidé. Les septines sont impliquées dans plusieurs processus tels que la division cellulaire, la neurogénèse et la ciliogénèse. Lors de ces processus, les septines agissent comme des protéines d’échafaudage pour le recrutement de nombreuses protéines, mais peuvent aussi former des barrières de diffusion et compartimenter la membrane plasmique27.
1.5 Sondes de F-actine
La phalloidine est un heptapeptide bicyclique isolé à partir du champignon Amanita phalloides. Elle stabilise la F-actine, en inhibant la relâche du phosphate nécessaire pour l’hydrolyse de l’ATP en ADP, ce qui inhibe la dépolymérisation de l’actine 46. Elle semble se lier au niveau de la fente entre les deux domaines du monomère d’actine 47. Ce peptide n’est pas perméable à travers la membrane cellulaire. Couplé à la Rhodamine (colorant fluorescent), on l’utilise pour le marquage de la F-actine en microscopie dans des cellules préalablement fixées.
Figure 8. L’effet stabilisant de la phalloidine sur les filaments
d’actine
La phalloidine se lie aux filaments d’actine et empêche la relâche du phosphate nécessaire à la dépolymérisation 47.
LifeAct est un peptide composé de 17 acides aminés, utilisé pour visualiser le cytosquelette
d’actine dans des cellules vivantes. Sa petite taille en fait un excellent marqueur. Couplé au GFP, LifeAct peut être utilisé pour l’étude des filaments d’actine in vivo. Il présente une affinité beaucoup plus grande pour la F-actine que pour la G-actine et se lie à un site distinct de celui utilisé par Latrunculin A ou la phalloidine48.
1.6 Le Forchlorophenuron (FCF)
Le FCF est une cytokinine synthétique utilisée en agriculture qui a aussi un effet stabilisant spécifiquement sur le cytosquelette des septines. Cette drogue se lie aux septines sous deux conformations différentes à la surface ou profondément dans la poche de liaison au GTP/GDP. Elle interagit avec le motif de Walker A (GxxxxGKS/T) qui stabilise le phosphate du GTP et le motif (AKAD) qui confère la spécificité au GTP en stabilisant la guanine. Cette interaction stabilise la liaison au GTP et empêche son hydrolyse, ce qui stabilise la formation de structures de septines 49. Des structures de septines anormalement larges sont observées après traitement avec cette drogue, et cet effet est réversible après lavage de la drogue. En plus de la formation de telles structures, le traitement au FCF induit des défauts de mitose et migration cellulaire aussi causés par la déplétion des septines par ARNi. Cette drogue présente une faible cytotoxicité et ne perturbe pas le cytosquelette d’actine et les microtubules 24.
1.7.1 Protéines d’échafaudage
Les septines sont des protéines d’échafaudage et sont responsables du recrutement de certaines protéines impliquées dans différentes voies cellulaires à des sites et moments spécifiques. Ceci permet leur interaction physique avec des partenaires de liaison et mène à l’exécution de leur fonction 50. Les septines forment une structure stable qui favorise cette interaction 50. De telles structures peuvent être observées au site de division cellulaire, à la membrane plasmique, et aux sites d’invasion des cellules épithéliales par certaines bactéries.
Par exemple, le collier de septines entre deux cellules en division chez la levure orchestre la cascade de protéines kinases nécessaires pour surmonter le point de contrôle G2 (point de contrôle de morphogénèse 51. Les septines sont aussi importantes lors de l’abscision, où elles aident la séparation des deux cellules filles. Chez les mammifères, cette séparation se fait par l’ajout de membrane nouvellement synthétisée dans des zones spécifiquement définies. Ce processus est spécifiquement régulé par les SNARES, par le complexe d’exocyste et par les septines. Des défauts dans le fonctionnement des SNARE, protéines associées à la membrane, mènent à des défauts dans la fusion membranaire et à l’accumulation des vésicules. La déplétion de Sept9 et Sept2, septines impliquées dans la division cellulaire, mène à un phénotype semblable, ce qui confirme un rôle des septines dans la régulation de la voie du trafique vésiculaire par les SNARE 52. Elles interagissent avec le complexe exocyste 53 et Sept5 peut lier directement syntaxin 1 et 254.
Les septines peuvent aussi former des structures d’échafaudage à la membrane plasmique. Sept4 lie spécifiquement les phosphatidylinositol 4,5-biphosphate et phosphatidilinositol 3, 4, 5-triphosphate55. Chez la levure, les septines ont une affinité de liaison plus grande pour les phosphatidylinositol-4-phosphate et phosphatidylinositol-5-phosphate 56.
Les septines participent dans le processus d’invasion des cellules épithéliales par des bactéries pathogènes57. Sep9, Sep2 et Sep11 sont recrutés à la membrane au site d’invasion dans des colliers autour de l’actine57. Ce recrutement est dépendant de l’accumulation d’actine au site d’invasion (Mostowy, Janel et al. 2011). InlA interagit avec E-cadhérine et InlB interagit avec le récepteur tyrosine kinase Met. La bactérie Listeria monocytogenes utilise la voie du InlB pour entrer dans la cellule par une cascade d’événement incluant la polymérisation de l’actine et l’expansion membranaire 58. Sept2 et Sept11 régulent les niveaux et la distribution des récepteurs
de surface Met et leur déplétion est caractérisée par une diminution de l’élasticité cellulaire et des défauts dans la forme cellulaire 58. La déplétion de Sep2 par ARNi diminue l’invasion bactérienne, tandis que la déplétion de Sep11 a l’effet contraire57,59.
1.7.2 Barrière de diffusion
Les septines forment des barrières de diffusion qui servent à définir différents domaines membranaires, qui se différencient par la localisation des protéines spécifiques. Des anneaux de septines sont observés entre deux cellules en division, à la base de l’annulus des spermatozoïdes, à la base des cils et entre les neurones dendritiques. Le collier chez la levure assure la propre ségrégation des protéines entre la mère et le bourgeon, et le maintien de la polarité60,61.
Normalement, l’annulus (en forme d’anneaux) assure l’intégrité du spermatozoïde et maintient l’emplacement des différentes protéines tout au long de sa queue. Les septines semblent participer dans l’assemblage de cette structure, car des souris, nulles pour le gène Sept4, ne possèdent pas d’annulus 62. Ces souris présentent donc des défauts de morphologie, de motilité et sont stériles.
Les cils sont des protrusions cellulaires, enveloppées de membrane, qui possèdent une fonction sensorielle (primaires) ou motile. Un complexe de 9 protéines est formé et maintenu à la base des cils par Sept2 63. Ce complexe assure la séparation de la membrane cellulaire et la membrane des cils. La déplétion des septines est caractérisée par des défauts de formation et induit une diffusion augmentée64,65.
Les neurones dendritiques présentent des réseaux branchés qui assurent la transmission des signaux entre les cellules avoisinantes. La déplétion des septines perturbe cette organisation et cause des défauts de communication entre les dendrites32,66.
Les septines sont dérégulées dans plusieurs maladies comme le cancer, les maladies neurodégénératives et les ciliopathies. Les mécanismes par lesquels elles contribuent à ces désordres ne sont pas encore bien élaborés.
1.8.1 Le cancer
Il a été démonté que plusieurs septines sont surexprimées dans des tumeurs solides. Étant donné que les septines sont impliquées dans la division cellulaire et se localisent au sillon de clivage, leur dérégulation mène à des défauts de cytokinèse. Sep2 a été démontré comme jouant un rôle dans l’attachement des chromosomes au fuseau mitotique par son interaction avec CENP-E, impliqué dans la régulation du point de contrôle 67. Sa dérégulation peut essentiellement mener à la mauvaise distribution des chromosomes et l’aneuploïdie, typique des cellules cancéreuses. À ce jour, les septines ont été démontées à servir comme partenaires de fusion de certaines gènes et agissant en tant qu’oncogènes et suppresseurs de tumeurs selon les cas.
Sept9_i1 spécifiquement a été proposé comme marqueur pour le cancer de la prostate vu que cette septine est exprimée dans les cellules cancéreuses uniquement. Son expression corrèle avec une note de Gleason élevée 68,69. Un test sanguin Epi proColon® de dépistage pour le cancer du côlon a été proposé, basé sur le fait que le gène sept9 se retrouve hyperméthylé au niveau des ilots CpG dans les cellules cancéreuses. Ce moyen de détection est avantageux, car il est simple et rapide.
La surexpression de Sep2 a été associée avec une meilleure prolifération des cellules cancéreuses en augmentant l’expression des métalloprotéinases 2 et 9 (MMP-2 et MMP9) de la matrice cellulaire et en inhibant l’activité de clivage des caspases 3,7 et 9. Ceci augmente la capacité invasive des tumeurs et inhibe l’apoptose 70.
Certaines septines (Sept2, Sept5, Sept6, Sept9, Sept11) peuvent aussi servir comme partenaires de fusion du gène MLL dans les cancers du sang comme la leucémie. Cette fusion survient suite à une translocation des chromosomes au locus 11q2371. Elle pourrait potentiellement perturber les interactions entre les septines et donc, la formation des complexes et structures hautement organisées. Par contre, les mécanismes d’action de ces gènes de fusion
dans l’établissement du cancer ne sont pas encore clairs. Les protéines de fusion du gène MLL mènent souvent à l’activation d’un nombre de gènes HOX et d’autres gènes impliqués dans la différenciation cellulaire72.
Tableau I. L’expression et l’implication des septines dans le cancer 70