O
pen
A
rchive
T
OULOUSE
A
rchive
O
uverte (
OATAO
)
OATAO is an open access repository that collects the work of Toulouse researchers and makes it freely available over the web where possible.This is an author-deposited version published in : http://oatao.univ-toulouse.fr/
Eprints ID : 8815
To cite this version :
Garrier, Leslie. Facteurs de variation du transfert passif de
l’immunité chez le chiot en élevage. Thèse d'exercice, Médecine
vétérinaire, Ecole Nationale Vétérinaire de Toulouse - ENVT, 2012, 82 p.
Any correspondance concerning this service should be sent to the repository administrator: staff-oatao@inp-toulouse.fr.
4
REMERCIEMENTS
Au président de thèse,
A Monsieur le Professeur Antoine BLANCHER
Professeur des Universités Praticien hospitalier
Chef de service du laboratoire d’Immunologie,
Qui nous a fait l’honneur d’accepter la présidence de notre jury de thèse, Hommages respectueux.
Au jury de thèse,
A Madame le Docteur Sylvie CHASTANT-MAILLARD
Professeur à l’Ecole Nationale Vétérinaire de Toulouse
Pathologie de la reproduction,
Qui a nous a confié ce sujet et guidé dans l’élaboration de ce travail, Pour son soutien, sa patience et sa gentillesse, Sincères remerciements.
A Madame le Docteur Séverine BOULLIER
Maître de Conférences à l’Ecole Nationale Vétérinaire de Toulouse
Immunologie,
Qui a très aimablement accepté de faire partie de notre jury de thèse, Sincères remerciements.
5
DEDICACES
A mes parents, pour leur soutien et pour avoir fait de moi ce qui je suis aujourd’hui. A ma sœur, dont l’enthousiasme permanent m’a inspiré quand j’en manquais ! A mon petit frérot, à qui je passe le flambeau pour les études !
A Laurent, mon amour, qui a été à mes côtés à chaque instant et qui n’a jamais cessé de croire en moi.
A mes grands et arrières grands parents, y compris ceux qui sont partis : ça y est, votre petite fille est enfin vétérinaire !
A toute ma famille, en reconnaissance de votre soutien tout au long de ce parcours. A Edith et Tanguy, pour leur soutien et leur amitié sans faille.
A mes Groushkas Elodie et Nadia, que de bons moments passés ensemble.
A ma super coloc et amie Marie Blanche, avec qui j’ai partagé une formidable expérience québécoise et américaine, et qui a eu la patience de me soutenir quand le moral n’allait pas. A tous mes amis que j’ai eu la chance de rencontrer durant mon séjour en terre métropolitaine, je suis désormais loin mais je pense beaucoup à vous !
A tous ceux qui m’ont soutenu, réconforté et qui ont cru en moi tout au long de ce long mais beau parcours.
6
TABLE DES MATIERES
LISTE DES FIGURES ... 8
LISTE DES TABLEAUX ... 10
INTRODUCTION ... 11
PARTIE 1 : SYNTHESE BIBLIOGRAPHIQUE ... 12
CHAPITRE 1 : FACTEURS INFLUENÇANT LA QUANTITE ET LA QUALITE DU COLOSTRUM ... 14
1 PHYSIOLOGIE DE LA PRODUCTION COLOSTRALE ... 14
1.1 MODALITES D’IMPORTATION COLOSTRALE DES IGG ... 14
1.2 VARIATIONS HORMONALES LORS DU PERI-PARTUM ... 15
1.3 CONTROLE HORMONAL DE LA COLOSTROGENESE ... 15
2 INFLUENCE DU POIDS DE LA PORTEE ... 19
3 ROLE SUPPOSE DE LA POSITION DES TETINES ... 20
3.1 NUMERO DE TETINE ET PRODUCTION COLOSTRALE ... 20
3.2 NUMERO DE TETINE ET CONCENTRATION EN IGG ... 20
4 INFLUENCES DE LA CONDUITE D’ELEVAGE ET DE L’ENVIRONNEMENT SUR LA PRODUCTION COLOSTRALE ... 21
4.1 EFFET DE L’ALIMENTATION ... 21
4.2 EFFET DE LA VACCINATION ... 27
4.3 INFLUENCE DU DEROULEMENT DE LA MISE-BAS SUR LA PRODUCTION COLOSTRALE ... 27
4.4 EFFETS ENVIRONNEMENTAUX ... 29
4.5 CONCLUSION ... 30
CHAPITRE 2 FACTEURS DE VARIATION DE LA PRISE COLOSTRALE ET DE L’ABSORPTION DES IGG DES NOUVEAU-NES ... 32
1 VARIATIONS PHYSIOLOGIQUES DE L’ABSORPTION DES IGG ... 32
1.1 PASSAGE DES IGG DE LA LUMIERE INTESTINALE VERS LA CIRCULATION SANGUINE ... 32
1.2 FERMETURE DE LA BARRIERE INTESTINALE ... 32
1.3 FACTEURS DE VARIATION DE L’ABSORPTION INTESTINALE DES IGG ... 33
2 INFLUENCE DU POIDS DE NAISSANCE ... 35
2.1 POIDS DE NAISSANCE ET ACCES AUX MAMELLES ... 35
2.2 POIDS DE NAISSANCE ET CONSOMMATION COLOSTRALE ... 36
2.3 INFLUENCE DE L’HETEROGENEITE DES POIDS AU SEIN D’UNE PORTEE ... 37
3 INFLUENCE DU RANG DE NAISSANCE ... 37
3.1 EFFET DU RANG DE NAISSANCE SUR LA CONSOMMATION COLOSTRALE ... 37
3.2 EFFET DU RANG DE NAISSANCE SUR L’ACQUISITION DES IGG ... 37
7
4.1 FACTEURS PREDISPOSANT A L’ASPHYXIE ... 41
4.2 CONSEQUENCE DE L’ASPHYXIE DU NOUVEAU-NE SUR LA PRISE COLOSTRALE ... 42
5 INFLUENCE DE LA PREMATURITE, DE L’INDUCTION ET DU DEROULEMENT DE LA MISE-BAS ... 43
5.1 CONSEQUENCES DE L’INDUCTION DE LA MISE-BAS ... 43
5.2 CONSEQUENCES D’UNE MISE-BAS PREMATUREE ... 44
5.3 CONSEQUENCES D’UNE MISE-BAS PAR CESARIENNE ... 44
6 FACTEURS ENVIRONNEMENTAUX ... 45
PARTIE 2 : ETUDE EXPERIMENTALE ... 47
MATERIELS ET METHODES ... 48
1 ANIMAUX ... 48
2 PRELEVEMENTS ... 49
3 TECHNIQUE DE DOSAGE DES IMMUNOGLOBULINES ... 49
3.1 PRINCIPE ... 49
3.2 PROTOCOLE ... 50
3.3 ANALYSE STATISTIQUE ... 51
RESULTATS : FACTEURS DE VARIATION DU TRANSFERT PASSIF DES IGG ... 52
1 DESCRIPTION DE LA POPULATION ... 52
2 EFFET DE L’AGE DES CHIOTS SUR LA CONCENTRATION SERIQUE EN IGG ... 54
3 VARIATION INTRA PORTEE ... 54
4 MORTALITE ET TAUX D’ IGG CIRCULANT ... 57
5 AUTRES FACTEURS DE VARIATION DE L’ACQUISITION DES IGG : RACE, TAILLE DE LA PORTEE, AGE DE LA MERE, SEXE DU CHIOT ... 58
CHAPITRE 3 DISCUSSION ... 59
1 LIMITES DE L’ETUDE ... 59
1.1 ÂGE AU PRELEVEMENT ... 59
1.2 NOMBRE DE CHIOTS PRELEVES ... 59
1.3 RACES REPRESENTEES ... 59
1.4 FACTEURS DE VARIATION SUPPLEMENTAIRES ... 60
2 RESULTATS ... 60
2.1 EVOLUTION DE LA CONCENTRATION SERIQUE EN IGG DES CHIOTS ... 60
2.2 MORTALITE PERINATALE DU CHIOT ... 60
2.3 FACTEURS DE VARIATION DU TRANSFERT PASSIF DE L’IMMUNITE ... 61
CONCLUSION ... 66
8
Liste des figures
Figure 1 : Evolution des concentrations hormonales plasmatiques chez la truie autour de la parturition, d’après Whitely et al. 1990, Castrén et al. 1993 et Devillers et al. 2004. ... 15 Figure 2 : Variations du taux plasmatique de progestérone autour de la mise-bas chez des truies produisant peu de colostrum et des truies produisant beaucoup de colostrum, d’après Foisnet et al. (2010). ... 18 Figure 3 : Variations du rapport Na/K dans le colostrum chez des truies produisant peu de colostrum et des truies produisant beaucoup de colostrum, d’après Foisnet et al. (2010).. 19 Figure 4 : Relation entre le nombre de porcelets mort-nés et la production colostrale de la truie. D’après Quesnel 2011... 29 Figure 5 : Taux sérique d’IgG chez des porcelets mis à jeun, ou ayant reçu 15g de lactose ou ayant reçu 54 g de lactose par voie orale pendant 24 heures après la naissance puis ayant reçu 3,5 g d’IgG porcines à 24 heures d’âge, d’après Werhahn et al. (1981) ... 34 Figure 6 : Concentration plasmatique en IgG chez des porcelets nés par voie vaginale (VD) ou césarienne (CS) et ayant reçu des injections de sérum physiologique, de métapyrone ou d’ACTH, d’après Sangild et al. (1993).. ... 35 Figure 7 : Taux de β2 et γ globulines sériques à 24 heures d’âge chez des porcelets laissés à la truie dès la naissance ou mis à la truie à 4 heures post partum.Les β2 et γ globulines reflètent la teneur sérique en immunoglobulines .D’après Coalson et Lecce (1973)...36 Figure 8 : Taux sérique en IgG (mg/ml) à 24 heures d’âge en fonction de la consommation estimée d’IgG (g/kg) chez des porcelets. D’après Bland et al. 2003.. ... 39 Figure 9 : Relation entre la quantité totale plasmatique estimée d’IgG des porcelets 24 heures après le début de la mise-bas (T24) et la prise d’IgG estimée. D’après Devillers et al. 2011. ... 40 Figure 10 : Relation entre la concentration plasmatique en IgG des porcelets 24 heures après le début de la mise-bas (T24) et consommation colostrale estimée entre la mise-bas et T24. D’après Devillers et al. 2011. ... 40
9 Figure 11 : Influence de critères de vitalité sur la prise colostrale. D’après Devillers et al. 2007.. ... 42 Figure 12 : Concentrations sériques d’IgG et d’albumine sérique bovine (BSA) 9 heures après leur administration par voie orale chez des porcelets prématurés (106-108 jours de gestation) nés par césarienne, par mise-bas induite par l’injection d’un analogue de prostaglandine ou par césarienne précédée d’une injection d’un analogue de prostaglandine (« cesarean section after birth induction »). D’après Sangild (2003). ... 45 Figure 13 : Répartition du nombre de chiennes par catégorie d’âge. ... 52 Figure 14 : Répartition des portées par taille ... 53 Figure 15 : Moyenne des concentrations sériques en IgG des chiots en fonction de l’âge à la prise de sang ... 54 Figure 16 : Répartition de l’écart-type des concentrations en IgG des chiots de chaque portée ... 55 Figure 17 : Ecart-type des concentrations en IgG des chiots d’une portée en fonction de la taille de la portée ... 55 Figure 18 : Ecart-type des concentrations en IgG des chiots d’une portée en fonction de l’âge de la mère. ... 56 Figure 19 : Ecart-type des concentrations en IgG des chiots d’une portée en fonction de l’âge des chiots au moment du prélèvement sanguin... 56 Figure 20 : Concentrations en IgG des chiots dont la mort est survenue après le prélèvement sanguin ... 57 Figure 21 : Prise de poids de la portée (g) entre la naissance et 24 heures d’âge en fonction de la taille de celle-ci, d’après Le Dividich et al. (2004). ... 62 Figure 22 : Effet de la parité sur la concentration en IgG du colostrum au début de la mise-bas et à 24 heures post-partum chez des truies Landrace x Large White. D’après Quesnel 2011. ... 65
10
Liste des tableaux
Tableau 1 : Lien entre la production colostrale de la truie 20 heures 20h) et 10 heures (T-10h) avant la mise-bas et au moment de la mise-bas (T0) et son taux plasmatique de
progestérone. D’après Foisnet et al. 2010. ... 17
Tableau 2 : Production colostrale moyenne en fonction de la position de la tétine, sur 2 traites de 3 minutes espacées de deux heures lors de la mise-bas.Adapté de Fraser et al. (1984). ... 20
Tableau 3 : Taux sériques en IgG à 2, 10 et 20 jours post partum chez des truies supplémentées en CLA et non supplémentées. Adapté de Bontempo et al. (2004). ... 24
Tableau 4 : Taux sériques en IgG à 2, 10 et 20 jours post partum chez des porcelets issus de truies supplémentées en CLA et de truies non supplémentées. Adapté de Bontempo et al. (2004). ... 24
Tableau 5 : Fréquence d’utilisation des tétines, basée sur l’observation de 20 tétées réparties sur les jours 3-4, 5-6, 8-10 et 12-14 post partum. Adapté de Fraser et al. 1984 ... 36
Tableau 6 : Numéro de la tétine la plus utilisée en fonction du poids de naissance, basé sur l’observation de 20 tétées réparties sur les jours 3-4, 5-6, 8-10 et 12-14 post partum. Adapté de Fraser et al. 1984 ... 36
Tableau 7 : Effectifs des différentes races et formats de chiens de notre étude ... 48
Tableau 8 : Dilution des échantillons ... 50
11
Introduction
Chez les espèces à placentation épithéliochoriale comme le porc, la vache, la brebis et le cheval ou endothéliochoriale comme les chiens et chats, le passage des immunoglobulines (Ig) à travers la barrière placentaire n’est pas ou très peu permis (Tizard 1982, Sangild 2003). Or l’acquisition des Ig maternelles, conférant une immunité passive au nouveau-né, est essentielle à la survie de celui-ci qui possède un système immunitaire immature (Rook et Bland 2002). Chez ces espèces, le transfert des Ig maternelles au nouveau-né, appelé transfert passif de l’immunité, s’effectue via la consommation du colostrum dans les heures suivant sa naissance, à une période où l’intestin permet encore le passage de macromolécules vers la circulation sanguine.
Bien qu’une prise insuffisante de colostrum engendre dans un premier temps une mortalité liée à des états hypoglycémiques ou hypothermiques (Le Dividich et al. 2005), plusieurs études ont également mis en évidence l’influence notable de la qualité du transfert passif de l’immunité sur la morbidité et la mortalité périnatales : plus la concentration en IgG circulant chez le nouveau-né est faible, plus celui-ci est à risque de développer des pathologies infectieuses telles que diarrhée ou pneumonie avant le sevrage ( Mc Guire et al. 1976, Donovan et al. 1998). L’étude des facteurs de variation de la qualité du transfert passif de l’immunité présente donc un intérêt économique. Chez les carnivores domestiques, l’intérêt est également affectif pour les propriétaires, pour qui la perte d’un chiot ou d’un chaton peut représenter un moment difficile.
La qualité du transfert passif, i.e. la quantité d’Ig plasmatiques circulant chez le nouveau-né, dépend de la quantité de colostrum consommé, de sa concentration en Ig et de leur absorption intestinale.
Les conditions d’un transfert optimal ont été largement décrites chez le veau (Weaver et al. 2000) ou le porcelet (Rook et Bland 2002) alors que les données chez le chiot sont rarissimes (Poffenbarger 1991). L’étude expérimentale présentée dans ce manuscrit avait pour but d’étudier l’éventuelle implication de facteurs tels que la taille de la portée, l’âge de la mère, le sexe du chiot et la race dans l’efficacité du transfert passif de l’immunité.
Dans une première partie, à travers une synthèse bibliographique pluri-espèces, nous discuterons des facteurs de variation du transfert passif de l’immunité autres que ceux abordés dans notre étude expérimentale. Certains éléments physiologiques clé de la colostrogenèse et de l’absorption intestinale des IgG seront abordés au fur et à mesure de notre discussion. Les facteurs abordés sont ceux susceptibles d’intervenir dans des conditions naturelles ou en élevage. Cependant, nous n’aborderons pas l’influence des différentes techniques d’administration artificielle des IgG ou du colostrum. Le porc étant une espèce particulièrement étudiée dans le cadre du transfert passif de l’immunité, une grande partie de notre synthèse bibliographique y fera référence. La seconde partie de ce manuscrit sera consacrée à la présentation de nos résultats expérimentaux.
12
PARTIE 1 : SYNTHESE BIBLIOGRAPHIQUE
FACTEURS DE VARIATION DU TRANSFERT PASSIF DE L’IMMUNITE
CHEZ PLUSIEURS ESPECES DOMESTIQUES
13 Dans cette première partie, nous exposerons les données bibliographiques disponibles concernant le transfert passif de l’immunité et ses facteurs de variations dans plusieurs espèces comme le porc, les bovins ou les chevaux. Nous aborderons dans un premier chapitre les éléments susceptibles d’influencer la production de colostrum et sa teneur en IgG. Puis, dans un second chapitre, nous nous intéresserons aux facteurs influençant la prise colostrale et l’absorption des IgG par le nouveau-né.
Dans cette première partie, nous exposerons les données bibliographiques disponibles concernant le transfert passif de l’immunité et ses facteurs de variations dans plusieurs espèces comme le porc, les bovins ou les chevaux. Nous aborderons dans un premier chapitre les éléments susceptibles d’influencer la production de colostrum et sa teneur en IgG. Puis, dans un second chapitre, nous nous intéresserons aux facteurs influençant la prise colostrale et l’absorption des IgG par le nouveau-né.
14
Chapitre 1 : Facteurs influençant la quantité et la qualité du colostrum
La quantité d’IgG fournies par la mère à ses nouveau-nés dépend à la fois de la quantité de colostrum produit et de la concentration de ce colostrum en IgG. Dans la suite de ce document, nous entendrons par « qualité du colostrum » sa concentration en IgG.
La quantité de colostrum produite entre la mise-bas et 24 heures post partum est très variable d’une femelle à l’autre, même au sein d’un même élevage. Par exemple, chez le porc, elle varie de 1900 à 5300 g (Le Dividich et al. 2005). La méthode d’estimation de la production colostrale la plus courante (surtout chez le porc) est la mesure de la prise de poids de la portée entre 0 et 24 heures d’âge (Devillers et al. 2004). En effet, la consommation colostrale compte pour 86 à 88% de la prise de poids individuelle du porcelet sur cette période (Le Dividich et al. 2005).
La concentration colostrale en IgG est également sujette à de grosses variations individuelles, même si les femelles sont élevées dans des conditions strictement similaires et collectées à un stade physiologique équivalent (Klobasa et Butler 1987; Bland et Rooke 2002).
1 Physiologie de la production colostrale
Le colostrum est produit aux alentours de la parturition et sa synthèse est sous l’influence et le contrôle de multiples facteurs physiologiques impliqués dans la régulation de la gestation, de la mise-bas et de la lactation. La connaissance de la cascade des événements hormonaux qui surviennent autour de la mise bas et des effets des différentes hormones sexuelles et lactogènes sur la sécrétion de colostrum est avancée par de nombreux auteurs comme une piste à explorer pour mieux comprendre l’origine de la variabilité de la production de colostrum d’une femelle à l’autre au sein d’une même espèce (Barrington et al. 2001 ; Devillers et al. 2007 ; Farmer et Quesnel 2009 )
1.1 Modalités d’importation colostrale des IgG
Les immunoglobulines G sont sécrétées depuis la circulation sanguine de la mère vers la lumière des alvéoles du tissu mammaire par passage trans-cellulaire, via des récepteurs spécifiques situés sur les cellules épithéliales mammaires, appelés FcRn (Huang et al. 1992) et par voie para-cellulaire (Klopfenstein et al. 2002), cette dernière étant une voie de sécrétion spécifique de la phase colostrale. Ce passage des IgG vers le tissu mammaire a lieu dans les dernières semaines de gestation.
Un des évènements physiologiques marquant le passage de la phase colostrale à la phase lactée est la fermeture des jonctions serrées entre les cellules épithéliales mammaires (Neville et al 2001). Une fois cette fermeture effective, le transfert des IgG n’est plus permis. Quesnel (2011) a montré qu’au cours des 24 heures post-partum, la teneur colostrale en potassium (K) augmente, tandis que la teneur en sodium (Na) diminue dans le colostrum,
15 signant une modification des échanges au niveau de l’épithélium mammaire. Le ratio Na/K a donc tendance à diminuer au fur et à mesure que les jonctions serrées de l’épithélium mammaire se referment.
1.2 Variations hormonales lors du peri-partum
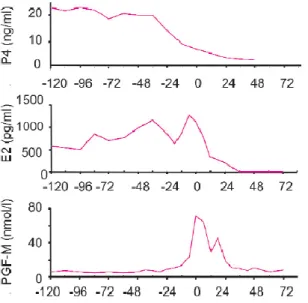
La cascade d’événements hormonaux aboutissant à la parturition commence environ 72 heures avant la mise-bas. Conjointement à une chute de la concentration plasmatique de progestérone, on observe une hausse des concentrations de l’oestradiol-17β, du métabolite de la prostaglandine F2α, de la relaxine , du cortisol, de l’ocytocine et de la prolactine (Whitely et al 1990, Castrén et al 1993a et b, Devillers et al 2004) (fig. 1)
Figure 1 : Evolution des concentrations plasmatiques de progestérone (P4)3, d’oestradiol (E2)3, du métabolite de la prostaglandine-F2α (PGF-M)1, de relaxine (RLX)1, du cortisol3, d’ocytocine (OT)2 et de prolactine (PRL)3 chez la truie autour de la parturition (1 Whitely et al. 1990, 2 Castrén et al.1993 a et b, 3 Devillers et al. 2004).
1.3 Contrôle hormonal de la colostrogenèse
Les hormones sexuelles et lactogènes influencent la production de colostrum de différentes manières. En premier lieu, elles régulent le développement mammaire pendant la gestation. Par ailleurs, elles contrôlent la synthèse des différents constituants du colostrum. Enfin, elles induisent la fermeture des jonctions serrées entre les cellules épithéliales mammaires et donc le passage de la sécrétion colostrale à la sécrétion lactée. Ceci est particulièrement important car, plus l’évolution de la composition du colostrum, sous l’action des hormones,
16 sera rapide, plus la durée de la période de sécrétion du colostrum sera courte et plus les quantités d’IgG sécrétées dans le colostrum seront faibles (Devillers et al. 2006)
Pendant l’initiation de la lactation, c’est-à-dire en fin de gestation et dans les 48 heures suivant la mise bas, les concentrations plasmatiques de progestérone, d’oestadiol 17β, de relaxine, de cortisol, de prolactine et de prostaglandines évoluent rapidement (cf.1.2). Ces hormones agissent sur la synthèse des constituants du colostrum et donc sur l’évolution de sa composition.
Nous nous intéressons ici en particulier à la régulation hormonale de la fermeture des jonctions serrées, qui a une incidence importante sur la concentration en Ig du colostrum (Barrington et al. 2001). Les hormones clés sont la prolactine, la progestérone et le cortisol.
1.3.1 Variations hormonales et passage des IgG dans le colostrum Rôle de la progestérone
Plusieurs études montrent, chez des espèces différentes, que la progestérone empêche la fermeture des jonctions serrées de l’épithélium mammaire (Nguyen et Neville 1998, Nguyen
et al. 2001, Neville et al. 2001). En effet, l’ovariectomie, qui supprime la source de
progestérone, ou l’administration de RU486, antagoniste de la progestérone, accélère la fermeture des jonctions serrées chez la souris. Inversement, l’administration de progestérone après l’ovariectomie retarde cette fermeture (Nguyen et al. 2001).
Cette hormone est donc fortement impliquée dans le transfert des immunoglobulines du plasma vers la lumière alvéolaire. Pour preuve, chez la truie, la chute plasmatique des IgG, témoignant d’un transfert des IgG vers le colostrum, a lieu alors que le taux plasmatique en progestérone est encore haut (Devillers et al. 2004). Jackson et al. (1995) confirment le rôle positif de la progestérone sur le transfert colostral des IgG en montrant que le colostrum est plus riche en IgG chez des truies traitées avec de la progestérone et mettant bas à 116 jours au lieu de 114. Le mécanisme par lequel la progestérone intervient sur les jonctions serrées est mal connu.
Rôle du cortisol
La dexaméthasone, analogue du cortisol, diminue la teneur en IgG1 du colostrum chez la vache (Field et al. 1989, Winger et al.1995). L’action des glucocorticoïdes a été étudiée chez la vache (Stelwagen et al. 1994, 1998, 2000), et la souris (Zettl et al .1992,Stelwagen et al. 1999) in vitro et in vivo. Il a ainsi été démontré que le cortisol stimule la formation des jonctions serrées dans la glande mammaire et exerce donc un effet négatif sur le transfert des IgG du plasma vers le colostrum. L’élévation pré-partum du cortisol maternel semble donc être un facteur essentiel à la fermeture des jonctions serrées mais n’en est pas l’élément initiateur (Nguyen et al. 2001).
17
Rôle de la prolactine
Chez la vache, la prolactine inhibe le transport des IgG1 du sang vers le colostrum et réduit ainsi leur concentration dans le colostrum (Barrington et al.1999).
L’action stimulatrice de la prolactine sur la formation des jonctions serrées a ainsi été montrée chez la rate, la souris et la vache (Flint et Gardner 1994, Nguyen et Neville 1998, Barrington et al. 2001, Nguyen et al.2001).
Chez la truie, l’influence de la prolactine sur le transfert colostral des IgG semble similaire puisque Devillers et al. (2004) ont montré une corrélation négative entre la concentration colostrale d’IgG et les concentrations plasmatique et colostrale en prolactine.
Il semblerait que la prolactine, tout comme les glucocorticoïdes, soit un élément essentiel mais non initiateur de la fermeture des jonctions serrées de l’épithélium mammaire (Nguyen et al. 2001).
1.3.2 Variations hormonales et quantité de colostrum
La quantité de colostrum, surtout dans le cas des espèces donnant naissance simultanément à plusieurs nouveau-nés, est, tout comme la concentration en IgG, un facteur important dans le transfert passif de l’immunité (voir partie 2, chapitre 2, paragraphe 2.3)
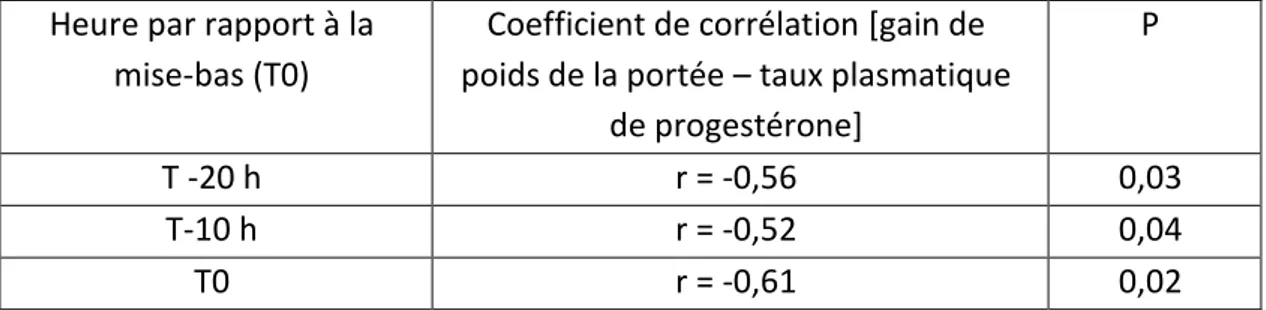
La chute pre-partum de la progestérone serait le signal déclenchant de la sécrétion du colostrum (Guy et al. 1994). La progestérone exerce en effet une influence négative sur la quantité de colostrum produit : Foisnet et al. (2010) ont montré, chez le porc, que le gain de poids de la portée (étroitement corrélé à la production de colostrum) dans les 24 premières heures de vie est négativement corrélé au taux plasmatique de progestérone de la truie mesuré dans les 24 heures pré-partum (Tableau 1).
Heure par rapport à la mise-bas (T0)
Coefficient de corrélation [gain de poids de la portée – taux plasmatique
de progestérone]
P
T -20 h r = -0,56 0,03
T-10 h r = -0,52 0,04
T0 r = -0,61 0,02
Tableau 1 : Lien entre la production colostrale de la truie 20 heures (T-20h) et 10 heures (T-10h) avant la mise-bas et au moment de la mise-mise-bas (T0) et son taux plasmatique de progestérone. D’après Foisnet et al. 2010.
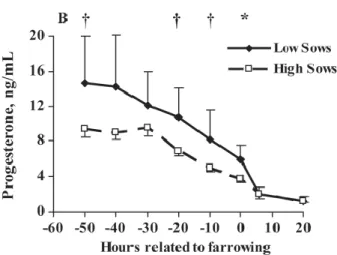
De plus, les truies ayant une faible production de colostrum présentent un taux plasmatique en progestérone plus élevé que les truies fortement productrices sur cette même période (Figure 2).
18 Figure 2 : Variations du taux plasmatique de progestérone autour de la mise-bas chez des truies produisant peu de colostrum (Low Sows) et des truies produisant beaucoup de colostrum (High Sows). † : P < 0,1 ; * : P< 0,05. D’après Foisnet et al. (2010).
La progestérone étant la principale hormone impliquée dans le maintien de l’ouverture des jonctions serrées, elle constitue un frein à l’entrée dans la phase de lactation, dont l’élément physiologique-clé est la fermeture de l’épithélium mammaire (Stelwagen et al. 1997), qui permet de retenir les constituants du lait dans la lumière alvéolaire (Nguyen et al. 2001).
L’effet négatif de la progestérone sur le volume colostral pourrait également être expliqué par une action inhibitrice sur la sécrétion de lactose (Banchero et al. 2006). En effet, la concentration colostrale en lactose durant les 6 heures post-partum est plus faible chez les truies faiblement productrices de l’étude de Foisnet et al. (2010). Or, le lactose étant le principal composant osmotique des sécrétions mammaires (Leong et al. 1990), une baisse de sa production entraine un appel d’eau plus faible vers la lumière alvéolaire et par conséquent un volume colostral réduit. De plus, cela aboutit à une viscosité accrue du colostrum qui pourrait nécessiter un effort de tétée plus grand pour les porcelets, comme cela a été suggéré chez l’agneau (Banchero et al. 2004).
Foisnet et al. (2010) ont également mis en évidence que les truies produisant le moins de colostrum avaient une concentration plasmatique plus faible en cortisol dans les 30 heures précédant la mise bas. Cet effet est certainement lié à l’implication du cortisol dans la fermeture des jonctions serrées de l’épithélium mammaire (cf.1.3.1).
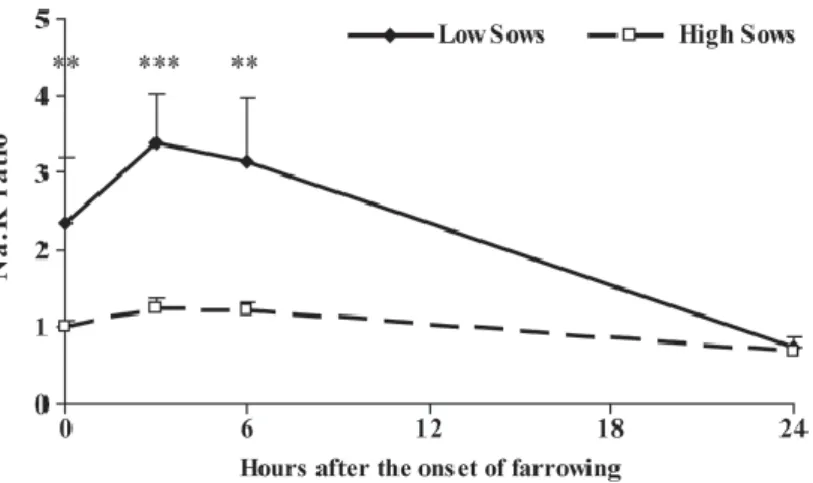
L’impact de la fermeture des jonctions serrées sur le volume des sécrétions mammaires en phase colostrale est confirmé par Foisnet et al. (2010), qui observent que le ratio Na/K dans le colostrum des truies les plus faibles productrices est plus élevé dans les 6 premières heures post partum (Figure 3). Les truies les plus faiblement productrices ont donc un épithélium mammaire plus lâche.
19 Figure 3 : Variations du rapport Na/K dans le colostrum chez des truies produisant peu de colostrum (Low Sows) et des truies produisant beaucoup de colostrum (High Sows). ** : P < 0,01 ; *** : P< 0 ,001. D’après Foisnet et al. (2010).
En conclusion, il apparait que l’équilibre hormonal autour du part soit un facteur déterminant de régulation de la sécrétion des IgG et du volume colostral. Il est important de distinguer la phase de sécrétion des IgG dans le colostrum, qui intervient avant la mise-bas, et la phase de sécrétion du colostrum qui est à la frontière entre colostrogenèse et lactogenèse. Les fortes variations individuelles de production colostrale semblent trouver une explication au moins partielle dans des variations interindividuelles d’équilibre hormonal. Afin d’en tirer des applications pratiques, des études supplémentaires sont nécessaires afin de trouver comment moduler ces facteurs hormonaux.
2 Influence du poids de la portée
L’effet du poids de la portée sur la production colostrale est sujet à controverses : Devillers
et al. (2005) ont montré que les truies les plus productives en colostrum étaient celles qui possédaient les portées les plus lourdes. Cette production accrue de colostrum n’est pas uniquement corrélée au poids global de la portée, mais aussi au poids moyen individuel de naissance. L’hypothèse avancée est que des porcelets de poids supérieur possédant une vitalité accrue, ils exerceraient une stimulation accrue de la mamelle par une succion plus vigoureuse. Cependant, l’augmentation de la production de colostrum dépasse largement l’augmentation de poids de la portée, ce qui laisse supposer qu’un autre facteur intervient dans cette modification de la production colostrale. Ceci expliquerait pourquoi Quesnel (2011) et Foisnet et al. (2010) trouvent que le poids n’a pas d’influence sur la production colostrale de la truie.
Une grande variabilité de poids intra-portée semble en revanche délétère pour la production de colostrum chez la truie (Devillers et al. 2007, Quesnel 2011) sans qu’aucune explication à ce phénomène ne soit donnée.
20 A notre connaissance, aucune étude n’a tenté de chercher un lien entre la taille de la portée et la concentration en IgG du colostrum, quelque soit l’espèce.
3 Rôle supposé de la position des tétines
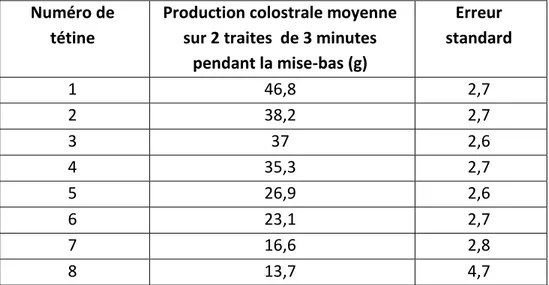
3.1 Numéro de tétine et production colostrale
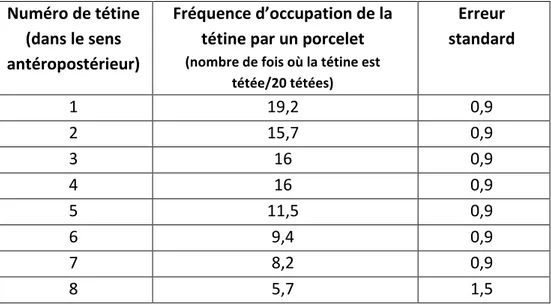
En 1984, Fraser et al. ont tenté de déterminer la quantité de colostrum produite en fonction de la position des mamelles et de mettre en relation cette quantité avec le choix préférentiel des tétines par les porcelets. Le colostrum est prélevé par traite manuelle pendant la mise-bas. Les tétines les plus antérieures se sont révélées être jusqu’à 3 fois plus productrices que les tétines postérieures (Tableau 2).
Numéro de tétine
Production colostrale moyenne sur 2 traites de 3 minutes
pendant la mise-bas (g) Erreur standard 1 46,8 2,7 2 38,2 2,7 3 37 2,6 4 35,3 2,7 5 26,9 2,6 6 23,1 2,7 7 16,6 2,8 8 13,7 4,7
Tableau 2 : Production colostrale moyenne en fonction de la position de la tétine, sur 2 traites de 3 minutes espacées de deux heures lors de la mise-bas. Les chiffres désignent les tétines de la plus antérieure (1) à la plus postérieure(8). Adapté de Fraser et al. (1984).
Il peut donc exister des variations de production de colostrum selon le numéro de tétine ou le quartier (pour les herbivores). Il serait cependant abusif de généraliser les données issues de l’espèce porcine aux autres espèces.
3.2 Numéro de tétine et concentration en IgG
Concernant la concentration en IgG, l’effet de la position des tétines chez la truie est contradictoire selon les études : Bland et Rook (1998) ont montré que les tétines caudales produisent un colostrum moins riche en IgG mais Klobasa et Butler (1987) rapportent le contraire. Plus récemment, Wu et al. (2010) ont comparé la composition protéique du colostrum issu des deux premières et des deux dernières paires de mamelles : les IgG sont présentes en quantité beaucoup plus importante dans les deux premières paires de mamelles, corroborant les résultats de Bland et Rook.
21
4 Influences de la conduite d’élevage et de l’environnement sur la
production colostrale
4.1 Effet de l’alimentation
4.1.1 Influence du niveau énergétique de la ration
o Apport énergétique et quantité de colostrum
Chez la truie, la majorité du développement mammaire intervient dans le dernier tiers de gestation (Sorensen et al. 2001). Des changements majeurs au niveau des cellules des glandes mammaires ont lieu pendant cette période : le tissu adipeux est remplacé par du tissu alvéolaire, qui deviendra le tissu sécréteur de lait (Hacker et Hill 1972).
Un apport énergétique insuffisant durant la gestation entraine une diminution du développement mammaire et de l’accumulation pré-natale de colostrum dans la mamelle de la brebis (Mellor et al. 1987, Banchero et al. 2006).
L’influence de l’apport énergétique sur le développement du tissu et les sécrétions mammaires trouve certainement son explication dans les modifications hormonales qu’il provoque. Premièrement, les femelles sous-alimentées présentent une concentration sérique en progestérone plus élevée avant et après la mise-bas que les femelles nourries avec des apports énergétiques correspondant à leurs besoins (Banchero et al. 2006). Compte tenu de l’effet négatif de la progestérone sur le volume colostral (voir 1.3.2 plus haut), il en résulte une moindre production de colostrum chez ces femelles. De plus, les femelles sous-alimentées présentent des concentrations sériques en IGF1 (Insulin-like Growth Factor 1) et en insuline plus faibles, ces molécules étant impliquées dans la croissance et la différentiation du tissu mammaire.
Inversement, un apport alimentaire excessif durant la gestation est également détrimentaire au développement mammaire : en effet, chez la brebis on observe une diminution du poids de la glande mammaire (par kilogramme de poids vif) et une production colostrale moindre (Swanson et al. 2008). Chez la truie, on observe chez les femelles grasses un dépôt excessif de tissu adipeux dans la glande mammaire au détriment du tissu alvéolaire, qui conduit à une production laitière moindre (Head et Williams 1991 et 1995).
o Apport énergétique et concentration en IgG
La note d’état corporel (NEC) ne semble pas influencer la concentration colostrale en IgG : chez la brebis, la teneur en IgG du colostrum n’est pas significativement différente pour des NEC comprises entre 2,5 et 3,5 sur une échelle de 5 (Al-Sabbagh et al. 1995). La généralisation de ce résultat, obtenu pour une fourchette de NEC de 1 point seulement, nécessite d’autres études avec des valeurs de NEC plus extrêmes. Plusieurs études montrent
22 également que les concentrations en IgG du colostrum de vaches dont les NEC sont comprises entre 4/9 et 7/9 ne sont pas significativement différentes. Cependant, chez les vaches dont l’apport énergétique est restreint en fin de gestation (troisième trimestre), on observe une baisse d’absorption intestinale des IgG par le veau qui est attribuable à une modification de la composition du colostrum (Burton et al. 1984, Hough et al. 1990). Un tel phénomène n’est pas observé lorsque le déficit énergétique intervient plus tôt au cours de la gestation (Lake et al. 2006).
Un apport énergétique excessif semble avoir, selon l’espèce, un effet délétère sur la qualité immunologique du colostrum. Chez la jument, un apport énergétique égal à 120% des recommandations durant le dernier tiers de gestation entraine une baisse significative de la teneur en IgG du colostrum par comparaison avec des juments nourries conformément aux recommandations. Les poulains nés de ces juments tendent (P = 0.06) à avoir des concentrations sériques en IgG plus basses, mais qui restent cependant bien supérieures à la concentration minimale nécessaire (8g d’IgG/L) (Thorson et al. 2010).
Chez la brebis recevant une ration trop énergétique, la teneur totale en IgG du colostrum est réduite par comparaison avec des femelles nourries selon les recommandations. Contrairement à la jument, il n’y a pas de répercussion sur la concentration colostrale en IgG compte tenu de la réduction du volume colostral également observé chez les brebis sur-nourries (Swanson et al. 2008).
Chez la truie, le niveau énergétique de la ration durant la gestation influence la teneur en gras du colostrum mais n’a aucune influence sur la teneur en protéines chez la truie (Long et
al. 2010). A notre connaissance, aucune donnée bibliographique n’est disponible dans cette
espèce concernant l’influence de l’apport énergétique sur la concentration colostrale en IgG
per se. Néanmoins, les Ig représentant 80% des protéines colostrales à la mise-bas (Klobasa
et Butler 1987), il est fortement probable que les résultats de Long et al. (2010) soient applicables aux IgG.
4.1.2 Influence de la teneur de la ration en vitamines et minéraux
o Vitamines anti-oxydantes
L’apport en vitamines anti-oxydantes A, C et E semble influencer le transfert passif de l’immunité à différents niveaux selon l’espèce.
Chez le porc, la supplémentation de la ration de la truie en vitamines anti-oxydantes en fin de gestation n’entraine pas d’augmentation significative de la teneur en IgG du colostrum (Pinelli-Saavedra et al. 2008). En revanche, elle a des répercussions positives significatives sur le taux sérique en IgG des porcelets à 24 heures d’âge (Bland et al. 2001). Il semblerait donc que, chez le porcelet, les vitamines anti-oxydantes modulent l’absorption intestinale des IgG. Les mécanismes sous jacents restent inconnus.
Chez les bovins, les résultats sont plus controversés : la complémentation en vitamine E en fin de gestation n’entraine pas de modification de la concentration colostrale ou sérique
23 des veaux en IgG (Horn et al. 2010) alors que la complémentation en vitamines A, D et E entraine une augmentation non significative de la concentration en IgG dans le colostrum et significative dans le sérum des veaux (Sikka et al. 2002), ce qui serait en faveur d’une amélioration de l’absorption des IgG comme chez le porc.
Chez la jument, une supplémentation en vitamine E en fin de gestation entraine une légère, mais significative, augmentation de la teneur en IgG des sécrétions mammaires, mais seulement lors des deuxième et troisième jours post partum. Cela n’entraine pas d’augmentation significative du taux d’IgG chez le poulain dans les 3 premiers jours de vie (Bondo et Jensen, 2010).
o Oligo-éléments
L’importance immunitaire des oligo-éléments tels que le cuivre, le zinc, le manganèse ou encore le sélénium est établie depuis longtemps chez les animaux de rente (Spears et al. 2000). Il est logique de penser qu’une carence en ces oligo-éléments puisse nuire à la synthèse des IgG chez la mère et donc avoir un impact sur leur concentration dans le colostrum. Cependant, à notre connaissance, très peu de travaux ont étudié leur impact sur la qualité immunitaire du colostrum. Par exemple, Muehlenbein et al. (2001) ont montré que des vaches laitières supplémentées en cuivre présentent une augmentation légère mais significative de la concentration en IgG dans le colostrum par comparaison avec des vaches non supplémentées. Le sélénium semble, quant à lui, avoir un effet positif plus marqué et reproductible sur la concentration en IgG du colostrum (Awadeh et al. 1998 ; Swecker et al. 1995). Lacetera et al. (1996) ont de plus montré que la supplémentation en sélénium peut conduire à une augmentation de la quantité de colostrum produit chez la vache.
La forme sous laquelle les minéraux sont apportés à la ration peut avoir une influence sur la teneur en IgG du colostrum. En effet, Formigoni et al. (2011) ont montré une augmentation de la concentration colostrale en IgG de 19% (P < 0.01) chez des vaches Holstein dont 50% des apports en zinc, cuivre et manganèse sont sous forme organique par comparaison avec celles recevant des formes exclusivement inorganiques.
4.1.3 Influence des acides gras
De nombreuses études récentes ont été menées afin d’observer les effets de l’acide linoléique conjugué ou «Conjugated Linoleic Acid» (CLA) sur l’immunité. Compte tenu du nombre assez conséquent de publications scientifiques concernant l’impact de ces acides gras sur la santé humaine et animale, il nous a semblé important d’y consacrer un paragraphe dans ce manuscrit.
L’acide linoléique conjugué est un terme générique qui désigne un mélange complexe d’isomères géométriques et de positions de l’acide linoléique possédant deux doubles
24 liaisons conjuguées (18:2). Ces doubles liaisons de configuration cis-trans, cis,
trans-trans ou cis-cis peuvent se situer en différentes positions de la chaîne carbonée (Corino et al. 2006).
Contrairement aux ruminants, dans le lait et la viande desquels on retrouve les CLA, les monogastriques ne peuvent pas en synthétiser. Ceux présents dans leurs tissus sont donc directement issus de l’alimentation. Les CLA utilisés en nutrition animale sont des mélanges synthétiques obtenus par hydrogénation partielle de l’acide linoléique, contenant principalement les deux isomères cis9,trans 11 (le plus répandu naturellement) et trans
10,cis12 en quantité égale (Corino et al. 2006)
Bontempo et al. (2004) ont mené une étude dans laquelle une préparation d’acides linoléiques conjugués sous forme d’acides gras libres contenant en proportions égales les isomères cis 9,trans11 et trans 10,cis 12 est rajoutée à raison de 0,5% à la ration de la truie à partir de 8 jours avant la mise bas jusqu’au sevrage.
La supplémentation de la ration en CLA n’entraine pas de modification de la composition chimique globale du colostrum mais modifie les proportions des différents acides gras, avec notamment la présence de CLA dans le colostrum. Le colostrum des truies ayant reçu les CLA est significativement plus riche en IgG (49,4 g/L contre 33.6 g/L pour les truies témoins, P < 0.05). Le taux sérique d’IgG des truies en lactation recevant des CLA est également plus élevé que dans la population témoin (Tableau 3).
Concentration sérique en IgG (g/L) 2 jours post partum 10 jours post partum 20 jours post partum Truies témoins 10,78 ± 1,45 14,98 ± 1,45 17,41 ± 1,45
Truies supplémentées en CLA 20,85 ± 1,59* 21,33 ± 1,59* 25,06 ± 1,59* Tableau 3 : Taux sériques en IgG à 2, 10 et 20 jours post partum chez des truies supplémentées en CLA et non supplémentées. * Différence significative (P < 0,05).Adapté de Bontempo et al. (2004).
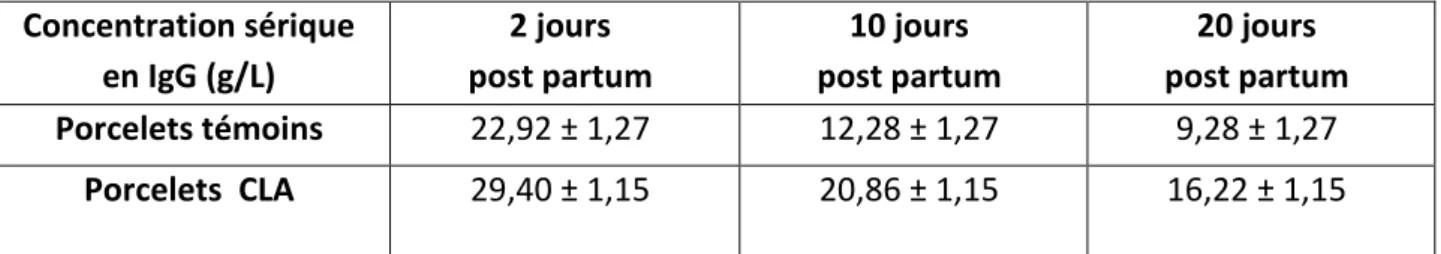
Les porcelets issus des truies complémentées en CLA (Porcelets CLA) possèdent également un taux sérique en IgG plus élevé que les porcelets issus des truies servant de témoins (Porcelets témoins) (Tableau 4). La supplémentation en CLA ne semble pas influencer la quantité de colostrum produit puisque le poids à 2 jours d’âge des porcelets ne diffère pas entre les 2 groupes.
Concentration sérique en IgG (g/L) 2 jours post partum 10 jours post partum 20 jours post partum Porcelets témoins 22,92 ± 1,27 12,28 ± 1,27 9,28 ± 1,27 Porcelets CLA 29,40 ± 1,15 20,86 ± 1,15 16,22 ± 1,15 Tableau 4 : Taux sériques en IgG à 2, 10 et 20 jours post partum chez des porcelets issus de truies supplémentées en CLA et de truies non supplémentées. Adapté de Bontempo et al. (2004).
25 Yamasaki et al. (2004) se sont intéressés aux possibles différences d’effet entre les CLA présents sous forme de triglycérides et ceux sous forme d’acides gras libres. En effet, la plupart des études visant à connaitre les propriétés des CLA sont réalisées avec des acides gras libres. Or, la plupart des CLA apportés par l’alimentation se trouvent sous forme de triglycérides. De plus, les acides gras libres ont un goût rance et leur utilisation dans l’alimentation s’en trouve donc limitée.
Pour ce faire, Yamasaki et al. ont dosé les immunoglobulines produites dans le surnageant d’une culture de splénocytes de souris nourries avec l’une ou l’autre des formes de CLA. Les CLA sous forme d’acides gras libres à hauteur de 1% de la ration semblent les plus efficaces pour stimuler la production d’IgG. La forme « triglycérides » exerce un léger effet positif à 0,1% mais pas à 1% de la ration. Il semble donc qu’il existe un dosage optimal pour obtenir des effets bénéfiques à partir des CLA sous forme de triglycérides, qui est différent de celui des acides gras libres.
La digestion et le métabolisme des formes « acides gras libres » et « triglycérides » ne laissent pas supposer de différence d’action entre ces deux formes. En effet, les acides gras libres sont absorbés et incorporés dans des triglycérides par les cellules intestinales. Les triglycérides sont, quant à eux, dégradés par des lipases en deux monoglycérides et deux acides gras libres, qui sont absorbés puis re-synthétisés en triglycérides par les cellules épithéliales de l’intestin. Les CLA, quelle que soit leur forme initiale, sont donc tous délivrés dans les voix lymphatiques sous forme de triglycérides. Par ailleurs, l’efficacité d’absorption lymphatique des deux formes est identique (Yamasaki et al. 2004). Les éventuelles différences d’action des deux formes de CLA seraient peut être liées à des formes de triglycérides différentes après leur absorption intestinale.
L’effet des CLA sur la production des immunoglobulines est également à moduler en fonction de l’isomère administré : c’est l’isomère trans10, cis12 qui est plus particulièrement responsable de l’augmentation du nombre de lymphocytes B et de la production d’immunoglobulines dans une culture de lymphocytes spléniques de souris nourries avec des CLA (Yamasaki et al. 2003).
Ces études mettent en évidence les rôles des CLA dans l’alimentation mais aussi des effets différentiels en fonction de leur structure, qui sont des points importants à considérer afin de pouvoir y avoir recours en nutrition à l’avenir.
Le mécanisme par lequel les acides linoléiques conjugués favorisent la synthèse des IgG reste incertain. Yang et Cook (2003) ont montré, chez la souris, l’effet stimulant des CLA sur la synthèse de l’interleukine 2. Or cette interleukine stimule la production d’IgG, A et M (Kawano et Noma, 1996).
L’effet immunomodulateur des CLA ne se restreint pas à la modification de la teneur en immunoglobulines sériques ou colostrales. Les CLA alimentaires entrainent également une augmentation du taux de lysozyme, présent dans les sécrétions physiologiques, les
26 macrophages ou les polynucléaires neutrophiles des truies et des porcelets allaités par les truies recevant des CLA (Bontempo et al. 2004). La supplémentation de l’alimentation en CLA permettrait donc une meilleure défense contre les infections bactériennes.
De part leurs effets sur l’immunité, les acides linoléiques conjugués constituent une piste intéressante dans les productions animales comme immunostimulant, comme moyen d’améliorer la réponse vaccinale ou encore la résistance aux maladies infectieuses.
4.1.4 Influence de la teneur protéique de la ration
Un apport important en protéines durant la gestation de la truie pourrait avoir un impact positif sur le volume des sécrétons mammaires (Kusina et al. 1999). En revanche, la teneur en protéines de la ration de la truie en gestation n’influence pas la teneur colostrale en IgG. Il est cependant intéressant de noter que des teneurs trop faibles ou trop élevées en protéines engendrent un poids de naissance des porcelets inférieur à ceux nés de truies nourries selon les recommandations (Rehfeldt et al. 2010).
4.1.5 Influence de l’apport alimentaire de molécules diverses
Dans le but d’améliorer le transfert passif de l’immunité et de limiter la mortalité des nouveau-nés liée à des causes infectieuses, plusieurs études ont cherché à mettre en évidence l’éventuel impact de différentes substances naturelles, connues pour leurs effets immunomodulateurs, sur la teneur en Ig du colostrum. Ces études sont relativement récentes et fournissent des résultats souvent mitigés ou contradictoires. Elles constituent un préalable à des travaux complémentaires qui seront nécessaires pour pouvoir peut-être à l’avenir utiliser ces substances de façon rationnelle en élevage. Les mécanismes d’action de ces molécules, peu ou pas connus, ne seront pas abordés ici.
o Produits de fermentation des levures
Plusieurs travaux visant à mettre en évidence l’effet des produits de fermentation de levures (Saccharomyces cerevisiae) sur la qualité colostrale et le transfert passif de l’immunité ont été menés. Chez la vache, Kinal et al. (2007) ont montré une augmentation de la concentration en immunoglobulines du colostrum après une supplémentation débutant 6 semaines avant la mise-bas. Demeckova et al. (2003) ont obtenus des résultats similaires chez la truie.
o Mannan-oligosaccharides
L’ajout de mannan oligosaccharides (MOS), extraits de parois de levures (Saccharomyces
cerevisiae), à la ration de la truie en fin de gestation entraine une augmentation de la
concentration des IgM, IgA et surtout des IgG dans le colostrum (O’Quinn et al.2001). Des résultats plus mitigés ont été mis en évidence chez la vache : les femelles qui ont reçu une
27 complémentation en MOS à partir de 3 semaines avant la mise-bas présentent une meilleure séroconversion après une vaccination mais la teneur en Ig de leur colostrum n’est pas augmentée (Franklin et al. 2005).
o Extraits d’algues marines
L’ajout de laminarin et de fucoïdan, polysaccharides extraits d’algues marines Laminaria spp., à la ration de la truie en fin de gestation augmente de façon significative la teneur en IgG du colostrum. Cette teneur accrue en IgG se retrouve dans les valeurs plasmatiques des porcelets issus de ces mêmes truies à 5 jours d’âge (Leonard et al. 2010).
4.2 Effet de la vaccination
Des études dans lesquelles des truies de la même unité sont vaccinées ou non ne montrent pas de différence en terme de teneur totale en IgG colostrales (Arey et al. 2000). Les titres colostraux en anticorps spécifiques subissent en revanche une augmentation.
Des truies vaccinées contre Actinobacillus pleuropneumoniae à 5 et 2 semaines avant la mise-bas présentent une augmentation significative du taux d’IgG spécifiques de cette bactérie dans le colostrum. Le taux sérique en ces IgG spécifiques est également significativement supérieur chez les porcelets recevant le colostrum des truies vaccinées (Chau et al. 2009).Des résultats similaires sont obtenus dans l’espèce équine avec un vaccin contre le virus West-Nile (Turner et al. 2008).
La vaccination durant la gestation est donc efficace pour transmettre à la portée une immunité passive vis-à-vis d’un germe spécifique mais ne semble pas influencer la teneur totale en IgG du colostrum.
4.3 Influence du déroulement de la mise-bas sur la production colostrale
Chez le porc, le rythme d’éjection du colostrum est variable dans le temps : lors de la mise bas, sa production est continue (Hemsworth et al. 1976) alors que par la suite, il est excrété toutes les 40 à 60 minutes. Ceci permet aux porcelets d’avoir un accès au colostrum le plus tôt possible après leur naissance et limite la compétition entre les porcelets dans les premières heures de vie, deux facteurs favorables au transfert passif de l’immunité.
Induction de la mise-bas
Afin d’interpréter correctement les résultats des travaux visant à étudier l’impact de l’induction de la mise-bas sur le transfert passif de l’immunité, il est important de discerner les effets de l’induction de la mise-bas de ceux liés à la durée de la gestation. Les travaux de Devillers et al. (2005) illustrent cette problématique : ils montrent que l’induction de la
28 mise-bas de la truie à 113 jours de gestation tend à diminuer la production colostrale de 15 %. Cependant, dans cette étude, l’effet de l’induction a pu être confondu avec celui de la durée de la gestation (114,1 jours pour les mises-bas induites contre 113,3 jours pour les mises-bas spontanées).
Afin de s’affranchir d’un éventuel biais lié à la durée de gestation, Foisnet et al. (2011) ont induit la mise-bas des truies par une injection intramusculaire d’alfaprostol (analogue de la prostaglandine F2α) à 113 jours de gestation. La durée de gestation est alors équivalente entre les truies induites et celles mettant bas naturellement. Dans ces conditions, l’injection d’alfaprostol à 113 jours de gestation n’entraine pas de modification de la production colostrale. De plus, la concentration colostrale en IgG est similaire à celle des truies ayant mi-bas spontanément. Enfin, les porcelets issus de mises-bas induites ont, à 24 heures d’âge, des taux sériques en IgG similaires à ceux nés de mises-bas spontanées. L’injection d’alfaprostol ne provoque pas de modification de la cascade hormonale peri-partum, notamment la chute du taux plasmatique de progestérone n’est pas accélérée. Il n’y a également pas de répercussion sur la perméabilité de l’épithélium mammaire, évaluée par le lactose plasmatique maternel et le ratio Na/K du colostrum. On note cependant une augmentation transitoire de la concentration sanguine en prolactine et en cortisol une heure après l’injection d’alfaprostol, qui expliquerait la concentration colostrale en lactose plus importante au moment de la mise-bas.
A l’opposé, Silver et al. (1983) ont montré une accélération de la chute du taux plasmatique de progestérone suite à l’injection d’un analogue de la prostaglandine F2α, mais l’injection avait été réalisée plus précocement que dans l’étude de Foisnet et al., entre 109 et 111 jours de gestation. Néanmoins, le reste des modifications hormonales classiques de la truie lors péri-partum est conservé.
Mise-bas prématurée
Une mise bas prématurée (110-111 jours de gestation chez la truie) entraine une réduction de 40% de la production colostrale (Milon et al. 1983). Ceci pourrait être lié à un poids moyen de naissance des porcelets et à une vitalité plus faibles et donc à une moindre stimulation de la mamelle.
Morts-nés
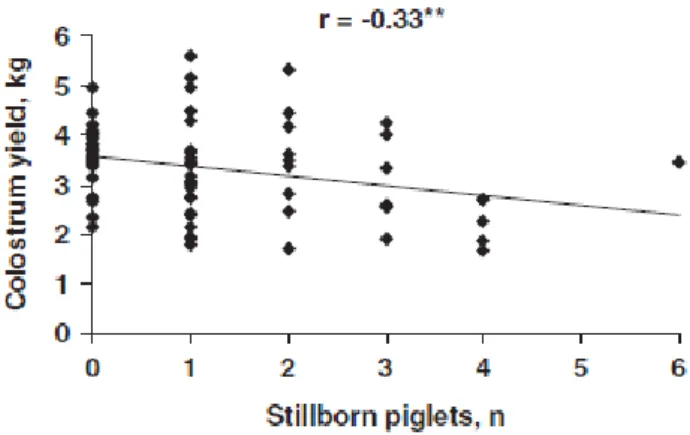
La production colostrale semble négativement corrélée au nombre de porcelets mort-nés (r = -0.33, P= 0.005) (Quesnel, 2011) (Figure 4)
29 Figure 4 : Relation entre le nombre de porcelets mort-nés et la production colostrale de la truie. * : P< 0.01. D’après Quesnel, 2011.
Durée de la mise-bas
L’augmentation de l’intervalle de naissance entre les porcelets semble également associée à une production colostrale plus faible (P< 0.1) (Quesnel 2011). Cependant, Foisnet et al. (2010) montrent qu’il n’y a pas de différence concernant la durée de la mise-bas entre les truies faiblement et fortement productrices de colostrum.
4.4 Effets environnementaux
Stress
Couret et al. (2009) ne trouvent pas de différence de concentration en IgG dans le colostrum entre des truies stressées en fin de gestation (entre J77 et J105 de gestation) par introduction de truies inconnues deux fois par semaine et les truies témoins.
Photopériode
Une part non négligeable de la mortalité périnatale des porcelets est liée au cannibalisme et à l’agressivité de la truie envers ses porcelets. Harris et Gonyou (2003) ont montré que passer la durée d’éclairement quotidien de 8 heures à 24 heures durant la mise-bas entraine une baisse du pourcentage de porcelets tués de cette façon. De plus l’augmentation de la photopériode entraine également une augmentation de la production du lait par la truie (Mabry et al. 1982). Lachance et al. (2010) ont donc voulu savoir si une modification de la photopériode aurait une influence sur la prise colostrale des porcelets. L’hypothèse est que la réduction de l’agitation de la truie favoriserait l’accès à la mamelle, et/ou l’augmentation de la production colostrale. Néanmoins, il s’est avéré qu’une augmentation de la durée quotidienne d’éclairement durant 24 heures au lieu de 8h n’exerce aucun effet positif en termes de prise colostrale chez le porcelet.
30 A notre connaissance, aucune donnée sur l’effet de la photopériode sur la qualité immunologique du colostrum n’est disponible.Morin et al. (2010) ont montré, chez la vache Holstein, que la photopériode n’a pas d’influence sur la concentration en IgG du colostrum.
Température
Chez la vache Holstein, un stress thermique modéré n’entraine pas de modification de la teneur en IgG du colostrum ni de la concentration sérique en IgG de leurs veaux (Lacetera et
al. 2002). Cependant, lors d’exposition à des températures plus élevées, les vaches qui
bénéficient d’un système de refroidissement par évaporation produisent un colostrum de meilleure qualité immunologique (Adin et al. 2009). L’effet délétère de températures chaudes sur la concentration colostrale en IgG est également constaté chez la truie (Machado-Neto et al. 1987). Plusieurs hypothèses explicatives existent : la chaleur peut causer une diminution de la consommation alimentaire ou alors il est possible que le flux sanguin mammaire diminue, ce qui conduit à un moindre transfert des IgG vers le tissu mammaire.
Saison
L’effet de la saison sur la qualité immunologique du colostrum est variable selon les études et l’espèce concernée. Cela peut s’expliquer par des localisations géographiques et donc des climats variables selon les études qui rendent une comparaison difficile. De plus, selon l’espèce et le système d’élevage concernés, les variations saisonnières de conduite d’élevage sont plus ou moins marquées et les raisons pouvant expliquer une variation de la qualité immunologique du colostrum peuvent être différentes : alimentation, circulation de pathogènes, parasitisme, ambiance du bâtiment etc.
A titre d’exemple, chez le porc, Inoue et al. (1980) ont montré un effet saison : la concentration en IgG augmente au printemps et diminue en été et en automne.
Chez la vache laitière, alors que certains auteurs n’ont pas trouvé d’effet significatif de la saison (Pritchett et al. 1991), d’autres ont mis en évidence une baisse de la concentration colostrale en IgG durant l’hiver (Gulliksen et al. 2008).
4.5 Conclusion
Si certains facteurs influençant de façon quantitative et qualitative la production colostrale ont été clairement identifiés, la grande variabilité observée dans un lot a priori homogène de truies reste inexpliquée. Il est possible que certains facteurs apportent une contribution trop discrète pour être statistiquement significative. C’est ainsi que Devillers et al. (2007) ont montré que la durée de gestation, l’induction de la mise-bas, la parité et le poids de la
31 truie à la mise-bas exercent une influence sur la production colostrale sans qu’aucun effet clair ne soit dégagé quand l’analyse de chaque facteur est réalisée de façon indépendante des autres.
Le transfert des IgG au nouveau-né ne dépend pas uniquement de la quantité et de la qualité immunologique du colostrum qui lui est fourni. Pour que le transfert passif de l’immunité soit efficace, il faut que les IgG soient consommées et absorbées en quantité adéquate. Dans le chapitre suivant, nous allons donc nous intéresser aux éléments pouvant moduler la consommation de colostrum et l’absorption des IgG au niveau intestinal par le nouveau-né.
32
Chapitre 2 Facteurs de variation de la prise colostrale et de l’absorption des
IgG des nouveau-nés
La consommation de colostrum chez les nouveau-nés est très variable. Par exemple, chez le porc, la variabilité intra-portée pour la consommation de colostrum lors des 24 premières heures de vie est en moyenne de 40% (Le Dividich et al. 2005). Nous allons ici répertorier les facteurs pouvant expliquer la variabilité de la consommation colostrale et du transfert sérique des IgG au niveau intestinal.
1 Variations physiologiques de l’absorption des IgG
1.1 Passage des IgG de la lumière intestinale vers la circulation sanguine
Une fois ingérées par le nouveau-né, les IgG ainsi que d’autres macromolécules présentes dans le colostrum sont absorbées intactes par pinocytose par les entérocytes de l’intestin grêle (Payne et Marsh 1962; Clarke et Hardy 1971). Les IgG sont ensuite libérées par les vacuoles intracellulaires dans la circulation lymphatique par exocytose et rejoignent la circulation sanguine via le canal thoracique (Staley et al. 1972)
1.2 Fermeture de la barrière intestinale
Cependant, les entérocytes qui sont produits après la naissance perdent cette capacité de pinocytose de protéines intactes (Smith et Jarvis 1978; Smith et Peacock 1980).
Chez le porc, le remplacement de la totalité des entérocytes fœtaux nécessite 19 jours (Smith et Jarvis 1978) et à 8 jours d’âge, 38% des entérocytes sont toujours d’origine fœtale (Smith et Peacock 1980). Le remplacement des entérocytes fœtaux ne suffit donc pas à expliquer l’arrêt du transfert de macromolécules dans la circulation sanguine, qui intervient en moyenne après 24 à 36 heures d’âge (Speer et al. 1957 ; Weström et al. 1984).
Ce phénomène connu sous le terme de « fermeture de la barrière intestinale » correspondrait plutôt à l’arrêt du transfert des immunoglobulines à travers la membrane basolatérale des entérocytes et non pas à l’arrêt d’absorption des macromolécules par les entérocytes (Le Dividich et al. 2005)
La fermeture de la barrière intestinale a lieu entre 1 et 2 jours d’âge chez le porcelet, le veau, le poulain ou l’agneau et intervient après plusieurs semaines chez d’autres espèces telles que le rat (Baintner 1986).
33
1.3 Facteurs de variation de l’absorption intestinale des IgG
1.3.1 Effet des nutriments du colostrum
En 1962, Lecce et Morgan constatent, chez le porcelet, que lorsque la première prise colostrale est différée, la perméabilité intestinale aux macromolécules dure plus longtemps.
Plusieurs autres études, menées chez le porc ou le veau, ont conduit à des observations similaires et à la conclusion que l’ingestion de colostrum ou de lait participe au processus physiologique de fermeture de la barrière intestinale (Lecce 1966 ; Werhahn et al. 1981 ; Mehrazar et al. 1993).
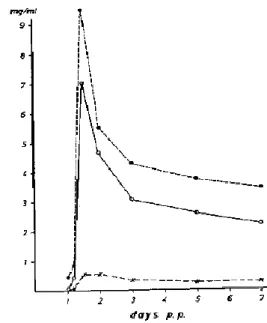
La nature des nutriments et les mécanismes par lesquels leur ingestion entraine la fermeture de la barrière intestinale ne sont à ce jour pas définis. A titre d’exemple, l’induction de cette fermeture a pu être réalisée par l’ingestion de lactose seulement, avec un effet dose-dépendant (Werhahn et al. 1981, Figure 5). Des facteurs humoraux, tels que l’insuline, pourraient également intervenir (Svendsen et al. 1986).
Plus le nouveau-né consomme de colostrum sur une période donnée, plus la baisse de perméabilité intestinale à l’issue de cet intervalle de temps est marquée (Le Dividich et al. 2005), confirmant un effet dose-dépendant suggéré par Werhahn et al. (1981).
En outre, il est intéressant de souligner qu’une ingestion de colostrum en quantité insuffisante pour prévenir une perte de poids des porcelets a un effet marqué sur la perméabilité intestinale, suggérant qu’une ingestion faible mais continue de colostrum suffit pour initier l’arrêt de l’absorption des immunoglobulines (Le Dividich et al. 2005). Ceci souligne donc l’importance de détecter au plus tôt les nouveau-nés consommant peu de colostrum afin de leur assurer un transfert passif de l’immunité adéquat avant que leur barrière intestinale ne soit fermée.
Par ailleurs, le colostrum possède un rôle important dans l’absorption des IgG : en effet les IgG sont mieux absorbées en présence de colostrum (Jensen et al.2001). Le colostrum contient en effet des substances telles qu’inhibiteurs de protéases, hormones ou facteurs de croissance qui sont indispensables au bon fonctionnement et à la maturation de l’intestin du nouveau-né (Xu 1996). Il est important de noter que la baisse de perméabilité intestinale aux macromolécules intervient plus précocement lors d’utilisation d’un substituant au colostrum tel qu’un lait artificiel ou encore le lait ou le colostrum d’une autre espèce (Jensen et al. 2001).
34 Figure 5 : Taux sérique d’IgG chez des porcelets mis à jeun , ou ayant reçu 15g de lactose
ou ayant reçu 54 g de lactose par voie orale pendant 24 heures après la naissance puis ayant reçu 3,5 g d’IgG porcines à 24 heures d’âge. D’après Werhahn et al. (1981).
1.3.2 Effet des glucocorticoïdes
Plusieurs études ont mis en évidence l’influence des glucocorticoïdes sur l’absorption intestinale des IgG.
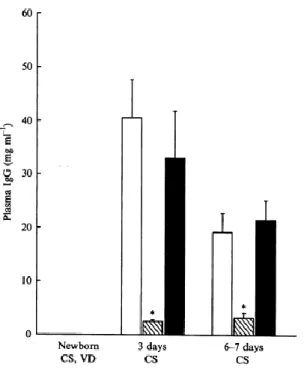
Le cortisol facilite l’absorption intestinale des IgG par le nouveau-né chez les espèces porcine, bovine et ovine. Une stimulation de la sécrétion de cortisol par l’injection d’ACTH chez la truie durant les 10 derniers jours de gestation entraine une augmentation des taux sériques d’IgG chez les porcelets nouveau-nés (Bate et Hacker 1985). De plus, le taux sérique d’IgG à 48 heures d’âge est positivement corrélé à la cortisolémie à la naissance chez les porcelets (Sangild et al. 1997). L’élévation physiologique pré partum de la cortisolémie aurait donc un rôle dans le développement de la capacité à absorber des macromolécules.
L’absence de cortisol circulant chez le nouveau-né compromet l’absorption des IgG : chez des porcelets dont la concentration plasmatique en cortisol est maintenue basse par injection de métyrapone (inhibiteur de l’activité de la 11β hydroxylase surrénalienne), on constate une baisse très nette de l’absorption intestinale des IgG (Sangild et al. 1993, Figure 6). Des résultats similaires ont été obtenus chez le veau et l’agneau (Johnston et Oxender 1979 ; Hough et al. 1990). Chez ce dernier, on constate en plus une fermeture intestinale plus précoce suite à l’injection de métyrapone (Hough et al. 1990).Les effets du cortisol sur l’intestin semblent varier selon l’âge du fœtus à la naissance et donc le degré de maturité