LA FACULTE DES SCIENCES DE RABAT N° d’ordre 2657
THÈSE DE DOCTORAT
Présentée par
Walid AMER
Discipline : Chimie
Spécialité : Chimie des matériaux & nanomatériaux / Catalyse
Phosphate nanostructuré à mésoporosité contrôlée préparé à l'aide d'agents
structurants bas-coût et phosphates hybrides organiques-inorganiques
obtenus via la gélification de biopolymère : Elaboration, caractérisation et
application en catalyse.
Soutenue le 29 juin 2013
Membres de jury :
Président :M. El Mokhtar ESSASSI Professeur à la faculté des Sciences, Agdal de Rabat
Examinateurs:
Mme. Souad El HAJJAJI Professeur à la faculté des Sciences, Agdal de Rabat
M. Mohamed ZAHOUILY Professeur à la FST de Mohammedia
Mme. Karima ABDELOUAHDI
Professeur au Centre National pour la Recherche Scientifique et Technique
M. Abdelali KOSSIR Docteur et Directeur R&D du Groupe OCP
M. Ismael SAADOUNE Professeur à la FST de Marrakech
M. Abderrahim SOLHY Docteur - Chef de Projet à la Fondation MAScIR
Faculté des Sciences, 4 Avenue Ibn Battouta B.P. 1014 RP, Rabat – Maroc Tel +212 (0) 37 77 18 34/35/38, Fax : +212 (0) 37 77 42 61, http://www.fsr.ac.ma
II
A la mémoire de mon oncle
A ma mére, Latifa
A mon pére, Said AMER
A ma sœur, Charifa
III
A ma chère femme, Zaineb
Et à ma belle famille
J’adresse mes spéciaux et particuliers remerciements à ma femme Zaineb, pour son affection, son soutien moral, son encouragement et sa patience.
IV
Avant prôpos
Les travaux de cette thèse ont été réalisés dans le cadre de la convention liant l’Université Mohammed V-Agdal de Rabat et la Fondation MAScIR. Lesdits travaux ont été effectués sous la direction scientifique de Monsieur le Professeur El Mokhtar ESSASSI et Monsieur le Docteur Abderrahim SOLHY.
Je tiens à remercier Monsieur El Mokhtar ESSASSI, Professeur à l’université Mohammed V-Agdal de Rabat, pour avoir accépté de m’inscrire avec lui à la prestigieuse Université Mohamed V-Agdal. C’est aussi un grand honneur qu’il m’a fait en acceptant de présider le jury de cette thèse.
Je tiens à remercier vivement Monsieur Docteur Abderrahim SOLHY, Project leader à la Fondation MAScIR non seulement pour avoir dirigé cette thèse, mais surtout pour son accompagnement, sa rigueur scientifique, sa disponibilité et l’attention dont il a fait preuve à mon égard tout au long de ces travaux.
Je remercie Madame Souad El HAJJAJI, Professeur à l’université Mohammed V-Agdal de Rabat, pour l’intérêt qu’elle a porté pour ce travail en acceptant de participer au jury en tant que rapporteur.
J’adresse également mes sincères remerciements à Monsieur Mohamed ZAHOUILY, Professeur à l’Université Hassan II, Faculté des Sciences et Techniques Mohammedia, pour le jugement de présent travail ainsi que sa participitaion au jury de cette thèse.
Je tiens à remercier infiniment Madame Karima ABDELOUAHDI, Professeur - responsable de la plateforme Matériaux UATRS-CNRST, qui a suivi de près le travail de cette thèse. Je la remercie pour tous ses conseils scientifiques, son aide à la réalisation de nombreuses analyses et leurs interprétations ainsi que pour toute sa patience et les encouragements durant la rédaction du manuscrit.
Que Monsieur Ismael SAADOUNE, Professeur à la faculté des Sciences et Techniques de Marrakech, ainsi que Monsieur Abdelali KOSSIR, Docteur et Directeur R&D du Groupe
V
OCP, trouvent ici l’expression de ma gratitude pour l’honneur qu’ils m’ont fait de participer en tant qu’examinateurs dans la soutenance de ce mémoire de thèse.
J'adresse mes remerciements également à tous les chercheurs : Aziz FIHRI, Said El KAZZOULI, Nadia KATIR et Mounir El ACHABY pour leur gentillesse, le partage des connaissances scientifiques, la collaboration, l’esprit d’équipe et la joie de vivre rayonnant tout au long de ce travail.
Je voudrais remercier vivement tous mes collègues du groupe VARENA-MAScIR : Hugo Ronald Ramananarivo, Houda Maâti, Otmane Amadine, Younes Essamlali, Hicham Abououalid, Karim Daânoun, Nassima El miri. Ainsi que mes amis de Inanotech-MAScIR :
Younes Belmamouni, Meriem Bricha, Mehdi El Daoudi, Khadija El Maalam, Tarik
Ajjammouri et Amine Bensaih. J’adreese également mes vifs remerciements à mes amis :
Soumia Aboul-hrouz, Mohammed Karkouri et Asmae lemaani ainsi que tous ceux qui m’ont
offert le bonheur de partager cette aventure.
Je remercie ensuite les docteurs, les ingénieurs, les techniciens de la plateforme ainsi que l’ensemble du staff administratif de la Fondation MAScIR.
Enfin, je ne saurais terminer cette liste sans adresser un remerciement particulier à ceux qui m’ont soutenu dans l’ombre, mes parents, mes sœurs et mes frères, sans qui ce travail n’aurait jamais pu voir le jour. Je leur dédie ce travail en témoignage de ma profonde reconnaissance pour toute la patience et les sacrifices qu’ils ont consentis pour moi et dont je leur serai à jamais redevable. D’avoir porté ce travail à terme représente pour moi aujourd’hui la plus belle des récompenses.
Que tous ceux qui m’ont aidé de près ou de loin dans l’élaboration de ce travail trouvent ici l’expression de ma sincère gratitude.
VI
Liste des abréviations
Matériaux
Techniques et méthodes de caractérisation
mn-HAP Mésoporeuse nanostructurée hydroxyapatite
HAP Hydroxyapatite TCP Phosphate tricalcique DCPD Brushite DCPA Monétite CPP Pyrophosphate de calcium β-TCP β-Phosphate tricalcique
SLES Lauryl éther sulfate de sodium
LABS Linéaire alkyl benzène sulfonate
LB Lauryl betaïne
cmc Concentration micellaire critique
ALG Alginate
CMC Carboxymethylcellulose
fC Faible concentration
FC Forte concentration
ATG Analyse thermogravimétrique
DRX Diffraction des rayons X
SAXRD Analyse par la diffraction des rayons X à petits angles
MEB Microscope électronique à balayage
EDAX Analyse semi-qualitative par spectrométrie à dispersion d'énergie
MET Microscope électronique en transmission
HRTEM Microscope électronique en transmission à haute résolution
FTIR Spectroscopie infrarouge à transformée de Fourrier
BET Théorie Brunauer, Emett et Teller
VII RMN 1H du
liquide Résonance magnétique nucléaire du proton RMN 31P du
solide Résonance magnétique nucléaire du phosphore
VIII
Table de matière
INTRODUCTION GENERALE ... 13
CHAPITRE I : ETAT DE L’ART ET CONTEXTE GENERAL ... 17
I.GENERALITES SUR LES PHOSPHATES DE CALCIUM :HYDROXYAPATITE ... 17
I.1. Les méthodes de synthèse de l’hydroxyapatite ... 18
I.1.1. La synthèse par voie sèche... 19
I.1.2. La synthèse hydrothermale ... 19
I.1.3. La co-précipitation ... 20
I.1.4. La méthode sol-gel ... 21
a- Sans tensio-actif ... 21
b- En présence du tensio-actif ... 23
I.1.5. La synthèse par microémulsion inverse ... 26
I.2. Rappels bibliographiques sur les tensioactifs utilisés dans la synthèse de la mn-HAP ... 27
I.3. Structure cristalline de l'apatite ... 31
I.4. Substitutions isomorphiques de l’HAP ... 32
I.5. Domaine d’applications de l’hydroxyapatite ... 33
I.5.1. Domaine de la santé : biocéramiques ... 33
I.5.2. Domaine de l’environnement ... 34
I.5.3. Domaine de la catalyse hétérogène ... 34
II.GENERALITE SUR LES MATERIAUX HYBRIDES ORGANIQUE/INORGANIQUE (BIO-POLYMERE/INORGANIQUE) ... 38
II.1. Matériau hybride organique/inorganique à base des polysaccharides ... 38
II.2. Matériaux hybrides organique/inorganique à base de l’alginate et phosphate de calcium ... 41
II.2.1. Composition et structure de l’alginate ... 42
II.2.2. Mécanismes de gélification... 43
a- Gel à base d’alginate ... 44
b- Hydrogel à base d’alginate ... 45
II.3. Applications générales d’alginates ... 45
II.4. Application d’alginate en catalyse... 46
III.PREPARATION DE LA BRUSHITE ET DE LA MONETITE ... 51
III.1. Brushite (dicalcique phosphate dihydraté, DCPD) ... 51
III.2. Monétite (dicalcique anhydre) ... 52
III.3. Domaine d’applications de la brushite et monétite ... 54
CHAPITRE II : SYNTHESE DE L’HYDROXYAPATITE MESO-POREUSE ET NANOSTRUCTUREE (MN-HAP) : APPLICATION EN CATALYSE DE LA REACTION D’OXYDATION DES ALCOOLS BENZYLIQUES ... 56
I.INTRODUCTION : ... 56
II.SYNTHESE DE MN-HAP ASSISTEE PAR MICRO-ONDE ... 56
II.1. Procédure expérimentale : ... 56
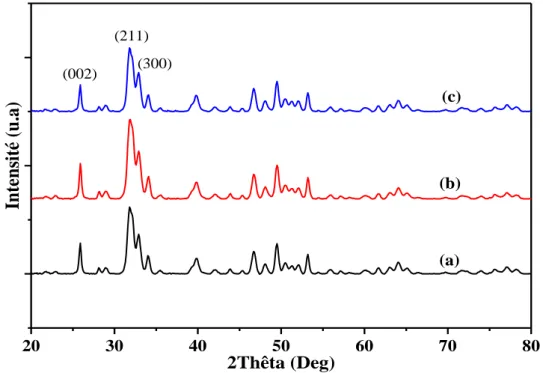
III.INFLUENCE DE LA CONCENTRATION DU TENSIOACTIF :CAS DU (SLES) ... 58
III.1. Caractérisation thermique ... 58
III.1.1. Analyse thermique ... 58
III.2. Caractérisation structurale ... 60
III.2.1. Analyse par la diffraction des rayons X ... 60
IX
III.2.3. Analyse par la spectroscopie Raman ... 66
III.2.4. Analyse par la RMN du solide ... 67
III.3. Caractérisation texturale ... 68
III.3.1. Analyse par la diffraction des rayons X à petits angles ... 68
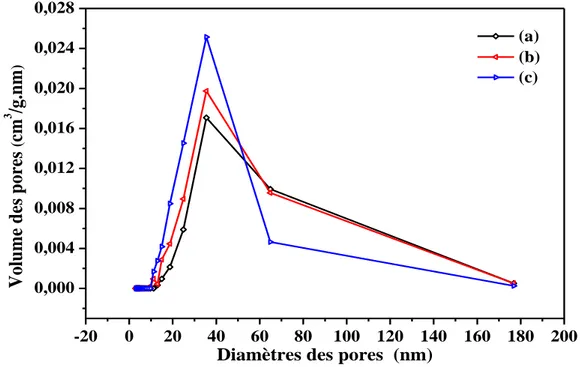
III.3.2. Détermination de la surface spécifique et distribution du diamètre moyen des pores ... 71
III.4. Caractérisation morphologique ... 75
III.4.1. Analyse par la microscopie électronique à balayage ... 75
III.4.2. Analyse par la microscopique électronique en transmission ... 76
IV.INFLUENCE DE LA NATURE DU TENSIOACTIF ... 79
IV.1 Caractérisation thermique ... 79
IV.1.1. Analyse thermique ... 79
IV.2.Caractérisation structurale ... 80
IV.2.1 Analyse par la diffraction des rayons X ... 80
IV.2.2. Analyse par la spectroscopie IR ... 81
IV.3. Caractérisation texturale ... 82
IV.3.1. Analyse par la diffraction des rayons X à petits angles ... 82
IV.3.2. Détermination de la surface spécifique et distribution de diamètre moyen des pores (adsorption/désorption de N2) ... 84
IV.4. Caractérisation morphologique : ... 87
IV.4.1. Analyse par la microscopie électronique en transmission ... 87
IV.4.2. Analyse semi-quantitative par l’EDAX : ... 89
IV.4.3. Analyse par la microscopie électronique en transmission à haute résolution ... 90
IV.5. Mécanisme réactionnel général sur la synthèse de l’hydroxyapatite via le tensioactif SLES. ... 91
V.PREPARATION ET CARACTERISATION DE LA MN-HAP IMPREGNEE PAR LE CHROME (CR@MN-HAP) ... 93
V.1. Préparation de Cr@mn-HAP... 93
V.2. Caractérisation structurale de Cr@mn-HAP ... 93
V.2.1. Analyse par la diffraction des rayons X ... 93
V.2.2. Analyse par la spectroscopie IR ... 94
V.3. Caractérisation texturale (adsorption/désorption de N2)... 95
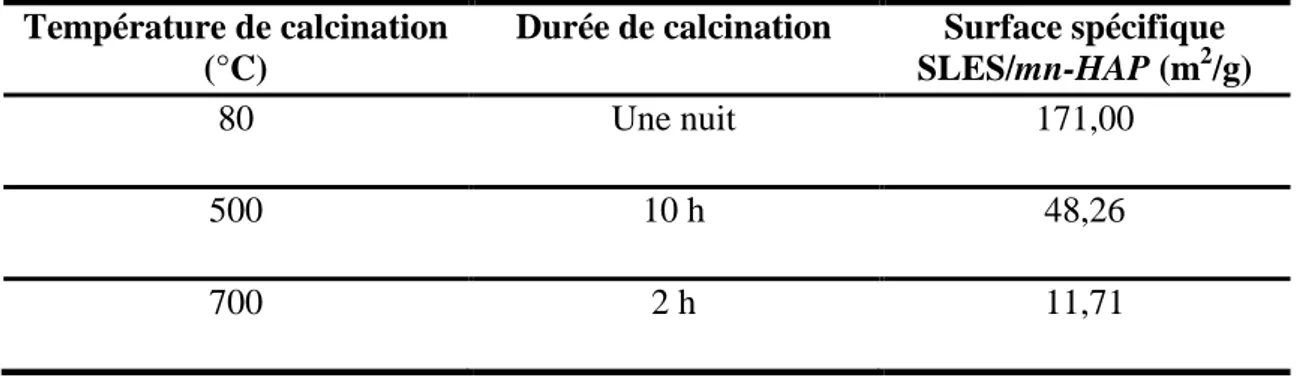
V.3.1. Détermination de la surface spécifique ... 95
V.3.2. Distribution de diamètre moyen des pores ... 97
V.4. Caractérisation morphologique ... 97
V.4.1. Analyse par la microscopie électronique à balayage ... 97
V.4.2. Analyse par la microscopique électronique en transmission... 98
VI.CATALYSE DE LA REACTION D’OXYDATION DES ALCOOLS BENZYLIQUE PAR CR@MN-HAP ... 99
VI.1 Rappels bibliographiques sur l’oxydation des alcools benzyliques ... 99
VI.2. Procédure de la réaction ... 101
CHAPITRE III : SYNTHESE DES BILLES HYBRIDES ALGINATE@BRUSHITE ET ALGINATE@MONETITE: APPLICATION EN CATALYSE DE LA SYNTHESE DES ALCENES Α,Β-INSATURES ... 106
I.INTRODUCTION ... 106
II.SYNTHESE ET CARACTERISATION DES MICROSPHERES HYBRIDES BRUSHITE@ALGINATE ET MONETITE@ALGINATE ... 106
II.1. Elaboration : procédure expérimentale ... 106
II.2. Caractérisation structurale : Matériaux préparés avant calcination ... 108
II.2.1. Analyse par diffraction des rayons X ... 108
X
II.3. Caractérisation morphologique ... 113
II.3.1. Analyse par le MEB ... 113
II.3.2 Analyse semi-quantitative l’EDAX : ... 114
II.4. Mécanisme de croissance des matériaux hybrides ... 115
II.5. Caractérisation thermique : matériaux préparés après calcination ... 118
II.5.1. Analyse thermique ... 118
II.6. Caractérisation structurale ... 119
II.6.1. Analyse par diffraction des rayons X ... 119
II.6.2. Analyse par FT-IR ... 121
II.7. Caractérisation morphologique ... 122
II.7.1. Analyse par le MEB ... 122
II.7.2. Analyse par le MET ... 124
III.CATALYSE DE LA REACTION DE KNOEVENAGEL PAR LE MATERIAU HYBRIDE D’ALGINATE@BRUSHITE ... 125
III.1. Rappels bibliographiques sur la synthèse des alcènes α,β-insaturés ... 125
III.2. Etude de l’influence des différents facteurs sur les rendements ... 126
III.2.1. Etude cinétique ... 127
III.2.2. Etude de l'influence du volume d’eau ... 128
III.2.3. Etude de l’influence de la masse du catalyseur ... 129
III.2.4. Etude de l’influence de la nature du solvant ... 129
III.2.5. Etude de la réutilisation du catalyseur ... 130
III.3. Proposition d’un mécanisme réactionnel de la réaction de Knoevenagel par action de la brushite@alginate ... 131
III.4. Généralisation pour la synthèse d’une série d’alcènes α,β-insaturés ... 132
CHAPITRE IV : DONNEES EXPERIMENTALES ... 136
I.APPAREILS ET TECHNIQUES D’ANALYSE ... 136
I.1. Micro-ondes utilisés (Annexe 1) ... 136
I.2. Dispositif d’adsorption/désorption d’un gaz (Annexe 2) ... 136
I.3. Diffraction des rayons X ... 136
I.4. Analyse par FTIR en mode ATR (Attenuated Total Reflexion) ... 137
I.5. Spectroscopie de résonance magnétique nucléaire ... 138
I.5.1. RMN liquide ... 138
I.5.2. RMN du solide ... 138
I.6. Spectroscopie Raman ... 139
I.7. Analyse thermogravimétrique ... 139
I.8. La microscopie électronique à balayage ... 140
I.9. La microscopie électronique en transmission ... 140
I.10. La microscopie électronique en transmission de haute résolution (HRMET) ... 141
I.11. Plasma à couplage inductif - spectrométrie d'émission atomique (ICP- AES) ... 141
I.12. Distillation sous vide (four à boulle) ... 141
I.13. Centrifugeuse... 141
I.14. Logiciels et programmes utilisés ... 141
II.GENERALISATION SUR L'ENSEMBLE DES REACTIFS UTILISES ... 142
III.CATALYSE DE LA REACTION D’OXYDATION DES ALCOOLS BENZYLIQUES ... 142
III.1. Identification des molécules organiques par la méthode spectroscopique de RMN 1H. ... 142
IV.CATALYSE DE LA REACTION DE SYNTHESE DES ALCENES Α,Β-INSATURES ... 147
XI
CONCLUSION GENERALE ET PERSPECTIVES... 151
ANNEXE ... 154
ANNEXE I: ... 154
I.MICRO-ONDES ... 154
I.1. Les propriétés des micro-ondes ... 154
I.2. Influence du champ électrique sur un produit diélectrique ... 155
I.3. Comparaison entre chauffage classique et chauffage par microonde ... 155
I.4. Avantage des microondes... 156
ANNEXE II ... 157
I.ANALYSE VOLUMETRIQUE D’ADSORPTION : ... 157
I.1. Les différents types d’isothermes d’adsorption/désorption ... 157
I.2. L’adsorption multicouche : Application de l’équation B.E.T ... 159
I.3. Calcul de la surface spécifique: Théorie Brrunauer, Emmet et Teller (BET) ... 160
I.4. Distribution de taille des pores (mésopores) ... 161
I.5. Détermination de la taille des pores par la méthode B.J.H. (Barret-Joyner-Halenda) ... 162
12
INTRODUCTION GENERALE
13
Introduction générale
L’histoire de l’utilisation des tensioactifs dans la méso-structuration des matériaux, revient avant même la découverte des matériaux mésoporeux organisés en 1992 par les chercheurs de la compagnie Mobil [1]. Depuis cette date, un vif intérêt accompagné d’une évolution drastique dans la science des matériaux mésoporeux et nanostructurés a vu le jour. Lesdits matériaux présentent sans nul doute, un potentiel d’applications dans de multiples domaines tels que la catalyse, la santé, l'énergie et l'environnement. Sauf que dans un contexte de développement durable, l’utilisation de nouveaux tensioactifs développés à partir de matières premières naturelles renouvelables, s’avère tout à fait rationnel et vital pour le progrès de cette branche scientifiquement enrichissante et industriellement profiteuse. En guise de ce qui précède, il est primordial de développer et d’utiliser bien évidemment, de biotensioactifs éco-compatibles ayant un impact réduit sur l’environnement. Les biotensioactifs totalement naturels, les plus développés actuellement, sont ceux dérivés de sucres, de protéines, d’acides aminés et de bio-polymères.
L’hydroxyapatite constitue l’une des phases les plus mystérieuses de la grande famille des apatites. Grand nombre d’articles et brevets sont publiés traitant la synthèse, les propriétés et les applications de ce fameux matériau. En raison de leur biocompatibilité et de leur structure cristalline permettant diverses substitutions isomorphiques, et en raison notamment de nombreux domaines d’applications (catalyse, environnement, médicale…), plusieurs méthodes de synthèse ont été mises en œuvre. Mais le problème majeur est de pouvoir contrôler sa nucléation et sa croissance ainsi que sa méso-, nano-structuration.
La synthèse chimique sous micro-ondes constitue, ainsi, une technique de plus en plus sollicitée en synthèse organique, mais aussi en synthèse des matériaux. Son apparition dans les laboratoires a débuté à partir des années soixante dix [2]. L’activation par micro-ondes, résulte de deux contributions : i) la première d’origine purement thermique résultant de l’agitation moléculaire causée par l’inversion des dipôles avec les alternances du champ électrique, et ii) la deuxième d’origine électrostatique résultant d’interactions de type dipôles-dipôles entre les molécules polaires et le champ électrique. Ce qui a donc un effet direct sur la cinétique par la diminution de l’énergie d’activation. Vue les multiples problèmes qui ont pénalisé le four micro-ondes, citons notamment le problème de l’hétérogénéité de champ qui
14
est tenu comme responsable de la non-reproductibilité des résultats ; les industriels ont développé des fours micro-ondes dits « monomodes » où le champ d’ondes stationnaires est focalisé grâce à l’utilisation d’un guide d’ondes, ce qui rend les ondes canalisées et concentrées sur l’échantillon.
D’autre part, l’une des thématiques de recherche les plus importantes qui a attiré l’attention de la communauté scientifique ainsi que le monde industriel, est celle des matériaux hybrides. Lesdits matériaux hybrides résultent habituellement de l’assemblage de deux parties : i) l’une est inorganique, et ii) l’autre est organique. L’association de matériaux, aussi différents, confère généralement aux matériaux hybrides de nouvelles propriétés que chacun des composants ne peut présenter seul (propriétés mécaniques, densité, propriétés hydrophobes ou hydrophiles, perméabilités…). Parmi les méthodes les plus propices de préparation de ce genre de matériaux sont celles dites « bio-inspirés ou biomimétiques », où le chimiste expérimentaliste essaye de copier le modèle adopté par les organismes vivants. Notons que plusieurs exemples de ce type de matériaux existent dans la nature comme les carapaces de crustacés et les coquilles de mollusques…Leurs champs d’application couvrent un large domaine : catalyse, environnement, santé, optique et électronique…etc.
Parmi les applications intensivement étudiés des matériaux mentionnés ci-dessus, la catalyse occupe une place particulière, pour plusieurs raisons parmi lesquelles la dépendance de plusieurs filières industrielles (pétrochimie, chimie fine, secteur pharmaceutique…), de cette science. L’amélioration des catalyseurs devient de plus en plus difficile et, l’un des challenges actuels, est de pouvoir maîtriser l’engénierie de catalyse (bifonctionnel, multifonctionnel, mono-site, concept clè-serrure…).
C’est dans ce contexte que s’inscrit le travail de cette thèse et qui est à l’interface de la chimie des matériaux/nanomatériaux, matériaux hybrides organiques/inorganiques, la catalyse hétérogène et la chimie verte. L’originalité de ce travail de recherche entrepris dans le cadre de cette thèse de doctorat, réside dans les points cités ci-après :
d’une part dans l’utilisation des nouveaux tensioactifs de prix très abordable pour
contrôler la nucléation et la croissance de l’hydroxyapatite afin d’obtenir une poudre nano-structurée et de porosité calibrée. L’activation de ce processus par des micro-ondes (monomode) était pertinente pour la synthèse de ce mystérieux matériau,
15
d’autre part, dans la synthèse des matériaux hybrides organiques/inorganiques,
C’était pour la première fois que l’alginate de sodium (biopolymère) a été employé sous conditions douces pour préparer des billes hybrides de taille micrométriques où l’élaboration, in-situ, des phosphates de calcium tels que la brushite (brushite@alginate) et la monétite (monétite@alginate), a été parfaitement contrôlée en variant les facteurs limitants de cette réaction,
autre levier d'originalité et de créativité de ce travail de thèse est l’utilisation d’une palette d’outils analytiques pour caractériser les matériaux préparés, soit celle correspondant à la chimie des matériaux ou d’autres de la chimie moléculaire,
par la suite et vue l’intérêt de la catalyse hétérogène dans notre ère, nous avons
entamé des études qui consistent à utiliser les matériaux préparés pour catalyser des réactions de synthèse organique. Ces présents travaux s’inscrivent dans le cadre de la chimie verte où l’un des douze principes de la chimie verte, établi par le Pr. Paul Anastas et Dr. John Warner (Department of Chemistry, Yale
University), devrait être adopté. Ainsi, l’hydroxyapatite nano-structurée et
méso-poreuse est testée dans l’oxydation des alcools benzyliques qui consiste à les
transformer en aldéhydes benzyliques. Puis, les matériaux hybrides
brushite@alginate, monétite@alginate sont utilisés pour la catalyse de la synthèse des alcènes α,β-insaturés. Ces deux réactions présentent des intermédiaires très importants dans l’industrie chimique.
Le manuscrit de la présente thèse est composé de quatre chapitres, dont le premier est une revue bibliographique générale. Le deuxième chapitre décrit dans un premier temps les travaux menés pour la synthèse de l’hydroxyapatite nano-structurée et méso-poreuse, ainsi que les données de la caractérisation de ce matériau, puis l’application de ce matériau à la catalyse de l’oxydation des alcools benzyliques. Dans le troisième chapitre nous présenterons les résultats et les discussions de la synthèse et de la caractérisation des matériaux hybrides organiques/inorganiques. Nous détaillerons, aussi leur application dans la synthèse des alcènes α,β-insaturés. Enfin dans le dernier chapitre, nous décrivons les détails expérimentaux: description des techniques physico-chimiques employées ainsi que l’identification des molécules organiques synthétisés au cours de cette thèse.
16
17
Chapitre I : Etat de l’art et contexte général
I. Généralités sur les phosphates de calcium : Hydroxyapatite
Le mot «Apatite» désigne tout composé minéral de formule générale M10(XO4)6Y2 où
M est un cation bivalent (Ca2+, Pb2+, Cd2+.), XO4 un anion trivalent (PO3-4, VO3-4, AsO3-4) et
Y un anion monovalent (OH-, F-, Cl-). Néanmoins, les propriétés physico-chimiques de
l’apatite phosphatée dépendent de la prédominance du fluor, du chlore ou des espèces hydroxylés dans la structure cristalline. Ainsi, en fonction de type de l’anion Y, on distingue trois minéraux: hydroxyapatite (HAP), fluorapatite (FAP) et chlorapatite (CLAP) de formules chimiques, Ca10(PO4)6(OH)2, Ca10(PO4)6F2 et Ca10(PO4)6Cl2, respectivement. En plus de leur forme minéralogique, les apatites phosphatées peuvent être sous forme de céramiques biologiques. L’os naturel et les tissus durs chez les mammifères sont constitués de structures très voisines des apatites. De ce fait, les phosphates de calcium ont été largement étudiés pour leurs diverses applications médicales en raison de leur excellente biocompatibilité spécialement l’hydroxyapatite.
Les éléments (Ca, P, O, H) qui composent les apatites phosphatés peuvent cristalliser sous plusieurs formes avec des structures cristallines très variées [3], ils peuvent être sous forme d’hydrate, d’hydroxyde ou d’anhydre (Tableau 1).
18 Tableau 1 : Famille des phosphates de calcium [3].
Orthophosphates de calcium Formule chimique Abréviation
Rapport Ca/P
Phosphate monocalcique anhydre Phosphate monocalcique hydraté
Ca(H2PO4)2 Ca(H2PO4)2, H2O MCPA MPCM 0,50 0,50 Phosphate dicalcique anhydre
(monétite)
Phosphate dicalcique hydraté (brushite) Pyrophosphate de calcium α, β ou γ CaHPO4 CaHPO4, 2H2O Ca2P2O7 DCPA DCPD CPP 1,00 1,00 1,00
Phosphate octocalcique Ca8(PO4)4(HPO4)2, 5H2O OCP 1,33
Phosphate tricalcique α ou β Phosphate tricalcique amorphe Phosphate tricalcique apatitique
Ca3(PO4)2
Ca9(PO4)6, nH2O Ca9(PO4)5(HPO4)(OH)
(α,β) TCP ACP ACP 1,50 1,50 1,50 Hydroxyapatite phosphocalcique -stœchiométrique -non-stœchiométrique Phosphate tétracalcique Ca10(PO4)6(OH)2 Ca10-x((PO4) 6-x(HPO4)x(OH)2-x Ca4(PO4)2O HAP PCA TTCP 1,67 1,5-1,67 2
I.1. Les méthodes de synthèse de l’hydroxyapatite
La synthèse de l’hydroxyapatite peut se faire selon plusieurs voies, on cite notamment : la méthode par voie sèche [4] et les méthodes par voie humide qui se devisent en trois groupes: la précipitation ou co-précipitation, la technique hydrothermale et la méthode sol-gel [5]. Il existe aussi d’autres techniques alternatives pour l’élaboration des poudres de l’HAP pure comme i) la pulvérisation par voie sèche [6], ii) l’irradiation sous micro-ondes [7] et iii) la technique de l’émulsion [8]. Nous allons détailler ci-après quelques exemples.
19 I.1.1. La synthèse par voie sèche
La préparation de l’hydroxyapatite par voie solide repose sur le traitement thermique des précurseurs finement broyés et mélangés. Ce mélange doit être parfaitement homogène pour avoir une réaction totale. Ainsi, la pureté du produit final ne dépend pas seulement de la précision des pesées, mais parfois, de la formation éventuelle de phases intermédiaires très stables qui peuvent limiter la formation du composé désiré. Tromel [9-10] a montré que les conditions optimums pour la formation de l’HAP à l'état solide (phosphate tricalcique et tétracalcique) ou (le phosphate tricalcique et l’oxyde de calcium) se fait vers 1050 °C sous atmosphère humide. Les réactions sont représentées selon les deux équations suivantes :
2 Ca
3(PO
4)
2+ Ca
4P
2O
9+ H
2O Ca
10(PO
4)
6(OH)
23 Ca
3(PO
4)
2+ CaO Ca
10(PO
4)
6(OH)
2En général, les réactions à l’état solide [11-12] donnent usuellement des produits stœchiométriques, bien cristallisés en plus leur frittage se fait aisément, mais exigent des températures relativement importantes, ce qui pénalise leur porosité par la suite.
I.1.2. La synthèse hydrothermale
Le principe de la synthèse hydrothermale consiste à chauffer au-dessus de 100 °C, un mélange de réactifs en solution sous une pression suffisamment haute > (1atm) permettant une élévation de la température tout en empêchant l’eau de s’évaporer. Elle permet l’obtention de poudres fines de l’HAP avec une bonne cristallinité sous une température
relativement faible. Liu et al. [13] ont utilisé comme matière première Ca(OH)2 et
CaHPO4.2H2O selon la réaction suivante :
4 Ca(OH)
2+ 6 CaHPO
4.2H
2O Ca
10(PO
4)
6(OH)
2Ces auteurs ont étudié l’influence de la température et de pH sur la structure et la morphologie de l’hydroxyapatite préparée. Ils ont obtenu une meilleure longueur des particules à un pH = 9 et à une température de 120 °C. Dans un autre travail [14], ils ont mis
20
un processus de cuisson sous pression pour la synthèse de l’HAP de haute qualité. Des
poudres de Ca(H2PO4)2H2O et Ca(OH)2 ont été mélangées en utilisant la technique de broyage
à boulle dans l’éthanol pendant une heure. Le rapport molaire est choisi de telle sorte à être convenable à la stœchiométrie de la composition. Le mélange est séché puis chauffé sous
pression, le produit est ensuite filtré et lavé trois fois avec l’eau distillée puis séché à 90 °C.
La poudre séchée a été pressée sous forme de disques compacts à 160 MPa, sans calcination. Ensuite, les disques ont été chauffés avec un taux de 10°C/min et filtrés à l’air à 1100-1300°C pendant 2 heures pour produire des échantillons massifs et denses.
Jae-Kil et al. [15], ont employé les deux précurseurs H3PO4 et Ca(OH)2 dans la
synthèse de l’hydroxyapatite de taille nanométrique par la méthode hydrothermale assistée par micro-onde dans un système fermé qui peut aller jusqu'à 300 °C et une pression de 600 psi. Le rapport molaire Ca/P et la puissance des micro-ondes ont été les deux paramètres primordiaux dans la formation de la nano-hdyroxyapatite pure. Ils ont montré qu’avec une puissance relativement faible (450 W), c’est difficile d’obtenir une phase pure de l’hydroxyapatite.
Ainsi, un mélange de phases de phosphate de calcium à savoir : Ca(OH)2, CaHPO4 et HAP a
été obtenu. Par contre, une augmentation de la puissance à 550 W donne lieu à une seule phase de nano-HAP de morphologie hétérogène sous deux formes : i) aiguille et ii) sphérique. La forme d'aiguille est variée de 4-15 nm de diamètre et 20-50 nm de longueur et la forme sphérique est d'environ 10-30 nm de diamètre.
I.1.3. La co-précipitation
Chaque processus de synthèse est choisi selon le domaine d’application. La méthode de double décomposition ou co-précipitation est largement utilisée actuellement à cause de la simplicité du mode opératoire, de l'obtention d'un rendement élevé et de la haute pureté des produits préparés [16]. Cependant, les produits de ces méthodes de synthèse ne sont pas stœchiométriques (déficients en Ca) avec un faible degré de cristallinité. Le rapport molaire
de Ca/P varie de 1,50 à 1,67 et la formule chimique générale est : Ca10-x(HPO4)x(PO4)
6-x(OH)2-x avec 0≤ x ≤1 [3]. Guzman et al. [17], ont réalisé une étude comparative entre deux
méthodes de synthèse de l’HAP à savoir : la précipitation et le sol-gel. L’hydroxyapatite obtenue par la méthode sol-gel a été stœchiométrique avec une composition homogène, pure et des poudres fines. Néanmoins, celle de la précipitation a été non stœchiométrique mais
21
l’avantage c’est que cette technique est moins coûteuse. Ces auteurs ont utilisé l’acide
phosphorique H3PO4 et l’hydroxyde de calcium Ca(OH)2 selon l’équation suivante :
10 Ca(OH)
2+ 6 H
3PO
4Ca
10(PO
4)
6(OH)
2+ 18 H
2O
Cette équation montre le processus de la précipitation. Le mélange est chauffé à 90 °C pendant 1 heure pour former les germes puis maintenu encore 1 heure à température ambiante pour sa maturation. L’HAP a été précipitée, filtrée et lavée par l’eau distillée, la poudre séchée a été calcinée à 850 °C durant 4 heures, pour avoir finalement une poudre cristallisée.
Dans une autre étude [18], les auteursstipulent que pour la première fois, une hydroxyapatite
nanocristalline a été préparée par précipitation à température ambiante et à pH = 11 en utilisant le nitrate de calcium tetrahydraté et le di-ammonium hydrogène phosphate comme précurseurs, selon l’équation suivante :
6 (NH
4)
2.HPO
4+ 10 Ca(NO
3)
2.4H
2O + 8 NH
4OH
Ca
10(PO
4)
6(OH)
2+ 20 NH
4(NO
3) + 20 H
2O
I.1.4. La méthode sol-gel
a- Sans tensio-actif
Cette méthode offre un mélange de molécules de phosphate et de calcium qui sont capable d’améliorer l’homogénéité chimique. Le procédé sol-gel a besoin d’un strict contrôle de pH, de l’agitation vigoureuse et d’une large durée pour l’hydrolyse. Différents avantages sont offerts par cette méthode : la simplicité, la composition homogène, la basse température et des poudres avec une haute pureté. Néanmoins l’application de la technique reste limitée par la possibilité d’hydrolyser les précurseurs de phosphates ainsi que le coût élevé des matières premières.
Cette méthode présente deux étapes essentielles pour la formation d’un gel dont le premier repose sur l’hydrolyse; il s’agit de la conversion de la fonction alcoxy en fonction hydroxy. La solution obtenue est appelée « sol » selon cette équation :
22
Le sol est suivi par une deuxième étape, c’est la condensation en espèces M-O-M. La viscosité de cette réaction augmente et par conséquent, le gel est formé avec l’élimination d’eau ou d’alcool selon les deux équations suivantes :
M: un métal de degré d’oxydation n, OR: un groupement alcoxyde
Notons que le pH joue un rôle très important dans la détermination de la nature du gel. Dans un milieu acide, l’hydrolyse s’accélère et la condensation se ralentit et donc, le gel se polymérise en chaîne rapidement et par conséquent, il conduit à des matériaux denses. Contrairement au pH basique, la vitesse d’hydrolyse est faible, ce qui favorise la nucléation et la formation d’une solution colloïdale.
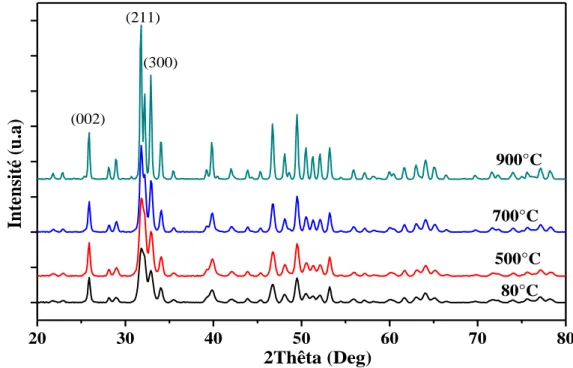
Durant la synthèse sol-gel, le vieillissement de la solution est un facteur très important. Par exemple, Wang et al. [19] ont démontré que le degré de cristallinité dépend de la température de frittage et du temps de vieillissement. Autrement dit, la croissance de la taille du cristal de l’HAP dépend de l’augmentation du temps de vieillissement. Une quantité de
pentoxyde phosphorique (P2O5) a été dissoute dans l’éthanol avec une autre quantité du nitrate
de calcium tétrahydraté Ca(NO3)2.4H2O. Les deux solutions sont mélangées pour avoir un
rapport de Ca/P égal à 1,67, et le mélange a été agité en continue pendant 10 min à température ambiante, puis chauffé dans un bain d’eau à 60 °C pendant 1 heure. Le gel transparent obtenu a été laissé vieillir pendant 4 heures à température ambiante et séché à 80 °C pendant 24 heures sous air. Postérieurement, le gel a été calciné à différentes températures 600, 700, 800 et 900 °C avec un programme de 10°C/min pour avoir une poudre bien cristallisée.
Et comme le vieillissement de la solution de Ca et P a été jugé critique dans le
développement d'une phase apatitique dans un procédé sol-gel. Dean-Mo et al.,[20], ont mis
au point une étude systématique qui englobe la température et le temps de vieillissement afin de former une phase pure de l’hydroxyapatite. Les résultats expérimentaux ont montré que le temps de vieillissement est considérablement réduit lors d’une augmentation de la température
23
de réaction. Cependant, des phases d'impuretés minoritaires comme : CaO, Ca2P2O7,
Ca3(PO4)2, CaCO3, ont été aussi obtenues durant ce processus, puisque les paramètres de la réaction ne sont pas correctement contrôlés (pH, durée, température).
Jiwen et al. [21], ont synthétisé une poudre de l’HAP nanostructurée et
cristallographiquement pure par l’addition de NH4OH dans une solution sol-gel sur des
précurseurs de nitrate de calcium et triéthylphosphite (TEP), suivie par un processus de combustion. La solution de calcium a été préparée par la dissolution du nitrate de calcium
Ca(NO3)2.4H2O dans l’éthanol à température ambiante avec l’agitation durant 24 heures, puis,
l’autre solution de phosphore a été préparée par l’hydrolyse du triéthylphosphite dans l’éthanol avec une agitation durant 24 heures à température ambiante. Les deux solutions sont mélangées avec un ratio Ca/P =1.67. La taille des nano-cristallites obtenues sont de 50 à 100 nm.
Daniel et al. [22] ont développé une nouvelle méthode pour la synthèse de la nano-HAP pure; ils ont utilisé la chimie du sol-gel pour produire l’ACP « phosphate de calcium amorphe» à l’échelle nanométrique qui est à son tour utilisé comme un précurseur dans un procédé hydrothermal afin de préparer un matériau bien cristallisé avec un aspect des nano-fils sans utiliser de solvants organiques ou de tensioactifs. Ils ont mentionné que le traitement hydrothermal dudit produit préparé via sol-gel, est une méthode simple, rentable et respectueuse de l'environnement, offrant un degré élevé de contrôle de la morphologie de
l’HAP nanostructurée.
b- En présence du tensio-actif
Récemment, plusieurs travaux intéressants [23,24] ont été publiés basés sur l’utilisation des tensioactifs comme agents structurants dans la préparation de l’hydroxyapatite pour générer un matériau de porosité calibrée ou hiérarchisée (micro-, méso- et macro-pores), de surface spécifique élevée, et nano-structuré avec une parfaite homogénéité de taille, de distribution et de morphologie. Notons que cette méthode peut s’assister par des moyens de chauffage et d’agitation non-conventionnels comme les micro-ondes [23] et l’ultra-son [25].
24
Song et al. [24], ont testé deux tensioactifs, le bromure de cétyltriméthylammonium (CTAB) et le polyvynil pyrrolidone (PVP) pour étudier les propriétés mécaniques de l’hydroxyapatite préparée et frittée jusqu'à 1250 °C. Ils ont constaté que le CTAB a donné une forme de prisme régulier avec une longueur moyenne de 200 nm et un diamètre moyen de 100 nm. Tandis que, le PVP a donné des nano-tiges déformées avec une longueur moyenne de 200 nm et un diamètre moyen de 20 nm avec une stabilité thermique pour les deux HAP préparées. Ils ont dévoilé que l’HAP frittée en forme prisme a une dureté de ~ 5,11 GPa, une résistance à la rupture transversale d'environ 106,26 MPa et une ténacité à la rupture d'environ
1,24 MPa m1/2.
Dans un autre travail, une nano-poudre poreuse d’HAP a été préparée avec succès à température ambiante et à pression normale en utilisant le CTAB en tant que tensioactif [26]. La concentration micellaire critique (cmc) et d'autres paramètres expérimentaux ont été explorés afin d'obtenir une HAP poreuse nano-sphérique. La cmc utilisée est de 3,88 mM et l'effet de la calcination à différentes températures a été également étudié. En outre, la
calcination à 350 °C a pu donner lieu à une surface spécifique de l’ordre de 89 m2/g tandis
qu’à 750 °C, la surface spécifique est de 15 m2
/g.
Une hydroxyapatite nanostructurée de dispersion homogène et de morphologie sous forme de bâtonnet a été synthétisée en se basant sur le système : acide oléique/éthanol/eau, suivi d’un traitement hydrothermal [27]. Des tensioactifs ont été ajoutés tels que le CTAB et le dodécylsulfate de sodium (SDS) pour étudier leur influence sur la morphologie des matériaux préparés. Une étude comparative récemment publiée sur la préparation de l’HAP avec et sans tensioactif (CTAB) a montré que l’utilisation du tensioacitf a triplé la valeur de la
surface spécifique du matériau, de 33 à 96 m2/g [28]. Dans ladite étude, elle a été démontré
aussi l’influence du traitement thermique sur la surface spécifique et le degré de cristallinité ainsi que l’architecture des particules obtenues.
Liu et al. [29] ont synthétisé de l’HAP nano-structurée sous l’irradiation micro-ondes en employant l’agent complexant l’acide éthylènediamine tétraacétique (EDTA) afin de contrôler la morphologie et la taille des nanoparticules. Ils ont constaté que l’augmentation de la basicité, a stabilisé davantage le matériau ainsi qu’à un changement de la forme de tiges à une forme de fleurs a été observé.
25
L’hydroxyapatite de taille nanométrique a été synthétisée par une technique de précipitation à température ambiante, en présence de divers agents complexants comme la triéthanolamine (TEA), (EDTA), la diéthanolamine (DEA) et l'éthylène-glycol (EG). L'analyse de la surface spécifique par la méthode BET indique que les poudres sont de nature
poreuse avec des surfaces spécifiques comprises entre 63,82 et 97.39 m2/g. Or, ils ont trouvé
une surface spécifique égale à 56,55m2/g sans l’utilisation d’un agent complexant. La taille
des particules analysées par le MET a été aux alentours de 5-8 nm en diamètre et de 30-56 nm en longueur via l’agent complexant (TEA). Par contre l’utilisation de l’EG donne lieu à des nanoparticules de 12-16 nm en diamètre et 80-120 nm de longueur [30].
En se basant sur le concept d’un gabarit moléculaire (template) dans la synthèse de
l’HAP, Santosh et al. [31] ont utilisé des nanotubes de carbones multiparois fonctionnalisés
par l’acide nitrique. La matrice utilisée possède la propriété d’avoir un potentiel spécifique de
chélation des ions Ca2+. Ils ont constaté que la morphologie de l’HAP ressemble à des
plaquettes en multicouches, due à la croissance de l’HAP entre les nanotubes de carbone fonctionnalisés.
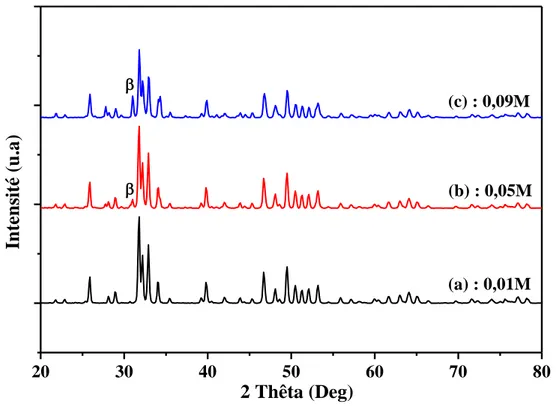
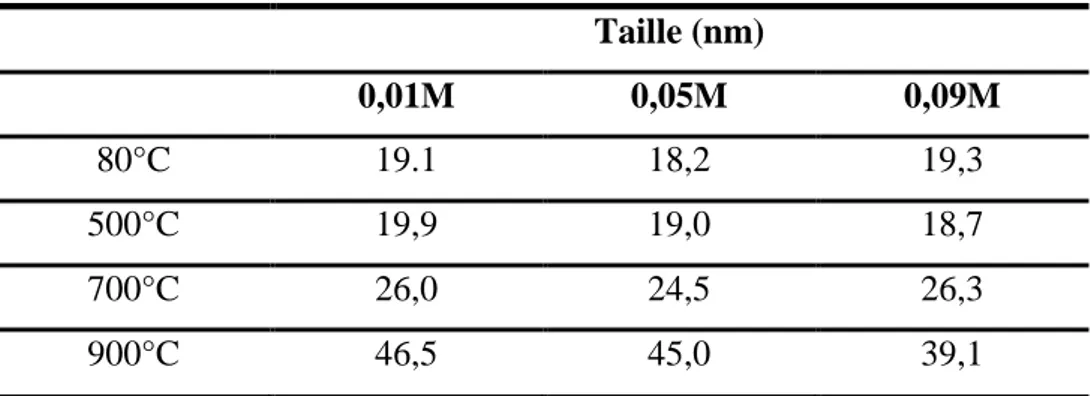
L'effet de la concentration du tensioactif mono-dodecyl phosphate C12H27O4P
(0,01, 0,02 et 0,03 M) sur la surface spécifique a été étudié [32]. Le calcium et l’acide phosphorique ont été mélangé avec la solution du tensioactif, le pH de la solution a été ajusté
à 7 par l’ajout de NH4OH goutte à goutte en solution. Il a été observé que la concentration
0,02 M du tensioactif a donné la plus grande surface spécifique de l’ordre de 52 m2/g, avec
l’apparition d’une phase pure inorganique d’hydroxyapatite nanocristalline.
El Hammari et al. [33] ont réalisé la synthèse d’une hydroxyapatite poreuse préparée dans un solvant mixte (eau et éthanol) V:V 50/50 pendant 24 heures à différentes températures 25, 70 et 90 °C. Ils ont obtenu des surfaces spécifiques intéressantes de l’ordre
de 235 m2/g ,151 m2/g et 108 m2/g, respectivement. Néanmoins, le matériau préparé à 25 °C
est une hydroxyapatite presque faiblement cristalline voire amorphe. Ils ont montré aussi que la surface spécifique diminue par rapport à l’augmentation de la température de calcination.
Une biomacromolécule cationique [34] N-[(2-hydroxy-3-trimethylammonium)propyl] chlorure de chitosane (HTCC) a été utilisée en tant que tensioactif, suivi par un traitement hydrothermal pour contrôler la nucléation et la croissance des cristaux. La taille et la
26
morphologie des cristaux de l’HAP peuvent être contrôlées en faisant varier le pH, la
températureet la concentration du tensioactif HTCC préparé.
I.1.5. La synthèse par microémulsion inverse
L’hydroxyapatite a été synthétisée par la technique dite micro-émulsion inverse en utilisant du nitrate de calcium et l'acide phosphorique comme précurseurs [35]. Le cyclohexane, l'hexane et l'isooctane ont été utilisés comme solvants organiques. Les tensioactifs utilisés pour faire l’émulsion ont été: le sel du dioctyl sulfosuccinate de sodium (AOT), le dodécyl de phosphate (DP), le polyoxyéthylène éther de nonylphénol 5 (NP5), et le NP12 (polyoxyéthylène éther de nonylphénol 12). L’effet des paramètres de synthèse, tels que le type de tensioactif, le rapport de la phase aqueuse et organique (A/O), le pH et la température ont été étudiés. Les auteurs ont constaté que les tensioactifs jouent un rôle important dans la régulation de la morphologie des nanoparticules. En revanche, seules les formes aiguille et tige, ont été obtenues malgré l’ajustement des conditions du système
d'émulsion. Une surface spécifique égale à 121 m2/g a été référée au matériau préparé en
utilisant le NP5 en tant que tensioactif.
Notons aussi que d’autres types de tensioactifs ont été utilisés dans la synthèse de l’hydroxyapatite de taille nanométrique par la voie de microémulsion inverse à savoir, le polyoxyethylene (TX-100) et le polysorbate 80 (Tween 80) [36].
L’utilisation des tensioactifs (CTAB, SDS, TEA, TX-100, Tween 80 …etc.) dans la préparation de l’HAP nano-structurée et poreuse a montré que leur emploi a donné une surface spécifique accrue avec une réduction de la taille des particules à l’échelle nanoscopique. Cependant, les valeurs de la surface spécifique trouvée restent encore à optimiser vue son rôle crucial dans l’activité et la réactivité chimique de l’HAP. L’optimisation de la surface spécifique fait l’objet de notre étude en utilisant de tensioactifs nouveaux et moins chers que ceux déjà utilisés. Nous présentons par la suite un rappel bibliographie sur les tensioactifs utilisés dans la synthèse de l’hydroxyapatite mésoporeuse et nanostructurée.
27
I.2. Rappels bibliographiques sur les tensioactifs utilisés dans la
synthèse de la mn-HAP
Un tensioactif présente une double affinité, qui peut être définie à partir du point de vue physico-chimique comme une dualité polaire apolaire : i) une tête polaire à caractère hydrophile, qui contient des hétéroatomes tels que O, S, P, ou N, incluant des groupes fonctionnels tels que l'alcool, thiol, éther, ester, acide, sulfate, sulfonate, phosphate, amine et amide, et ii) une queue apolaire à caractère hydrophobe « lipophile » qui est en général une chaîne hydrocarbonée du type alkyle ou alkylbenzène. Mais encore de multiples variations sont possibles : présence de plusieurs têtes, de plusieurs queues et volume relatif à la variation de la taille de la tête et de la longueur de la queue. La partie polaire présente une forte affinité pour les solvants polaires, en particulier l'eau. Tandis que la partie apolaire présente une forte affinité pour les solvants apolaires en général de type hydrocarbures. La figure 1 illustre un modèle d’un tensioactif.
Figure 1: Représentation schématique d'un tensioactif
Un tensioactif est nommé aussi un surfactant et sa classification dépend de la nature du groupement hydrophile. Nous pouvons répertorier quatre catégories selon la nature de leur tête et queue [37] :
Anioniques : la tête hydrophile porte une charge négative comme les carboxylates
RCOO-, les sulfonate RSO3-, les esters phosphoriques ROPO32-,
Cationiques : la tête hydrophile porte une charge positive comme les ammoniums
quaternaires R4N+ par exemple et les alkyl triméthyl ammoniums,
Amphotères ou (Zwitterioniques) : qui comportent à la fois un pôle anionique et un
28
bétaïnes : C16H33N+OO-, les aminoacides et les phospholipides. Selon les conditions
du milieu, ils peuvent s’ioniser en solution aqueuse en conférant au tensioactif un caractère anionique aux pH alcalins ou un caractère cationique aux pH acides,
Non ioniques : qui sont caractérisés par une tête hydrophile et dont l'interaction avec l'eau est assurée par des hétéroatomes (O, S, N, P) exempte de charge dont la solubilité dans l'eau résulte de groupements fortement polaires comme les alcools éthoxylés, les POE (polyoxyéthylènes comme le P123, P127), les esters d’acides gras, les alkylpolyglucosides et les alkylamides éthoxylés.
D’autres types de tensioactifs sont répertoriés de nature siliconés [38-40], fluorés [41] et des polymères tensio-actifs [42]. Ces derniers résultent de l'association d'une ou plusieurs structures macromoléculaires présentant des caractères hydrophile et lipophile, soit sous
forme de blocs séparés ou en tant que greffés. L’alginate utilisé dans notre étude fait partie de
la classe des polymères tensioactifs.
Dans ce qui suit, nous allons présenter un rappel bibliographique sur les trois tensioactifs lauryl éther sulfate de sodium (SLES), linéaire alkyl benzène sulfonate (LABS) et lauryl betaïne (LB) utilisés dans la préparation de l’hydroxyapatite nanostructurée et mésoporeuse (mn-HAP).
- Lauryl éther sulfate de sodium (SLES) :
C’est un tensioactif anionique utilisé en industrie cosmétique [43], en tant qu’agent : i) émulsifiant, ii) mouillant, iii) lubrifiant, iv) agent moussant, avec une bonne solvabilité, une forte résistance à l'eau dure, une haute biodégradation et une faible irritation de la peau et des yeux. Il est largement utilisé dans les détergents liquides, tels que, le liquide vaisselle, le shampoing [44], et il est également utilisé dans l’industrie de textile et de teinture. Concernant sa structure chimique, elle est constituée d’une chaîne aliphatique avec un groupement éthoxylé et une tête polaire formée d’un groupement sulfonate. Aoudia et al. [45] ont étudié l'effet de l'éthoxylation sur le comportement de l'auto-agrégation du lauryl éther sulfate de
sodium (SLES) dans des milieux aqueux, avec C12H25 (OCH2CH2) xOSO3Na, où x = 1, 2 et
3). Ils ont montré que la concentration micellaire critique est de 0,8 mM et le nombre moyen d’agrégation des tensioactifs sont indépendants du degré d’ethoxylation. Cette classe de
29
tensioactif a le pouvoir de combiner les avantages à la fois du tensioactif anionique et non ionique [46]. Dans la plupart des applications, il est rarement utilisé seul, mais souvent dans des mélanges avec d'autres tensioactifs. Le rendement d'un mélange de lauryl éther sulfate de sodium (SLES) avec un agent tensioactif non ionique, par exemple alkylpolyglucoside (APG) atteint la tension superficielle la plus faible. Cela donne une meilleure détergence et des propriétés moussantes impressionnantes avec une stabilité comparative au SLES seul. La figure 2 présente la formule semi-développée de SLES avec un degré d’éthoxylation égal à n = 2.
Figure 2 : Formule semi-développée de la molécule de SLES.
- Linéaire alkyl benzène sulfonate (LABS):
C’est parmi les tensioactifs les plus couramment utilisés dans l’industrie. Plus de 80% de la consommation de LABS est destinée aux détergents ménagers et des produits de nettoyage liquides [47]. Il sert aussi à augmenter la durée de vie des mousses; ce qui explique sa présence dans de nombreux produits cosmétiques tels que : les shampooings et les dentifrices.
De nombreuses études sur la biodégradation de LABS ont montré qu’il est biodégradable dans une grande variété de conditions aérobiques [48,49]. Les algues vertes, par exemple, ont une certaine capacité d'absorper et dégrader le LABS [50,51]. En effet, le tensioactif utilisé dans ce travail est constitué d’une chaine de 12 atomes de carbones sans ramification avec un noyau aromatique lié avec une tête polaire qui est composée d’un groupement de sulfonate. La concentration micellaire critique de LABS est égale à 0.105 g/l [52]. La figure 3 donne une illustration de sa formule semi-développée.
30 Figure 3 : Formule de la molécule « Linéaire alkyl benzène sulfonate ».
- Alkyl betaïne « Dodecyl bétaïne de diméthyle » :
Dodecyl bétaïne de diméthyle ou lauryl betaïne (LB) est un tensioactif amphotère, qui a une activité antimicrobienne contre une variété de micro-organismes [53]. Il est utilisé en cosmétique [54] comme additifs de conditionnement de shampooings. Il est moins irritant par rapport au dodécyl sulfate de sodium (SDS) [54,55]. Il a des effets adoucissants et antistatiques sur les cheveux [56]. En effet, il est largement utilisé comme amplificateur de la mousse dans les formulations de shampooings commerciaux [57]. Ces caractéristiques conviennent très bien pour des produits de nettoyage ménagers, de lavage facial et de gel douche [56].
En effet, c’est un tensioactif qui a une chaine lipophile de 12 atomes de carbones avec une tête hydrophile qui contient une charge positive représentée par un atome d’azote et une charge négative représentée par le groupement carboxylate ; sa concentration micellaire critique est égale cmc = 1,8 mM [58]. La figure 4 ci-dessous, donne une illustration de sa formule semi-développée.
31
I.3. Structure cristalline de l'apatite
L’hydroxyapatite phosphocalcique cristallise dans le système hexagonal (groupe d’espace P63/m) avec les paramètres cristallographiques suivants : a = 9,424 Ǻ, c = 6,879 Ǻ,
β = 120 °C. Le volume de maille est égal à 529,09 Å3
[60]. La structure cristallographique de
l’HAP (figure 9) consiste en un empilement de groupements phosphate PO43- très compact,
situés à la côte c/2. Cet empilement forme le squelette de la structure apatitique et fait apparaître deux types de tunnels parallèles à l’axe c dans lesquels se localisent les cations
Ca2+ [61, 62]. Le premier tunnel coïncide avec l’axe ternaire (C3) de la structure. Ces tunnels
sont occupés par les ions calcium notés communément Ca(I). Ces cations sont au nombre de quatre par maille et sont liés à neuf atomes d’oxygène. Ces tunnels ont un diamètre d’environ 0,25 nm. Le second type de tunnel, dont l’axe coïncide avec l’axe sénaire hélicoïdal du
réseau, est bordé par les atomes d’oxygène et les autres ions calcium, notés Ca(II). Il est
occupé par les ionshydroxyde. La taille de ce type de tunnel d’environ 0,3 nm confère aux
apatites des propriétés d’échangeurs d’ions et d’accepteurs de petites molécules (O2, H2O,
glycine) [63, 64].
Figure 5 : Représentation schématique de la structure de l’HAP Ca10(PO4)6(OH)2 le long de l'axe [001] [65].
32
I.4. Substitutions isomorphiques de l’HAP
L’HAP est une mystérieuse structure capable de faire diveres substitutions, tout en
conservant sa structure apatitique de base. M2+ peut être substitué par différents cations :i)
monovalents (Na+, K+) [66], ii) divalents (Mg2+, Sr2+, Ba2+, Pb2+) [67] et iii) trivalents (Y3+)
[67] ou des lacunes. Le second site anionique Y- peut aussi être occupé par OH-, F-, Cl-. Les
groupements XO43- peuvent également être substitués par des groupements bivalents ou
tétravalents SO42- et MnO4-…etc. Cependant, l’existence d’apatites contenant des sites XO4
3-lacunaires n’a jamais été reportée. Des doubles substitutions sont aussi possibles, consistant à
maintenir l'équilibre des charges dans l'apatite, tels que, CO32- par PO43- couplé avec Na+ par
Ca2+. Les substitutions possibles sont indiquées dans le tableau 2.
Tableau 2: Exemples de substitutions possibles dans la structure apatitique [61, 68, 69]
M2+ XO43- Y- Ca2+ Mg2+ Cu2+ Na+ Sr2+ Ba2+ Zn2+ K+ Cd2+ Pb2+ Eu3+ Lacune PO4 3-SO4 2-CrO4 3-SiO4 4-MnO 4-CO3 2-AsO4 3-VO4 3-HPO4 2-OH -Br -S 2-F -I -O 2-Cl -CO3 2-Lacune
33
La substitution des ions dans la structure apatitique affecte les propriétés de l’HAP : les paramètres cristallins (a et b), la forme, la taille du cristal, le degré de cristallinité, les propriétés d’absorption infrarouge, les propriétés de dissolution et la stabilité thermique [70]. Selon la substitution en terme de taille et de quantité de substituant, les paramètres cristallins (a et c) se contractent ou se décontractent [71-74]. La substitution des ions par d’autres
éléments, par exemple : (Ca2+ par Sr2+ ou OH- par Cl-) influence les paramètres cristallins de
la maille: soit les deux paramètres a et b sont affectés dans une même direction ou dans deux
directions opposées. Lorsque, l’ion OH- reste non substitué [70-73], aucun changement
significatif ne peut affecter l’axe (c). Or, l’axe (a) peut augmenter ou diminuer, tout dépend de la nature de l’ion substitué.
Le type du substituant affecte aussi la cristallinité des apatites, par exemple, lors de
l’incorporation de F
-, une augmentation de la cristallinité a été remarquée-, tandis que
l’incorporation de CO32- a conduit à une diminution de la cristallinité. Les caractéristiques du
substituent influencent les propriétés de dissolution apatitique, par exemple, le fluor, le carbonate et le magnésium ont un effet spécifique sur la solubilité de l’HAP. Dans le cas du fluor, la solubilité a été diminuée [70, 74, 75]. Par contre, dans le cas du carbonate et du magnésium la solubilité a été augmentée [70, 76, 77].
I.5. Domaine d’applications de l’hydroxyapatite
L’HAP fait l’objet de nombreuses études, en raison de ses propriétés physico-chimiques qui lui confèrent une large gamme d’application dans différents domaines.
I.5.1. Domaine de la santé : biocéramiques
L’HAP présente d’excellentes propriétés de biocompatibilité et de bioactivité avec les os naturels [78,79]. Elle est ostéoconductrice, c’est à dire qu’elle facilite la migration et l’attachement des ostéoblastes (cellules qui fabriquent l’os). De ce fait, l’HAP trouve de nombreuses applications dans le domaine biomédical [80-82] (substituts osseux, recouvrement de prothèses).
34 I.5.2. Domaine de l’environnement
Généralement, l’HAP possède une surface active qui facilite l’adsorption des molécules organiques (alcools, acides aminés, protéines, colorants, pesticides) [83-86] ainsi que la fixation et la rétention des métaux lourds. Divers procédés ont été employés pour l’élimination de métaux lourds (actinides, lanthanides, plomb …etc.) et polluants rencontrés dans les sols contaminés et les eaux souterraines [87, 88].
I.5.3. Domaine de la catalyse hétérogène - Solide-gaz
Grâce à ses propriétés de surface, sa stabilité et sa capacité d’être promue ou échangée les constituants de sa charpente de base avec d’autres éléments, l’HAP a été largement utilisée dans la catalyse hétérogène solide-gaz [89-92]. De nombreuses inventions utilisant l’hydroxyapatite comme catalyseur ou support de catalyseur sont brevetées [93,94] et, d’autre part, plusieurs travaux décrivant la catalyse par l’HAP sont publiés [95-97]. Ainsi, parmi les réactions catalysées par ce matériau, nous citons à titre d’exemple : la, la déshydrogénation,
l’oxydation du méthane,l’isomérisation, la polymérisation, et la synthèse du phénol à partir
du benzène [98-102].
L’hydroxyapatite a été aussi utilisée comme support de catalyseurs à base de fer, de cobalt et de nickel pour catalyser la décomposition d’une source de carbone comme l’éthylène pour produire des nanotubes de carbones via la technique dite C-CVD (Catalysis Chemical Vapor Deposition) [103].
- Solide-liquide
Il est rapporté dans la littérature que l’HAP stœchiométrique peut se comporter comme un catalyseur basique alors que l’HAP déficitaire en calcium peut jouer le rôle d’un catalyseur acide [104,105]. Ce double rôle lui a permis d’être un catalyseur de choix pour des réactions acido-basiques. Cependant, l’HAP a été appliquée aussi dans des réactions d’oxydo-réductions. Cela, peut se faire via la substitution du calcium de l’HAP par des métaux de
35
L’aspect nanoscopique et la porosité de l’hydroxyapatite peuvent influencer la qualité de contact entre le catalyseur et les réactifs et par la suite le rendement et la sélectivité de la
réaction. D’autres exemples de réactions solide-liquide catalysées par l’hydroxyapatite seront
cités ci-après.
L’hydroxyapatite est employée dans un milieu hétérogène comme catalyseur solide de la réaction de Knoevenagel pour former des nitrile-éthyléniques 3 ou 3’ [107]. La synthèse a été réalisée entre les aldéhydes 1 ou 1’ et les méthylènes activés 2 en absence de solvant, l'ajout de l'eau ou du chlorure de benzyltriéthylammonium (BTEAC) a amélioré notablement l'activité catalytique de l'hydroxyapatite.
Schéma 1
L’imprégnation de l’hydroxyapatite par le nitrate de sodium a permis également de catalyser l'hydratation sélective de plusieurs nitriles 4 ou 4’. Les amides 5 ou 5’ ont été obtenus de manière efficace et sélective avec de bons rendements [108].
36 Schéma 2
Le même catalyseur sodium@hydroxyapatite, a été utilisé dans la catalyse de la condensation de Claisen-Schmidt [109]. La réaction a été effectuée dans des conditions très douces entre les arylaldéhydes 6 et des acétophénones 7. L'addition d'un sel d'ammonium quaternaire a permis d’améliorer considérablement le rendement de la synthèse des chalcones
8.
37
Les α,α’-(EE)-bis(benzylidène)-cycloalcanones 11 ont été préparées par la condensation des arylaldéhydes 9 et cycloalcanones 10 par action du même catalyseur [110]. La synthèse a été réalisée dans l’eau sous chauffage classique et sans solvant ou via une irradiation par micro-ondes. L’étude faite montre que les micro-ondes donnant la possibilité de faire la synthèse d'une manière douce et propre avec une période plus courte et des rendements plus élevés par rapport à la méthode conventionnelle de chauffage.
Schéma 4
L’hydroxyapatite a été utilisée largement comme support dans le domaine de la catalyse hétérogène. Plusieurs métaux sont supportés sur ce matériau, nous citons par exemple : l’or [111], le palladium [112], le cuivre [113], l’argent [114], le cobalt [115], et le fer [116]…etc. On trouve aussi le zinc qui a été supporté sur l’HAP pour la catalyse de l'addition de Michael [117] entre des indoles 12 et des α,β- cétones insaturées 13 pour préparer des indoles 3-substitués 14. La substitution est faite sur la position 3 du noyau d’indole sans formation des produits secondaires tel que la N-alkylation.
38 Schéma 5
II. Généralité sur les matériaux hybrides organique/inorganique
(bio-polymère/inorganique)
II.1. Matériau hybride organique/inorganique à base des
polysaccharides
Un matériau hybride est un matériau constitué d'au moins une phase organique et d'une phase inorganique. On distingue deux types de matériaux hybrides en fonction du mode d'arrangement entre les constituants:
i) Les hybrides de classe I : caractérisés par des interactions faibles entre les
phases organique et inorganique du type (Van der Waals, ou électrostatiques) [118].
ii) Les hybrides de classe II : définis par des interactions fortes (de type ionique,
ou covalente.) entre les phases organique et inorganique [118].
Actuellement, une nouvelle voie de synthèse se développe basée sur l’utilisation des polysaccharides naturelles comme : l’Alginate [119], le Chitosan [120-122], le carboxymethylcellulose (CMC) [123] et la dextrine [124]. Les gels formés par ces éléments
peuvent se combiner à des matériaux inorganiques et former des matériaux hybrides. Dans ce
concept, Song-wei Xu et al. [125] ont préparé des billes hybrides qui regroupent
(alginate-silice-enzyme) en utilisant l’alginate (ALG) comme un support bio-polymère, la silice comme