UNIVERSITÉ MOHAMMED V – AGDAL
FACULTÉ DES SCIENCES
Rabat
Faculté des Sciences, 4 Avenue Ibn Battouta B.P. 1014 RP, Rabat – Maroc Tel +212 (0) 5 37 77 18 34/35/38, Fax : +212 (0) 5 37 77 42 61, http://www.fsr.ac.ma
N° d’ordre………..
THÈSE DE DOCTORAT
Présentée par
RECHCHACH Meryem
Discipline : Chimie
Spécialité : Physico-Chimie des alliages métalliques et environnement
Etude thermodynamique des systèmes ternaires In-Sn-Zn, Bi-Sn-Cu
et Bi-Sn-Ni comme matériaux pour soudure sans plomb
Soutenue le 16 Décembre 2011
Devant le jury
Président :
ZRINEH Abdallah, Professeur, Faculté des Sciences, Rabat – Maroc.
Examinateurs :
EL HAJJAJI Souad,Professeur, Faculté des Sciences de Rabat – Maroc.
LBBIB Rachid, Professeur, Faculté des Sciences et Techniques de Beni-Mellal et Vice- Doyen de la Faculté Polydiscilplinaire de Beni-Mellal – Maroc.
MEKKAOUI Mohamed, Professeur, Faculté des Sciences de Rabat – Maroc.
OULMEKKI Abdallah, Professeur, Faculté des Sciences et Techniques de Fès – Maroc. SABBAR Abdelaziz, Professeur, Faculté des Sciences de Rabat – Maroc.
SOMMAIRE
Introduction générale ... 5
I-La soudure classique Sn-Pb ... 8
II-Les soudures sans plomb ... 15
II-1 La soudure Bi-Sn ... 17
II-2 La soudure Bi-Sn/Cu... 18
II-2-1 Réactions à l’interface Sn/Cu ... 18
II-2-2 Evolution de l’interface Bi-Sn/Cu ... 20
II-3 La soudure Bi-Sn/Ni ... 24
II-3-1 Réaction à l’interface Sn/Ni ... 26
II-3-2 Evolution à l’interface Bi-Sn/Ni ... 26
Références bibliographiques…
……….………...30
I-Analyse thermique différentielle ... 35
I-1 Analyse Thermique (AT) ... 35
I-2 Analyse Thermique Différentielles (ATD) ... 36
II-Calorimétrie ... 38
II-1 Calorimétrie à haute température ... 40
II-2 Automatisation du calorimètre Calvet ... 42
CHAPITRE I: Revue bibliographique des systèmes Bi-Sn-X (X=Cu, Ni).
Formation et évolution des composés intermétalliques.
II-2-1 Introducteur d’échantillons ... 42
II-2-2 Système d’acquisition et de traitement des données ... 44
II-3 Etalonnage du calorimètre ... 45
II-4 Mesure des enthalpies de formation ... 46
II-4-1 Les méthodes ... 47
II-4-2 Le calcul des enthalpies molaires partielles et intégrales ... 51
Références bibliographiques…
……….………..…...
....54
Partie A : Le système ternaire In-Sn-Zn
I-Revue bibliographique ... 56
I-1 Système binaire In-Sn
... 56
I-2 Système binaire In-Zn ... 58
I-3 Système binaire Sn-Zn ... 60
I-4 Système In-Sn-Zn ... 63
II- Résultats expérimentaux ... 70
II-1 Procédure expérimentale pour la synthèse des alliages ... 71
II-2 Système binaire In-Sn ... 71
II-3 In-Sn-Zn ... 76
Références bibliographiques
………
……….……..
..…..…....81
Partie B : Le système ternaire Bi-Cu-Sn
I-Revue bibliographique ... 84
I-1 Système binaire Bi-Cu ...
84
CHAPITRE III: Résultats expérimentaux
I-2 Système binaire Bi-Sn ...
86
I-3 Système binaire Cu-Sn ...
90
I-4 Système ternaire Bi-Cu-Sn ...
94
II-Résultats expérimentaux ... 95
II-1 Système binaire Bi-Cu ...
95
II-2 Système ternaire Bi-Cu-Sn ...
102
II-2-1 Détermination des enthalpies molaires partielles et intégrales ... 102
II-2-2 Extrapolation des résultats expérimentaux du système ternaire Bi-Cu-Sn ... 130
II-2-3 Détermination des enthalpies molaires partielles à dilution infinie ... 133
Références bibliographiques…
……….…………..…...135
Partie C : Le système ternaire Bi-Ni-Sn
I-Revue bibliographique ... 138
I-1 Le système binaire Bi-Ni ... 138
I-2 Le système binaire Bi-Sn ... 141
I-3 Le système binaire Ni-Sn ... 141
I-4 Le système ternaire Bi-Ni-Sn ... 146
II-Résultats expérimentaux ... 148
II-1 Système Bi-Ni... 148
II-2 Système ternaire Bi-Ni-Sn ... 153
II-2-1 Détermination des enthalpies molaires partielles et intégrales ... 153
II-2-2 Extrapolation des résultats expérimentaux du système ternaire Bi-Ni-Sn ... 182
II-2-3 Détermination des enthalpies molaires partielles à dilution infinie ... 184
Conclusion générale ... 188
Annexe ... 190
1
AVANT PROPOS
Les travaux présentés dans ce mémoire ont été réalisés au Laboratoire de Chimie- Physique Générale de la Faculté des Sciences de Rabat (Maroc) en collaboration avec l’Institut de Chimie Inorganique de l’Université de Vienne (Autriche).
Au terme de ce travail, je tiens tout d’abord à exprimer ma profonde gratitude et mes plus vifs remerciements à Monsieur A. SABBAR, Professeur à la Faculté des Sciences de Rabat, pour avoir accepté de diriger patiemment ce travail durant toutes ces années, pour son dynamisme et son infatigable énergie, pour son soutien constant pendant la rédaction de ce manuscrit, pour sa disponibilité et sa générosité exceptionnelles et pour la confiance en moi qu’il m’a toujours transmise grâce à son caractère chaleureux. Sans Professeur A. SABBAR cette thèse ne serait pas ce qu’elle est. Qu’il trouve ici le témoignage de mon profond respect et de ma plus vive reconnaissance.
A cette occasion, je suis particulièrement heureuse d’associer dans mes remerciements Monsieur H. IPSER, responsable du Laboratoire de Chimie des Matériaux à l’Institut de Chimie Inorganique de l’Université de Vienne pour avoir accepté de m’accueillir au sein de son Laboratoire et pour ses précieuses suggestions.
Je remercie Monsieur H. FLANDORFER, Professeur à l’Institut de Chimie Inorganique de l’Université de Vienne pour sa précieuse collaboration, pour son soutien et son accueil chaleureux qu’il a toujours su m’apporter lors de mes séjours à Vienne.
Mes plus sincères remerciements s’adressent également à Monsieur J.P BROS, Professeur à l’Université de Provence (Marseille, France), pour avoir suivi l’évolution de ma thèse et pour les discussions scientifiques fructueuses qu’il m’a accordées lors de son séjour au Maroc. Il a toujours montré de l'intérêt pour mes travaux et répondu à mes sollicitations lorsque le besoin s'en faisait sentir. Je le remercie également pour les conseils précieux qu’il n’a cessés de me prodiguer et de m’avoir permis de profiter de sa compétence scientifique.
Je remercie Monsieur A. ZRINEH, Professeur à la Faculté des Sciences de Rabat, qui m’a honoré en acceptant d’être Président de mon jury.
Je remercie également Madame S. EL HAJJAJI, Professeur à la Faculté des Sciences de Rabat, pour avoir accepté la charge d’être rapportrice de ce travail malgré ses occupations et ses responsabilités.
2 Mes remerciements s’adressent aussi à Monsieur M. MEKKAOUI, Professeur à la Faculté des Sciences de Rabat, pour avoir accepté de juger ce travail et de faire partie de ce jury.
Je remercie également Monsieur R. LBBIB, Professeur à la Faculté des Sciences et Techniques de Beni-Mellal et Vice-Doyen de la Faculté Polydiscilplinaire de Beni-Mellal, pour la rapidité avec laquelle il a lu mon manuscrit et l’intérêt qu’il a porté à mon travail en acceptant d’en être rapporteur.
Je remercie Monsieur A.OULMEKKI, Professeur à la Faculté des Sciences et Techniques de Fès, d’avoir accepté de participer à mon jury.
J’adresse un remerciement très affectueux à mon cher époux Jalal, pour ces années de compréhension et de privation, pour son soutien moral et financier, pour son amour et pour son apport quotidien à la réalisation de ce travail en me donnant toujours l’espoir d’aller de l’avant. Ce travail lui doit beaucoup… Qu’il soit pour lui le témoignage de mon infinie reconnaissance.
A mes parents, sans lesquels je n’en serai pas là aujourd’hui, je dis un immense merci.
Je tiens à exprimer ma profonde gratitude à Madame J. El MENDILI pour ses encouragements, son appui et surtout pour le temps qu’elle me consacrait lors des discussions téléphoniques que nous avons eues à des moments critiques où je manquais de repères.
Je remercie également ma chère belle-mère et mon adorable belle-sœur qui n’ont jamais refusé de s’occuper de mon fils Ghali pour me libérer à la rédaction de ce mémoire.
Une pensée spéciale pour Aicha qui m’a apporté beaucoup d’aide et de soutien. Je lui exprime ma profonde sympathie et lui souhaite beaucoup de bien.
Enfin, une pensée émue pour tous les étudiants avec qui j’ai partagé une salle, un café, ou un repas : Sanae, Aziz, Adnane, Karima... et toute l’équipe du très convivial Laboratoire de Chimie - Physique Générale de la Faculté des Sciences de Rabat, sans oublier Beatrice et Martin, doctorants au Laboratoire de Chimie des Matériaux à l’Institut de Chimie Inorganique de Vienne, qui ont rendu mon séjour agréable à Vienne.
3
A mes parents
A mon cher époux
A mon fils Ghali
A mes frères et sœurs et leurs familles
A toute ma famille
A ma belle-famille
4
Liste des abréviations
ATD : Analyse Thermique Différentielle.
BCT-A5 : Body-Centred Tetragonal (Quadratique Centré). CALPHAD : Calculation of Phase diagrams.
CFC : Cubique à Faces Centrées. CIM : Composé InterMétallique.
DSC : Differencial Scanning Calorimetry (Analyse enthalpique differentielle)
EDXS : Energy Dispersive X-ray spectrometry (Spectrométrie X à Dispersion d’Energie). EPMA : Electron Probe Micro-Analysis.
f.e.m : Force Electromotrice
MEB : Microscopie Electronique à Balayage. MET : Microscopie Electronique en Transmission. SDE : Energy-Dispersive solid state Spectrometry. t : temps.
Rappelons que :
A) Les compositions d’alliages sont toutes indiquées en fractions molaires exceptées pour certains diagrammes d’équilibre des phases.
B) L’unité de température utilisée est le degré Celsius mais sur certains diagrammes directement tirés de la littérature certaines températures sont indiquées en Kelvin.
C) Les fonctions portant le signe «°» correspondent à des données obtenues à la pression de référence.
D) Les enthalpies partielles et intégrales sont calculées en prenant comme référence les métaux purs à l’état liquide.
5 D’une façon très générale l’action de souder, aussi ancienne que la métallurgie elle-même, consiste à réaliser, sous l’effet de la chaleur, un joint entre deux pièces métalliques en contact par apport d’un métal ou alliage. Rappelons ici qu’en langue anglaise trois termes désignent cette action soldering (soudure), brazing (brasure), welding (soudure autogène). Les matériaux utilisés pour la soudure et le brasage doivent fondre à une température inférieure à celle des pièces à joindre, le liquide pouvant alors couler dans l’interstice entre les pièces et ainsi constituer un joint en se solidifiant.
Une distinction a été introduite par l’American Welding society : les soudures sont des joints réalisés à une température inférieure à 427°C (800F) alors que les brasures sont réalisées à des températures supérieures. Ceci explique que nous n’emploierons dans ce mémoire que le terme soudure.
Il est évident que la nécessité de joindre des pièces de métal a été ressentie par toutes les communautés humaines à diverses époques, quelle que soit leur position géographique (Afrique, Amérique du Sud, Europe, Proche, Moyen et Extrême Orient,…). Il n’est pour s’en convaincre que de parcourir, même superficiellement, l’œuvre de Needham (Science and Civilization in China) ou plus simplement les actes de la conférence Internationale « The beginning of the Use of Metals and alloys » Zhengzhou, China, October 1986. Il apparaît que la toute première phase de cette technique fut d’abord le rivetage des pièces suivi par un collage à l’aide d’un métal ou alliage fondu.
En examinant d’anciennes photographies, il est aisé de se rendre compte qu’une évolution de ce type a été suivie à une époque relativement récente. En effet, de nombreuses photographies de navires à vapeur relâchant, par exemple, dans le port de Casablanca, vers 1900, nous montrent des coques en acier dont les tôles sont solidement maintenues par de gros rivets et, moins de 50 ans plus tard, les coques de bateaux similaires sont totalement lisses ne laissant apparaître que, de place en place, la trace de la soudure.
Dans notre domaine de recherche, les soudures à basse température, l’utilisation de cette technique a singulièrement évolué au cours de ces dernières années. Hormis la joaillerie, où la nature des soudures dépend essentiellement de la qualité, donc du prix de la pièce à réaliser, les secteurs qui font le plus appel aux soudures basses températures sont les industries électrique, électronique et aéronautique. Il faut remarquer que maintenant l’utilisation généralisée des matières plastiques ainsi que les progrès fulgurants réalisés dans le domaine des colles ont pratiquement éliminé l’emploi des soudures dans de nombreuses petites industries (conserves, construction des réservoirs de moyennes et petites contenances, en plomberie,…).
6 A cela il faut ajouter toutes les contraintes légales imposées pour le respect de l’environnement : la plupart des matériels (ordinateurs, téléviseurs, réfrigérateurs,…) étant détruits par combustion et fusion, les rejets dans l’atmosphère d’éléments comme le plomb, l’arsenic, le mercure,… sont, soit totalement interdits, soit sévèrement contrôlés.
Par contre, aujourd’hui, les soudures à basse température doivent être d’excellentes qualités. Elles doivent être d’une extrême fiabilité (combien de fois mon petit téléphone portable n’est-il tombé sans pour autant, heureusement, cesser de fonctionner !), d’une
durabilité exceptionnelle (tout l’appareillage électronique d’un avion de ligne en fin
d’utilisation peut être récupéré, révisé et réemployé sur un autre avion), d’une grande
endurance aux contraintes extérieures telles que les rayonnements, les variations de
température et de pression (peut-on totalement imaginer tout ce que subissent ou subiront les instruments embarqués à bord des satellites d’exploration spatiale ou des divers appareillages déposés sur la Lune, Mars, Jupiter,…).
…Et enfin les conditions économiques auxquelles il faut toujours, en fin de compte, se plier.
Cette courte exposition permet de prendre la mesure de la complexité du problème que pose le développement maîtrisé de ces matériaux de soudure. Hommes politiques et les industriels ont pris conscience, il y a quelques années, qu’il fallait pousser les scientifiques à s’intéresser à ce problème (d’où la création d’organismes, de programmes de recherche, de bourses, … facilitant les rencontres et les travaux entre chercheurs).
Ces contraintes acceptées, nous avons examiné la plupart des soudures disponibles sur le marché (la grande majorité est réalisée à partir d’alliages binaires) et nous en avons conclu qu’il nous fallait diriger notre recherche vers des alliages à plus de deux constituants.
Mais il est évident que l’accroissement du nombre de constituants entraîne inéluctablement des difficultés expérimentales (par exemple si, à l’aide de la détermination de la température de fusion de dix alliages binaires de compositions bien choisies il est possible d’avoir une bonne idée de sa ligne liquidus, il faudra plus de cent mesures pour espérer connaître approximativement la surface liquidus d’un alliage ternaire !).
Après avoir analysé toutes ces contraintes, nous avons choisi d’aborder la recherche des propriétés physicochimiques de trois alliages ternaires par une approche purement thermochimique. Notre laboratoire a participé à cet effort ce qui nous a permis de réaliser les recherches et les résultats qui en découlent sont présentés dans ce mémoire comportant les parties suivantes :
7 Introduction générale
Chapitre I : Revue bibliographique des systèmes Bi-Sn-X(X = Cu, Ni). Chapitre II : Approche expérimentale de ces systèmes.
Chapitre III : Résultats expérimentaux Conclusion générale.
Chapitre I
Revue bibliographique des systèmes Bi-Sn-X(X=Cu, Ni).
Formation et évolution des composés intermétalliques.
I-La soudure classique Sn-Pb
... 7
II-Les soudures sans plomb
... 14
II-1 La soudure Bi-Sn ... 16
II-2 La soudure Bi-Sn/Cu... 17
II-2-1 Réactions à l’interface Sn/Cu ... 17
II-2-2 Evolution de l’interface Bi-Sn/Cu ... 19
II-3 La soudure Bi-Sn/Ni ... 23
II-3-1 Réaction à l’interface Sn/Ni ... 25
8 Bien que réduit par les limites de température choisies, le domaine des soudures basse température est vaste et difficile à explorer. Si, pendant longtemps, seule la tenue mécanique des soudures basse température a été essentiellement prise en compte, au fur et à mesure de l’évolution industrielle de nos sociétés, les qualités exigées de ces matériaux ont singulièrement évoluées: leur conductibilité thermique, électrique, leur résistance à la corrosion, leur compatibilité avec des supports très variés,… sont devenues des conditions essentielles. A cela, il faut ajouter des considérations économiques et écologiques de plus en plus prégnantes.
Au cours de ce premier chapitre, nous avons réduit notre champ d’investigation aux soudures développées ou susceptibles de l’être à base de bismuth et d’étain particulièrement sur des substrats à base de cuivre et du nickel.
I-La soudure classique Sn-Pb
Le diagramme d’équilibre des phases du système Pb-Sn est relativement simple (Fig. 1) [1]: il présente un point eutectique (xSn= 0.739 à T=183°C) et deux solutions solides
extrêmales Pb et Sn de structure cristallographique cfc et BCT-A5 respectivement.
9 La ligne liquidus de ce système a été déterminée par analyse thermique différentielle par Fischer et al. [2] et par Kandelaki et al. [3], par mesure de la résistivité électrique par Hultgren et al. [4] et par diffraction des rayons X par Tokmakov et al. [5]. La température de l´eutectique Pb0,261Sn0,739, généralement admise de 183°C, a été trouvée par Stockdale [6] et
Stockburn [7] et compilée par Hansen et al. [8].
Le "puits eutectique" Pb-Sn est peu profond (Fig. 1) d’où une pente relativement faible des lignes liquidus. Ceci a permis d’utiliser un grand nombre de mélanges de plomb et d’étain comme matériau de soudure.
Lors de la solidification du mélange eutectique Liquide Pb(ss) + Sn(ss), les deux solutions solides (ss) se développent et la morphologie du solide dépend de la vitesse de refroidissement (Fig. 2) [9]
Figure 2: Clichés micrographiques de l’alliage solide eutectique Pb-Sn obtenus au cours d’un refroidissement lent (a) et d’un refroidissement rapide(b) [9].
A la température ambiante (25°C), les domaines d’existence des solutions solides extrémales sont très différents ; xSn = 0.034 dans la phase Pb et quasi-nulle dans la phase
Sn.
La microstructure des soudures Pb-Sn évolue à la température ambiante. Wassink [10] a noté une précipitation d’une solution solide d’étain dans la phase riche en plomb ainsi que de gros précipités de la phase riche en plomb dans la matrice riche en étain. Ces changements de microstructures induisent une diminution de la résistance mécanique de la soudure [11]. Pour palier ce problème et augmenter la résistance de la soudure, une microstructure fine et uniforme est recommandée, obtenue en effectuant un refroidissement rapide.
10 La microstructure finale de la soudure est déterminée aussi bien par le type de solidification effectuée que par la réaction à l’interface soudure /substrat. La mouillabilité de la soudure est améliorée si une réaction chimique à l’interface se produit (formation des composés intermétalliques). Chimiquement, le plomb dans les soudures Pb-Sn est considéré comme inerte ce qui simplifie la structure de l’interface. La seule réaction chimique à l’interface se produit donc entre Sn et le substrat.
Ma et al. [12] ont reporté, en 2002, que l’addition de Lanthane (xLa = 0.05) à la
soudure Pb-Sn élimine complètement la formation des composés intermétalliques (CIM) durant le recuit à l’état solide à la température 125°C pendant 120h.
En 2004, Sharif et al. [13] ont effectué une étude comparative très importante, aux températures 190, 200 et 210°C pendant 1, 5, 10 et 20 minutes, sur la dissolution du cuivre (substrat) dans la soudure conventionnelle Pb-Sn liquide pour deux volumes différents indiqués par P et G (P inférieur à G). La microscopie électronique leur a permis de mesurer l’épaisseur consommée de cuivre et celle des composés intermétalliques formés.
A partir de l’équation ci-dessous établie pat Kim et Tu [14], une évidente dépendance peut être déduite entre le volume des composés intermétalliques et celui de la soudure : lorsque le volume de la soudure augmente, celui des composés intermétalliques, et donc, l’épaisseur de la couche incluant des CIM diminue (en considérant une température et une surface interfaciale constantes).
où
VCIM : volume total des composés intermétalliques,
VS : volume total de la soudure liquide,
A : l’aire totale de l’interface entre la soudure et le substrat, dh : l’épaisseur consommée du substrat en cuivre,
S Cu
x : fraction massique du cuivre dans la soudure,
CIM Cu S S CIM CIM
dV
A
dh
d
-dt
dt
dt
S Cu CIM CIM Cu Cux
x
x
11
CIM Cu
x : fraction massique du cuivre dans les composés intermétalliques,
Cu, CIM, Ssont les densités du cuivre, des composés intermétalliques et de la soudure
liquide respectivement.
Ces résultats ont été confirmés par les travaux expérimentaux de Sharif et al. [13] (Fig. 3).
Figure 3 : Micrographies MEB illustrant la dissolution du substrat en cuivre et la formation des composés intermétalliques Cu-Sn lors du réchauffement à 210°C pendant 20min, (a) soudure P et (b) soudure G.
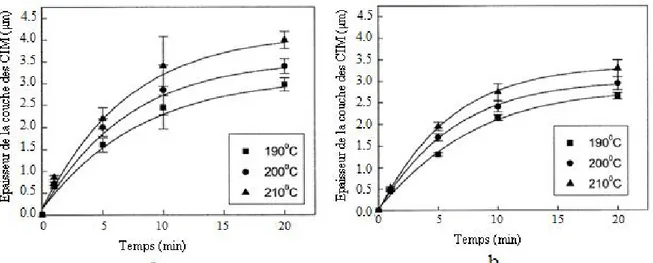
D’autre part, ces auteurs [13] ont révélé que la consommation du cuivre était moins importante pour la soudure ayant un petit volume mais l’épaisseur des composés intermétalliques formés est plus importante que celle des composés formés à l’interface de la soudure ayant un volume plus grand (Fig. 4, 5).
Figure 4 : Epaisseur consommée du cuivre en fonction du temps à trois températures différentes (a) soudure P et (b) soudure G.
12 Figure 5 : Epaisseur des composés intermétalliques en fonction du temps à trois températures différentes
(a) soudure P et (b) soudure G.
Ces résultats montrent, indépendamment du volume de la soudure, que :
- la consommation du cuivre et la formation des CIM sont rapides au début puis deviennent lentes pour être presque constantes avec le temps ;
- l’épaisseur consommée du cuivre et celle des couches CIM augmentent en fonction de la température.
Dans le cas de soudure de grand volume, comme la réaction de formation des CIM n’est pas assez rapide pour consommer tous les atomes de Cu diffusés, une partie de ces atomes diffuse à l’intérieur du volume de la soudure liquide et conduit à la formation de Cu6Sn5 (Fig. 6).
Figure 6 : Micrographie (MEB) montrant le composé intermétallique Cu6Sn5 formé dans le volume de la
soudure G après 10 min à 190°C.
En mesurant la tension superficielle par la méthode de la balance (wetting test balance), Wang et al. [15] ont étudié la mouillabilité d’une série de soudures riches en plomb,
13 PbSn(x) avec x = 0, 0.012, 0.024, 0.036, 0.05 et 0.059. Cette étude a montré que l’addition de faibles quantités d’étain au plomb pur conduit à une amélioration notable de la mouillabilité de la soudure PbSn(x) sur le substrat en cuivre (Fig. 7).
Figure 7 : Courbes demouillage (obtenue par la technique de la balance pour la mesure des tensions superficielles)de PbSn(x)/Cu à 350°C (x = 0, 0.012, 0.024, 0.036, 0.05 et 0.059) [15].
Ces auteurs ont reporté que la tension superficielle diminue légèrement avec la teneur en étain, pendant que l’angle de mouillabilité diminue considérablement. Wang et al. [15] ont confirmé que la formation des composés intermétalliques est une condition indispensable pour mouiller l’interface soudure/substrat. Les calculs (méthode CALPHAD) comme l’expérience (analyses EDX) ont confirmé qu’à l’état métastable, Cu3Sn est le premier
composé intermétallique qui se forme à l’interface soudure/substrat, ce qui est en bon accord avec certains résultats trouvés précédemment [16, 17]. Durant cette étude [15] le seul composé intermétallique observé est Cu3Sn avec des morphologies différentes pour chacune
des soudures.
Islam et al. [18] ont étudié la mouillabilité, sur un substrat en cuivre, des soudures Sn0.85Zn0.15 et Sn0.84Zn0.14Bi0.02 pour les comparer à celle obtenue avec la soudure
conventionnelle Sn0.76Pb0.24 sur un intervalle de température de 220-250°C. Islam et al. [18]
ont reporté que l’angle de contact diminue considérablement lorsque la température expérimentale augmente; Sn0.76Pb0.24 passe de 61.5° à 220°C à 41° à 250°C ; Sn0.85Zn0.15 de
14 Lors d’une étude comparative, deux types d’alliages pour soudure, les eutectiques Pb-Sn et Ag-Cu-Pb-Sn, ont été préparés et recuits sur un substrat en cuivre à la température 230°C par Kar et al. [19]. La microstructure des deux zones de réaction a mis en évidence des composés intermétalliques fragiles et cassants. La microanalyse des interfaces Pb-Sn/Cu et Ag-Cu-Sn/Cu par spectrométrie (EDS) a montré, respectivement, la présence seulement de la phase -Cu6Sn5 avec une épaisseur de 4.5-5µm et de -Cu6Sn5 et Cu3Sn avec une épaisseur
totale de 2-3µm. Ce résultat a été confirmé par microscopie (MET). La différence entre les deux épaisseurs a été expliquée par la différence entre les températures de fusion des deux alliages et la température expérimentale. La surchauffe de la soudure au-dessus de son point de fusion améliore la réactivité à l’interface soudure/substrat. Le point de fusion de l’alliage Pb-Sn est 183°C et la température expérimentale est de 230°C, donc l’alliage Pb-Sn subit une surchauffe de 47°C, alors que Ag-Cu-Sn en subit 13°C, ce qui aboutit à une zone de réaction plus large pour Pb-Sn que celle de Ag-Cu-Sn.
Avec une température eutectique de 183°C, le système binaire Pb-Sn combine les conditions de soudage qui sont compatibles avec la majorité des matériaux substrats et appareils.
Étant l’un des principaux composants de la soudure eutectique, Pb présente plusieurs avantages :
1. Pb réduit la tension de surface de l’étain pur, qui est de 550mN/m à 232°C : cette diminution de la tension de surface de la soudure Sn0.76Pb0.24 facilite la
mouillabilité [20].
2. Pb ralentit la transformation de l’étain blanc (étain- en étain gris (étain- qui se produit, pendant le refroidissement, à 13°C. Rappelons que cette transformation entraîne une augmentation de volume de 26% et cause une perte de l’intégrité structurale de l’étain [21].
3. Pb sert comme métal solvant, permettant aux autres constituants tels que Sn et Cu de former rapidement des liaisons intermétalliques par diffusion à l’état liquide. 4. La couche d’oxyde du plomb, insoluble dans l’eau, est également présente à la surface de la phase riche en plomb de la soudure. Cette couche d’oxyde protège donc la soudure de la corrosion [22].
Ces facteurs, combinés au fait que Pb soit largement disponible avec un bas prix, font de lui un métal idéal à combiner avec l’étain.
15 Toutefois, et malgré tous ses avantages, les problèmes environnementaux et technologiques ainsi que les nouvelles contraintes légales ont incité les chercheurs à orienter leurs recherches vers d’autres soudures que Pb-Sn sans plomb. Rappelons que :
1. La législation impose la restriction ou l’élimination de l’utilisation de Pb à cause de sa toxicité. Le plomb est considéré par l’Agence de Protection de l’Environnement (EPA) comme l’un des éléments chimiques présentant une réelle menace pour la vie humaine et l’environnement [23]. L’intoxication par le plomb (ou saturnisme) est un grave danger pour la santé avec de sérieuses conséquences socio-économiques. Le plomb est un puissant agent neurotoxique, en particulier pour les enfants dont le corps, en pleine croissance, y est fort sensible. L’exposition, à des niveaux excessivement élevés, de plomb dans l’air, l’eau, le sol et les aliments est nuisible à la santé et au développement intellectuel de la population dans toutes les régions du monde.
2. D’autres alternatives doivent être mises au point pour élaborer de nouveaux matériaux adaptés aux nouvelles technologies qui concernent la miniaturisation des appareils électroniques (téléphones portables, ordinateurs,…). Par exemple, le rayon de courbure naturel R de la soudure liquide (2.2mm) [24] est plus large par rapport aux nouveaux appareils nécessitant un rayon de 0.5mm [25].
II-Les soudures sans plomb
Lors de l’élaboration d’une alternative à la soudure classique Pb-Sn, largement utilisée, il est important de s’assurer que les propriétés de l’alliage remplaçant sont comparables ou supérieures à celles de Pb-Sn. De strictes performances sont requises dans les alliages pour soudure utilisés en microélectronique.
En général, un alliage pour soudure doit combiner de nombreuses performances mécaniques et électroniques : avoir la température de fusion désirée, mouiller adéquatement les circuits imprimés communs, former des joints de soudure fiables... L’alliage sans plomb doit surtout être écologique. D’autres propriétés doivent être assurées dont la conductivité électrique et thermique, la résistance à la fatigue, la résistance à l’oxydation et à la corrosion… De plus, l’alliage pour soudure doit être capable de former des composés
16 intermétalliques avec le substrat et enfin, les métaux constituant l’alliage doivent être disponibles et peu coûteux.
De nombreuses études ont été menées pour développer de nouveaux alliages susceptibles de remplacer la soudure classique Pb-Sn. Sn-Au, Sn-In, Sn-Ag, Sn-Bi, Sn-Cu sont quelques exemples d’alliages binaires eutectiques qui ont été utilisés dans l’industrie électronique pour des applications spéciales. A partir de ces binaires, des alliages ternaires et quaternaires ont été développés. Tous ces alliages sont riches en étain.
Rappel de quelques propriétés de l’étain
La capacité de l’étain à mouiller et à s’étaler sur une large gamme de substrat a fait de ce métal le composant principal des alliages pour soudures utilisés pour les applications électroniques. L’étain fond à 232°C et existe sous deux formes avec deux structures cristallographiques différentes à l’état solide.
L’étain blanc (étain- , stable à la température ambiante avec la structure cristallographique quadratique centrée, et l’étain gris (étain- , qui a la structure cristallographique cubique à faces centrées avec occupation d’un site tétraédrique sur deux par les atomes d’étain, thermodynamiquement stable au-dessous de 13°C.
La transformation étain- étain qui porte le nom de «maladie de l’étain » ou « lèpre de l’étain » a lieu à des températures inférieures à 13°C, et conduit à une augmentation importante du volume ce qui entraine des fractures dans la structure de l’étain. Par conséquent, cette transformation constitue un problème pour les applications s’effectuant à des températures extrêmement basses. Lorsque l’étain- est exposé à des cycles thermiques répétés, une déformation plastique et d'éventuelles fissures peuvent se produire. Cet effet est observé pendant les faibles cycles thermiques allant de 30 à 75°C [26]. Ainsi, une fatigue thermique pourrait être provoquée dans l’étain ou dans les phases riches en étain des alliages pour soudure, sans toutefois qu’une pression mécanique externe soit imposée. Ceci laisse comprendre que l’utilisation de l’étain seul comme soudure est très limitée. L’addition, à l’étain, d’autres éléments a été reportée comme étant efficace pour réduire, voire éliminer cette transformation de phase, et par conséquent éviter le problème associé à la maladie de l’étain. En s’accordant aux travaux de Lewis [27], l’addition de quantités supérieures à 0.5 % at. Sb, 0.1 % at. Bi ou plus de 3 % at. Pb est efficace pour l’élimination de ce phénomène. Le mécanisme permettant cette élimination demeure cependant inconnu.
17 Plusieurs alliages (binaires, ternaires et quaternaires) ont été développés dans l’objectif de remplacer la soudure classique Pb-Sn. Dans cette partie, et dans l’impossibilité de citer tous ces alliages, nous nous intéresserons à l’étude bibliographique des deux systèmes ternaires Bi-Sn-X (X = Cu, Ni) étudiés au cours de ce travail. Pour cela, nous avons jugé utile, dans un premier temps, de rassembler les informations bibliographiques les plus récentes sur le système de base Bi-Sn, puis celles concernant l’effet de l’addition d’un troisième métal, cuivre ou nickel comme substrat, sur ce système de base.
II-1 La soudure Bi-Sn
Le système Bi-Sn a une composition eutectique de Bi0.43Sn0.57 et une température
eutectique relativement basse de 139°C (Fig. 8). A la température ambiante, les largeurs des solutions solides sont très différentes : une solubilité quasi nulle de l’étain dans le bismuth
xSn= 0.023 [28], alors que la solubilité maximale de Bi dans l’étain est xBi = 0.13, environ
[29].
Figure 8 : Diagramme d’équilibre des phases du système binaire Bi-Sn [1].
L´alliage eutectique Bi0.43Sn0.57 a une température de fusion de 139°C, très inférieure à
celle de la soudure eutectique Pb-Sn (183°C). Ses propriétés physiques et mécaniques sont proches de celles de l’eutectique Pb-Sn. Il a été utilisé pendant longtemps dans certaines applications électroniques à basse température [30,31]. Cependant, à faible température de soudage, il existe un impact défavorable sur l’activation du flux affectant ainsi les
18 caractéristiques de la mouillabilité de la soudure. Aussi, un processus spécial de soudage doit être développé pour cet alliage Bi0.43Sn0.57. Les soudures Bi-Sn sont incompatibles avec des
substrats et flux généralement utilisés dans le cas des soudures Pb-Sn.
D’autres études [32,33] ont montré que la soudure eutectique Bi-Sn ne peut être compatible avec des surfaces contenant du plomb puisqu´une dissolution d´une petite quantité du plomb dans Bi-Sn conduirait au système ternaire Bi-Pb-Sn dont la température de fusion ne dépasse pas 100°C et affectant de façon significative la fiabilité de la soudure.
Des études microstructurales du système binaire Bi-Sn ont été réalisées lors du refroidissement de la soudure [34,35]. Ces travaux ont reporté une microstructure lamellaire avec dégénérescence du matériau lors d’un refroidissement lent. Cette microstructure n’a pas été observée au cours d’un refroidissement rapide.
II-2 La soudure Bi-Sn/Cu
Dans la plupart des cas, lors de l’utilisation d’une soudure riche en étain sur un substrat en cuivre, les composés intermétalliques qui se forment à l’interface soudure/substrat sont à base de cuivre et d’étain. Une bonne connaissance des réactions à l’interface Sn/Cu nous semble alors essentielle.
II-2-1 Réactions à l’interface Sn/Cu
Le cuivre est le métal conducteur le plus couramment utilisé en contact avec les soudures grâce à ces excellentes caractéristiques de soudabilité. Le système Cu-Sn est caractérisé par une série de réactions péritectiques dans la région riche en cuivre et plusieurs phases intermédiaires existent dans ce système [36] (Fig. 9). Pour une température expérimentale inférieure à 350°C, la réaction interfaciale avec une soudure fondue à base d’étain aboutit à la formation des couches Cu3Sn ( ) et Cu6Sn5 ( ) [37, 38].
19 Figure 9 : Diagramme d’équilibre des phases du système binaire Cu-Sn [36].
En général, aux températures typiques du processus de soudage, au-dessous de 260°C, Cu6Sn5 ( ) est la première phase qui se forme à l’interface Sn/Cu. La première étape de la
réaction est la dissolution du cuivre dans la soudure liquide, jusqu’à ce que la soudure devienne saturée en cuivre à l’interface Sn/Cu [39, 40]. Initialement, la dissolution est un processus non-équilibré et, localement, une très haute concentration de cuivre peut être réalisée au voisinage proche de l’interface Cu/liquide. Cependant, la composition du liquide à l’interface tend à passer immédiatement à l’état métastable, parce que les atomes en excès de cuivre vont se déposer à la surface du cuivre (substrat). Néanmoins, comme il y a une grande force motrice pour la réaction chimique entre les atomes de Cu et Sn à la composition métastable, les cristaux de Cu6Sn5 peuvent se former très rapidement par nucléation
hétérogène et croissent à l’interface Cu/liquide [41]. Cette formation rapide de Cu6Sn5 a été
observée expérimentalement [42]. L’épaisseur finale et la morphologie des couches de réaction sont déterminées essentiellement par la vitesse de dissolution de Cu dans le liquide. Thermodynamiquement, il doit y avoir aussi la formation d’une couche de Cu3Sn entre le
cuivre et Cu6Sn5. Cette couche a été observée expérimentalement, même pour un court temps
20 celle de Cu6Sn5 et sa formation nécessite souvent un temps de contact plus important que
celui nécessaire pour la formation de Cu6Sn5.
L’addition d’éléments à l’étain pur peut affecter l’interface soudure/substrat. Trois effets majeurs sont possibles :
- augmenter ou abaisser la vitesse de la réaction et la vitesse de croissance, - changer les propriétés physiques des phases formées (Cu6Sn5 et Cu3Sn),
- former d’autres couches à l’interface ou déplacer les phases binaires qui doivent normalement apparaître et former ainsi d’autres produits.
Durant le processus de soudage, l’alliage pour soudure réagit avec le substrat pour former des composés intermétalliques désirables pour réaliser un bon lien métallurgique. Ces composés jouent un rôle crucial dans la fiabilité des joints de soudure dans l’industrie microélectronique puisqu’ils assurent la continuité électronique, thermique et mécanique des assemblages électroniques [24, 44]. La formation des couches de composés intermétalliques fines, continues et uniformes entre la soudure et le substrat, est donc une condition essentielle pour la réalisation d’un bon lien métallurgique. Cependant, à cause de leur nature fragile et leur tendance à générer des défauts structuraux, les couches de composés intermétalliques très épaisses, formées à l’interface soudure/substrat, peuvent dégrader l’intégrité de l’interface conduisant à une faible fiabilité des appareils électroniques [44].
Donc la microstructure et la taille des composés intermétalliques qui se forment à l’interface soudure/substrat peuvent être à l’origine de la fragilité mécanique de la soudure. En augmentant le temps de vieillissement, des fractures apparaissent dans différents endroits de la soudure [45, 46].
II-2-2 Evolution de l’interface Bi-Sn/Cu
En 2001, Miao et Duh [47] ont étudié l’effet du vieillissement thermique sur l’évolution de la microstructure et la taille des composés intermétalliques pour l’eutectique Sn-Bi sur différents types de substrats. Ces auteurs ont montré, que d’une part, un seul composé intermétallique, Cu6Sn5, a été observé à l’interface Sn-Bi/Cu à 100°C pendant 49
jours, et d’autre part, une dégradation significative de la phase riche en Bi a été détectée. Les auteurs ont montré que cette dégradation microstructurale est réduite par l’addition de Cu (1% de la masse totale) à l’alliage binaire Sn-Bi.
21 Yoon et Jung [48] ont étudié l’évolution de la taille des composés intermétalliques formés entre le cuivre comme substrat et la soudure Sn0.97Bi0.03, en fonction de la température
et du temps. Les intervalles de température et de temps sont 70-200°C et 0-30 jours, respectivement. Cette étude a montré que pour une durée de 15 jours, le composé Cu3Sn était
présent pour toutes les températures étudiées sauf 70°C (Fig. 10 a). Des résultats similaires ont été reportés antérieurement par Tu et Thompson [49].
Figure 10 : micrographies ( MEB) de l’interface Sn0.97-Bi0.03/Cu après un temps de réaction de 15 jours à ;
(a) 70°C, (b) 100°C, (c) 120°C, (d) 150°C, (e) 170°C et (f) 200°C [48].
En fixant la température à 200°C et en variant le temps (0-30 jours), Yoon et Jung [48] ont reporté que le composé Cu6Sn5 se forme dès le début du processus de soudage (Fig. 11a).
Cependant, le composé Cu3Sn ne se forme à l’interface soudure/substrat qu’à partir du 6ème
22 Figure 11 : micrographies (MEB) de l’interface Sn0.97-Bi0.03/Cu à 200°C après différents temps de réaction
t ; (a) t = 0, (b) t = 1 jour, (c) t = 3 jours, (d) t = 6 jours, (e) t = 15 jours et (f) t = 30 jours [48].
En 2006, Li et al. [50] ont étudié, par EDS, l’interface Sn0.56Bi0.44 /Cu. L’étude a été
réalisée à 200, 220 et 240°C pour un temps variant de 1 à 48 heures. Aux différentes températures étudiées, deux couches de composés intermétalliques ont été formées. En plus de Cu6Sn5, formé en premier du côté de la soudure, le composé Cu3Sn a également été
observé du côté du substrat. L’épaisseur moyenne de chacun des composés augmente en fonction du temps et de la température.
Li et al. [50] ont également étudié l’effet de l’addition en faibles quantités (1-2 mass.%) de Al, Cr, Cu, Si, Zn, Ag, Au, Pt et Nb à la soudure de base (Sn0.56Bi0.44) sur la
croissance des composés intermétalliques et donc, sur la consommation du cuivre formant le substrat. L’addition des éléments Al, Cr, Si, Nb, Pt, Au et Cu, aux températures 200 et 240°C pendant 48, 96 et 120h, n’a pas eu d’effet considérable sur la croissance des composés
23 intermétalliques. Dans les mêmes conditions expérimentales, Ag a conduit à une faible réduction de la consommation du cuivre. Par contre l’addition de 1.8 at.% de Zn à la soudure Sn-Bi a conduit à la formation du composé –Cu5Zn8 à l’interface soudure/substrat au lieu des
composés Cu6Sn5 et Cu3Sn. Cette couche de –Cu5Zn8 retarde évidemment la diffusion à la
fois des atomes de Cu et Sn et conduit à un temps de vie du substrat au-delà de 120h à 200°C (Fig. 12). Toutefois, l’effet du zinc a été trouvé limité, car il commence à migrer graduellement à la surface de la soudure liquide pour former ZnO, et le composé –Cu5Zn8
laisse place à Cu6Sn5.
Figure 12 : microstructure de l’interface Sn0.559Bi0.438Zn0.003/Cu : (a) t0 ; (b) 200°C, 12h ; (c) 220°C, 12h ;
(d) 240°C, 12h ; (e) 200°C, 120h ; (f) 240°C, 48h.
Récemment, Kang et al. [51] ont étudié le comportement des CIM formés à l’interface Bi-Sn/Cu en fonction du temps. Ces auteurs ont reporté que :
24 Deux CIM (Cu6Sn5, Cu3Sn) ont été observés à l’aide du MET et que leurs épaisseurs
évoluent linéairement avec le temps.
La ségrégation de Bi à l’interface Cu3Sn/Cu, peu importante au début de la formation
des CIM pour causer des fractures, augmente avec le temps de vieillissement pour conduire à une interface cassante.
Très récemment en 2011, Zou et al. [52] ont réalisé une étude microstructurale de l’interface Bi-Sn (eutectique)/Cu. Ces auteurs ont noté qu’en plus des deux CIM, Cu6Sn5 et
Cu3Sn, observés à l’interface soudure/Cu, des particules de Bi ont été observées par MET
entre le cuivre (substrat) et Cu3Sn en accord avec les travaux de Kang et al [51]. La
ségrégation de Bi pourrait conduire, selon ces auteurs, à des fractures du joint de soudure. Pour éliminer ce phénomène de ségrégation, les auteurs [52] ont suggéré l’addition, au substrat de cuivre, de faibles quantités de certains métaux tels que Ag, Al, Sn ou Zn.
Sasaki et al. [53] se sont basés sur le principe de la vitesse maximale de dégradation de l’énergie libre totale d’un système pour déterminer théoriquement l’ordre de formation des composés intermétalliques entre l’étain pur et le cuivre comme substrat. La première phase formée selon ce modèle, pour Sn/Cu est Cu6Sn5 [53]. Ce résultat est en bon accord avec ceux
trouvés expérimentalement [47-50].
II-3 La soudure Bi-Sn/Ni
Le cuivre a été largement utilisé comme substrat dans les applications microélectroniques. Cependant, durant le processus de soudage, le cuivre se dissout très rapidement dans les soudures liquides riches en étain et les couches intermétalliques SnxCuy
formées croissent avec une très grande vitesse pour devenir épaisses durant le vieillissement thermique. La croissance excessive de ces couches pourrait avoir un effet indésirable sur la fiabilité des joints de soudure lorsque les appareils électroniques sont utilisés à haute température [54, 55, 56].
Aussi le nickel et les alliages à base de nickel sont souvent considérés comme une excellente alternative aux substrats à base de cuivre. La vitesse de dissolution du nickel dans les soudures à base d’étain est très lente à la température de soudage, et par conséquent des couches intermétalliques très fines sont généralement observées entre le nickel et les soudures à base d’étain [57, 58] .
25 L’observation des diagrammes de phases des systèmes binaires Ni-Sn (Fig. 13a) et Bi-Ni (Fig. 13b), nous montre trois composés (Bi-Ni3Sn, Ni3Sn2 et Ni3Sn4) pour le système Ni-Sn et
deux composés intermétalliques pour le système Bi-Ni (NiBi et NiBi3). Cependant, les
réactions entre l’alliage Bi-Sn avec Ni sont très compliquées : lorsque Bi-Sn réagit avec Ni, il y a compétition entre la formation des composés intermétalliques de Ni-Bi et Ni-Sn.
Figure 13 : (a) Diagramme d’équilibre des phases du système Ni–Sn [33], (b) Diagramme d’équilibre des phases du système Ni–Bi [36].
La réaction entre le nickel et le bismuth produit une couche épaisse de NiBi3. La
croissance de ce composé est très rapide et atteint 230 µm en 70h à 250°C [59, 60] ce qui est défavorable pour les joints de soudure. En plus, NiBi3 a de faibles propriétés mécaniques [61,
62], il est mou et fragile, et sa formation est donc indésirable pour les joints de soudure.
Comme pour le cas d’un substrat en cuivre, la réaction est déterminée par la dissolution du nickel dans l’étain liquide. Cette réaction chimique aboutit à la formation de Ni3Sn4. La dissolution du nickel est essentiellement arrêtée après la formation de Ni3Sn4.
Ensuite, nous assistons à la diffusion de l’étain à travers la couche du composé intermétallique Ni3Sn4, pour conduire à la formation des deux autres composés, Ni3Sn2 et
Ni3Sn, dont la cinétique est considérablement plus lente. Ni3Sn semble avoir des difficultés à
se former à l’interface Sn/Ni [44]. 63, 64 65, 66, 67, 68, 69 70
Plusieurs études [54, 63-70] ont reporté que seul Ni3Sn4 est présent dans la réaction
entre les soudures à base d’étain et le substrat en nickel. L’absence des deux autres CIM est probablement due à leur difficulté de nucléation.
26 II-3-1 Réaction à l’interface Sn/Ni
Kang et Ramachandran [71] ont étudié les réactions interfaciales dans le système liquide Sn/Ni à des températures élevées et ont reporté la formation du composé Ni3Sn4 et une
éventuelle présence du composé Ni3Sn2. Plus tard, Huang et Chen [72] ont confirmé la
présence de la seule phase Ni3Sn4 aux deux températures expérimentales 240 et 300°C.
Des études sur la solidification isotherme du système Ni-Sn ont été effectuées par Bader et al. [73] pour les températures 240-400°C. Ces chercheurs ont trouvé que Ni3Sn4 se
forme rapidement dés le début de la réaction interfaciale. Après recuit à 240°C et dés 7 secondes seulement, une grande quantité de Ni3Sn4 s’est formée pour atteindre son maximum
après deux minutes. Après 60 minutes, la totalité de la couche d’étain (8.6µm) a été transformée en Ni3Sn4 [73]. La même étude a été réalisée par Gur et Bamberger [74] à des
températures entre 235 et 500°C. Par microscopie, ces auteurs ont observé que, pendant la solidification, Ni3Sn4 était la seule phase intermétallique formée. Cependant, des études
détaillées (MET)ont révélé qu’une couche de Ni3Sn existait aussi à l’interface.
Oh [75], étudiant la réaction interfaciale entre l’étain solide et le nickel à 200°C, indique que seul Ni3Sn4 se forme après un long recuit de 918h.
II-3-2 Evolution à l’interface Bi-Sn/Ni
En 2001, Chen et al. [76] ont étudié la réaction entre le nickel et l’alliage eutectique Bi-Sn aux températures 180, 240, 300, 360 et 420°C pour des durées allant de 0.5 à 48h. Seul le composé Ni3Sn4 a été détecté. Ces résultats sont en bon accord avec ceux trouvés par
d’autres auteurs [63, 77] pour des conditions expérimentales différentes, 170°C pendant plus que 20 minutes [63] et 85, 100, 120 et 135°C pour un intervalle de temps allant de 25 à 3600h [77]. Pour les basses températures (180, 240 et 300°C), Chen et al. [76] ont trouvé que Ni3Sn4
formé à l’interface comme une couche fine et continue joue un rôle protecteur en tant que barrière de diffusion. Les travaux de Chen et al. [77] ont révélé que lorsque le temps de réaction augmente, la région adjacente à la couche Ni3Sn4 était préférentiellement remplacée
par une phase riche en bismuth. Cela pourrait être expliqué par le fait que, dans cette région, seul l’étain réagit avec le nickel pour former Ni3Sn4, en laissant une phase riche en bismuth
27 Lee et al. [66] ont effectué des études expérimentales sur différents alliages liquides Bi-Sn riches en Bi en contact avec un substrat en nickel à la température 300°C. Ces auteurs ont trouvé que pour des teneurs allant de 89.5 at.% à 95.7 at.% en bismuth seule la phase Ni3Sn4 est détectée (Fig. 14a). Cependant, lorsque la teneur de la soudure en bismuth dépasse
96.5 at.%, le composé intermétallique NiBi3 se forme à l’interface soudure/substrat (Fig.
14b).
Figure 14 : micrographie optique de l’interface (a) Sn-97.5mass.%Bi (Sn-95.7at.%Bi)/Ni à 300°C pendant 20 minutes (b) Sn-98mass.%Bi (Sn-96.5at.%Bi)/Ni à 300°C pendant 20 minutes.
Par microscopie (MET), Hwang et al. [78] ont observé en 2003, une couche très fine (environ 50nm), de Ni3Sn2, à l’interface entre Ni3Sn4 et le nickel après le processus de
soudage. Comparé à l’épaisseur de Ni3Sn4, celle de Ni3Sn2 est négligeable. La couche Ni3Sn4
est donc supposée être l’unique CIM formé à l’interface soudure (à base d’étain)/Ni à 250°C selon Hwang et al. [78].
Les réactions interfaciales entre les alliages Sn0.09Bi0.91, Sn0.43Bi0.57 et Sn0.64Bi0.36 et un
substrat en nickel à 150°C ont été étudiées expérimentalement par Wang et al.[79]. Les mesures (EPMA) ont révélé que Ni3Sn4 était le seul composé intermétallique formé à
l’interface soudure/substrat. Ces auteurs ont également reporté que l’épaisseur de la couche Ni3Sn4 diminue lorsque la teneur de la soudure en bismuth augmente, car la quantité d’étain
nécessaire pour la formation de Ni3Sn4 est inversement proportionnelle à celle du bismuth
[79].
Lin et al. [80] ont étudié l’effet de l’addition des éléments Ag, Pb et Bi à l’étain pur sur la croissance des CIM à 250-280°C pendant différentes durées. L’observation de
28 l’interface soudure/substrat par le MET a révélé que seul Ni3Sn4 a été formé pour les
différents temps et températures étudiés (Fig. 15).
Figure 15 : Micrographies des composés intermétalliques Ni3Sn4 formés entre différentes soudures et Ni
(substrat) après 10h de soudage à 250°C. (a) 100Sn/Ni, (b) Sn-3.5Ag 3.7at.%Ag)/Ni, (c) Sn-37Pb (Sn-25at.%Pb)/Ni et (d) Sn-58Bi (Sn-44at.%Bi)/Ni.
Choi et Lee [81] ont développé un modèle en se basant sur l’énergie d’activation de nucléation pour prédire la première phase qui se forme à l’interface Ni/Sn liquide. Ces auteurs ont trouvé, pour les deux alliages binaires Pb-Sn et Ag-Sn, que Ni3Sn4 était la première phase
qui se formait selon leur modèle, ce qui est en bon accord avec plusieurs résultats expérimentaux [54, 63-70, 73, 76-79]. La phase suivante était Ni3Sn, puis Ni3Sn2 [81].
En 2007, Sasaki et al. [53] se sont basés sur le principe de la vitesse maximale de dégradation de l’énergie libre totale d’un système, pour déterminer théoriquement l’ordre de formation des composés intermétalliques entre l’étain pur et le nickel comme substrat. La première phase formée selon ce modèle pour le couple Sn/Ni est Ni3Sn4 suivie de Ni3Sn2 puis
de Ni3Sn [53].
(a) (b)
29 La formation exclusive de Ni3Sn4 pourrait être expliquée par la grande vitesse de
diffusion de Ni. L’épaisseur de la couche de Ni3Sn4 augmente avec le temps de vieillissement
et sa vitesse de croissance diminue en fonction de la teneur de la soudure en bismuth.
Dans le cadre de développement de nouveaux matériaux pour soudures sans plomb, Ohriner [82] a effectué des études intenses sur les réactions entre les substrats à base de cuivre et de nickel et des alliages pour soudure riches en étain pour un intervalle de températures allant de 150 à 250°C. Les substrats ont été mis en contact avec la soudure liquide pendant 5s (30°C au-dessus de la température de fusion de la soudure) et recuit par la suite à l’état solide à différentes températures 150-250°C. Il a observé que la vitesse de formation des composés intermétalliques, formés entre les substrats contenant du cuivre et du nickel et les soudures Sn0.945Ag0.055, Sn0.902Sb0.098 et Sn0.739Pb0.261, dépend de la concentration en nickel et exhibe un
maximum pour l’intervalle 6.5-9.7 at.% en Ni. Ohriner, en utilisant le microscope électronique à balayage, a observé que le seul composé intermétallique formé entre les substrats à base de nickel et de cuivre et les soudures étudiées était (Cu,Ni)6Sn5. Ainsi,
l’addition du nickel au cuivre élimine, presque complétement, la croissance du composé Cu3Sn.
Plus tard, en 2004, Paul [83] a étudié les réactions à l’état solide (T=225°C) entre l’étain pur et l’alliage Cu-Ni (5-15 at.% en Ni) comme substrat. Ce chercheur a détecté une augmentation significative de la vitesse de croissance du composé (Cu,Ni)6Sn5 dans cet
intervalle de concentrations, ainsi que l’absence du composé Cu3Sn.
Conclusion
Même pour un nombre limité d'alliages, la recherche bibliographique exposée au cours de ce premier chapitre montre toute la complexité des soudures aussi bien dans leurs structures, dans leurs domaines d'application que dans leurs mécanismes de formation. Il apparaît qu'une approche fondamentale reste indispensable pour tenter d'améliorer notre connaissance de leur formation. C'est la voie que nous avons choisie et que nous suivrons au cours de notre travail.
30
Références bibliographiques
[1] T.B. Masssalski, Binary Alloys Phase Diagrams, ASM International, Materials Park, Ohio) 1 (1990).
[2] H.J. Fischer, A. Phillipps, Trans. Aime. 200 (1954) 1060.
[3] B.S. Kandelaki, A.E. Avaliani, Trans. Gruz. Politekh. 4 (1968) 37. [4] R. Hultgren, S. A. Lever, Trans. Aime. 185 (1949) 67.
[5] V.S. Tokmakov, Y.V. Moish, Y.S. Astashkim, L.Y.V. Silanov, V.V. Zhiryakov, Zavod. Lab. 45 1 (1979) 26.
[6] D. Stockdale, J. Inst. Met. 43 (1932) 193. [7] A. Stockburn, J. Inst. Met. 66 (1940) 33.
[8] M. Hansen, K. Anderko, “ Constitution of Binary Alloys” Mc Graw Hill, New York (1958).
[9] Z. Mei, J.W. Morris Jr., ASME Journal of Electronic Packaging, 114 (1992) 104.
[10] K.J.R. Wassink, Soldering in Electronics. 2nd Ed. (Ayr. Scotland: Eletrochem. Pub.Ltd. 1989) 141.
[11] B. Lampe, Welding J. (1976) 330.
[12] X. Ma, Y. Qian, F. Yoshida, J. Alloys Comp. 334 (2002) 224.
[13] A. Sharif, Y.C. Chan, R.A. Islam, Mater. Sci. Eng. B 106 (2004), 120. [14] H.K. Kim, K.N. Tu, Appl. Phys. Lett. 67 14 (1995) 2002.
[15] H. Wang, X. Ma, F. Gao, Y. Qian, Mater. Chem. Phys 99 (2006) 202. [16] B.-J. Lee, N.-M. Hwang, H.-M. Lee, Acta Mater. 45 (1997) 1867. [17] H.-M. Lee, S.-W. Yoon. B.-L. Lee, J. Electron. Mater. 27 11 (1998).
[18] R.A. Islam, Y.C. Chan, W. Jillek, S. Islam, Microelectron. J. 37 (2006) 705.
[19] A. Kar, M. Ghosh, R.N. Ghosh, B.S. Majumdar, A.K. Ray, Mater. Lett. 62 (2008) 151. [20] T.P. Vianco, Development of alternatives to lead-bearing solders, in: Proceeding of the Technical Program on Surface Mount International, 19 August-2 September 1993, San Jose, CA.
[21] R. E. Reed-Hill, Physical Metallurgy Principles, PWS Publishing Company, Massachusetts, 1994, pp 306.
[22] H. Manko, Solders and Soldering (Reading. PA: McGraw-Hill. 1979) 14. [23] E.P. Wood, K. L. Nimmo, J. Electron. Mater. 23 8 (1994) 709.
31 [24] K.J.R. Wassink, M.M.F. Verguld, Manufacturing Techniques for Surface Mounted Assemblies, Electrochemical publications Ltd., (1995) 17.
[25] M. Abtew, G. Selvaduray, Mater. Sci. Eng. 27 (2000) 95.
[26] C. Lea, A Scientific Guide to Surface Mount Technology, Electrochemical Publications Ltd., (1988), 378.
[27] W.R. Lewis, Tin Research Institute, (1961) 66.
[28] J.W. Morris, J.L.F. Goldstein, Z. Mei, J. Electron. Mater. (1993) 25. [29] H. Kabassis, J.W. Rutter, W.C. Mater. Sci. Technol. 2 (1986) 985. [30] R.N. Wild, Proc. Inter. NEPCON Conf. Briton. (1971) 81.
[31] J.R. Getten, R. Senger, IBM. J. Res. Devel. 26 (1982) 379. [32] Z. Mei, H. Holder, J.Electro. Pack. 118 (1996) 62.
[33] Z.Mei, H. Vander Plas, J. Gleason, J. Baker, 124th TMS annual meeting, Las Vegas, Feb. (1995) 12.
[34] M.N. Croker, R.S. Fidler, R.W. Smith, The characterization of eutectic structure, Proc. R. Soc., London, Ser. A. 335 (1973) 15.
[35] R.W. Walid, Properties of Some Low Melting Fusible Alloys, Technical Report, IBM Federal Systems Division Laboratory, New York, 1971.
[36] T.B. Massalski, Okamoto H, Subramanian PR, Kacprzak L. ‘Binary Alloy Phase Diagrams’, ASM International 1996.
[37] C.T. Heycock, F.H. Neville, Phil. Trans. R. Soc. London Ser. A 202 (1904) 1.
[38] G.V. Raynor, Annoted Equilibrium Diagram Series, No. 2, The Institute of Metals, London, 1994.
[39] W. Bader, Welding J. 48 12 (1969) 551.
[40] W. Bader, in : Proceedings of Conference on Physical Matallurgy, Metal Joining, St. Louis, MO, October 16-17, TMS/AIME, Warredale, USA, 1980.
[41] J.K. Kivilahti, K. Kuloj rvi, in: R.K. Mahidhara (Ed). Proceedings of the TMS Annual Meeting on Design and Reliability of Solders and Solder Interconnections, Orlando, FL. USA, Febrery 9-13, (1997) 377.
[42] R. Gagliano, G. Ghosh, M. Fine, J. Electr. Mater. 31 11 (2002) 1195.
[43] T. Chiu, K. Zeng, R. Stierman, D. Edwards, K. Ano, in: Proceedings of the Electronics Components and Technology Conference, 2004.
[44] T. Laurila, V. Vuorinen, J.K. Kivilahti. Mater. Sci. Eng. R 49 (2005), 1. [45] F. Bartels, J.W. Morris, J. Electron. Mater. 23 (1994) 787.
32 [46] D. Yao, J.K. Shang, IEEE Trans. Compon. Hybrids Manuf. Technol. B 19 (1996) 157. [47] H.-W. Miao, J.-G. Duh, Mater. Chem. Phys. 71 (2001) 255.
[48] J.-W. Yoon, S.-B. Jung, J. Alloys Comp. 359 (2003) 202. [49] K.N. Tu, R.D. Thompson, Acta Metall. 30 (1982) 947.
[50] J.F.Li, S.H. Mannan, M.P. Clode, D.C. Whalley, D.A. Hutt, Acta Materialia 54 (2006) 2907.
[51] T.Y. Kang, Y.Y. Xiu, C.Z. Liu, L. Hui , J.J. Wang, W.P. Tong, J. Alloys Compd. 509 (2011à 1785-1789.
[52] H.F.Zou, Q.K. Zhang, Z.F. Zhang, Mater. Sci. Eng. (2011) sous presse. [53] T. Sasaki, M.Tanaka, Y. Ohno, Mater. Lett. 61 (2007) 2093.
[54] K.N. Tu, K.Zeng, Mater. Sci. Eng. R 34 (2001) 1 .
[55] K.N. Tu, T.Y. Lee, J.W. Jang, L. Li, D.R. Frear, K. Zeng, J. Appl. Phys. 89 (2001) 4843. [56] J.O. Suh, K.N. Tu, N. Tamura, J. Appl. Phys. (2007) 102: 063511.
[57] G. Ghosh, J. Appl. Phys. 88 (2000) 6887.
[58] J.W. Jang, D.R. Frear, T.Y. Lee, K.N. Tu, J. Appl. Phys. 88 (2000) 6359. [59] O.V.Duchenko, V.I. Dybkov, J. Mater. Sci. Let. 14 (1995) 1725.
[60] V.I. Dybkov, O.V.Duchenko, J. Alloys Comp.234 (1996) 295. [61] M.S. Lee, C.M. Liu, C.R. Kao, J. Electron. Mater. 28 (1999) 57. [62] M.S. Lee, C. Chen, C.R. Kao, Chem. Mater. 11 (1999) 292.
[63] S.K. Kang, R.S. Rai, S. Purushothaman, J. Electron. Mater. 25 (1996) 1113. [64] S.W. Chen, C.M. Chen, W.C. Liu, J. Electron. Mater. 27 (1998) 1193. [65] C.M. Chen, S.W. Chen, Acta Mater. 50 (2002) 2461.
[66] J.-I Lee, S.-W. Chen, H.-Y. Chang, C.-M. Chen, J. Electron. Mater., 32, (2003) 3. [67] J.H.Kim, S.W. Jeong, H.D. Kim, H.M. Lee, J. Electron. Mater. 32 (2003) 1228. [68] M. He, W.H. Lau, G. Qi, Chen, Thin Solid Films 376 (2004) 462.
[69] H.F. Hsu, S.W. Chen, Acta Mater. 52 (2004) 2541.
[70] A. Sharif, Y.C. Chan, M.N. Islam, M.J. Rizvi, J. Alloys Compd. 388 (2005) 75. [71] S.K. Kang , V. Ramachandran, Scripta Mater. 14 (1980) 421.
[72] C.-Y. Huang, S.-W. Chen, J. Electron. Mater. 31 (2002) 152. [73] S. Bader, W. Gust, H. Hieber, Acta Metall. Mater. 43 1 (1995) 329. [74] D. Gur, M. Bamberger, Acta Mater. 46 14 (1998) 4917.
[75] M. Oh, Doctoral Dissertation, Lehigh University, USA, 1994.
33 [77] C. Chen, C.E. Ho, A.H. Lin, G.L. Luo, C.R. Kao, J. Electron. Mater. 29 (2000) 1200. [78] C.W. Hwang, K.S. Kim, K. Suganuma, J. Electron. Mater. 32 (2003) 1249.
[79] J. Wang, H.S. Liu, L.B. Liu, Z.P. Jin, J. Electron. Mater. 35 (2006) 10. [80] C-Y. Lin, C.-C. Jao, C. Lee, Y.-W. Yen, J. Alloys Comp.440 (2007) 333. [81] W. Choi, H. Lee, Scripta Mater. 46 (2002) 777.
[82] E. Ohriner, Welding J. 191 (1987).
Chapitre II
Techniques et méthodes expérimentales
I-Analyse thermique différentielle
... 34
I-1 Analyse Thermique (AT) ... 34
I-2 Analyse Thermique (AT) ... 35
II-Calorimétrie
... 37
II-1 Calorimétrie à haute température ... 39
II-2 Automatisation du calorimètre Calvet ... 41 II-2-1 Introducteur d’échantillons ... 41
II-3 Etalonnage du calorimètre ... 44
II-4 Mesure des enthalpies de formation ... 45 II-4-1 Les méthodes ... 46 II-4-2 Le calcul des enthalpies molaires partielles et intégrales ... 50
34 Compte tenu de nos collaborations internationales, de nos possibilités expérimentales et de la spécialisation de notre groupe nous avons choisi une approche thermochimique de la compréhension du problème des alliages de soudure et de leur développement.
Il est évident qu’aujourd’hui l’incessant développement des programmes d’évaluation par le calcul des grandeurs thermodynamiques des systèmes à 1, 2 ..n constituants (Thermodata, CALPHAD,…) permet d’enrichir notre connaissance des matériaux et de mieux comprendre leur évolution en fonction de divers paramètres (température, pression, compositions,…). Ces programmes de calcul ont pour fondement nos premiers cours de thermodynamique chimique : nous y avons appris que la connaissance de la variation de l’enthalpie de formation fH et de l’enthalpie libre de formation fG d’un alliage en fonction
de la fraction molaire et de la température (respectivement fH = f(xA, xB,…,T) et fG = f(xA, xB,…T) pouvait nous permettre, par minimisation des potentiels chimiques des phases, de
retrouver le diagramme d’équilibre des phases. Corrélativement, l’étude de la cohérence de l’ensemble des données thermodynamiques d’un système peut conduire, soit à choisir parmi un ensemble de résultats expérimentaux celui qui paraît le plus fiable, soit à proposer une information encore inconnue.
Aujourd’hui, il apparaît bien qu’expériences et programmes d’évaluation sont absolument complémentaires, d’autant plus complémentaires que dans de nombreux domaines, les données sont de plus en plus techniquement difficiles à obtenir (ou beaucoup trop onéreuses). C’est bien le cas de l’étude des alliages : il est bien rare que, pour un même système, il soit possible de déterminer les températures d’équilibre, les fonctions activités, enthalpies, énergie libre,… sur l’ensemble de domaines des compositions, de température et de pression.
En ce qui concerne les alliages de soudure à basse température, leur connaissance et donc l’amélioration de leurs propriétés nous a conduit à réaliser des expériences à haute température ; en effet, si de tels alliages doivent fondre impérativement à des températures inférieures à 250°C, leur emploi sur des substrats comme le cuivre ou le nickel nous a amené à mieux connaître la réactivité chimique soudure/cuivre ou soudure/nickel. Pour ce faire, nous avons dû essentiellement travailler à haute température.
Donc, au cours de ce chapitre, nous exposerons brièvement les deux principales méthodes expérimentales retenues :
- Les diverses analyses thermiques, - la calorimétrie isotherme.
35 Ces deux techniques, bien connues, ont donné lieu à de très nombreuses publications. Aussi avons-nous plus particulièrement décrit les adaptations apportées à ces techniques, adaptations nécessaires à cette recherche.
Ainsi, parmi toutes les grandeurs thermodynamiques indispensables à la connaissance d’un système binaire, ternaire,… nos recherches se sont focalisées sur les températures d’équilibre et les enthalpies de formation.
I-Analyse thermique différentielle
I-1 Analyse Thermique (AT)
L'analyse thermique, mise en œuvre pour la première fois par Le Chatelier au 19ème siècle, a considérablement évolué. Au sens général du terme, cette technique consiste à suivre l'évolution d'une grandeur physique en fonction de la température lorsque celle-ci varie linéairement au cours du temps. La grandeur mesurée peut être la masse (analyse thermogravimétrique), le dégagement ou l'absorption de chaleur (analyse thermique, au sens restreint du mot, ou analyse calorimétrique), la longueur ou le volume (analyse dilatométrique), une propriété électrique (conductimétrie ou mesure de résistance), magnétique, optique, structurale...
L'analyse thermique peut être simple ou différentielle selon que la détection de la variation de la grandeur physique considérée est effectuée directement ou par comparaison au comportement d'un échantillon de référence ne subissant aucune modification de cette grandeur physique dans le domaine de température exploré (Fig. 16).
Figure 16 : Principe de l’analyse thermique directe : G : système d’enregistrement, Sc et Sf respectivement les soudures chaude et froide du thermocouple, A et B les deux métaux constituant les fils
du thermocouple.
Par habitude ou tradition, la soudure froide (Sf) du thermocouple est en bon contact avec le matériau de référence, la soudure chaude (Sc) avec l’échantillon à étudier.
36
I-2 Analyse Thermique Différentielle (ATD)
Une très notable amélioration de l’analyse thermique a été introduite par Curie et Laborde [1]: c’est la détection différentielle de la température. L'analyse thermique différentielle d'une substance, dans un domaine de température donné, consiste à enregistrer les effets thermiques des transformations et réactions qu'elle subit, en chauffant, dans une enceinte à température programmée (où la température varie en général linéairement au cours du temps) le matériau expérimental (placé en Sc) et un matériau témoin, thermiquement inerte (placé en Sf), disposés symétriquement du point de vue thermique (Fig. 17). Le thermocouple enregistre la différence de températures entre les deux échantillons. En l’absence de réaction ou de transformation, l’écart de température est faible et régulier: c’est ce que l’on nomme la ligne de base de l’appareillage.
Figure 17 : Schéma de principe de l’analyse thermique différentielle. G : système d’enregistrement, B : bloc –en cuivre- de raccordement maintenu à température constante, C2 : cellule témoin, C1 : cellule
laboratoire, A et D fils constituant le ou les thermocouples.
Lorsqu’une transformation de l’échantillon à étudier intervient, elle met en jeu une quantité d’énergie et sa température s’écarte alors de celle du témoin. La différence de température est enregistrée sous forme d’un pic ou d’une succession de pics, [endothermiques ( = échantillon – référence<0) ou exothermiques ( > 0)], en fonction du
temps t. De plus, la température de l’échantillon est enregistrée simultanément.
Plusieurs classes de transformations ou réactions impliquant des changements énergétiques apparaissent sur les courbes d'ATD: transitions de phase, réactions à l'état solide, décompositions, … se traduisant par un décalage de la ligne de base.
![Figure 2: Clichés micrographiques de l’alliage solide eutectique Pb-Sn obtenus au cours d’un refroidissement lent (a) et d’un refroidissement rapide(b) [9]](https://thumb-eu.123doks.com/thumbv2/123doknet/2187507.11053/16.892.167.708.512.748/figure-cliches-micrographiques-alliage-eutectique-obtenus-refroidissement-refroidissement.webp)
![Figure 8 : Diagramme d’équilibre des phases du système binaire Bi-Sn [1].](https://thumb-eu.123doks.com/thumbv2/123doknet/2187507.11053/24.892.195.751.595.930/figure-diagramme-equilibre-phases-systeme-binaire-bi-sn.webp)
![Figure 29: Diagramme d’équilibre des phases du système In-Zn calculé [29] et comparé aux résultats expérimentaux [18, 19, 21, 23-25]](https://thumb-eu.123doks.com/thumbv2/123doknet/2187507.11053/69.892.186.689.380.747/figure-diagramme-equilibre-systeme-calcule-compare-resultats-experimentaux.webp)
![Figure 30 : Enthalpie molaire de formation des alliages In-Zn liquides : valeurs mesurées [21, 23- 23-25, 30-32] et calculées [29]](https://thumb-eu.123doks.com/thumbv2/123doknet/2187507.11053/70.892.247.660.522.840/figure-enthalpie-molaire-formation-alliages-liquides-mesurees-calculees.webp)
![Tableau 2 : différents coordonnées du point eutectique trouvés par différents auteurs [58], [58] , [61- 65].](https://thumb-eu.123doks.com/thumbv2/123doknet/2187507.11053/77.892.103.797.825.1130/tableau-coordonnees-eutectique-trouves-auteurs.webp)
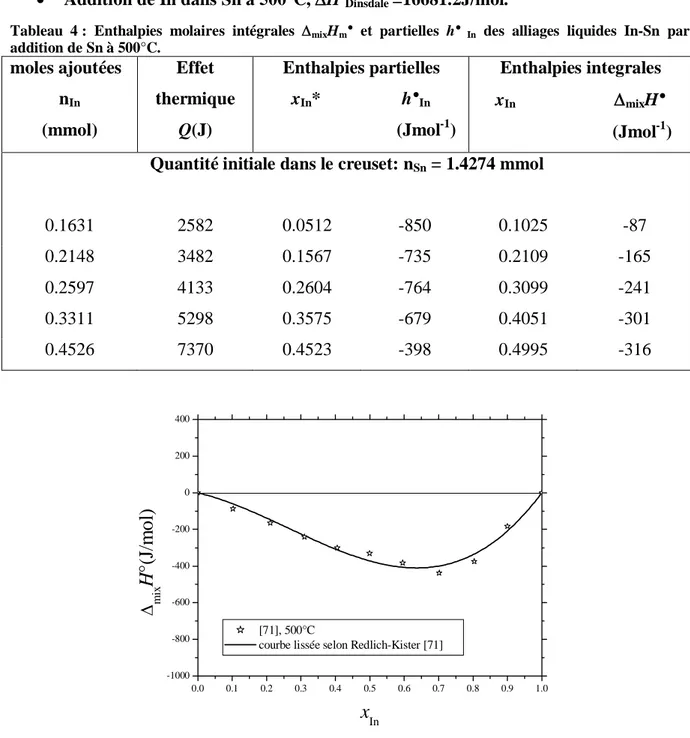
![Figure 42 : Enthalpies molaires intégrales de mélange des alliages liquides In–Sn à 500°C [71] comparées à celles disponibles dans la littérature [2, 14, 16, 17]](https://thumb-eu.123doks.com/thumbv2/123doknet/2187507.11053/84.892.255.674.263.593/enthalpies-molaires-integrales-melange-alliages-comparees-disponibles-litterature.webp)
![Figure 49 : Diagramme d’équilibre des phases du système Bi-Cu calculé [5] en comparaison avec les données disponibles dans la littérature [6-15].](https://thumb-eu.123doks.com/thumbv2/123doknet/2187507.11053/95.892.217.695.699.1051/diagramme-equilibre-systeme-calcule-comparaison-donnees-disponibles-litterature.webp)