Analyse des isomères de F
2-isoprostanes par
chromatographie liquide couplée à la spectrométrie de
masse dans la circulation maternelle en fin de
grossesse
Mémoire
Jessica Larose
Maîtrise en physiologie-endocrinologie
Maître ès sciences (M. Sc.)
Québec, Canada
© Jessica Larose, 2013
Résumé
Un stress oxydatif survient lorsqu’il y a surproduction de dérivés actifs de l’oxygène par rapport aux défenses antioxydantes. Ce déséquilibre est associé, entre autres, à la prééclampsie, une pathologie de la grossesse. Les F2-isoprostanes regroupent soixante-quatre isomères issus de la peroxydation
de l’acide arachidonique. Ceux-ci sont reconnus comme étant les biomarqueurs les plus fiables du stress oxydatif in vivo. Une méthode d’analyse par chromatographie liquide couplée à la spectrométrie de masse en tandem pour le dosage de sept isomères de F2-isoprostanes dans des
échantillons de plasma, de sang et de membranes érythrocytaires a été mise au point et validée. Les F2-isoprostanes dans le plasma ont été corrélés positivement avec plusieurs acides gras trans
plasmatiques au troisième trimestre de la grossesse. Contre toute attente, les F2-isoprostanes du
plasma, du sang et des membranes érythrocytaires sont moins abondants en prééclampsie par rapport aux contrôles en fin de grossesse.
Abstract
An oxidative stress is defined as an imbalance between the production of reactive oxygen species and antioxidant defenses of the organism. This imbalance has been associated with preeclampsia, a pathology of the mid-to-late pregnancy. Peroxidation of arachidonic acid generates sixty-four isomers of F2-isoprostanes. The latter are recognized as the most reliable biomarkers of oxidative stress in
vivo. A method using liquid chromatography tandem mass spectrometry (HPLC-MS/MS) for the
determination of seven isomers of F2-isoprostanes in plasma samples, whole blood and erythrocyte
membranes has been developed and validated. The F2-isoprostanes correlated positively with
several trans fatty acids in plasma at end of the pregnancy. Unexpectedly, F2-isoprostanes were less
Table des matières
Résumé ... III Abstract ... V Table des matières ... VII Liste des tableaux ... XI Liste des figures ... XI Liste des abréviations ... XIII Remerciements ... XIX Avant-Propos ... XXI Chapitre 1 – Introduction ... 1 1.1. Le stress oxydatif ... 1 1.1.1. Les prooxydants ... 1 1.1.2. Les antioxydants ... 3 1.2. Les lipides ... 9
1.2.1. Définitions et fonctions biologiques ... 9
1.2.2. Digestion, absorption et transport dans l’organisme ... 9
1.2.3. Acide arachidonique ... 12
1.2.4. Acides gras trans ... 14
1.2.5. Acides gras et stress oxydatif ... 16
1.3. Les F2-isoprostanes ... 19
1.3.1. Formation des F2-isoprostanes ... 20
1.3.2. Transport et métabolisme des F2-isoprostanes ... 22
1.3.3. Mesure des F2-isoprostanes ... 23
1.3.4. Effets biologiques des F2-isoprostanes ... 25
1.4. Grossesse et désordre hypertensif avec protéinurie ... 26
1.4.1. La grossesse, un évènement oxydatif ... 26
1.4.2. Désordre hypertensif avec protéinurie (prééclampsie) ... 27
1.5. Problématique et objectifs ... 31
1.5.1. Problématique ... 31
1.5.2. Hypothèses ... 32
1.5.3. Objectifs ... 32
Chapitre 2 – F2-isoprostanes analysis in plasma of pregnant women by HPLC-MS/MS using a column packed with core-shell particles... 35
2.1. Résumé ... 35
2.2. Abstract ... 37
2.3. Introduction ... 38
2.4. Material and methods ... 39
2.4.1. Materials ... 39
2.4.2. Patient selection ... 39
2.4.3. Blood collection and processing ... 40
2.4.5. Extraction of F2-isoPs from plasma ... 40 2.4.6. Chromatography ... 41 2.4.7. Mass Spectrometry ... 41 2.4.8. Method validation ... 42 2.4.9. Statistical analyses ... 42 2.5. Results ... 42
2.5.1. Analysis of F2-isoPs in plasma by selected reaction monitoring mass spectrometry ... 42
2.5.2. Chromatographic separation ... 43
2.5.3. Method validation ... 43
2.5.4. F2-isoPs in the plasma of pregnant women ... 44
2.6. Discussion ... 44
2.7. Acknowledgments ... 46
2.8. References ... 46
2.9. Figure legends ... 50
Chapitre 3 – F2-isoprostanes are correlated with trans fatty acids in plasma of pregnant women... 57
3.1. Résumé ... 57
3.2. Abstract ... 59
3.3. Introduction ... 60
3.4. Material and methods ... 61
3.4.1. Materials ... 61
3.4.2. Patient recruitment ... 62
3.4.3. Blood collection and processing ... 62
3.4.4. F2-isoPs analysis by HPLC-MS/MS ... 62
3.4.5. Determination of plasma fatty acid profile by gas chromatography ... 63
3.4.6. Statistical analyses ... 63
3.5. Results ... 63
3.5.1. F2-isoPs in the plasma of pregnant women ... 63
3.5.2. Analysis of plasma fatty acids ... 64
3.5.3. Relationship between F2-isoPs and trans fatty acids... 64
3.6. Discussion ... 64
3.7. Acknowledgments ... 68
3.8. References ... 68
Chapitre 4 – Étude du stress oxydatif en prééclampsie ... 79
4.1. Introduction ... 79
4.2. Matériel et méthode ... 80
4.2.1. Matériel ... 80
4.2.2. Sélection des patientes ... 80
4.2.3. Récolte et traitement des échantillons de sang ... 80
4.2.4. Préparation des standards pour l’analyse des F2-isoprostanes ... 81
4.2.5. Extraction des F2-isoprostanes totaux contenus dans le plasma ... 81
4.2.6. Extraction des membranes érythrocytaires ... 81
4.2.7. Extraction des F2-isoprostanes totaux contenus dans les membranes érythrocytaires .... 81
4.2.8. Extraction des F2-isoprostanes totaux contenus dans le sang total ... 82
4.2.10. Analyses statistiques ... 82
4.3. Résultats ... 82
4.3.1. F2-isoprostanes dans le plasma ... 82
4.3.2. F2-isoprostanes dans le sang... 83
4.3.3. F2-isoprostanes dans les membranes érythrocytaires ... 84
4.4. Discussion ... 85
4.5. Bibliographie ... 87
Chapitre 5 – Discussion générale ... 89
Bibliographie ... 97
Liste des tableaux
Chapitre 1Tableau 1. Caractéristiques des différents types de lipoprotéines ... 10
Tableau 2. Facteurs de risques pour la prééclampsie liés à la mère ... 30
Tableau 3. Facteurs de risques pour la prééclampsie liés au père ... 31
Tableau 4. Facteurs de risques pour la prééclampsie liés à la grossesse ... 31
Chapitre 2 Table 1. Selected reaction monitoring parameters optimized for each classes of F2-isoPs ... 51
Table 2. Results for the method validation of F2-isoPs. ... 52
Table 3. F2-isoPs in the plasma of third trimester pregnant women. ... 53
Chapitre 3 Table 1. F2-isoprostanes in the plasma of third trimester pregnant women. ... 75
Table 2. Fatty acids of interest in plasma of third trimester pregnant women. ... 76
Table 3. Correlations between F2-isoprostanes and trans fatty acids in plasma of third trimester pregnant women. ... 77
Chapitre 4 Tableau 1. F2-isoprostanes totaux mesurés dans le plasma de femmes au troisième trimestre d’une grossesse normotensive ou prééclamptique. ... 83
Tableau 2. F2-isoprostanes totaux mesurés dans le sang entier de femmes au troisième trimestre d’une grossesse normotensive ou prééclamptique. ... 84
Tableau 3. F2-isoprostanes totaux mesurés dans les membranes érythrocytaires de femmes au troisième trimestre d’une grossesse normotensive ou prééclamptique. ... 85
Liste des figures
Chapitre 1 Figure 1. Cycle du glutathion. ... 4Figure 2. Système de la thiorédoxine. Adaptée de [24]. ... 5
Figure 3. Exemples de petites molécules antioxydantes. ... 6
Figure 4. Structures des tocophérols et des tocotriénols. ... 7
Figure 5. Neutralisation du radical peroxyle en hydroperoxyde organique par l’α-tocophérol qui est à son tour recyclée par la vitamine C (ascorbate). Adaptée de [31]. ... 8
Figure 6. Schémas général d'une lipoprotéine. Tirée de [41]. ... 10
Figure 7. Transport des lipides par les lipoprotéines. Tirée de [45]. ... 12
Figure 8. Voies de synthèse des eicosanoïdes dérivés de l’acide arachidonique. Tirée de [46]. ... 13
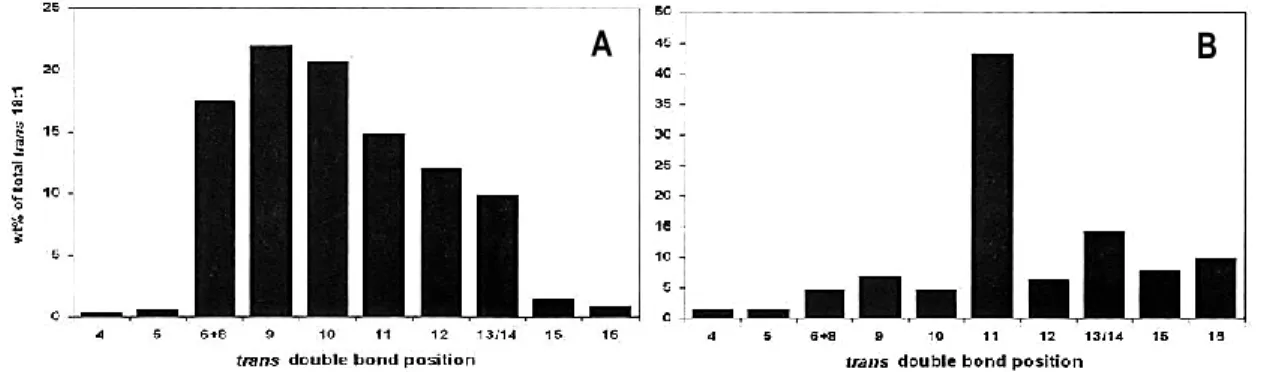
Figure 10. Distribution des t-18:1 dans (A) l’huile végétale partiellement hydrogénée (margarine, n = 46 échantillons) et dans (B) le gras de lait de vache (n = 1765
échantillons). Adapté de [57]. ... 15
Figure 11. Mécanisme général de la peroxydation des lipides. ... 17
Figure 12. Structure des différents types d'isoprostanes dérivés de l'acide arachidonique. Tirée de [9]. ... 18
Figure 13. Mécanisme général de la réaction d'isomérisation cis-trans induite par les radicaux libres. X• représente n’importe quel radical capable d’induire cette réaction. Tirée de [22]. ... 19
Figure 14. Structures de la Prostaglandine F2α (PGF2α) et du 8-iso PGF2α. ... 20
Figure 15. Mécanisme de formation des F2-isoprostanes. Adaptée de [92]. ... 21
Figure 16. Structure d’un peroxyde dioxolane-isoprostane (classe IV). R = -(CH2)3COOH... 22
Figure 17. Structures du 2,3-dinor-8-iso-PGF2α et le 2,3-dinor-5,6-dihydro-8-iso-PGF2α. ... 23
Figure 18. Dérivation chimique pour l'analyse des F2-isoPs par GC-MS. Tirée de [104]. ... 24
Figure 19. Signalisation impliquant le 8-iso-PGF2α dans la fonction plaquettaire. Tirée de [115]. ... 25
Figure 20. Invasion des artères spiralées par les cytotrophoblastes dans une grossesse sans complications. Tirée de [130]. ... 27
Figure 21. Invasion des artères spiralées par les cytotrophoblastes dans une grossesse prééclamptique. Tirée de [130]. ... 29
Chapitre 2 Figure 1. Chemical structures of analytes investigated by LC-MS/MS. ... 54
Figure 2. Mass chromatograms of a standard solution (A-F) and of a typical plasma sample spiked with 50 pg of each internal standard (G-L). ... 55
Chapitre 5 Figure 1. Compétition entre la formation des F2-isoprostanes et des isofuranes ... 94
Liste des abréviations
11t-18:1 : Acide trans-vaccénique
1O2 : Oxygène singulet
9t-18:1 : Acide élaïdique AA : Acide arachidonique
AA-CoA : Acide arachidonique estérifié à la coenzyme A ALA : Acide alpha-linolénique
AMPc : Adénosine monophosphate cyclique Asc•- : Radical ascorbyl
AscH- : Ascorbate
BHT : Hydroxytoluène butylé; butylated hydroxytoluene CAT : Catalase
CCl4 : Tétrachlorométhane
CETP : Protéine de transfert des esters de cholestérol; cholesteryl ester transfer protein CM : Chylomicrons
CoA : Coenzyme A COX : Cyclo-oxygénases Cu : Cuivre
CYP : Cytochromes P450 DHA : Acide docosahexaénoïque DHAsc : Dehydroacscorbate
ELISA : Méthodes immuno-enzymatiques F2-isoPs : F2-isoprostanes
Fe : Fer
GC-MS/MS : Chromatographie en phase gazeuse couplée à la spectrométrie de masse en tandem
GC-NICI-MS : Chromatographie en phase gazeuse couplée à la spectrométrie de masse en mode « ionisation chimique négative »
GPR : Glutathion réductase GPx : Glutathion peroxydases GSH : Glutathion réduit GSSG : Glutathion oxydé GST : Glutathion-s-transférase H• : Hydrogène
H2O2 : Peroxyde d’hydrogène
HDL : Lipoprotéines de haute densité; high density lipoprotein
HELLP syndrome : Hemolysis, Elevated Liver enzymes and Low Platelets count syndrome HL : Lipase hépatique; hepatic lipase
HO• : Radical hydroxyle
HOCl : Acide hypochloreux
HPLC-MS/MS : Chromatographie liquide couplée à la spectrométrie de masse en tandem IDL : Lipoprotéines de densité intermédiaire
isoFs : Isofuranes isoP : Isoprostanes
ISR : Récepteur des isoprostanes
iTFA : Acides gras trans d'origine industrielle L• : Lipide radicalaire
LA : Acide linoléique; linoleic acid LCAT : Lécithin:cholestérol acyl transférase
LDL : Lipoprotéines de basse densité; low density lipoprotein LOO• : Radical peroxyle de lipide
LOOH : Hydroperoxyde de lipide LOX : Lipoxygénase
LPL : Lipase lipoprotéique
LPLAT : Lysophospholipide acyltransférase Lp-PLA2 : PLA2 associée aux lipoprotéines
NADPH : Forme réduite du nicotinamide adénine dinucléotide phosphate NO• : Oxyde nitrique
NO2• : Dioxyde d’azote
NOS : Synthétases d’oxyde nitrique
NOX : Nicotinamide adénine dinucléotide phosphate oxydase O2 : Oxygène moléculaire
O2•- : Superoxyde
O3 : Ozone
OMS : Organisation mondiale de la santé ONOO- : Peroxynitrite
PGF2α : Prostaglandine F2α
PL : Phospholipides PLA2 : Phospholipase A2
PUFA : Acide gras polyinsaturé; polyunsaturated fatty acid R• : Radicaux alkyles
RIA : Méthodes radio-immunologiques RO• : Radicaux alkoxyles
ROO• : Radicaux peroxyles
ROOH : Hydroperoxydes organiques
ROS : Dérivés actifs de l'oxygène; reactive oxygen species RS• : Radicaux thiyle
RSH : Thiols
rTFA : Acides gras trans retrouvés dans les aliments dérivés des ruminants SOD : Superoxyde dismutases
TAG : Triacylglycérol TBA : Acide thiobarbiturique
TFA : Acide gras trans; trans fatty acid TPR : Récepteur de la thromboxane A2
Trx : Thiorédoxine TXA2 : Thromboxane A2
VLDL : Lipoprotéines de très basse densité; very low density lipoprotein α-TO• : α-tocophérol oxydé
α-TOH : α-tocophérol
«Tu ne traverseras jamais l’océan si tu as peur de perdre de vue le rivage» Christophe Colomb
Remerciements
Premièrement, j’aimerais remercier mon directeur de recherche, le Dr Jean-François Bilodeau, pour son encadrement tout au long de ma maîtrise. Celui-ci m’a offert une occasion en or de découvrir ce domaine passionnant qu’est la recherche dans le secteur médical. Il a également su faire preuve de patience et de compréhension à mon égard puisque, étant chimiste, je n’étais pas très familière avec les domaines de la physiologie et de l’endocrinologie. Malgré cela, le Dr Bilodeau a eu confiance en mes capacités et m’a accordé beaucoup d’autonomie pour la réalisation de mon projet de maîtrise. Il m’a également donné l’opportunité de présenter et d’assister à plusieurs congrès et conférences. J’ai entre autres présenté mes résultats au Eastern Canadian Perinatal Investigators Meeting le 16 novembre 2012 à Toronto.
Ensuite, j’aimerais remercier la Dre Vanessa Moisan tant pour son support technique que moral. Son aide a été particulièrement précieuse alors que j’avais de la difficulté à saisir certaines notions enseignées pendant les cours que j’ai dû suivre dans le cadre de ma maîtrise et pour lesquels je n’avais pas toutes les connaissances nécessaires pour comprendre.
Les conseils du Dr Pierre Julien ont été grandement appréciés. J’aimerais également remercier ce dernier pour le dosage des lipides fait dans les échantillons sur lesquels j’ai travaillé ainsi que pour les corrections apportées aux manuscrits des articles qui seront présentés dans ce mémoire.
Je suis reconnaissante envers le Fonds de recherche en santé du Québec (FRSQ) pour le support financier accordé par l’entremise d’une bourse de formation de maîtrise ainsi qu’envers le Centre de recherche en biologie de la reproduction (CRBR) pour la bourse À la poursuite de l’excellence. Enfin, je tiens à remercier chaleureusement mes parents, Denise et Michel, mon conjoint, Sébastien, ainsi que tous les autres membres de ma famille pour leur écoute et leurs encouragements. Leur support a été très précieux tout au long de mes études.
Avant-Propos
Dans le cadre de ma maîtrise, je devais développer et valider une méthode d’analyse des F2
-isoprostanes, des biomarqueurs du stress oxydatif, par chromatographie liquide couplée à la spectrométrie de masse en tandem (HPLC-MS/MS). Je devais ensuite utiliser cette technique pour étudier le stress oxydatif dans la circulation maternelle en fin de grossesse. Le présent mémoire résume mes travaux effectués au cours des deux dernières années. Il contient cinq chapitres et une annexe. Voici une brève description de chacune de ces sections :
Le premier chapitre met en place toutes les notions théoriques nécessaires à la compréhension du reste du document.
Le deuxième chapitre est le manuscrit d’un article scientifique qui a été accepté pour publication dans le Journal of Lipid Research en février 2013. En tant que première auteure, j’ai mis au point et validé la technique d’analyse des F2-isoprostanes par HPLC-MS/MS. J’ai
ensuite procédé au dosage de ces molécules dans le plasma de femmes au troisième trimestre d’une grossesse normotensive avec l’aide de la Dre Vanessa Moisan. Enfin, j’ai analysé les résultats et rédigé l’article sous la supervision de mon directeur de recherche, le Dr Jean-François Bilodeau. Le manuscrit a été révisé avant sa soumission au journal par ce dernier ainsi que par le Dr Pierre Julien.
Le troisième chapitre est le manuscrit d’un article scientifique dont je suis la première auteure et qui sera soumis sous peu dans le journal Biochimica et Biophysica Acta. J’ai utilisé la méthode que j’ai mise au point pour le dosage des F2-isoprostanes. La mesure des
acides gras a été faite par Karine Greffard qui est professionnelle de recherche dans le laboratoire du Dr Pierre Julien. J’ai analysé les résultats et rédigé ce manuscrit sous la supervision de mon directeur de recherche. Le manuscrit a été révisé par celui-ci et par le Dr Pierre Julien.
Le quatrième chapitre résume les résultats que j’ai obtenus suite au dosage des F2
-isoprostanes dans le plasma, le sang entier et les membranes érythrocytaires de femmes au troisième trimestre d’une grossesse normotensive ou prééclamptique. Ces résultats n’ont pas fait l’objet d’un article scientifique pour le moment.
Dans le dernier chapitre du présent mémoire, les résultats présentés précédemment sont discutés.
L’article présenté en annexe a été publié en 2012 dans le journal Molecular Reproduction &
Development. Il traite de la voie des polyols dans l’oviducte bovin. En tant que première
auteure, j’ai optimisé une technique d’analyse des polyols par HPLC-MS/MS et j’ai ensuite procédé au dosage de ces molécules dans des sections d’oviductes bovin. Ces travaux ont été faits lors d’un stage effectué dans le laboratoire du Dr Jean-François Bilodeau alors que j’étais encore étudiante au baccalauréat, mais la rédaction de l’article à laquelle j’ai participé a été faite pendant ma maîtrise.
Chapitre 1 – Introduction
1.1. Le stress oxydatif
Les dérivés actifs de l’oxygène (ROS) sont des molécules chimiquement réactives contenant au moins un atome d’oxygène. Plusieurs d’entre eux sont radicalaires, c’est-à-dire qu’ils possèdent un électron non apparié sur la couche électronique externe [1]. Dans les conditions physiologiques normales, les ROS occupent des fonctions biologiques importantes. Entre autres, ils agissent comme seconds messagers dans différentes voies de signalisation [2, 3] et sont impliqués dans la défense immunitaire [4]. Les ROS sont constamment produits dans l’organisme, mais étant donné leur très grande réactivité, leurs niveaux sont contrôlés par des antioxydants enzymatiques et non enzymatiques. Un stress oxydatif survient lorsqu’il y a surproduction de ROS par rapport aux défenses antioxydantes de l’organisme [5]. Ce déséquilibre est observé dans le processus du vieillissement ainsi que dans certaines situations physiologiques normales comme la grossesse [6, 7]. Il est également impliqué dans la physiopathologie de plusieurs maladies [8]. Par exemple, le stress oxydatif est observé dans plusieurs maladies cardiovasculaires (ex. : athérosclérose, insuffisance cardiaque), inflammatoires (ex. : arthrite, asthme) et neurodégénératives (ex. : maladie d'Alzheimer).
1.1.1. Les prooxydants
Parmi les ROS figurent le superoxyde (O2•-), le peroxyde d’hydrogène (H2O2), le radical hydroxyle
(HO•), radicaux alkoxyles (RO•), les radicaux peroxyles (ROO•), les hydroperoxydes (ROOH),
l’oxygène singulet (1O2) et l’ozone (O3) [9].
Le superoxyde est principalement produit dans les mitochondries où le transfert des électrons entre les différents constituants de la chaîne de transport des électrons n’est pas complètement efficace [10]. Une faible proportion des électrons qui circulent dans cette chaîne peuvent s’échapper par les complexes I et III et causer la réduction directe de l’oxygène moléculaire pour former le superoxyde. Entre 1 et 2 % de l’oxygène consommé chaque jour est ainsi réduit dans les conditions physiologiques normales [11, 12]. Outre les mitochondries, le réticulum endoplasmique constitue une autre source majeure de la production du superoxyde dans la cellule. En effet, jusqu’à 25 % du
superoxyde produit dans une cellule pourrait provenir de cet organite [13]. Pendant le repliement des protéines, la formation de ponts disulfures est une réaction d’oxydation et les électrons libérés peuvent être récupérés par l’oxygène moléculaire et ainsi le réduire en superoxyde. Certaines enzymes, comme les cytochromes P450, la xanthine oxydase et les nicotinamide adénine dinucléotide phosphate (NADPH) oxydases (NOX) sont également responsables de la production de ce ROS. Les NOX catalysent la production de superoxyde à partir de l’oxygène et du NADPH [14]. Ces enzymes sont impliquées dans la signalisation cellulaire et l’une d’entre elles, NOX2, est retrouvée dans les cellules phagocytaires qui produisent le superoxyde après exposition à des microorganismes étrangers ou à des médiateurs de l’inflammation afin de détruire l’élément étranger. Le superoxyde est une espèce radicalaire hautement réactive, mais à cause de sa charge anionique, il lui est impossible de traverser les membranes lipidiques. Sa dismutation, catalysée par les enzymes superoxyde dismutases (SOD), forme du peroxyde d’hydrogène (H2O2). Cet autre ROS
peut également être généré par les oxydases des peroxysomes, par la xanthine oxydase [15], par les monoamines-oxydases [16] et par la p66shc dans les mitochondries [17]. Le peroxyde d’hydrogène peut circuler dans l’organisme sur de plus longues distances, car il ne porte pas de charge anionique, ce qui lui permet de traverser les membranes lipidiques. De plus, cet oxydant est beaucoup moins réactif que le superoxyde, car il n’est pas radicalaire. Cependant, en oxydant le fer (II) non chélaté selon la réaction de Fenton (1), il forme le radical hydroxyle, une espèce encore plus réactive que le superoxyde et qui a la possibilité de traverser les membranes lipidiques. Le superoxyde peut quant à lui réduire le fer (III) non chélaté en fer (II) (réaction (2) plus bas). En combinant les réactions (1) et (2), la réaction de Haber-Weiss (3) est obtenue et celle-ci démontre que les ions de fer non chélatés agissent comme des catalyseurs dans la production du radical hydroxyle. D’autres ions métalliques non chélatés, comme le cuivre, peuvent également servir de catalyseur dans cette réaction [18].
(Réaction de Fenton) (1) (2) (Réaction de Haber-Weiss) (3) H2O2 + Fe2+ O2•- + Fe3+ O2•- + H2O2 HO• + HO- + Fe3+ O2 + Fe2+ HO• + HO- + O2 Fe3+, Fe2+
La réaction des ROS avec d’autres constituants biologiques peut causer la formation d'autres molécules réactives. Par exemple, la réaction du radical hydroxyle avec d’autres molécules biologiques mène à la formation d'autres ROS (RO•, R-O-O•, R-O-O-H) ou encore d'autres espèces
radicalaires (R•, RS•). Le superoxyde peut quant à lui réagir avec l’oxyde nitrique (NO•), une espèce
radicalaire synthétisée par les synthétases d’oxyde nitrique (NOS) à partir de la L-arginine (réaction (4)). Cette réaction mène à la formation du peroxynitrite, un autre prooxydant qui peut se décomposer en radical hydroxyle (réaction (5)) [19]. L’acide hypochloreux (HOCl) peut aussi être formé lors de la réaction entre un chlorure (Cl-) et le peroxyde d’hydrogène [20]. Finalement, si la
production de ROS n’est pas suffisamment ralentie dans l’organisme par les antioxydants, ils peuvent induire de sérieux dommages aux différents constituants cellulaires (ex. : protéines, ADN, glucides et lipides). La réaction des ROS avec les lipides se nomme la peroxydation lipidique [21]. Les acides gras insaturés sont particulièrement sujets à réagir avec les ROS et d’autres radicaux libres. Certains radicaux libres tels que les radicaux thiyles (RS•) ont la propriété de catalyser leur
isomérisation cis-trans [22]. La peroxydation lipidique et l’isomérisation cis-trans seront deux réactions traitées plus en détail ultérieurement.
(4) (5)
1.1.2. Les antioxydants
Les ROS causent des dommages importants aux différents constituants cellulaires, mais l’organisme peut compter sur l’action des antioxydants enzymatiques et non enzymatiques.
1.1.2.1. Les antioxydants enzymatiques
Plusieurs enzymes sont impliquées à différents degrés dans les la défense de l’organisme contre l’assaut des ROS [23]. En première ligne, les superoxyde dismutases (SOD) catalysent la dismutation du superoxyde en peroxyde d’hydrogène selon la réaction (6). Ces enzymes existent sous trois formes. La SOD1, ou CuZn-SOD, est retrouvée dans le cytosol alors que la SOD2, ou Mn-SOD, est retrouvée dans les mitochondries. Il existe également une SOD extracellulaire, la SOD3.
ONOO -ONOO- + H+
NO• + O2
Le peroxyde d’hydrogène peut quant à lui être décomposé par la catalase (CAT) qui est retrouvée dans les peroxysomes (réaction (7)) ou encore par les glutathion peroxydases (GPx). Il existe cinq GPx qui utilisent le glutathion (GSH) comme réducteur afin de décomposer le peroxyde d’hydrogène et les hydroperoxydes organiques (réactions (8) et (9)) [24]. Cependant, ces cinq GPx ne possèdent pas la même spécificité pour chacun des substrats. Ainsi, GPx1 et GPx2 peuvent réduire le peroxyde d’hydrogène ainsi que les hydroperoxydes organiques solubles (ex. : hydroperoxydes d’acides gras). GPx3 et GPx4 peuvent réduire des hydroperoxydes organiques plus complexes, mais GPx4 est le seul enzyme pouvant utiliser les hydroperoxydes de phospholipides, de cholestérol et d'ester de cholestérol encore intégrés dans les membranes lipidiques, et cela sans aide des phospholipases [25]. GPx5, quant à elle, est seulement retrouvée dans l’épididyme. Après avoir été utilisé par les GPx, le glutathion oxydé (GSSG) est réduit par une glutathion réductase (GPR) avec NADPH comme agent réducteur (réaction (10)) pour compléter le cycle du glutathion (Figure 1). Une autre famille d’enzyme utilisant le glutathion, les glutathion-S-transférases (GST), sont également capable d’éliminer les ROS de la même manière que les GPx [26].
(6) (7) (8) (9) (10)
Figure 1. Cycle du glutathion. 2 O2•- + 2 H+ H2O + O2 2 H2O + GSSG H2O + GSSG + ROH GSH + NADP+ SOD CAT GPx GPx GPR O2 + H2O2 2 H2O2 H2O2 + 2 GSH ROOH + 2 GSH GSSG + NADPH ROOH 2 GSH NADPH GPx GPR ROH + H2O GSSG NADP+
Les enzymes appartenant au système de la thiorédoxine (Trx) sont aussi impliquées dans la détoxication directe des ROS (Figure 2) [24]. Brièvement, les thiorédoxine peroxydases (TrxP), aussi appelées peroxyrédoxines, peuvent décomposer le peroxyde d’hydrogène et les hydroperoxydes organiques. La thiorédoxine peroxydase oxydée (oxTrxP) est recyclée par la thiorédoxine (Trx), une autre enzyme capable de réduire les ROS. Il se crée alors des ponts disulfures entre deux cystéines situées dans la portion N-terminale de l’enzyme oxydée (oxTrx) qui peuvent être réduits grâce à la thiorédoxine réductase (TrxR) qui utilise le NADPH comme agent réducteur. Cette dernière enzyme participe également dans la détoxication des ROS et elle est capable de réduire la vitamine C oxydée ainsi que l’acide α-lipoïque [20]. À noter, aucune enzyme n’est capable de réduire le radical hydroxyle, les radicaux alkoxyles (RO•) et les radicaux peroxyles (ROO•) car ceux-ci sont trop réactifs
et endommageraient la protéine impliquée dans leur détoxication. Le système enzymatique tente plutôt d’empêcher la formation de ces espèces hautement réactives en éliminant leurs précurseurs : les peroxydes et le superoxyde.
Figure 2. Système de la thiorédoxine. Adaptée de [24].
1.1.2.2. Les antioxydants non enzymatiques
Les enzymes antioxydantes utilisent principalement les peroxydes ou le superoxyde comme substrats. L’organisme a également recourt à de nombreuses petites molécules hydrosolubles et liposolubles capables de neutraliser les ROS, dont les ROS radicalaires. Par exemple, le glutathion, l’acide urique et la vitamine C (acide ascorbique) sont des antioxydants hydrosolubles alors que
ROOH
Vitamine C oxydée ROOH
ROOH TrxP oxTrx TrxR NADPH
ROH + H2O oxTrxP Trx oxTrxR NADP+
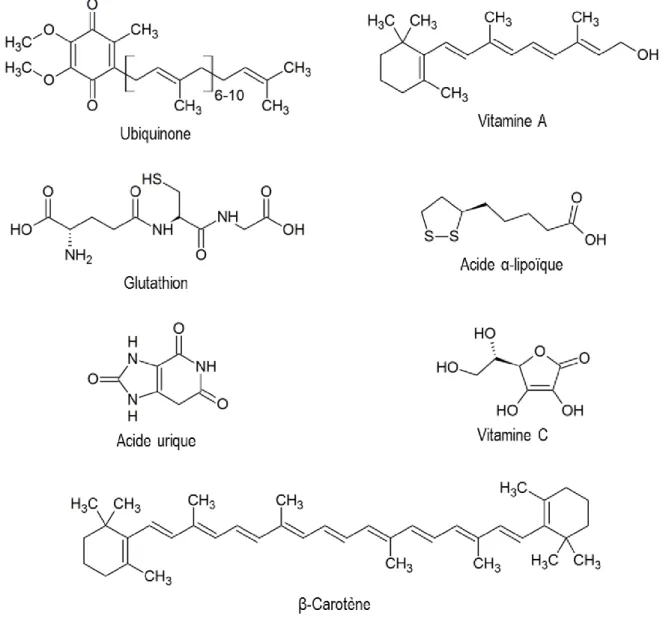
l’ubiquinone (Coenzyme Q), l’acide α-lipoïque, les caroténoïdes (β-carotène, la vitamine A), et les vitamines E sont des antioxydants liposolubles (Figure 3 et Figure 4).
Figure 3. Exemples de petites molécules antioxydantes.
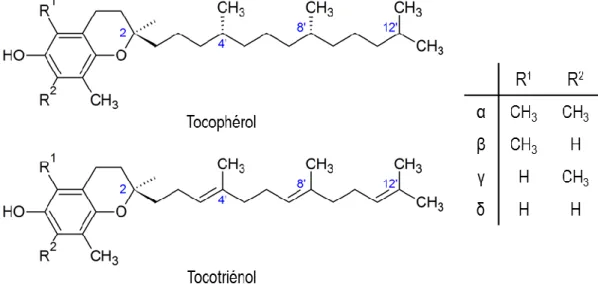
Les vitamines E sont produites par les plantes et regroupent huit molécules de structures similaires, c’est-à-dire quatre tocophérols (forme α-, β-, γ-, et δ-) et quatre tocotriénols (forme α-, β-, γ-, et δ-) [27]. Ces molécules possèdent toutes un noyau chromanol et une longue chaîne latérale de 16 carbones (Figure 4). Pour les tocophérols, cette longue chaîne est saturée et compte trois centres chiraux. Ces carbones asymétriques sont retrouvés seulement dans la configuration R dans la nature. Pour les tocotriénols, cette chaîne contient trois liaisons doubles et le seul carbone
asymétrique est en configuration R dans la nature. Les huit types de vitamine E sont absorbés par l’intestin, mais une fois acheminées dans le foie, la α-tocopherol transfer protein (α-TTP) favorise la sécrétion de l’α-tocophérol (α-TOH) dans le plasma par le biais des lipoprotéines de très basse densité (VLDL) et cela au détriment des autres formes de vitamines E [28]. Il en résulte que l’α-tocophérol est la vitamine E la plus abondante dans les tissus et dans le plasma alors que les tocotriénols sont les moins abondants [29]. C’est également la forme de tocophérol la plus efficace comme antioxydant in vivo, suivi par les formes β-, γ-, et finalement δ- [27].
Figure 4. Structures des tocophérols et des tocotriénols.
À cause de sa nature hydrophobe, l’α-tocophérol est retrouvé dans les membranes lipidiques qu’il protège contre la peroxydation. Cette molécule est capable de donner son hydrogène (H•) phénolique
aux différents ROS radicalaires (HO•, RO•, ROO•, O2-•) afin de les convertir en espèces moins
réactives (Figure 5). Elle empêche ainsi de façon très efficace la propagation de la réaction radicalaire en chaîne qu’est la peroxydation lipidique. En effet, le radical peroxyle réagit 1000 fois plus rapidement avec l’α-tocophérol qu’avec les acides gras polyinsaturés [30]. L’α-tocophérol radicalaire (α-TO•) obtenu est moins réactif que les ROS, car le radical est délocalisé par résonnance
dans la molécule et donc moins accessible pour réagir. Cependant, ce radical peut être prooxydant s’il n’est pas rapidement neutralisé [27]. Étant confiné dans les membranes lipidiques, il peut initier de nouvelles réactions radicalaires (réactions (11) et (12)). L’α-tocophérol et l’α-tocophérol oxydé
peuvent également réduire les ions métalliques tels que le fer (III) (réactions (13) et (14)), favorisant ainsi la réaction de Fenton (1).
(11) (12) (13) (14)
Figure 5. Neutralisation du radical peroxyle en hydroperoxyde organique par l’α-tocophérol qui est à son tour recyclée par la vitamine C (ascorbate). Adaptée de [31].
La vitamine C (ou ascorbate, AscH-) est une petite molécule hydrosoluble qui a la capacité de
neutraliser directement les ROS radicalaires (HO•, RO•, ROO•, O2-•). Cependant, sa principale
fonction comme antioxydant est de recycler l’α-tocophérol oxydé (Figure 5) [31]. Le radical ascorbyl formé (Asc•-) peut ensuite être réduit soit par dismutation (réaction (15)), soit grâce à la thiorédoxine
réductase (Figure 2). Le dehydroacscorbate (DHAsc) formé lors de la dismutation de Asc•- peut être
réduit grâce à la DHAsc réductase dépendante du GSH (réaction (16)). α-TO• + RH α-TO• + ROOH α-TOH + Fe3+ α-TO• + Fe3+ α-TOH + R• α-TOH + ROO• α-TO• + Fe2+ + H+ α-TO+ + Fe2+ ROOH ROO• α-tocophérol
(15) (16)
1.2. Les lipides
1.2.1. Définitions et fonctions biologiques
Les lipides sont de petites molécules hydrophobes ou amphiphiles divisées en huit catégories : les acides gras, les acylglycérols, les glycérophospholipides (ou phospholipides), les sphingolipides, les stérols (ex. : cholestérol, esters de cholestérols), les prénols, les glycolipides et les polycétides [32]. Ils occupent d’importantes fonctions biologiques [33]. Les phospholipides (PL) et le cholestérol sont des constituants majeurs des membranes biologiques alors que les triacylglycérols (TAG) servent à emmagasiner de l’énergie. En effet, l’oxydation complète de 1 g d’acides gras génère environ 38 kJ. De plus, les cellules adipeuses sous-cutanées riches en TAG servent d’isolant thermique. Certains lipides ou dérivés de lipides sont également impliqués dans la signalisation cellulaire.
1.2.2. Digestion, absorption et transport dans l’organisme
Les lipides représentent environ 35% de l’énergie quotidienne fournie par une diète américaine typique [34]. Les TAG sont les principaux lipides ingérés. Les PL, le cholestérol et les esters de cholestérol sont également retrouvés dans la diète, mais en quantité beaucoup plus faible. La digestion et l’absorption des lipides se font dans l’intestin grêle où ils sont mélangés à la bile qui est composée entre autres de sels biliaires, de phospholipides et de cholestérol [35]. Les TAG sont hydrolysés en 2-monoacylglycérols et en acides gras grâce à la lipase pancréatique alors que les phospholipides sont hydrolysés en 2-lysophospholipides et en acides gras grâce à une phospholipase A2 (PLA2) [36, 37]. Les esters de cholestérols sont hydrolysés par la cholestérol
estérase [38-40]. Les acides gras, le 2-monoacylglycérol, le 2-lysophospholipide et le cholestérol entrent ensuite dans les entérocytes principalement par diffusion passive où ils sont réestérifiés puis assemblés pour former des chylomicrons, un type de lipoprotéine. Les lipoprotéines sont des
2 Asc •-DHAsc AcsH- + DHAsc AscH- DHAsc réductase dépendante du GSH
particules sphériques dont la surface est composée d’apolipoprotéines, de PL et de cholestérol et dont le cœur est composé de TAG et d’esters de cholestérol (Figure 6). Outre les chylomicrons (CM), il existe trois autres types de lipoprotéines : les lipoprotéines de très basse densité (VLDL), les lipoprotéines de basse densité (LDL) et les lipoprotéines de haute densité (HDL). Ces particules diffèrent par leur densité, leur composition lipidique (Tableau 1) ainsi que par le type et la quantité d’apolipoprotéines qui y sont associées (Figure 7).
Figure 6. Schémas général d'une lipoprotéine. Tirée de [41]. Tableau 1. Caractéristiques des différents types de lipoprotéines
CM VLDL LDL HDL
Densité (g/mL) < 0.94 0.94 - 1.006 1.006 - 1.063 1.063 - 1.210
Lipides (g/100 g lipoprotéine) 98 – 99 90 – 92 75 - 80 40 – 48
Acylglycérols (g/100 g lipides) 81 – 89 50 – 58 7 - 11 6 – 7
Esters de Cholestérol (g/100 g lipides) 2 – 4 15 – 23 47 - 51 24 – 45
Cholestérol (g/100 g lipides) 1 – 3 4 – 9 10 - 12 6 – 8
Phophoslipides (g/100 g lipides) 7 – 9 19 – 21 28 - 30 42 – 51 Adapté de [42]
La principale fonction des lipoprotéines est le transport des lipides dans l’organisme (Figure 7) [41, 43]. Le transport des TAG d’origine alimentaire vers les tissus est fait par les chylomicrons. Ceux-ci sont formés dans les entérocytes puis sécrétés dans la lymphe avant de rejoindre la circulation sanguine au niveau du canal thoracique. La lipase lipoprotéique (LPL) endothéliale hydrolyse les
TAG contenus dans ces particules en acides gras. Ceux-ci traversent ensuite l’endothélium et entrent dans les cellules sous-jacentes où ils seront réestérifiés et entreposés sous forme de TAG ou encore oxydés pour produire de l’énergie. Au cours de l’hydrolyse des TAG, la taille du chylomicron diminue et le surplus de phospholipides, de cholestérol et de protéines retrouvé à sa surface est transféré aux particules de HDL. Les résidus de chylomicrons sont captés et dégradés par le foie où les acides gras obtenus sont soit oxydés, soit réorganisés en TAG, en PL et en esters de cholestérol pour être sécrétés sous forme de VLDL. Les VLDL sont également constituées de lipides provenant des acides gras emmagasinés dans les cellules adipeuses ou encore des acides gras synthétisés par le foie. Tout comme les chylomicrons, ces lipoprotéines assurent le transport des TAG vers les tissus où ils sont hydrolysés par la LPL alors que les PL, le cholestérol et certaines protéines membranaires sont transférés aux HDL. Les VLDL résiduelles se nomment lipoprotéines de densité intermédiaire (IDL). Certaines IDL sont éliminées par le foie alors que d’autres sont converties en LDL en interagissant avec la lipase hépatique (HL), une enzyme capable d’hydrolyser les TAG et, à plus petite échelle, les PL [44]. Les LDL sont des lipoprotéines enrichies en esters de cholestérol et assurent le transport de ces lipides dans le sang vers les tissus jusqu’à ce qu’elles soient éliminées par le foie. Le transport inverse du cholestérol des tissus vers le foie est quant à lui pris en charge par les HDL. Ces dernières lipoprotéines sont assemblées dans les hépatocytes et les entérocytes et finissent leur maturation dans le sang en captant le cholestérol non estérifié provenant des membranes cellulaires et des autres lipoprotéines. Elles captent également les PL et les protéines larguées lors de la lipolyse des chylomicrons et des VLDL. Le cholestérol situé à la surface des HDL est estérifié grâce à la lécithin:cholestérol acyl transférase (LCAT) puis introduit à l’intérieur de la particule. Les esters de cholestérols ainsi formés sont soit acheminés au foie ou transférés vers les autres lipoprotéines grâce à la protéine de transfert des esters de cholestérol (CETP).
Figure 7. Transport des lipides par les lipoprotéines. Tirée de [45].
1.2.3. Acide arachidonique
Certains lipides et dérivés de lipides jouent un rôle dans la signalisation cellulaire. C’est le cas de l’acide arachidonique (AA), un acide gras polyinsaturé (PUFA) oméga-6 de 20 carbones (20:4ω6) précurseur d’un très grand nombre de molécules bioactives faisant partie de la famille des eicosanoïdes (Figure 8) [46]. Ces molécules régulent de nombreux processus physiologiques et sont impliquées de près dans l’inflammation [47]. Trois voies enzymatiques contribuent à la synthèse des eicosanoïdes: celle des cyclooxygénases (COX), celle des lipoxygénases (LOX) et celle des cytochromes P450 (CYP). Pour initier ces voies de biosynthèse, l’acide arachidonique doit d’abord être libéré des phospholipides par une PLA2. Il existe également une voie non enzymatique menant à
la formation d'autres eicosanoïdes appelés les isoprostanes (isoPs). Cette dernière sera décrite plus en détail ultérieurement. L’acide dihomo-gamma-linolénique (20:3ω6) et l’acide eicosapentaénoïque (EPA, 20:5ω3) sont également des précurseurs des eicosanoïdes.
Figure 8. Voies de synthèse des eicosanoïdes dérivés de l’acide arachidonique. Tirée de [46]. Une partie de l’AA retrouvé dans les tissus et en circulation dans le sang est fournie directement par la diète (entre 100 et 300 mg AA/jour) [48]. L’organisme peut également synthétiser cet acide gras à partir de l’acide linoléique (18:2ω6, LA), un acide gras essentiel qui ne peut être synthétisé chez l’humain et qui doit donc absolument être fourni par l’alimentation. Dans une diète occidentale, entre 10 et 20 g de LA est consommé chaque jour, ce qui représente plus de 85 % des acides gras polyinsaturés ingérés [48, 49]. La conversion de cet acide gras en AA est faite dans plusieurs tissus, mais principalement dans le foie grâce aux enzymes Δ6-désaturase, élongase et Δ5-désaturase
(Figure 9) [50]. Il a été estimé qu’environ 677 mg AA/jour peuvent être synthétisés de cette façon lorsque 20 g LA/jour sont ingérés dans une diète américaine typique [51]. L’acide arachidonique provenant de la diète ou synthétisé à partir de LA est ensuite acheminé aux tissus par le biais des lipoprotéines. Pour parvenir aux tissus moins accessibles par ces dernières, il est transporté en étant lié à l’albumine soit sous forme de 1-lyso-2-arachidonyl-phospholipide soit sous forme d’acide gras non estérifié [48, 52].¸
La catégorie de lipides qui contient la plus forte proportion d’AA est celle des phospholipides [53]. En effet, dans le plasma, l’AA représente 8.3 mol% des acides gras contenus dans les phospholipides alors qu’il représente 5.1 mol% des acides gras estérifiés au cholestérol et 0.8 mol% des acides gras dans les TAG. L’intégration de ce PUFA en position sn-2 des phospholipides se fait principalement lors de leur remodelage (cycle de Lands) plutôt que lors de leur synthèse de novo (voie de Kennedy)
[54-56]. Pour ce faire, l’acide gras en position sn-2 d’un phospholipide quelconque doit préalablement avoir été hydrolysé par une PLA2 avant que le 1-acyl-2-lyso-phospholipide obtenu soit réacétylé avec
l’AA estérifié à la coenzyme A (AA-CoA) grâce à une lysophospholipide acyltransférase (LPLAT).
Figure 9. Conversion de l'acide linoléique en acide arachidonique.
1.2.4. Acides gras trans
Les désaturases sont des enzymes qui insèrent des liaisons doubles dans la chaîne aliphatique des acides gras. Chez l’humain, ces nouvelles liaisons doubles sont seulement retrouvées en configuration cis. Des acides gras insaturés contenant au moins une liaison double en configuration
trans (acides gras trans, TFA) sont toutefois présents dans les différentes classes de lipides de
l’organisme. Ceux-ci proviennent majoritairement de la diète. Ils sont retrouvés naturellement dans les produits laitiers et la viande provenant de ruminants. Ils y représentent 2 à 5 % de tous les acides gras [57]. Ce sont des bactéries situées dans le rumen de ces animaux qui sont responsables de la production des TFA lors de la biohydrogénation partielle des acides gras insaturés. Les TFA sont également produits industriellement lors de l’hydrogénation partielle des huiles végétales. Avant les années 2000, les TFA d’origine industrielle pouvaient représenter entre 40 et 65 % de tous les acides gras contenus dans la margarine et le shortening [58, 59]. Le profil d’isomères de TFA retrouvé dans les aliments dérivés des ruminants (rTFA) diffère beaucoup de celui retrouvé dans les huiles végétales partiellement hydrogénées (iTFA). Dans les deux cas, les acides gras mono-insaturés
trans comptant dix-huit carbones sont les plus abondants [60]. Cependant, les rTFA sont
principalement composés d’acide trans-vaccénique (11t-18:1) alors que l’isomère le plus abondant Acide linoléique (18:2ω6, LA) Acide γ-linoléique (18:3ω6, GLA) Δ6-désaturase Acide arachidonique (20:4ω6, AA) Δ5-désaturase Acide dihomo-γ-linoléique (20:3ω6, DGLA) Élongase
parmi les iTFA est l’acide élaïdique (9t-18:1), suivi de près par le 10t-18:1 et le 11t-18:1 (Figure 10) [57, 60, 61].
Figure 10. Distribution des t-18:1 dans (A) l’huile végétale partiellement hydrogénée (margarine, n = 46 échantillons) et dans (B) le gras de lait de vache (n = 1765 échantillons). Adapté de [57]. Il a été démontré par de nombreuses études que la consommation d’une grande quantité de TFA augmente les risques de maladies cardiovasculaires [62-68]. En effet, ils altèrent le profil lipidique du sang (ex. : augmentation du cholestérol associé aux LDL et diminution du cholestérol associé aux HDL, augmentation du rapport cholestérol total sur HDL-cholestérol) et modifient le niveau d’apolipoprotéines. Ils provoquent également une réponse inflammatoire systémique ainsi que la dysfonction de l’endothélium. Plusieurs études cliniques ont également démontré qu’une consommation plus importante de TFA est associée à une augmentation du stress oxydatif [69-71]. Jusqu’à maintenant, les études portant sur l’impact de la consommation de TFA sur la santé n’ont pas réussi à démontrer clairement si les rTFA (ex. : 11t-18:1) et les iTFA (ex. : 9t-18:1, 10t-18:1, 12t-18:1) sont aussi nuisibles les uns que les autres. En fait, il semble plutôt que les effets néfastes observés sur la santé sont plus liés à la quantité ingérée qu’à l’origine des TFA. Si les rTFA semblent moins dommageables pour la santé, c’est qu’ils sont consommés en moins grande quantité que les iTFA [62, 72, 73]. Cependant, les t-18:2 semblent plus nocifs pour la santé que les t-18:1 alors que les t-16:1 semblent n’avoir aucun impact sur les facteurs de risque des maladies cardiovasculaires [64, 68, 74].
Il a été estimé qu’au milieu des années 1990, les Canadiens consommaient en moyenne 8.4 g TFA/jour, dont 81 % provenait des iTFA [58, 60]. À cause des préoccupations émises au sujet des impacts néfastes de ces gras sur la santé, il est devenu obligatoire à partir de décembre 2005 au
B A
Canada d’inscrire la quantité de TFA contenu dans les aliments sur leur emballage [75]. L’étiquetage nutritionnel obligatoire ainsi qu’une plus grande sensibilisation de la population canadienne ont fait diminuer à 4.9 g/jour leur consommation moyenne de TFA en 2005 [58]. Cependant, cette valeur était nettement supérieure à la quantité recommandée par l’Organisation mondiale de la santé (OMS). Selon l’OMS, les gras trans ne doivent pas représenter plus de 1 % de l’apport énergétique quotidien. C’est-à-dire que pour une diète de 2000 kCal/jour, la quantité maximale de TFA pouvant être ingérée est de 2 g/jour. Afin d’atteindre cet objectif de consommation, un groupe d’étude sur les gras trans a été créé en 2005 par Santé Canada. Celui-ci a remis en juin 2006 son rapport final dans lequel il recommande de limiter la teneur totale en acides gras trans à 2 % de la teneur totale en graisses pour les huiles végétales et les margarines molles et tartinables et de limiter cette teneur à 5 % pour tous les autres aliments, y compris les ingrédients vendus aux restaurants [75].
1.2.5. Acides gras et stress oxydatif
Les radicaux libres générés en période de stress oxydatifs sont hautement réactifs et ils peuvent induire de sérieux dommages aux différents constituants cellulaires comme il a été expliqué précédemment. Les acides gras insaturés sont particulièrement susceptibles à réagir avec eux. Deux réactions sont possibles : la peroxydation lipidique et l’isomérisation cis-trans.
1.2.5.1. Peroxydation lipidique
La peroxydation lipidique est une réaction radicalaire en chaîne initiée lorsqu’un radical (HO•, RO•,
ROO•, ONOO-) vient arracher un hydrogène situé sur la chaîne aliphatique d’un acide gras ou d’un
ester d’acide gras (ex : TAG, PL, ester de cholestérol, etc) pour former un lipide radicalaire (L•)
(Figure 11) [1, 9, 21]. Les hydrogènes les plus susceptibles d’être arrachés sont les hydrogènes bis-allyliques et bis-allyliques puisque le nouveau radical obtenu est stabilisé par résonnance. L’énergie de liaison d’un hydrogène allylique étant plus élevée de 10 kCal/mol en comparaison à celle d’un hydrogène bis-allylique, ce dernier réagira donc plus rapidement [76]. D’ailleurs, plus le nombre d’hydrogènes bis-allyliques est important dans un acide gras ou dans un ester d’acide gras, plus il sera susceptible à être peroxydé [77]. Ainsi, la peroxydabilité d’acides gras communs décroit selon l’ordre qui suit : acide docosahexaénoïque (DHA, 22:6ω3) > acide eicosapentaénoïque (EPA, 20:5ω3) > acide arachidonique (AA, 20:4ω6) > acide linoléique (LA, 18:2ω6). Le lipide radicalaire, L•,
se combine ensuite avec l’oxygène moléculaire (O2), un diradical, pour former un radical peroxyle de
gras et ainsi propager la réaction radicalaire. La réaction est arrêtée grâce aux défenses antioxydantes de l’organisme. Par exemple, l’α-tocophérol retrouvé dans les membranes lipidiques est un inhibiteur de radicaux libres très efficace. En effet, comme mentionné précédemment, LOO•
réagit 1000 fois plus rapidement avec l’α-tocophérol qu’avec les acides gras polyinsaturés qui l’entoure [30].
La peroxydation lipidique génère un vaste éventail de produits pouvant perturber l’organisation des membranes lipidiques, leur fluidité ainsi que leur perméabilité. En effet, L• et LOO• peuvent se
réarranger, se fragmenter, se réduire, se cycliser ou encore réagir avec d’autres molécules de leur environnement (ex. : protéines). Parmi les produits issus de la peroxydation lipidique figurent de nombreux hydroperoxydes et aldéhydes (ex. : malondialdehyde (MDA)) [1, 9]. La cyclisation est un processus particulièrement important pour les LOO• comptant trois doubles liaisons et plus [21].
Ainsi, la peroxydation de l’acide arachidonique peut mener à une série de produits cycliques semblables aux prostaglandines, les isoprostanes (isoPs, Figure 12) et d’isofuranes [9].
Figure 12. Structure des différents types d'isoprostanes dérivés de l'acide arachidonique. Tirée de [9].
1.2.5.2. Isomérisation cis-trans
Les TFA retrouvés dans les différentes catégories de lipides proviennent principalement de la diète. Cependant, il a également été démontré qu’ils peuvent être générés in vivo en présence de stress oxydatif. Ce phénomène a, entre autres, été observé dans les membranes érythrocytaires et les reins de rats âgés nourris avec des aliments ne contenant pas de TFA et exposés au tétrachlorométhane (CCl4), un inducteur de stress oxydatif [78]. En fait, certains radicaux libres catalysent, selon un
mécanisme d’addition-élimination, l’isomérisation d’acides gras cis vers la configuration trans qui est thermodynamiquement plus stable (Figure 13). Plusieurs radicaux sont capables de réagir de cette façon et les plus importants retrouvés in vivo sont les radicaux thiyles (RS•) et le dioxyde d’azote
(NO2•) [78-80]. Par contre, selon les données cinétiques disponibles, les RS• semblent plus efficaces
que le NO2• pour isomériser les acides gras insaturés [79]. Les RS• sont produits en période de
stress oxydatif à partir des thiols (RSH) retrouvés en abondance dans l’organisme (ex. : glutathion). Ces derniers sont des inhibiteurs de la peroxydation lipidique à cause de leur facilité à donner un hydrogène (H•) [22]. NO2• provient quant à lui de sources exogènes (ex. : fumée de cigarette, smog)
et de sources endogènes (ex. : oxydation de NO•, oxydation des nitrites (NO2-), décomposition du
peroxynitrite selon la réaction (5) à la page 3) [81]. Outre l’isomérisation cis-trans, ce radical est également capable de causer la peroxydation et la nitration des lipides [81]. La réaction favorisée dépend beaucoup des conditions du milieu.
Figure 13. Mécanisme général de la réaction d'isomérisation cis-trans induite par les radicaux libres. X• représente n’importe quel radical capable d’induire cette réaction. Tirée de [22].
Un peu comme pour la peroxydation lipidique, plus le nombre d’insaturations est important dans un acide gras et plus celui-ci sera facilement isomérisé [82]. Les TFA obtenus rigidifient les membranes lipidiques et diminuent leur perméabilité. Ils peuvent également modifier le métabolisme des lipides et influencer différentes réactions enzymatiques [79]. Afin de limiter ces effets néfastes, l’organisme peut compter sur des inhibiteurs d’isomérisation tels que la vitamine A, les caroténoïdes et l’α-tocophérol. Ce dernier est cependant moins efficace que les deux autres [83].
1.3. Les F
2-isoprostanes
Afin d’étudier le rôle des ROS dans la physiopathologie de plusieurs maladies, l’utilisation de biomarqueurs est essentielle. En effet, mesurer directement les ROS in vivo est impensable à cause de leur haute réactivité et de l’instrumentation inadaptée. Les lipides sont des cibles faciles pour ces petites molécules et c’est donc pourquoi différents produits issus de la peroxydation lipidique sont utilisés comme marqueur du stress oxydatif. Pendant longtemps, la méthode la plus utilisée a été le dosage du malondialdehyde (MDA) à l’aide de l’acide thiobarbiturique (TBA). Cependant, malgré sa simplicité, cette technique manque de spécificité pour le MDA puisque le TBA peut réagir avec d’autres composés dont plusieurs sont générés lors du traitement des échantillons, menant ainsi à des résultats erronés [84-86]. En 1990, Morrow et son équipe démontrent que la peroxydation non enzymatique de l’acide arachidonique mène à la formation in vitro et in vivo de composés analogues à la prostaglandine F2α (PGF2α) (Figure 14) [87]. Ces composés, nommés les F2-isoprostanes (F2
-isoPs), sont des biomarqueurs très fiables du stress oxydatif comme l’a mis en évidence une étude réalisée en 2005 au cours de laquelle différents biomarqueurs potentiels ont été mesurés dans le plasma et l’urine de rats exposés au tétrachlorométhane (CCl4) [88]. En effet, les F2-isoPs possèdent
de nombreuses qualités leur permettant de jouer ce rôle. Ils sont produits spécifiquement par la peroxydation lipidique, ils sont stables chimiquement et détectables dans tous les tissus et fluides biologiques même en condition non pathologique. De plus, leur concentration augmente en réponse à un stress oxydatif [89]. L’isomère de F2-isoPs le plus utilisé jusqu’à maintenant comme
biomarqueur du stress oxydatif est le 8-iso-PGF2α (Figure 14) [8].
Figure 14. Structures de la Prostaglandine F2α (PGF2α) et du 8-iso PGF2α.
1.3.1. Formation des F2-isoprostanes
Lors de l’initiation de la biosynthèse de PGF2α par la voie des cyclooxygénases (COX), l’acide
arachidonique est d’abord libéré des phospholipides par une PLA2. Bien que les F2-isoPs possèdent
une structure très similaire à ce médiateur lipidique et qu’ils dérivent eux aussi de l’acide arachidonique, les étapes menant à leur synthèse in vivo sont très différentes et n’impliquent pas d’enzymes (Figure 15). Premièrement, la synthèse de ces composés se fait in situ sur les phospholipides et débute par l’abstraction d’un des hydrogènes bis-allyliques de l’acide arachidonique par un ROS [90]. La probabilité d’abstraction de ces hydrogènes situés sur les carbones C7, C10 ou C13 est à peu près la même [9]. Selon l’hydrogène arraché, un radical peroxyle (ROO•) conjugué est ensuite formé par l’addition d’une molécule d’oxygène sur l’un des carbones
suivants : C5, C8, C9, C11, C12 ou C15. L’oxygène peut également s’additionner sur les carbones C7, C10 ou C13 et ainsi former un ROO• non conjugué, mais ce composé est instable. En effet, la
constante de vitesse pour l’élimination de la molécule d’oxygène nouvellement additionné (kβ = 1.9 x
106 s-1) est beaucoup plus grande que celle mesurée dans le cas des ROO• conjugués (kβ = 70 s-1)
[89]. L’étape suivante de la formation des F2-isoPs consiste en une cyclisation 5-exo du ROO•
conjugué alors qu’une deuxième molécule d’oxygène est additionnée pour ultimement mener à la formation d’un bicycloendoperoxyde (Figure 15, avant dernière rangée de molécules). Dans le cas des ROO• où l’oxygène est situé sur les carbones C5 ou C15, le mécanisme de cyclisation est un
peu plus complexe, car ces derniers ne peuvent pas cycliser directement. L’oxygène doit d'abord se détacher de la molécule puis se réadditionner sur les carbones C9 ou C11, respectivement, pour que la cyclisation 5-exo soit possible [91]. Finalement, le bicycloendoperoxyde est réduit et un F2-isoPs
est obtenu.
Figure 15. Mécanisme de formation des F2-isoprostanes. Adaptée de [92].
ROS ROS ROS O2 O2 O2 O2 O2 O2 O2 O2 7 13 10 5 9 8 12 15 11 5 12 8 15 Acide arachidonique
La peroxydation de l’acide arachidonique peut générer 64 isomères de F2-isoPs subdivisés en quatre
classes de régioisomères qui contiennent chacune 8 diastéréoisomères racémiques [89]. Les isomères de classe IV et V sont les moins abondants de tous, car leur précurseur bicycloendoperoxyle peut s’oxyder davantage et mener à la formation de peroxydes dioxolane-isoprostane (Figure 16) [93]. Ceux de classe VI sont les plus abondants, suivis par ceux de classe III [94]. Parmi les isomères de classe III figurent le populaire 8-iso-PGF2α et la PGF2α d’origine non
enzymatique [91]. Par contre, la formation de la PGF2α n’est pas favorisée, car les chaînes latérales
de cet isomère sont en configuration trans par rapport au cyclopentane alors que c’est la configuration cis qui est privilégiée lors de la synthèse des F2-isoPs [91]. Malgré cela, la PGF2α
retrouvée chez l’humain provient d’avantage de la peroxydation lipidique que de la synthèse enzymatique par le biais des COX [9].
Figure 16. Structure d’un peroxyde dioxolane-isoprostane (classe IV). R = -(CH2)3COOH.
1.3.2. Transport et métabolisme des F2-isoprostanes
Les F2-isoPs sont générés in situ en position sn-2 sur les phospholipides (PL) et peuvent être
hydrolysés par l’action de certaines PLA2 dont la PLA2 associée aux lipoprotéines (Lp-PLA2) [90].
D’ailleurs, les PLA2 retrouvées dans le venin de serpent préfèrent cliver les lipides oxydés,
protégeant ainsi les membranes lipidiques des dommages causés par la peroxydation lipidique [95, 96]. Malgré cela, les F2-isoPs circulent principalement estérifiés au PL des HDL dans le plasma [97].
En effet, ils sont quatre fois plus abondants sous forme estérifiée au PL des lipoprotéines que sous forme libre dans le plasma [98]. La Lp-PLA2 est plus active en présence des LDL, ce qui fait de ces
lipoprotéines de moins bons transporteurs d’isoprostanes [97].
La demi-vie du 8-iso-PGF2α libre, le F2-isoPs le plus étudié jusqu’à maintenant, est d’environ 16
minutes chez l’humain [8]. Ce composé, tout comme les autres isomères formés lors de la peroxydation de l’acide arachidonique, est filtré tel quel par les reins et excrété dans l’urine où il est
retrouvé en très grande quantité. Il peut également être métabolisé par le foie. Les principaux métabolites du 8-iso-PGF2α formés sont le 2,3-dinor-8-iso-PGF2α et le
2,3-dinor-5,6-dihydro-8-iso-PGF2α (Figure 17) [99]. Ces derniers composés sont également retrouvés en très grande quantité
dans l’urine.
Figure 17. Structures du 2,3-dinor-8-iso-PGF2α et le 2,3-dinor-5,6-dihydro-8-iso-PGF2α.
1.3.3. Mesure des F2-isoprostanes
Les F2-isoPs sont retrouvés dans tous les tissus et fluides biologiques. Le plasma et l’urine sont les
deux matrices biologiques les plus utilisées pour évaluer le stress oxydatif in vivo, car leur collection est facile et peu ou pas invasive. Certaines précautions doivent être prises lors de l’entreposage et de l’analyse des échantillons de plasma afin d’éviter la peroxydation ex vivo des lipides qu’ils contiennent [98]. En effet, ces échantillons doivent être conservés à -80°C en présence d’un antioxydant comme le hydroxytoluène butylé (BHT) [100]. L’ajout de BHT n’est pas nécessaire pour les échantillons d’urine, car ce liquide biologique ne contient qu’une quantité négligeable lipides. Dans le plasma, les F2-isoPs sont principalement retrouvés estérifiés aux PL et en une plus faible
proportion sous la forme libre [98]. Afin d’évaluer le stress oxydatif, les F2-isoPs libres peuvent être
mesurés, mais aussi les F2-isoPs totaux, c’est-à-dire la somme de ces composés libres et estérifiés.
Dans ce cas, les F2-isoPs doivent être hydrolysés des PL soit par hydrolyse alcaline, soit par
hydrolyse enzymatique à l’aide d’une PLA2 [101]. Dans l’urine, une telle hydrolyse n’est pas
nécessaire. Par contre, en plus des F2-isoPs, mieux vaut y mesurer aussi leurs métabolites dans le
but d’évaluer la peroxydation lipidique endogène réelle puisque cette information peut être faussée par la production locale de F2-isoPs dans les reins [102]. Les concentrations mesurées sont
normalisées en fonction de la quantité de créatinine contenue dans l’urine.
De nombreuses méthodes ont été mises au point pour mesurer les F2-isoPs dans les différentes
matrices biologiques. La première technique à avoir été développée utilise la chromatographie en phase gazeuse couplée à la spectrométrie de masse en mode « ionisation chimique négative » (GC-NICI-MS) [101, 103]. Pour être mesurés par cette technique, les F2-isoPs estérifiés sont hydrolysés
des PL puis extraits de la matrice biologique avant d’être soumis à une dérivation chimique afin de les rendre compatibles avec la chromatographie gazeuse (Figure 18). Cette méthode très sensible mesure les F2-isoPs, c’est-à-dire le 8-iso-PGF2α et les autres F2-isoPs qui coéluent avec ce composé
[104]. L’utilisation de la chromatographie en phase gazeuse couplée à la spectrométrie de masse en tandem (GC-MS/MS) est possible afin d’améliorer la sélectivité de la méthode [105, 106]. Dans le but de simplifier la préparation des échantillons, des méthodes utilisant la chromatographie liquide couplée à la spectrométrie de masse en tandem (HPLC-MS/MS) ont été mises au point. Ces méthodes ne nécessitent pas la dérivation chimique des F2-isoPs. De plus, elles permettent de doser
simultanément les quatre classes de regioisomères et de doser séparément plusieurs diastéréoisomères dans une même classe [107, 108]. Finalement, des méthodes immuno-enzymatiques (ELISA) [109] et radio-immunologiques (RIA) ont également été mises au point [110]. Ces méthodes ne nécessitent pas l’utilisation d’instruments dispendieux comme les GC-MS et HPLC-MS/MS, mais elles sont moins spécifiques à cause des réactions croisées de l’anticorps avec d’autres eicosanoïdes apparentés.
1.3.4. Effets biologiques des F2-isoprostanes
Les F2-isoPs ne sont pas que des biomarqueurs du stress oxydatif, ce sont également des molécules
bioactives. La plupart des études en lien avec la bioactivité des F2-isoPs ont été faites à l’aide du
8-iso-PGF2α. Il a été démontré que ce composé est vasoconstricteur dans la plupart des tissus, dont
l’aorte, le cerveau, les reins et le poumon [111-113]. De plus, il induit la prolifération des cellules musculaires lisses [114]. Il exerce ces actions biologiques principalement en interagissant avec le récepteur du thromboxane A2 (TPR). 8-iso-PGF2α est également un médiateur dans la fonction
plaquettaire [115]. Cette molécule stimule l’agrégation des plaquettes en interagissant avec le récepteur TP mais il peut également inhiber cette agrégation en interagissant avec un récepteur inconnu (ISR, récepteur des isoprostanes) jusqu’à maintenant qui implique l’adénosine monophosphate cyclique (AMPc) (Figure 19) [115, 116]. Enfin, le 8-iso-PGF2α possède d’autres
activités biologiques et entre autres, il peut induire la synthèse de TXA2 dans certains lits vasculaires
tels que les microvaisseaux du cerveau de porc [117].
Les études concernant l’activité biologique des autres F2-isoPs sont limitées. Une étude faite chez le
porc sur des microvaisseaux cérébraux et rétiniens a démontré que d’autres isomères de la classe III, c’est-à-dire 8-iso-15(R)-PGF2α, ent-8-iso-PGF2α et ent-8-iso-15(S)-PGF2α, sont également des
vasoconstricteurs comme le 8-iso-PGF2α. Il en va de même pour les deux isomères de la classe V
qui ont été testés. Cependant, deux des trois isomères de la classe VI testés (iPF2α-VI et 5-iPF2α-VI)
ne possèdent pas d’effets vasomoteurs alors que le ent-iPF2α-VI cause une faible vasoconstriction.
Ces résultats confirment ce qui avait déjà été démontré dans des vaisseaux sanguins humains concernant le iPF2α-VI et le 5-iPF2α-VI [118].
1.4. Grossesse et désordre hypertensif avec protéinurie
1.4.1. La grossesse, un évènement oxydatif
Le placenta est un organe hémochorial qui se développe pendant la grossesse et qui lie la mère à son enfant par le biais du cordon ombilical. Il occupe plusieurs fonctions essentielles au bon développement du fœtus [119]. Premièrement, il assure le transport de l’oxygène, de l’eau et des nutriments de la mère vers le fœtus et expulse le dioxyde de carbone de même que les autres déchets métaboliques vers la circulation maternelle. Ensuite, il protège le fœtus contre les infections et maladies maternelles ainsi que contre certains xénobiotiques. Enfin, il occupe également une fonction endocrine puisqu’il relâche autant dans la circulation sanguine maternelle que fœtale différents types d’hormones dont des œstrogènes, de la progestérone, des facteurs de croissance, des cytokines et des eicosanoïdes.
Le développement du placenta débute 6 à 7 jours après la fécondation de l’ovule [120]. Lors de la placentation, les cytotrophoblastes d’origine fœtales envahissent les artères spiralées utérines où ils remplacent les cellules endothéliales maternelles et détruisent les cellules musculaires lisses sous-jacentes jusqu’au premier tiers du myomètre (Figure 20) [120, 121]. Ces artères ainsi remodelées ont un diamètre au moins quatre fois plus large qu’initialement et ne répondent plus aux stimuli vasomoteurs [121]. Ces nouvelles caractéristiques permettent au placenta de recevoir, à partir du deuxième trimestre de la grossesse, un haut débit sanguin non pulsé et de faible pression [7, 122]. Pendant le premier trimestre, les artères spiralées sont obstruées par un bouchon de

![Figure 2. Système de la thiorédoxine. Adaptée de [24].](https://thumb-eu.123doks.com/thumbv2/123doknet/6698194.184066/27.918.158.792.529.820/figure-système-thiorédoxine-adaptée.webp)

![Figure 6. Schémas général d'une lipoprotéine. Tirée de [41].](https://thumb-eu.123doks.com/thumbv2/123doknet/6698194.184066/32.918.259.621.320.578/figure-schémas-général-lipoprotéine-tirée.webp)
![Figure 7. Transport des lipides par les lipoprotéines. Tirée de [45].](https://thumb-eu.123doks.com/thumbv2/123doknet/6698194.184066/34.918.139.748.118.571/figure-transport-lipides-lipoprotéines-tirée.webp)
![Figure 8. Voies de synthèse des eicosanoïdes dérivés de l’acide arachidonique. Tirée de [46]](https://thumb-eu.123doks.com/thumbv2/123doknet/6698194.184066/35.918.279.697.104.421/figure-voies-synthèse-eicosanoïdes-dérivés-acide-arachidonique-tirée.webp)