HAL Id: dumas-01676203
https://dumas.ccsd.cnrs.fr/dumas-01676203
Submitted on 5 Jan 2018HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Marie-Hélène Jourdan
To cite this version:
Marie-Hélène Jourdan. Ache des marais (Apium graveolens L., Ombellifères). Sciences pharmaceu-tiques. 1989. �dumas-01676203�
AVERTISSEMENT
Ce document est le fruit d'un long travail approuvé par le
jury de soutenance et mis à disposition de l'ensemble de la
communauté universitaire élargie.
Il n’a pas été réévalué depuis la date de soutenance.
Il est soumis à la propriété intellectuelle de l'auteur. Ceci
implique une obligation de citation et de référencement
lors de l’utilisation de ce document.
D’autre part, toute contrefaçon, plagiat, reproduction illicite
encourt une poursuite pénale.
Contact au SID de Grenoble :
bump-theses@univ-grenoble-alpes.fr
LIENS
LIENS
Code de la Propriété Intellectuelle. articles L 122. 4
Code de la Propriété Intellectuelle. articles L 335.2- L 335.10
http://www.cfcopies.com/juridique/droit-auteurANNEE: 1989
U.F.R. DE PHARMACIE Domaine de laMerci -La Tronche
TITRE DE LATHESE
Ache
des
mara
is
(Apium graveolensL. -Ombellifères)
THE SE
Présentéeàl'UniversitéJoseph FOURIER GRENOBLE I pour obtenir legrade de: DOCTEUR EN PHARMACIE.
PAR
Mlle Marie-Hélène JOURDAN
Cette thèseserasoutenue publiquement le: 23 Octobre 1989
Devant Mme leProfesseur A. M. MARIOTTE : Président du Jury et
Mlle leProfesseur J. ALARY Mme S. CUNY :
[Données à caractère personnel]
UNIVEUSI'I'E JosephFOURIER GRENOBLE1 ·Sciences Technologie Médecine
·.
ANNEE: 1989
U.F.R. DE PHARMACIE Domaine de laMerci- La 'fronche
Ill 11111111111111111111111111
115 005476 8
TITRE DE LATHESE
Ache
des
mara
is
(Apium graveolens L. -Ombellifères)
THE SE
N°D'ORDRE:
Présentéeàl'UniversitéJosephFOURIER GRENOBLE 1 pour obtenir legrade de: DOCTEUR EN PHARMACIE.
PAR
Mlle Marie-Hélène JOURDAN
Cette thèseserasoutenuepubliquement le:23 Octobre 1989
Devant Mme leProfesseur A. M. MARIOTTE : Président du Jury et
Mlle leProfesseur J. ALARY Mme S. CUNY :
[Données à caractère personnel]
A mes parents A mon frère en témoignage de mon affection
2
-A Madame -A.M. M-ARIOTTE, qui m'a fait l'honneur
d'accepter la présidence de cette thèse, qui a su m'aider et me conseiller au cours de ce travail,
A Mademoiselle J. ALARY, qui a accepté de faire partie du jury,
A Madame
S.
CUNY, pharmacien, qui m'a fait découvrir la vie professionnelle à l'officine, ainsi qu'à tous ceux qui m'ont fait bénéficier de leur expérience,4 -PLAN INTRODUCTION
BOTANIQUE :
1 GENERALITES SUR LES OMBELLIFERES 1.1 Place dans la systématique
1.2 Répartition géographique 1.3 Morphologie 1.3.1 L'appareil végétatif : 1.3.2 L'appareil reproducteur 1.4 Caractères anatomiques 1.5 Classification
2 ETUDE DE L 1 ACHE DES MARAIS
2.1 Etymologie 2.2 Description 2.3 Répartition géographique 2.4 Culture et récolte 2.5 Confusions p. 14 p. 17 p. 17 p. 17 p. 17 p. 18 p. 18 p. 19 p. 25 p. 27 p. 28 p. 28 p. 29 p. 33 p. 34 p. 35
COMPOSITION CHIMIQUE p. 40 1 PARTIES AERIENNES (TIGES ET FEUILLES) : p. 40 1.1 L'huile essentielle 1.1.1 Monoterpènes : 1.1.2 Sesguiterpènes 1.1.3 Phtalides : 1.1.3.1 Structure : a - Phtalides aromatiques b - Dihydrophtalides : c - Tetrahydrophtalides d - L'acide sédanonique 1.1.3.2 Méthodes d'étude 1.1.4 Phénylpropanoïdes 1.1.5 L'arôme du céleri 1.2 Flavonoïdes 1.2.1. L'apioside ou apiine 1.3 Furocoumarines : 1.3.1 Structure 1.3.2 Méthodes d'études 1.3.3 Furocoumarines et phytoalexines 1.4 Composés divers p. 40 p. 40 p. 40 p. 40 p. 41 p. 41 p. 42 p. 43 p. 44 p. 44 p. 46 p. 47 p. 50 p. 50 p. 50 p. 50 p. 52 p. 56 p. 60
6 -2 FRUITS p. 60 2.1 L'huile essentielle p. 60 2.1.1 Terpènes : p. 61 2.1.2 Phta1ides : p. 61 2.1.3 Phény1propanoïdes p. 61 2.2 Acides phénols p. 61 2.3 Acides gras p. 62 2.4 Flavonoïdes p. 63 p. C:-:1 VJ 2.4.1 Apigérine et 1utéoline
2.4.2 Isoguercitrine ou guercétine 3.0. glucoside p. 64
.,
J:: Furocoumarines p. 64 ~.
..; 2.5.1 Isopimpinelline ~...
isoimpératorine p. 64 t:\.. 2.5.2 Apiumétine et rutarétine.
.
p . 65 2.5.3 Célereoside.
.
p . 66 2.6 Coumarines p. 67 2.6.1 Célerine : p. 67 2.6.2 Apigravine p. c:o vo 2.6.3 Osthénol.
.
p • 68 2.6.4 Umbelliferone p. 68 2.7 ALcaloïdes p. 693 RACINES : 3.1 L'huile essentielle 3.1.1 Terpènes : 3.1.2 Phtâlides : 3.1.3 Composés polyâcétyléniques 3.2 Flâvonoïdes 3.3 Dérivé de l'ândrostène 3.4 Mucopolysâcchârides p. 69 p. 69 p. 70 p. 70 p. 72 p. 72 p. 72 p. 73
8
-PHARMACOLOGIE 1 ACTIVITE DIURETIQUE 2 ACTIVITE HYPOTENSIVE :
3 EFFETS SUR LE SYSTEME NERVEuX : 3.1 Historigue 3.2 Activité sédative p. 75 p. 75 p. 76 p. 77 p. 77 p. 79
3.2.1 Activité sédative de l'huile essentielle de graines d'ache :
3.2.2 Activité sédative de la fraction d'alcaloïdes :
3.3 Activité anticonvulsivante
3.3.1 Activité anticonvulsivante de l'huile
p. 79
p. 80
p. 82
essentielle de graines : p. 82
3.3.2 Activité anticonvulsivante de la fraction d'alcaloïdes :
3.4 Neurotoxicité aiguë
4 ACTIVITE ANTIINFLAMMATOIRE : 4.1 Principe
4.1.1 Test au carraghenane :
4.1.2 Test sur l'oreille de souris
p. 83 p. 85 p. 86 p. 86 p. 86 p. 86
4.2 Résultat
5 ACTIVITE ANTICOAGULANTE : 6 ACTIVITE SUR LA SPERMATOGENESE : 6.1 Protocole : 6.2. Discussion p. 87 p. 90 p. 91 p. 91 p. 92
10 -UTILISATIONS EN PHYTOTHERAPIE 1 UTILISATIONS TRADITIONNELLES 1.1 Usage interne 1.1.1 Alimentaire : 1.1.2 Diurétique
1.1.3 Apéritive, digestive, cholagogue 1.1.4 Fébrifuge :
1.1.5 Affections pulmonaires chroniques 1.1.6 Laxatif, anthelminthigue
1.1.7 Aphrodisiaque 1.2 Usage externe
2 PRESCRIPTIONS ACTUELLES EN PHYTOTHERAPIE 2.1 Usage interne
2.1.1 Affections rénales :
2.1.2 Affections pulmonaires chroniques 2 .1. 3 Obésité :
2.1.4 Inappétence 2.1.5 Spécialité
3 AUTRES UTILISATIONS 3.1 Préparation de pâtes dentifrices
p. 103 p. 103 p. 103 p. 103 p. 104 p. 105 p. 105 p. 105 p. 106 p. 106 p. 107 p. 108 p. 108 p. 108 p. 109 p. 109 p. 109 p. 109 p. 110 p. 110
TOXICOLOGIE p. 112 1 PHYTOPHOTODERMATOSES p. 112 1.1 Définition p. 112 1.1.1 La réaction phototoxigue : p. 112 1.1.2 La réaction photoallergigue p. 113 1.2 Cas du céleri : p. 114
1.3 Identification des composés responsables des
phytophotodermatoses : p. 119
2 PRODUCTION D'AFLATOXINES B1 PAR LE CELERI, CONTAMINE PAR UNE MOISISSURE ASPERGILLUS FLAVUS :
p. 123
3 ACCUMULATION POSSIBLE DE METAUX LOURDS (Cu, Pb) PAR LES PARTIES AERIENNES DU CELERI : p. 126
4 ABORTIF : p. 129
Dans le cadre de l'avis aux fabricants 86/20 bis de 1986, concernant les demandes d'autorisation de mise sur le marché de spécialités pharmaceutiques à base de plantes,
cent quinze plantes peuvent bénéficier d'un dossier allégé. Ce travail est une mise au point bibliographique sur une plante qui pourrait entrer sur une liste additionnelle. Il s'agit de l'Ache des Marais : Apium graveolens L
appartenant à la famille des Ombellifères.
Cinq aspects de cette plante sont traités - botanique,
- chimique,
- pharmacologique, - thérapeutique, - toxicologique.
Les objectifs de ce travail sont de permettre une connaissance précise de cette plante et de définir son
intérêt en tant que phytomédicament, en tenant compte de ses propriétés pharmacologiques et toxiques.
Plante condimentaire, l'ache ainsi que le fenouil et le coriandre furent cultivés très tôt par les hommes devenus sédentaires. Les Egyptiens l'utilisaient dans l'embaumement des momies en l'associant à d'autres épices et aromates. Les
Grecs, héritiers de la civilisation pharaonique, se servaient des Ombellifères en thérapeutique ; en
15
-particulier, ils indiquaient l'ache comme aphrodisiaque. Les médecins arabes étudièrent beaucoup ces plantes et sont à l'origine de l'invention du sirop des cinq
racines, composé de fenouil, d'ache, d'asperge, de petit houx et de persil.
Au Moyen-Age, en France, Charlemagne recommande de cultiver, dans les fermes du domaine impérial et autour des monastères, des plantes médicinales et condimentaires. La Renaissance fut marquée par la consommation presque abusive en cuisine, des épices et condiments, destinés à parfumer une sauce, relever une viande (26,45).
A l'heure actuelle, bien que peu employée en
thérapeutique, l'ache est cultivée dans le monde entier sous le nom ''de céleri" (11).
Appréciées en cuisine, les feuilles de céleri sont utilisées en salade, ragoût, accompagnent les plats de poissons, alors que les graines servent de condiments destinés à exalter le goût de certains aliments (16).
Cependant, des accidents graves peuvent se produire lors de confusions avec des Ombellifères toxiques, du groupe des Ciguës.
17
-I GENERAL-ITES SUR LES OMBELL-IFERES 1.1 Place dans la systématique
L'ache des marais appartient à la série des DIALYPETALES CALICIFLORES (15).
La famille des Ombellifères est homogène et se caractérise par :
- une inflorescence en ombelle,
- une fleur régulière à 5 sépales réduits, - 5 pétales,
- 5 étamines alternipétales,
- 2 carpelles soudés en un ovaire infère biloculaire, surmonté de deux styles et de disques nectarifères (stylopodes).
Chaque carpelle ne renferme, en définitive, qu'un ovule bien développé, anatrope pendant, l'autre étant unitégumenté.
Le fruit est un diakène avec graine à albumen charnu, canaux sécréteurs (15).
1.2 Répartition géographique
La famille des Ombellifères compte environ trois cents genres et trois mille espèces. Elles sont surtout répandues dans l'hémisphère Nord, pratiquement inexistantes
sous les tropiques.
Les diverses tribus sont très inégalement répandues et ont chacune leur aire de dispersion propre. Ainsi, les Fêniculoïdes sont surtout européennes, les Hydrocotyloïdes américaines. La région méditerranéenne, l'Asie Mineure, le Turkestan, l'Iran renferment de nombreuses espèces (15).
Etant donné leur intérêt alimentaire, certaines espèces, comme le céleri (Apium qraveolens), ont été
introduites, puis cultivées dans de nombreux pays, notamment la Chine et l'Inde. A l'état sauvage, dans le nord de
l'Himalaya, les collines du Penjab et de l'Uttar Pradesh, l'ache est connue sous le nom d'Ajmud (8).
1.3 Morphologie
1.3.1 L'appareil végétatif
Ce sont des plantes herbacées vivaces, annuelles (cerfeuil), bisannuelles (persil) ou pluriannuelles
(angélique), à tige cannelée et devenue fistuleuse par
résorption de la moelle, pouvant atteindre une taille élevée (Ferula, Angelica). Certaines espèces sont, par contre,
rampantes et filiformes.
L'appareil souterrain pérennant est très varié racine pivotante, rhizome, tubercule.
Les feuilles sont alternes, sans stipules, munies d'une gaine très développée et d'un limbe habituellement
- 19
-pennatiséquéà 1,2 ou 3 degrés (segments parfois larges et dentés, plus souvent encore réduitsàune lame étroite -Daucus-ou même linéaire-foeniculum-)(44).
1.3.2 L'appareil reproducteur
1.3.2.1 Les inflorescences
Ce sont des ombelles terminales ou axillaires avec combinaison fréquente des deux types, sur un même pied.
Les ombelles peuvent être simples, lesrayons
portant directement les fleurs ou plus souvent, elles sont composées, des rayons primaires. soutenant des ombelles secondaires ou ombellules qui, elles, sont florifères.
Les rayons des ombelles sont, en principe, accompagnés,à leurbase, de bractées dont l'ensemble
constitue un involucre. Les ombellules peuventà leur tour,
être entourées de bractées formant des involucelles. Le nombre de rayons de l'ombelle, laprésence ou l'absence de bractéesde l'involucreet de l'involucelle, leurnombre, leur forme sont autant de caractères génériques(15).
~
~ "''---involucre1.3.2.2 La constitution de la fleur : {15,44) Elle est homogène, en dehors des fleurs stériles ou unisexuées, principalement périphériques.
Elle répond à la formule : 5 S + 5 P + 5 E + 2
c.
Les sépales sont à peine visibles, le plus souvent réduits à cinq dents.Les pétales ont un onglet court, un limbe élargi entier, à pointe ordinairement repliée vers l'intérieur. Dans les fleurs périphériques des ombelles, les pétales extérieurs prennent souvent un grand développement, ce qui rend la fleur zygémorphe (Coriandrum).
Les étamines alternent normalement avec les pétales. (Fig. 1).
Le gynécée est réduit à deux carpelles soudés à la coupe florale et formant un ovaire biloculaire et infère. Chacune des loges renferme un ovule anatrope pendant bien développé et un second ovule qui s'atrophie. L'ovaire est
surmonté de deux styles divergents à stigmates globuleux. A la base des styles, la face dorsale des carpelles se renfle en forme de deux disques nectarifères appelés stylopodes
Ovaire biloculaire réceptacle
Carpelle
stigmate style
21
-'2
5
ï
F1o. "1 . - Fleurs et Inflorescences d'Ombellifères. (.if5}
1-2. Diagrammes llo raux: 1. Ombelhtere a sepales bien développés (Astrantia) ; 2. Ombellifère à sépales rudimentaires (cas général); 3. Eryngium campestre : fleur à sépales développés; 4. Coriandrum sativum : pétales bifides: 5. Orlaya grandiflora : fleur du bord de l'inflorescence : le pétale extérieur est très grand. 6-8. lnflon;sccn-ccs; 6. Petagnia saniculifolia : cymes bipares ; 7. Hydrocotyle : cyme biparc triflorc ; 8. Astrantia major : inflorescence simulant un capitule.
~
~~ ~
Ovule anatrope
Microp ..yle
1.3.2.3 Le fruit (15)
C'est un diakène, ou mieux un double méricarpe, où laparoi du fruit est en réalitéconstituée par labase des verticilles floraux externes et par laparoi des carpelles.
Les deux méricarpes, habituellement soudés et
surmontés des restes du style, se séparent bientôt de bas en haut d'une columelle centrale qui lesmaintient unis et, qui àson tour se délamine de haut en bas.
En coupe transversale, laface dorsale de chaque méricarpe présente cinq faisceaux vasculaires périphériques qui, avec letissuqui les entoure, font saillieàla
surface du fruit.
On distingue ainsi extérieurement cinq côtes primaires longitudinales, entre lesquelles peuvent se
développer d'autres côtes, souvent plus volumineuses que les premières et non vascularisées : ce sont les quatre côtes secondaires. Les dépressions qui séparent les côtes
- 23
-primaires portent lenom de vallécules, où l'ontrouve habituellement une ou plusieurs poches sécrétrices.
Les deux méricarpes peuvent se juxtaposer par une
~ largeou étroite : laforme générale du diakène
en dépend et l'ondistingue des fruitscylindriques comme ceux du coriandre, comprimés dorsalement, parallèlementàla cloison qui devient trèslarge (Angélique} ou latéralement, perpendiculairement à lacloison qui devient étroite
(persil, ache, ciguë).
La graine présente un tégument trèsmince, un
albumen à parois souvent épaisses, cornées et un embryon de petite dimension à cotylédons inégaux. Les substances de réserve consistent en mannanes et galactannes, en
gouttelettes huileuses et en grains d'aleurones contenant des globoïdes ou des cristaux d'oxalate de calcium sous forme de macles. Fig. 2.
0 c
~
a o ~ ('.Ill. () F1c.Z .- Fruits d'Ombellifères.(.-15}1.Fru1t montrant la separationàmaturité des deux mencarpcs :2·3. Hnlrvcvryle vulgaris :fruit comprimé
~ : -'-5.Coriandrum sarivum :fruit cylindrique avec arc ~ dans le mésocarpe. sans canaux
sécréteursàmaturite: 6-7.Pirnpinel/a anisum:fruit arrondi.ànombreuses bandelettes:8.Ange/ica syl1·esrris:fruit comprimé sur le dos, côtes marginales ailées. nombreuses bandelettes : 9.Fœniculum du/ce ;10.Cuminum crminum :côtes secondaires garnies de poils :11. Carum Caf'l·i :12. Daucus Carora cc> tc< ,,.,·,,ndairc'1 ~
>ai liantes: sn{. stylopode :c.d...:ôte dorsale :c. /..nit.: ~ :c. '"·..:ote mart!'''·'k ' '1. f.,;,, o u
25 -1.4 Caractères anatomigues (15)
Les Ombellifères présentent de nombreux caractères anatomiques spéciaux.
1.4.1 Tige
- pas de formation secondaire subérophellodermique ; l'épiderme sera donc toujours persistant,
- les faisceaux cribrovasculaires sont de taille inégale (les petits sont des traces foliaires), réunis par un cercle de sclérenchyme,
la moelle est résorbée de bonne heure, ce qui donne une tige fistuleuse. Parfois, la moelle est plus ou moins persistante et possède des faisceaux cribrovasculaires supplémentaires (Ferula, Oénantha),
- les faisceaux de collenchyme sous-épidermiques, saillants à l'extérieur, donnent un aspect cannelé à la tige.
1.4.2 Racine
La racine primaire est remarquable par l'existence de deux faisceaux libéroligneux seulement, se rejoignant au centre en une lame unique. Les racines secondaires qui
normalement devraient naître dans le péricycle, en face de ces deux faisceaux, en sont empêchées par la présence, à ce
1.4.3 Le tissu sécréteur :
Il est représenté par des canaux sécréteurs à
oléorésine que l'on trouve dans tous les tissus de la tige et de la racine sauf dans le xylène et le parenchyme
cortical où ils sont protégés par un faisceau de collenchyme sous-épidermique. On en trouve aussi dans le parenchyme de la moelle de la tige, quand il n'est pas résorbé.
Le fruit possède deux sortes de canaux sécréteurs a) des canaux ordinaires, accompagnant chaque
faisceau ligneux et en continuité avec ceux de la tige, mais ces canaux sont habituellement écrasés et impossibles à
voir,
b} des canaux courts ou bandelettes limités à la paroi du fruit. Il y en a habituellement un par vallécule dans certains cas, ils disparaissent à maturité du fruit, par écrasement (ciguë, coriandre) alors que d'autres espèces possèdent un très grand nombre de bandelettes dans la paroi du péricarpe (anis, angélique ... ).
Côte Côte Endocarpe Epicarpe Faisceau libéroligneux Albumen Canaux sécréteurs Coupe schématique d'un méricarpe
- 27
-1.5 Classification
Elle est basée sur lescaractères du fruitet de l'organisationdes ombelles et du fruit (14).
(D. BACH, M. ~ G. DEYSSON, 1967).
Hydrocotyloïdées : ombelles simples. Pas de canaux sécréteurs dans lesvallécules.
- Hydrocotylées Hydrocotyle.
fruitcomprimé latéralement
- Saniculées : fruitsensiblement cylindrique Sanicula, Eryngium, Astrantia.
Féniculoïdées : ombelles composées, bandelettes dans lesvallécules, pas de côte secondaire.
- ~ : fruit comprimé latéralement
Apium, Carum, Petroselinum, Pimpinella, Anthriscus, - Sesélinées
comprimé sur ledos,
fruit cylindrique ou faiblement Foeniculum, Ligusticum, Angelica, Archangelica, Oenanthe, Aethusa, Meum.
- Peucédanées trèsaplati,
fruit trèscomprimé sur ledos et Ferula, Anethum, Heracleum, Pastinaca.
Daucoïdées : ombelles composées, bandelettes dans lesvallécules, côtes secondaires,
Caucalinées : côtes secondaires obtuses, Coriandrum, Cuminum, Daucus, Caucalis.
Laserpitiées : côtes secondaires toutes (ou les latérales) très larges,
Laserpitium, Thapsia.
Guinochet, dans la Flore de la France (29) propose, pour l'identification des espèces, des clés basées sur les caractères de la plante adulte, de la plantule et des
fruits.
2 ETUDE DE L'ACHE DES MARAIS (Apium graveolens L) 2.1 Etymologie
Apium, nom cité par Virgile, viendrait du celtique
11Apon11 signifiant 11eau11, car l'ache est une plante aimant le
voisinage de l'eau.
Graveolens vient de grave : fortement et olens odorant par l'intermédiaire de apcha et apche (26).
Dans le nord de la France, ce même terme vient de "apis" (abeille) (8).
Noms vernaculaires (27)
Fr ache, ache des marais, céleri, persil des marais,
29
-ALL Sellerie, Appich, Seller,
Angl celery, Alexander's scurvy grass, Ach, Esp apio, apio commun, apio palustre,
Ital Apio, Apio palustre, Sedano, Sesano. 2.2 Description
2.2.1 De l'ache (27, 44)
L'ache est une plante herbacée bisannuelle à tige dressée, cannelée et creuse, mesurant de vingt à
quatre-vingt centimètres de hauteur (Fig. 3).
Les feuilles vertes foncées sont luisantes, assez épaisses : celles de la base pétiolées sont découpées en cinq segments ovales plus ou moins lobés et dentés, celles du sommet sessiles sont réduites à trois segments étroits portés par une gaine mince, liserée de blanc.
Les rameaux se terminent par des ombelles de fleurs blanc-verdâtre qui apparaissent de juillet à septembre.
Les ombelles presque sessiles sont formées de six à douze rayons très inégaux sans involucre et involucelle.
Les fruits petits, globuleux, bruns, glabres
présentent des côtes blanchâtres peu saillantes et. une ou deux bandelettes par vallécule Fig. 4.
Fig. 3 :
APIUM GRAVEOLENS, LINN.
(Indian medicinal plants Part II) BD Basu, Ims Delhi 1975
31
-Fig. 4 :
Fruit d'Apium graveolens
1 - Schéma du double méricarpe
2 - Coupe transversale d'un méricarpe
3 - Fruit à maturité montrant la séparation des deux méricarpes
De nature spongieuse, la souche et les racines d'ache sont composées d'un pivot de six, sept centimètres dont la surface est ornée de stries circulaires serrées, portant des racines latérales de grosseur variable,
tortueuses et ridées, de couleur gris brun, recouvertes d'un liège peu adhérent Fig. 5 (27).
Fig. 5 : ~
Représentation de la racine d'ache Caractères anatomiques
La section transversalede lasouche montre sous le suber peu adhérent, un tissuspongieux où l'ondistingue la région corticale jaune fauve, nettement ponctuée et lebois blanc-jaunâtre, marqué de stries transversales (47).
La souche radicante est inscriteàlaIX ème édition
de lapharmacopée française (27)
L'examen des segments foliaires terminaux et de la section transversaledu pétiole peut être utile pour déceler
- 33
-A
-Fig. 6: ~
1) Représentation des segments foliaires terminaux. 2) Coupe transversaledu pétiole.
2.2.2 Du céleri
Le céleri est une variété d'ache améliorée par des sélections répétées. Il présente de nombreuses variétés parmi lesquellesnous pouvons citer les deux principales
- lavariété dite dulce, qui est le céleriàcôte, caractérisée par des pétioles pleins et charnus,
- lavariété rapaceum ou céleri-rave, chez lequel lespétioles foliaires s'élargissent et s'épaississentàla base, se rapprochant lesuns des autres, pour former un
pseudo-tubercule (44).
2.3 Répartition géograPhique (27)
Le céleri se localisesurtout dans les sols
de la Manche, de l'Océan, de la Méditerranée et dans les sources salines de l'intérieur des terres.
Il en est de même sur presque toutes les côtes d'Europe, en Asie occidentale, en Afrique, ainsi qu'en Amérique.
2.4 Culture et récolte (27)
L'ache se sème, au printemps, sur couche (ou en pleine terre) : la plante germe lentement.
Dès l'apparition de quelques feuilles, on repique en pépinière sur couche, puis en place, vers la fin de Mai. On choisira un sol humide, bien fumé (tourteaux d'arachide, engrais composés) et on espacera les plants de trente centimètres, en lignes distantes de cinquante centimètres environ.
L'arrachage a lieu en Octobre, à la fin de la première année, sans attendre la floraison et la
lignification partielle des racines. Celles-ci sont lavées, sélectionnées, parfois fendues. On les sèche de préférence à l'air chaud.
S'il s'agit de récolter les graines, on coupe les plantes mûres au ras du sol, du 15 Juillet au 15 Août et on les laisse sécher deux ou trois jours sur place, avant de les fouler au rouleau ou à la batteuse.
35
-2.5 Confusions :
Le céleri peut être confondu avec l'Oenanthe
safranée (Oenantha crocata) qui possède une odeur proche de celui-ci.
L'Oenanthe est une plante vivace d'un mètre à un mètre vingt qui abonde, à basse altitude, dans l'ouest de la
France (Bretagne, Anjou, Vendée) en Italie, en
Grande-Bretagne dans les prairies humides et au bord des cours d'eau.
La tige creuse est sillonnée et porte des feuilles deux à trois fois divisées en segments découpés et dentés. Les feuilles semblables, lorsqu'elles sont jeunes, à celles du persil, puis adultes, à celles du céleri, peuvent être
reconnues à l'examen des segments foliaires terminaux et de la section transversale du pétiole Fig 7.
Les fleurs blanches ou rosées sont disposées en ombelles de quinze à trente rayons.
La souche est formée de tubercules fusiformes, ayant l'aspect d'une botte de navets, remplis d'un latex jaune. Sa forte odeur vireuse s'atténue par séchage.
Le principe toxique le plus important est l'oeanthotoxine provoquant des symptômes narcotiques,
c'est-à-dire une violente irritation du tube digestif et des manifestations nerveuses (tressaillements, convulsions,
Fig. 7 : Confusions éventuelles (27)
1) Schéma de l'Oenanthe safranée (Oenantha crocata). 2) Représentation des segments foliaires terminaux. 3) Coupe transversale du pétiole.
37
-Mais les racines de céleri peuvent aussi être
confondues avec celles de la ciguë vireuse (Cicuta virosa). Cette dernière se reconnaît aux alvéoles superposées dont elle est creusée.
Les feuilles caractéristiques sont d1un vert sombre.
Les feuilles inférieures à long pétiole tuberculeux sont complètement divisées, deux à trois fois, en segments lancéolés aigus, bordés de dents acérées ou formées de lanières étroites, quand elles sont flottantes (dans les marécages, mares, étangs). On peut examiner avec profit les segments foliaires terminaux et le contour transversal du pétiole Fig. 8.
Si les tiges et les feuilles de ciguë vireuses
semblent inoffensives, le tubercule occasionne de dangereux empoisonnements. Le principe toxique, la cicutoxine (isomère de 11oenanthotoxine) provoque, chez l 1homme, nausées,
vomissements, douleurs abdominales, diarrhées, convulsions, crises tétaniques, pouls et respiration accélérés, coma et mort en quelques jours (27).
~
3
-
4
-Fig. 8 : Confusions éventuelles (27)
1) Schéma de laCiguë vireuse (Cicuta virosa).
2) Fruit de ciguë pourvu de cinq dents calicinales accrues et des deux styles avec d'épaisses côtes primaires
blanchâtres.
1 PARTIES AERIENNES {TIGES ET FEUILLES) 1.1 L'huile essentielle : (0,1 %)
De composition proche de celle des fruits, elle est constituée de (19, 20}
1.1.1 Monoterpènes (77 %)
Notamment
- le myrcène (tige 11 %, feuilles 34 %), - limonène (tige 37 %, feuilles 26 %}, - cisocimène (tige 18 %, feuilles 14 %). 1.1.2 Sesguiterpènes : (9 %)
Surtout le B selinène (tige 2 %, feuilles 3 %).
1.1.3 Phtalides
Ce sont les constituants les plus intéressants puisque, seulement une quinzaine de familles botaniques
accumulent ce type de composés, sous forme substituée ou non en position 3.
Dans la grande famille des Ombellifères, les membres de la sous-famille des Apiacées sont spécialisés dans
l'élaboration de phtalides et apparentés C3 substitués par une chaîne en C4 (alkyle ou alkylidène de configuration Z).
- 41
-Le terme "phtalide" désigne, en fait, des molécules qui dérivent de l'acidephtalique
:ÇJÇ>.
(14).Phtalide ouisobenzofuranone
On lesclasse en quatre sous-groupes, selon ledegré de saturation du noyau aromatique :
- lesphtalides aromatiques, - lesdihydrophtalides,
- lestétrahydrophtalides, - leshexahydrophtalides.
1.1.3.1 Structure
L'ache des marais contient : (61). a - Phtalides aromatiques : - hydrocarbures :
R chaîne alkyle en 3
11
butyl 3 phtalide.
R : chaîne alkylidène en 3 ~ 3 phtalide
isobutylidène. 3 phtalide isopentylidène. 3 phtalide - phénoliques : R chaîne alkyle
f
HO):A
U(
dihydroxy 4,5. butyl. 3 phtalide b - Dihydrophtalides
- hydrocarbures : R chaîne alkyle
dihydro 4,5 butyl. 3 phtalide (séàanenolide ou senkyunolide) R : chaîne alkylidène
43
-dihydro 4,5. butylidêne. 3 phtalide (ligustilide)
dihydro. 3a, 4 isobutylidêne. 3 phtalide
Dihydro. 3a, 4 isopentylidène. 3 phtalide
c - Tetrahydrophtalides :
Le noyau aromatique est remplacé par un cyclohexane.
R : chaîne alkyle
tétrahydro 3a, 4, 5, 6 butyl. 3 phtalide (neocnidilide ou sédanolide).
d - L'acide sédanonique
Certains composés, malgré l'absencedu noyau lactonique pentagonal se rapprochent de lastructure des phtalides. C'est lecas de l'acidesédanonique:
1.1.3.2 Méthodes d'étude (51) a - Extraction etpurification :
Les tigesde céleri cultivé sont broyées jusqu'à obtention d'une masse homogène, en présence d'eau glacée. Puis l'homogénat est extrait par lechlorure de méthylène (lesextractions sont conduites de manière parallèle avec un étalon internechoisi comme référence : lebutylidène
phtalide).
L'extrait contenant lesphtalides est purifié sur colonne de siliceet lesphtalides sont élués par lemélange chlorure de méthylène- méthanol (0,5%). Le solvant est évaporé sous un courant d'azote et lerésidu est dissous dans lechlorure de méthylène anhydre. Les échantillons sont conservés à-20~ jusqu'à l'analyse.
- 45 -b - Séparation :
Les phtalides sont séparés par chromatographie liquide, haute pression (HPLC)à 25
ac
,
sur colonne ZorbaxSil (Dupont, Wilmington, DE).
La phase mobile est composée de chlorure de méthylène anhydre.
Les molécules sont détectées sous UV à lalongueur d'onde de 256nm, correspondantàl'absorption
caractéristique des phtalides.
La ~ en phtalides est déterminée par l'airedes pics, exprimée en grammes de solides totaux.
Fig. 9 : (51)
~ ~
-- ----n---
~---
~i
1
TRANS-BUTYLIOENE PHTHALID€ 1
1 ' E
~
~
~ z ...: co 0:: 0 1/) co <il
CIS -BUTYLIOENE PHfHALID€li
l1 1: !:d
1il' 1 i: :_\· j: ' ' 1~~~~
1 BUTYL PHTHALIOE ,, i~
~
/. 1~
\ 1~~
U
SéOAI'OliD€ r---,---,---,r----, 10 20 30 40 0 Tl ME (MINUTES1Séparation des phtalides par HPLC, lebutylidène phtalide, servant d'étalon interne. L'absorbance de chaque composé est mesurée à lalongueur d'onde : 265nm.
c - Identification
Les échantillons de phtalides sont collectés et analysés par un spectromètre de masse (GC/MS) reliéà la colonne de lachromatographie gazeuse, en silice3%SE 57.
Un programme de température s'échelonnant de 80° C à 200° C (àraison d'une progression de 6° C/mn) est
sélectionné.
1.1.4 Phényl propanoïdes (43)
Composés volatils, isolésaussi à partir des
feuillesde persil (Pétrpselinum sativum), ilspourraient être considérés, par extension, comme caractéristiques des Ombellifères, dans lamesure où ilssont peu répandus, chez
lesautres espèces végétales. Ainsi, ont été décelés : (43). - l'apiole(23%)
~
l
.-0"
OMe CH1CH=CHl - lamyristicine (2%), connue comme étant leprincipal composé hallucinogène de lanoix de muscade (42).
~
Meü 0
.-0
- 47
-1.1.5 L'arôme du céleri (43)
De récents travaux, conduits par Mac Leod (1988) sur une variété de céleri (Apium graveolens L) d'origine
libyenne, ont permis de mettre en évidence lescomposés volatils, responsables de lasaveur aromatique de la plante .
1.1.5.1 Méthode
Des échantillons de céleri frais sont recueillissur lesmarchés locaux de Brack (Libye) et l'extraitconcentré par distillation à lavapeur d'eau, s'avère posséder une forteodeur caractéristique. L'échantillon est ensuite purifié par chromatographie, sur colonne de siliceet les constituants identifiéspar spectrométrie de masse.
1.1.5.2 Résultat
De manière quantitative, seulement 17,5~ de
composés aromatiques sont obtenus par gramme de céleri frais.
Au total, 42 composés sont détectés parmi lesquels, seuls 24 sont formellement identifiés (représentant une concentration de 94,4% en poids de l'échantillon).
9 des composés sont mentionnés pour lapremière fois, comme étant volatils et sont indiqués sur laFig. 10 par un(+).
~~ ~ 1!1dl'\ CJ6 ~ ~ t'tllllJ'\11\l'll( NftJ llll\1\1* l\it.lt ~ ~ !1).!. !-! ~ JL' 1:' .\h.1 12 () 21 Ft han,,\ + \." ~ ', 11.1'1 Pentane
...
~ ~ u \1.2(1 But-2-cna\ 2.11 '20 02 11.0-t ~ _q h94 0.5 Il.(}') Hc\anal ~~ 7XO 2.7 \l.-\7Uranchcd chain C"h)dr<lcarhtn1 ' 1 !1.1 11.!12 2-Pcnty1furan 12.5 ')X_1 o.n tl.\\
~ jJl) lll20 1.0 0.\x
~ 1-1.-t \()JO 2.0 ~
4-lsopropcnyl-1-mcthylhenLcnc + 17._1 0.7 0.12 Pcntylhcn/.cne 211.X 0.-l (1()7
-t-l,opropylcyclohcx-2-enone
(Ct}ptonc) + 21 -l \.(1 Il.!X
{'-:-.1cntha-l ~ + 21 '! 2.3 0.-lil {'-:-.kt hylaœtophcnonc
....
~ ~ \l(lh 1.2 () 21 ( ~ 2-l -l 122X tU Il. ~Cany 1 acetate .1-ll U.X tl.\4 /1-Scltncnc .1'.11 2.-l () -l2 \'aicnc·cnc +- ~ ~ ~ Oj 11.11'1 1-Sclincnc + ~ 03 tl.l\5 -l-\kthtl\)-li-( ~ lihcnw-1J-ditn<>lan 1my rtstic·in 1 _\h.l 1.9 11..13 sc,<juitcrpcnnli \1~ 2201 ·'l''-j 11.5 OlllJ Scs<jUttcrpcne J•j"" tU 11.115 ~Hut) lphth,t!idc -l\.2 ~ .1.<)()
-l.7.Dimcthoxy -5-t rrop-2-cny
\1-benzo-l J-dicl\olan lapi,,lcl -\2.1> ~ -l.llh
.\-Hutyltctrahyd rllphthal ide
t-;cdathllidcl -l-l.tl 2-l.-l -l.2~
.1-l:luty1-4.5-dlh) dn,phthal1dc
hc'dancnt>lidci -+-l 2 ~ 11\-l
Fig. 10 (43)
Liste des composés volatiles mis en évidence chez lecéleri par chromatographie gazeuse.
méthode - colonne capillaire en silice, avec comme support, une phase BP1 ou BP 20.
gaz vecteur hydrogène
programme de température 70° C pendant 5 mn puis montée de 3° C/mn jusqu'à 180° C
49
-1.1.5.3 Discussion
Il est intéressant car insolite de noter que trois constituants seulement représentent 70 % de la totalité des composés volatils :
- l'apiole (23 %),
- la myristicine (2 %) contenue surtout dans l'huile essentielle des graines,
ainsi que les alkyles phtalides suivants - butyl3phtalide (22 %),
butyl 3 tetrahydrophtalide ou sédanolide
(24 %).
De plus, trois des nouveaux composés ont aussi été isolés à partir des feuilles de persil à savoir :
- l' isopropenyl - 4 methy1 1 benzène (0,7 %), - l'isopropenyl 4 cyclohexenone- 2 ou cryptone
( 1 % ) ,
- p mentha- triène 1,3,8 (2,3 %).
Parmi les monos et les sesquiterpènes, seuls le B sélinène et le limonène participent surtout à l'odeur aromatique de la plante.
Comme composés terpéniques, on retiendra le carvone et l'acétate de carvyle.
1.2 F1avonoïdes
1.2.1 Hétéroside flavoniaue l'apioside ou apiine
(27,44)
(apigenine - 7 apiosyl glucoside)
Il a été isolé à partir des feuilles de céleri et de persil.
apiosyl-qlucosyl-o OH
0
L'identification est très ancienne, elle utilisait des méthodes d'hydrolyse partielle et l'isolement des
composés se faisait par chromatographie sur papier (5}
1.3 Furocoumarines
1.3.1 Structure
La structure de base est une molécule hétérocyclique résultant de la condensation d'un noyau furane avec un noyau coumarine (18}
R
51
-Le noyau furane est en position 6-7 sur le noyau coumarine, ce qui définit la série linéaire des
furocoumarines.
Parfois, la fusion furane - coumarine a lieu en position 7-8, ce qui donne naissance à la série angulaire des furocoumarines : les isopsoralènes.
0 1.3.1.1 Série linéaire psoralène bengaptène ou 5 MOP OCH3
Xanthotoxine ou
8-MOP
1.3.1.2 Série angulaire isopimpinelline ou 5,8 MOP
1.3.2 Méthodes d'étude (30)
1.3.2.1 Extraction et purification : Les plantes âgées de 2 ans sont récoltées à des périodes variables de l'année et séchées par la chaleur (température constante de 50 C).
Les plantes séchées sont triturées et extraites par le méthanol pendant 48 heures.
L'extrait méthanolique, après concentration, sert à la préparation de l'extrait coumarinique.
1.3.2.2 Séparation et dosage
Deux procédés de chromatographie sur couche mince (CCM) ont été utilisés :
- le premier, pour l'isolement et la caractérisation des nouvelles furocoumarines,
-le second, pour l'évaluation quantitative du bergaptêne, xanthotoxine et isopimpinelline.
53
-L'extrait coumarinique est déposé sur le gel de silice en couche mince, puis placé dans une cuve, en présence de chloroforme.
Après migration, un mélange de substances
comprenant, d'une part la xanthotoxine et l'isopimpinelline (Rf = 0,27) et d'autre part, le bergaptène (Rf = 0,37) est mis en évidence.
Les bandes correspondant à la séparation incomplète de l'isopimpinelline et de la xanthotoxine ainsi que du bergaptène, sont éluées et chromatographiées sur papier Whatman No 1, en présence d'eau, comme solvant migrateur.
Cette méthode permet une purification correcte du bergaptène (Rf : 0,47) et une meilleure séparation de la xanthotoxine (Rf 0,82) de l'isopimpinelline (Rf= 0,76).
Pour le dosage des furocoumarines, la chromatographie suivante est réalisée :
Sur des plaques de gel de silice est déposé en bandes, l'extrait coumarinique puis les plaques sont développées dans le chloroforme.
Les résultats sont : bergaptène xanthotoxine + isopimpinelline
Rf
=
0,37 Rf=
0,27Les deux bandes (celle de bergaptène et du mélange xanthotoxine- isopimpinelline) sont éluées par l'éthanol et les solutions sont utilisées pour le dosage
Le bergaptène est évalué à la longueur d'onde
)\:::. 312 nm.
La détermination quantitative des deux autres furocoumarines est conduite directement sur la solution, contenant le mélange (par la méthode de double lecture) après avoir sélectionné le couple de longueurs d'onde :
À= 272 nm et À = 250 nm.
Les résultats d'absorbance sont
À= 312 nm bergaptène
E=
14 185 xanthotoxineE
=
7 120 À= 272 nm isopimpinellinet=
19 515 À= 250 nm xanthotoxine€.=
23 965 isopimpinellineE:
=
13 290 1.3.2.3 Teneur en furocoumarinesINNOCENT!, DALL'ACQUA (1976) ont étudié la teneur en ces trois furocoumarines chez le persil et le céleri, en fonction de la saison afin de mieux comprendre les
-55
-Herb Colleccion !sot!red furocoumarins(')
monrh Bergapren Xanrhoroxin lsopimpinellin
j:muary 33 37 39
~ 133 60
july 145 61 114
Apium gr.weolens
seprember 101 183 122 december 210 44 3 juh· 1690 24 seprember 2000 95 23 Pctroselimtms.uiuum occober 315 289 79 Fig. 11 : (31)
Concentration en bergaptêne, xanthotoxine et isopimpinel --line, chez l'acheet lepersil.
<"'>Quanti téexprimée en
J
'
g 1gde plante sèche.Le psora1ène, composé de base des furocoumarines, dépourvu de substitution sur lecycle, n'est présent chez aucune des deux plantes et jouerait, par conséquent, le rôle de composé de transition, permettant lasynthèse des
alkylcoumarines (0-alkylation en 8 donnant naissanceàla
xanthotoxine, en 5 au bergaptène et en 5,8àl'isopim -pinelline).
Le persil et lecéleri montrent un comportement similaire pendant l'hiver, laquantité en furocoumarines diminue sensiblement, alors que, pendant lereste de l'année
(surtout l'été), letaux en furocoumarines augmente de manière significative.
En considérant chaque composé successivement, on constate que lebergaptêne, présent en grande quantité
pendant l'été, devient moins abondant, quand la température décline (septembre- octobre).
Par contre, le taux de xanthotoxine et
d'isopimpinelline augmente progressivement, après l'hiver, avec un pic en septembre - octobre.
Ainsi, la concentration maximale en bergaptène coïncide avec la saison chaude, alors que xanthotoxine et
isopimpinelline sont présents en grande quantité un ou deux mois après, ce qui peut s'expliquer de la manière suivante :
la biosynthèse du bergaptène est favorisée, lorsque le temps devient de plus en plus, chaud et régresse en hiver.
Par contre, la synthèse de xanthotoxine et
d'isopimpinelline augmente, même si la température est en baisse (septembre- octobre).
L'hypothèse la plus vraisemblable est qu'une partie du bergaptène, accumulée pendant l'été, peut être convertie en xanthotoxine et isopimpinelline par interconversion
(déméthoxylation en 5 puis 0 - alkylation en 8 pour la xanthotoxine, 0- alkylation en 8 pour l'isopimpinelline).
1.3.3 Furocoumarines et phytoalexines
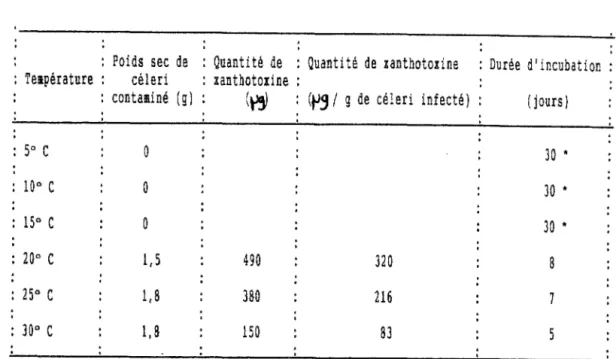
De récents travaux, conduits par BEIER, OERTLI (1983), sur le céleri (Apium graveolens L) ont révélé que les furocoumarines de la série linéaire pourraient être considérées comme des phytoalexines c'est-à-dire que leur synthèse serait favorisée, lorsque la plante est placée dans
- 57
-des conditions de vie difficiles (par exemple, infectionpar un champignon Sclerotinia Sçlerotiorum) (1).
1.3.3.1 Matériel et méthode
Le céleri commercial (Apium graveolens var 5270 R) est traitéde différentes manières, notament par lesulfate de cuivre, facteur connu pour induire la ~ de
phytoalexines.
Les pétioles sont extraits par l'étheret les furocoumarines isolées sont dosées par chromatographie liquide, haute pression.
La concentration en furocoumarines est déterminée vingt-quatre heures,après letraitement par Cu 504.
1.3.3.2Discussion (Fig.12) 20~ 1
1
1 1 5îii li Temp 2°~
~~
o. 11
! 1 1 ,:+-1~ ~ ~
c 0 4(a) Days After Treatment (b) Days After Treatment
Fig. 12 : (1)
Distribution du psoralène(A),bergaptène(+),xanthotoxine (0) et isopimpinelline
<•>
sur une période de quatre jours, chez lecéleri traitépar lesulfate de cuivreà latempérature de 26° C (a) et 2° C (b).
La xanthotoxine est apparemment lecomposé leplus abondant, chez lecéleri sain.
Après 3 jours d'incubationàlatempérature de
26° C, les taux de bergaptène et de xanthotoxine augmentent, tandis que lepsoralène resteàune teneur constante. A la température de 2° C, laconcentration en psoralène croît,à partir du troisième jour, pour atteindre une teneur
équivalente au bergaptène età l'isopimpinelline.
La teneur en psoralène, composé considéré comme le précurseur dans lasynthèse des autres furocoumarines
linéaires, s'accroît considérablement lorsque lecéleri est placéàbasse température, après l'amorce de lasynthèse des
- 59
-transformation du psoralène en alkoxyfurocoumarines,àbasse
températurel
Ensuite, l'incidenced'une concentration variable en Cu 504 sur letaux en furocoumarines est évaluée,
soixante-douze heures après letraitementà26°
c
.
r---~ 100l
,, 1
" 80l
.c J~ ~
Q 40J 1 ~ 1 1 1+'
~ ~ '?0~ ~ ! !0 0: ! 1 ~ j ,.. __<e ----+--J o-r-vT 1 1 ., 1 0 10-· 10-' 10-'i10-3 1 1CuSO, Concentrn11on (M)
Fig. 13 : (1)
,1
/
i
+...
10-'Pourcentage relatifen bergaptène(+)et xanthotoxine(0)
mesuré soixante-douze heures après avoir traitélecéleri par différentes concentrations de Cu 504.
Il apparaît que lasynthèse de phytoalexines est induite,àpartir d'une concentration en Cu 504 de 5.10
M, comme en témoigne l'augmentation linéairedu taux de bergaptène et de xanthotoxine.
1.4 Composés divers
Polyols : mannitol (1,2 %) inositol
Vitamine C : 75 mg/100 g (44)
Stérol : indostérol (0,03 % en poids sec) (39)
L'échantillon de tiges de céleri (900 g en poids frais) est écrasé et homogénéisé pendant cinq minutes dans un litre d'eau distillée.
L'homogénat est filtré, puis centrifugé pendant trente minutes. Le surnageant limpide est lyophilisé et une poudre verte est obtenue (17,8 g soit 20% w/w).
Ensuite, 15 g de cette poudre sont extraits par l'éthanol dans un appareil Soxhlet, pendant deux heures.
L'alcool est éliminé par évaporation et le résidu dissous dans un minimum d'eau.
La séparation phytochimique a permis d'isoler l' indostérol ou hydroxy 3 ~ stigmasta 5oldiene. 9. (11) r 22
(23) se présentant sous forme d'aiguilles incolores. 2 Fruits
2.1 L'huile essenti§lle : (2,5 - 3 %)
2.1.1 Terpènes
61
-(70 - 90 %)
Ils regroupent les monoterpènes comme le limonène (68,5 %), le myrcène (1,2 %) et le terpinolène
(0,1 %) et les sesquiterpènes surtout le B selinêne (8 %) le caryophyllène (0,5 %).
2.1.2 Phtalides :
Ils sont essentiellement composés de butylidène phtalide (8 %) :
- dihydro 3a, 4 isobutylidêne phtalide (6,5 %), - Sédanolide (2,5 - 3 %),
-Anhydride sédanonique (0,5 %), - butyl 3 phtalide (0,2 %),
- Ligustilide (0,2 %).
2.1.3 Phényl propanoïdes surtout (43) - l'apiole,
- la myristicine.
2.2 Acides phénols (36, 21.25) Comme
- l'acide myristicique ou- méthoxy 3 méthylène 4,5 benzoïque,
~ caféïque,
- l'acidechlorogénique et protocatéchique, -l'acidep. OH cinnamique. 2.3 Acides gras : (5 - 27 - 44) composés de : - acide pétrosélinique (51%) CH3 - (CH2)1o - CH
=
CH - (CH2)4=
COOH - acide oléique (2%} CH3 - (CH2)7 - CH=
CH - (CH2)7 - COOH. - acide linoléïque (20%)- acide palmitique (3%)
2.3.1 Extraction et identification
Les lipidesdes graines sont extraits par un mélange méthanol-acétone ou chloroforme-méthanol. Après
saponification, élimination de l'insaponifiable, lateneur en acides gras est de 16,7% (pour 100 g de graines
broyées).
Les différents acides gras sont identifiéssous forme d'esters méthyliques par chromatographie gazeuse.
63 -2.4 Flavonoïdes
2.4.1 apigenine et luteoline présents sous forme de glucosides en 7 (30, 56).
OH
apigénine lutéoline
2.4.1.1 Extraction - glycosides :
La poudre, composée de tissus du fruit, préextraite par l'éther, est extraite avec 70% d'éthanol à chaud. Les
glycosides, présents dans l'extrait sont séparés et purifiés par chromatographie sur papier en utilisant les solvants standards des flavonoïdes.
- aglycones
La poudre obtenue à partir de l'échantillon de
fruits préextraite par l'éther, subit une hydrülyse à 100° C par l'acide chlorydrique 2 Net les aglycones libérés sont extraits par l'acétate d'éthyle.
2.4.1.2 Identification - Aglycones et glycosides :
Ils sont identifiés par chromatographie sur couche mince en comparant les Rf obtenus, à ceux des échantillons témoins ou par des méthodes spectrales (UV).
2.4.2. - Isoguercitrine ou glucoside 3 guercetine 2.4.2.1 Extraction et Identification
Isolé par chromatographie sur gel de silice en utilisant comme solvant, un mélange de chloroforme
-méthanol, (1-1} et identifié par des méthodes spectrales
(UV, IR}.
2.5 Furocoumarines
2.5.1 Isopimpinelline, isoimperatorine (8) - isoimperatorine (IMP)
2.5.1.1 Extraction
Les échantillons de fruits d'ache sont extraits par l'acétate d'éthyle, puis le résidu, obtenu après évaporation du solvant, est dissous dans le chloroforme.
65
-2.5.1.2 Identification
Les furocoumarines sont séparées par chromatographie bidimensionnelle sur gel de silice et identifiées par leurs RF et leurs spectres UV. Elles peuvent aussi être analysées par chromatographie liquide, haute pression.
2.5.2 Apiumétine et rutarétine (33) - Apiumétine
Provenant de la déshydratation de la rutarétine à partir des graines d'ache.
R=H
- rutarétine
Isolé, aussi chez une autre plante Ruta graveolens
R= R = H L.
1.5.2.1 Extraction et séparation Les graines séchées d'ache sont extraites successivement par l'éther de pétrole, le benzène et l'acétate d'éthyle.
L'extrait obtenu est concentré, puis séparé par
chromatographie sur gel de silice, en utilisant comme éluant le benzène (ce qui permet d'isoler la rutarétine) puis le
mélange benzène - acétate d'éthyle (permettant la mise en évidence de l'apiumétine).
2.5.2.2 Identification
Les composés sont identifiés par comparaison des Rf
à ceux d'échantillons témoins, déposés sur le gel de silice ou à l'aide de méthodes spectrales (UV, IR).
2.5.3 Céléreoside (251
dihydrofurocoumarine· récemment isolé des graines d'ache et existant dans la plante sous forme de glucoside.·
R glucose R1
=
HORt
2.5.3.1 Extraction
Les graines séchées d'ache sont extraites successivement par l'éther de pétrole, le benzène et l'acétate d'éthyle.
L'extrait d'acétate d'éthyle est concentré, puis chromatographié sur gel de silice, en présence d'un gradient de solvant chloroforme- méthanol. (9 : 1) et (17 : 3).
- 67
-2.5.3.2 Identification
Le célereoside est identifiéen comparant lesRf calculésàpartir de lachromatographie sur couche mince à ceux d'échantillons témoins ou par des méthodes spectrales (UV, IR, RMN à protons).
2.6 Coumarines
2.6.1 célerine (39)
Cette coumarine, récemment isolée par GARG, GUPTA, SHARMA présente une structure isoprénylée, peu répandue dans lerègne végétal.
~ H
2.6.1.1 Extraction
Les graines de céleri sont extraites, successivement par l'étherde pétrole, lebenzène et l'éther.
L'extrait d'éther de pétrole est concentré, puis chromatographié sur colonne de silice avec un gradient de solvant éther de pétrole-->benzène.
Les fractions êluées sont purifiées par une chromatographie sur couche mince préparative.
2.6.1.2 Identification
Elle est basée sur l'analyse spectrale (UV, RMN) permettant de localiser la nature et la position des différents groupements sur le cycle.
2.6.2 Apigravine (24, 56)
2.6.3 Osthénol (24, 56> :
Osthenol . R = -H
2.6.4 Umbelliferone (23)
Très répandu dans le règne végétal et obtenu par distillation de l'huile essentielle chez les Ombellifères.
HO
2.6.4.1 Extraction
Les graines d'ache sont extraites par l'éther de pétrole. L'extrait est ensuite chromatographié sur colonne de silice, en utilisant comme éluant un mélange d'éther de pétrole et de benzène à dose croissante.
69
-2.6.4.2 Identification
Elle est basée sur l'analyse spectrale (fluorescence UV, RMN du proton).
2.7 Alcaloïdes
La composition exacte est inconnue (37).
En 1970, KULSHRESTHA, SINGH, SAXENA et KOHL! isolent une fraction d'alcaloïdes, à partir de l'huile essentielle de graines d'ache.
2.7.1 Extraction
L'huile essentielle est extraite avec 2 % d'acide sulfurique aqueux. La phase aqueuse acide est extraite en milieu basique (NH40H) par le chloroforme.
Les phases chloroformiques sont séchées par le sulfate de magnésium anhydre.
2.7.2 Identification
Le solvant est évaporé sous pression et le résidu montre une,réaction DRAGENDORFF positive (formation de complexes insolubles avec l'iodobismuthite de potassium)
3 RACINES 3.1 L'huile essentielle (0,1 %)
3.1.1 Terpènes (20) : surtout : - Transocimène (18,2 %), - Limonène (9,3 %), - Terpinolène (5,5 %), ~ (5 %), ~ Pinène (1 %), - Terpinéol-4 (0,9 %). 3.1.2 Phtalides : (28) - butyl 3n phtalide (0,5%), - Z butylidène phtalide (0,5%), - sédanolide (néocnidilide), - sédanenolide (senkyunolide), - ligustilide.
3.1.2.1 Extraction :
Les racines de céleri (Apium graveolens variété
feuilleet rave) sont extraites par l'étherde pétrole, puis l'extraitest concentré sous faible pression.
71
-3.1.2.2 Identification
Elle est basée sur des méthodes chromatographiques telles que :
- la chromatographie liquide sous moyenne pression. Elle utilise une colonne remplie de silice. L'élution optimale est obtenue avec un gradient de 0 à 50 % d'éther
(contenant 2% de méthanol) dans l'éther de pétrole, - chromatographie gaz liquide. Elle utilise une
colonne en cuivre remplie avec 10 % de carbowax 20 M. Le gaz vecteur est l'azote,
- chromatographie sur couche mince. Elle utilise des plaques de gel de silice, le système de solvant est
CH CL3- C6 H5 CH3- Me OH (30 : 29 : 1).
La révélation des plaques se fait sous ultra-violet ou à l'aide de réactions colorées (vaporisation
d'anisaldéhyde suivie d'un chauffage à 150° pendant quinze
minutes).
- chromatographie gazeuse couplée à la spectrométrie de masse :
Elle utilise une colonne en cuivre remplie avec 10 % SF 96 sur chromosorb.
La colonne de chromatographie est reliée à un spectromètre de masse. Le véhicule gazeux est l'hélium maintenu à 180° C.
3.1.4 Composés poly-acétylénigues
En trèsfaibles quantités (0,0001 à 0,001 %), appartenant au groupe des polyines et apparentés à la cicutoxine (Cicuta virosa) et à l'oenanthotoxine (Oenantha crocata) (5, 6) . n-C7Hl5 -CH = CH CH2
-
[c
:c
]
2co
CH = CH2 n~ 15 CH = CH CH2-[c :
cJ
2 CH CH = CH2 l cis OH 3.2 FlavonoïdesApioside ou apiine, retrouvé aussi dans lesparties aériennes de l'ache.
3.3 Dérivé de l'androstène : (10)
androstène ~ à laconcentration de 8 ng1g de
plante.
Ils'agitd'un composé déjà isolédans lesglandes salivaires du sanglier, agissant comme une hormone
aphrodisiaque, au moment des chaleurs. ("boar pheromone"). 3.3.1 Extraction- purification-identification Les racines de céleri sont extraites par lemélange chlorure de méthylène- acétate d'éthyle (111).
L'extrait est purifié sur colonne en gel de silice avec comme solvant, lemélange cyclohexane -acétate
73 -(90 10).
L'éluat est estimé par radioimmunologie (RIA). Remarque : La présence de ce stéroïde pourrait expliquer les propriétés stimulantes du céleri, sur la libido, connues depuis longtemps.
3.4 Mucopolysaccharides (32,33)
- Il est constitué d'acide hexuronique, arabinose, galactose et rhamnose.
- On peut réaliser une sulfonation du
mucopolysaccharide et l'extrait séparé par chromatographie sur colonne de gel, permet d'obtenir deux fractions
75
-1 ACTIVITE DIURETIQUE
(Feuilles et racines)
Elle serait due aux flavonoïdes. Son intérêt
thérapeutique est connu dès le Moyen-Age : elle est mise à
profit dans le sirop des cinq racines, inventé par les arabes et composé d'asperge, de fenouil, persil et petit houx (27, 44).
Paris, en 1953, {5) considérant l'inocuité des dérivés flavoniques en général, décide de vérifier l'effet diurétique de l'apioside. Il utilise pour l'expérimentation, le lapin mâle, l'urine est recueillie par sondage uréthral, l'apioside est employé à des doses de 0,01 g à 0,05 g par voie orale, voie sous-cutanée et voie intra-veineuse.
L'apioside se montre faiblement diurétique, les effets les plus nets étant obtenus par voie intraveineuse et en
solution phosphatée, mais aucune hématurie n'est observée. Des essais sont également effectués sur des lots de rats soumis à un régime standard, additionné ou non
d'apioside (0,01 g par animal et par jour pendant 8 jours). Chez les rats ayant absorbé l'apioside, le débit urinaire est augmenté de 20 à 30 %, la recherche de sang dans les urines est négative.
Les mêmes expériences sont réalisées avec l'apiol, il y a une augmentation de la diurèse qui s'accompagne dans près de 50 % des cas, et surtout après injection
intra-veineuse, d'hématurie. Il semble donc que l'apiol soit responsable de certains accidents attribués à l'apioside.
2 ACTIVITE HYPOTENSIVE : (Branches de céleri)
L'extrait aqueux dialysé et non dialysé administré par voie parentérale sur des lapins provoque une brutale chute de la pression sanguine de l'ordre de 40 à 55% par rapport à la pression mesurée sur le lot témoin.
Ces mêmes solutions, injectées à des coeurs isolés· de cobaye, entraînent une élévation significative de la force de contraction, sans modifier le nombre de
contractions (40).
Chez l'homme, le jus de céleri administré par voie orale, à la posologie de 40 ml trois fois par jour mélangé à du miel ou du sirop, montre une activité hypotensive
significative (16).
L'activité hypotensive légère serait due (5)
•
-à l'apioside, qu1 est responsable aussi d'une
amélioration de la circulation veineuse (en diminuant la perméabilité capillaire)
-à l'apiol et la myristicine qui entraînent une vasodilatation.
77
-3 EFFETS SUR LE SYSTEME NERVEUX
(Fruits) 3.1 Historique
L'intérêt de l'huile essentielle extraite des graines de l'ache des marais fut signalé pour la première
fois par les employés d'une usine de distillation en Inde ils constatèrent qu'elle masquait la fatigue, créait une sensation de bien-être et augmentait la capacité au
travail.
En 1961, GUENTHAR remarque que les graines de céleri présentent des effets sédatifs et toniques sur le système nerveux central (SNC).
En 1967, KOHLI et son équipe (36) évaluent sur une partie de l'huile essentielle, l'activité tranquillisante et anticonvulsivante. Or, à cette époque, les résultats des observations préliminaires sur l'animal étaient davantage orientés, dans le sens d'une dépression du SNC que d'une stimulation.
Les constituants chimiques de l'huile essentielle sont le d - 1 imonène ( t"0(. eb
=
176<=> c)1 d - sel inène
( t"C eh
=
265 - 273° C) et l'anhydride sédanonique.Ces auteurs n'ont découvert aucune activité sur le SNC de la fraction contenant le d limonène mais les autres fractions, obtenues à des points d'ébullition compris entre 185° C et 300° C ont montré une activité dépressive variable
sur le SNC. D'après les premiers résultats, l'activité apparaît maximale pour la fraction recueillie entre les points d'ébullition 180° C et 265° C, mais aucune tentative pour isoler les principes actifs n'est faite.
En 1970, KULSHRESTHA et son équipe analysent la composition chimique de l'huile essentielle contenue dans les graines d'ache et isolent une fraction d'alcaloïdes, connue en pharmacologie pour posséder une activité sur le système nerveux central. Cette fraction est mise en
suspension dans une solution saline, puis administrée par voie orale aux animaux d'expérience.
L'activité sédative de l'huile essentielle est confirmée par BJELDANES en 1978 (27}.
En 1984 et 1985, ont été isolés par des chercheurs chinois, le butyl 3 n phtalide et le butyl 3 n dihydro 4,5 phtalide, à partir des graines d'Apium graveolens. Ces composés sont dotés de propriétés anticonvulsivantes,
puisqu'ils s'avèrent capables de protéger les souris et les rats, des convulsions induites par le métrazole et les
électrochocs, à des doses nettement inférieures aux doses létales 50 (TD 50) (59, 60, 62).
79 -3.2 Activité sédative
3.2.1 Activité sédative de l'huile essentielle de graine d'ache :
Elle fut étudiée selon deux méthodes par KOHL!, SHANKER, DUA (1961) (36).
3.2.1.1 Potentialisation des effets narcotiques du pentobarbital
Le pentobarbital à la dose de 50 mg 1 kg induit la perte des réflexes appropriés, chez toutes les souris
albinos mâles et femelles testées.
Au moment de récupérer ce réflexe, une fraction de l'huile essentielle est injectée par voie péritonéale à dose variable et le pourcentage d'animaux, ayant perdu ce réflexe est noté.
Puis, on calcule la dose efficace 50 (ED 50),
correspondant à la posologie en huile essentielle induisant une activité tranquillisante chez 50 % des animaux.
3.2.1.2 Etude des réflexes conditionnés On sélectionne un stimulus électrique de 400 volts, d'amplitude 0,5 mA à la fréquence de cinq pulsations 1
seconde.
Une colonie de rats est entrainée de manière à développer des réflexes conditionnés1suite au stimulus