UNIVERSITÉ MOHAMMED V AGDAL FACULTÉ DES SCIENCES
Rabat N u m éro d ord re : 2289 THÈSE DE DOCTORAT Présentée par
Mohammed-Adil HAJJI
Discipline : Physique-Chimie Spécialité : Electrochimie-Corrosion.CORROSION ET CORROSION-ABRASION D ALLIAGES
IN OXYD ABLES EN MILIEUX PHOSPHORIQUES
Soutenue le 23 décembre 2005, devant le jury composé de :
Président : Ali BEN BACHIR, Professeur, Faculté des Sciences - Rabat
Examinateurs : Abdellah GUENBOUR, Professeur, Faculté des Sciences - Rabat EL Miloudi JALLOULI, Professeu r, Ecole N ationale d e l Ind u strie Minérale-Rabat
Mohamed CHERKAOUI, Professeur, Faculté des Sciences - Kénitra Souad EL HAJJAJI, Professeur, Faculté des Sciences - Rabat
Abdelkbir BELLAOUCHOU, Professeur Habilité, Faculté des Sciences - Rabat
ANNEE : 2005 N u m éro d ord re : 2289
DOCTORAT
Titre de la thèse : CORROSION ET CORROSION-ABRASION D ALLIAGES INOXYDABLES EN MILIEUX PHOSPHORIQUES.
Prénom, Nom: Mohammed-Adil HAJJI Spécialité : Electrochimie-Corrosion
RESUME
Cette étude nous a permis d élucider l effet des facteurs qui régissent la résistance à la corrosion avec et sans abrasion dans l acide phosphorique pur et industriel.
Les ions chlorures accélèrent la dissolution active de l alliage, retardent l établissement de la passivité et surtout provoquent une destruction locale de la couche de passivité. Par contre, l addition des ions sulfures s accompagne d une augmentation considérable de la vitesse de corrosion des alliages. Les matériaux riches en Cr et Mo semblent être les mieux adaptés au milieu phosphorique pollué par les ions Cl- et/ou S2-.
En milieu phosphorique industriel, l abrasion entraîne une accélération des processus électrochimiques aboutissant à une diminution de la résistance des matériaux. L augmentation de la vitesse de corrosion est attribuée à l effet de synergie entre impuretés chimique et abrasif. La résistance à la corrosion-abrasion est régie essentiellement par la teneur en chrome.
Mots-clefs : Acide phosphorique, corrosion, corrosion-abrasion, aciers inoxydables, fonte au chrome.
AVANT-PROPOS
Les travaux présentés dans le mémoire ont été effectués au laboratoire de corrosion de la Faculté des Sciences de Rabat.
Ils ont été réalisés en collaboration avec le laboratoire de corrosion et protection des matériaux de l Ecole Nationale de l Industrie Minérale.
J exprime ma profonde reconnaissance à Messieurs les professeurs A. GUENBOUR, professeur à la Faculté des Sciences de Rabat et E.M. JALLOULI, responsable du laboratoire de corrosion de l E.N.I.M pour avoir accepté de codiriger ce travail. Ils m ont éclairé de leurs conseils et m ont fait bénéficier de leur grande expérience dans le domaine de la recherche expérimentale appliquée à l étude des phénomènes de corrosion. Je les prie d agréer mes respectueux remerciements.
Je voudrais exprimer mes vifs remerciements à Monsieur le Professeur A. BEN BACHIR, directeur du laboratoire de corrosion pour son accueil. Je suis très sensible à l honneur qu il me fait en acceptant de présider mon jury de thèse.
Puisse Monsieur Mohamed CHERKAOUI, professeur à la Faculté des Sciences de Kénitra, trouver à travers ce travail ma sincère reconnaissance pour avoir accepté de faire partie des rapporteurs.
Je tiens également à remercier Madame Souad EL HAJJAJI, professeur à la Faculté des Sciences de Rabat qui a bien voulu examiner ce travail et participer au jury.
Que Monsieur Abdelkbir BELLAOUCHOU, professeur à la Faculté des Sciences de Rabat soit ici remercié pour avoir accepté de se joindre aux membres de jury de cette thèse.
S O M M A I R E
INTRODUCTION ... 5
CHAPITRE I :ETUDE BIBLIOGRAPHIQUE I-1 PRODUCTION D ACIDE PHOSPHORIQUE... 7
I-1-1 Procédé par voie thermique ... 7
I-1-2 Procédé par voie humide... 8
I-2 PROBLEMES DE CORROSION RENCONTRES DANS L INDUSTRIE DE L ACIDE PHOSPHORIQUE... 11
I-2-1 Agressivité chimique du milieu ... 11
a- Effet des chlorures... 12
b- Effet des sulfures... 12
c- Effet des cations métalliques... 14
I-2-2 Agressivité mécanique du milieu... 15
a- Aspect d abrasion... 15
b- Aspect de corrosion... 16
c- Synergie abrasion-corrosion... 17
I-3 INFLUENCE DE LA COMPOSITION CHIMIQUE DES ALLIAGES... 17
CHAPITRE II : MATERIAUX ET CONDITIONS EXPERIMENTALES II-1 MATERIAUX ETUDIES... 20
II-2 MILIEUX ELECTROLYTIQUES ... 22
II-3 TECHNIQUES EXPERIMENTALES ... 23
II-3-1 Dispositif d étude de la corrosion... 23
II-3-2 Dispositif d étude de la corrosion abrasion ... 27
II-3-3 Tests normalisés de piqûres et crevasses 29 II-3-4 Méthodes d analyse du milieu électrolytique... 31
II-3-4-1 Dosage par spectrométrie d absorption atomique ... 31
II-3-4-2 Dosage par spectrométrie d'émission (ICP) ... 33
II-4.. CONDITIONS EXPERIMENTALES... 33
II-4-1 Préparation des échantillons ... 33
II-4-1-1 Essais électrochimiques et d abrasion... 33
II-4-1-2 Tests normalisés de piqûres et crevasses... 34
II-4-2 Acide phosphorique synthétique pollué par les chlorures et/ou les sulfures ... 35
II-4-2-1 Préparation et analyse des solutions polluées par S2-... 35
II-4-3 Acide phosphorique industriel... 35
II-4-4 Paramètres des essais d abrasion... 36
II-4-5 Tests normalisés de piqûres et crevasses... 36
CHAPITRE III : COMPORTEMENT ELECTROCHIMIQUE DES ALLIAGES DANS L ACIDE PHOSPHORIQUE SYNTHETIQUE POLLUE PAR LES CHLORURES ET/OU LES SULFURES III-1 EFFET DES CHLORURES ... 37
III-1-1 Cas de l alliage 3127hMo ... 37
III-1-2 Cas de l alliage 2418MoN ... 40
III-1-3 Cas de l alliage 5923hMo ... 42
III-2 DETERMINATION DE LA VITESSE DE CORROSION PAR ANALYSE DE
LA SOLUTION ELECTROLYTIQUE ... 46
III-2-1 DOSAGE PAR SPECTROSCOPIE D'EMISSION (ICP) ... 46
III-2-2 DOSAGE PAR ABSORPTION ATOMIQUE... 47
III-2-3 Comparaison des résultats obtenus par les différentes méthodes d'analyse utilisées... 47
III-3 EFFET DES SULFURES ... 49
III-3-1 Cas de l alliage 3127hmo... 49
III-3-2 Cas de l alliage 2418mon... 50
III-3-3 Cas de l alliage 5923hmo... 51
III-3-4 Cas de la fonte au chrome (fcr)... 52
III-4 EFFET SYNERGIQUE DES CHLORURES ET DES SULFURES ... 53
III-5 DISCUSSION ... 55
CHAPITRE IV : COMPORTEMENT ELECTROCHIMIQUE DES ALLIAGES DANS L ACIDE PHOSPHORIQUE INDUSTRIEL IV-1 EFFET DE LA TEMPERATURE... 62
IV-1-1 Essais potentiostatiques ... 62
IV-1-2 Essais potentiocinétiques ... 64
IV-1-3 Résistance de polarisation... 69
IV-2 TESTS NORMALISES DE PIQURES ET CREVASSES ... 70
IV-2-1 Alliage base nickel (5923hMo) ... 70
IV-2-2 Alliage super-austénitique (3127hMo)... 71
IV-2-3 Acier inoxydable au Mo et N (2418MoN) ... 71
IV-2-4 Fonte au chrome (FCr)... 72
PERTE DE POIDS ... 72
IV-4 DISCUSSION ... 73
IV-5 CONCLUSION... 74
CHAPITRE V : ETUDE ELECTROCHIMIQUE DE LA CORROSION- ABRASION EN MILIEU PHOSPHORIQUE INDUSTRIEL V-1 ESSAIS EN CONDITIONS DYNAMIQUES SANS ABRASIF... 76
V-2 INFLUENCE DE LA VARIATION DE LA VITESSE DU JET D ACIDE ... 78
V-3 EFFET DE L ABRASION SUR LA CORROSION ... 81
V-4 DISCUSSION... 83
V-5 CONCLUSION ... 86
CONCLUSION GENERALE... 87
REFERENCES BIBLIOGRAPHIQUES ... 91
INTRODUCTION
L industrie des phosphates constitue un environnement très agressif vis-à-vis des matériaux. L acide phosphorique est le principal dérivé du phosphore. A l état pur, il est peu corrosif par rapport à l acide nitrique et à l acide sulfurique. Cependant, l origine du minerai et le mode de fabrication jouent un rôle déterminant dans le comportement du milieu.
De nos jours, 95% de l acide phosphorique est produit par voie humide, qui consiste en une réaction entre le minerai de phosphates naturels et l acide sulfurique. Cette technique engendre d importants problèmes de corrosion en relation avec les étapes de production. L effet de la corrosion est activé par la température et la présence d impuretés (fluorures, chlorures, sulfures) contenues dans le minerai ou introduites dans l eau de lavage [1-9]. A ces phénomènes s ajoute l effet abrasif des particules solides en suspension dans les bouillies phosphoriques [10, 12].
Selon la nature des phosphates et le type de procédé de fabrication d acide phosphorique utilisé, les appareils (cuves, agitateurs, pompes, canalisation, etc.) sont soumis à une détérioration plus ou moins rapide. Ainsi, le choix des matériaux doit tenir compte de la nature du minerai utilisé, du type de procédé, des conditions de service de chaque appareil et du rapport coût d investissement/ coût d entretien.
Les matériaux utilisés dans ce milieu doivent à la fois posséder une bonne résistance à la corrosion électrochimique et une bonne résistance à l usure mécanique. Ces deux caractéristiques ne sont pas toujours faciles à réaliser et l on est souvent amené à faire des compromis entre ces deux propriétés.
De ce fait, et dans le but de connaître la tendance de certains alliages à être utilisés dans le milieu phosphorique, des techniques électrochimiques et d analyse de la solution électrolytique ainsi que des tests normalisés de piqûres et crevasses ont été mis en uvre. Et ce afin d élucider l effet de la composition chimique, de la température, des impuretés et des particules solides sur la tenue à la corrosion des
alliages.
Le premier chapitre est consacré à une étude bibliographique sur l état des connaissances concernant la résistance à la corrosion des alliages inoxydables dans l acide phosphorique. L influence des impuretés chimiques et des particules solides sur l agressivité de ce milieu y figure aussi.
Les techniques d études, les conditions expérimentales et la caractérisation des matériaux font l objet du deuxième chapitre.
Dans le troisième chapitre sont présentés les résultats de l étude systématique sur l influence des additions croissantes des chlorures et/ou sulfures sur l agressivité du milieu phosphorique vis à vis des matériaux.
Le quatrième chapitre comprend deux parties. La première concerne une étude généralisée sur le comportement électrochimique des alliages en milieu phosphorique industriel à 30% P2O5, à différentes températures. La deuxième partie, quant à elle, est
consacrée aux tests normalisés de piqûres et crevasses.
Enfin, Le cinquième chapitre porte sur l étude de la corrosion-abrasion en milieu phosphorique industriel.
CHAPITRE I
ETUDE BIBLIOGRAPHIQUE
I-1 PRODUCTION D'ACIDE PHOSPHORIQUE
La Fabrication de l acide phosphorique est la principale production de l industrie des phosphates. Cet acide joue le rôle d intermédiaire quasi-indispensable pour l élaboration de la plupart des produits phosphorés et en premier lieu les engrais.
La composition et la pureté de l acide phosphorique dépendent essentiellement du type de procédé de fabrication utilisé, ainsi que de l origine des phosphates naturels.
Il y a deux catégories de procédés pour la fabrication de l acide phosphorique, les procédés au four et les procédés par voie humide. Les premiers comprennent le procédé électrique au haut fourneau et le procédé au four électrique. Ce dernier est très utilisé pour fabriquer le phosphore élément, dont la plus grande partie est transformée en acide phosphorique pour des usages autres que la fabrication d engrais.
Les procédés par voie humide peuvent être classés suivant l acide utilisé pour décomposer le phosphate naturel ; dans l industrie, on emploie les acides sulfurique, nitrique et chlorhydrique.
I-1-1 Procédé par voie thermique
Le premier stade de ce procédé est l obtention de phosphore élément dans un four électrique. Le four est alimenté par un mélange de coke, de phosphate en nodules ou en morceaux d une autre forme et de cailloux de silice. Le courant électrique, qui entre dans le four par des électrodes en carbone ou en graphite, fond la silice et le phosphate ; ce dernier est réduit par le carbone contenu dans le coke. On enlève continuellement du four le phosphore à l état de vapeur, mélangé à du monoxyde de carbone. Le phosphore est condensé à l état liquide ; il est transformé en acide
phosphorique dans une usine distincte, souvent éloignée [13]. Le coût de production dans ce cas est élevé en raison de la consommation d énergie à haute température ; d où l utilisation réduite de cette méthode.
I-1-2 Procédé par voie humide
Les procédés à l acide sulfurique sont de beaucoup le moyen le plus courant de production d acide phosphorique pour l utilisation comme engrais et quelquefois pour d autres usages. Ils consistent à attaquer les phosphates naturels par l acide sulfurique concentré (93%) et chaud (figure 1).
Figure 1 : Schéma de fabrication de l'acide phosphorique par voie humide.
Quel que soit le procédé employé, la production d acide phosphorique comporte généralement trois étapes essentielles :
- Attaque des phosphates : la principale réaction peut être représentée par l équation suivante, le phosphate naturel étant supposé être de la fluorapatite pure :
Ca10 F2(PO4)6 + 10H2SO4 + 10nH2O 10Ca SO4nH2O + 6H3PO4 + 2HF
Où n = 0, 1/2 ou 2, suivant que le sulfate de calcium cristallise sous une forme plus ou moins hydratée.
On peut classer les procédés commerciaux par voie humide suivant la forme cristalline du sulfate de calcium formé :
Anhydre : CaSO4
Hémihydrate : CaSO4 1/2H2O
Dihydrate : CaSO4 2H2O
Le procédé à l anhydre n est pas actuellement utilisé dans l industrie, la principale raison étant que la température nécessaire est si élevée qu elle pose de graves problèmes de corrosion. Les procédés actuellement utilisés de façon commerciale sont regroupés dans le tableau 1.
Tableau 1 : Procédés de fabrication d acide phosphorique par voie humide
Température normale (en °C) Forme(s) cristalline(s) Nombre de stades de séparation Concentration normale de l acide produit (en % P2O5) Réacteur recristallisoir Dihydrate 1 26-32 70-85
-
Hémihydrate 1 40-50 85-100-
Hémihydrate- Dihydrate 1 26-30 90-100 50-60 Hémihydrate- Dihydrate 2 40-50 90-100 50-65 Dihydrate-Hémihydrate 2 35-38 65-70 90-100Au niveau de cette étape, la dégradation des matériaux est favorisée par la présence des matières en suspension et par les impuretés contenues dans le minerai ou introduites dans l eau de lavage [3, 14, 15]. Ces deux éléments aggravent très sérieusement l agressivité du milieu.
Les matières en suspension sont sous forme de gypse de granulométrie se situant entre 90 et 150 microns, provenant de la digestion du minerai après son introduction dans le réacteur [16]. Quant aux impuretés, elles proviennent du minerai de phosphate qui en contient une variété dont, entre autres, les chlorures (0,03 à 0,2%), les fluorures (2 à 5%) et la silice (3 à 6%).
Au stade de l attaque acide, ces corps donnent naissance à des composés tels que l acide chlorhydrique, l acide fluorhydrique, l acide fluosilicique, le fluosilicate vitreux de soude ou de potasse, le tetrafluorure de silicium, qui sont responsables des phénomènes d abrasion-corrosion.
- Filtration de la bouillie : les cristaux de sulfate de calcium ou de gypse sont séparés par filtration en continu, sous vide partiel. Le gâteau de gypse est ensuite lavé. L eau de lavage, chargée d acide phosphorique, est renvoyée au réacteur d attaque. Le rôle de la filtration est de séparer le gypse (et toutes les matières insolubles provenant du phosphate naturel ou formées au cours de la réaction) de l acide phosphorique produit aussi complètement, aussi efficacement et aussi économiquement que possible. Les conditions de travail des équipements sont généralement moins agressives qu au niveau de l étape précédente du fait que les températures de fonctionnement et les vitesses fluides - matériaux sont plus faibles. Les avaries rencontrées à ce stade de fabrication sont essentiellement dues à la corrosion localisée (piqûre ou crevasse) ou à la corrosion par fatigue (cas des filtres).
- Concentration de l acide : le produit de filtration est ensuite concentré par évaporation sous vide jusqu à 54% environ de P2O5, ou plus, selon l utilisation prévue.
Les conditions de service sont caractérisées par des températures et des vitesses de fluide plus élevées et par des taux de particules solides et d impuretés plus faibles. Les matériaux subissent ainsi une attaque moins agressive que lors des étapes précédentes du fait que les teneurs des impuretés et le taux des particules solides sont plus faibles. Néanmoins, les phénomènes de corrosion-érosion sont prédominants. Les contraintes thermiques et les concentrations localisées d impuretés sont également responsables de dégradations importantes des structures métalliques (cas des tubes). I-2 PROBLEMES DE CORROSION RENCONTRES DANS L INDUSTRIE
D ACIDE PHOSPHORIQUE
L acide phosphorique lui-même est généralement moins corrosif que les autres acides (HCl, H2SO4 par exemple). Néanmoins, les impuretés qu il contient à savoir
HF, H2SiF6, des composés soufrés ou encore des chlorures provenant des phosphates
ou de leur lavage, rendent le milieu très corrosif (tableau 2) [17].
Tableau 2 : Les principales impuretés déterminant le pouvoir corrosif des milieux phosphoriques industriels. Phosphates Bouillie concentrée Acide concentré Effet corrosif Effet abrasif P2O5% 30 à 38 28 à 32 46 à 54 SO3 % 1,5 à 3 1,5 à 4,5 2,5 à 6,5 + F - % 2,5 à 4 1,5 à 4 0,5 à 1,5 : {80%H2SiF {20%HF ++ Cl- ppm 20 à 2500 20 à 2500 5 à 300 ++ SiO2% 0,5 à 3 0,5 à 3 néant ++ S= ppm 50 à 1500 {H2S}=7 {H2S}=7 ++ Al2O 3% 0,2 à 1 ~ 0,5 ~ 1,5 - Fe2O 3% 0,2 à 1 ~ 1,5 ~ 1,5 -
I-2-1 Agressivité chimique du milieu
Le procédé de fabrication d acide phosphorique par voie humide présente, à chaque stade de production, une variété d impuretés ayant un effet déterminant sur l agressivité du milieu. Les espèces les plus agressives sont les chlorures, les fluorures
et les sulfures. Cependant, les cations métalliques tels que Si4+, Al3+, Fe3+, Ca2+ et Mg2+ ont un effet inhibiteur
a - Effet des chlorures
L ion chlorure provient du minerai de phosphate et des eaux de lavage. Caractérisé par un grand rayon ionique, il est faiblement solvaté et peut donc être adsorbé à la surface du métal, inhibant ainsi le processus de passivation. Il joue aussi un rôle primordial dans la destruction locale de la passivité, en raison de sa mobilité et de sa polarisabilité [18].
Les travaux de A. Guenbour [19, 20] ont montré que les chlorures provoquent la corrosion par piqûre. Leur effet corrosif s accentue avec l accroissement de la température ainsi qu avec l augmentation de la concentration de la solution électrolytique en Cl-. Ces ions accélèrent la dissolution active de l alliage et retardent l établissement de la passivité.
Par ailleurs, certains auteurs [9, 21] ont montré que la densité de courant de passivité des alliages (Ip) n est pratiquement pas influencée par l augmentation de la teneur en Cl-. Ce phénomène, n ayant pas été interprété, confirme que le caractère spécifique des ions Cl- réside surtout en leur aptitude de provoquer une destruction locale de la couche de passivité.
N. Nassif [23] a, pour sa part, montré, en étudiant l influence de certaines impuretés sur la corrosivité du milieu phosphorique, que les ions chlorures diminuent la résistance à la corrosion des alliages étudiés. L augmentation de la vitesse de corrosion des matériaux a été aussi signalée. Cet auteur attribue également la nocivité des ions Cl- à leurs propriétés physico-chimiques : électronégativité, taille ionique...
b - Effet des sulfures
Les sulfures sont des composés dérivés du soufre. Dans la nature, ils existent sous différentes formes : sulfures alcalins (Na2S, K2S), sulfures alcalino-terreux (MgS,
CaS...), sulfures métalliques (FeS, CuS, Cr2S3, NiS...). La présence de ces ions seuls
n est pas responsable des endommagements rencontrés fréquemment dans l industrie. Cependant, la co-présence de l oxygène et des sulfures (même à faible concentration)
peut provoquer une accélération dramatique de la vitesse de corrosion.
L hydrogène sulfuré H2S (P.F = 85,6°C, P.E= 60,7°C), provenant de l attaque
des sulfures par les acides forts, est un gaz assez soluble dans l eau (0,15 mol.g/l ). En solution aqueuse, H2S est un diacide faible.
HS2 ====> HS- + H+ PK1 = 7
HS- ====> S2
+ H+ PK2 = 13
En milieu très acide, le diagramme tension-pH du système S-H2O (figure 2)
montre que, selon le potentiel, les espèces stables sont l hydrogène sulfuré (H2S), le
gaz sulfureux (SO2) et le soufre (S).
Figure 2 : Diagramme tension-pH du système S- H2O
Un certain nombre de chercheurs se sont penchés sur l étude du mécanisme d action des sulfures afin de mieux comprendre le phénomène de corrosion engendré par ces ions. Ainsi, les études menées par P. Sury [22] en milieux sulfuriques ont
montré que la présence de H2S dans la solution électrolytique entraîne une extension
du domaine actif et une augmentation de la densité de courant critique. La corrosion par piqûre aux potentiels immédiatement au dessus de la transition active-passive a aussi été observée.
La présence de H2S dans l acide sulfurique augmente également le courant
critique de passivation des aciers inoxydables [24-26]. L effet nocif de H2S semble
être général puisqu on le rencontre pour le cas du Fer, Cobalt, Nickel et aciers inoxydables [24, 26, 27].
A. Benhamou et coll [28] ont montré que la présence des sulfures (sous forme de Na2S, 9H2O) altère complètement le comportement électrochimique de l alliage
AISI 304L. Cette modification se manifeste d une part par un accroissement de la vitesse de corrosion du matériau à l état actif, et d autre part par des densités de courant Ip et Icr élevées.
En général, la présence des ions S2- dans le milieu électrolytique, en quantité suffisante, empêche la formation du film passif [6, 9, 28]. En effet, les sulfures entraînent une augmentation importante de Ip qui est due à leur adsorption à la surface du métal. Le film formé dans ces conditions est constitué essentiellement par des hydroxydes, des phosphates et des sulfures métalliques. Par conséquent, il ne remplit pas la fonction d une couche protectrice.
Parmi les mécanismes qui ont été développés pour expliquer le phénomène de corrosion par les sulfures, il y a lieu de citer le modèle proposé par Schwabe [29]. Ce dernier repose sur l adsorption compétitive entre H2S (HS-) et H2O (OH-).
Pour leur part, Iofa et coll [30] ont proposé, en étudiant l influence de Na2S
dans H2SO4 sur le comportement du fer, un mécanisme attribuant l accélération des
processus anodiques et cathodiques à la formation de (HS-) et du composé adsorbé Fe(HS-)ads.
c - Effet des cations métalliques
L agressivité du milieu phosphorique est généralement tempérée par la présence des ions oxydants. L attaque de ce milieu est dictée par la proportion relative des
espèces agressives (Cl-, F-,...) et inhibitrices (Fe3+, Al3+, Si4+...).
L ion Fe3+ contribue à l effet de cathode et favorise le pouvoir oxydant de l acide phosphorique [31]. Il accroît le processus cathodique en favorisant la transition active-passive. Aussi, ce cation peut s adsorber à la surface du matériau pour former des liaisons avec les oxydes de la couche protectrice, renforçant ainsi la stabilité du film de passivité et ralentissant les cinétiques de transfert de masse et de charge [21].
Quant aux ions Al3+ et Si4+, ils contribuent à l inhibition, en milieu phosphorique, des effets nocifs des fluorures en formant des complexes forts du type AlF2+, AlF63-, SiF3+ et SiF62- qui sont moins agressifs que l ion F- [19, 31].
Par ailleurs, les travaux de T. Sydberger et S. Nordin [32] ont mis en évidence l effet inhibiteur des ions oxydants tels que Fe3+, Al3+, Mg2+ sur le comportement des aciers inoxydables du type 317L. Selon ces auteurs, l effet passivant desdits ions peut être classé par ordre décroissant comme suit : Fe3+ > Al3+ > Mg2+.
I-2 1 Agressivité mécanique du milieu a- Aspect de l abrasion
L usure par abrasion se définit comme la perte progressive du matériau à sa surface par action mécanique d un abrasif [33]. Cette usure a surtout été considérée comme un enlèvement de matière provoqué par un mécanisme analogue à la coupe des métaux [34]. L expérience de Mulhearn et coll [35, 36] a montré, à cet égard, qu un outil de section triangulaire pouvait creuser un sillon en enlevant du métal par effet de coupe.
Les caractéristiques mécaniques de l abrasion décrites dans la littérature concernent en général l érosion provoquée par projection des particules solides (quartz, alumine, carbure de silicium) transportées dans les gaz sur des matériaux. Le modèle de Finnie [37] reste la base fondamentale la plus intéressante pour les études théoriques de l abrasion.
D après les travaux de Finnie [37] et Bitter [38], il intervient dans l érosion par des particules solides, suivant l angle d impact, deux mécanismes : l érosion par effet de coupe aux incidences rasantes et l érosion par déformation aux angles d incidence
voisins de la normale.
Quelle que soit la nature du modèle (théorique ou empirique), l abrasion (E) des matériaux varie avec l angle d impact ( ) et la vitesse (V) à travers la relation :
E = K . Vn . f( )
L effet de la masse d abrasifs sur la vitesse d usure a été examiné par Tilly [39], Neilson et Gilchrist [40]. Ces auteurs ont constaté que lorsque l érosion s établit, la perte de poids, pour une vitesse et un angle donné, augmente linéairement avec la masse des particules projetées.
Le régime d abrasion est généralement défini par plusieurs paramètres comme la vitesse du fluide, la concentration et la granulométrie des particules [41]. F. Maratray, Avient et coll. [42, 43] rapportent que l abrasivité augmente très rapidement quand le diamètre des particules abrasives augmente, et qu elle tend vers une valeur constante quand ledit diamètre atteint une certaine dimension. D après les études de G. Colin, la granulométrie influe particulièrement sur l usure ; on observe généralement une croissance rapide de l usure du grain, puis une stabilité à partir d une dimension critique, généralement voisine de 100 µm.
L étude systématique de l abrasion, par l interaction film passif-particules solides, a fait l objet des travaux réalisés par A. Guenbour [11, 20, 44]. Cette étude a mis en évidence l impact de l abrasion sur la corrosion et la cinétique électrochimique. Ainsi en milieux phosphoriques, l abrasion active la dissolution anodique de l alliage, favorise la piqûration en milieu pollué par les ions Cl- et modifie l épaisseur des couches passives.
b- Aspect de corrosion
En l absence de particules solides, et contrairement au cas statique, un fluide corrosif en mouvement modifie les échanges d espèces entre la surface du matériau et le fluide ainsi que les cinétiques de diverses réactions susceptibles de se produire à la surface du matériau. Ceci est valable aussi bien pour l arrivée d espèces corrosives ou passivantes que pour le départ des produits de corrosion. La vitesse de corrosion peut donc être affectée de manière positive ou négative en fonction de la nature du matériau et du milieu. Quand la vitesse du fluide excède une valeur critique, les contraintes
induites sont capables de détruire les films passifs et accroître ainsi la corrosion [41]. Lorsqu on ajoute des particules à un fluide corrosif en mouvement, deux effets principaux viennent se superposer aux aspects d abrasion pure et de corrosion. Le premier est un effet géométrique puisque les impacts répétés créent une rugosité à la surface du matériau, qui augmente la surface réelle en contact en particulier avec le fluide [18]. Le second effet est électrochimique ; il apparaît en particulier lorsque les matériaux sont passivables. En effet, chaque impact de particule, dans ce cas, va créer une rupture locale du film passif d étendue d autant plus grande que l énergie de la particule est importante et que sa forme est anguleuse [41].
c- Synergie abrasion-corrosion
L effet de synergie entre abrasion et corrosion, ayant pour conséquence l augmentation de la vitesse de corrosion, a été démontré par plusieurs travaux [18, 41, 45]. La résistance des matériaux en conditions de corrosion-abrasion, dépend du régime d abrasion. L apport de la corrosion à l usure totale est fonction de l agressivité de la solution et de la nature du métal.
I-3 INFLUENCE DE LA COMPOSITION CHIMIQUE DES ALLIAGES Outre la nature du milieu électrolytique, La résistance à la corrosion des alliages inoxydables dépend des éléments d addition tels que Cr, Mo, W, Cu et N. Ces derniers sont ajoutés en quantités différentes selon l importance, le besoin et le coût de chacun d entre eux. L'effet des principaux éléments d'addition sur les courbes de polarisation est illustré par la figure 3 [19, 32].
Le chrome est considéré comme le principal agent anti-corrosion des aciers inoxydables. L accroissement de la teneur en Cr augmente la vitesse de corrosion à l état actif, par contre il la diminue lorsque l alliage est à l état passif [46]. C est essentiellement pour cette dernière propriété que le chrome est ajouté dans l alliage pour le rendre inoxydable. Il peut être utilisé pour améliorer la résistance à la corrosion dans les milieux acides oxydants (HNO3 et H2CrO4) ainsi que dans l acide
Figure 3 : Influence des éléments d addition dans les aciers sur l allure des courbes potentiocinétiques.
Quant au molybdène, il doit son importance à l effet bénéfique qu il présente vis à vis de la résistance à la corrosion. Son action en corrosion généralisée (milieu acide) est positive sauf dans certains milieux très oxydants (HNO3 bouillant par
exemple), correspondant à un fonctionnement transpassif [46]. Le rôle essentiel de Mo est d'augmenter la stabilité de la couche passive en diminuant la cinétique de dissolution anodique [47, 49].
Un autre élément, le tungstène en l occurrence présente aussi une action bénéfique puisqu il favorise l établissement de l état passif. Selon N. Bui, A.Guenbour et coll [49], la présence de Mo et W sous formes d oxydes conduit à un renforcement, par interaction, des liaisons entre les oxydes et à l interface oxyde métal.
Concernant le cuivre, son influence sur la transition active-passive est légèrement positive.
Enfin il y a l azote qui, durant ces dernières années, commence à être utilisé pour augmenter la résistance à la corrosion des matériaux. Il contribue, en présence du molybdène, au développement de la passivité de l alliage 18%Cr-8%Ni dans des solutions d acide sulfurique [50]. Sa présence dans la composition chimique des alliages inoxydables, aux côtés de Mo et Cr, améliore leur résistance à la corrosion généralisée en milieu phosphorique industriel [22].
Cette analyse bibliographique a montré que les effets agressifs de l action combinée de la corrosion et de la corrosion-erosion dans les bouillies phosphoriques, nécessitent la mise en uvre d alliages ayant une très bonne résistance à la corrosion.
C est dans ce sens que nous avons mené une étude systématique du comportement électrochimique de quatre nuances en milieux phosphoriques. Cette étude a pour but la détermination de l effet de la température, des impuretés chimiques (Cl- et/ou S2-) et de l abrasion sur la tenue à la corrosion des alliages. Et ce afin de connaître la tendance de ces nuances à être utilisés dans le milieu phosphorique.
MATERIAUX ET CONDITIONS EXPERIMENTALES
II-1 MATERIAUX ETUDIES
Les études réalisées dans ce travail ont porté sur quatre nuances commerciales. Certaines d entre elles ont prouvé leur bonne tenue à la corrosion dans divers milieux agressifs [2, 51].
Ces matériaux se répartissent selon leurs compositions chimiques en quatre catégories :
1°) Acier inoxydable austénitique au Mo et N (2418MoN) ; 2°) Alliage super - austénitique au Mo (3127hMo) ;
3°) Alliage base nickel au Mo (5923hMo) ; 4°) Fonte à 30% en chrome (FCr).
La teneur en molybdène varie de 2% à 15,6%. Les caractéristiques de ces nuances sont rassemblées dans le tableau 3.
Tableau 3 : Composition chimique des matériaux en pourcentage massique.
Composition Chimique Alliage Ni Cr Fe Mo C Mn Si N S P autres 3127hMo 31,05 26,65 33,02 6,34 0,008 1,51 0,04 0,207 0,005 0,01 1,16 Cu 2418MoN 17,7 24,2 46,7 4,52 0,015 6,01 0,03 0,44 0,003 0,013 --- 5923hMo 60,75 22,65 0,29 15,6 0,006 0,15 0,02 0 0,003 0,002 0,13 V 0,23 Al FCr 0,6 30 63,5 2 1,2 0,7 2 0 0 0 --- II-1-1 Structure
La structure métallographique des différents échantillons a été révélée à l aide d une solution d attaque constituée de : 5g FeCl3 + 10ml HCl + qq goutes de HNO3.
Les trois premières nuances présentent une structure austénitique alors que la Fonte au chrome a une structure ferritique (figures 4 à 7).
Figure 4 : Micrographie de l'alliage 3127hMo.
Figure 6 : Micrographie de l'alliage 5923hMo.
Figure 7 : Micrographie de la Fonte au chrome (FCr).
II-2 MILIEUX ELECTROLYTIQUES
Le milieu électrolytique utilisé pour la réalisation des essais électrochimiques traitant de l influence des ion Cl- et/ou S2-, est l acide phosphorique synthétique à 40% H3PO4 (5,5 M) et d acidité Ro (H) = -1,9. Ro (H) est l équivalent du pH pour les
(0 à 1200 ppm ; 1 ppm = 1g Cl-/1Kg et/ou les sulfures (0 à 20 ppm). Les tests ont été effectués à 90°C.
La solution polluée par les sulfures a été préparée à partir d une solution mère à 1g (Na2S). la concentration du sulfure de sodium a été déterminée par la méthode
iodométrique ; le dosage est basé sur la réaction : H2S + I2 2H+ + 2I- + S.
Concernant l étude portant sur l effet de la température et celle de la corrosion-abrasion, la solution utilisée est l acide phosphorique industriel à 30% P2O5.
Quant aux tests normalisés de piqûres et crevasses, ils ont été réalisés dans une solution contenant 6% en poids de chlorure ferrique (Norme ASTM G-48-76).
II-3 TECHNIQUES EXPERIMENTALES II-3-1 Dispositif d'étude de la corrosion
Les essais de corrosion électrochimique réalisés dans ce travail ont pour but la détermination du rôle des impuretés sur l agressivité du milieu phosphorique ainsi que l influence de l augmentation de la température sur la résistance des alliages.
Le montage expérimental ayant servi au traçage des courbes courant-tension, est représenté sur la photo de la figure 8. Il est constitué de :
- Une plaque chauffante, pour le chauffage de la solution avant son introduction dans la cellule de travail ;
- Un erlen muni d un robinet ;
- Un bain thermostaté permettant la stabilité de la température de l électrolyte ; - Une cellule de travail thermostatée munie d'orifices permettant l introduction de l électrode de travail, l électrode de référence (au calomel saturé), l électrode auxiliaire à disque de platine, du réfrigérant en spiral et d un thermomètre.
Figure 8 : Montage utilisé pour la réalisation des essais électrochimiques.
L unité électrique utilisée pour la réalisation des essais électrochimiques (figure 9) comporte :
- Un potentiostat permettant la fixation d une d.d.p. entre l électrode de travail et la contre électrode ;
- Un pilote qui assure le balayage du potentiel en fonction du temps ; - Une table traçante.
Le tracé des courbes E = f (t) et Rp = f (t) a été réalisé à l aide d un système informatisé illustré par la figure 10.
La vitesse instantanée de corrosion électrochimique a été déterminée par la technique de résistance de polarisation. Cette méthode consiste à faire le balayage du potentiel en fonction du temps à des valeurs de 10 mV au delà du potentiel de corrosion. La valeur de la Rp est donnée par la pente à l origine (figure 11).
L avantage de cette méthode est qu elle permet de suivre en continu la cinétique de corrosion.
Figure 10 : Unité informatique.
Figure 11 : Technique de mesure de la résistance de polarisation.
Mode opératoire
Pour les alliages fortement passivables, comme c est le cas des échantillons étudiés, il est difficile d obtenir des résultats reproductibles en maintenant l échantillon au contact de la solution durant son chauffage; même si on le maintient à l état cathodique. Nous avons donc été contraint de chauffer séparément la solution et la cellule de travail afin de diminuer le temps de contact échantillon - solution. En effet, avant l introduction de l échantillon dans la cellule de travail, on procède à l échauffement simultané de cette dernière (en la reliant au bain thermostaté) et de l'erlenmeyer contenant l acide phosphorique (en utilisant la plaque chauffante). Lorsque la cellule de travail et l erlenmeyer atteignent la température voulue, on place l échantillon dans la cellule et on évacue le contenu de l'erlenmeyer dans la cellule en prenant soin d appliquer à l échantillon un potentiel cathodique de -500 mV/ECS juste après l introduction de la solution. L application d un potentiel cathodique évitera que l alliage soit passivé avant essai.
L échantillon est maintenu à l état cathodique pendant ¼ h avant chaque essai; ce qui permet de partir du même état de surface et d assurer une bonne reproductibilité.
II-3-2 Dispositif d étude de la corrosion-abrasion
Les essais de corrosion-abrasion ont été réalisés à l aide d un dispositif expérimental permettant de suivre en continu le comportement électrochimique des échantillons exposés à un jet de fluide avec et sans particules solides ; il est constitué de :
- Une cellule en téflon munie de plusieurs orifices permettant l introduction des électrodes (travail, référence (ECS) et auxiliaire) et d une buse de diamètre fixe pour la projection de la solution (figure 12). La disposition des électrodes au niveau de la cellule est réalisée de telle façon que l électrode de travail soit en position centrale et que la suspension projetée par l intermédiaire de la buse, tombe directement sur la surface du métal ;
- Une pompe à débit réglable assurant la circulation de la solution ;
- Un agitateur permettant l homogénéisation de la solution dans le réservoir ; - Un système informatique pour le stockage et le traitement des données (déjà cité en paragraphe II-3-1 : figure 10).
Figure 12 : Schéma de la cellule de corrosion-abrasion.
1 Electrode de référence 2 Echantillon 3 Fil électrique 4 Electrode de Pt 5 Buse
La figure suivante (fig. 13) illustre bien l ensemble du montage de corrosion-abrasion :
Figure 13 : Dispositif d essai de corrosion-abrasion
1 Cellule de corrosion 2 Pompe péristaltique 3 Agitateur
a/ Choix de l abrasif
L abrasif doit être chimiquement neutre par rapport au milieu considéré et suffisamment dur, avec notamment des formes assez aigues pour provoquer une abrasion efficace. En effet, la nature de l abrasif influe énormément sur les résultats obtenus [52].
Des travaux antérieurs de corrosion-abrasion dans la bouillie phosphorique, ont montré que l agressivité mécanique des particules solides diminuait au cours de l essai [10, 53]. Les observations au MEB de ces particules, ont fait paraître une forme des grains plus arrondie (moins angulaire) après essai.
La taille des particules, elle, se situait entre 20 et 100 µm, avec une taille moyenne de 60 µm environ.
De ce fait, nous avons opté, dans cette étude, pour le carbure de silicium (SiC) comme abrasif. Les particules de SiC sont connues par leur inertie chimique vis-à-vis de l acide phosphorique. Elles préservent en outre leur forme durant l essai d abrasion [54].
II-3-3 Tests normalisés de piqûres et crevasses
Ces tests ont pour but la détermination de la résistance à la corrosion par piqûre et par crevasse des différents alliages. Ils consistent à placer les matériaux dans un environnement oxydant chloruré à une température donnée. La procédure adoptée est basée sur la norme ASTM G-48-76.
Le montage expérimental utilisé pour la réalisation de ces essais normalisés comporte un bain thermostaté dans lequel on place deux erlenmeyers en verre (figure 14). Ces erlenmeyers sont fermés par des bouchons contenant des réfrigérants permettant de minimiser les pertes des chlorures qui se dégagent sous forme de vapeur. Un thermomètre placé à l'intérieur du bain permet de connaître sa température de façon instantanée.
a/ Mode opératoire
La solution utilisée pour la réalisation de ces essais normalisés contient 6% en poids de chlorure ferrique. Sa préparation se fait en dissolvant 100g de FeCl3, 6H2O
dans 900 ml d'eau distillée (Norme G48-76) ; ce qui correspond à une concentration en ion chlorure de 43770 mg/l.
Le volume de la solution électrolytique dépend de la surface totale de l'échantillon plongé dans la solution. En effet, et selon l'ASTM, on prend un volume de 20 ml/cm² . La température choisie est de 90°C et l'essai dure 72 heures.
Après que la solution électrolytique ait atteint 90°C, on place les échantillons préalablement dégraissés et nettoyés dans les erlenmeyers et on ferme le tout (bain et erlenmeyers). A la fin de l'essai, les échantillons récupérés sont rincés avec de l'eau distillée et l'acétone, puis séchés.
II-3-4 Méthodes d'analyse du milieu électrolytique
La détermination de la vitesse de corrosion des alliages peut se faire aussi par un simple dosage des éléments qui passent en solution, après attaque électrolytique.
Parmi les méthodes d'analyse de la solution électrolytique il y a la spectrométrie d'absorption atomique de flamme et la spectrométrie d'émission (ICP).
La spectroscopie est, au sens le plus général, l'étude de la réponse d'un système à une excitation extérieure. Plus restrictivement, on désigne par spectroscopie l'étude des interactions d'un ranyonnement électromagnétique avec la matière.
Selon l'énergie des photons apportés par l'onde électromagnétique on distingue : - La spectroscopie Hertzienne qui s'étend des ondes millimétriques ( =1mm) aux ondes kilométriques ( =1km) et même au-delà (RMN, RPE).
- la spectroscopie optique ou spectrophotométrie qui englobe l'IR, le visible et l'UV comprenant la gamme de fréquence 5.1011 HZ (5.106 mm) et 1017 Hz (10mm).
- La spectroscopie X et traite des fréquences de 107 Hz (10 mm) jusqu'à 1023 Hz (5.10-5mm).
La spectroscopie peut être différenciée enfin en :
-Spectroscopie d'absorption dans laquelle des quanta d'énergie apportés par l'onde frappent l'échantillon et sont absorbés.
- Spectroscopie d'émission dans laquelle des quanta d'énergie sont émis par l'échantillon.
II-3-4-1 Dosage par spectrométrie d'absorption atomique de flamme
La spectrométrie d'absorption atomique est une méthode d'analyse élémentaire. Elle s'applique de manière courante à l'analyse des éléments des solutions aqueuses ou organiques.
Si la technique permet, en principe, l'analyse de tous les éléments, les appareils
classiques ne rendent accessible qu'un domaine de longueurs d'onde limité (190 à 900 mm ) et ne permettent pas l'atomisation de tous les éléments tels que les
Absorption d'un rayonnement
Lorsqu'un photon d'énergie h rencontre un atome dans un état d'énergie Eo; s'il existe pour cet atome un état énergétique plus élevé Ei, il pourra y avoir absorption du photon et passage de l'atome du niveau Eo au niveau Ei tel que : Ei - Eo = h
h est la constante de planck (6,626.10-34J.s).
Le niveau d'énergie Eo est dit état fondamental de l'atome (énergie minimale prise comme origine Eo=0), alors que le niveau Ei est dit état excité de l'atome.
Emision Absorption
Ei
Eo E
Si l'on considère un flux de photons d'intensité I0 et de fréquence traversant un milieu absorbant d'épaisseur I, par exemple une vapeur atomique dans une flamme, une partie de ces photons sera absorbée. L'intensité lumineuse du rayonnement excitateur diminue et la loi de Beer-Lambert peut-être appliquée :
A = Log (I0/I) = K.L.C
A = grandeur caractérisant l'absorption de la lumière I0 = intensité du faisceau incident.
I = intensité du faisceau après absorption.
K = c fficient d'absorption pour une fréquence donnée. L = épaisseur du milieu absorbant.
C = concentration.
La densité de courant est obtenue par application de la loi de Faraday : I = ni mi F/Mi.t
mi = masse du métal passé en solution. Mi = masse atomique de l'élément. ni = nombre d'électrons mis en jeu.
F = nombre de faraday.
i = élément de l'alliage (Fe, Cr, Ni, Cu, Mn).
II-3-4-2 Dosage par spectrométrie d'émission à plasma à couplage inductif (ICP)
L'ICP est une technique d'analyse utilisant un plasma induit par haute fréquence (inductively coupled plasma ou ICP) et permettant la détermination de la plupart des éléments de la classification périodique. Les seules limitations sont des gaz comme l'hélium ou des éléments dont les raies les plus sensibles sont situées dans l'UV lointain, c'est à dire en dessous de 150mm. Cette technique est adoptée aussi bien au dosage des traces et ultra-traces (PPB), qu'à l'analyse des éléments majeurs (%) où son exactitude et sa précision sont souvent supérieures à celles de la fluorescence X et de l'absorption atomique de flamme.
L'ICP permet d'étendre le potentiel de la flamme en accédant à un plus grand nombre d'éléments et en étant beaucoup plus rapide, avec un surcoût généralement acceptable dans le cas des systèmes séquentiels. Cependant, la spectrométrie d'absorption avec four reste irremplaçable pour l'obtention de très basses limites de détection. Si on peut admettre que la flamme et l'ICP sont relativement concurrents, il n'en est pas de même pour le four et l'ICP qui sont parfaitement complémentaires.
II-4 CONDITIONS EXPERIMENTALES
II-4-1 Préparation des échantillons
II-4-1-1 Essais électrochimiques et d abrasion
Les matériaux étudiés se présentent sous forme de disques cylindriques de 10 mm de diamètre et de faible épaisseur. La surface exposée à la solution électrolytique est de l'ordre de 0,22 cm2 environ. La préparation de l état de surface comporte un polissage mécanique avec papiers abrasifs de granulométries décroissantes, suivi d un polissage sur draps d alumine puis d un rinçage à l eau distillée.
Les échantillons utilisés dans ce type d'essai sont sous forme de plaques rectangulaires de longueur et de largeur égales respectivement à 7,5 et 2,5 cm environ (figure 15 (a)). Au milieu de ces plaques se trouve un trou dans lequel on fixe deux anneaux à l'aide d'un boulon en inox (figure 15 (b)). Le boulon est revêtu avec du Téflon afin d'éviter tout risque de corrosion galvanique.
(a)
(b)
Figure 15: Forme des échantillons utilisés pour les essais de crevasse.
sulfures.
- Solution de base : Acide phosphorique pur à 40% H3PO4.
- Teneurs des ions Cl- étudiées : 0 à 12000 ppm Cl-. - Teneurs des ions S2- étudiées : 0 à 20 ppm S2-. - Température : 90°C.
- Vitesse de balayage du potentiel : 30 mV/min. - Potentiel de départ : - 500 mV/ECS.
- Agitation permanente.
Interaction chlorures-sulfures
- Solution de base : Acide phosphorique pur à 40 % H3PO4 + 1000 ppm Cl-.
- Teneurs des ions S2- étudiées : 5 et 10 ppm S2-. - Température : 90°C.
II-4-2-1 Préparation et analyse des solutions polluées par les sulfures
La méthode adoptée dans ce travail repose sur la formation du sulfure d hydrogène à partir de composés sulfureux. Elle consiste en une addition de Na2S
dans la solution électrolytique. Cette technique présente l avantage de connaître avec précision la concentration réelle des ions sulfureux ajoutés dans le milieu.
La solution polluée par les ions sulfures a été préparée à partir d une solution mère de 1g (Na2S)/l. La concentration de sulfure de sodium a été déterminée par la
méthode iodométrique. Le dosage est basé sur la réaction : H2S + I2 =====> 2H+ + 2I- + S
II-4-3 Acide phosphorique industriel
- Solution utilisée : Acide phosphorique industriel à 30% P2O5.
- Températures étudiées : 30, 60, 75 et 90°C. - Vitesse de balayage du potentiel : 30 mV/min. - Potentiel de départ : - 500 mV/ECS.
- Agitation permanente.
Ces essais ont été effectués dans les conditions suivantes : - Abrasif utilisé : carbure de silicium SiC ;
- Taille des grains de l abrasif 61 µm ;
- Vitesse de projection de la solution : 1,3 à 5,3 m/s ; - Angle d impact : 90° (corrosion normale) ;
- Electrolyte utilisé : acide phosphorique industriel à 30% P2O5 ;
- Température ambiante. - Agitation permanente.
II-4-5 Tests normalisés de piqûres et crevasses - Solution de FeCl3, 6H2O à 6% en poids.
- Volume : 20 ml/cm2. - T = 90°C.
Chapitre III
COMPORTEMENT ELECTROCHIMIQUE DES ALLIAGES DANS L ACIDE PHOSPHORIQUE SYNTHETIQUE POLLUE PAR LES CHLORURES ET/OU LES SULFURES
En raison de la complexité du milieu phosphorique industriel, et dans le but de connaître l influence de certaines impuretés, en l occurrence Cl- et/ou S2- sur le comportement des matériaux dans ce milieu, une étude systématique portant sur des addition croissantes desdites impuretés a été menées dans une solution synthétique de base à 40% de H3PO4.
L impureté chlorurée ajoutée dans la solution est sous forme de chlorure de sodium tandis que l addition des sulfures a été effectuée par l intermédiaire d une solution mère de 1g (Na2S)/l. L ensemble des essais a été réalisé à 90°C.
III-1 EFFET DES CHLORURES.
Pour les alliages inoxydables (3127hMo, 2418MoN et 5923hMo), les teneurs en ion Cl- étudiées sont comprises entre 0 et 12000 ppm. Cependant, la teneur maximale en ion Cl- utilisée pour l étude de la Fonte au chrome (FCr) est de 5000 ppm. Cette teneur est en effet suffisante pour rompre complètement la passivité de ce matériau.
III-1-1 Cas de l alliage 3127hMo
Les courbes de polarisation de l alliage 3127hMo sont illustrées par la figure 16.
Dans toute la gamme de concentration en Cl- étudiée, la passivité du matériau (courbes allers) est pratiquement stable. Le domaine de passivité s étend du potentiel de passivation primaire (Epp) jusqu au potentiel d oxydation de l eau. Aucune transpassivité associée à une dissolution de l alliage n a été mise en évidence.
Figure 16 : Courbes de polarisation de l alliage 3127hMo dans l acide phosphorique à 40% de H3PO4 pollué par les ions chlorures, à 90 °C.
En ce qui concerne les courbes retours, le matériau subit aux grandes concentrations en Cl-, une forte attaque caractérisée par une difficulté de repassivation conduisant à un déplacement du potentiel de repassivation (Erp) vers des valeurs de plus en plus faibles, et par conséquent une diminution de l intervalle de potentiel E
défini par : E = Erp - Epp, avec Epp = potentiel de passivation primaire et Erp = potentiel de repassivation. La variation de E en fonction de la concentration en
0 200 400 600 800 1000 1200 0 5000 8000 10000 12000 E (m V ) ppm Cl-T = 90°C
Figure 17 : Effet des chlorures sur l intervalle de potentiel ( E) de l alliage 3127hMo.
Les paramètres électrochimiques déduits des courbes de polarisation sont rassemblés dans le tableau 4. On remarque que la densité de courant de passivité Ip (courbes allers) reste presque constante indépendamment de la teneur en Cl-. Aussi, la valeur de Ecorr ne semble pas être beaucoup influencée par l addition des chlorures.
Tableau 4 : Paramètres électrochimiques de l'alliage 3127hMo dans l'acide phosphorique à 40 % de H3PO4, avec diverses teneurs en Cl-. [Cl-] (ppm) Icr (µA/cm²) Ecorr (mV) Ip (µA/cm²) Erp (mV) 0 9,5 -181 9,8 980 5000 15,9 -194 8,4 980 8000 21,4 -193 9,8 550 10000 21,4 -194 9,4 230 12000 14,3 -189 9,5 140
Les observations métallographiques ont montré l apparition de piqûres à la surface de l échantillon. La structure micrographique a été aussi révélée.
Notons enfin l apparition d un pic anodique de dissolution générale qui augmente avec l accroissement de la concentration en Cl-. A 12000 ppm Cl-, ce pic tend à diminuer.
III-1-2 Cas de l alliage 2418MoN
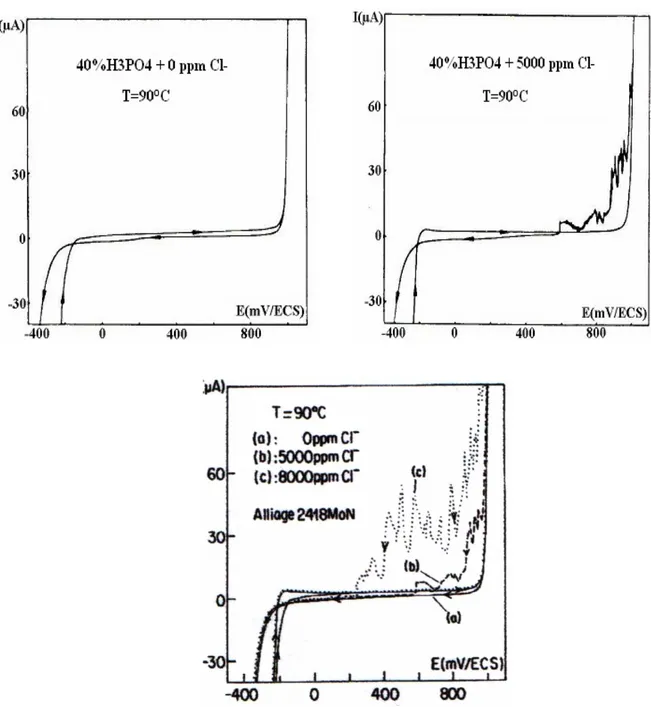
Comme dans le cas précédent, le matériau reste passif dans tout le domaine de concentration en Cl- étudié. Le domaine de passivité s étend du potentiel de passivation primaire jusqu au potentiel d oxydation de l eau (figure 18).
Figure 18 : Courbes de polarisation de l alliage 2418MoN dans l acide phosphorique à 40% de H3PO4 pollué par les ions chlorures, à 90 °C.
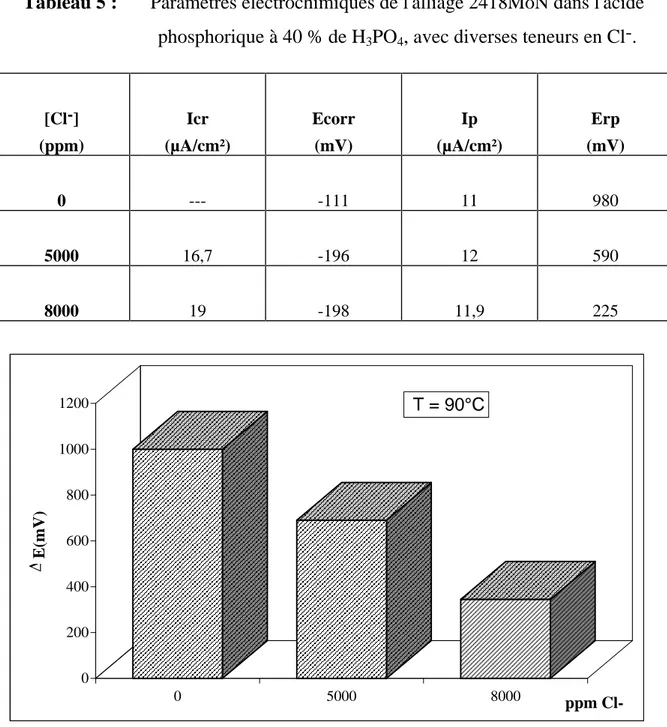
Le tableau 5, dans lequel sont regroupés les paramètres caractéristiques des courbes de polarisation, montre que :
- La densité de courant de passivité (Ip) reste constante dans toute la gamme de concentration et de température étudiées ;
- Le potentiel de corrosion se déplace vers des valeurs plus cathodiques dès la première contamination du milieu par les ions Cl-, puis se stabilise à -198 mV environ.
Tableau 5 : Paramètres électrochimiques de l'alliage 2418MoN dans l'acide phosphorique à 40 % de H3PO4, avec diverses teneurs en Cl-. [Cl-] (ppm) Icr (µA/cm²) Ecorr (mV) Ip (µA/cm²) Erp (mV) 0 --- -111 11 980 5000 16,7 -196 12 590 8000 19 -198 11,9 225
0 200 400 600 800 1000 1200 0 5000 8000 E (m V ) ppm Cl-T = 90°C
Figure 19 : Effet des chlorures sur l intervalle de potentiel ( E) de l alliage
Au niveau de la courbe retour, une altération, se manifestant par une difficulté de repassivation, apparaît à partir de 5000 ppm Cl-. Ainsi, Erp se déplace vers des valeurs plus faibles quand la concentration en Cl- augmente. Un léger pic de dissolution anodique, dépendant de la teneur en Cl-, apparaît à cette même température. Les observations micrographiques ont révélé la formation de piqûres à la surface de l échantillon et la mise en évidence de la structure austénitique.
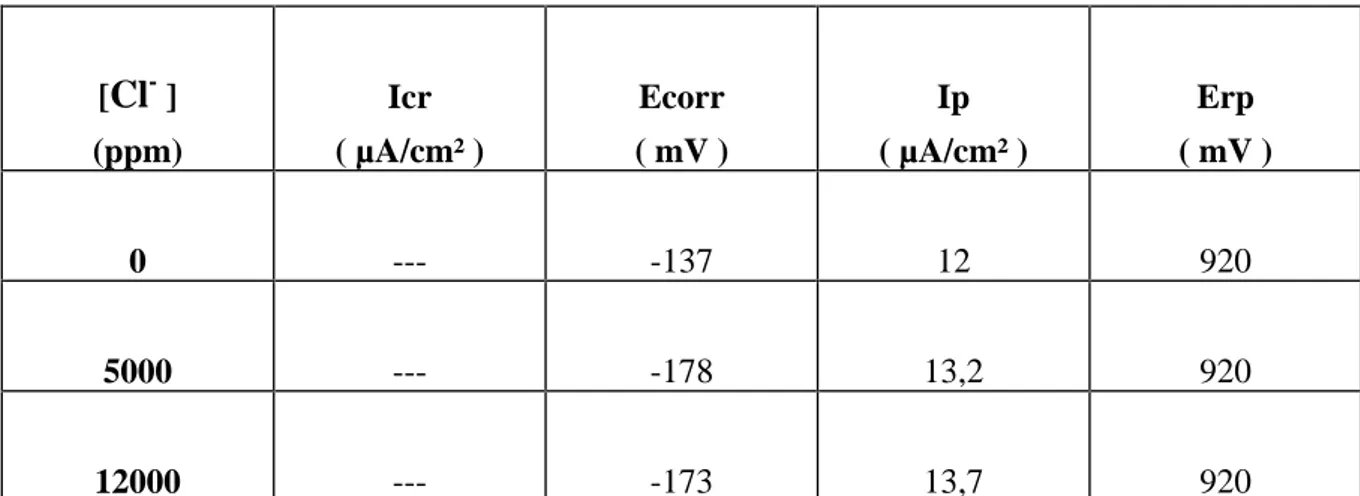
III-1-3 Cas de l alliage 5923hMo.
Cette nuance, renfermant dans sa composition chimique un très haut pourcentage de molybdène, possède aussi une passivité inaltérée et une densité de courant de passivité (Ip) presque constante malgré l augmentation de la teneur en Cl- (figure 20).
Pour sa part, Ecorr subit une forte diminution dès la première addition des ions Cl-, puis garde une valeur presque constante aux plus fortes concentrations.
La contamination de la solution électrolytique par les ions Cl- ne semble pas engendrer de corrosion par piqûre pour cette nuance. En effet, dans toute la gamme de concentration étudiée, les courbes de polarisation (allers et retours) de cet alliage sont pratiquement inchangées.
Tableau 6 : Paramètres électrochimiques de l'alliage 5923hMo dans l'acide phosphorique à 40% de H3PO4, avec diverses teneurs en Cl-. [Cl- ] (ppm) Icr ( µA/cm² ) Ecorr ( mV ) Ip ( µA/cm² ) Erp ( mV ) 0 --- -137 12 920 5000 --- -178 13,2 920 12000 --- -173 13,7 920
Figure 20 : Courbes de polarisation de l alliage 5923hMo dans l acide phosphorique à 40% de H3PO4 pollué par les ions chlorures, à 90 °C.
III-1-4 Cas de la Fonte au chrome
Contrairement aux autres nuances, l ajout des ions chlorures entraîne, aux fortes teneurs (à partir de 2000 ppm Cl-), une altération de la passivité de la fonte au chrome (figure 21). Par conséquent, le potentiel de rupture de passivité (Erup) se déplace vers des valeurs plus faibles lorsque la concentration en Cl- augmente.
Figure 21 : Courbes de polarisation de la fonte au chrome (FCr) dans l acide phosphorique à 40% de H3PO4 pollué par les ions chlorures, à 90 °C.
Le tableau 7, regroupant les paramètres caractéristiques des courbes de polarisation, montre que Ip augmente suite à l accroissement de la concentration en Cl- ; ce qui n a pas été le cas pour les nuances précédentes.
Le potentiel de corrosion subit à son tour l effet des chlorures et se déplace vers des valeurs plus cathodiques. La pollution du milieu par 5000 ppm Cl- entraîne l apparition de plusieurs potentiels de corrosion.
Tableau 7 : Paramètres électrochimiques de la Fonte au chrome (FCr) dans L acide phosphorique à 40 % de H3PO4, avec diverses teneurs en Cl-. [ Cl- ] (ppm) Erup ( mV ) Ecorr ( mV ) Ip ( µA/cm² ) Erp ( mV ) 0 980 60 12,5 950 500 980 21 11,9 935 1000 960 4 12,5 930 2000 960 -4 14,6 --- 5000 500 -470 28,1 ---
La forte attaque des chlorures se manifeste également par une absence complète de la repassivation de ce matériau à partir de 2000 ppm Cl-. L apparition de piqûres à la surface de l échantillon et la révélation de la structure micrographique (ferritique) de l alliage ont été confirmées par les observations métallographiques.
0 10 20 30 0 500 1000 2000 5000 T = 90°C Ip ( µ A /c m ²) ppm
III-2 DETERMINATION DE LA VITESSE DE CORROSION PAR ANALYSE DE LA SOLUTION ELECTROLYTIQUE
Dans le but de confirmer les résultats obtenus par la méthode électrochimique, nous avons fait appel à des méthodes spectroscopiques d'analyse de la solution électrolytique.
L'étude a été menée dans une solution d'acide phosphorique synthétique de composition : 40% H3PO4 + 2000 ppm Cl-, à une température de 90°C. L'échantillon
était maintenu à l'abandon pendant une durée de 48 h. A la fin de chaque essai, la solution électrolytique est dosée soit par spectroscopie d'émission (ICP), soit par spectroscopie d'absorption atomique de flamme. Les résultats de ces analyses permettent de calculer la perte de masse totale de chaque matériau.
III-2-1 Dosage par spectroscopie d'émission (ICP)
Dans le tableau 8 sont rassemblés les résultats du dosage élémentaire de la solution électrolytique par ICP, pour les quatre nuances testées. Ces valeurs ont été prises comme moyennes des pertes de masse pour le calcul des pertes de poids globales des alliages.
L'analyse de ces résultats montre que la perte de masse des matériaux est très faible et est presque similaire pour l'ensemble des échantillons. Cependant, l'alliage base nickel (5923hMo) semble présenter une meilleure résistance à la corrosion par rapport aux autres matériaux.
Tableau 8 : Résultat de l'analyse par spectroscopie d'émission ( ICP ).
Nuances Composition de la solution (ppm) Perte de masse
Fe Cr Ni Cu Mn (mg/cm 2 ) 3127hMo 0,53 < 0,16 < 0,16 0,088 < 0,08 0,68 2418MoN 0,53 < 0,16 < 0,16 < 0,08 < 0,08 0,67 5923hMo 0,32 < 0,16 < 0,16 < 0,08 < 0,08 0,54 FCr 0,60 < 0,16 < 0,16 0,11 < 0,08 0,73
III-2-2 Dosage par absorption atomique
Les résultats de l'analyse faite par spectroscopie d'absorption atomique de flamme sont donnés dans le tableau 9.
Dans ce cas, les pertes de masse sont plus élevées que celles déterminées à partir des analyses de l'ICP. Toutefois, la différence entre les nuances reste toujours très peu significative.
Tableau 9 : Résultat de l'analyse par absorption atomique.
Nuances Composition de la solution (ppm)
Perte de masse Fe Cr Ni Cu Mn (mg/cm 2 ) 3127hMo 2,15 0,40 --- 0,48 0,80 2,35 2418MoN 1,99 0,48 --- 0,40 0,72 2,20 5923hMo 2,23 0,32 --- 0,40 0,80 2,30 FCr 2,31 0,40 --- 0,40 0,72 2,35
III-2-3 Comparaison des résultats obtenus par les différentes méthodes d'analyse utilisées
Les deux méthodes d'analyse utilisées dans ce travail, à savoir ICP et absorption atomique ont fourni des résultats différents. Ceci est dû au fait que les pertes de masse des alliages sont très faibles et se situent pratiquement dans le domaine d'incertitude de l'absorption atomique de flamme.
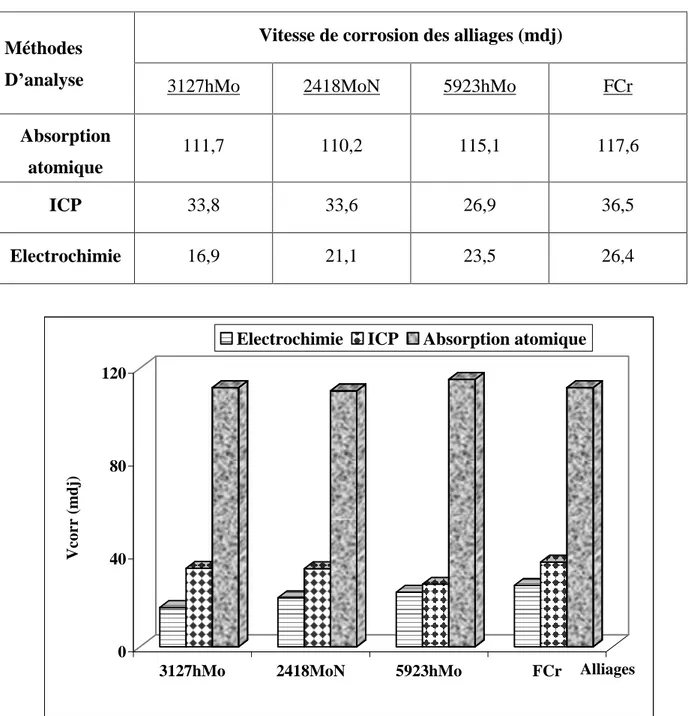
Dans le tableau 10 sont regroupées les vitesses de corrosion des différentes nuances, déterminées à partir des deux méthodes d'analyse précitées et des courbes de polarisation. Elles ont été calculées à partir des valeurs des courants de passivité (Ip).
Ainsi, nous constatons que ce sont les résultats obtenus par ICP qui se rapprochent de ceux trouvés par la technique électrochimique. Cependant, les vitesses données par absorption atomique sont largement plus élevées (figure 23).
différentes méthodes d analyse étudiées, à T = 90°C.
Méthodes Vitesse de corrosion des alliages (mdj)
D analyse 3127hMo 2418MoN 5923hMo FCr
Absorption atomique 111,7 110,2 115,1 117,6 ICP 33,8 33,6 26,9 36,5 Electrochimie 16,9 21,1 23,5 26,4 0 40 80 120 V co rr ( m d j)
3127hMo 2418MoN 5923hMo FCr Alliages
Electrochimie ICP Absorption atomique
Figure 23 : Variation de Vcorr en fonction des trois méthodes d analyse étudiées, à T = 90°C.
Par ailleurs, il ressort de cette étude que c'est la technique électrochimique qui permet de mieux caractériser ces alliages vis à vis de la résistance à la corrosion. Dans cette méthode, il faut tenir compte de plusieurs paramètres (Ip, Icr, stabilité du film passif, phénomènes secondaires...). Les techniques basées sur les pertes de poids ne sont pas recommandées pour caractériser et établir un classement adéquat de ce type
d'alliages très résistants et subissant de très faibles pertes de masse. III-3 EFFET DES SULFURES
Nous nous sommes intéressés dans cette partie du travail à l évolution de l allure des courbes de polarisation des alliages dans l acide phosphorique synthétique (40% H3PO4) contenant des teneurs en ion S2- allant de 5 à 20 ppm.
III-3-1 Cas de l alliage 3127hMo
Les courbes de polarisation obtenues à différentes teneurs en S2- (figure 24) révèlent une bonne stabilité de la passivité de cette nuance dans tout le domaine de potentiel étudié. Le domaine de passivité s étend du potentiel de passivation primaire (Epp) jusqu au potentiel d oxydation de l eau. Aucune transpassivité associée à une dissolution de l alliage n a été mise en évidence.
La contamination du milieu par les ions sulfures entraîne, pour les premières teneurs en S2- (5 et 10 ppm), un léger déplacement du potentiel de corrosion vers des valeurs plus négatives. Cependant, pour des teneurs en S2- plus élevées (20 ppm), Ecorr subit une augmentation d environ 100 mV.
Figure 24 : Courbes de polarisation de l alliage 3127hMo dans l acide phosphorique à 40% de H3PO4, pollué par les ions sulfures.