Table des matières
Table des matières………I Avant propos……….VII Abréviations……….VIII Résumé..………X
Partie I : Introduction
Introduction..………...2
A. Généralités sur le genre Astragalus………..3
I. Historique……….3
II. Description botanique………3
III. Répartition et écologie………..…4
B. Toxicité du genre Astragalus ……….5
?
Astragales non toxiques……….5?
Astragales toxiques………5I. Les espèces riche en Sélénium……….6
I. 1. Forme du Sélénium dans les plantes………..6
I. 2. Facteurs influençant l’accumulation du Se par la plante……….8
I. 3. Circonstances et évolution d’intoxication………...9
I. 4. Les espèces animales sensibles………9
I. 5. Les symptômes………...9
I. 6. Les lésions ………..10
II. Les espèces riches en produits nitrés………..11
II. 1. Circonstance et évolution de l’intoxication………11
II. 2. Les espèces animales sensibles………1 2 II. 3. Les symptômes……….…………12
II. 4. Les lésions……….…………13
II. 5. Principes Toxiques………..13
II. 5. 1. Identification des composés toxiques………....13
II. 5. 2. Toxicité du 3-NPA et 3-NPOH………...15
II. 5. 4. Mécanisme de l’intoxication………..16
III. Les espèces provoquant le locoïsme………18
III. 1. Circonstances et évolution de l’intoxication………18
III. 2. Espèces animales sensibles………...19
III. 3. Principes toxiques……….19
III. 4. Les symptômes………...21
III. 5. Les lésions……….22
IV. Les astragales du Maroc………..24
IV. 1. Les astragales non toxiques……….24
IV. 2. Les astragales toxiques………24
V. Toxicité d’Astragalus lusitanicus……….28
V. 1. Description botanique ………...28
V. 2. Répartition et écologie ………..28
V. 3. Circonstances d’intoxication………30
V. 4. Espèces animales affectées………30
V. 5. Symptômes………..30
V. 5. 1. Intoxication aiguë………...31
V. 5. 2. Intoxication chronique………...31
V. 6. Les lésions………32
V. 7 . Etude chimique d’A. Lusitanicus………..33
Conclusion………35
Partie II : Travaux expérimentaux de thèse
Chapitre 1 : Etude toxicologique de l’hypaphorine :
un alcaloïde isolé d’Astragalus lusitanicus
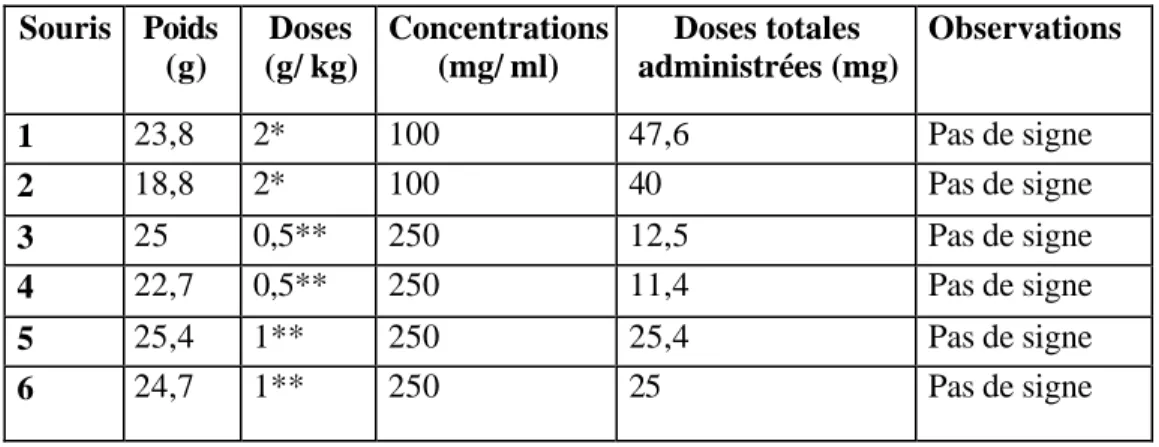
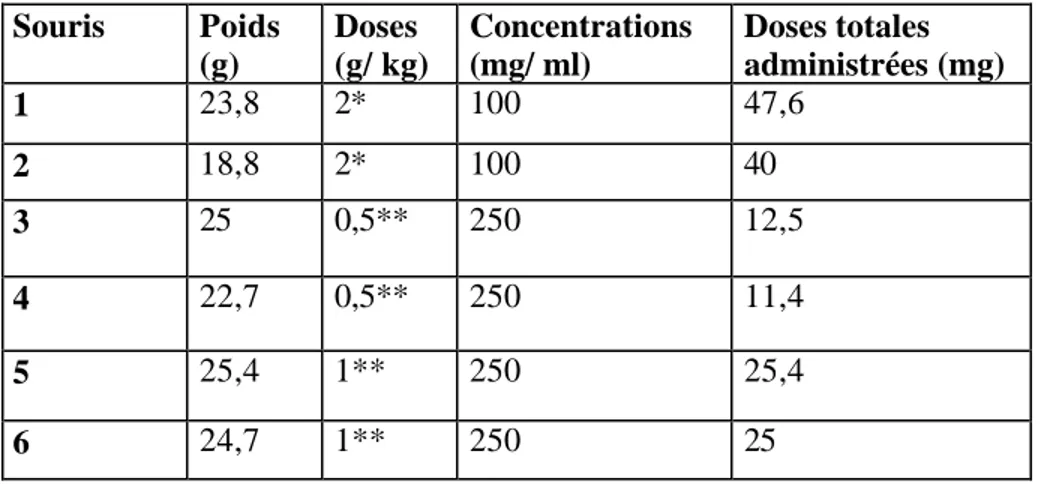
Introduction……….38 I. Matériel et méthodes………...39 I. 1. Matériel de l’expérimentation………39 I. 1. 1. Plante……….…...39 I. 1. 2. Animaux d’expérience……….39 I. 1. 3. Révélateurs………...39 a. Réactif d’Erlhich……….39 b. Réactif de Dragendorff………...39I. 2. Isolement de l’hypaphorine d’A. lusitanicus………..40
I. 3. Synthèse de l’hypaphorine………..………..41
I. 4. Protocole d’intoxication expérimentale des animaux par l’hypaphorine…42 II. Résultatset discussion………43
II. 1. Détermination structurale de l’hypaphorine………43
II. 2. Résultats des tests de l’hypaphorine………..51
Conclusion……….54
Chapitre 2 : Etude phytochimique et toxicologique
d'Astragalus lusitanicus
Introduction………56 I. Matériel et méthodes………..57 I. 1. Matériel de l’expérimentation………...57 I. 1. 1. Plante……….……..57 I. I. 2. Animaux d’expérience………...57 I. I. 3. Solvants organique………..57 I. 2. Extractions………..58I. 2. 1. Ex traction avec des so lvants organiques………...58
I. 2. 2. Macération dans l’eau et extraction du macérât par le n-butanol…59 I. 2. 3. Décoction ………59
I. 3. Protocole d’intoxication expérimentale des animaux………61
I. 3. 1. Administration des extraits aux solvants organiques………61
I. 3. 2. Administration des extraits aqueux d’A. lusitanicus………...61
I. 3. 3. Administration du décocté d’A. lusitanicus………....63
II. Résultats et discussion ………64
II. 1. Résultats de l’administration des extraits aux solvants organiques... 64
II. 2. Résultats de l’administration de la plante fraîche et de ses extraits ...65
II. 3. Résultats de l’administration du décocté………...66
Chapitre 3 : Toxicité des fractions issues du décocté
d'Astragalus lusitanicus
Introduction……….69 I. Matériel et méthodes………...70 I. 1. Matériel de l’expérimentation………70 I. 1 . 1. Décocté……….70 I. 1. 2. Animaux d’expérience……….70 I. 1. 3. Systèmes chromatographiques ………..70 I. 1. 4. Réactif à la ninhydrine………70 I. 1. 5. Solvants organiques………71I. 2. Chromatographie liquide sur colonne……….………..71
I. 2. 1. Chromatographie sur silice RP2 du décocté………71
I. 2. 2. Chromatographie sur silice de la fraction C……….74
I. 3. Protocole d’intoxication expérimentale des animaux………..76
I. 3. 1. Administration des fractions FI et FII……….……...76
I. 3. 2. Administration des fractions A, B, C1, C2 et D……….…76
I. 3. 3. Administration des fractions CI, CIII et CIV………...77
I. 3. 4. Administration des fractions SI, SII, SIII et SIV……….78
I. 4.Recherche de l’hypaphorine par CCM de silice………..78
II. Résultats et discussion ………..79
II. 1. Résultats des tests de toxicité des fractions FI et FII………..79
II. 2. Résultats des tests de toxicité des fractions A, B, C1, C2 et D………79
II. 3. Résultats des tests de toxicité des fractions CI, CIII et CIV………..80
II. 4. Résultats des tests de toxicité des fractions SI, SII, SIII et SIV……….80
II. 5. Résultat de la recherche de l’hypaphorine………..81
Conclusion………82
Chapitre 4 : Isolement du principe toxique
Introduction……….84I. Matériel et méthodes………...85
I. 1. Matériel de l’expérimentation………85
I. 1. 1. Fraction C……….85
I. 2. Isolement du principe toxique………..85
II. 2. 1. Chromatographie de la fraction C toxique sur colonne de RP18…85 II. 2. 2. Chromatographie de la fraction H4 sur colonne de LH20 ………..88
II. 2. 3. Chromatographie de H4 sur SiO2 avec le système CMA…………90
II. 2. 4. Chromatographie de H4 sur SiO2 avec le système BAE…………..92
II. 2. 4. CCMP des fractions H2 et HK5……….94
I. 3. Protocole d’intoxication expérimentale des animaux……….95
I. 3. 1. Administration du produit T2………..………95
I. 3. 2. Administration des produits T1, T3 et T4………..………95
II. Résultats et discussion ……….………..96
Conclusion………98
Chapitre 5 : Détermination de la structure du principe
toxique et des autres produits isolés d’ Astragalus lusitanicus
Introduction……….100I. Matériel et mé thodes………..………….101
I. 1. Spectrosco pie de masse………..………….101
I. 2. RMN monodimensionnelle……….……....101
I. 3. Résonance Magnétique Nucléaire bidimensionnelle : RMN 2D……….101
I. 3. 1. Heteronuclear Simple Quantum Coherence : HSQC………..101
I. 3. 2. Coorrelate d Spectroscopy : COSY……….………101
I. 3. 3. Heteronuclear Multiple Bond Coherence : HMBC…………..……102
I. 3. 4. Nuclear Overhauser Effect Spectroscopy : NOESY………....102
I. 3. 5. Pouvoir rotatoire………..………...102
II. Résultatset discussion………...103
II. 1. Détermination de la structure de la Lusitoxamide T2………103
II. 1. 1. Analyse des spectres de RMN 1H, 13C de la Lusitoxamide T2……103
II. 1. 2. Spectre de RMN 15N de la Lusitoxamide T2………....114
II. 2. Détermination de la structure de la Lusitoxamine TD……….….….116
II. 2. 1. Analyse des spectres de RMN 1H, 13C de la Lusitoxamine TD….116 II. 2. 2. Spectre de RMN 15N de la Lusitoxamine TD……….126
II. 3. Détermination de la structure de la Lusitoxamidoside F (T1)……….128
II. 4. Détermination de la structure de la Lusitoxamidoside G (T3)………141
II. 5. Détermination de la structure du produit T4 ………...143
Conclusion………..152
Chapitre 6 : Détermination de la stéréochimie de la
Lusitoxamide
Introduction………154 I. Matériel et méthodes……….160 I. 1. Matériel d’expérimentation………..160 a. Produits de réactions..………..160 b. Solvants organiques………..160I. 2. Condensation de TME avec la (R) et la (S)-BPG………160
I. 2. 1. Protection de la fonction acide de la Lusitoxamide………160
I. 2. 2.Condensation de TME avec la (R) et la (S)-BPG……….162
II. Résultats et discussion……….164
II. 1. Analyse des spectres de RMN 1H, 13C de la Lusitoxamine O -méthylée….164 II. 2. Analyse RMN à haute résolution de la (S)- et (R)-BPG amide de TME.…172 II. 2. 1. La (S)-BPG amide de O-méthylusitoxamine………..173
II. 2. 2. La (R)-BPG amide de O-méthylusitoxamine ………...184
II. 3. Stéréochimie de la Lusitoxamide………..195
Conclusion………199
Discussion générale
………...200Conclusion générale
………...207Perspectives
………...207Avant propos
Le travail a été réalisé au Laboratoire de Chimie des Plantes et de Synthèse Organique et Bioorganique de la Faculté des Sciences de Rabat en collaboration avec le Laboratoire de Toxicologie de l’Institut Agronomique et Vétérinaire Hassan II de Rabat sous la codirection du Professeur Zoubida CHARROUF et du Professeur Driss LAMNAOUER.
La partie chimique et une partie de l’étude phytochimique de ce travail ont été réalisées dans le Laboratoire de Chimie des Substances Naturelles (ESA 8041 CNRS) du Muséum National d’Histoire Naturelle de Paris sous la direction du Professeur Akino JOSSANG et du Professeur Bernard BODO, Directeur du laboratoire.
L’objectif principal de ce travail est d’identifier le(s) principe(s) toxique(s) d’Astragalus lusitanicus. Cette espèce de la famille des fabacées, est responsable d’intoxications graves chez les ovins et les caprins et engendre des pertes économiques importantes pour les éleveurs.
La première partie du travail réalisé est une synthèse bibliographique et comporte :
? Une étude botanique du genre Astragalus, ainsi que la toxicité du genre. ? Les différentes espèces d’astragales du Maroc.
? Une étude sur la chimie de l’espèce A. lusitanicus et sur sa toxicité.
La deuxième partie concerne les expérimentations et les travaux réalisés dans le but de déterminer le principe toxique d’A. lusitanicus. Elle comporte six chapitres : ? Le premier est une recherche réalisée pour confirmer ou infirmer la toxicité de l’hypaphor ine. Cet alcaloïde isolé d’A. lusitanicus est rapporté dans la littérature comme étant un poison convulsivant.
? Le deuxième et le troisième chapitres sont consacrés à l’étude phytochimique et toxicologique des extraits et des fractions issues d’ A. lusitanicus.
? Le quatrième chapitre a été réservé à l’isolement du principe toxique et à la confirmation de sa toxicité par la détermination de la dose létale .
? Le cinquième chapitre est consacré à la détermination de la structure du principe
toxique et d’autres produits isolés de la fraction toxique.
? Le sixième chapitre décrit la méthode appliquée pour la détermination de la
Liste des abréviations
AcEt : acétate d’éthyle.9-AMA : acide 9-anthrylméthoxyacétique. BuOH : n-butanol.
BAE : n-butanol-acide acétique -eau.
BPG : n-(tertiobutoxycarbonyl) phénylglycine. Ca2+ : ion calcium.
CCM : chromatographie sur couches minces.
CCMP : chromatographie sur couches minces préparatives. CDCl3 : chloroforme deutéré.
CD3OD : méthanol deutéré.
Cl- : ion chlorure.
CMA : chloroforme-méthanol-acide acétique. COSY : correlated spectroscopy.
CPG : chromatographie en phase gazeuse.
CPG-SM : chromatographie en phase gazeuse couplée à la masse. Cq : carbone quaternaire. d : déplacement chimique. d : doublet. D2O : H2O deutérée. Da : Dalton. dd : doublet dédoublé.
Dose adm. : dose administrée. Dose calc. : dose calculée. DMF : diméthyle formamide.
DMSO-d6 : diméthyle sulfate deutéré.
GABA : ?-aminobytyric acid.
GAD : glutamate acid décarboxylase. HCl : acide chlorhydrique.
HOBT : hydroxybenzotriazole.
HPLC : chromatographie liquide à haute performance. HMBC : heteronuclear multiple bond coherence. HSQC : heteronuclear simple quantum coherence.
J : constance de couplage. K : Kélvin.
m : multiplet.
masse calc. : masse calculée. MHz : méga hertz.
Mg2+ : ion magnésium.
MPA : acide méthoxyphénylacétique.
MTPA : méthoxytrifluorométhylphénylacétique. Nat. Pdt. Adm. : nature de produit administré. NMDA : acide N-méthyl-D-aspartique. N-Me-morpholine : N-méthylmorpholine. NOE : nuclear overhauser.
NOESY : nuclear overhauser effet spectroscopy.
3-NPA; 3-NPOH : 3-nitro propionic acid; 3-nitro propanol.
PyBOP : benzotriazol-1-yloxytripyrolidinophosphonium.hexafluorophosphate. Pdt. Adm. : produit administré.
ppm : partie par million. P y-d5 : pyridine deutérée.
Qtités. Tots. Adms. : quantités totales administrées.
RMN 2D : résonance magnétique nucléaire à deux dimensions. RMN 1H : résonance magnétique nucléaire de proton.
RMN 13C : résonance magnétique nucléaire de carbone 13. RMN 15N : résonance magnétique nucléaire d’azote 15.
RP2 et RP18 : silice en phase inversée, diméthylée et octadécylée.
Rt : temps de rétention. Rf : rapport frontal. s : singulet. SAR : structre-activity-rolationship. Se : sélénium. SM : spectroscopie de masse. SNC : système nerveux centrale. SiO2 : silice.
Résumé
Astragalus lusitanicus est une espèce de la famille des fabacées, rencontrée dans les
pays à l’ouest de la méditerrané notamment au Maroc où elle est connue par sa toxicité chez les petits ruminants. L’intoxication par cette plante se traduit par des symptômes nerveux graves menant à la mort des animaux et à des conséquences socio- économiques importantes touchant les éleveurs.
Le principe toxique de cette astragale est différent de ceux rencontrés dans d’autres astragales vénéneuses à savoir : (1) Celles contenant l’agent du locoïsme : la swainsonine. (2) Celles contenant la misérotoxine, glycoside libérant par hydrolyse le 3- nitropropanol et l’acide 3-nitropropionique toxiques. (3) Les astragales accumulatrices de sélénium à des concentrations toxiques.
Le principe toxique d’A. lusitanicus n’est pas n’en plus l’hypaphorine isolée de la plante et rapportée dans la littérature, par erreur, être un poison convulsivant.
L’étude expérimentale réalisée sur des étapes, menant de pair les tests toxicologiques et l’étude phytochimique, a permis de montrer que le principe toxique n’est pas extrait par les solvants organiques mais possède plutôt un caractère hydrophile. Il n’est pas détruit à la température d’ébullition et est extrait par décoction.
Le fractionnement du décocté par chromatographie sur colonne de silice en phase inversée RP2 a permis de ramener la dose toxique de 30 g de plante fraîche/ kg de poids vif à 125 mg/ kg d’une sous fraction du décocté ; soit un facteur de l’ordre de 240.
Le principe toxique T2, nommé Lusitoxamide a été isolé par différentes techniques chromatographiques. La structure de T2 a été identifiée par spectroscopie de masse et de RMN mono et bidimensionnelle comme : 2-N-acétyl-3-(?-L-glutamyl)aminoisoxazolidine. Sa configuration absolue est aussi déterminée comme S-glutamine.
La Lusitoxamide est létale chez les agneaux et les chèvres respectivement aux doses de 25 mg/ kg et 10 mg/ kg par injection intraveineuse.
D’autres nouveaux produits non toxiques accompagnant la Lusitoxamide dans la sous fraction toxique ont été également isolés. Leurs structures ont été déterminées par les méthodes spectroscopiques. Au bilan,
1/ Lusitoxamide : 2-N-acétyl- 3-(?-L-glutamyl)aminoisoxazolidine. 2/ Lusitoxamine : 3-(?-L -glutamyl)aminoisoxazolidine.
3/ Lusitoxamidoside F : a-(6-fructofuranosyl)Lusitoxamine. 4/ Lusitoxamidoside G : 1ß-(D-glucosipyranosyl)Lusitoxamine . 5/ Caffeoyloside : 5’-caffeoyl ribose.
Mots clés : Astragalus lusitanicus, intoxication, ovins, caprins, principe toxique, Hypaphorine, Lusitoxamide, Lusitoxamine, Lusitoxamidoside, Caffeoyloside.
Partie I :
Introduction
Le Maroc est caractérisé par sa diversité à la fois climatique et écologique. En effet, on y trouve des montagnes et des plaines, des zones côtières, des zones forestières et des zones désertiques. Le climat varie d’une saison sèche à une saison pluvieuse avec toutes les possibilités de changement entre les deux extrêmes. Toutes ces conditions expliquent l’existence d’un patrimoine botanique important (+ de 4300 taxons) qui ne peut être entièrement sans inconvénient. En effet, plus de deux cents espèces, distribuées selon la nature du sol et le climat qui règne, sont signalées toxiques pour l’Homme et les animaux [92, 22, 176]. Parmi celles-ci Astragalus lusitanicus du genre
Astragalus est considérée comme l’une des espèces vénéneuses les plus redoutées par
les elveurs.
Le genre Astragalus est l'un des plus importants genres de la famille des légumineuses. Ce genre est représenté dans le monde par plus de deux milles espèces y compris de nombreuses espèces toxiques [69]. Dans les régions du bassin Méditerranéen, près de cinq cents espèces du genre Astragalus ont été dénombrées et prés de quarante sept espèces sont connues au Maroc [151], et sont partagées entre espèces toxiques et espèces non toxiques dont cinq sont endémiques [43, 84, 131, 156].
Les espèces toxiques du genre Astragalus ont été identifiées dans le monde entier depuis une centaine d'années. Selon la nature du principe toxique qu'elles renferment, elles sont classées, en trois catégories :
- Les espèces accumulatrices de sélénium à des teneurs élevées. - Les espèces riches en produits nitrés.
- Les espèces contenant la swainsonine qui produit le locoïsme, maladie décrivant le comportement anormal d’une personne ou d’un animal.
A. lusitanicus dont le principe toxique n’est pas connu est une espè ce
vénéneuse, hautement toxique [40, 3, 44, 56, 91] qui pousse au Maroc et dans d'autres pays Méditerranéens [50, 152, 153, 154, 178, 177, 180]. Elle est responsable de fréquentes mortalités de bétail et causant des dégâts économiques importants surtout par les mortalités qu'elle engendre chez les petits ruminants [1, 2, 38, 84, 139]. Cette espèce n'est pas encore classée et n'appartient à aucune des trois catégories. Bien que l'intoxication par cette espèce induise des crises épileptiques, cliniquement similaires à celles induites par les plantes produisant le locoïsme, aucune preuve n'a pu être apportée sur une éventuelle présence de la swainsonine dans la plante.
A. Généralités sur le genre Astragalus
I. Historique
Le mot astragale est d'origine grecque ; il désigne l'os de la cheville ou plus exactement l'un des os de l'articulation tibiotarsienne. La dénomination de astragale vient de la ressemblance du bruit des graines séchées de la plante avec celui de l'os, quand ils tombent sur une surface solide [69].
L'intoxication par les espèces du genre Astragalus a été décrite pour la première fois chez le mouton en 1873 à l'ouest des Etats Unis [64] puis dans d'autres pays du monde tels que le Canada, l'Australie, l'Espagne, le Maroc et autres [113, 114, 40].
Aux Etats Unis, il a été constaté que les espèces toxiques du genre Astragalus occupaient le premier rang dans les pertes annuelles causées par les intoxications d'origine végétale qui sont estimées à 107 Millions de dollars par an dans les années 1970 [134].
II. Description botanique
Le genre Astragalus, classé dans la sous famille des papilionacées, appartient à l'embranchement des cormophytes; sous embranchement des angiospermes, classe des dicotylédones, sous classe des dialypétales; tribu des galégas. C'est l'un des plus importants genres de la famille des fabacées.
La classification du genre Astragalus est très complexe et l'identification de ses espèces et leur taxonomie sont difficiles à établir (Figure 1).
III. Répartition et écologie
Le genre est représenté dans le monde par prés de deux milles espèces (Figure 2) localisées dans l'hémisphère Nord du globe terrestre [70, 92] et dans la cordillères des Andes [205].
Dans les pays du bassin Méditerranéen cinq cents espèces ont été décrites dont une cinquantaine en Afrique du Nord [151, 82]. Au Sahara Algéro-Marocain, une quinzaine d'espèces ont été identifiées [140].
La croissance des espèces du genre Astragalus se produit de l'automne au printemps. Elles demeurent vertes pendant l'hiver quand l'herbe est peu disponible [23]. Chez certaines espèces, les graines peuvent maintenir leur vitalité pendant quarante ans [69, 134].
Figure 1: Historique de la taxonomie du genre Astragalus et sa relation avec les genres Oxytropis et Phaca .
B. Toxicité du genre Astragalus
Le genre Astragalus regroupe les espèces toxiques et les espèces non toxiques.
? Astragales non toxiques
La majorité des astragales ne sont pas toxiques. Certaines sont utilisées pour l'alimentation du bétail. Astragalus nuttalianus et Astragalus cicer rencontrées respectivement dans le Sud-Ouest et à l’Ouest des Etats Unis sont très appréciées par le bétail. D’autres comme Astragalus tennelus bien que non toxiques, elles ne sont pas appréciées par les animaux [71].
?
Astragales toxiques
Les espèces toxiques du genre Astragalus sont classées selon la nature du principe toxique domina nt et le type d’intoxication qu’elles provoquent, en trois catégories [71] :
- Les astragales accumulatrices de Sélénium. - Les astragales synthétisant des produits nitrés.
- Les astragales renfermant des alcaloïdes indolizidiques.
Signalons qu’il existe d’autres genres de la famille des fabacées tels que Swainsona et Oxytropis, dont certaines espèces causent les mêmes troubles neurologiques que ceux observés lors de l’intoxication par les locoweeds [18, 121, 186].
I. Les espèces riches en Sélénium
Le Sélénium (Se) est un élément indispensable à faibles doses pour la croissance des plantes. Il est présent en concentrations importantes dans les sols dits sols sélénifères [8]. Certains végétaux fixent le Se quelle que soit la forme sous laquelle il se trouve, d’autres transforment le Se insoluble en Se hydrosoluble, ce qui augmente considérablement sa toxicité.
Les teneurs normales en Se dans les fourrages sont de 0,1 à 0,5 ppm et à partir de 5 ppm, les risques d’intoxication du bétail deviennent élevés [71].
Les plantes qui poussent sur des sols sélénifères peuvent accumuler le Se à des taux allant de moins de 1 ppm jusqu’à plusieurs milliers de ppm [4, 7, 155]. Selon leurs teneurs en Se, ces plantes ont été subdivisées en plantes indicatrices et non indicatrices de Se. En effet, les plantes indicatrices exigent du Sélénium pour leur croissance. Elles ont des racines peu profondes qui accumulent plus de 30 ppm [195]. Dans ce type de plantes, on distingue les plantes indicatrices secondaires qui sont les plantes qui absorbent jusqu'à 1000 ppm et les plantes indicatrices primaires qui accumulent plusieurs milliers de ppm et dont le Se est soluble dans l'eau [124, 56]. Par contre dans les plantes non indicatrices, la teneur en Se est de 5 à 40 ppm [63].
I. 1. Forme du Sélénium dans les plantes
Le Sélénium peut exister sous des formes organiques et des formes inorganiques (Figure 1). Il se trouve chez 80 % des plantes accumulatrices du Se, sous la forme de Se-méthyl-sélénocystèine, composé, d’après Whanger, identifié dans toutes les espèces accumulatrices examinées [195] et qui n’a pas été détecté chez les espèces non accumulatrices. Cette forme est à la fois tolérée par la plante et facilement absorbée par l’organisme animal ou humain.
Le peptide ?-glutamyl Se-méthyl-sélénocysteine a été aussi identifié dans d’autre espèces d’Astragalus accumulatrices du Se comme A. bisulcatus [184]. Ce peptide est rapporté comme agent anticancereux [33].
H
2N
Se
CH
3CO
2H
H
R H N CO2H OH
NH
2H
Se CH3CO
2H
S SSe -méthyl-sélé nocystèine ?-glutamyl Se -méthyl-sélénocysteine
H2N Se CO2H H H H2N CO2H H Se SelenoCysteine Selenomethionine Se O OH O OH Acide selenique (Selenate) Selenious acide (Selenite) Se O OH OH P OH O OH OH Acide phosphorique (Phosphate) S O OH OH O C OH O OH Acide carbonique (Carbonate) Acide sulfurique (Sulfate) CH3
Figure 3 : Formes organiques et inorganiques du Se.
Il a été rapporté que l’introduction de l’enzyme méthyl-sélénocysteine transferase dans Astragalus thaliana non accumulatrice de Se a permis à cette dernière d’avoir le pouvoir de synthétiser le ?-glutamyl méthyl-sélénocysteine et le Se-méthyl-sélénocystèine rapporté dans un récent travail jouant un rôle significatif dans la réduction de l’incidence des cancers des poumons, du colon et de la prostate [29] .
I. 2. Facteurs influençant l’accumulation du Se par la
plante
De nombreux facteurs influencent l'accumulation du Se par les plantes [195], notamment, la nature du sol telle que l'existence des sulfures qui activent l'absorption du Se du sol par la plante [144].
Les sols sélénifères sont généralement alcalins et contiennent des carbonates de calcium, ce qui favorise la forme hydrosoluble représentée par les sélénates (SeO4-) qui
sont assimilés par les plantes et qui peuvent être accumulés par certaines espèces végétales comme les astragales. Notons que plusieurs sols contiennent des taux élevés en Se mais la faible teneur de la forme hydrosoluble dans les végétaux ne leur confère pas une toxicité élevée.
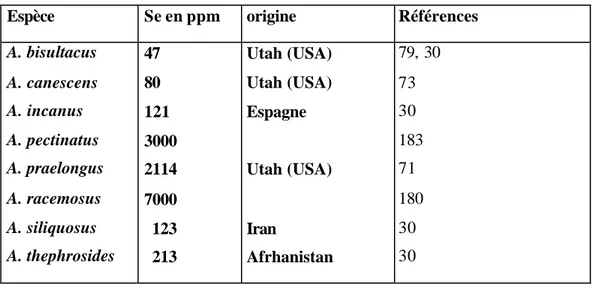
Prés de 24 espèces de Astragalus sont connues comme accumulatrices du Se [79] [30, 180]. Quelques exemples de la teneur du Se en ppm des espèces de Astragalus sont donnés dans le tableau 1.
Les espèces les plus connues sont A. bisulcatus, A. thephorosides, A.
praelongus et A. racemosus qui peuvent contenir jusqu’à 7000 ppm de Sélénium.
Tableau 1 : Quelques espèces du genre Astragalus accumulatrices de Sélénium. Espèce Se en ppm origine Références
A. bisultacus A. canescens A. incanus A. pectinatus A. praelongus A. racemosus A. siliquosus A. thephrosides 47 80 121 3000 2114 7000 123 213 Utah (USA) Utah (USA) Espagne Utah (USA) Iran Afrhanistan 79, 30 73 30 183 71 180 30 30
I. 3. Circonstances et évolution de l’intoxication
Les premières intoxications attribuées au Se ont été observées en 1857 chez le cheval [79]. Le Se n’a été identifié comme agent responsable de ces intoxications que depuis 1934 [195]. Généralement, la consommation des plantes accumulatrices du Se est médiocre à cause de leur odeur désagréable et de leur mauvais goût [73, 125, 30].
L’intoxication des animaux par les astragales accumulatrices du Se dépend du taux de Sélénium dans la plante et de la fréquence de la consommation de cette plante [137]. Elle apparaît sous deux formes aiguë ou chronique.
L’intoxication aiguë survient suite à l’ingestion des astragales indicatrices de Se [155]. Elle résulte de la consommation d’une grande quantité de ces plantes en un temps court. Elle est rare à cause de la mauvaise odeur de ces plantes et se produit généralement en hiver quand l’herbe fait défaut [69]. Cependant, l’intoxication chronique est plus fréquente car elle survient suite à l’ingestion de petites quantités de plantes accumulatrices de Se pendant une longue période. De la forme chronique, deux types d’intoxication ont été répertoriés :
- ?Alkali-disease? ou maladie causée par les métaux alcalins attribuée à l’ingestion des plantes non-indicatrices de Se [195, 79].
- ?Blind-staggers? ou allure chancelante d’un animal aveugle. Elle est associée à l’ingestion de plantes indicatrices de Se pendant plusieurs mois en quantités limitées [87].
I. 4. Les espèces animales sensibles
L’intoxication par les Astragales accumulatrices du Sélénium se rencontre généralement chez les bovins, les ovins et les équidés [79, 73]. L’homme aussi peut être intoxiqué par le Sélénium en consommant des plantes qui poussent sur des sols selénifères ou leurs graines [195].
I. 5. Les symptômes
L'intoxication aiguë est caractérisée par une faibless e générale avec une respiration audible et une perte de contrôle moteur des membranes. Elle débute par une diminution d'appétit, une démarche chancelante, accompagnées d’une diarrhée et de polyurie et une accélération des rythmes cardiaque et respiratoire. La mort survient soudainement au terme d'une apnée, en quelques heures [79].
Par contre dans la forme ''Alkali-disease'' de l'intoxication chronique, les signes cliniques se manifestent par une dépilation, une perte d'appétit et de poids, des boitements suite à une déformation des sabots et une diminution des performances reproductives se traduisant par des avortements et des malformations congénitales. L’animal fini par mourir suite à des difficultés de locomotion [79]. Quant à la forme "Blind- staggers", elle débute par l'incoordination des mouvements, un trouble de la vision et une faiblesse générale accompagnée d'une perte d'appétit. En fin, l'animal devient aveugle et meurt suite à une détresse respiratoire et à une paralysie [79].
I. 6. Les lésions
L'étude macroscopique, dans le cas de l'intoxication aiguë, a montré des pétéchies, qui se traduisent par de petites taches rouges dues à une congestion aiguë et à des hémorragies au niveau de l'endocarde, un afflux de sang dans les poumons, une congestion du foie et une entérite traduisant une inflammation de la muqueuse de l'intestin grêle [69, 73].
Microscopiquement, une congestion aiguë de l'endocarde, une hémorragie et un œdème au niveau des alvéoles pulmonaires ont été observés. De même, un œdème, des hémorragies et des lésions de nécrose ont été aussi notés au niveau des muqueuses gastriques et intestinales [73].
L'examen post-mortem dans le cas de l'Alkali-disease a révélé une inflammation du tractus gastro-intestinal, une congestion pulmonaire et une augmentation du fluide dans le sac péricardique [79]. Alors que l'étude microscopique a montré une fibrose hépatique et une inflammation du parenchyme rénal et du tube digestif [79]. Dans le cas du blind-staggers, l'étude macroscopique a montré des congestions pulmonaires viscérales, une hydrocarde et des pétéchies péricardiques [79]. Microscopiquement, une congestion pulmonaire et une gastrite hémorragique avec une inflammation de la muqueuse gastrique ont été observées [79].
II. Les espèces riches en pro duits nitrés
Plus de 450 espèces de plantes, notamment, les espèces du genre Astragalus, contiennent le 3-nitropropanol (3-NPOH) ou l'acide 3-nitropropionique (3-NPA) [9, 197, 198, 206]. Dans la plante, ces nitrotoxines existent sous forme de glucosides qui s’hydrolysent rapidement dans le rumen pour donner le 3-NPOH et le 3-NPA.
Chez les espèces riches en composés nitrés, on distingue deux classes selon le taux de NO2 dans la plante. En effet, la première classe est constituée par les astragales
dont la dose toxique en NO2 ne dépasse pas 100 mg/ kg; ce sont les espèces qui
accumulent le 3-NPOH comme forme toxique. La deuxième classe est constituée des astragales qui renferment plus que 100 mg/ kg de NO2, ce sont généralement celles
accumulant le 3-NPA.
Près de 263 espèces et variétés du genre Astragalus synthétisant les nitrotoxines ont été identifiées en Amérique du Nord [16, 166, 121, 196, 105, 70] dont la miserotoxine, glucoside du 3-NPOH, est présente dans 56 espèces du genre Astragalus [203, 70]. Certaines espèces et variétés d’astragales renfermant les plus grandes quantités de misérotoxine sont spécifiques à des régions particulières où des milliers de cas d’intoxications d’ovins et de bovins sont observées chaque année [197, 198]. On cite à titre d'exemple A. emoryanus qui pousse au Texas et en Arizona [15], A.
hylophilus au Colorado [202], A. tetrapterus au Nevada et en Utah, A. miser var. obligifolius au Colorado et au Montana et A. miser var. serotinus appelée également
"Emory milkvetch" ou vesce la iteuse qui est spécifique à l'Ouest du Canada [204, 200].
II. 1. Circonstance et évolution de l'intoxication
Les premières intoxications par les espèces riches en composés nitrés ont été décrites en 1920 chez le bétail par A. tetrapterus [114] puis en 1927, l’empoisonnement des moutons par A. campestris [18]. Ces intoxications sont de type chronique ; elles surviennent suite à l'ingestion répétée de faibles quantités de la plante [69].
Les intoxications par les espèces riches en composés nitrés diffèrent selon les régions ; par exemple chez les bovins et les ovins élevés en Amérique de Nord (Canada, Etats-Unis) et au Mexique, pays dans lesquels on trouve les espèces végétales renfermant les plus grandes quantités de miserotoxine, on compte des milliers de cas d'intoxication chaque année [198]. Ces cas d’intoxication diffèrent aussi selon le stade
de croissance de la plante ; ils sont très élevés au stade de la floraison quand la plante est plus riche en toxine et ils diminuent au fur et à mesure que la plante mûrit [69].
II. 2. Les espèces animales sensibles
Les intoxications par les astragales accumulatrices de produits nitrés affectent généralement les bovins et les ovins [70, 197, 205]. Elles sont signalées aussi chez le cheval, le lapin et la volaille comme le poussin et le pigeon [200]. Le chat, le rat et la souris sont également des espèces sensibles à l'intoxication par les astragales riches en composés nitrés [100, 106, 199, 201, 70].
Les ruminants, surtout les bovins, se révèlent plus sensibles à l' intoxication par les nitrotoxines que les monogastriques [105, 200].
Expérimentalement, les moutons se révèlent plus résistants que les bovins.
II. 3. Les symptômes
Les intoxications de l’espèce ovine et de l’espèce bovine par les astragales accumulatrices de composés nitrés se manifestent selon la quantité ingérée et selon le taux de toxine dans la plante [105, 200, 69, 198] sous deux formes d’intoxication : forme aiguë et forme chronique.
Lors des intoxications aiguës, les animaux sont très affaiblis et urinent fréquemment ; ils présentent une intense détresse respiratoire, un jetage mousseux, des troubles de l'équilibre, des déformations du boulet [109] et ils peuvent mourir de collapsus cardiaque et respiratoire 24 heures après l'ingestion de la plante [197, 200, 105]. L'intoxication chronique ,peut durer plusieurs jours [109]. Les premiers signes de la forme chronique se manifestent par des dépressions et avec le temps, l'animal développe des troubles respiratoires et devient de plus en plus cachectique suite à une paralysie des membres postérieurs et il finit par mourir [200, 198].
Les symptômes aigus et chroniques dus aux astragales accumulatrices de composés nitrés peuvent être développés expérimentalement au laboratoire chez le rat, la souris, le poussin, le pigeon et le lapin [105, 200, 69].
II. 4. Les lésions
Les lésions dues à l'intoxication par les astragales accumulatrices de produits nitrés se localisent principalement au niveau du système nerveux, les poumons, le cœur et le foie. En effet, un œdème et une congestion pulmonaire, une hémorragie myocardique et des congestions cérébrales ont été observés dans les formes aiguës [69, 70]. Dans les formes chroniques, la congestion et l'hémorragie au niveau du cerveau ont été observées avec une augmentation du volume du liquide céphalo -rachidien [130]. Une congestion au niveau du foie et des hémorragies myocardiques avec souvent un hydropéricarde sont aussi observées lors de l'intoxication chronique chez les animaux [71]. Microscopiquement, l’étude a révélé des lésions surtout au niveau des poumons et du système nerveux. Les lésions pulmonaires les plus fréquentes dans la forme aiguë sont des lésions des parois alvéolaires des poumons, une constriction des bronchioles et un oedème interlobulaire. En outre, des cas d’emphysème alvéolaire et de congestion pulmonaire ont été également observés [69, 130].
Par ailleurs, les formes aiguës et chroniques s’accompagnent d’une dégénérescence wallerienne de la moelle épinière chez les animaux intoxiqués. Cette dégénérescence est aussi observée au niveau du nerf vague et du nerf sciatique. Une dégénérescence extensive des cellules granulaires du cervelet, ainsi qu’une diminution du nombre des cellules de Purkinje et une vacuolisation spongieuse de la substance blanche ont été aussi rapportées chez les ruminants [130].
II. 5. Principes Toxiques
II. 5. 1. Identification des composés toxiques
En 1963, STERMITZ et al. ont isolé un produit nitré à partir d' A. miser var.
oblongifolicus et l'ont testé sur un veau induisant les mêmes signes que lors de
l'ingestion de la plante entière [171]. Cette nitrotoxine est le 3-nitro-1-propyl-ß-D-glucopyranoside appelé miserotoxine.
O H HO H HO H H OH H OCH2CH2CH2NO2 HO
Après ingestion par les ruminants des espèces contenant la miserotoxine, cette dernière est hydrolysée en glucose et 3-nitropropanol (Figure 2). En effet, par hydrolyse acide (HCl 2N), la misérotoxine libère le glucose et le 3-nitropropanol (3- NPOH) [109, 202]. Son incubation dans le fluide ruminale de bovins et d'ovins montre que cette nitrotoxine est convertie en 3- NPOH et en glucose au bout de 4 heures et qu'aucun autre métabolite nitré n'est produit [202]. Ainsi, aucune perte du 3- NPOH n'est détectée après son incubation pendant 24 heures [202, 54]. Par conséquent, ce nitroalcool n’est pas métabolisé par la microflore du rumen [54, 103].
OCH2CH2CH2NO2
+
(3-NPOH) glucose (misérotoxine) HCl 2N 3-nitropropanol 3-nitropropyl-β-D-glucopyranoside O H HO H HO H H OH H OH O H HO H HO H H OH H OH OH CH2 CH2 CH2 OH NO2Figure 4 : Réaction d'hydrolyse acide
En 1972, un produit nitré autre que la misérotoxine a été isolé de A. cibarius par STERMITZ et al.; il s'agit d'un glucoside de l'acide 3-nitropropionique. Dans la plante, le nitroacide est estérifié par les fonctions hydroxyles des carbones 1 et 2 du glucose pour donner le 1,2-di-3-nitropropanoyl-ß-D-glucopyranoside [172]. Dans le rumen, cet hétéroside s'hydrolyse par les glucosidases (Figure 3) des bactéries libérant ainsi le glucose et l'acide nitropropionique (3-NPA) métabolite toxique [109, 130].
3NPA
+
(3-NPA)
glucose acide 3-nitropropionique 1,2-di-3-nitropropionique -β-D-glucopyranoside O H HO H HO H H 3NPA H OH O H HO H HO H H OH H OH OH CH2 CH2 OH glucosidase O NO2
Figure 5 : Réaction d’hydrolyse enzymatique
Le 3-NPA est identifié comme forme toxique dans d'autres genres de la famille des légumineuses notamment Coronilla [98, 127, 128], Corynocarpus, Indigofera [54],
II. 5. 2. Toxicité du 3-NPA et du 3-NPOH
Le 3-NPA et le 3-NPOH ont été isolés et identifiés dans plusieurs espèces d'astragales toxiques; cependant, ils n'ont jamais été identifiés ensembles dans une même espèce [171, 203, 172, 59, 71, 104, 201, 197, 198, 200, 98, 55, 101].
Il s'est avéré que chezles ruminants,la forme alcool est 4 à 6 fois plus toxique que la forme acide. En effet, le 3-NPOH est absorbé plus rapidement que le 3-NPA au niveau des pré-estomacs [142, 171], métabolisé par oxydation au niveau du foie en 3-NPA, ceci est associé à une élévationde la concentration de la méthémoglobine dans le sang, puis transporté vers le cerveau où il affecte directement les points contrôlant les réponses musculaires et respiratoires [130]. Contrairement, le 3-NPA est métabolisé dans le rumen avant d'atteindre les vaisseaux sanguins. Si sa concentration ne dépasse pas 1 mg/ ml du fluide rumenal, il se métabolise totalement en produits non toxiques [54, 55, 108].
Chez les ovins, le 3-NPA est métabolisé au bout de 7 heures. Ses métabolites sont non toxiques pour le campagnol [201, 55].
Le 3-NPOH peut être aussi détoxifié par une bactérie développée dans le rumen chez le ruminant. En effet, ces derniers nourris avec de faibles quantités de plantes toxiques ou recevant une alimentation supplémentée en nitroéthane (un analogue moins toxique du 3-nitropropanol) sont capables de tolérer l'absorption de miserotoxine. Cette tolérance résulte de la stimulation de la croissance de certaines bactéries du rumen capables d'utiliser et de métaboliser le 3-nitropropanol [13, 12, 11, 10, 110, 150, 107].
La détoxification du 3-NPA est due au développement de bactéries dans le rumen. Ce nitroacide est converti à la ß-alanine [9].
Un protocole décrit par Anderson et al. en 1996permettant, in vitro, de stimuler la croissance des bactéries responsables de la détoxication de la miserotoxine, ils ont isolé une souche bactérienne, la souche NPOH1, capable de réduire le 3-nitropropanol en aminopropanol. Ultérieurement, trois autres souches ont été isolées aux Etats-Unis par les mêmes chercheurs (NPOH2, NPOH3) et au Canada, par l'équipe de Majak (MAJ1).
II. 5. 3. Doses létales
La dose létale par voie orale du 3-NPOH chez les bovins est estimée par James à 57 mg/ kg [69]. Chez les ovins, la dose létale du 3-NPA est égale à 307 mg/ kg alors que celle du 3-NPOH est égale à 114 mg/ kg [103].
Chez le rat, la DL50 de la misérotoxine par voie orale est supérieure à 2,5 g/ kg et
celle du 3-NPOH est de 77 mg / kg [100].
Cette différence de toxicité entre d’une part la misérotoxine et son métabolite le 3-NPOH et d’autre part entre ce dernier et le 3-NPA est dûe essentiellement au rôle que peut jouer le rumen surtout quant à la dégradation du 3-NPA [200].
II. 5. 4. Mécanisme de l’intoxication
Chez les bovins, le 3-NPOH, à une dose de 50 mg/ kg, provoque une augmentation de 27 % de méthémoglobine au bout de 3 heures tandis qu'il faut administrer une dose de 125 mg/ kg de 3-NPA pour arriver à un taux de 20 % de méthémoglobine. Cela peut être expliqué par une détoxication du 3-NPA au niveau du rumen.
D’autre part, il a été démontré que chez les ruminants, les intoxications aiguës dûes aux espèces accumulatrices des produits nitrés s'accompagnent généralement d'une augmentation rapide du taux de méthémoglobine [101, 142]. L'administration du 3-NPOH chez les bovins par voie intraveineuse entraîne une augmentation progressive de méthémoglobine [69] [103]. Le 3-NPOH prouvé stable dans le sa ng, in vitro, subit alors une dégradation, in vivo, en produisant l’ion nitrite (NO2-) qui forme un complexe avec
l'hémoglobine pour donner la méthémoglobine [95]. Mais d’après Majak, la létalité dans les intoxications par les nitrites est obtenue lorsque le taux de méthémoglobine atteint plus de 80 % et que dans ce syndrome l'injection par voie intraveineuse du bleu de méthylène entraîne une évolution favorable [102]. Cependant ,chez les ruminants,lors des intoxications létales par le 3-NPA ou le 3-NPOH, le taux de méthémoglobine ne dépasse jamais 30 %. En effet, quand le taux de la méthémoglobine dépasse 20 % du taux global d'hémoglobine, la mort de l'animal survient au bout de 3 à 4 heures [200, 101] ainsi le traitement au bleu de méthylène est sans effet [109] et n'empêche pas la mort de l’animal. Alors, la toxicité de ces nitrotoxines est dûe à un mécanisme autre que la méthémoglobinémie.
In vitro, l'incubation du 3-NPOH avec le sang des bovins ne produit aucune variation significative [142, 129]. Par ailleurs, l'administration intraveineuse du 3-NPOH à des bovins est accompagnée d'une dégradation du 3-3-NPOH et d'une détection simultanée du 3-NPA dans le plasma [129]. Ceci démontre que in vivo, chez les bovins, le NPOH est métabolisé dans le sang en NPA [96]. La conversion du NPOH en 3-NPA est observée également chez les ovins intoxiqués par le 3-NPOH [109, 130, 102]. Il a été rapporté que cette conversion s’effectue au niveau du foie par une déshydrogénase, inhibiteur compétitif de la succinate déshydrogénase qui est une enzyme du cycle de Krebs oxydant le succinate en fumarate en produisant une molécule de FADH2 [13, 109].
En conclusion, pour expliquer le mécanisme de l’intoxication, il a été supposé, du fait que le 3-NPA a une structure chimique similaire à celle de la succinate (Schéma 3) et après réalisation de certaines études biochimiques sur la succinate déshydrogénase, que le 3-NPA est un inactivateur de l'enzyme [24, 5, 96]. En effet, 1 % du 3-NPA est transformé dans la circulation générale en carbanion [158]. Cette concentration, même faible, est suffisante pour inhiber la succinate déshydrogénase des mitochondries provoquant un blocage irréversible du cycle de Krebs [200, 55].
Deux autres enzymes, la Fumarase associée au cycle de Krebs et l'isocitrate lyase impliquée dans le cycle glyoxylique, sont inhibées par le 3-NPA [109, 145].
C - CH2 - CH2 - N O O O O C - CH2 - CH2 - C O O O O
Succinate
3-NPA
Figure 6 : similitude de la succcinate et le 3 -NPA.
Enfin, signalons que la présence de la misérotoxine dans l'organisme est indiquée par l’élévation de la méthémoglobine dans le sang.
III. Les espèces provoquant le locoïsme
Le mot Locoweed dérive du terme espagnol «Loco» qui signifie «Fou» et du terme «Weed» qui signifie mauvaise herbe en anglais. C’est l’appellation de certaines espèces toxiques des genres Astragalus et Swainsona causant le locoïsme, maladie décrivant le comportement anormal d’une personne ou d’un animal.
L’empoisonnement par les locoweeds a été rapporté depuis 1873. L’intoxication par le genre Astragalus n’a été démontrée expérimentalement qu’en 1906 [116]. En Amérique du Nord, 18 espèces ont été rapportées causant le locoïsme [26, 18, 70, 121, 186].
Tableau 2 : Quelques espèces causant le locoïsme.
Genre Espèce Référence
Astragalus A. lentiginosus A. mollisimus A. Biçulcatus A. wootnii A. praelongus A. tetrapterus [42, 60, 66, 120, 167, 168, 189, 191]. [169, 170]. [79] [17, 122, 113]. - [114]
Oxytropis Oxytropis sericea [68, 148, 168, 121]
Swainsona Swainsona canescens [23, 34]
III. 1. Circonstances et évolution de l'intoxication
A cause de la longue conservation du pouvoir de germination des graines et l’absence de l’altération de la toxicité des locoweeds, les animaux mis sur pâturage sont souvent exposés au locoïsme [65]. L’intoxication du bétail est due également à la croissance précoce et rapide des jeunes plantules d’astragales par rapport aux autres plantes [67]. Le nombre des intoxications par les locoweeds sont généralement au maximum au début du printemps quand l’herbe se fait rare. Il diminue à la fin de cette période car le bétail préfère le fourrage vert abondant [135].
III. 2. Espèces animales sensibles
Les premières intoxications par les locoweeds ont été décrites chez les bovins et les équidés [89, 77, 75, 72]. La majorité des animaux domestiques, comme le chat, a été touchée par le locoïsme [72, 116]. Le porc et le rat sont également affectés [74, 26]. Les animaux les plus touchés par ce syndrome sont les ovins et les caprins [64, 72]. Généralement, les jeunes sont beaucoup plus sensibles que les adultes [188]. Le locoïsme affecte aussi les oiseaux et les abeilles et autres carnivores [123]. Il a été rapporté que l’homme pourrait être sujet au locoïsme [65, 123].
III. 3. Principes toxiques
Le principe toxique nommé swainsonine a été isolé en 1936 de Swainsona
canescens. Cette espèce provoque le locoïsme chez les animaux [187, 34, 80]. Elle a été
isolée par la suite à partir d’ Oxytropis ochrocephala [21], d’Oxytropis sericea, d’Astragalus lentiginosus , d’A. mollisimus, d’A. Biçulc atus, d’A. praelongus et d’A.
wootnii espèces de la famille des astragales.
Dans Astragalus lentiginosus , en plus de la swainsonine, un autre produit de même nature indolizidique a été isolé et identifié, il s’agit de la swainsonine N-oxyde (C8H15NO4) [42, 189].
La swainsonine a été aussi isolée à partir de certains champignons comme
Rhizoctonia leguminicola et Metarhizium anispoliae [120, 159, 17, 36].
L’analyse spectroscopique de la swainsonine a conduit à la structure bicyclique 1, 2, 8-octahydro indolizidinetriol de formule brute C8H15NO3. L’alcaloïde indolisidique
ne réagit pas aux réactifs spécifiques aux alcaloïdes comme le réactif de Dragendorff, car la swainsonine ne possède pas de groupement chromophore [159, 122]. La visualisation de cet alcaloïde sur les plaques CCM nécessite son couplage au réactif d’Ehrlich (produit chromophore) après son saturation avec l’acide acétique 10 % (V/V).
La révélation des plaques CCM par le réactif d’Ehrlich donne une coloration pourpre qui caractérise la présence de la swainsonine.
N OH OH OH H S R R R
La détection de la swainsonine dans A. Biçulcatus et dans A. praelongus a été d’un intérêt particulier, car ces deux espèces ont été initialement classées dans les espèces d’astragales accumulatrices de Sélénium. De ce fait, le syndrome chronique habituellement connu sous «Blind staggers» est du à l’association de locoïsme et de l’intoxication chronique au Sélénium [79].
Cette toxine soluble dans l’eau, est facilement absorbée dans le tractus gastro-intestinal et rapidement excrété dans les urines, les fèces et le lait [167, 168].
La distribution de la swainsonine est large dans l’organisme des animaux intoxiqués. En effet, cet alcaloïde a été détecté dans le sang, les urines et dans la majorité des tissus à savoir : le cerveau, la thyroïde, les muscles squelettiques, le rein et le foie. La concentration en swaisonine détecté dans le rein et le foie est 2 à 4 fois plus élevée que celle dosée dans d’autre tissus [167, 168]. Ceci est lié à la présence de système de transport extensif du mannose, dont la structure est similaire à cet alcaloïde.
La concentration dans les organes est liée à la dose et à la durée de la consommation. En cas d’intoxication chronique chez les bovins et les ovins, le produit toxique sera totalement éliminé 5 à 6 jours après le retrait des animaux du pâturage. La réorganisation cellulaire débute aussitôt après l’arrêt de l’ingestion de la plante par les animaux. En revanche, le dysfonctionnement cellulaire peut subsister pendant plusieurs jours, voire plusieurs semaines [77].
La swainsonine possède la même activité que l’inhibiteur de l’enzyme a-mannosidase. La swainsonine est un inhibiteur puissant de l’a -mannosidase [119], elle inhibe l’a -mannosidase de l’appareil de Golgi impliqué dans le processus de glycosylation des protéines. L’insuffisance génétique de l’a-mannosidase entraîne le stockage des oligosaccharides riches en mannose. En effet, la swainsonine est responsable de l’hydrolyse des liaisons a (1, 2), (1, 3), (1, 6) mannosidique. L’a-mannosidase est une exoglycosidase impliquée dans le catabolisme des glycoprotéines [36]. Par ailleurs, la swainsonine inhibe la mannosidase II de l’appareil de Golgi qui a une spécificité pour les liaisons a (1, 2), (1, 6) mais n’inhibe pas les manosidases Ia et Ib qui ont une spécificité pour la liaison a (1, 4). Ces trois enzymes de l’appareil de Golgi sont impliquées dans le processus des glycosylations N-liées des glycoprotéines [36].
L’inhibition de l’a -mannosida se de l’appareil de Golgi entraîne des modifications au niveau des processus de la glycosylation N-liées des glycoprotéines, ce qui engendre la formation de glycoprotéine hybrides [28, 34, 36].
III. 4. Les symptômes
Généralement, les intoxications des animaux par les astragales dites locoweeds se manifestentselonuneseule forme c’est la forme chronique; elle résulte de l’ingestion de la plante d’une façon continue pendant une longue période [65, 66, 67, 69]. Les signes cliniques de l’intoxication peuvent apparaître 15 à 60 jours après le début de la consommation de la plante [81, 116]; elles se développent et persistent plusieurs mois.
La dépression, le déficit proprioceptif, les tremblements, l’agitation, l’émaciation, les poils et la toison ternes, la diminution de la libido chez le mâle, les performances de la reproduction diminuent tel que l’infertilité et l’avortement chez la femelle ainsi que des troubles de la vision sont les symptômes rapportés lors de l’intoxication par les locoweeds [167, 168, 114, 190]. Les animaux intoxiqués vivant à haute altitude montrent des troubles cardiovasculaires [189].
Chez les bovins, les tremblements de la tête sont fréquents, les démarches sont maladroites et rigides. Les animaux les plus affectés deviennent plus agressifs, la mort survient après l’aggravation de l’incoordination musculaire [186] et l’émaciation [35]. Les avortements deviennent plus fréquents chez les femelles en gestation [42, 188]. Les malformations congénitales décrites chez les ovins, les bovins [42, 64, 72] et la jument [86] se manifestent par des déformations des membres chez les nouveau-nés. Ces mêmes phénomènes sont observés dans le cas du déficit en zinc [14].
Malgré le fait de retirer l’animal intoxiqué du pâturage, ce dernier peut présenter de légers tremblements persistants, un amaigrissement progressif ainsi son organisme devient vulnérable aux maladies infectieuses, surtout aux maladies respiratoires [169]. Ces signes peuvent s’aggraver à la suite d’un stress [65].
La perte de poids observée chez les animaux intoxiqués est due d’une part, au déficit neurologique qui se répercute sur l’appréhension et la mastication des aliments [147] [146] et d’autre part, aux effets directs de la swaisonine, qui inhibe l’action de plusieurs glucosidases intestinales incluant les sucrases [39].
Enfin, certains auteurs ont constaté que la majorité des signes cliniques observés dans le locoïsme sont similaires à ceux de l’hypothyroïdie [170].
III. 5. Les lésions
L’étude macroscopique révèle une hypertrophie de la thyroïde, une congestion cérébrale, une pâleur du foie et du rein [41, 115, 164].
Des lésions au niveau du placenta et du fœtus ont été révélés chez la brebis gestante [20, 60, 63, 74]. L’examen macroscopique du fœtus révèle des hémorragies [67], une ascite, un oedème généralisé, des déformations squelettiques et une hypertrophie de la thyroïde et du cœur.
Les lésions microscopiques dues à l’intoxication par les locoweeds sont importantes au niveau du système nerveux central [78], des glandes, des appareils digestif, respiratoire et urinaire, des organes lymphoïdes, du placenta, du fœtus et au niveau de l’œil. Au niveau du système nerveux central, les neurones du cortex cérébral, du thalamus, du cérébellum et de la moelle épinière sont caractérisés par une dégénérescence vacuolaire cytoplasmique. Au stade avancé de l’intoxication, une caryolyse et une cytolyse des neurones ont été observées avec minéralisation des débris cellulaires et neurophagie [34].
En ce qui concerne les axones de la moelle épinière, ils sont atteints d’une dystrophie. Un oedème péri-vasculaire est présent dans le système nerveux central [115].
Quant aux glandes, la vacuolisation cytoplasmique est très importante au niveau des cellules folliculaires et para-folliculaires de la thyroïde. Les cellules principales de la parathyroïde apparaissent hypertrophiées avec un cytoplasme sévèrement vacuolisé. De nombreuses vacuoles sont observées dans le cytoplasme des cellules acineuses du pancréas et celui des cellules corticales de la surrénale. Aucune lésion n’a été détectée au niveau de la glande hypophysaire [115].
Une étude au microscope photonique de l’appareil digestif a révélé une atteinte sélective des cellules séreuses des glandes salivaires. Les cellules muqueuses ne sont pas affectées. Une vacuolisation cytoplasmique a été également observée dans les hépatocytes [115].
Les lésions de l’appareil urinaire sont sévères avec une vacuolisation cytoplasmique des cellules épithéliales du tube contourné proximal. Le glomérule
présente une hypertrophie des cellules, mais le cytoplasme n’apparaît pas vacuolé. Les cellules épithéliales de l’urètre et de la vessie présentent des vacuoles dans le cytoplasme, plus particulièrement celles qui sont directement en contact de l’urine [115].
Les observations cliniques des troubles de la vision chez les animaux intoxiqués par les locoweeds sont établies par la découverte des lésions ophtalmiques. En effet, les cellules ganglionnaires et les neurones bipolaires de la rétine présentent une vacuolisation cytoplasmique. Ces changements vacuolaires ont été observés également dans les neurones du cortex visuel occipital. L’épithélium sécrétoire des glandes lacrymales est aussi concerné par cette vacuolisation du cytoplasme [190] .
Chez les brebis gestantes, une vacuolisation cytoplasmique importante a été observée au niveau des cellules de l’épithélium chorionique et trophoblastique du placenta. Les cellules lutéales de l’ovaire sont également atteintes et hypertrophiées et semblent responsables des avortements par insuffisance des sécrétions de progestérone [20, 42].
Chez le foetus, les résultats d’une étude histopathologique indiquent que les locoweeds peuvent causer l’hypertrophie et la vacuolisation cytoplasmique largement répandue au niveau de tous les viscères [42, 76, 80, 77, 74]. Ce phénomène de vacuolisation cytoplasmique s’installe progressivement dans ces organes ; en effet, une étude séquentielle de ce processus chez le mouton nourri de locoweed indique que le premier organe atteint est l’épithélium du tube contourné proximal. Ceci permet de supposer que le facteur responsable pourrait être concentré et excrété par le rein.
D’autres expériences ont montré que l’urine du mouton intoxiqué provoque la vacuolisation cytoplasmique des cellules rénales chez le rat quand ces urines sont la seule boisson disponible. Ceci peut expliquer la présence de vacuoles au niveau de l’épithélium de transition de la vessie [115].
Le système nerveux, le foie et la rate constituent le deuxième groupe d’organes atteints après le rein. Les changements neuronaux progressent vers une neurolyse et des études préliminaires au microscope électronique de ces tissus indiquent que les vacuoles sont surtout localisées au niveau des mitochondries, de l’appareil de Golgi et du réticulum endoplasmique [35].
IV. Les Astragales du Maroc
IV. 1. Les astragales non toxiques
Le tableau 3 présente les espèces non toxiques du genre Astragalus, l’écologie
à laquelle elles sont adaptées et leur répartition géographique [151]. Cinq espèces ont été dénombrées endémiques.
Parmi ces astragales, on envisage des espèces qui appartiennent à la flore des champs cultivés comme A. epiglottus.
IV. 2. Les astragales toxiques
Neuf espèces du genre Astragalus ont été rapportées toxiques à savoir :
Astragalus lusitanicus [40] [3], A. vogelii, A. hamosus, A. solandri (var. solandri et
var. bubaloceras), A. stella, A. sesameus, A. boeticus , A. echinatus et A. gombo [196]. Parmi ces neufs espèces toxiques, seules A. lusitanicus et A. vogellii ont été rapportées entraîner des pertes de bétail en l'occurrence d’ovins [3] [40] [177] et dont les principes toxiques sont encors inconnus. Les autres espèces toxiques sont des plantes accumulatrices de produits nitrés [196].
Le tableau 4 présente la répartition géographique des espèces toxiques du genre
Tableau 3 : Espèces non toxiques du genre Astragalus dénombrées au Maroc [151]; écologie et répartition.
Noms Ecologie Répartition géographique
A. epiglottis - pelouses arides, coteaux des plaines et des basses montagnes.
Largement répandue.
A. cymbicarpos Var. brevipes
- pâturages et forets claires de basses montagnes sili ceuses.
- étage sub-humide à hivers frais.
Tanger, Rif sud -ouest, Tazekka, Zaïane.
A. algarbiensis - terrains sablonneux de la plaine et des basses montagnes.
- étages sub-humides à hivers frais à chauds.
Rabat, Kenitra, forêt de Mamora. Haut Atlas (Damnate).
A. edulis - pâturages sablonneux et pierreux; graviers des oueds jusqu’à 1500 m.
- étages arides à semi arides à hivers chauds à frais.
Maroc oriental, Moyen Sebou (Nord), Abda-Haha, Seksaoua, Anti Atlas, Draâ.
A. sinaïcus - sols sablonneux des terr ains arides. - étages sahariens à hivers arides à tempérés
Nkor, Tarifa ; Maroc oriental, Seksaoua.
A. tribuloïdes - sols sablonneux des terrains arides. - étages sahariens à hivers frais à tempérés
Nkor, Tarifa ; Maroc oriental, Haut Atlas.
A. polyactinus - pâturages rocailleux.
- étages arides à semi arides à hivers tempérés.
Moulouya et hauts plateaux orientaux, Haouz, Souss, Haut et anti-Atlas.
A. geniculatus - pâturages rocailleux.
- étages arides à sub -humide à hivers tempérés.
Oujda, Haut Msoun.
A. scorpioides - pâturages rocailleux, arides.
- étages semi arides à hivers frais à tempérés.
Maroc oriental, Haut Msoun, Haouz, Chaouia et anti-Atlas.
A. longidentalus - pâturages rocailleux des basses montagnes. - étages semi arides à sub-humides à hivers frais à tempérés.
Tétouan, Jerrada, Debdou, Mekam.
A. mareoticus - pâturages sablonneux arides.
- étages sahariens et désertiques à hivers tempérés
Haut plateau oriental. Draâ.
A. corrugatus - lits sablonneux des oueds.
- étage saharien aride, à hivers tempérés.
Maroc oriental, Sahara Marocain, Draâ.
A. hauarensis - alluvions des oueds.
- étage saharien aride, à hivers tempérés.
Sahara Marocain.
A. reesei (*) - steppes argileuses et pierreuses.
- étages sahariens arides, à hivers frais à tempérés.
Maroc oriental, Sahara Marocain.
A. maroccanus (*)
- terrains rocailleux, arides.
- étages arides à semi-arides, à hivers frais à tempérés.
Haouz, Haut Atlas
A. armatus S/esp : armatus S/esp: numidicus
- étages arides à hivers frais
étages arides à semiarides, et même sub -humides.
Maroc oriental: Moulouya, Nkor, Tarifa et Bni Snassen.
Haut Atlas centre: Telouet Tanger, Rif (en montagne) et Anti-Atlas.
A. granatensis - pelouses et rocailles arides de 1300 à 1700 m. - étages semi-arides à sub -humides à hivers frais à tempérés.
Rif (SW), Moyen Atlas centre: Ain Louh et Timahdit; Haut Atlas centre: Telouet.
Maroc oriental: Hauts plateaux.
A. glau - pâturages secs souvent argileux. Partout au Maroc sauf à l’étage
saharien.

![Tableau 3 : Espèces non toxiques du genre Astragalus dénombrées au Maroc [151]; écologie et répartition](https://thumb-eu.123doks.com/thumbv2/123doknet/2190763.11440/35.918.180.779.152.1092/tableau-especes-toxiques-astragalus-denombrees-maroc-ecologie-repartition.webp)
![Tableau 4 : Espèces toxiques marocaines du genre Astragalus [3, 40, 151] ; écologie et répartition](https://thumb-eu.123doks.com/thumbv2/123doknet/2190763.11440/37.918.173.779.150.796/tableau-especes-toxiques-marocaines-genre-astragalus-ecologie-repartition.webp)
![Figure 11 : Synthè se de l’hypaphorine selon la méthode de Romburgh [193].](https://thumb-eu.123doks.com/thumbv2/123doknet/2190763.11440/51.918.179.783.646.918/figure-synthe-l-hypaphorine-methode-romburgh.webp)
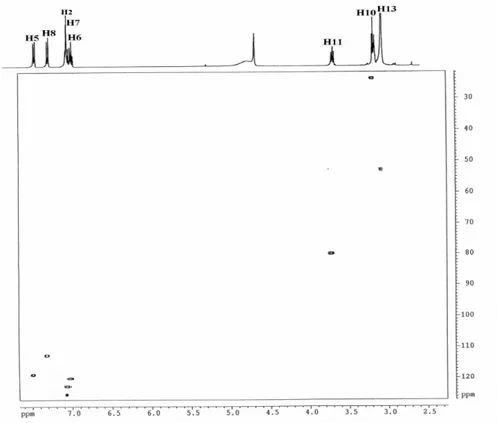
![Tableau 7 : Données de RMN de 1 H et de 13 C de l’hypaphorine (dH 300Mz, dC 75 MHz, H 2 O-CD 3 OD, 298 K) Positions des atomes 13 C δ (ppm) 1 H δ (ppm) (m; J en Hz) 1 (NH) 2 (CH) 3 (Cq) 4 (Cq) 5 (CH) 6 (CH) 7 (CH) 8 (CH) 9 (Cq) 10 (CH 2 ) 11 (CH) 12 (CO) 13 (N [(CH 3 ) 3 ] + ) - 125,11 108,96 128,27 119,05 120,04 122,60 112,45 138,04 24,65 80,52 171,62 52,66 10,17 (s) 7,11 (s) - - 7,50 (d, 8) 7,02 (t, 8) 7,05 (t, 8) 7,35 (d, 8) - 3,20 (d) 3,72 (t) - 3,07 (s)](https://thumb-eu.123doks.com/thumbv2/123doknet/2190763.11440/54.918.250.773.575.1015/tableau-donnees-rmn-hypaphorine-mhz-positions-atomes-co.webp)