Université de Sherbrooke
Analyse systémique du métabolisme des lipides chez les adipocytes et son effet sur le développement du diabète de type 2
Par Thierry Chénard Programme de Biochimie
Thèse présentée à la Faculté de médecine et des sciences de la santé en vue de l’obtention du grade de philosophiae doctor (Ph.D.)
en Biochimie
Sherbrooke, Québec, Canada 03/2018
Membres du jury d’évaluation
Pr. Rafael Najmanovich, Département de Pharmacologie et Physiologie, Faculté de Médecine, Université de Montréal
Dr. André Carpentier, Service d’endocrinologie, Département de médecine Pr. André Tchernof, Département des Sciences des Aliments et Nutrition, Faculté des
Sciences de l’Agriculture et de l’Alimentation, Université Laval Pr. Michelle Scott, Programme de Biochimie
Pr. Sheela Ramanathan, Programme d’Immunologie
Pr. Sebastian Pechmann, Département de Biochimie, Faculté de Biochimie, Université de Montréal
À ma femme, mon fils et mes parents pour m'avoir encouragé et soutenu durant ces longues années
iii
R
ÉSUMÉAnalyse systémique du métabolisme des lipides chez les adipocytes et son effet sur le développement du diabète de type 2
Par Thierry Chénard Programmes de Biochimie
Thèse présentée à la Faculté de médecine et des sciences de la santé en vue de l’obtention du diplôme de philosophiae doctor (Ph.D.) en Biochimie, Faculté de médecine et des sciences de la santé, Université de Sherbrooke, Sherbrooke, Québec, Canada, J1H 5N4
Les données expérimentales provenant de l’humain et des modèles animaux démontrent qu’une surexposition des tissus maigres aux acides gras joue un rôle important dans le développement de la résistance à l’insuline et de la dysfonction pancréatique caractéristique du diabète de type 2. Les tissus adipeux jouent un rôle critique dans la régulation des flux d’acides gras en circulation. Il a été noté qu’un problème de stockage des acides gras dans les tissus adipeux mène à une augmentation des niveaux circulants d’acides gras tôt dans le développement du diabète de type 2. Un défaut dans l’hyperplasie des adipocytes c’est-à-dire dans le recrutement des préadipocytes et leur maturation en adipocytes matures résulte en une expansion pathologique de type hypertrophique des tissus adipeux. Ce phénomène contribue au développement de la résistance à l’insuline. L’étude des mécanismes et des voies métaboliques liés à l’hypertrophie des adipocytes pourrait mener à l’identification de nouvelles cibles thérapeutiques potentielles pour le traitement du diabète de type 2. Nous avons développé un réseau métabolique d’adipocyte humain,
iTC1390adip, afin d’identifier des gènes codants pour des enzymes ayant le potentiel
d’affecter les mécanismes d’expansion des tissus adipeux. iTC1390adip est un réseau compartimenté contenant 1390 gènes, 4519 réactions et 3664 métabolites. Nous avons utilisé le réseau pour réaliser une analyse de délétion génique in silico permettant de prédire l’effet de la délétion des gènes sur la production optimale de biomasse et de gouttelettes lipidiques utilisées comme des représentations de l’hyperplasie et de l’hypertrophie des adipocytes, respectivement. Cette analyse nous a permis d’identifier 31 gènes ayant le potentiel d’affecter l’expansion des tissus adipeux. Il s’agit à notre connaissance de la première analyse combinant deux objectifs complémentaires dans une analyse de délétion génique in
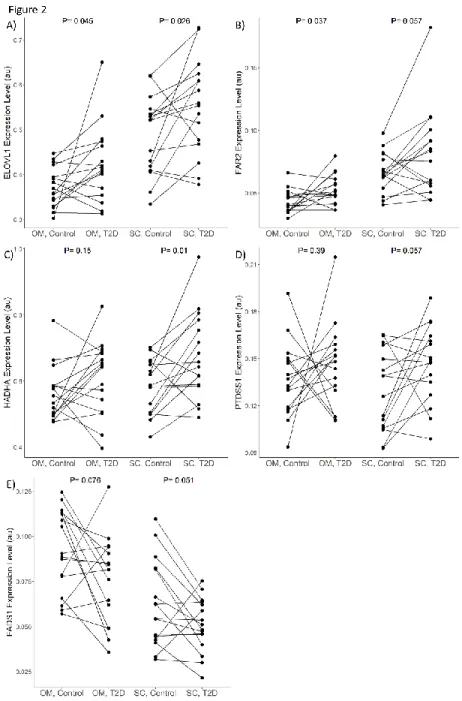
silico. L’expression de 20 de ces gènes fut étudiée dans les tissus adipeux de participants
souffrant ou non de diabète de type 2, appariés selon leur sexe, leur âge et leur indice de masse corporelle, via une analyse RT-qPCR. L’expression de 9 de ces gènes variait selon la présence du diabète (FADS1, ELOVL1, FAR2, HADHA et PTDSS1), de l’indice de masse corporel (DGAT1, ELOVL1, FADS1, FAR2 et HADHB) ou de la taille des adipocytes (SUCLG1 et ELOVL4). Ces résultats permettront de guider des expériences in cellulo et ex
vivo à venir afin de valider le potentiel thérapeutique des gènes identifiés. Les résultats
d’expression génique confirment les bénéfices de l’utilisation d’outils bio-informatiques pour la science fondamentale.
iv Mot-clés : Réseau métabolique, Bioinformatique, Diabète de type 2, Métabolisme, Lipides, Adipocytes, Études de cibles identifiées par bio-informatique
v
S
UMMARYSystemic analysis of lipid metabolism in adipocytes and its effect on the development of type 2 diabetes
By Thierry Chénard Biochemistry Program
Thesis presented at the Faculty of medicine and health sciences for the obtention of Doctor degree diploma philosophiae doctor (Ph.D.) in Biochemistry, Faculty of medicine and
health sciences, Université de Sherbrooke, Sherbrooke, Québec, Canada, J1H 5N4 Experimental data from human and animal models show that exposure of lean tissues to excess fatty acids plays an important role in the development of the insulin resistance and pancreatic dysfunction common to type 2 diabetes. Adipose tissues play a critical role in the regulation of circulating fatty acid fluxes. Fatty acid storage deficiency in adipose tissues leads to increased levels of circulating fatty acids which appears early in the development of type 2 diabetes. A defect in the hyperplasia of adipocytes which means a failure to recruit and differentiate new pre-adipocytes into lipid storing mature adipocytes results in a pathological hypertrophic expansion known to contribute to the development insulin resistance. The study of mechanisms and metabolic pathways linked to adipocyte hypertrophy could lead to the identification of potential novel therapeutic targets in the treatment of type 2 diabetes. We developed a human adipocyte metabolic network,
iTC1390adip, to help in the identification of genes coding for enzymes which have the
potential to affect the expansion mechanisms of adipose tissues. iTC1390adip is a compartmentalised network containing 1390 genes, 4519 reactions and 3664 metabolites. We used the network to perform an in-silico analysis to predict the effect of gene deletions on the optimal production of biomass and lipid droplets, used as proxies for hyperplasia and hypertrophy respectively. This analysis enabled us to identify 31 genes as having the potential to affect adipose tissue expansion. It is, to our knowledge, the first analysis combining two complementary objective functions in an in-silico gene deletion analysis. The expression of 20 of those genes was studied using RT-qPCR in adipose tissues of participants with and without type 2 diabetes, paired for sex, age and body mass index. The expression levels of 9 of these genes varied as a function of type 2 diabetes (FADS1, ELOVL1, FAR2,
HADHA and PTDSS1), body mass index (DGAT1, ELOVL1, FADS1, FAR2 and HADHB) or
adipocyte cell-size (SUCLG1 and ELOVL4). These results will guide future in-cellulo and
ex-vivo experiments for the validation of the therapeutic potential of the identified genes.
The experimental results demonstrate the potential benefits of using bioinformatics tools to help fundamental sciences.
Keywords: Metabolic Networks, Bioinformatics, Type 2 Diabetes, Metabolism, Lipids, Adipocytes. Study of targets identified by bioinformatics
vi
T
ABLE DESM
ATIÈRESRésumé ... iii
Summary ... v
Table des Matières ... vi
Liste des figures ... x
Liste des abréviations ... xi
1. Introduction ... 1
1.1 Le diabète ... 1
1.1.1 Le diabète de type 2 ... 2
1.2 La lipotoxicité ... 3
1.2.1 Activité des métabolites diabètogéniques ... 3
1.2.2 L’inflammation ... 5
1.3 Rôle des tissus adipeux dans le développement de la lipotoxicité ... 6
1.3.1 Les tissus adipeux bruns ... 8
1.3.2 Les tissus adipeux blancs viscéraux et sous-cutanés ... 9
1.3.3 Hyperplasie et hypertrophie ... 12
1.4 Voies de traitement actuelles pour le diabète de type 2 ... 17
1.4.1 Changements des habitudes de vie ... 17
1.4.2 Chirurgie bariatrique ... 18
1.4.3 Approches pharmacologiques ... 21
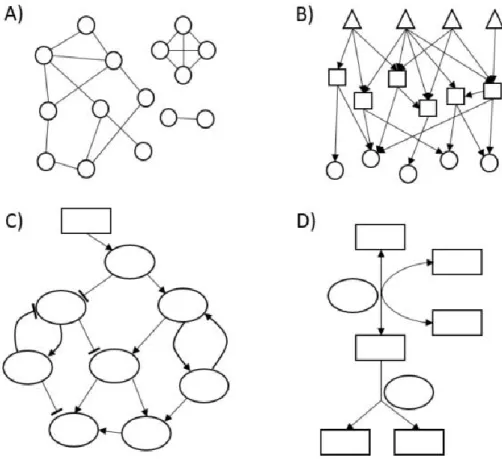
1.5 Les réseaux biologiques ... 24
1.5.1 Techniques d’analyse des réseaux métaboliques ... 27
1.5.2 Historique des réseaux métaboliques ... 29
1.5.3 Réseaux métaboliques portant sur l’obésité et le diabète ... 32
vii 1.7 Objectifs ... 39 2. Article 1 ... 40 Abstract ... 41 Keywords ... 41 Background ... 41 Methods ... 44
Removal of genes not expressed/translated in adipocytes. ... 45
Correction of gene/reaction associations. ... 45
Removal of non-metabolic functions. ... 46
Reducing the number of dead-end metabolites. ... 46
Addition of genes and reactions from KEGG and Recon2. ... 47
Addition of protein complexes. ... 47
Validation of iTC1390adip. ... 48
Gene deletion analysis. ... 49
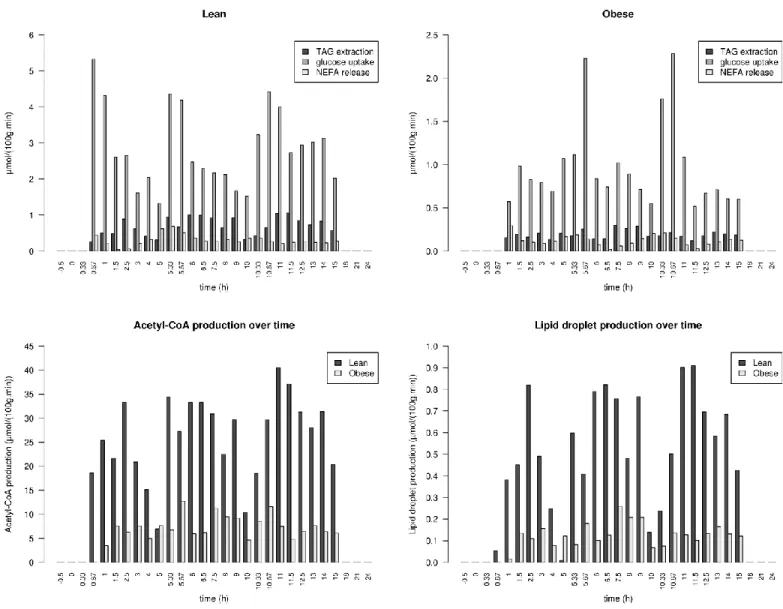
Definition of biomass and lipid droplets. ... 50
Metabolic differences between subcutaneous and visceral adipose tissues. ... 51
Results ... 51
Modification of the network ... 51
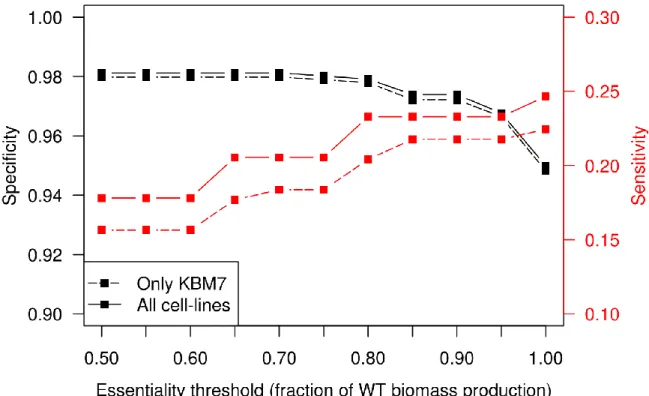
Validation of iTC1390adip ... 53
Determination of the threshold at which the decrease in biomass is associated with impaired cellular function ... 55
Gene Deletion Analysis ... 57
Metabolic differences between subcutaneous and visceral adipose tissues ... 61
Discussion ... 61
viii References ... 69 3. Article 2 ... 77 Abstract ... 78 Introduction ... 79 Methods ... 80 Selection of participants ... 80
Adipocyte size measurements ... 80
Measurement of gene expression ... 81
Statistical analyses ... 83
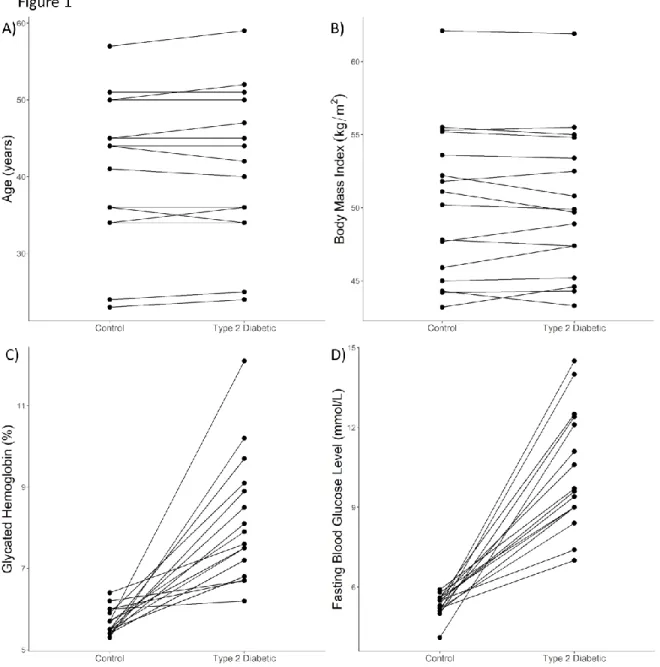
Results ... 83
Characteristics of the population ... 83
Gene expression analysis ... 85
Discussion ... 91
Acknowledgements ... 94
References ... 95
4. Discussion ... 100
4.1 Résumé des résultats principaux ... 100
4.2 Les réseaux métaboliques ... 101
4.3 Points faibles de l’analyse ... 102
4.4 Les gènes n’ayant pas été sélectionnés pour les analyses expérimentales ... 103
4.5 Possibilité d’études subséquentes sur les cibles potentielles ... 104
5. Références ... 106
Annexe A: Données supplémentaires de l’article 1 ... 132
Figure supplémentaire ... 132
ix
Annexe B: Données supplémentaires de l’article 2 ... 196
Figures supplémentaires ... 196
Tableau supplémentaire ... 198
x
L
ISTE DES FIGURESFigure 1 : Caractéristiques des tissus adipeux hyperplasiques et hypertrophiques…………13 Figure 2 : Représentation schématique des chirurgies bariatriques les plus communes…...19 Figure 3 : Représentation graphique des différents types de réseaux biologiques………...24
xi
L
ISTE DES ABRÉVIATIONSIDF International Diabetes Federation / Fédération internationale du Diabète
HbA1C Hémoglobine glyquée A1C
PPARG Peroxisome proliferator-activated receptor gamma
PGC-1 Peroxisome proliferator-activated receptor-gamma coactivator 1
FTO Fat mass and obesity-associated gene
KBTBD2 kelch repeat and BTB domain containing 2
CDKN2A Cyclin-dependent kinase inhibitor 2A
ROS Reactive oxygen species / Espèces réactives d’oxygène
PKC Protein kinase C
NF-κB Nuclear factor kappa-light-chain-enhancer of activated B cells
IκB-α NF-κB inhibitor alpha
IRS-1 Insulin receptor substrate 1
NOX NAD(P)H oxidase
GLUT4 Glucose transporter type 4
TNFα Tumor necrosis factor alpha
IL Interleukine
FASR Tumor Necrosis Factor Receptor Superfamily, Member 6
MCP1 Monocyte chemoattractant protein 1
SOCS Suppresor of cytokine signalling
LPIN1 Lipin 1
HSL Hormone-sensitive lipase
CIDEC Cell death-inducing (DNA fragmentation factor subunit alpha)-like effector C
AGPAT2 1-acylglycerol-3-phosphate O-acyltransferase 2
BSCL2 Bernardinelli-Seip congenital lipodystrophy type 2
UCP1 Uncoupling protein-1
VLDL Very low-density lipoprotein / lipoprotéine de très faible densité
LPL Lipoprotein lipase
LDL Low density lipoprotein / Lipoprotéine à faible densité
CIDEA Cell death-inducing (DNA fragmentation factor subunit alpha)-like effector A
DGAT2 Diacylglycerol O-acyltransferase 2
SREBP1c Sterol regulatory element binding transcription factor 1c
MMP Matrix metalloproteinase
VEGF Vascular endothelial growth factor
HIF-1 Hypoxia inducible factor 1
TLR Toll-like receptor
Myf5 Myogenic factor 5
SERPINE1 Plasminogen activator inhibitor 1
GLP-1 Glucagon-like peptide-1
SGLT2 Sodium glucose cotransporter 2
DPP-4 Dipeptidyl peptidase-4
EHMN Edinburgh human metabolic network
PDH Pyruvate dehydrogenase
xii
BCAT1 Branched chain amino acid transaminase 1
ETPDH Electron-transferring-flavoprotein dehydrogenase
RT-qPCR Réaction en chaîne par polymérase quantitative avec transcription inverse
ELOVL1 Elongation of very long chain fatty acids 1 protein
FADS1 Fatty acid desaturase 1
FAR2 Fatty acyl-CoA reductase 2
HADHA Hydroxyacyl-CoA dehydrogenase/3-ketoacyl-CoA thiolase/enoyl-CoA
hydratase, alpha subunit
PTDSS1 Phosphatidylserine synthase 1
DGAT1 Diacylglycerol O-acyltransferase 1
HADHB Hydroxyacyl-CoA dehydrogenase/3-ketoacyl-CoA thiolase/enoyl-CoA
hydratase, beta subunit
ELOVL4 Elongation of very long chain fatty acids 4 protein
SUCLG1 Succinate-CoA ligase alpha subunit
ENO1 enolase 1
PDHB pyruvate dehydrogenase beta
PDHX pyruvate dehydrogenase component X
GAPDH glyceraldehyde-3-phosphate dehydrogenase
GPIHBP1 glycosylphosphatidylinositol anchored high density lipoprotein binding
protein 1
LPL lipoprotein lipase
TECR trans-2,3-enoyl-CoA reductase
ADH5 alcohol dehydrogenase 5
HMGCS1 3-hydroxy-3-methylglutaryl-CoA synthase 1
PCYT2 phosphate cytidyltransferase
1
1.
I
NTRODUCTION1.1 Le diabète
Le diabète est l’une des maladies non infectieuses les plus répandues mondialement et affecte un nombre croissant de personnes chaque année. Les estimations de la fédération internationale du diabète (IDF) indiquent qu’approximativement 415 millions d’adultes au niveau mondial souffraient d’une forme de diabète en 2015 et que ce nombre augmentera de plus de 50% d’ici 2040 (Ogurtsova et al. 2017). Les estimations de l’IDF indiquent aussi que le coût annuel mondial associé au diabète s’élève à plus de 673 milliards de dollars américains et qu’approximativement 5 millions de décès pouvaient être attribués au diabète en 2015 (International Diabetes Federation 2015). Toutes ces statistiques indiquent que le diabète est l’une des maladies pour lesquelles il est très important d’améliorer le traitement. Le diabète est une maladie caractérisée par un niveau élevé de glucose sanguin à jeun. Cette élévation du niveau de glucose est habituellement causée par des déficiences au niveau de la signalisation de l’insuline. Le diabète peut être diagnostiqué par le niveau de glucose plasmatique à jeun (>7 mmol/L), par le niveau de glucose plasmatique 2 heures après une hyperglycémie orale provoquée de 75 grammes (>11.1 mmol/L) ou encore par le niveau
d’hémoglobine glyquée A1C (HbA1C) (>6.5%) qui permet de déterminer le niveau moyen de
glucose sanguin des deux ou trois derniers mois (American Diabetes Association 2016b). Le diabète n’est en réalité pas qu’une seule maladie, elle est habituellement divisée en plusieurs catégories. Le diabète de type 1 est une maladie auto-immune menant à la destruction des cellules β des îlots de Langerhans du pancréas menant à une absence complète de production d’insuline (Atkinson et al. 2014). Les diabètes de type 2 et gestationnels sont quant à eux associés à une réduction progressive de la synthèse d’insuline dans le pancréas ainsi qu’au développement de résistance à l’insuline dans différents tissus (Crawford 2017). Le diabète gestationnel est plus spécifiquement un diabète qui s’est développé lors du deuxième ou troisième semestre d’une grossesse en absence d’un diagnostic préexistant de diabète de type 1 ou 2 (Mao et al. 2017). Il existe aussi des types
2 de diabète spécifiques qui ont d’autres causes telles que des mutations monogéniques ou la prise de certains médicaments (American Diabetes Association 2016b). De tous les cas de diabète, environ 90% sont des cas de diabète de type 2 (Evans et al. 2000; Holman et al. 2015).
1.1.1 Le diabète de type 2
La résistance à l’insuline et la réduction de la sécrétion d’insuline stimulée par le glucose sont les deux caractéristiques physiopathologiques principales spécifiques au développement du diabète de type 2. Le déficit dans la sécrétion d’insuline stimulée par le glucose est considéré comme une condition essentielle au développement du diabète de type 2, car une réponse normale des cellules β du pancréas permet de compenser la résistance à l’insuline et de prévenir une augmentation des niveaux de glucose sanguin (Carpentier 2008). La relation entre la résistance à l’insuline et la sécrétion d'insuline stimulée par le glucose peut être quantifiée en utilisant une fonction hyperbolique connue sous le nom d’indice de disposition (Bergman et al. 2002; Utzschneider et al. 2006). Un indice de disposition faible indique un défaut dans l’augmentation de la sécrétion d’insuline en réponse à une augmentation de la résistance à l’insuline.
Il existe une variété de facteurs venant affecter le développement de la résistance à l’insuline et la sécrétion d’insuline. Des variations génétiques et épigénétiques dans plusieurs gènes tels que peroxisome proliferator-activated receptor gamma (PPARG) 2, peroxisome
proliferator-activated receptor-gamma coactivator 1 (PGC-1), fat mass and obesity-associated gene (FTO), kelch repeat and BTB domain containing 2 (KBTBD2) et cyclin-dependent kinase inhibitor 2A (CDKN2A) sont associés avec une augmentation des risques
de développer le diabète de type 2 (Altshuler et al. 2000; Ek et al. 2001; Sanghera et al. 2008; Zhang et al. 2016b). Le tabagisme est un autre facteur de risque ayant été associé à une augmentation de 50% des risques de développer un diabète de type 2 (Eliasson 2003). Un mode de vie sédentaire, une diète occidentale, l’obésité viscérale, un historique familial de diabète de type 2 et l’âge sont aussi des facteurs de risque environnementaux reliés à une augmentation des probabilités de développer un diabète de type 2 (Shi 2016; Kolb et Martin 2017). Plusieurs de ces facteurs de risque favorisent l’exposition excessive des tissus maigres
3 aux acides gras ce qui favorise la progression de la résistance à l’insuline et des défaillances dans la production d’insuline en réponse au glucose (Carpentier 2008). Cette exposition excessive des tissus maigres aux acides gras mène à la création de dépôts d’acide gras intracellulaires dans les tissues maigres, un phénomène connu sous le nom de lipotoxicité.
1.2 La lipotoxicité
Les acides gras sont une source d’énergie majeure pouvant être utilisée par la majorité des tissus humains. Un équilibre entre l’absorption de lipides par la cellule et leur utilisation dans la β-oxydation est important pour le bon fonctionnement des mitochondries. Un débalancement entre l’absorption de lipides et la β-oxydation mène à l’accumulation intracellulaire de lipides caractéristique de la lipotoxicité (Zhang et al. 2010). Une dysfonction de l’activité mitochondriale a été reliée à l’accumulation des lipides dans les tissus maigres (Lowell et Shulman 2005), mais cette dysfonction mitochondriale ne semble pas se produire tôt dans le développement du diabète de type 2 (Callahan et al. 2017). Cette accumulation de lipides intracellulaires ne mène pas directement au développement de la résistance à l’insuline, mais contribue à l’accumulation de métabolites diabètogéniques dérivés de lipides tels que les diacylglycérols et les céramides ainsi que des métabolites inflammatoires tels que les espèces réactives d’oxygène (ROS) et les cytokines pro-inflammatoires. Ces différents métabolites considérés comme étant diabétogéniques activent une variété de voies métaboliques menant à la résistance à l’insuline ou à une réduction de sa sécrétion.
1.2.1 Activité des métabolites diabètogéniques
Une augmentation des diacylglycérols augmente la présence membranaire des
protein kinases C (PKC)-βII et PKC-δ et diminue aussi la présence de nuclear factor kappa-light-chain-enhancer of activated B cells (NF-κB) inhibitor alpha (IκB-α), menant à
l’activation de NF-κB (Pieper et Riaz-ul-Haq 1997; Itani et al. 2002). Les PKCs activées phosphorylent à la fois le récepteur à l’insuline et l’insulin receptor substrate 1 (IRS-1) menant à une signalisation à l’insuline altérée et une diminution de l’import de glucose
4 (Bollag et al. 1986; De Fea et Roth 1997). L’activation des PKCs peut ainsi mener à la résistance à l’insuline et à l’augmentation du stress oxydatif (Inoguchi et al. 2000).
Le stress oxydatif résulte entre autres d’une augmentation des ROS causée par une augmentation de l’activité de la NAD(P)H oxidase (NOX) PKC-dépendante (Inoguchi et al. 2000). L’augmentation du stress oxydatif est associée à la résistance à l’insuline et à la dysfonction de la sécrétion d’insuline (Evans et al. 2002). Les cellules β du pancréas sont particulièrement sensibles au stress oxydatif résultant de la lipotoxicité (Li et al. 2008). L’augmentation de la résistance à l’insuline associée au stress oxydatif est due entre autres à une activation par les ROS de différentes kinases phosphorylant IRS-1 menant à une diminution de la présence du glucose transporter type 4 (GLUT4) à la surface de la cellule (Bloch-Damti et Bashan 2005). L’administration d’antioxydants tel que l’acide α-lipoïque chez des diabétiques de type 2 améliore la sensibilité à l’insuline ainsi que le profil lipidique, faisant du stress oxydatif un facteur causal probable de la résistance à l’insuline (Derosa et al. 2016). Le stress oxydatif est aussi un important activateur des voies reliées à l’inflammation telles que celle du NF-κB (Schreck et al. 1992).
NF-κB est un complexe protéique contrôlant la transcription et qui est exprimé dans tous les types cellulaires (Schreck et al. 1992). Son activation peut provenir de différentes sources, entre autres celles mentionnées précédemment (absence de IκB-α, stress oxydatif, activation des PKCs). NF-κB est un modulateur important de la réponse immunitaire par l’intermédiaire de l’activation de gènes reliés au processus d’inflammation et d’apoptose tels que les cytokines pro-inflammatoires comme le tumor necrosis factor alpha (TNFα) (Baeuerle et Henkel 1994; Schmitz et al. 2004).
Les céramides, des sphingolipides composés d’un sphingosine et d’un acide gras, sont des messagers secondaires dans diverses voies de signalisation impliquées dans la pathogenèse de la résistance à l’insuline (Yazıcı et Sezer 2017). Ils ont aussi été identifiés à titre de métabolites importants liant les cytokines pro-inflammatoires et les sphingolipides à la régulation de fonctions cellulaires associées au développement du diabète de type 2 (Summers 2005). Les sphingolipides sont des acides gras saturés, ils sont moins bien oxydés
5 que les acides gras insaturés, ce qui facilite leur accumulation dans les tissus (Gaster et al. 2005). Ils ont aussi été associés à une réduction de la sensibilité à l’insuline (Rivellese et al. 2002; Chavez et al. 2013). Les cytokines pro-inflammatoires sont connues depuis plusieurs années pour leur effet sur l’inhibition de la signalisation à l’insuline (Marette 2002) et il est connu qu’ils peuvent être activés par la présence des céramides dans les radeaux lipidiques (Inokuchi 2006).
1.2.2 L’inflammation
L’inflammation est au centre de toutes les voies de signalisation décrites précédemment et le diabète comporte une composante importante d’inflammation chronique (Gram et al. 2017). L’effet de l’inflammation chronique sur le développement du diabète de type 2 dépend du tissu (Lontchi-Yimagou et al. 2013). Parmi les organes affectés, les tissus adipeux et le pancréas sont les plus affectés par l’inflammation, mais le foie (Kiechl et al. 2013), les muscles squelettiques (Varma et al. 2009) et l’hypothalamus (Cai 2013) montrent aussi des signes d’inflammation reliés au développement du diabète de type 2 et pouvant possiblement mener aux diverses comorbidités du diabète de type 2 telles que la stéatose hépatique non alcoolique (Augustin et al. 2017).
Les îlots pancréatiques des patients souffrant de diabète de type 2 présentent des signes de fibrose, de dépôts amyloïdes et une augmentation de la mort cellulaire, qui sont tous des signes associés à la réponse inflammatoire (Costes et al. 2013). Cette inflammation des îlots de Langerhans du pancréas mène à une diminution de leur masse et de leur capacité à sécréter de l’insuline (Donath et al. 2008). De plus, l’interleukine (IL)-1β est une cytokine pro-inflammatoire sécrétée par les cellules β du pancréas qui inhibe la fonction sécrétoire des cellules β par l’activation de la voie NF-κB et l’activation de Tumor Necrosis Factor
Receptor Superfamily, Member 6 (FasR) (Maedler et al. 2002). Tel que mentionné
précédemment, cette inhibition de la sécrétion de l’insuline est l’une des caractéristiques physiopathologiques principales du diabète de type 2.
Les tissus adipeux ont longtemps été considérés comme de simples dépôts d’énergie sous forme de lipides, mais ils sont maintenant connus comme l’une des sources principales
6 de marqueurs inflammatoires tels que les cytokines pro et anti-inflammatoires (TNFα, IL-1, IL-6, IL-10 et monocyte chemoattractant protein 1 (MCP1)) et les adipocytokines (la leptine, l’adiponectine, la résistine et la visfatine) ainsi que la cible du processus inflammatoire dans le développement du diabète de type 2 (Shoelson et al. 2006). L’action de ces molécules contribue à l’infiltration des macrophages dans les tissus adipeux, ce qui perpétue le cycle de l’inflammation dans ces tissus reliés au développement du diabète de type 2 (Kanda et al. 2006; Tilg et Moschen 2006). L’inflammation du tissu adipeux a pour effet de réduire l’accumulation de lipides ainsi que d’augmenter l’apoptose des adipocytes et préadipocytes en plus d’induire la dédifférenciation des adipocytes matures (Coppack 2001).
La corrélation entre l’inflammation et la résistance à l’insuline est indéniable, mais les mécanismes précis reliant ces deux phénomènes ne sont toujours pas bien définis (Shoelson et al. 2006; Tilg et Moschen 2006; Lontchi-Yimagou et al. 2013). Différents mécanismes ont été mis de l’avant. Les protéines suppresor of cytokine signaling (SOCS) 1 et 3 ont initialement été identifiées comme des inhibiteurs des voies de signalisation des cytokines dans différents tissus (Krebs et Hilton 2000). Elles ont aussi la capacité d’inhiber la phosphorylation d’IRS-1 en se liant au récepteur à l’insuline ainsi que d’induire sa dégradation, induisant ainsi la résistance à l’insuline (Lebrun et Van Obberghen 2008). Il y a aussi diverses cascades de signalisation telles que la voie NF-κB et celle des PKCs, qui sont activées par des intermédiaires lipidiques et qui induisent l’inflammation, menant ainsi à la phosphorylation des sérines et thréonines d’IRS-1 (Schenk et al. 2008).
1.3 Rôle des tissus adipeux dans le développement de la lipotoxicité
Tel que mentionné précédemment, la lipotoxicité consiste en une accumulation intracellulaire d’acides gras dans les tissus maigres. Le degré d’exposition des tissus maigres aux acides gras est majoritairement déterminé par le métabolisme des tissus adipeux. En temps normal, les tissus adipeux blancs emmagasinent les acides gras alimentaires provenant des chylomicron lors de la phase postprandiale et relâchent des acides gras non estérifiés suite à la lipolyse intracellulaire des réserves de triglycérides lors de la phase post-absorptive (Lewis et al. 2002). Un défaut dans la capacité de stockage des acides gras par le tissu adipeux en réponse à un bilan calorique positif est associé à une augmentation des flux
7 circulants d’acides gras contribuant par le fait même à l’exposition des tissus maigres à ces composés (Carpentier 2008). Plusieurs facteurs peuvent influencer la capacité de stockage des tissus adipeux : 1) Plusieurs gènes importants peuvent affecter le stockage des lipides lorsqu’ils ont une variation dans leur expression; et 2) l’obésité et plus précisément l’obésité viscérale de type hypertrophique est associée à un défaut de stockage des lipides dans les adipocytes.
Plusieurs gènes ont la capacité d’affecter la capacité de stockage des lipides dans les tissus adipeux et plusieurs de ceux-ci sont aussi associés à une augmentation du risque de développer le diabète de type 2. Les quelques exemples suivants servent à démontrer la variété des gènes pouvant affecter le stockage des lipides. La délétion du facteur de transcription PPARG2 dans un modèle de souris obèse mène à une réduction de la masse graisseuse, à la résistance à l’insuline et à la défaillance des cellules β du pancréas (Medina-Gomez et al. 2007). Une délétion homozygote du gène Lipin 1 (LPIN1) génère des souris souffrant de lipodystrophie et caractérisées par une diminution de la masse graisseuse, une forte résistance à l’insuline, mais aussi par le développement progressif d’une neuropathie périphérique (Reue et al. 2000). À l’inverse, une surexpression de LPIN1 dans les tissus adipeux des souris mène à une augmentation du degré d’obésité ainsi qu’à une amélioration de la sensibilité à l’insuline (Phan et Reue 2005), possiblement par l’augmentation de l’absorption des lipides spécifiquement dans les tissus adipeux et une diminution des dépôts ectopiques d’acides gras dans les tissus périphériques (Frayn 2002). La délétion de l’hormone-sensitive lipase (HSL) résulte en une augmentation des risques de diabète de type 2 suite à une réduction du stockage des lipides dans les tissus adipeux qui pourrait être due à une réduction de l’activité des voies régulées par PPARG (Albert et al. 2014). Une mutation du gène cell death-inducing (DNA Fragmentation Factor Subunit Alpha)-like effector C (CIDEC) causant l’apparition d’un codon stop prématuré chez l’humain cause une lipodystrophie avec de faibles niveaux de leptine et d’adiponectine et une augmentation de la résistance à l’insuline (Rubio-Cabezas et al. 2009). L’effet de cette perturbation de l’expression du gène CIDEC contraste avec l’effet de sa délétion chez la souris qui mène à un phénotype maigre et en santé (Toh et al. 2008). Finalement, des mutations dans les gènes
8
congenital lipodystrophy type 2 (BSCL2) causent une lipodystrophie congénitale de
Bernardinelli-Seip caractérisée entre autres par une absence presque complète de tissu adipeux, une forte résistance à l’insuline, une hypertriglycéridémie ainsi qu’une hypertrophie musculaire et une augmentation des risques de développer un diabète de type 2 durant l’adolescence (Magré et al. 2001; Magré et al. 2003; Haghighi et al. 2015).
L’obésité et le surplus de poids affectent plus d’un tiers de la population mondiale et sont considérés comme l’un des facteurs de risque les plus importants du développement du diabète de type 2 (Ng et al. 2014). L’indice de masse corporelle, une mesure de l’adiposité générale, est corrélé au risque de développer le diabète de type 2, mais il ne permet pas de prendre en considération l’effet des différents dépôts de tissus adipeux sur le développement du diabète de type 2 (McLaughlin et al. 2011). La capacité des tissus adipeux à remplir leurs fonctions habituelles dépend de plusieurs facteurs dont la localisation du tissu ainsi que la taille des cellules adipeuse le constituant. Il existe deux dépôts principaux de tissu adipeux blancs (les tissus adipeux viscéraux et les sous-cutanés) ayant une physiologie distincte ainsi que des rôles distincts dans la progression du diabète de type 2, mais dont le rôle principal est le stockage des triglycérides et la sécrétion d’acides gras libres lorsque d’autres tissus requièrent de l’énergie. Ils sont distincts des tissus adipeux bruns dont le rôle consiste en la production de chaleur par une thermogénèse sans frisson (Marlatt et Ravussin 2017).
1.3.1 Les tissus adipeux bruns
Les tissus adipeux bruns, contrairement aux tissus adipeux blancs, sont associés à la thermorégulation par la production de chaleur associée au découplage de la phosphorylation oxydative et de la respiration cellulaire, et ce grâce à leur grande quantité de mitochondries et de la uncoupling protein-1 (UCP1) causant une fuite thermogénique de protons à la membrane des mitochondries (Fenzl et Kiefer 2014). Ces dépôts de tissus adipeux bruns se situent dans la section antérieure du cou jusqu’au thorax chez l’adulte et la quantité de tissu adipeux brun est inversement corrélée à l’adiposité générale (Lehman et al. 2009). Il y a aussi des regroupements d’adipocytes dans les tissus adipeux blancs exprimant aussi UCP1 et ayant la capacité d’effectuer une forte thermogénèse tout comme les tissus adipeux bruns communément appelés les tissus adipeux beiges. Malgré leur capacité commune à effectuer
9 une thermogénèse significative et leurs gouttelettes lipidiques multiloculaires, les tissus adipeux bruns et beiges doivent être considérés comme des types cellulaires différents dus à certaines différences importantes entre les deux (Harms et Seale 2013). Le niveau basal d’expression d’UCP1 par les tissus adipeux beiges est faible contrairement aux tissus adipeux bruns, mais l’expression d’UCP1 augmente en réponse aux mêmes stimuli tel qu’une exposition au froid ou la présence d’un agoniste des récepteurs β-adrénergiques (Cousin et al. 1992). Il a été démontré chez l’humain que le volume total de tissu adipeux brun et beige ainsi que la capacité oxydative de ces tissus augmente significativement suite à une exposition répétée au froid (Noll et al. 2014). L’origine des deux tissus varie aussi, les adipocytes bruns se différenciant à partir de cellules précurseures exprimant myogenic factor
5 (Myf5) alors que les adipocytes beiges proviennent de cellules sans historique d’expression
de Myf5 (Wu et al. 2012). Certaines études indiquent que la majorité des adipocytes beiges proviennent de la transformation d’adipocytes blancs matures en adipocytes beiges en réponse à différents stimuli (Vitali et al. 2012) alors que d’autres indiquent que les adipocytes beiges sont produits directement à partir des cellules précurseures et non d’adipocytes blancs préexistants (Wang et al. 2013). La possibilité d’augmenter la consommation d’énergie par sa diffusion sous forme de chaleur fait des tissus adipeux bruns et beiges des cibles attrayantes dans le traitement de l’obésité et du diabète de type 2 (Cypess et Kahn 2010).
1.3.2 Les tissus adipeux blancs viscéraux et sous-cutanés
Différentes analyses ont démontré qu’une accumulation de tissus adipeux viscéraux augmente les risques de développer de la résistance à l’insuline et du diabète de type 2 alors qu’une accumulation de tissus adipeux sous-cutanés protège contre la résistance à l’insuline chez les patients en surpoids ou obèses (McLaughlin et al. 2011; Farzaneh-Far et Khera 2012). Lorsqu’on considère un plus large éventail d’adiposité, l’accumulation de tissus adipeux est associée à une augmentation des risques de développer de la résistance à l’insuline et le diabète de type 2, peu importe la localisation de l’accumulation (Preis et al. 2010) probablement en raison de l’importance générale de l’obésité comme facteur de risque. La variation dans l’effet des différents dépôts de tissus adipeux sur les risques de développer le diabète de type 2 peut aussi servir à expliquer la variation des risques de développer un diabète de type 2 entre les hommes et les femmes puisqu’il existe une différence marquée
10 dans la distribution des tissus adipeux entre les deux sexes (Kuk et al. 2005). Les hommes ont tendance à accumuler des tissus adipeux au niveau de l’abdomen alors que les femmes accumulent des tissus adipeux sous-cutanés au niveau de la région glutéal-fémoral et pour une adiposité identique, les hommes accumulent deux fois plus de tissus adipeux viscéraux que les femmes (Lemieux et al. 1993; Blouin et al. 2008). L’adiposité viscérale est aussi associée à une augmentation des risques de développer plusieurs autres complications telles que des maladies cardiovasculaires (Kouli et al. 2017), de l’apnée du sommeil (Naufel et al. 2018) et de l’hypertension (Cassano et al. 1990).
L’accumulation de tissus adipeux viscéraux
Les mécanismes reliant l’excès des tissus adipeux viscéraux à l’augmentation des risques de développer de la résistance à l’insuline et un diabète de type 2 comparativement à l’accumulation de tissus adipeux sous-cutanés ne sont pas encore complètement élucidés. Une des explications possibles est que la localisation des tissus adipeux viscéraux leur donne un accès direct au foie par la circulation de la veine porte. Cet accès associé à l’état hyperlipolytique des tissus adipeux viscéraux mènerait au relâchement de grandes quantités d’acides gras non estérifiés aussi appelé acides gras libres vers le foie (Mathieu et al. 2009). L’importance de la lipolyse par les tissus adipeux viscéraux dans l’augmentation de la livraison d’acide gras libre au foie corrèle avec l’augmentation de l’adiposité viscérale (Nielsen et al. 2004), mais puisque moins de 15% des acides gras libres présents dans la circulation veineuse proviennent de la veine hépatique et que plus de 80% des acides gras libres présents au foie proviennent des tissus sous-cutanés, la lipolyse effectuée par les tissus adipeux viscéraux n’est possiblement pas un facteur important dans le développement de la résistance à l’insuline dans les tissus autres que le foie (Klein 2004). Mais, cette augmentation de la présence d’acides gras libres dans le foie stimule aussi la production par le foie de lipoprotéines de très faible densité (VLDL) riches en triglycérides. Cette surproduction de VLDL dépasse éventuellement la capacité de clairance de la lipoprotein
lipase (LPL), qui est sous-exprimée dans les tissus adipeux viscéraux des sujets obèses
(Pouliot et al. 1991), causant une accumulation postprandiale de chylomicrons ainsi que des autres lipoprotéines riches en triglycérides (Rashid et al. 2002), ce qui pourrait augmenter l’exposition des tissus maigres aux acides gras. Cette élévation des triglycérides en
11 circulation mène aussi à une augmentation de la concentration plasmatique de lipoprotéines à faible densité (LDL) petites et denses. Ces LDL petites et denses se lient inefficacement aux récepteurs de LDL ce qui augmente leur demi-vie en circulation (Rizzo et Berneis 2006). De plus, ils ont une plus grande perméabilité endothéliale (Toft-Petersen et al. 2011) ce qui facilite leur entrée dans les parois vasculaires où elles sont oxydées et ensuite absorbées par les macrophages qui se transforment progressivement en cellules spumeuses menant au développement de plaques athérosclérotiques qui sont associées au risque de développer des maladies cardiovasculaires, une des comorbidités principales du diabète de type 2 (Libby et al. 2011).
L’inflammation est un autre mécanisme pouvant relier l’accumulation des tissus adipeux viscéraux aux risques de développer le diabète de type 2. Tel que décrit précédemment, le diabète de type 2 est caractérisé par une inflammation chronique reliée au développement de la résistance à l’insuline et au développement du diabète de type 2. Les tissus adipeux viscéraux sont considérés comme particulièrement associés à l’inflammation par la réduction de la production d’adiponectine, un peptide produit par les adipocytes ayant un effet anti-inflammatoire dans différents organes, ainsi que l’augmentation de la production d’interleukine 6 chez les gens obèses qui est plus particulièrement marquée dans les tissus adipeux viscéraux (Després 2007). En plus de ces variations dans la sécrétion de molécules associées à l’inflammation, les tissus adipeux viscéraux de gens obèses subissent une plus grande infiltration de macrophage que les tissus adipeux sous-cutanés, contribuant aussi au développement de l’inflammation associée au diabète de type 2 (Zhang et al. 2009)
L’importance des tissus adipeux sous-cutanés
Même si les différentes analyses indiquent que l’accumulation de tissus adipeux viscéraux est plus fortement reliée au développement du diabète de type 2, cela ne signifie pas obligatoirement que le problème se développe initialement dans ce tissu. Une des hypothèses à propos de l’origine de l’accumulation des tissus adipeux viscéraux stipule que l’accumulation de tissus adipeux viscéraux résulte d’une limitation dans le stockage d’acides gras par les tissus adipeux sous-cutanés, menant à une augmentation de leur absorption par les tissus adipeux viscéraux (Ali et al. 2010). Il a été démontré qu’une dysfonction de la
12 capacité de stockage des tissus adipeux sous-cutanés, caractérisée par une variation importante de l’expression des gènes Cell death-inducing (DNA fragmentation factor subunit
alpha)-like effector A (CIDEA), Diacylglycerol O-acyltransferase 2 (DGAT2) et Sterol regulatory element binding transcription factor 1c (SREBP1c) qui sont tous impliqués dans
le stockage des lipides, est corrélée à l’expansion des tissus adipeux viscéraux chez des hommes sains soumis à une surcharge lipidique journalière durant près de deux mois (Alligier et al. 2013). Cette hypothèse concorde bien avec les études montrant que l’accumulation de tissus adipeux sous-cutanés protège de la résistance à l’insuline et du diabète de type 2 chez les gens obèses (Farzaneh-Far et Khera 2012). De toute évidence, des déficits dans le stockage des acides gras dans les deux dépôts principaux de tissus adipeux sont importants dans diverses étapes du développement du diabète de type 2, mais la dysfonction des tissus adipeux sous-cutanés précèderait celle des tissus adipeux viscéraux, qui sont plus directement reliés à la résistance à l’insuline.
1.3.3 Hyperplasie et hypertrophie
Les différents mécanismes présentés pour relier l’accumulation de tissus adipeux viscéraux au développement du diabète de type 2 sont aussi reliés au type d’expansion favorisé par les tissus adipeux viscéraux lorsqu’ils sont soumis à un bilan énergétique positif. Il y a deux types d’expansion possible pour les tissus adipeux : 1) l’hypertrophie, soit une augmentation du stockage de lipide dans les adipocytes préexistants résultant en des adipocytes plus gros et moins nombreux; et 2) l’hyperplasie, soit une augmentation du recrutement et de la différentiation de préadipocytes en adipocytes matures résultant en des cellules plus petites et plus abondantes (Sun et al. 2011). L’expansion des tissus adipeux est accompagnée d’un recrutement effectif de macrophages permettant un remaniement de la matrice extracellulaire ainsi qu’une vascularisation adéquate au bon fonctionnement du tissu (Carobbio et al. 2017). Dans le contexte de l’obésité, il est considéré que les tissus adipeux viscéraux favorisent une expansion de type hypertrophique associée au risque de développer différentes complications telles que le diabète de type 2, des maladies cardiovasculaires et de l’hypertension (Blüher 2009). Généralement, la taille des adipocytes présents dans les tissus adipeux augmente non linéairement avec l’adiposité générale excepté dans les populations obèses où la taille des adipocytes atteint un plateau (Laforest et al. 2015). La
13 Figure 1 sert à résumer les caractéristiques particulières des tissus adipeux hyperplasiques et hypertrophiques.
Figure 1 : Caractéristiques des tissus adipeux hyperplasiques et hypertrophiques. Les tissus adipeux
hypertrophiques sont caractérisés par une augmentation de la mort cellulaire, de l’hypoxie, de l’inflammation et de la fibrose ainsi que par un changement de polarité des macrophages, changeant des macrophages M2 anti-inflammatoires vers des macrophages M1 pro-anti-inflammatoires. Crédit : Thierry Chénard, 2018
Mesure de la taille des adipocytes
Les méthodes principales utilisées pour mesurer la taille des adipocytes présents dans les tissus adipeux sont la digestion à la collagénase (Tchernof et al. 2006), la fixation au tétroxyde d’osmium (Michaud et al. 2016) et l’analyse histologique (Laforest et al. 2016), chacun ayant leurs avantages et leurs points faibles. La digestion à la collagénase (Rodbell 1964) est la plus souvent utilisée et consiste en la séparation des adipocytes du reste du tissu par flottaison, générant des cellules vivantes pouvant être utilisées dans des analyses subséquentes dont des études fonctionnelles. Les faiblesses de la digestion à la collagénase sont la faible flottabilité des petits adipocytes, due à leur faible contenu lipidique, et la fragilité des gros adipocytes, cette dernière pouvant être réduite par l’ajout d’adénosine au milieu de suspension (Honnor et al. 1985), mais menant tout de même à un biais envers les
14 cellules de taille moyenne. La fixation au tétroxyde d’osmium (Hirsch et Gallian 1968) fixe les lipides intracellulaires et permet l’analyse des cellules à plus long terme. L’utilisation d’un compteur Coulter Multisizer permet une mesure directe de la taille d’un grand nombre de cellules fixées au tétroxyde d’osmium dont les cellules plus petites, réduisant ainsi le biais envers les cellules plus grandes (McLaughlin et al. 2016). Les points faibles principaux étant le coût relié à la fixation ainsi que l’utilisation du tétroxyde d’osmium, une substance toxique requérant un recyclage adéquat, et l’espace occupé par l’osmium au niveau intracellulaire qui augmente artificiellement la taille des cellules (Laforest et al. 2016). Finalement, l’analyse histologique des tissus permet de conserver l’architecture du tissu analysé et de réaliser des analyses additionnelles d’immunocolloration sur les coupes de tissu (Blanchette 1995). Les faiblesses de l’analyse histologique sont la possibilité que les cellules présentes dans la coupe ne montrent pas leur plus grand diamètre ainsi que le fait que la fixation au formaldéhyde mène à une réduction de la taille des adipocytes (Laforest et al. 2016). Malgré le fait que les différentes techniques de mesure donnent une certaine variation dans la taille des adipocytes, l’association de la taille des adipocytes avec l’obésité n’est pas affectée par la technique choisie (Laforest et al. 2016).
Infiltration de macrophages
L’infiltration de macrophages élevée dans les tissus adipeux viscéraux hypertrophiques menant à l’inflammation chronique associée à la résistance à l’insuline est régulée par une variété de phénomènes (Sun et al. 2011). 1) Dans les tissus adipeux hypertrophiques, il y a une augmentation de la mort cellulaire des adipocytes, soit sous forme de nécrose ou d’apoptose, ce qui pourrait stimuler une infiltration rapide de macrophages (Cinti et al. 2005; Pajvani et al. 2005). Les macrophages fusionnent alors pour absorber les gouttelettes lipidiques des cellules mortes formant de grands syncytia qui sont un marqueur de l’inflammation chronique (Cinti et al. 2005). 2) La production de chimiokines par les tissus adipeux stimule la mobilisation des macrophages vers ces tissus. Il a été démontré que les cellules adipeuses viscérales produisent quantités de MCP1, une cytokine chimiotactique proinflammatoire, proportionnellement à la taille des adipocytes (Bruun et al. 2005; Kanda et al. 2006), les tissus adipeux hypertrophiques produisant donc plus de chimiokine que les hyperplasiques. 3) Une bonne vascularisation des tissus adipeux est importante pour éviter
15 l’hypoxie chez l’obèse. Dans un tissu adipeux hypertrophique, les adipocytes mesurent plus de 100 µm, ce qui correspond à la distance de diffusion de l’oxygène dans les tissus, ce qui peut créer une barrière menant au développement d’hypoxie (Muir et al. 2016). L’effet de l’hypoxie locale dans les tissus adipeux a été examinée dans des modèles animaux menant à la conclusion qu’une variété d’adipokines reliées à l’activation des mécanismes inflammatoires tels que les matrix metalloproteinases (MMP) 2 et 9, la vascular endothelial
growth factor (VEGF) et la leptine sont produites en plus grande quantité dans les tissus
hypoxiques (Lolmède et al. 2003). Plusieurs de ces adipokines sont sous le contrôle direct du facteur de transcription hypoxia inducible factor 1 (HIF-1) dont la sous-unité alpha est sensible à l’oxygène et dont la surexpression est associée à une augmentation de la résistance à l’insuline et de la fibrose de la matrice extracellulaire (Halberg et al. 2009), un autre élément ayant un rôle important dans le développement de la dysfonction des tissus adipeux reliée au diabète de type 2 (Khan et al. 2009). 4) L’augmentation du flux d’acides gras libres en circulation produite par la lipolyse dans les tissus adipeux viscéraux hypertrophiques permet une activation accrue du complexe Toll-like receptor (TLR) 4 (Shi et al. 2006), un récepteur important pour la réponse immunitaire innée aux bactéries Gram négatif (Panchapakesan et Pollock 2018). L’activation de TLR4 active les voies métaboliques classiques de l’inflammation menant à l’activation de NF-κB et à la sécrétion de cytokines (van Beijnum et al. 2008), résultant en une augmentation du recrutement de macrophages aux tissus adipeux hypertrophiques.
Il y a non seulement une augmentation de l’infiltration de macrophages dans les tissus adipeux hypertrophiques, il y a aussi un changement dans le type de macrophages majoritairement présents dans le tissu. Il a été démontré que l’obésité induit un changement de polarité des macrophages de type M2 anti-inflammatoire vers des macrophages de type M1 pro-inflammatoires (Lumeng et al. 2007). Les deux types de macrophages sont activés via différents stimuli, les M1 sont activés par les médiateurs classiques tels que les lipopolysaccharides et l’interféron gamma alors que les M2 sont activés par les IL-4 et IL-13 (Gordon 2003). L’activité anti-inflammatoire des macrophages M2 passe par une production élevée de la cytokine anti-inflammatoire IL-10, du récepteur leurre d’IL-1 ainsi que d’arginase. L’arginase empêche la production d’oxyde nitrique, une ROS impliquée dans
16 l’inflammation, en partie en consommant l’arginine nécessaire à la production d’oxyde nitrique (Bronte et Zanovello 2005). Les M1 ont quant à eux une production accrue des cytokines pro-inflammatoires IL-6, IL12 et TNFα ainsi qu’une accumulation de succinate et de citrate causée par une augmentation de la glycolyse, de l’activité de la voie des pentoses phosphate, de la synthèse d’acides gras et d’une terminaison hâtive du cycle de Krebs (Na et al. 2018). L’effet pro-inflammatoire du succinate passe par la stabilisation de HIF-1α (Tannahill et al. 2013) alors que l’accumulation de citrate sert de précurseur dans la production de plusieurs métabolites pro-inflammatoires tels que les ROS, les acides gras et le NADPH (Na et al. 2018).
Matrice extracellulaire
La matrice extracellulaire des tissus adipeux joue un rôle important dans le maintien de sa fonction et le remodelage de la matrice extracellulaire a un rôle critique dans l’accommodation des variations de la demande en stockage lipidique. Dans les cas d’expansion hypertrophique associée à un apport énergétique excessif soutenu, la matrice extracellulaire subit un stress menant au développement de complications telles l’inflammation et la résistance à l’insuline (Lackey et al. 2013). L’expression de plusieurs types de collagènes est augmentée chez les gens obèses, mais plusieurs (collagènes type 6 alpha 3, type 5 alpha 2 et type 3 alpha 1) ont une expression plus faible chez les obèses souffrant du syndrome métabolique que chez les obèses sains (Buechler et al. 2015). Cette surabondance de collagène dans la matrice extracellulaire coincide avec le développement de fibrose dans le tissu adipeux. L’expression de plasminogen activator inhibitor 1 (SERPINE1), un inhibiteur de la fibrinolyse, est elle aussi élevée dans les tissus adipeux de gens obèses, contribuant ainsi à l’augmentation de la fibrose (Alessi et al. 2000).
La fibrose est une accumulation excessive de tissu conjonctif fibreux dans la matrice extracellulaire d’un tissu en réponse à différents stimuli et dont les mécanismes ne sont pas complètement connus (Birbrair et al. 2014). La fibrose des tissus adipeux augmente avec l’adiposité générale et diminue lors de la perte de poids. La fibrose des tissus adipeux viscéraux est inversement associée à la taille des adipocytes présents dans le tissu, indiquant que la fibrose viscérale contribue à limiter l’expansion de la taille des adipocytes viscéraux.
17 Cette association n’a pas été détectée dans les tissus adipeux sous-cutanés, mais une corrélation négative existe entre la quantité de fibrose dans les tissus adipeux sous-cutanés et le pourcentage de masse grasse perdu par les patients ayant subi une chirurgie bariatrique indépendamment de l’inflammation (Divoux et al. 2010). De plus, l’augmentation de la fibrose est aussi associée à une augmentation de l’hyperplasie des préadipocytes, ce qui supporte un modèle dans lequel la fibrose des tissus adipeux régule l’équilibre entre l’hyperplasie et l’hypertrophie (Muir et al. 2016). D’autre part, l’augmentation de la rigidité de la matrice extracellulaire associée à la fibrose a aussi été associée à une augmentation des risques de complications puisque l’absence du collagène VI dans les tissus adipeux cause un relâchement de la matrice extracellulaire et permet une meilleure expansion du tissu adipeux menant à une amélioration du profil inflammatoire et du métabolisme énergétique général (Khan et al. 2009). La variation de la fibrose des tissus adipeux mènerait à une augmentation de sa rigidité limitant la capacité du tissu adipeux à se dilater pour stocker plus de lipides alimentaires et à rapetisser lors de la perte de poids pouvant mener à une augmentation du relâchement d’acide gras dans la circulation, ce qui est associé au développement de la lipotoxicité. De plus, la fibrose des tissus adipeux est associée à une augmentation de l’inflammation et plusieurs facteurs pro-fibrotiques affectent négativement la différentiation des préadipocytes en adipocytes matures (Pellegrinelli et al. 2016). Finalement, la majorité des preuves directes de l’effet de la fibrose sur le métabolisme des tissus adipeux indique un effet néfaste par la limitation de la capacité de stockage des tissus adipeux et l’augmentation de l’inflammation.
1.4 Voies de traitement actuelles pour le diabète de type 2
Il existe plusieurs voies actuellement utilisées dans le traitement du diabète de type 2. Celles-ci peuvent être séparées en trois grands groupes : les changements des habitudes de vie, les chirurgies bariatriques et les approches pharmacologiques.
1.4.1 Changements des habitudes de vie
Les changements de la diète et d’activité physique sont à la base du traitement du diabète de type 2. Ces changements des habitudes de vie du patient visent l’amélioration des
18 symptômes du diabète de type 2 par l’intermédiaire d’une perte de poids et une réduction de l’apport calorique, réduisant la demande de stockage dans les tissus adipeux (Cradock et al. 2017). La combinaison d’une augmentation de l’activité physique avec une restriction calorique a été démontrée comme ayant un effet plus élevé sur les différents indicateurs de glycémie que chacune des deux interventions individuelles (Zhang et al. 2016a). L’arrêt de la consommation de tabac est aussi recommandé pour les patients diabétiques puisqu’elle est associée à une augmentation significative des risques de diabète de type 2 (Levesque 2017). Les interventions visant à changer les habitudes de vie peuvent aussi réduire de près de 50% les risques de développer le diabète de type 2 chez des patients à risque élevé de le développer (Kolb et Martin 2017; Sun et al. 2017). Il a été découvert qu’une perte de poids modérée réduit préférentiellement la quantité de tissu adipeux viscéral et améliore les dysfonctions métaboliques associées, mais que ce biais envers les tissus adipeux viscéraux diminue avec une perte de poids plus importante (Chaston et Dixon 2008).
La limite principale des interventions visant le changement des habitudes de vie est l’adhérence variable des patients aux traitements, qui peut varier de 10 à 80% pour des programmes d’exercice à long terme (Praet et van Loon 2009). Les diètes faibles en calorie, quant à elles, sont efficaces pour une bonne perte de poids initiale, mais plus de 70% des patients ne parviennent pas à conserver cette perte de poids à long terme, en raison des mécanismes adaptatifs à la diète favorisant un regain de poids (Maclean et al. 2011). Plusieurs facteurs peuvent affecter le taux d’adhérence des patients tels que la motivation, la fréquence du suivi effectué par le personnel médical et les aliments prescrits dans la diète (García-Pérez et al. 2013). Les modifications des habitudes de vie sont habituellement le traitement utilisé initialement pour le diabète de type 2 en combinaison avec la prise de metformine (Garber et al. 2017).
1.4.2 Chirurgie bariatrique
Tout comme pour les interventions sur les habitudes de vie, l’objectif principal de la chirurgie bariatrique est de faciliter une perte de poids majeure à long terme (Koliaki et al. 2017). En plus de la perte de poids, les chirurgies bariatriques influencent la distribution des tissus adipeux vers une accumulation sous-cutanée (Frikke-Schmidt et al. 2016) et ils
19 amènent aussi une amélioration du métabolisme du glucose et de la résistance à l’insuline indépendante de la perte de poids et dont les mécanismes ne sont pas encore complètement élucidés (Bojsen-Møller et al. 2013). Les différentes chirurgies bariatriques utilisent tous les mêmes mécanismes de base soit une restriction de l’apport alimentaire, une malabsorption calorique ou une combinaison des deux. Quatre procédures majeures représentent la majorité des chirurgies bariatriques réalisées mondialement : le pontage gastrique de Roux-en-Y, la gastrectomie longitudinale, l’anneau gastrique ajustable et la dérivation biliopancréatique avec commutation duodénale (Torres-Landa et al. 2018). La Figure 2 décrit schématiquement ces chirurgies.
Figure 2 : Représentation schématique des chirurgies bariatriques les plus communes. A) l’anneau gastrique
ajustable. B) La gastrectomie pariétale. C) Le pontage gastrique Roux-en-Y. D) La dérivation biliopancréatique avec commutation duodénale. Adapté avec permission d’images provenant de bariatric-surgery-source.com (10 janvier 2018).
20 L’efficacité de la perte de poids et l’amélioration du diabète varient en fonction de la chirurgie. La dérivation biliopancréatique avec commutation duodénale est la plus efficace, suivie du pontage gastrique de Roux-en-Y, de la gastrectomie pariétale et de l’anneau gastrique ajustable (Cummings et Rubino 2018). La prévalence des effets secondaires suite à ces chirurgies suit en gros l’ordre inverse. La gastrectomie pariétale est la chirurgie la plus fréquemment utilisée au niveau mondial et aussi celle en plus forte croissance (Angrisani et al. 2017). À court terme. l’amélioration du métabolisme menant à la rémission du diabète de type 2 suivant les chirurgies provient principalement de la restriction calorique importante menant à un état hypocalorique suivi ensuite par une perte de poids importante après la chirurgie (Koliaki et al. 2017). Cette perte de poids peut varier entre ~25% et >60% du poids initial 4 ans après la chirurgie dépendamment du type d’opération (Maciejewski et al. 2016). En plus de la perte de poids, plusieurs effets métaboliques indépendants de la perte de poids et spécifiques aux chirurgies bariatriques dont un contournement de l’appareil gastro-intestinal supérieur se produisent rapidement et contribuent à l’amélioration de la sensibilité à l’insuline (Chondronikola et al. 2016).
La limite majeure des chirurgies bariatriques est leur accessibilité qui reste limitée (Sweeting et al. 2015). De plus, toutes les chirurgies bariatriques sont associées à une variété de complications. Par exemple, une perte de densité osseuse semble être associée plus fortement aux chirurgies de malabsorption, mais est tout de même présente après les chirurgies restrictives (Lalmohamed et al. 2012). Des déficits en plusieurs minéraux et vitamines tels que le fer, la vitamine B12 et le folate causés par les chirurgies bariatriques ont été associés à une augmentation des risques d’anémie (Alexandrou et al. 2013; Lupoli et al. 2017). Les chirurgies de malabsorption résultent aussi en des déficits protéiques dans une faible proportion des patients (Faintuch et Matsuda 2004; Taton et al. 2017). Le pontage gastrique de Roux-en-Y possède quelques complications spécifiques incluant une hypoglycémie dans les heures suivant un repas (van Beek et al. 2016) et une vidange gastrique rapide (Borbély et al. 2017). Malgré les différents effets secondaires pouvant être développés suite à une chirurgie bariatrique, les effets bénéfiques de la perte de poids associée à ces chirurgies demeurent plus importants et ces chirurgies constituent les
21 approches ayant les effets les plus prononcés sur l’incidence du diabète de type 2 (Ollendorf et al. 2016).
1.4.3 Approches pharmacologiques
L’amélioration de notre compréhension des mécanismes physiopathologiques associés au développement du diabète de type 2 a permis la génération d’une variété de traitements. Ces différents traitements ciblent habituellement au moins l’un des mécanismes suivants : la sécrétion d’insuline, l’effet des incrétines, la lipolyse, la réabsorption du glucose, l’absorption du glucose, la production hépatique de glucose et la sécrétion de glucagon (Thrasher 2017). Six classes d’agents thérapeutiques n’étant pas de l’insuline sont favorisées dans les recommandations de l’American Diabetes Association (American Diabetes Association 2016a) : la metformine, les agonistes du récepteur du glucagon-like
peptide-1 (GLP-1), les inhibiteurs du sodium glucose cotransporter 2 (SGLT2) et du dipeptidyl peptidase-4 (DPP-4), les sulfonylurées et les thiazolidinediones.
Metformine
Tel que défini précédemment, un traitement à la metformine accompagné de changements des habitudes de vie sert de traitement initial dans la gestion du diabète de type 2 (Garber et al. 2017). Les effets principaux de la metformine sont la réduction de la production hépatique de glucose et de la résistance à l’insuline hépatique ainsi qu’une augmentation de l’utilisation du glucose par les tissus périphériques (Hu et al. 2017) pouvant résulter en une perte de poids modeste ainsi qu’en une amélioration de l’hyperglycémie avec un faible risque d’hypoglycémie (Garber et al. 2017). Par contre, la prise de metformine nuit à l’absorption de la vitamine B12 pouvant, à long terme, mener à des déficits en vitamine B12 et des défauts neuropsychiatriques dans de très rares cas (Olt et Oznas 2017).
Agoniste du récepteur du GLP-1 et inhibiteurs de DPP-4
GLP-1 est une hormone produite par l’intestin grêle stimulant l’excrétion d’insuline, inhibant le relâchement de glucagon, ralentissant la vidange gastrique et réduisant l’appétit par son interaction avec son récepteur (Marathe et al. 2013). GLP-1 est habituellement
22 rapidement dégradé par DPP-4. Les agonistes du récepteur du GLP-1 sont résistants à la dégradation par DPP-4 et sont associés à une réduction des niveaux de glucose et une perte de poids avec un faible risque d’hypoglycémie (Kim et al. 2017). De plus, certains agonistes du récepteur du GLP-1 ont démontré une capacité à réduire les risques de complications cardiovasculaires (Bethel et al. 2018). Les inhibiteurs de DPP-4 quant à eux n’entrainent pas de perte de poids tout en permettant une réduction des niveaux de glucose moins importante que les agonistes du récepteur du GLP-1, possiblement parce qu’ils n’agissent pas directement sur le récepteur du GLP-1. Les agonistes du récepteur du GLP-1 et les inhibiteurs de DPP-4 ont été associés à une augmentation des risques de développer des pancréatites et des cancers pancréatiques (Elashoff et al. 2011) mais aucune association forte entre la prise de ces médicaments et l’augmentation des problèmes pancréatiques n’a pu être identifiée (Monami et al. 2017). Par contre, la prise d’agoniste du récepteur du GLP-1 ou d’inhibiteurs de DPP-4 augmente les risques de développer des calculs biliaires et les complications associées (Monami et al. 2017).
Inhibiteurs de SGLT2
SGLT2 est l’un des contributeurs majeurs de la réabsorption du glucose dans les reins. L’inhibition de SGLT2 mène à une réduction des niveaux de glucose sanguin due à une augmentation de l’excrétion rénale de glucose. Les inhibiteurs de SGLT2 sont associés à une perte de poids modérée, une baisse de la pression, une réduction des risques cardiovasculaires ainsi qu’un effet protecteur sur les reins (Avogaro et al. 2018; Wang et al. 2018). Chez la souris diabétique de type 2, l’administration d’un inhibiteur de SGLT2 améliore plusieurs caractéristiques associées au diabète de type 2 tels que l’inflammation, l’obésité et le métabolisme anormal des lipides (Tahara et al. 2017). Les effets indésirables principaux de la prise d’inhibiteurs de SGLT2 sont l’augmentation des risques de développer des infections urogénitales et l’augmentation des risques d’acidocétose diabétique euglycémique, qui reste toutefois minime (Filippas-Ntekouan et al. 2018).
23
Sulfonylurées et thiazolidinediones
Les sulfonylurées et les thiazolidinediones permettent tous les deux de réduire le niveau de glucose sanguin, mais sont les deux classes d’agents thérapeutiques ayant la plus faible priorité dans l’algorithme de traitement de l’American Diabetes Association, dû en partie à leurs effets secondaires qui comprennent entre autres : une prise de poids pour les deux catégories d’agents thérapeutiques, une augmentation des risques d’insuffisance cardiaque avec la prise de thiazolidinediones et une hypoglycémie causée par les sulfonylurées (Garber et al. 2017). Les sulfonylurées stimulent le relâchement d’insuline indépendant du glucose par les cellules β du pancréas en inhibant les flux de potassium à travers des canaux potassiques ATP-dépendants présents à la membrane plasmique (Thulé et Umpierrez 2014). Les thiazolidinediones sont des agonistes du récepteur nucléaire PPARG menant à une augmentation de la sensibilité à l’insuline dans tous les tissus par les différentes voies de signalisation stimulées par PPARG qui ne sont pas encore toutes comprises (Ahmadian et al. 2013).
Malgré la variété des traitements disponibles pour le diabète de type 2, le nombre de cas de diabète de type 2 est toujours en croissance mondialement (International Diabetes Federation 2015). De plus, tous les traitements pharmacologiques actuellement disponibles ciblent la résistance à l’insuline ou le niveau élevé de glucose sans prendre en considération les causes de ces problèmes physiopathologiques. L’identification de nouvelles cibles thérapeutiques affectant le métabolisme des lipides relié à l’hypertrophie des adipocytes et menant à la lipotoxicité pourrait éventuellement aider au développement de nouveaux agents thérapeutiques contre le diabète de type 2.