THÈSE
THÈSE
En vue de l'obtention duDOCTORAT DE L’UNIVERSITÉ DE TOULOUSE
DOCTORAT DE L’UNIVERSITÉ DE TOULOUSE
Délivré par l'Université Toulouse III - Paul Sabatier Discipline: Biosciences Végétales
Présentée et soutenue par : Ricardo Aarón Chávez Montes
Titre :
Caractérisation de mutants et transformants d'α -L-arabinofuranosidase chez Arabidopsis thaliana
JURY
Marie-Christine Ralet, Chargée de Recherche, INRA, centre de Nantes, Rapporteur Grégory Mouille, Chargé de Recherche, INRA, centre de Versailles, Rapporteur Rafael Pont-Lezica, Professeur de l'Université Paul Sabatier, Toulouse, Examinateur Michael O'Donohue, Directeur de Recherche, INRA, centre de Toulouse, Examinateur Yves Barrière, Directeur de Recherche, INRA, centre de Poitou-Charentes, Examinateur Deborah Goffner, Chargée de Recherche, CNRS, Toulouse, Directrice de thèse
Ecole doctorale : Biologie – Santé – Biotechnologies
Unité de recherche :« Surfaces cellulaires et signalisation chez les végétaux », Unité Mixte de Recherche 5546, Université Paul Sabatier – CNRS, 24 chemin de Borde Rouge, BP 42617 Auzeville, 31326 Castanet-Tolosan, France
I wish God were alive to see this...
REMERCIEMENTS Je remercie Deborah pour m'avoir accueilli dans son équipe, pour sa confiance, sa patience, sa direction... Bref, pour avoir été ma chef pendant ces années de thèse. Bien évidemment merci à Philippe Ranocha, même s'il ne veut pas être remercié. Tout ceci n'aurait été possible sans lui. Merci au service microscopie : Alain Jauneau. Toujours de bonne humeur. Toujours disponible pour aider un élève en difficultés ou pour une discussion sur les parois, le monde, la vie... Alain m'a toujours aidé à voir ce qui est important. Yves Martinez. Avec qui d'autre voudraiton passer des journées entières au confocal? Au fait, je t'ai raconté ma dernière théorie sur les arabinanes? Merci à JeanLouis Luc et à Patricia Panegos, sans qui il n'y a plus de jolies plantes d'Arabidopsis à analyser. Ne partez pas en vacances! #!/usr/bin/perl for ($i = 1; $i <= 1000; $i++) { print "Merci Hélène!\n"; # Hélène San Clemente } Evidemment, merci à Sabine Guillaumie et à Christophe Pineau, chers camarades thésards. Nous avons passé trop peu de temps ensemble...
TABLE DES MATIERES LISTE DES FIGURES...7 LISTE DES TABLEAUX...9 ABREVIATIONS...11 INTRODUCTION GENERALE...13 INTRODUCTION...15 I 1 L'importance des parois végétales...15 I 2 Les différents types de paroi...15 I 2.1 La paroi primaire...17 I 2.1.1 La structure de la cellulose...17 I 2.1.2 La structure des hémicelluloses...17 I 2.1.3 La structure des pectines...19 I 2.1.3.1 La structure de l'homogalacturonane...19 I 2.1.3.2 La structure du rhamnogalacturonaneI...21 I 2.1.3.3 La structure du rhamnogalacturonaneII...23 I 2.1.4 L'organisation de la paroi primaire...23 I 2.2 La paroi secondaire...25 I 2.2.1 Composition de la paroi secondaire...25 I 2.2.2 La structure des xylanes...25 I 2.2.3 La composition de la lignine...25 I 2.2.4 L'organisation de la paroi secondaire...27 I 3 La nature des protéines pariétales...27 I 4 Synthèse et modification des polysaccharides pariétaux...29 I 4.1 Les UDP et GDPsucres...29 I 4.2 La base de données CAZy...33 I 4.3 Synthèse et modification de la cellulose...35 I 4.4 La synthèse des pectines et hémicelluloses : les GT...35 I 4.5 La modification des pectines et hémicelluloses : les GH...41 I 5 Les α Larabinofuranosidases...43 I 5.1 Définition de la réaction Larabinofuranosidase...43 I 5.2 Les arabinofuranosidases de microorganismes...43 I 5.2.1 Le mécanisme de réaction des arabinofuranosidases...45 I 5.3 Les arabinofuranosidases de plantes...45 I 5.3.1 Arabinofuranosidases vraies et bifonctionnelles...45
I 5.3.2 Les substrats des arabinofuranosidases : molécules artificielles, polysaccharides d'origine végétale...47
I 5.4.2 Le rôle des arabinanes pectiques...55 I 5.4.3 Les arabinanes des arabinogalactaneprotéines...59 I 5.4.4 Le rôle des xylanes...61 OBJECTIFS...63 RESULTATS...67 R 1 Analyse bioinformatique des séquences d'arabinofuranosidase de plantes...67 R 1.1 Propriétés des séquences d'arabinofuranosidase de la famille 3 et 51 d'Arabidopsis...67 R 1.2 Combien d'arabinofuranosidases dans d'autres plantes ?...69 R 2 Article : caractérisation de mutants et transformants ARAF1...75 R 3 Résultats complémentaires pour le mutant araf11...93 R 3.1 Phénotypage du mutant araf11...93 R 3.2 Croissance à l'obscurité à 4°C...93 R 3.3 Marquage LM6 en microscopie électronique...95 R 3.4 Hydrolyse in vitro des AIR araf11 et 35S::ARAF1...99 R 4 Caractérisation fonctionnelle du gène ARAF2...99 R 4.1 Expression du gène ARAF2...99 R 4.1.1 RTPCR...99 R 4.1.2 Plantes pARAF2::GUS...101 R 4.2 Caractérisation du mutant araf2...101 R 4.2.1 Obtention du mutant araf2...101 R 4.2.2 Le niveau d'activité ARAF2 dans les hampes d'Arabidopsis...103 R 4.3 Phénotypage du mutant araf2...103 R 5 Les doubles mutants araf1araf2 et araf1xyl1...105 R 5.1 Le double mutant araf1araf2...105 R 5.2 Le double mutant araf1xyl1...105 R 6 Effet du Larabinose sur la croissance de plantules in vitro...107 DISCUSSION...111 D 1 Les arabinofuranosidases participent à un équilibre de synthèse / hydrolyse des arabinanes...111 D 2 Les arabinofuranosidases dans les graines d'Arabidopsis...113 D 3 L'effet de l'altération des arabinanes sur la physiologie d'Arabidopsis...115 D 4 Les arabinanes sontils un senseur moléculaire ?...119 D 5 Vers un rôle des arabinofuranosidases dans la partition de carbone...121 D 5.1 Le métabolisme du Larabinose...121 D 5.2 Régulation allostérique des voies de synthèse des UDP/GDPsucres...123
PERSPECTIVES...127 P 1 Analyse structurale des arabinanes chez les transformants ARAF1...127 P 2 Caractérisation d'ARAF2 et XYL1...127 P 3 Les arabinanes des arabinogalactane protéines...129 P 4 Les sousgroupes de la famille 3 des GH...129 P 5 Les arabinofuranosidases et la synthèse des pectines et des hémicelluloses...129 P 6 Les arabinofuranosidases et la mise en place de la paroi secondaire...131 P 7 Les arabinofuranosidases et le métabolisme des UDP/GDPsucres...131 MATERIELS ET METHODES...133 REFERENCES BIBLIOGRAPHIQUES...141 ANNEXE 1...169 ANNEXE 2...175
LISTE DES FIGURES Figure 1, L'importance des paroi végétales...14 Figure 2, Microfibrilles de cellulose...16 Figure 3, Structure de l'homogalacturonane...18 Figure 4, Structure du rhamnogalacturonaneI...20 Figure 5, Structure des arabinanes d'Arabidopsis...20 Figure 6, Structure du rhamnogalacturonaneII...22 Figure 7, Pont esterborate entre deux chaînes de rhamnogalacturonaneII...22 Figure 8, Modèle simplifié de la paroi primaire...24 Figure 9, Structure des xylanes...24 Figure 10, Les couches S1, S2 et S3 de la paroi secondaire...26 Figure 11, Stratégie globale pour la synthèse des polysacharides pariétaux...28 Figure 12, Métabolisme des UDP/GDPsucres...30 Figure 13, Synthèse de cellulose par les cellulose synthases...34 Figure 14, Réaction catalysée par les Larabinofuranosidases...42 Figure 15, Mécanisme de réaction des arabinofuranosidases de la famille 51...44 Figure 16, Cinétique de formation d'un "transglycoside"...44 Figure 17, Structure des gènes ARAF1 et ARAF2...66 Figure 18, Alignement des séquences protéiques ARAF1 et ARAF2...68 Figure 19, Structure du gène XYL1...70 Figure 20, Phylogramme des séquences de la famille 3 de plantes...74 Figure 21, Effet du froid sur la croissance de plantules étiolées WS et araf11...94 Figure 22, Micrographies électroniques du marquage LM6...96 Figure 23, Détection par RTPCR du transcrit ARAF2 dans différents tissus d'Arabidopsis...98 Figure 24, Activité GUS des plantes pARAF2::GUS...100 Figure 25, Obtention du mutant araf2...102 Figure 26, Développement de plantules in vitro en présence de Larabinose 30 mM...106 Figure 27, Développement de plantules in vitro en présence de saccharose et de différentes concentrations de Larabinose...108 Figure 28, Le métabolisme du Larabinose...120 7
LISTE DES TABLEAUX Tableau 1, Caractéristiques biochimiques des arabinofuranosidases purifiées de plantes...46, 48 Tableau 2, Nombre de gènes de la famille 51 et 3 parmi quelques espèces végétales...72 Tableau 3, Expériences réalisées pour le phénotypage du mutant araf11...92 Tableau 4, Niveau du marquage LM6 dans les différents tissus WS et araf11...97 Tableau 5, Hydrolyse enzymatique de résidus alcoolinsolubles des racines et de bas de hampe de plantes araf11 et 35S::ARAF1b...98 Tableau 6, Expériences réalisées pour le phénotypage des mutants araf11 et araf2...104
ABREVIATIONS AGP arabinogalactane protéine CAZy Carbohydrate Active enZymes CESA cellulose synthase GH glycosylhydrolase GT glycosyltransférase HG homogalacturonane pNPA 4nitrophénylLarabinofuranose pNPX 4nitrophénylDxylopyranose RGI rhamnogalacturonaneI RGII rhamnogalacturonaneII SBA sugar beet arabinan (arabinane de betterave) WAX wheat arabinoxylan (arabinoxylane de blé) 11
INTRODUCTION GENERALE
Ce travail de thèse a été réalisé dans l'équipe "Différientiation du xylème : Signaux cellulaires et dynamique pariétale" dirigée par Deborah Goffner, à l'UMR 5546 CNRSUPS, "Surfaces cellulaires et signalisation chez les végétaux". L'équipe s'intéresse aux mécanismes de synthèse et de modification des parois végétales. Durant le processus d'identification des possibles acteurs de ces mécanismes, notre attention s'est tournée vers une catégorie particulière d'enzymes, les Larabinofuranosidases. C'est dans ce contexte qu'a été entreprise la caractérisation de deux gènes d'Arabidopsis, nommées ARAF1 (At3g10740) et ARAF2 (At5g26120), et annotés "Larabinofuranosidase" dans les bases de données. Une partie du travail a donné lieu à une publication dans la revue Plant Physiology (2008, 147: 6377) avec le titre "Cell wall modifications in Arabidopsis thaliana plants with altered Larabinofuranosidase activity", qui est incluse dans la section Résultats. Ce manuscrit est divisé en six parties, une Introduction (dont les paragraphes sont nommés I1, I2, etc.), les Objectifs de la thèse, les Résultats (R1, R2, etc.), une Discussion (D1, D2, etc.), les Perspectives (P1, P2 etc.) et les Matériels et Méthodes.
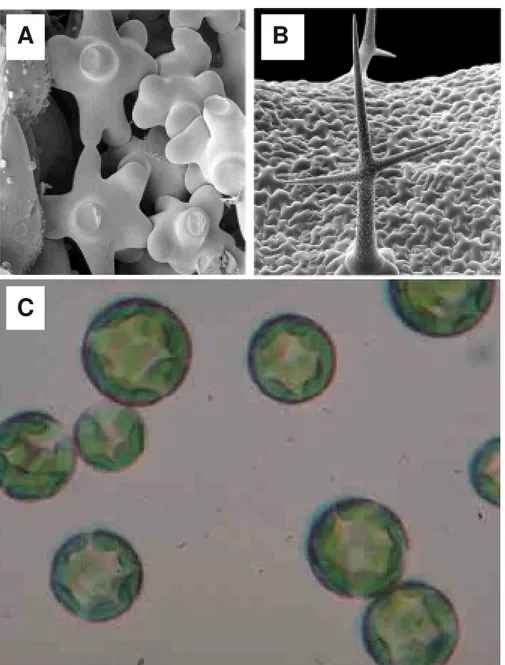
Figure 1. L'importance des parois végétales. A, cellules de parenchyme de feuilles de Zinnia elegans et B, un trichome d'Arabidopsis. La paroi détermine la forme des cellules végétales. Noter le contraste entre A ou B et la forme sphérique des protoplastes (C), cellules végétales sans paroi.
Source: A, http://users.ugent.be/~pdebergh/ind/ind01.jpg; site « Tissue culture and Biotehnology », un projet conjoint entre Department of Plant Production Horticulture, Universiteit Gent (Belgique) et Department of Botany, University of Natal Pietermaritzburg (Afrique du Sud).
C
INTRODUCTION
I 1 L'importance des parois végétales
La paroi est responsable de l'énorme diversité des formes et des tailles des cellules végétales (Figs. 1A et 1B) et, par conséquent, de l'énorme diversité des formes et des tailles des plantes. Sans sa paroi, une cellule acquiert une forme sphérique, dictée uniquement par les lois de la thermodynamique (Fig. 1C). Nous pouvons ainsi comprendre intuitivement que la paroi est l'un des facteurs essentiels qui contrôlent le développement des cellules végétales et donc de la plante dans son ensemble. Nous savons que la forme d'une cellule végétale est la résultante d'un équilibre entre une force hydrostatique qui pousse vers l'extérieur de la cellule et la tension de la paroi végétale qui entoure la cellule (Cosgrove, 2000; Thompson, 2005; Cosgrove, 2005). Bien qu'il ait été montré que l'expansion de la paroi peut influencer la morphogenèse (Fleming et al., 1997; Pien et al., 2001), il reste encore à déterminer si cette expansion est à l'origine ou à l'aboutissement du processus (Fleming, 2006). Toutefois, la paroi est plus que le support mécanique de la cellule. En effet, elle est aussi une source de signaux impliqués dans plusieurs processus physiologiques. On assiste ainsi depuis quelques années à une série de découvertes qui montrent que des plantes altérées dans la composition ou la structure de la paroi présentent aussi des altérations dans la réponse à la sécheresse ou aux stress osmotiques (Chen et al., 2005), dans la morphogenèse (Krupková et al., 2007), dans la résistance aux bactéries ou aux champignons pathogènes (Hernandez Blanco et al., 2007), dans la sensibilité au saccharose (Li et al., 2007). Ainsi, la paroi doit être considérée comme un organite à part entière participant activement à la physiologie de la cellule. Pourtant, si la nature des composants de la paroi est assez bien connue, les mécanismes de biosynthèse et de modification des parois sont loin d'être élucidés (Kohorn, 2001; Bacic, 2006). C'est dans ce contexte que s'inscrit ce travail de thèse, qui a porté sur les arabinofuranosidases, des enzymes de modification de la paroi.
I 2 Les différents types de paroi
Il existe deux types de parois chez les plantes, les parois primaires (chez les non graminées, elle est de Type I, chez les graminées, de Type II) et les parois secondaires. Toutes sont composées de polysaccharides variés, de protéines et certaines (les parois secondaires) contiennent également des composés phénoliques. Toutes les cellules
Figure 2. Microfibrilles de cellulose. Une microfibrille est composée de douzaines de molécules de cellulose qui s'assemblent en une matrice cristalline. Les microfibrilles peuvent interagir avec d'autres polysaccharides présents dans la paroi (hémicelluloses et, possiblement, pectines). Source: http://www.emc.maricopa.edu/faculty/farabee/biobk/BioBookCHEM2.html, site « Online Biology Book », M.J. Farabee, Estrella Mountain Community College, Avondale, AZ (Etats Unis d'Amérique). Matrice cristalline Molécules de cellulose Microfibrille Molécules de cellulose Autres polysaccharides
comportent une paroi primaire. La plupart des plantes contiennent des parois de Type I. Néanmoins, certaines espèces végétales de grande importance économique (le maïs, Zea
mays; le blé, Triticum spp.; le sorgho, Sorghum spp.; l'orge, Hordeum vulgare; le riz, Oryza sativa / glaberrima), qui appartiennent à l'ordre des Poales, famille des Poaceae (ex Gramineae), possèdent un type de paroi primaire à la composition particulière, appelée paroi
de Type II. Ces parois diffèrent des parois de Type I par leur contenu élevé en glucuronoarabinoxylanes (GAX), une hémicellulose qui n'est habituellement présente que dans les parois secondaires, par leur faible contenu en pectines et par la présence de composés aromatiques (hydroxycinnamates, ferulate, et pcoumarate; Carpita, 1996). Finalement, certains types cellulaires particuliers, c'estàdire les fibres (le sclérenchyme) et les vaisseaux de xylème, possèdent un deuxième type de paroi, appelée paroi secondaire, qui est déposée après le processus d'expansion. Dans les sections suivantes nous allons présenter ces différents types de paroi, commençant par la structure des différents polysaccharides qui les composent pour ensuite aborder l'organisation de ces polysaccharides au sein de la matrice.
I 2.1 La paroi primaire
I 2.1.1 La structure de la cellulose
Les parois primaires de Type I sont composées de cellulose, d'hémicelluloses et de pectines. La cellulose est un polymère comportant 500 à 14000 résidus de (1,4)D glucopyranose (Somerville, 2006). Dans la paroi, la cellulose se trouve sous forme de microfibrilles, comprenant des douzaines de chaînes de polymère, qui font 35 nm de largeur et plusieurs m de longueur (Fig. 2; Cosgrove, 2005). I 2.1.2 La structure des hémicelluloses Les hémicelluloses sont un groupe de polysaccharides complexes qui se caractérisent par leur extractibilité de la paroi par des solutions alcalines (par exemple KOH 1M). Le squelette des hémicelluloses est composé de résidus (1,4)Dpyranose, où l'O4 est en positionβ équatoriale. Les pyranoses peuvent être glucose, mannose ou xylose, et les hémicelluloses sont alors appelées xyloglucanes, mannanes ou xylanes, respectivement.
Figure 3. Structure de l'homogalacturonane (HG) et ponts Ca2+ entre deux chaînes d'HG. L'HG est un polymère linéaire de résidus d'(1,4)D galacturonate. Les groupes carboxyle libres du groupe acide forment une liaison ionique avec des ions calcium et stabilisent l'interaction entre deux chaînes HG. Adapté de Cosgrove, 2005.
Dans les parois primaires de type I, la principale hémicellulose est le xyloglucane. Le xyloglucane est composé d'un squelette de Dglucose en (1,4), et ces glucoses peuvent être substitués en (1,6) par des résidus de Dxylose. Les xyloglucanes ont été particulièrement étudiés car ils sont essentiels pour déterminer l'expansibilité de la paroi primaire, et l'expansion des parois est un des sujets fondamentaux de la recherche sur les parois végétales (Cosgrove, 2005). Un autre type d'hémicellulose que l'on trouve dans les parois primaires est le mannane. Le mannane peut avoir un squelette de Dmannose en (1,4) ou un squelette de Dmannose et de Dglucose, également unis en (1,4). Ils sont alors appelés glucomannanes. Ces deux types de mannanes peuvent être substitués en (1,6) par des résidus de Dgalactose, et on parle alors de galactomannanes ou galactoglucomannanes. Les mannanes sont particulièrement abondants dans les graines et sont supposés être des polysaccharides de réserve (Buckeridge et al., 2000; Hoch, 2007). Il a également été montré que les mannanes peuvent être des sources de signaux développementaux. Par exemple, des fragments de mannanes peuvent influencer la xylogenèse in vitro (BeňováKákošová et al., 2006).
I 2.1.3 La structure des pectines
Les pectines forment un groupe de polysaccharides complexes qui ont comme caractéristique d'être extraits de la paroi par de l'eau chaude, des acides dilués ou des chélateurs de calcium. On considère qu'il existe trois domaines parmi les pectines : L'homogalacturonane (HG), le rhamnogalacturonane I (RGI) et le rhamnogalacturonane II (RGII). On parle de domaines car à ce jour une discussion est ouverte quant à savoir le(s)quel(s) parmi ces trois polysaccharides constitue(nt) le squelette et le(s)quel(s) constitue(nt) les chaînes latérales (Vincken et al., 2003).
I 2.1.3.1 La structure de l'homogalacturonane
L'HG est un polymère linéaire de résidus d'(1,4)Dgalacturonate (GalA; Fig. 3). Les résidus de GalA peuvent être méthylestérifiés en C6 et être Oacétylés en O2 et O3. Deux
Figure 5. Structure proposée pour les arabinanes d'Arabidopsis. Les arabinanes consistent en un squelette de Larabinofuranoses en (1,5), avec des ramifications en (1,2) et/ou (1,3). Les Larabinofuranoses terminaux nonréducteurs (tAraf), en bleu, sont les substrats des arabinofuranosidases. Figure 4. Structure du rhamnogalacturonaneI (RGI). Le RGI est composé d'un squelette de Dgalacturonate et de Lrhamnose. Le rhamnose peut être substitué par des chaînes latérales de galactane, d'arabinane ou d'arabinogalactane. Adapté de Obro et al., 2004. galactane arabinogalactane arabinane Lrhamnose Dgalacturonate Dgalactose Larabinose
chaînes d'homogalacturonane peuvent interagir par des ponts Ca2+. Cette interaction est
contrôlée par le degré de méthylesterification du galacturonate, qui masque les groupes carboxyle qui participent à ces liaisons ioniques (Fig. 3).
I 2.1.3.2 La structure du rhamnogalacturonaneI
Le deuxième domaine des pectines est le RGI (Fig. 4). Le RGI est composé de la répétition d'une unité disaccharide [>2)Lrhamnopyranose(1,4)D galacturonylpyranose(1>]n où n peut être supérieur à 100. Les groupes galacturonyl peuvent être acétylés en O2 ou O3. Les résidus rhamnosyl peuvent être substitués en O4 avec des sucres neutres. Ces substitutions peuvent être des résidus uniques de D galactopyranose en (1,4) mais aussi polymériques tels que l'arabinogalactane ou l'arabinane (50 résidus ou plus). L'arabinogalactane de type I est composé d'un squelette de (1,4)Dgalactopyranose, qui à son tour peut être substitué en O3 par des résidus de L arabinofuranose. L'arabinane est constitué d'un squelette de (1,5)Larabinofuranose qui est parfois substitué en O2 et/ou O3 par d'autres résidus Larabinofuranose. L'abondance et l'identité des chaînes latérales présentes dans le RGI varie considérablement entre espèces (Vincken et al., 2003). Dans le contexte des arabinofuranosidases nous serons amenés à parler en particulier des arabinanes. La structure des arabinanes est connue d'un point de vue global, mais les détails sont encore obscurs. La littérature montre que les arabinanes forment une structure ramifiée (Cardoso et al., 2007; Harholt et al., 2006), mais il n'est pas clair si ces ramifications sont des résidus uniques ou des chaînes secondaires. Un deuxième point qui reste à élucider est le type de liaison des chaînes latérales d'arabinane. Certaines analyses montrent que les chaînes d'arabinane ne contiennent que des liaisons en (1,5) (Harholt et al., 2006; OBro et al., 2004), mais d'autres résultats indiquent la présence de Larabinoses en (1,3) (Cardoso et
al., 2007). D'autre part, il a été montré que les arabinanes de pomme de terre (Solanum tuberosum) peuvent aussi être substitués par des chaînes de galactane (OBro et al., 2004). A
ce jour, une analyse détaillée des arabinanes d'Arabidopsis n'a pas encore été réalisée, mais les résultats disponibles suggèrent qu'ils sont composés de chaînes en (1,5), avec des ramifications en (1,2) et/ou (1,3) (Fig. 5; Harholt et al., 2006). La présence de substitutions galactane reste à démontrer.
Figure 6. Structure du rhamnogalacturonaneII. Le RGII consiste en un squelette d'HG substitué par quatre chaînes latérales complexes, nommées A, B, C et D.
Source: http://www.uea.ac.uk/cap/carbohydrate/projects/RGII.htm, site de S.A. Nepogodiev, Centre for Carbohydrate Chemistry, University of East Anglia (RoyaumeUni).
Figure 7. Pont esterborate entre deux chaînes A du RGII. Noter la position critique de l'apiose dans cette interaction. Source: Cosgrove, 2005. O O O O O O O O O O O O O O O O O O O O O COO COO COO COO OOC OOC OOC OOC O B chaîne latérale chaîne latérale Api Api
I 2.1.3.3 La structure du rhamnogalacturonaneII
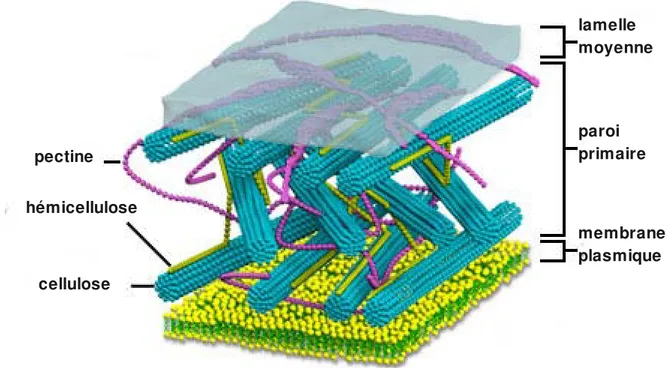
Le troisième domaine des pectines est appelé rhamnogalacturonaneII (RGII). Le RGII comprend approximativement neuf résidus de GalA auxquels sont unies quatre chaînes latérales complexes. (Fig. 6; O'Neill et al., 2004). Ces chaînes latérales contiennent des monosaccharides particuliers, tels que le Dapiose (Api), le Lacerate (AceA), le 2Ométhyl Lfucose, le 2Ométhyl Dxylose, le Lgalactose, l'acide 2keto3deoxyDLYXO heptulosarique (Dha), et le 2keto3deoxyDmannooctulosonate (Kdo). Le nom RGII peut être trompeur car il suggère que ce polysaccharide contient un squelette de rhamnose (Rha), ce qui n'est pas le cas. Dans le RGII, le Rha est peu abondant et forme partie des chaînes latérales. La structure du RGII est très conservée parmi les plantes, même si certaines différences mineures ont parfois été identifiées (O'Neill et al., 2004). La distribution des quatre chaînes dans le squelette d'HG ainsi que la distribution du RGII par rapport à l'HG restent à être déterminées. Une caractéristique importante du RGII est sa capacité à former des dimères à travers une liaison esterborate. Les liaisons esterborate impliquent le Dapiose de la chaîne A (Fig. 7). D'importantes altérations de la paroi, telles une réduction de 50% dans la formation de dimères ou la présence de trous dans la paroi, sont observées en l'absence de borate ou de Dapiose, ce qui souligne l'importance de cette liaison pour la structuration correcte du RGII (O'Neill et al., 2001; Ahn et al., 2006). I 2.1.4 L'organisation de la paroi primaire Les polysaccharides décrits dans les sections précedentes s'organisent et interagissent entre eux pour former la paroi primaire. Le modèle aujourd'hui accepté pour la structure de la paroi primaire veut que les hémicelluloses forment des interactions avec les microfibrilles de cellulose, les pectines constituant un gel occupant le reste de l'espace (Fig. 8; Cosgrove, 2000). La zone de contact entre deux cellules végétales, et donc deux parois primaires, est appelée la lamelle moyenne. Ce modèle a été complété depuis quelques années, car certains résultats suggèrent que d'autres interactions peuvent exister (Cosgrove, 2005). Par exemple, dans des cultures de cellules de rose (Rosa sp. 'Paul's Scarlet') il existe une liaison covalente entre xyloglucane et pectines acides (Thompson et Fry, 2000). De plus, le fait que des hypocotyles de petitpois
Figure 8. Modèle simplifié de la paroi primaire. La cellulose interagit avec les hémicelluloses, les pectines formant une matrice occupant le reste de l'espace. La zone de contact entre deux cellules est appelée lamelle moyenne.
Source: http://micro.magnet.fsu.edu/cells/plants/cellwall.html, site « Molecular Expressions », Michael W. Davidson, Florida State University (Etats Unis d'Amérique). pectine hémicellulose cellulose membrane plasmique paroi primaire lamelle moyenne Figure 9. Structure des xylanes. Les xylanes consistent en un squelette de D xylopyranoses en (1,4), qui peuvent être substitués par du Dgalacturonate en (1,2) (luimême pouvant être Ométhylé en position 4; glucuronoxylane), par des résidus de Larabinose en (1,2) ou (1,3) (arabinoxylanes), ou par les deux (glucuronoarabinoxylanes, GAX). Les Larabinofuranoses, si présents, sont terminaux et donc substrat des arabinofuranosidases.
Dxylopyranose Larabinofuranose Dgalacturonate
(Pisum sativum) incorporent du [14C]Dgalactose dans un complexe pectine
xyloglucane, laisse supposer l'existence d'une liaison covalente entre ces deux types de polysaccharides (Cumming et al., 2005). Finalement, il a été montré que cellulose et pectines peuvent interagir in vitro, même si cette interaction est plus faible que celle observée également in vitro entre cellulose et xyloglucane (Zykwinska et al., 2005). I 2.2 La paroi secondaire I 2.2.1 Composition de la paroi secondaire Les parois secondaires sont composées de cellulose, d'hémicelluloses et d'un polymère aromatique appelé lignine. Les parois secondaires forment le bois et, du fait de l'intérêt économique de ce matériau, elles sont étudiées d'un point de vue différent de celui des parois primaires. En effet, la recherche a le but affiché de modifier la structure et la composition de ces parois pour en modifier les propriétés en vue d'usages industriels (voir pour exemple le début de l'introduction d'Aspeborg et al., 2005 ou la fin de la discussion de Peña et al., 2007). I 2.2.2 La structure des xylanes Contrairement aux parois primaires, les hémicelluloses principales des parois secondaires sont les xylanes. Les xylanes sont composés d'un squelette de résidus de Dxylose unis en (1,4) (appelé xylane), qui peut être substitué par des résidus de Dglucuronate en (1,2) (luimême pouvant être Ométhylé en position 4; glucuronoxylane), par des résidus de L arabinose en (1,2) ou (1,3) (arabinoxylanes), ou par les deux (glucuronoarabinoxylanes, GAX; Fig. 9). Des études récentes suggèrent que les xylanes présents chez Arabidopsis, du moins dans les hampes florales, sont des xylanes ou des glucuronoxylanes, le Larabinose n'ayant pas été détecté (Lise Jouanin, communication personnelle; Peña et al., 2007). I 2.2.3 La composition de la lignine
La lignine, qui est présente exclusivement dans les parois secondaires, est un hétéropolymère complexe dérivé de molécules appelées monolignols. Les principaux
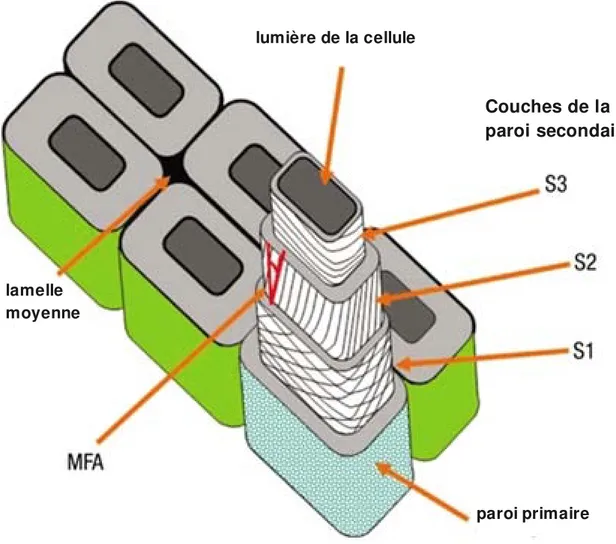
Figure 10. Les couches S1, S2 et S3 de la paroi secondaire. Les microfibrilles de cellulose de ces couches ont une orientation définie et cette orientation (appelée angle des microfibrilles, microfibril angle, MFA) affecte les propriétés du bois. Source: Kretschmann et al., 2003. lamelle moyenne lumière de la cellule Couches de la paroi secondaire paroi primaire
monolignols sont l'alcool pcoumarylique, l'alcool coniférylique et l'alcool synapylique qui, lors de leur incorporation dans le polymère, donnent lieu aux unités phydroxyphényl, guaïacyl et syringyl (appelées respectivement unités H, G et S). La composition des lignines varie entre les espèces végétales et entre les types cellulaires, mais en général la lignine des angiospermes est composée d'unités G et S, avec des traces d'unités H (Boerjan et al., 2003). La mise en place de la lignine est précédée par la mise en place de la cellulose et des hémicelluloses. La synthèse de la lignine commence aux jonctions cellulaires dans la lamelle moyenne et la paroi primaire quand la formation de la couche S1 est en cours, puis se poursuit dans les couches S2 et S3 (voir section suivante). Ainsi, la lamelle moyenne contient aussi de la lignine, mais la relation entre la lignine et les composants de la paroi primaire, en particulier les pectines, reste totalement inconnue (Boerjan et al., 2003). I 2.2.4 L'organisation de la paroi secondaire Il est admis dans la littérature que l'organisation de la paroi secondaire est analogue à celle des parois primaires, avec la cellulose formant des interactions avec les hémicelluloses, la lignine occupant le reste de l'espace. La paroi secondaire est déposée en trois étapes successives formant des couches aux orientations définies, appelées S1, S2 et S3 (Fig. 10). Cette orientation joue un rôle primordial pour définir les propriétés physiques de ces parois (Keckes et al., 2003). I 3 La nature des protéines pariétales Dans la composition des parois primaires ou secondaires on a tendance à ignorer un composant essentiel, les protéines pariétales. Le nombre total de protéines pariétales différentes est estimé chez Arabidopsis entre 1000 et 2000 (Jamet et al., 2006). Elles peuvent être classifiées suivant leurs caractéristiques physicochimiques ou suivant leur fonction. La classification selon leurs propriétés physicochimiques fait référence à leur interaction avec les polysaccharides. Elles sont alors divisées en protéines labiles (qui ne sont pas liées aux polysaccharides), faiblement liées (qui peuvent être extraites par des solutions salines) et fortement liées (qui ne peuvent pas être extraites par des solutions salines; Jamet et al., 2006). Du fait de la difficulté d'extraction des protéines fortement liées, la classification des
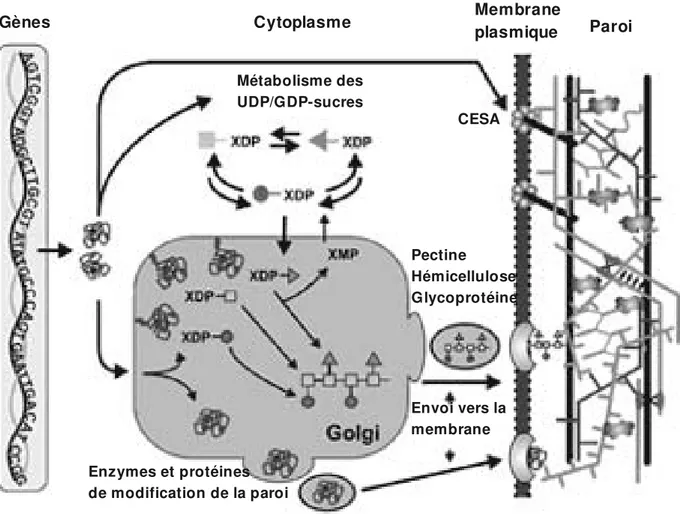
Figure 11. Stratégie globale pour la synthèse des polysacharides pariétaux. Les constituants fondamentaux sont les UDP/GDPsucres (XDP) qui sont incorporés dans les différents polysaccharides par des glycosyltransférases, soit dans la membrane plasmique (cellulose), soit dans l'appareil de Golgi (pectines, hémicelluloses, glycoprotéines). Ces polysaccharides sont alors exportés vers le milieu extracellulaire où ils s'assemblent pour former la paroi végétale. La paroi peut ensuite être modifiée par différentes enzymes et protéines.
Source: http://www.ccrc.uga.edu/~mao/intro/ouline.htm, site « Plant Cell Walls », Complex Carbohydrate Research Center, The University of Georgia (Etats Unis d'Amérique).
Gènes Cytoplasme Membraneplasmique Paroi
Métabolisme des UDP/GDPsucres Envoi vers la membrane CESA Pectine Hémicellulose Glycoprotéine Enzymes et protéines de modification de la paroi
protéines pariétales selon leur fonction n'est disponible que pour les protéines labiles et faiblement liées. Dans cette classification selon leur fonction nous trouvons des protéines qui ont une action envers les polysaccharides (glycosylhydrolases, estérases, expansines), des oxydoréductases, des protéines de signalisation, des protéases, des lectines, des protéines contenant des carbohydrate binding modules ou des protéines de fonction inconnue (Bosch et Hepler, 2005; Sampedro et Cosgrove, 2005; Jamet et al., 2006; Humphrey et al., 2007; Minic et al., 2007; Obembe et al., 2007). I 4 Synthèse et modification des polysaccharides pariétaux Nous avons vu la structure des polysaccharides pariétaux. Intéressons nous maintenant aux enzymes qui participent à leur synthèse et à leur modification. Un schéma global résumant la logique de synthèse de la paroi est présenté Figure 11. La synthèse des polysaccharides pariétaux est réalisée par une diversité d'enzymes. Elle débute par la synthèse des unités fondamentales, les UDP et GDPsucres. Ces unités sont assemblées par des glycosyltransférases (GT) en différents polymères, dans la membrane plasmique pour la cellulose, et dans l'appareil de Golgi pour les hémicelluloses et les pectines. Les polysaccharides sont ensuite exportés vers l'apoplaste, où ils s'organisent pour former la matrice extracellulaire. Les polysaccharides peuvent ensuite être modifiés dans la paroi par différentes enzymes, parmi lesquelles les glycosylhydrolases (GH). Nous verrons dans les sections suivantes que la majeure partie de nos connaissances de ces différents processus résulte de l'utilisation de mutants chez Arabidopsis. I 4.1 Les UDP et GDPsucres
Une vue d'ensemble du métabolisme des UDP/GDPsucres est représentée Figure 12 (Seifert, 2004). Les UDPsucres sont tous synthétisés à partir d'UDPDglucose. Par contre, les GDPsucres proviennent du Dfructose6phosphate. La transformation de ces différentes molécules se fait par des déshydrogénases (aussi appelées déshydratases), des décarboxylases et des épimérases. Les principaux UDPsucres sont l'UDPDglucose, l'UDP Dgalactose, l'UDPDglucuronate, l'UDPDgalacturonate, l'UDPLrhamnose, l'UDPD apiose, l'UDPDxylose et l'UDPLarabinose. Les deux GDPsucres présents dans les parois sont le le GDPLfucose et le le GDPDmannose. Deux autres GDPsucres sont synthétisés
Figure 12. Métabolisme des UDP/GDPsucres. Noter l'interaction entre ce métabolisme et la glycolyse et gluconéogénèse via la phosphomannose isomérase (PMI), phosphoglucose isomérase (PGI), phosphomannomutase (PMM), et phosphoglucomutase (PGM). UGP, UDPDglucose pyrophosphorylase; GMP, GDPDmannose pyrophosphorylase; UAP, UDPD glucuronate pyrophosphorylase; SUS, sucrose synthase; GMD, GDPD mannose4,6déshydrogénase; GAE, UDPDglucuronate 4épimérase; GER, GDP4keto6déoxyDmannose3,5épimérase4réductase; GME, GDPD mannose 3,5épimérase; UGE, UDPDglucose 4épimérase; UGD, UDPD glucose déshydrogénase; RHM, rhamnose synthase; INO, inositol oxygénase; GAK, Dglucuronokinase; UAP, UDPDglucuronate pyrophosphorylase; UXS, UDPDxylose synthase; AXS, UDPDapiose/UDPDxylose synthase; CeS, cellulose synthase; CaS, callose synthase. Une discussion détaillée du rôle de ces enzymes se trouve dans Seifert, 2004.
mais ne participent pas à la synthèse de polysaccharides pariétaux; il s'agit du GDPL galactose et le GDPLgulose. Différents mutants d'Arabidopsis du métabolisme des UDP/GDPsucres ont été décrits. Il s'agit de mur1, mur4 et de la série des mutants uge1 à 5. MUR1 est une GDPDmannose 4,6déshydratase qui participe à la synthèse de GDPLfucose (Bonin et al., 2003). MUR4 est une UDPDxylose 4épimérase, qui catalyse l'épimérisation d'UDPDxylose en UDPL arabinose (Burget et Reiter, 1999; Burget et al., 2003). Les protéines UGE sont des UDPD glucose 4épimérase, qui catalysent l'épimérisation d'UDPDglucose en UDPDgalactose (Barber et al., 2006; Rösti et al., 2007). Les mutants mur4 et uge n'ont pas de phénotype évident. Pourtant, le contenu en Larabinose chez mur4 est réduit de 70%, ce qui suggère que la quantité de Larabinose présente dans les polysaccharides n'est pas essentielle au développement. Dans le cas des mutants uge, le contenu en Dgalactose est légèrement réduit, ce qui laisse penser que des altérations mineures dans le contenu en Dgalactose ne perturbent pas non plus le développement des plantes. Par contre, le mutant mur1 et des combinaisons de mutants uge présentent des phénotypes sévères. Le phénotype du mutant
mur1 est dû au fait que les chaînes latérales A et B sont altérées, la chaîne A étant essentielle
à la formation des dimères de RGII (O'Neill et al., 2001). Dans le cas des différentes combinaisons de mutants uge, le phénotype est corrélé à une réduction importante dans la quantité de Dgalactose des xyloglucanes et des pectines (Rösti et al., 2007). Il devient alors évident que l'impact de la synthèse des UDP/GDPsucres sur la structure de la paroi est variable et dépendant de l'importance du monosaccharide pour la structure du polysaccharide qui le contient ainsi que de l'importance du polysaccharide affecté. Finalement, puisque les UDP/GDPsucres se trouvent en amont des GT, les altérations de ce métabolisme ont aussi des conséquences sur les polysaccharides nonpariétaux, c'estàdire les polysaccharides des glycoprotéines. En effet, le mutant mur1 exhibe une réduction du contenu en Lfucose des Nglycanes des protéines (Rayon et al., 1999) et les mutants mur4 et uge2,4 présentent des altérations dans la partie polysaccharidique des AGP (Burget et Reiter, 1999; Rösti et al., 2007).
I 4.2 La base de données CAZy
Une fois les UDP/GDPsucres synthétisés, ils sont incorporés dans les polysaccharides par des GT. Ces polysaccharides peuvent alors être modifiés par plusieurs activités enzymatiques, dont les GH. Toutes les protéines qui ont une activité envers les polysaccharides, dont les GT et les GH, sont classées dans une base de données appelée Carbohydrate Active enZymes (CAZy). Pour reprendre la définition de CAZy telle qu'exprimée sur son site internet (http://www.cazy.org): "The Carbohydrate Active enZymes (CAZy) database describes the families of structurallyrelated catalytic and carbohydrate binding modules (or functional domains) of enzymes that degrade, modify, or create glycosidic bonds". L'esprit derrière la classification est de regrouper par familles les protéines aux structures tertiaires semblables. La structure tertiaire n'étant disponible que pour une minorité de protéines et, sachant que la structure tertiaire dépend de la structure primaire, la classification en familles se fait donc à partir des séquences protéiques. CAZy distingue cinq grandes classes de protéines: les GH, les GT, les polysaccharidelyases, les carbohydrateesterases et les carbohydrate binding modules (CBMs), classes sousdivisées en familles selon la séquence des protéines correspondantes.
Dans le contexte des arabinofuranosidases nous allons nous intéresser particulièrement à la synthèse et à la modification des pectines et des hémicelluloses par les GT et les GH. Les activités GT comprennent les réactions E.C. 2.4.1. (hexosyltransférases) et E.C. 2.4.2. (pentosyltransférases). Les GH (E.C. 3.2..) sont des enymes qui hydrolysent les liaisons O, S ou N glycosidiques. Les activités GH qui nous intéressent sont les Oglycosidases, qui forment partie de la famille E.C. 3.2.1..
Aujourd'hui, dans la base de données CAZy sont répertoriés 393 et 445 gènes d'Arabidopsis codant des GH et des GT, respectivement, contre 379 GH et 356 GT en 2001 (Henrissat et al., 2001). Ce nombre risque encore d'évoluer car il est possible d'identifier de nouvelles GT non pas par homologie de séquence mais par des méthodes bioinformatiques, par exemple par la recherche de motifs et de structures secondaires définies (Egelund et al., 2004). Il est l'habitude dans la littérature de mentionner la famille CAZy à laquelle une protéine appartient. En effet, puisqu'une famille regroupe des protéines aux séquences similaires, on peut s'attendre, en principe, à trouver dans cette famille des activités enzymatiques semblables ou proches. Pour cette raison, il est aussi souvent implicitement admis que la totalité des 838 gènes GH et GT CAZy participent à la synthèse ou à la
Figure 13. Synthèse de cellulose par les cellulose synthases (CESA). Une CESA est responsable de la synthèse d'une molécule de cellulose. Les CESA s'assemblent en hexamères dans la membrane plasmique et ces hexamères, à leur tour, forment une suprastructure appelée rosette, responsable de la formation des microfibrilles.
Source: Cosgrove, 2005.
CESA hexamère Rosette
modification des polysaccharides. Pourtant, des preuves directes de cette participation ne sont disponibles que pour une vingtaine seulement de ces gènes. Finalement, il est à noter que les protéines qui participent à la synthèse ou à la modification des polysaccharides ne sont pas forcément des protéines CAZy. Par exemple, les enzymes du métabolisme des UDP/GDPsucres, ou les pectineestérases, ne "dégradent, modifient ou créent" pas de liaisons Oglycosidiques et par conséquent n'appartiennent pas à la base de données CAZy.
I 4.3 Synthèse et modification de la cellulose
Une fois les UDP/GDPsucres synthétisés, ils peuvent être incorporés dans les divers polysaccharides. Commençons par le polysaccharide présent dans toutes les parois végétales, la cellulose. La cellulose est extrudée sous forme de microfibrilles par un complexe enzymatique de cellulose synthases (CESA) présentes dans la membrane (Fig. 13). Les CESA sont des Dglucosyltransférases et les 10 gènes CESA identifiés à ce jour appartiennent à la famille 2 des GT (une description détaillée des CESA est disponible dans Somerville, 2006). Les microfibrilles extrudées par le complexe enzymatique sont déposées dans une orientation définie, contrôlée par l'orientation des microtubules (Paredez et al., 2006; Emons et al., 2007). La cellulose étant le polysaccharide qui soutient la structure de la paroi, il n'est pas étonnant de constater que la plupart des mutants CESA (atcesa2, irx1, irx3, irx5, rsw1) présentent un phénotype, tel une croissance réduite ou des vaisseaux de xylème effondrés. Il n'est pas clair si la cellulose est modifiée après sa synthèse. KORRIGAN1, une (1,4) endoglucanase putative (Zuo et al., 2000), semble participer à la modification de la cellulose mais elle ne colocalise pas avec les complexes CESA et son mécanisme d'action reste à déterminer (Szyjanowicz et al., 2004; Cosgrove, 2005). A ce jour, aucune autre enzyme de modification de la cellulose n'a été décrite. I 4.4 La synthèse des pectines et hémicelluloses : les GT Les pectines et les hémicelluloses sont, comme la cellulose, synthétisées par des GT mais, contrairement à cellesci, la synthèse a lieu dans l'appareil de Golgi. Les polysaccharides sont ensuite exportés dans des vésicules vers la paroi (Driouich et al., 1993). Le génome 35
d'Arabidopsis contient un nombre élevé de gènes de GT par rapport au nombre total de gènes, ce qui est probablement dû à la quantité de gènes nécessaires à la synthèse des polysaccharides pariétaux (Coutinho et al., 2003). Les pectines et les hémicelluloses sont des structures complexes, comprenant plusieurs types de monosaccharides et de liaisons (, , 1 >2, 1>3 etc.). Mohnen (1999) propose que, si chaque liaison Oglycosidique des polysaccharides requiert d'une GT spécifique, 53 activités distinctes sont nécessaires rien que pour la synthèse des pectines. Si cette hypothèse est correcte, nous pouvons assumer que, contrairement aux altérations du métabolisme des UDP/GDPsucres, la mutation d'un gène GT affecte un monosaccharide particulier dans un polysaccharide particulier. Pourtant, la compréhension de la biosynthèse des pectines et des hémicelluloses n'est qu'à ses débuts (Bacic, 2006). En effet, à ce jour seule une poignée de GT d'Arabidopsis a été formellement identifiée par des approches de biochimie et de génomique fonctionnelle. Il s'agit de MUR2, une xyloglucan fucosyltransférase (GT hémicellulose famille 37; Vanzin et
al., 2002), MUR3, une xyloglucan galactosyltransférase (GT hémicellulose famille 47;
Madson et al., 2003), quatre cellulose synthaselike, AtCslA9, AtCslC4, AtCslD3 et AtCslE1 (GT hémicellulose famille 2 Liepman et al., 2005), RGXT1 et RGXT2, deux (1,3)xylosyltransférases (GT RGII famille 77; Egelund et al., 2006) et GAUT1, une galacturonosyltransférase (GT pectine famille 8; Sterling et al., 2006). Les mutants mur2 et
mur3 sont altérés dans une liaison particulière du Dgalactose présent dans le xyloglucane.
Bien que le xyloglucane soit l'hémicellulose principale formant des interactions avec la cellulose, mur2 et mur3 n'ont aucun phénotype apparent, l'unique phénotype décelable étant des papilles des trichomes effondrées. Il semblerait que chez mur2 et mur3 il existe une compensation de la structure altérée par une autre structure xyloglucane aux propriétés physicochimiques comparables (Vanzin et al., 2002; Madson et al., 2003). Les mutants des gènes RGXT1 et RGXT2 ont aussi un développement en apparence normal. De plus, aucune altération dans la composition du RGII n'a pu être décelée. Il semblerait qu'il existe un mécanisme de compensation pour l'incorporation du xylose en (1,3) dans le RGII, probablement dû aux gènes At4g01220 et At1g56550, homologues à RGXT1 et RGXT2 (Egelund et al., 2006). La caractérisation de GAUT1 et des Csl n'a pas fait appel à des plantes transformées et donc les polysaccharides synthétisés in vivo par ces enzymes restent inconnus.
à la synthèse des pectines. Il s'agit de QUA1, une putative galacturonosyltransférase de la famille 8 (GT homogalacturonane; Bouton et al., 2002), ARAD1, une arabinosyltransférase putative de la famille 47 (GT arabinane; Harholt et al., 2006) et IRX8 (GT famille 8) et IRX9 (GT famille 43) qui participent à la synthèse des xylanes (Peña et al., 2007). Pour QUA1 et ARAD1, les auteurs sont obligés d'écrire le mot "putative" car l'activité enzymatique de ces GT reste à être démontrée par des approches biochimiques. Les plantes mutantes adultes qua1, affectées dans l'incorporation d'acide galacturonique dans l'HG, présentent un phénotype nain qui est à l'origine de son nom (qua pour quasimodo; Bouton et
al., 2002). Il semblerait dans ce cas que cette GT soit essentielle à la synthèse d'HG et qu'il
n'existe aucun mécanisme de compensation, malgré la présence de 41 autres gènes GT de la famille 8. Les mutants irx8 et irx9 présentent un phénotype sévère et une altération dramatique dans la quantité et de la structure des xylanes, mais l'interprétation des résultats n'est pas linéaire car il semblerait que ces GT participent à la synthèse de la partie terminale réductrice des xylanes, qui, à son tour, pourrait déterminer la structure du polysaccharide. Tout ceci suggère fortement que l'organisation de la paroi secondaire est très sensible à la structure des xylanes (Peña et al., 2007). Finalement, le mutant arad1 ne présente aucun phénotype évident, malgré une réduction d'au moins 60% du contenu en Larabinose des arabinanes pectiques, suggérant, comme pour mur4, que la structure des arabinanes n'est pas essentielle au développement (Harholt et al., 2006).
Nous pouvons aussi citer les gènes dont les mutants ont un phénotype paroi, mais qui n'ont pas fait l'objet d'une caractérisation détaillée. Il s'agit de FRA8 (GT famille 47; Zhong
et al., 2005), IRX7, IRX10 (GT famille 47) et RRA1 et RRA2 (GT famille 77). La
composition des parois n'a été déterminée que pour les mutants rra1 et rra2, où l'on a observé une réduction de 20% dans le contenu en Larabinose, ce qui laisse penser que les gènes mutés sont des arabinosyltransférases (Egelund et al., 2007). Comme pour mur4 et
arad1, rra1 et rra2 n'ont aucun phénotype évident, suggérant encore une fois que la structure
des arabinanes n'est pas essentielle au développement (Egelund et al., 2007). En conclusion, il est clair que l'impact des GT sur la structure de la paroi est variable et dépend de l'importance du monosaccharide et du polysaccharide affecté, ainsi que de la disponibilité de différents mécanismes de compensation.
I 4.5 La modification des pectines et hémicelluloses : les GH
Une fois les pectines et hémicelluloses synthétisées et exportées vers la paroi, elles peuvent subir différentes modifications, dont l'hydrolyse par des GH. Notre connaissance des GH qui modifient la paroi est encore plus limitée que pour les GT. A ce jour uniquement une GH a été formellement identifiée et caractérisée comme participant à l'hydrolyse de polysaccharides pariétaux. Il s'agit de XTH21, une xyloglucan endotransglucosylase/hydrolase de la famille 16, qui participe au remodelage des xyloglucanes (Liu et al., 2007). Le mutant xth21 a une croissance réduite mais la relation entre ce phénotype et la paroi n'est pas claire. Les parois du mutant xth21 contiennent des polysaccharides, en général, et des xyloglucanes, en particulier, de masse moléculaire supérieure à celle des plantes sauvages. Une analyse plus détaillée de ces polysaccharides n'a toutefois pas été entreprise (Liu et al., 2007). Un mutant pour une deuxième XTH, xth27, a été décrit mais aucune caractérisation de la paroi n'a été réalisée (Matsui et al., 2005). Contrairement à xth21, les plantes xth27 n'ont pas d'altérations morphologiques. Néanmoins, les feuilles de ce mutant développent des lésions ponctuelles qui sont attribuées à l'absence de veines tertiaires. Il semble donc que le gène XTH27 soit indispensable à la formation de veines tertiaires dans les feuilles, mais la relation avec la modification des xyloglucanes n'a pas été abordée (Matsui et al., 2005). Une poignée d'autres GH d'Arabidopsis ont été purifiées, caractérisées et identifiées, et les résultats obtenus suggèrent qu'elles participent aussi à l'hydrolyse de polysaccharides pariétaux. Il s'agit XYL1, XYL3 (deux arabinofuranosidases) et XYL4 (une xylosidase), qui sont capables d'hydrolyser des xylanes ou des arabinanes in vitro (Minic et al., 2004; Minic
et al., 2006). Les plantes xyl1 ne présentent aucun phénotype apparent (Lise Jouanin,
communication personnelle), et on ne sait pas si la composition des parois de ce mutant est altérée. Pour xyl3, un mutant pour une arabinofuranosidase spécifique des graines, il a été observé que ces dernières sont plus petites chez le mutant que chez le témoin sauvage. Encore une fois cependant la relation entre ce phénotype et la structure ou la composition de la paroi n'a pas été abordée (Minic et al., 2006). Le mutant xyl4 quant à lui n'a pas encore été caractérisé. Finalement, le rôle d'ARAF1 dans la modification des polysaccharides pariétaux est le sujet de ce travail de thèse. Une fois présentés les mécanismes généraux de synthèse et modification des polysaccharides pariétaux, nous allons nous intéresser de plus près à une catégorie d'activité GH particulière, les Larabinofuranosidases.
O OH OH O H O R O OH OH O H OH + ROH araf αLarabinofuranoR Larabinose (H2O) Figure 14. Réaction catalysée par les Larabinofuranosidases (E.C. 3.2.1.55), à savoir l'hydrolyse des Larabinofuranoses terminaux non réducteurs. R représente le groupe chimique auquel le Larabinofuranose se retrouve uni par la liaison Oglycosydique.
I 5 Les α Larabinofuranosidases
I 5.1 Définition de la réaction Larabinofuranosidase
Les α Larabinofuranosidases (arabinofuranosidases; E.C. 3.2.1.55) sont des GH
capables d'hydrolyser les résidus de α−Larabinofuranose terminaux nonréducteurs (Fig. 14). On trouve des arabinofuranosidases chez les bactéries, les champignons et les plantes. Dans la base de données CAZy, l'activité E.C. 3.2.1.55 se retrouve dans les familles 3, 10, 43, 51, 54 et 62 des GH. I 5.2 Les arabinofuranosidases de microorganismes Les bactéries et les champignons ne possèdent pas de polymères de Larabinose ou de D xylose. Ainsi, les arabinofuranosidases de ces microorganismes semblent avoir pour but l'hydrolyse des parois végétales, en vue de leur utilisation comme source de carbone. Les arabinofuranosidases de bactéries et de champignons sont alors étudiées principalement dans le contexte d'applications industrielles telles que l'utilisation de déchets issus de la production d'éthanol à partir de blé (Sorensen et al., 2007) ou la production de xylobiose à partir de déchets de maïs (Xue et al., 2006). La recherche sur les arabinofuranosidases de microorganismes est aussi centrée sur l'obtention d'enzymes thermorésistantes (Miyazaki, 2005), aux spécificités particulières (par exemple une activité sur une plage plus large de valeurs de pH; Canakci et al., 2007), ou sur l'obtention d'une activité arabinofuranosidase dans des conditions de culture particulières, par exemple lors de la culture de champignons en phase solide (Panagiotou et al., 2006). Les arabinofuranosidases de microorganismes sont aussi étudiées d'un point de vue d'enzymologie pure. Ceci implique, d'une part, que nos connaissances sur le mécanisme de réaction des arabinofuranosidases proviennent de l'étude des enzymes bactériennes et, d'autre part, que ces enzymes sont souvent bien caractérisées et peuvent par conséquent être utilisées pour des tâches précises, comme par exemple confirmer la présence de liaisons en (1,5) entre résidus de Larabinose (Konishi et al., 2006).
Figure 15. Mécanisme de réaction proposé pour les arabinofuranosidases de la famille 51. La réaction consiste en une étape de glycosylation de l'enzyme, suivie par une attaque nucléophile par une molécule d'eau, puis sa déglycosylation. La fonction du deuxième résidu nucléophile est l'activation de l'eau qui réalise l'attaque nucléophile. Cette attaque peut avoir lieu sans nécessité d'activation par une molécule "naturellement" nucléophile telle l'azide (N3).
Source: Shallom et al., 2002.
Figure 16. Cinétique de formation d'un "transglycoside", pNPL arabinofuranosyl(1,2)Larabinofuranoside, par AbfD3, une arabinofuranosidase de Thermobacillus xylanilyticus. Les transglycosides sont à leur tour substrat de l'enzyme, d'où leur disparition progressive.
I 5.2.1 Le mécanisme de réaction des arabinofuranosidases
Le mécanisme de réaction des arabinofuranosidases de la famille 51 a été particulièrement étudié chez les bactéries thermophiles, en particulier Geobacillus
stearothermophilus (Shallom et al., 2002; Hovel et al., 2003) mais aussi Clostridium thermocellum (Taylor et al., 2006), à travers l'obtention des structures tridimensionnelles de
complexes enzymesubstrat. Les arabinofuranosidases sont des GH à double déplacement, appelées retaining enzymes car la configuration du carbone anomérique est conservée durant la réaction. Le mécanisme proposé est montré Figure 15, les deux résidus nucléophiles étant des glutamates.
Le mécanisme de réaction des GH à double déplacement, en général, et des arabinofuranosidases en particulier, permet une réaction où la molécule acceptrice lors de la déglycosylation est un alcool différent de l'eau. Cette réaction est alors appelée transglycosylation. La transglycosylation est particulièrement intéressante car elle permet d'obtenir des Larabinofuranosides, qui sont difficiles à synthétiser par chimie organique (Rémond et al., 2004; Lopez et al., 2007). Il faut toutefois remarquer que, puisqu'il contient toujours un Larabinofuranose terminal nonréducteur, le produit d'une transglycosylation est à son tour substrat de l'enzyme (Fig. 16). Le caractère éphémère des produits de transglycosylation des arabinofuranosidases pose des questions quant à la pertinence in vivo de cette réaction. I 5.3 Les arabinofuranosidases de plantes I 5.3.1 Arabinofuranosidases vraies et bifonctionnelles Bien que la définition de la réaction E.C. 3.2.1.55 soit assez simple, dans la réalité le mot "arabinofuranosidase" chez les plantes (mais aussi chez les autres organismes) doit être pris avec précaution. En effet, avec le séquençage massif des génomes, les gènes ont été annotés "arabinofuranosidase" sans avoir au préalable des preuves biochimiques de l'activité des enzymes qu'ils codent. Or la caractérisation de plusieurs arabinofuranosidases de plantes a révélé que certaines enzymes qui catalysent la réaction E.C. 3.2.1.55 peuvent aussi catalyser la réaction E.C. 3.2.1.37, Dxylopyranosidase (xylosidase), à savoir l'hydrolyse des résidus
Tableau 1. Caractéristiques biochimiques des arabinofuranosidases purifiées de plantes. (suite du Tableau page suivante) (1) pNPA, pnitrophénylLarabinofuranose (2) pNPX, pnitrophénylDxylopyranose (3) l'activité avec pNPX comme substrat n'a pas été déterminée (4) NON, aucune activité détectable avec le substrat correspondant (5) nd, non déterminé (6) AX, arabinoxylane (7) SBA, sugar beet arabinan
Nom Ara 1 AXAHI ARA1 XYL ARAF1 XYL1
Plante Orge Orge Orge Orge Arabidopsis Arabidopsis
Référence Ferre 2000 Lee 2001 Lee 2003 Lee 2003 Minic 2004 Minic 2004
Tissu d'origine plantules 5j plantules 5j hampe florale hampe florale
6300 (pNPA) 6610 (pNPA) 6060 (pNPA) 169 (pNPX)
Famille CAZy nd 51 3 3 51 3
Activité vraie araf bifonctionnelle vraie xyl bifonctionnelle bifonctionnelle
kcat/Km pNPA 14,1 19500 7020 310 kcat/Km pNPX 3570 9100 1810 1130 Km pNPA (mM) 0,50 0,77 6,50 24,80 kcat pNPA (s1) 7,10 15,00 45,60 7,70 Km pNPX (mM) 0,8 1,7 0,48 1,2 kcat pNPX 3,6 15,5 0,87 1,35 %pNPA / %pNPX 100 / 20 3 / 100 100 / 15 100 / 29
hydrolyse oligoLara? OUI OUI NON OUI
hydrolyse oligoDxyl? OUI OUI OUI OUI
OUI (ara) OUI (ara) OUI (ara+xyl) OUI (xyl) OUI (ara+xyl) OUI (ara+xyl)
NON OUI OUI OUI
graines germées plantules étiolées 7j Activité spécifique en nmol.min1.mg1 (substrat utilisé) 4184 (pNPA1) 97 (pNPX2) vraie araf?3 nd5 nd5 NON4 nd5 nd5 (>8) nd5 nd5 nd5 nd5 nd5 nd5 nd5 nd5 nd5 nd5 nd5 hydrolyse AX6? (produits libérés) hydrolyse SBA7? nd5 nd5