Épidémiologie des fractures en insuffisance rénale
chronique: Analyse de la cohorte CARTaGENE
Mémoire
Louis-Charles Desbiens
Maîtrise en épidémiologie - avec mémoire
Maître ès sciences (M. Sc.)
Résumé
L’insuffisance rénale chronique (IRC) cause des anomalies biochimiques, osseuses et vasculaires. L’association entre IRC et fractures reste controversée, alors que les travaux antérieurs ont été restreints à l’étude de certains sites fracturaires et aux patients âgés. En outre, la performance de modalités d’imagerie ou scores de prédiction pour prédire les fractures en IRC fut peu étudiée. Les objectifs de ce mémoire sont donc d’évaluer l’impact de l’IRC légère à modérée sur : 1) la prévalence du statut fracturaire ; 2) l’incidence des fractures selon l’âge et le sexe; 3) la prédiction des fractures par l’échographie calcanéale (QUS); et 4) la performance de scores de prédiction clinique (FRAX, Garvan, QFracture).
Nous avons analysé la cohorte CARTaGENE, incluant 19 990 Québécois âgés entre 40 et 69 ans. La fonction rénale fut estimée au recrutement. Les fractures furent identifiées de façon prévalente (autorapportées par questionnaire) et incidente (données médico-administratives). Nous n’avons pas observé d’association entre l’IRC et la prévalence du statut fracturaire après ajustement. Nous avons toutefois observé que l’IRC légère à modérée est associée à une augmentation de l’incidence des fractures à tous sites durant un suivi médian de 70 mois, particulièrement chez les jeunes et les hommes. Nous avons constaté que le QUS discrimine les fractures similairement en IRC et non-IRC, mais les sous-estime en IRC stade 3. Enfin, nous avons observé que la discrimination et la calibration des fractures par FRAX et QFracture étaient similaires en non-IRC et IRC, mais que le score Garvan menait à une discrimination plus faible et une sous-estimation en IRC stade 3. Ces travaux suggèrent un impact de l’IRC sur l’incidence fracturaire et la performance des outils prédictifs. Ils sensibilisent donc les cliniciens à l’impact fracturaire précoce de l’IRC et aux limites de certains outils prédictifs dans cette population.
Abstract
Chronic Kidney Disease (CKD) causes biochemical, bone and vascular abnormalities. The association of non-terminal CKD with fracture remains controversial as previous studies focused on select fracture sites and were restricted to older patients. Furthermore, the fracture predictive performance of imaging methods and prediction tools has not been thoroughly studied. Thus, our objectives were to assess the impact of non-terminal CKD on : 1) fracture status prevalence; 2) fracture incidence by age and sex; 3) the performance of calcaneal quantitative ultrasonography (QUS) to predict fracture risk and; 4) the performance of three fracture prediction tools (FRAX, Garvan, QFracture).
We analyzed the CARTaGENE cohort, which includes 19,990 participants aged 40 to 69 years from the province of Quebec, Canada. Renal function was estimated at baseline. Fractures were assessed at baseline (self-reported by health questionnaire) and during a follow-up of 70 months (medico-administrative data). We did not observe an association between non-terminal CKD and prevalent fracture status after adjustment for potential confounders. In contrast, we found that non-terminal CKD was associated with increased fracture incidence at any site, especially in younger patients and in men. Additionally, we observed that non-terminal CKD did not modify significantly the discriminative ability of QUS for fracture incidence but did lead to an underestimation of fracture incidence in patients with CKD stage 3. Finally, we found that FRAX and QFracture had similar discrimination and calibration for fractures in patients with and without non-terminal CKD while Garvan had lower discrimination and led to fracture underestimation in CKD stage 3. These findings suggest that non-terminal CKD is associated with increased fracture incidence and decreased performance of some fracture prediction tools. They therefore highlight the early effect of CKD on fracture risk and the limitations of some fracture prediction tools in this population.
Table des matières
Résumé... ii
Abstract ... iii
Table des matières ... iv
Liste des figures, tableaux, illustrations ... vii
Liste des figures ... vii
Liste des tableaux ... viii
Liste des abréviations, sigles, acronymes ... ix
Remerciements ... xii
Avant-propos ... xiii
Introduction... 1
L’insuffisance rénale chronique ... 1
L’ostéoporose et les fractures ostéoporotiques ... 7
Le trouble minéral et osseux de l’insuffisance rénale chronique ... 21
Les fractures en insuffisance rénale chronique ... 35
Problématique et objectifs ... 45
Méthodologie générale ... 46
Chapitre 1. Fracture status in middle-aged individuals with early CKD: cross-sectional analysis of the CARTaGENE survey ... 48
1.1 Résumé ... 49
1.2 Abstract ... 50
1.3 Introduction ... 51
1.4 Material and methods ... 51
1.5 Results ... 53
1.6 Discussion ... 57
1.7 Compliance with ethical standards ... 60
1.8 References ... 60
Chapitre 2. Incidence of fractures in middle-aged individuals with early CKD: A population-based analysis of CARTaGENE ... 63
2.1 Résumé ... 64
2.2 Abstract ... 65
2.3 Introduction ... 66
2.4 Material and methods ... 66
2.5 Results ... 68
2.6 Discussion ... 74
2.7 Supplementary material ... 76
2.9 Conflict of interest statement ... 76
2.10 Authors’ contributions ... 76
2.11 Funding ... 76
2.12 References ... 77
Chapitre 3. Predictive value of quantitative ultrasound parameters in individuals with chronic kidney disease: A population-based analysis of CARTaGENE... 79
3.1 Résumé ... 80
3.2 Abstract ... 81
3.3 Introduction ... 82
3.4 Material and methods ... 82
3.5 Results ... 84 3.6 Discussion ... 90 3.7 Acknowledgments ... 93 3.8 Declaration of interest ... 93 3.9 Authors’ contribution ... 93 3.10 Funding ... 93 3.11 References ... 93
Chapitre 4. Comparison of fracture prediction tools in individuals without and with early chronic kidney disease: A population-based analysis of CARTaGENE ... 97
4.1 Résumé ... 98
4.2 Abstract ... 99
4.3 Introduction ... 100
4.4 Material and methods ... 101
4.5 Results ... 104
4.6 Discussion ... 109
4.7 Acknowledgments ... 113
4.8 References ... 114
Chapitre 5. Complément de discussion ... 116
Conclusion ... 128
Bibliographie ... 129
Annexe A. FGF23-klotho axis, bone fractures, and arterial stiffness in dialysis: a case-control study 161 Abstract ... 161
Introduction ... 163
Materials and methods ... 163
Results ... 165
Annexe B. Does alfacalcidol reduce cardiovascular complications in hemodialysis patients? ... 177
Acknowledgements ... 180
References ... 181
Annexe C. Matériel supplémentaire du chapitre 2 ... 183
Méthodes supplémentaires ... 183
Figures et tableaux supplémentaires ... 183
Annexe D. Matériel supplémentaire du chapitre 3 ... 185
Méthodes supplémentaires ... 185
Figures et tableaux supplémentaires ... 185
Annexe E. Matériel supplémentaire du chapitre 4 ... 189
Méthodes supplémentaires ... 189
Liste des figures, tableaux, illustrations
Liste des figures
Introduction
Figure 1. Anatomie du rein 1
Figure 2. Classification de l’insuffisance rénale chronique 3
Figure 3. Anatomie de l’os 7
Figure 4. Biologie cellulaire osseuse 9
Figure 5. Mécanisme d’action des inhibiteurs de la voie Wnt//-Catenin 10 Figure 6. Incidence des fractures ostéoporotiques par âge, sexe et site anatomique au Québec 12 Figure 7. Intégration pathophysiologique de FGF23 et α-Klotho dans le développement des anomalies
biochimiques de l’IRC 27
Chapitre 1. Fracture status in middle-aged individuals with early CKD: cross-sectional analysis of the CARTaGENE survey
Figure 8. Study flowchart 53
Figure 9. Prevalence of fracture status by CKD stage after stratification for age 55 Figure 10. Associations between CKD stage, eGFR, and fracture status 55 Figure 11. Associations between QUS parameters and fracture status in CKD subgroups 56 Chapitre 2. Incidence of fractures in middle-aged individuals with early CKD: A
population-based analysis of CARTaGENE
Figure 12. Association between eGFR levels and fracture incidence 71
Figure 13. Age- and sex-stratified fracture incidence rates by CKD stage 72 Figure 14. Association between eGFR and fracture incidence by age and sex 72 Figure 15. Probabilities of fracture associated with CKD and traditional risk factors by age and sex 73 Chapitre 3. Predictive value of quantitative ultrasound parameters in individuals with chronic
kidney disease: A population-based analysis of CARTaGENE
Figure 16. Study flow diagram 85
Figure 17. Association between eGFR levels and calcaneal QUS parameters 87
Figure 18. Association of QUS parameters with fractures by eGFR 88
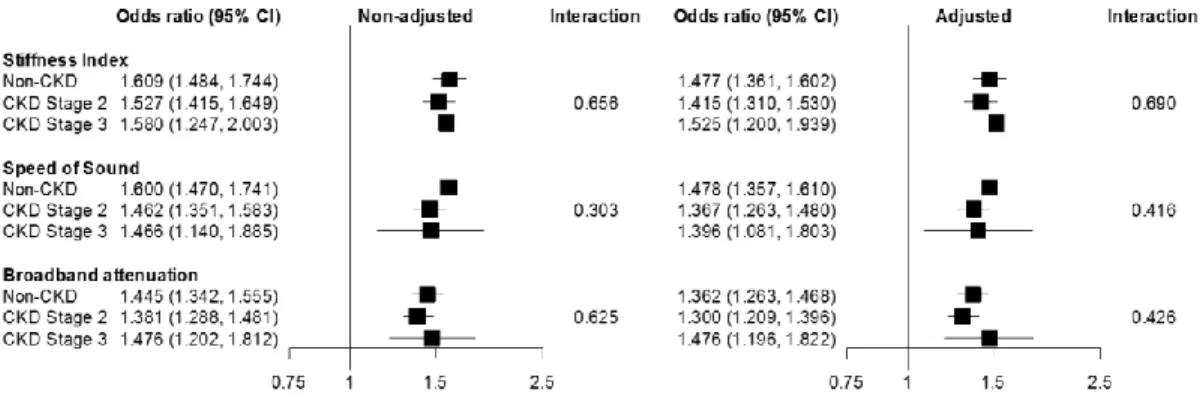
Figure 19. QUS stiffness index and 7-year fracture risk by CKD stage 90 Chapitre 4. Comparison of fracture prediction tools in individuals without and with early
chronic kidney disease: A population-based analysis of CARTaGENE
Figure 20. Study flow diagram 104
Figure 21. Association of prediction tools with fracture risk by eGFR levels 106 Figure 22. Observed and predicted 5-year fracture risk by CKD stage 107 Figure 23. Calibration curves of prediction tools by CKD stage before and after recalibration 108 Figure 24. Calibration of prediction tools by eGFR levels after stratification for age or sex 109
Liste des tableaux
Introduction
Tableau 1. Causes d’insuffisance rénale 4
Tableau 2. Causes d’ostéoporose secondaire 11
Tableau 3. Facteurs de risque de fractures ostéoporotiques 14
Tableau 4. Comparaison des modèles de prédiction de fractures 18
Tableau 5. Impact clinique des anomalies phosphocalciques en IRC 23
Tableau 6. Catégorisation des anomalies osseuses du TMO-IRC 23
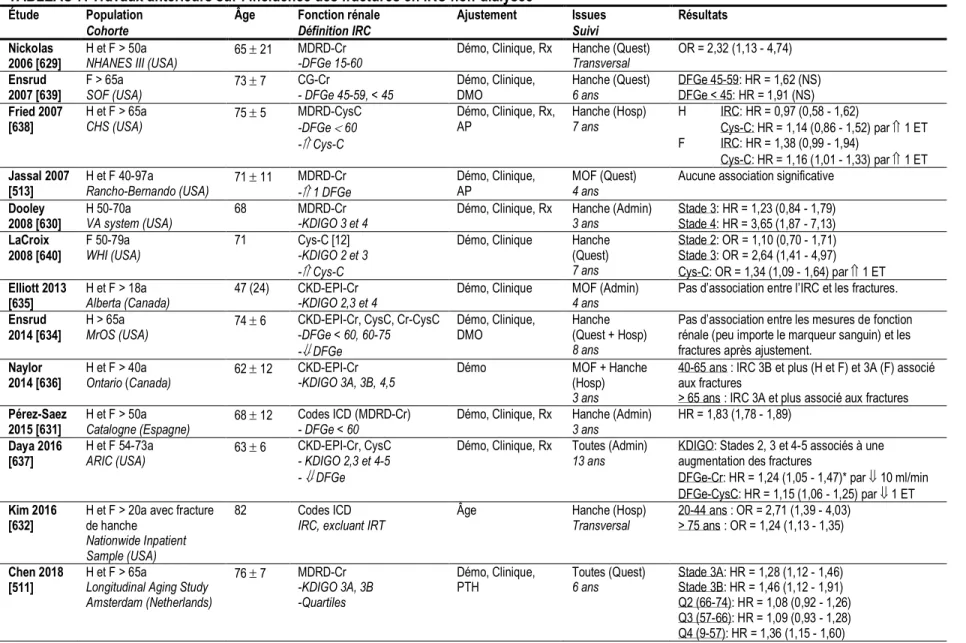
Tableau 7. Travaux antérieurs sur l’incidence des fractures en IRC non-dialysée 37 Tableau 8. Facteurs de risque de fracture en insuffisance rénale chronique 40 Chapitre 1. Fracture status in middle-aged individuals with early CKD: cross-sectional analysis of the CARTaGENE survey
Table 9. Population characteristics 54
Table 10. Factors associated with fracture status in CKD and non-CKD individuals 57 Chapitre 2. Incidence of fractures in middle-aged individuals with early CKD: A
population-based analysis of CARTaGENE
Table 11. Population characteristics 69
Table 12. Association between early CKD and fracture incidence in unadjusted and adjusted models 70 Table 13. Association between early CKD and fracture incidence by age and sex 71 Chapitre 3. Predictive value of quantitative ultrasound parameters in individuals with chronic
kidney disease: A population-based analysis of CARTaGENE
Table 14. Population characteristics 85
Table 15. QUS stiffness index and fractures by CKD stage 86
Table 16. Association between QUS stiffness index and fractures by CKD stage with adjustment 89 Chapitre 4. Comparison of fracture prediction tools in individuals without and with early
chronic kidney disease: A population-based analysis of CARTaGENE
Table 17. Population characteristics 105
Table 18. Discrimination of prediction tools by CKD stage 106
Table 19. Calibration of prediction tools for 5-years fractures before and after recalibration by CKD
Liste des abréviations, sigles, acronymes
1,25-(OH)2-D 1,25-dihydroxycholecalciferol 25-OH-D 25-hydroxycholecalciferol
ACE Angiotensin-converting enzyme (Enzyme de conversion de l’angiotensine) ARA Antagonistes du récepteur de l’angiotensine II
ARIC Atherosclerosis Risk in Communities AUC Area under the curve (Aire sous la courbe) BMI Body mass index (BMI)
BMD Bone mineral density (BMD)
BPS Bisphosphonate
BTM Bone turnover markers (Marqueurs du remodelage osseux) BUA Broadband ultrasound attenuation
Ca Calcium
CAG CARTaGENE
CaMOS Canadian Multicentre Osteoporosis Study CaSR Calcium sensing receptor
CG Cockcroft-Gault
CKD Chronic Kidney Disease (IRC)
CKD-EPI Chronic Kidney Disease Epidemiology Collaboration
CKD-MBD Chronic kidney disease–mineral and bone disorder (TMO-IRC)
Cr Créatinine
CRF Clinical risk factors (Facteurs de risque cliniques) CTX C-terminal telopeptide
CysC Cystatine C
DALY Disability-adjusted life-years (Espérance de vie corrigée de l’incapacité) DFG Débit de filtration glomérulaire
DFGe Débit de filtration glomérulaire estimé DKK Dicckopf-related-protein
DMO Densité minérale osseuse
DXA Absorptiométrie biphotonique à rayons X ECR Essai clinique randomisé
eGFR Estimated glomerular filtration rate (DFGe)
ERA-EDTA European Renal Association–European Dialysis and Transplant Association ESRD End-stage renal disease (IRT)
ET Écart type
FGF23 Fibroblast Growth Factor 23 FPPS Farnesyl pyrophosphate synthetase FRAX Fracture Risk Assessment Tool GnRH Gonadotropin Releasing Hormone GR Gradient Risk (Gradient de risque) HIF Hypoxia-inductible-factors
HLA Human Leukocyte Antigen
HR Hazard ratio (Ratio de risque instantané)
HRpQCT High-resolution peripheral quantitative computed tomography
HRT Hormone replacement therapy (Thérapie de remplacement hormonal) HyperPTH Hyperparathyroïdie
ICD International classification of diseases
INSPQ Institut National de Santé Publique du Québec IRC Insuffisance rénale chronique
IRR Incidence rate ratio (Ratio de taux d’incidence) IRT Insuffisance rénale terminale
ISCD International Society for Clinical Densitometry
ISRN Inhibiteurs sélectifs de la recapture de la noradrénaline ISRS Inhibiteurs sélectifs de la recapture de la sérotonine KDIGO Kidney Disease Improving Global Outcomes LRP Low-density Lipoprotein Receptor-related Protein MDRD Modification of Diet in Renal Disease
MET Metabolic equivalent (Équivalent métabolique)
MOF Major osteoporotic fractures (Fractures ostéoporotiques majeures) MrOS Osteoporotic Fractures in Men Study
Na-Pi Cotransporteurs sodium-phosphate
NCC Transporteur Na-2Cl
NHANES National Health and Nutrition Examination Survey NKCC Transporteur Na-K-2Cl
NS Non significatif
OMS Organisation Mondiale de la Santé
OPG Ostéoprotégérine
OR Odds ratio (Ratio de cotes)
P1NP Propeptide N-terminal du procollagène de type 1
PA Phosphatase alcaline
PO4 Phosphate
PTH Parathormone
PTX Parathyroïdectomie
QUS Quantitative ultrasound (Ultrasonométrie quantitative) RAMQ Régie de l’assurance maladie du Québec
RANKL Receptor Activator of Nuclear Factor-B SD Standard deviation (Écart-type)
SFRP Secreted Frizzled-Related Protein
SGLT2i Inhibiteurs du cotransporteur sodium/glucose 2 SHBG Sex hormone binding globulin
SI Stiffness index
SIR Standardized incidence ratio (Ratio d’incidence standardisé) SOF Study of Osteoporotic Fractures
SOS Speed of sound
SOST Sclérostine
TBS Trabecular Bone Score
TDM Tomodensitométrie
TMO-IRC Trouble minéral et osseux de l’insuffisance rénale chronique TRAP5b Tartrate-resistant acid phosphatase 5b
TRPV5 Transient receptor potential calcium channel 5 TRPV6 Transient receptor potential calcium channel 6 VA Veterans affairs
VC Vascular calcification (Calcification vasculaire)
VDRA Vitamin D receptor agonists (Agonistes du récepteur de la vitamine D) VIH Virus de l’immunodéficience humaine
« Tout ce qui mérite d’être fait mérite d’être
bien fait »
Remerciements
Le 15 décembre 2015, alors que je rencontrais le Dr Mac-Way pour la première fois, je n’anticipais certainement pas les défis, les interrogations et les doutes qui parsèmeraient ce long parcours qu’est la poursuite d’études graduées en parallèle au doctorat en médecine. Néanmoins, à cette date, je n’aurais jamais pu croire que je serais entouré d’une équipe qui allait faire de la maitrise une expérience inestimable et inoubliable. Les prochaines lignes seront ainsi bien courtes pour exprimer toute la gratitude que je ressens à leur égard.
Évidemment, l’ensemble de ce parcours n’aurait jamais été possible sans l’aide et le soutien incommensurable du Dr Fabrice Mac-Way, mon directeur de recherche. Dès le tout début de notre relation, il a su offrir le parfait équilibre entre autonomie et supervision qui m’a permis de développer maintes aptitudes et expériences. Il a toujours eu un défi ou un projet nouveau à m’offrir pour satisfaire ma soif d’aller plus loin. Il m’a transmis sans conteste sa passion débordante et a allumé en moi la flamme de la découverte et de la recherche. Je lui serai longtemps reconnaissant pour les années enrichissantes et stimulantes passées au sein de son équipe.
En parallèle, cette aventure qu’est la maitrise n’aurait jamais été la même sans l’aide précieuse d’Aboubacar, de Catherine et de Visal. Ils furent présents tout au long de mon parcours et surent prodiguer conseils, encouragements et surtout, des réponses à mes nombreuses questions. Que ce soit par des conseils statistiques, de l’aide dans la gestion des bases de données ou bien l’apprentissage des techniques de laboratoire, une part de ce mémoire leur revient. Par ailleurs, je ne pourrais écrire ces lignes sans remercier Jane, Olivier et Stéphanie, collègues avec qui je partageai mon quotidien au centre de recherche. Nos nombreuses discussions égayèrent les journées parfois longues passées devant l’ordinateur ou les nombreux midis passés dans la « salle à diner ». Vous avez permis de rendre ces moments des plus agréables et mémorables.
Ces remerciements ne seraient pas complets sans souligner l’aide et le soutien inestimables de mes parents, famille et amis dans l’accomplissement de ce mémoire. Merci d’avoir cru en cette idée que fut la maitrise et de m’avoir soutenu à travers ce choix que fut l’année sabbatique. Plus particulièrement, merci à Cédric, mon copain, d’avoir été à mes côtés à travers l’ensemble de mon parcours aux études graduées. Merci d’avoir « enduré » mon intérêt constant à discuter des résultats de mes travaux, mon excitation suite à l’achèvement d’une analyse statistique complexe ou ma joie débordante après l’acceptation d’un article scientifique. Merci aussi d’avoir également su me soutenir lors des nombreuses déceptions, questionnements, et remises en question qui emplirent également ces années passées à la maitrise. Ces années n’auraient jamais été les mêmes sans toi. Enfin, je souhaite remercier les nombreux organismes subventionnaires qui rendirent cette expérience possible sur le plan financier. Votre soutien fut inestimable dans la réalisation de cette grande aventure que fut la maitrise.
Avant-propos
L’objectif de ce mémoire est d’étudier l’épidémiologie des fractures chez les individus atteints d’insuffisance rénale chronique (IRC) légère à modérée dans la cohorte populationnelle CARTaGENE (CAG). Il se divise en quatre volets, chacun représentant un article dont je suis le premier auteur.
Le premier volet (Chapitre 1) consiste en une étude transversale de la prévalence du statut fracturaire en IRC légère à modérée et de son association avec les paramètres d’échographie calcanéale et de facteurs de risque cliniques dans la cohorte CARTaGENE. Ces résultats ont été publiés dans Osteoporosis International en avril 2019 sous le titre Fracture status in middle-aged individuals with early CKD: cross-sectional analysis of the CARTaGENE survey. Les trois autres volets de ce mémoire consistent en des études prospectives de CARTaGENE utilisant les données médico-administratives de la Régie de l’Assurance Maladie du Québec (RAMQ) pour identifier l’incidence des fractures. Dans le Chapitre 2, nous avons étudié l’association de l’IRC légère à modérée avec l’incidence des fractures en fonction de l’âge et du sexe. Ces résultats ont été publiés en janvier 2020 dans la revue Nephrology, Dialysis, Transplantation sous le titre Incidence of fractures in middle-aged individuals with early chronic kidney disease: a population-based analysis of CARTaGENE. Dans le Chapitre 3, nous avons plutôt étudié l’utilisation de l’échographie calcanéale pour la prédiction des fractures chez les individus atteints ou non d’IRC dans CARTaGENE. Ces résultats ont été publiés en novembre 2019 dans la revue Bone sous le titre Predictive value of quantitative ultrasound parameters in individuals with chronic kidney disease: A population-based analysis of CARTaGENE. Enfin, dans le Chapitre 4, nous avons comparé l’utilisation de scores de prédiction clinique des fractures chez des individus recrutés dans CAG avec et sans IRC. Ces résultats ont été publiés en février 2020 dans la revue Journal of Bone and Mineral Research sous le titre Comparison of fracture prediction tools in individuals without and with early chronic kidney disease: A population-based analysis of CARTaGENE.
En parallèle à ces travaux, j’ai pu œuvrer sur divers autres projets reliés de près ou de loin aux fractures en IRC légère à modérée. Tout d’abord, j’ai complété un projet préalablement débuté lors d’un stage de recherche portant sur la relation entre des marqueurs de la voie de signalisation Wnt/-Catenin, l’incidence de fractures et la rigidité artérielle chez des patients en hémodialyse. Ces résultats furent publiés dans Osteoporosis International en octobre 2018 (Annexe 1) sous le titre FGF23-klotho axis, bone fractures, and arterial stiffness in dialysis: a case-control study. Sous la supervision du Dr Mac-Way, j’ai également rédigé un éditorial invité portant sur un essai clinique étudiant l’utilisation de l’alfacalcidiol en hémodialyse. Cet éditorial (Annexe 2) a été publié en avril 2019 dans Annals of Translational Medicine sous le titre Does alfacalcidol reduce cardiovascular complications in hemodialysis patients? Enfin, j’ai mené une revue systématique et méta-analyse étudiant l’effet
sont en préparation pour soumission dans le Journal of the American Medical Association. La liste complète des publications sur lesquelles j’ai travaillé au cours de la maitrise est présentée ci-dessous :
Manuscrits publiés à titre de premier auteur :
Desbiens LC, Sidibe A, Beaudoin C, Jean S, Mac-Way F. Comparison of fracture prediction tools in individuals without and with early chronic kidney disease: A population-based analysis of CARTaGENE. Journal of Bone and Mineral Research. 2020 Jun;35(6):1048-1057.
Contribution : Conception du devis d’étude, analyses statistiques, interprétation des résultats, rédaction et révision du manuscript.
Desbiens LC, Goupil R, Madore F, Mac-Way F. Incidence of fractures in middle-aged individuals with early chronic kidney disease: a population-based analysis of CARTaGENE. Nephrology, Dialysis, Transplantation. 2020 Jan 17: gfz259.
Contribution : Conception du devis d’étude, analyses statistiques, interprétation des résultats, rédaction et révision du manuscript.
Desbiens LC, Goupil R, Mac-Way F. Predictive value of quantitative ultrasound parameters in individuals with chronic kidney disease: A population-based analysis of CARTaGENE. Bone. 2020 Jan;130:115120.
Contribution : Conception du devis d’étude, analyses statistiques, interprétation des résultats, rédaction et révision du manuscript.
Desbiens LC, Mac-Way F. Does alfacalcidol reduce cardiovascular complications in hemodialysis patients? Ann Transl Med 2019;7(8):167.
Contribution : Revue de la littérature, analyse critique, rédaction et révision du manuscrit.
Desbiens LC, Goupil R, Sidibe A, Madore F, Mac-Way F. Fracture status in middle-aged individuals with early CKD: cross-sectional analysis of the CARTaGENE survey. Osteoporos Int. 2019; 30: 787. Contribution : Conception du devis d’étude, analyses statistiques, interprétation des résultats, rédaction et révision du manuscript.
Desbiens LC, Sidibé A, Ung RV, Fortier C, Munger M, Wang YP, Bisson SK, Marquis K, Agharazii M, Mac-Way F. FGF23-klotho axis, bone fractures, and arterial stiffness in dialysis: a case-control study. Osteoporos Int. 2018; 29: 2345.
Contribution : Conception du devis d’étude, collecte des données cliniques, mesure des marqueurs en laboratoire, analyses statistiques, interprétation des résultats, rédaction et révision du manuscrit. Manuscrits publiés à titre de co-auteur :
Wang YP, Sidibe A, Roussy LO, Desbiens LC, Gilbert A, Mac-Way F. Type of Subtotal Parathyroidectomy and Evolution of Parathyroid Hormone Levels in End-Stage Renal Disease Patients. International Urology and Nephrology. 2020 Jul 28. doi: 10.1007/s11255-020-02574-z
Contribution: Interprétation des résultats, révision du manuscrit.
Lavigne F, Desbiens LC, Garneau G, Coté F, Mac-Way F. Iliac crest bone biopsy by interventional radiologists to improve access to bone biopsy in chronic kidney disease populations: Technical note and a case series. Journal of Nephrology. 2020 Jul 12. doi: 10.1007/s40620-020-00798-x
Fortier C, Côté G, Mac-Way F, Goupil R, Desbiens LC, Desjardins MP, Marquis K, Hametner B, Wassertheurer S, Schultz MG, Sharman JE, Agharazii M. Prognostic Value of Carotid and Radial Artery Reservoir-Wave Parameters in End-Stage Renal Disease. J Am Heart Assoc. 2019 Jul 2; 8 (13) Contribution : Analyses statistiques, révision du manuscrit.
Sidibe A, Auguste D, Desbiens LC, Fortier C, Wang YP, Jean S, Moore L, Mac-Way F. Fracture Risk in Dialysis and Kidney Transplanted Patients: A Systematic Review. JBMR Plus (2019) 3: 45.
Introduction
L’insuffisance rénale chronique
Anatomie et physiologie du rein
Les reins sont des organes rétropéritonéaux situés de chaque côté de la colonne vertébrale, entre la 12e vertèbre thoracique et la 3e vertèbre lombaire. Le parenchyme rénal se sépare en cortex (région externe) et
en médulla (région interne). Le rein est vascularisé par l’artère rénale, qui prend naissance dans l’aorte abdominale. Celle-ci se divise à multiples reprises avant de donner naissance à l’artériole afférente qui alimente les capillaires glomérulaires. Ces capillaires se déversent dans les artérioles efférentes qui accompagneront les tubules rénaux sous forme de capillaires péritubulaires et de vasa recta avant de reformer un réseau de veinules menant à la veine rénale. [1]
Figure 1. Anatomie du rein
Reprinted from National Kidney Foundation Primer on Kidney Diseases, Seventh edition, Scott G and Weiner D, Chapter 1. Overview of Kidney Structure and Function, pages 2-18, Copyright (2018), with permission from Elsevier.
L’unité fonctionnelle du rein est le néphron. Le sang y est d’abord filtré au glomérule par une membrane électriquement chargée laissant uniquement passer le plasma et les petites molécules, puis est recueilli dans la capsule de Bowman. Le filtrat généré circule dans le tubule proximal qui en réabsorbe plus de 50 % du contenu. L’anse de Henlé permet ensuite la concentration des urines en réabsorbant passivement l’eau dans son segment descendant et en réabsorbant activement le sodium dans son segment ascendant avec le transporteur Na-K-2Cl (NKCC). Puis, le tubule distal assure la dilution du filtrat ainsi concentré avec le co-transporteur Na-2Cl (NCC). Enfin, le tubule collecteur ajuste finement la natriurèse et l’osmolalité urinaire en réponse aux concentrations sanguines d’aldostérone et de vasopressine. En plus de son rôle de régulation des fluides et électrolytes, le rein accomplit une fonction endocrine. En effet, les cellules tubulaires rénales proximales, distales et collectrices expriment la 1--hydroxylase, l’enzyme responsable de l’hydroxylation de la 25-hydroxycholecalciferol (25-OH-D) en 1,25-dihydroxycholecalciferol (1,25-(OH)2-D), la forme active de la
vitamine D. [2] Le rein est également responsable de la sécrétion d’érythropoïétine, hormone centrale à la production d’érythrocytes dans la moelle osseuse. Les fibroblastes péritubulaires rénaux produisent cette hormone en réponse aux hypoxia-inductible-factors (HIF) qui sont stabilisés par la présence d’hypoxie. [1]
Classification et définition de l’insuffisance rénale chronique
Mesure de la fonction rénale
Plusieurs méthodes de mesure et d’estimation de la fonction rénale ont été développées. Ces méthodes mesurent généralement le débit de filtration glomérulaire (DFG), soit le volume filtré dans une minute par les reins. [3] Le DFG varie considérablement entre chaque individu selon l’âge, le sexe, le poids, les habitudes de vie, la diète et la médication. [4] Bien que le véritable DFG d’un individu ne puisse être exactement déterminé, des méthodes permettent de s’en approcher le plus possible. Elles sont classiquement divisées en deux classes. La première permet d’obtenir un DFG mesuré en déterminant la clairance d’un marqueur qui est filtré au glomérule sans être réabsorbé ou sécrété au niveau tubulaire. Cette clairance est obtenue en divisant le produit du flot urinaire et de la concentration urinaire du marqueur par la concentration plasmatique moyenne du marqueur pendant la période de collecte. Ces méthodes sont généralement réservées au contexte de recherche. [3]
La deuxième classe de méthodes permet d’obtenir un DFG estimé (DFGe) à l’aide de formules qui utilisent un marqueur sanguin et différents paramètres démographiques. Ces formules sont généralement standardisées pour la surface corporelle et exprimées en ml/min/1,73 m2, permettant de comparer les résultats entre individus.
La plupart de ces formules utilisent la créatinine, un produit du métabolisme de la phosphocréatine musculaire. Comme la créatinine est librement filtrée au glomérule, mais aussi sécrétée au niveau tubulaire, les formules l’utilisant tendent à surestimer le DFG mesuré. En outre, la créatininémie est influencée par plusieurs facteurs démographiques, la diète, la masse musculaire et la médication. [4] Bien que certains paramètres comme la démographie sont intégrés dans les formules, d’autres comme la masse musculaire ne sont pas complètement pris en compte par les formules existantes. Le DFG estimé via la créatinine peut donc être sous-estimé chez les patients à haute masse musculaire et surestimé chez les patients à faible masse musculaire. [5] Néanmoins, les lignes directrices du Kidney Disease Improving Global Outcomes (KDIGO) recommandent actuellement l’utilisation de la formule Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI) pour calculer le DFGe. [6, 7] Cette formule calcule le DFGe à l’aide de l’âge, du sexe, de la race et de la créatinine sérique. Elle est fiable pour différentes compositions corporelles et comorbidités. [4] D’autres formules comme la Modification of Diet in Renal Disease (MDRD) et la Cockcroft-Gault (CG) furent précédemment développées, mais sont maintenant moins utilisées. La formule MDRD fut en effet développée dans une population atteinte de dysfonction rénale et sous-estime les valeurs au-dessus de 60 ml/min/1,73 m2 tandis que la CG estime la
clairance de la créatinine plutôt que le DFGe. [4] Dans les dernières années, d’autres formules utilisant un autre marqueur, la cystatine C (ou sa combinaison avec la créatinine), furent développées. [8] La cystatine C (CysC) est une protéine sécrétée à un rythme constant par l’ensemble des cellules nucléées et est librement filtrée au glomérule et réabsorbée au tubule proximal. [4, 9] Comme sa concentration ne dépend pas du sexe, de l’âge et
En ce sens, une méta-analyse de 16 études observationnelles rapporta que la formule CKD-EPI utilisant la CysC prédit mieux la mortalité que celle basée sur la créatinine. [13] Néanmoins, son dosage en laboratoire est peu standardisé, ce qui limite pour le moment son usage à la confirmation du statut d’IRC chez les individus avec DFGe entre 45 et 59 ml/min/1,73 m2 sans évidence de dommage rénal. [5, 6]
Figure 2. Classification de l’insuffisance rénale chronique
Reprinted from Kidney International Supplements, 3 (3), Current Chronic Kidney Disease (CKD) Nomenclature used by Kdigo, page vii, Copyright (2013), with permission from Elsevier.
Classification de l’insuffisance rénale chronique
Les lignes directrices du KDIGO recommandent l’utilisation de deux paramètres pour la classification et la prognostication de l’IRC. [6] D’abord, le DFGe mesuré avec la formule CKD-EPI utilisant la créatinine peut être classifié en 5 stades (Figure 2). L’IRC est ainsi généralement définie comme un DFGe inférieur à 60 ml/min/1,73 m2 (stade 3 et plus). De plus, le stade 3 est subdivisé en stade 3A et 3B car le pronostic d’un
individu peut varier grandement entre 30 et 60 ml/min/1,73 m2. [14] Enfin, les patients recevant une thérapie de
remplacement rénal chronique sont classés au stade 5 de l’IRC, appelé insuffisance rénale terminale (IRT). En plus de suggérer l’usage du DFGe, le KDIGO suggère la mesure de l’albuminurie, un marqueur de dommage glomérulaire. [15, 16] Effectivement, certaines pathologies rénales entrainent un dommage au glomérule avant d’entraver la capacité de filtration du néphron. La mesure de l’albuminurie permet ainsi d’identifier des individus à risque élevé de mortalité, d’évènements cardiovasculaires et d’IRT indépendamment du DFGe. [14-17] La combinaison de l’albuminurie et du DFGe permettent ainsi d’attribuer à chaque individu un risque de mortalité ou de progression vers l’IRT allant de faible à très élevé (Figure 2).
Étiologies de l’insuffisance rénale chronique
Déclin physiologique de la fonction rénale
Le vieillissement est associé à une diminution du DFG. En effet, à mesure que l’âge augmente, la masse et la dimension des reins diminuent. [18, 19] Ces changements macroscopiques sont accompagnés microscopiquement de sclérose glomérulaire et artérielle, d’une perte de l’autorégulation artérielle, d’atrophie
tubulaire et de fibrose tubulo-interstitielle. [1, 20-24] Ces altérations ont été cliniquement associées à une diminution annuelle du DFG mesuré de 0,5 à 0,8 ml/min/1,73 m2. [25-27] Bien que l’âge soit également associé
à un déclin de la masse musculaire et donc de la créatinine, les formules d’estimation du DFG prennent en compte l’âge et permettent ainsi d’obtenir des estimations valides chez les individus âgés. [28, 29] Par conséquent, la valeur normale du DFGe d’un individu jeune est de 115 à 130 ml/min/1,73 m2 et celle d’un
individu âgé de 70 ans est de 72 à 89 ml/min/1,73 m2. [30-34]
Causes pathologiques de l’insuffisance rénale chronique
En plus du déclin physiologique du DFG avec l’âge (qui ne mène généralement pas à l’IRC avancée), plusieurs conditions peuvent causer l’IRC. Une liste non exhaustive des causes d’IRC est présentée au Tableau 1. Celles-ci sont divisées en causes pré-rénales, rénales et post-rénales selon la localisation du mécanisme pathologique.
TABLEAU 1. Causes d’insuffisance rénale chronique [35, 36]
Causes prérénales Causes rénales Causes post-rénales
Sténose des artères rénales Microangiopathie thrombotique Hyperplasie bénigne de la prostate Syndrome cardio-rénal Néphroangiosclérose Néphropathie de reflux
Syndrome hépato-rénal Glomérulonéphrites Néphropathie diabétique Myélome multiple
Maladies tubulo-interstitielles Médications néphrotoxiques Maladie rénale polykystique
La néphropathie diabétique et la néphroangiosclérose (causée par l’hypertension) sont les deux causes les plus importantes d’IRC avancée, représentant respectivement 47 % et 25 % des cas aux États-Unis en 2016. [37]
Épidémiologie de l’insuffisance rénale chronique
Incidence et prévalence
De récents travaux utilisant les données d’un réseau de surveillance des maladies chroniques au Canada ont estimé la prévalence des stades d’IRC à 3,4 % (stade 3A), 2,5 % (stade 3B), 1,2 % (stade 4) et 0,3 % (stade 5). [38] Cette prévalence était similaire en fonction du sexe, mais augmentait avec l’âge, avec le niveau de carence sociale, le nombre de comorbidités et le contexte rural. Quant à elles, les données de l’Institut Canadien d’Information sur la Santé ont estimé l’incidence de l’IRT au Canada à 198 cas par million de personnes-années. [39] Cette incidence est similaire à celles de la France et du Royaume-Uni, mais deux fois inférieure à celle des États-Unis. [40] Bien que les données canadiennes ne ventilent pas selon l’âge, le sexe et la race, des données américaines rapportent que l’IRT est plus prévalente chez les hommes, les individus âgés et les individus de race noire. [37]
augmentation de la mortalité. [14] Cette augmentation de la mortalité culmine en IRT avec une espérance de vie de 33 % à 50 % inférieure à celle de la population générale. [37] En outre, les individus atteints d’IRC, particulièrement en IRT, ont une qualité de vie diminuée et engendrent des coûts de santé de 4 à 45 fois supérieurs à ceux de la population générale. [41-43] Au Canada, une récente analyse du fardeau global des maladies a déterminé que l’IRC était ainsi responsable de 2,5 % des disability-adjusted life-years (DALY) perdues et de 4,5 % des décès. [44] Aux États-Unis, l’IRC est responsable de 3,5 % des DALY et de 175 000 décès annuels. [45]
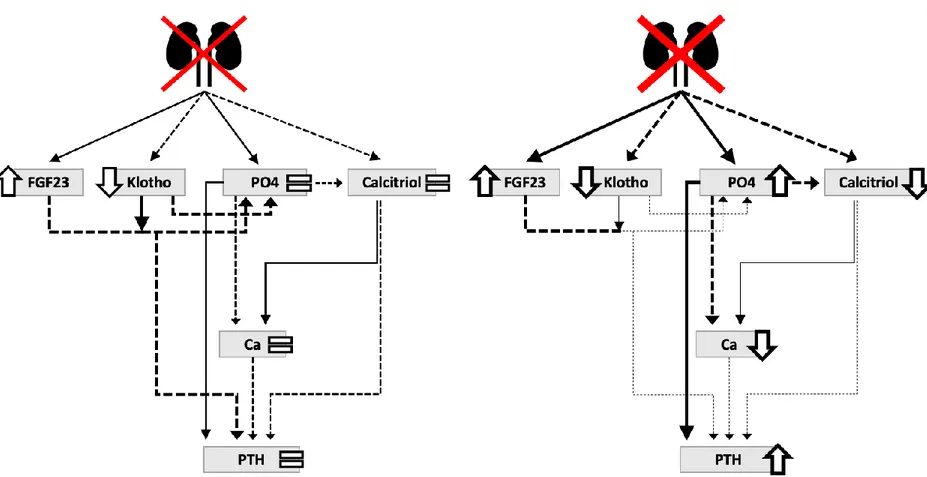
L’IRC est également associée à une augmentation des évènements cardiovasculaires, cause majeure de la mortalité élevée dans cette population. [46] Cette grande incidence de la maladie cardiovasculaire est entre autres causée par la prévalence augmentée de dyslipidémie et d’hypertension dans la population IRC. [47-54] Le diabète, l’obésité et le tabagisme, trois facteurs de risque majeurs de maladie rénale, contribuent également de manière importante à l’augmentation du risque cardiovasculaire chez les individus atteints d’IRC. [37, 55-59] En outre, plusieurs autres complications de la maladie rénale contribuent à l’augmentation de la morbidité et de la mortalité en IRC. Par exemple, la déficience en érythropoïétine et l’inflammation associées à l’IRT entraînent une anémie qui augmente le risque cardiovasculaire. [60, 61] De façon similaire, l’IRT mène à une augmentation de la concentration sérique de toxines dites urémiques associées à la mortalité cardiovasculaire. [62, 63] Enfin, le trouble minéral et osseux de l’IRC cause une calcification vasculaire et augmente l’incidence de fractures, contribuant à la mortalité en IRC. [64]
Traitements de l’insuffisance rénale chronique
Thérapies ralentissant la progression de la maladie rénale
Plusieurs stratégies non pharmacologiques ou pharmacologiques permettent d’éviter l’apparition ou de ralentir la progression de la maladie rénale. Dans des études observationnelles, le tabagisme, l’inactivité physique, l’obésité, une haute consommation alimentaire de sodium et de protéines ont été associés à l’incidence de l’IRC. [65-71] Sur le plan pharmacologique, le contrôle de la tension artérielle fut associé à une réduction de la protéinurie et une diminution de la détérioration de la fonction rénale chez les patients diabétiques et non-diabétiques dans des essais cliniques. [72, 73] De façon similaire, plusieurs études observationnelles observèrent qu’un mauvais contrôle glycémique était associé à l’incidence de maladie rénale et des essais cliniques randomisés (ECR) subséquents associèrent son contrôle intensif à une réduction de l’albuminurie et de l’incidence d’IRT. [74-77] Dans les dernières années, plusieurs études suggérèrent également que certaines médications antihypertensives ou hypoglycémiantes ont un effet néphroprotecteur indépendant de leur action sur la tension artérielle ou la glycémie. Il fut ainsi observé dans des ECR que la prise d’inhibiteurs de l’enzyme de conversion de l’angiotensine (IECA) ou d’antagonistes du récepteur de l’angiotensine II (ARA) était associée à une diminution du déclin du DFGe et de l’incidence d’IRT dans diverses populations, indépendamment de leur
effet antihypertenseur (IRC, diabète de type 1, diabète de type 2 avec microalbuminurie, néphropathie diabétique). [72, 78-80] Les IECA ou ARA sont donc maintenant indiqués pour prévenir la néphropathie diabétique. [81, 82] De plus, les inhibiteurs du cotransporteur sodium/glucose 2 (SGLT2i) ont été associés à une réduction de l’incidence et de la progression de néphropathie diabétique dans des ECR d’individus avec ou sans IRC. [83-85] Néanmoins, les IECA et ARA sont associés à de l’hyperkaliémie en IRC avancée et les SGLT2i ne peuvent être prescrits sous un DFG de 30 à 45 ml/min/1,73 m2 ; l’utilisation de ces classes pharmacologiques
est donc limitée dans les phases avancées de l’IRC. [83-86]
Thérapies de remplacement rénal
Lorsque le DFG d’un individu descend sous 5 à 15 ml/min/1,73 m2, sa survie est menacée à court terme et un
traitement de remplacement rénal doit être initié. Ces traitements peuvent prendre la forme d’hémodialyse, où le sang est pompé en dehors du circuit vasculaire et mis en contact avec une membrane de dialyse le séparant d’un dialysât, permettant l’osmose et l’ultrafiltration. Le péritoine peut également agir comme membrane en dialyse (dialyse péritonéale). Les traitements de dialyse peuvent avoir lieu à l’hôpital ou à domicile. Bien que la dialyse soit associée à une mortalité élevée à moyen terme (survie à 5 ans de 42 % aux États-Unis), elle demeure souvent la seule option pour des individus non-candidats ou en attente de greffe rénale. [37] En plus, la dialyse s’accompagne de problématiques d’accès vasculaire, d’infections et de contrôle volémique, est associée à une qualité de vie diminuée et à des coûts de santé très élevés. [42, 43]
Transplantation rénale
La transplantation rénale est une alternative à la dialyse qui permet à un individu de recevoir un rein provenant d’un donneur décédé ou vivant. La greffe peut avoir lieu pendant que l’individu reçoit un traitement de dialyse chronique ou avant que celui-ci soit amorcé. La transplantation est associée à une survie et à une qualité de vie augmentée ainsi qu’à des risques cardiovasculaire et fracturaire moindres que la dialyse. [37, 87-91] Néanmoins, son usage est restreint par les limites organisationnelles associées au don d’organes. En outre, elle nécessite l’emploi de thérapies immunosuppressives associées à un risque infectieux, néoplasique et métabolique. [92-94] Enfin, malgré un traitement immunosuppresseur optimal, certains individus rejettent leur greffon à court ou long terme et doivent retourner en dialyse avant de recevoir une autre greffe rénale.
L’ostéoporose et les fractures ostéoporotiques
Anatomie et physiologie normale de l’os
Anatomie
Le tissu osseux assure des fonctions de support, de fixation et de protection des organes, participe à plusieurs processus physiologiques et est le siège de l’hématopoïèse. Macroscopiquement, il se divise en squelette axial et appendiculaire. Le squelette axial est composé des os du visage, du crâne et du tronc alors que le squelette appendiculaire est composé des os des 4 membres et de la ceinture pelvienne. Dans le squelette axial, plusieurs os partagent une organisation similaire et sont regroupés sous le terme d’os longs. Ceux-ci sont formés d’une épiphyse à une ou deux de leurs extrémités, siège d’une ossification indépendante du reste de l’os. Ils sont séparés de la métaphyse et du corps central de l’os (appelé diaphyse) par une plaque de croissance cartilagineuse appelée physe (Figure 3). [95]
Figure 3. Anatomie de l’os
Copyright © OpenStax College – Anatomy & Physiology (2013). Disponible sous licence Creative Commons Attribution 3.0 au
https://upload.wikimedia.org/wikipedia/commons/2/23/603_Anatomy_of_Long_Bone.jpg
Le tissu osseux se divise en os cortical et trabéculaire. L’os cortical est un os compact principalement retrouvé dans la diaphyse des os longs. L’os trabéculaire est un os spongieux formé de travées à l’intérieur desquelles la moelle osseuse réside. Cet os est principalement retrouvé dans le squelette axial et dans les épiphyses et métaphyses des os longs. Microscopiquement, le tissu osseux est organisé sous forme d’os lamellaire ou fibreux. L’os fibreux est un os immature composé de fibres de collagène disposées aléatoirement dans l’espace.
Il est retrouvé chez l’os en croissance et dans le processus de réparation après une fracture. À l’inverse, l’os lamellaire est un os mature composé de fibres de collagène disposées parallèlement dans l’espace. Dans l’os cortical, il est parfois organisé en ostéons secondaires, formés de plusieurs lamelles concentriques autour d’un canal contenant les vaisseaux et les nerfs. [95]
Formation et résorption osseuse
L’os est un tissu dynamique qui se forme et se résorbe constamment ; 2 à 5 % du tissu osseux est résorbé et reformé annuellement. [95] La formation et la résorption osseuse sont sous contrôle de cellules issues de deux lignées cellulaires distinctes, qui communiquent entre elles en utilisant plusieurs types de cytokines. Une multitude de signaux mécaniques, paracrines et endocrines influencent l’intensité de ces processus. L’équilibre entre la formation et la résorption osseuse contribue ainsi à la masse osseuse d’un individu.
La formation osseuse est sous responsabilité de l’ostéoblaste, qui produit le collagène de type 1 formant la matrice osseuse, aussi appelée ostéoïde. C’est sur celle-ci que se déposent le calcium et le phosphate sous forme d’hydroxyapatite, formant ainsi l’os minéralisé. L’ostéoblaste produit également l’ostéocalcine, qui régule le processus de minéralisation dans l’ostéoïde. [96] L’ostéoblaste est issu de la cellule souche mésenchymateuse, qui produit également les adipocytes, les myoblastes et les chondrocytes. La différenciation des cellules souches mésenchymateuses en ostéoblaste nécessite le facteur de transcription Runx2. [97, 98] Ce dernier est obligatoire à la production de plusieurs protéines nécessaires à la formation osseuse (collagène de type 1, ostéocalcine). Runx2 est régulé par de nombreux facteurs de croissance et voies de signalisation, contrôlant ainsi l’activité ostéoblastique. L’ostéocyte est un type précis d’ostéoblaste qui a échappé à l’apoptose et qui a réduit sa production d’ostéoïde. Il constitue le type cellulaire le plus abondant de l’os, ayant une durée de vie pouvant aller jusqu’à 25 ans. [99] Il est encapsulé dans l’os minéralisé à l’intérieur de cavités appelées lacunes. Chaque ostéocyte possède de nombreuses dendrites qui circulent dans les canalicules, de petits canaux reliant les différentes lacunes. Grâce à ce réseau de communication, les ostéocytes et leurs dendrites permettent la transmission de signaux mécaniques et chimiques qui contribuent à la régulation de l’activité des autres cellules osseuses.
L’ostéoclaste est une cellule multinucléée qui assure la résorption osseuse. Celui-ci adhère à la surface osseuse et sécrète des ions H+ dissolvant l’hydroxyapatite et des protéases digérant la matrice osseuse. Comme l’ostéoclaste est une cellule polarisée, un seul côté de sa membrane cellulaire peut adhérer à l’os et en faire la résorption, assurant l’unidirectionalité de la résorption osseuse. L’ostéoclaste est issu de la lignée cellulaire hématopoïétique, également responsable de la production des érythrocytes, lymphocytes et thrombocytes. Plus précisément, l’ostéoclaste est formé par la fusion de plusieurs cellules d’origine monocytaire et s’apparente donc à un macrophage polynucléé. [95] L’étape centrale de la différenciation des cellules d’origine hématopoïétiques
RANKL. [100] Ce dernier est sécrété par l’ostéoblaste, assurant donc un couplage entre l’activité ostéoblastique et ostéoclastique. La différenciation ostéoclastique est également régulée par l’ostéoprotégérine (OPG), l’inhibiteur du RANKL, qui prend sa place sur le RANK et empêche ainsi d’activer la différenciation en ostéoclaste. Le ratio RANKL/OPG influence donc l’équilibre entre formation et résorption osseuse (Figure 4).
Figure 4. Biologie cellulaire osseuse
Reprinted from Trends in Cell Biology, 28 (3), Rao S., Cronin S.J.F., Sigl V., et al, RANKL and RANK: From Mammalian Physiology to Cancer Treatment, pages 213-223, Copyright (2018), with permission from Elsevier.
Rôle de la voie de signalisation Wnt/-Catenin canonique
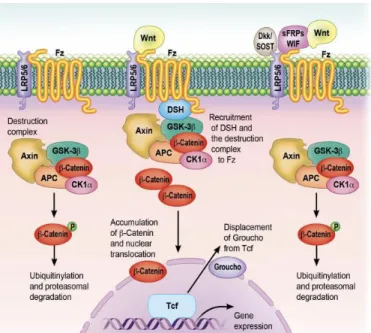
La voie de signalisation Wnt/-Catenin canonique joue un rôle important dans la physiologie osseuse. Cette voie est activée par la fixation d’un ligand Wnt à un récepteur de la famille Frizzled et à une protéine transmembranaire de la famille des Low-density Lipoprotein Receptor-related Protein (LRP). Cette fixation stabilise la -Catenin intracellulaire, entraine sa translocation au niveau du noyau et augmente alors la transcription de gènes cibles. Ces gènes ont pour effet d’augmenter la différenciation ostéoblastique et de diminuer l’apoptose ostéoblastique et le ratio RANKL/OPG. [101-103] Il résulte donc une augmentation de la formation osseuse et une réduction de la résorption osseuse. [104, 105] L’activité de la voie Wnt/-Catenin est principalement régulée par l’action inhibitrice de plusieurs protéines. Par exemple, des protéines de la famille des Secreted Frizzled-Related Protein (SFRP) fixent les ligands Wnt et empêchent leur action, entrainant une diminution de la formation osseuse. [106, 107] De manière similaire, la sclérostine (SOST) et certaines Dicckopf-related-protein (DKK) se fixent sur le LRP et y empêchent la fixation du Wnt-ligand, réduisant alors la formation osseuse (Figure 5). [108, 109]
Figure 5. Mécanisme d’action des inhibiteurs de la voie Wnt//-Catenin
Adapted from Front. Cell Dev. Biol. 6:170, Houschyar KS., Tapking C., Borrelli MR. et al, Wnt Pathway in Bone Repair and Regeneration – What Do We Know So Far, doi: 10.3389/fcell.2018.00170, Copyright (2019).
Rôle de la parathormone et de la vitamine D
La parathormone (PTH) et la vitamine D, deux hormones impliquées dans le métabolisme phosphocalcique, ont un rôle clé dans la physiologie osseuse. La PTH est sécrétée par les cellules principales de la glande parathyroïde en réponse à l’hypocalcémie, à l’hyperphosphatémie et à une déficience en vitamine D. Au niveau rénal, la PTH augmente la réabsorption de calcium au tubule distal et stimule la 1-hydroxylation de la vitamine D. Au niveau osseux, la PTH agit à la fois sur la formation et sur la résorption, dépendamment de sa cinétique de sécrétion. Ainsi, une sécrétion pulsatile de PTH augmente la survie et la différenciation ostéoblastique en inhibant la sécrétion d’inhibiteurs de Wnt tels que SOST et DKK1 et augmente ainsi la formation osseuse. [110-112] En contrepartie, une sécrétion continue de PTH accroit le ratio RANKL/OPG, augmentant ainsi la différenciation ostéoclastique et stimulant la résorption osseuse. [113] Dans un contexte physiologique, les niveaux assez constants de PTH contribuent principalement à la résorption.
La vitamine D joue également un rôle clé dans le maintien de la calcémie et de la phosphatémie. Elle est synthétisée dans l’épiderme au contact de rayons solaires UVB, hydroxylée en 25-OH-D au foie et enfin 1-hydroxylée au rein en sa forme biologiquement active (1,25-(OH)2-D). La vitamine D agit de concert avec la PTH
afin de réguler les niveaux de calcium sanguins via une boucle de rétrocontrôle : alors que la 1--hydroxylation de la vitamine D est stimulée par la PTH, des niveaux élevés de 1,25-(OH)2-D inhibent la sécrétion de PTH. Au
niveau osseux, il fut suggéré que la vitamine D augmente l’apport de calcium à l’os et promeut ainsi indirectement la formation osseuse. [114, 115] Un effet direct de la vitamine D sur l’os via la stimulation de l’ostéoblastogenèse, l’inhibition de la minéralisation et l’augmentation de l’activité ostéoclastique a également
Définition et classification de l’ostéoporose
L’ostéoporose est définie cliniquement comme une « maladie systémique caractérisée par une faible masse osseuse et une détérioration de la microarchitecture osseuse qui résulte en une fragilité osseuse et une susceptibilité aux fractures ». [117] Opérationnellement, les lignes directrices de la National Osteoporosis Foundation recommandent de poser le diagnostic d’ostéoporose avec un score-T sous -2,5 à la densité minérale osseuse (DMO ; voir section suivante) ou après une fracture de la hanche ou vertébrale en l’absence d’un traumatisme majeur. [118] Un score-T entre -1 et -2,5 est quant à lui classifié comme un état intermédiaire appelé ostéopénie.
Pathophysiologie de l’ostéoporose
La cause primaire de l’ostéoporose est la diminution de l’action des hormones stéroïdiennes sexuelles (estrogène, testostérone) liée à l’âge. Chez la femme, les estrogènes augmentent la formation osseuse en stimulant la fonction ostéoblastique, inhibant l’apoptose des ostéoblastes et en diminuant l’expression de sclérostine. [119-121] Les estrogènes diminuent également la résorption osseuse en diminuant le ratio RANKL/OPG et en stimulant l’apoptose ostéoclastique. [122, 123] Lors de la ménopause, la diminution des estrogènes entraine un découplement du remodelage osseux : alors que la formation osseuse augmente de 45 %, la résorption osseuse augmente de 90 %. [124] Ce débalancement entraine une augmentation de la porosité trabéculaire qui se manifeste par une diminution rapide de la DMO et ainsi une augmentation de l’incidence des fractures. [125-127] Chez l’homme, l’augmentation des niveaux de la sex hormone binding globulin (SHBG) avec le vieillissement diminue la fraction sanguine bioactive d’estrogène et de testostérone. [128, 129] Cette diminution des concentrations sanguines d’estrogènes et de testostérone actives biologiquement est associée à la diminution de la DMO observée chez l’homme, s’accélérant à un âge plus avancé que les femmes. [130-132]
En plus de l’ostéoporose primaire due au vieillissement, plusieurs autres conditions peuvent entrainer une fragilité osseuse dite secondaire. Une liste non exhaustive des causes est présentée au Tableau 2.
TABLEAU 2. Causes d’ostéoporose secondaire [95, 116]
Maladies inflammatoires Maladies endocriniennes ou métaboliques
Arthrites inflammatoires Hyperthyroïdie de longue date non-traitée Maladies inflammatoires intestinales Hypercorticisme/Corticothérapie Maladie pulmonaire obstructive chronique Diabète
VIH Insuffisance rénale chronique
Chirurgie bariatrique/Malabsorption intestinale chronique
États d’hypogonadisme Maladie hépatique chronique Inhbiteurs de l’aromatase Hyperparathyroïdie Inhibiteurs de la GnRH Carence en vitamine D Orchidectomie bilatérale
Ménopause précoce
Épidémiologie de l’ostéoporose et des fractures ostéoporotiques
Incidence et prévalence
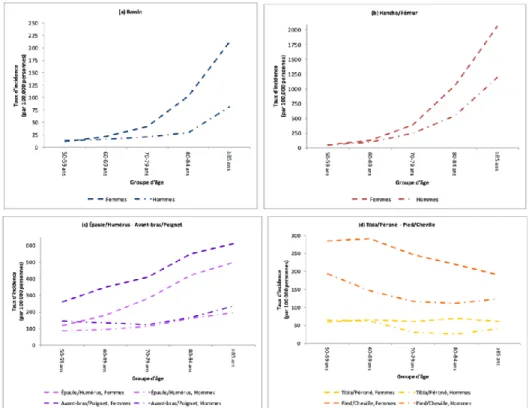
La prévalence de l’ostéoporose au Canada varie selon le site anatomique de DMO utilisé. Ainsi, dans la cohorte Canadian Multicentre Osteoporosis Study (CaMOS), la prévalence de l’ostéoporose chez les femmes et les hommes était respectivement de 8 % et 5 % au col fémoral, 12 % et 3 % à la colonne lombaire et 16 % et 7 % avec l’une ou l’autre de ces mesures. [133] Dans une étude combinant ces résultats à des données plus récentes, la prévalence canadienne d’ostéoporose était de 18 et 13 % respectivement. [134] Cette prévalence est similaire à celle des États-Unis, mais inférieure à celle des pays européens et du Japon. Néanmoins, ces prévalences au Canada et États-unis sont probablement sous-estimées par la plus haute prévalence du diabète et de l’obésité (qui sont associées à des DMO plus élevées) dans ces juridictions. [135-137] L’incidence des fractures varie également en fonction de l’âge, du sexe et du site anatomique considéré. Au Canada, l’incidence annuelle en 2010-2011 de fracture ostéoporotique chez les individus de plus de 50 ans était ainsi de 1,9 % chez les femmes et 0,9 % chez les hommes. [138] Lorsque stratifiée selon l’âge, celle-ci atteignait un maximum chez les individus de 90 à 99 ans avec une incidence annuelle de 9 % chez les femmes et 5,1 % chez les hommes. Les données de l’Institut National de Santé Publique du Québec (INSPQ) sur l’incidence des fractures ostéoporotiques par âge, sexe et site en 2011-2012 sont présentées à la Figure 6. [139]
Figure 6. Incidence des fractures ostéoporotiques par âge, sexe et site anatomique au Québec
Reproduit de Jean S., Godi M.J., Brown J.P., et al, Portrait des fractures ostéoporotiques chez les adultes québécois âgés de 50 ans et plus pour la période 1997-1998 à 2011-2012, 2015, Institut national de santé publique du Québec.
Ces données de surveillance ont également observé une diminution de l’incidence des fractures au cours des deux dernières décennies. Cette diminution est présente à tous les sites, à l’exception du bassin. [139] Une tendance similaire est observée pour les fractures de la hanche à l’échelle mondiale, sauf dans les pays asiatiques où l’incidence des fractures de la hanche a augmenté depuis les années 1990. [140]
Morbidité et mortalité
La survenue d’une fracture ostéoporotique a des conséquences majeures sur la santé d’un patient. En effet, une fracture est associée à une augmentation de la mortalité qui culmine dans les mois suivant la fracture et qui persiste plus de 10 ans après son occurrence, particulièrement chez les hommes. [141-143] Cette augmentation de la mortalité est plus prononcée à la suite d’une fracture de la hanche, mais est aussi observée à l’ensemble des autres sites. [142-145] Bien que la mortalité absolue post-fracture soit plus importante chez les individus âgés (mortalité à 1 an post-fracture de la hanche de 20 à 40 %), l’augmentation relative est plus importante chez les jeunes individus. [95, 141-143] Une augmentation des maladies cardiovasculaires et des infections ainsi qu’une détérioration du statut fonctionnel post-fracture ont entre autres été suggérées comme médiateurs de cette mortalité augmentée. [146-148] L’incidence d’une fracture ostéoporotique est également associée à une diminution importante de la qualité de vie qui persiste pour au moins 18 mois post-fracture. [149-151] Les fractures ostéoporotiques sont ainsi responsables de 0,8 % des DALY perdues au niveau mondial et de 1 à 2 % des DALY perdues au Canada et aux États-Unis. [44, 45, 152] En outre, l’incidence d’une fracture est associée à une augmentation du risque d’institutionnalisation, qui peut atteindre 30 % à 1 an. [95, 153] Enfin, l’ostéoporose est associée à un poids économique majeur, estimé à 4,6 milliards de dollars durant l’exercice financier 2010/2011 au Canada, dont 1,5 milliard consacré aux soins aigus et 1 milliard consacré à l’institutionnalisation. [138, 154]
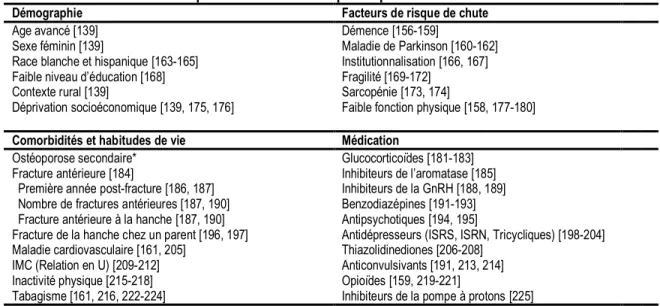
Facteurs de risque de fractures ostéoporotiques
Afin de faciliter l’identification d’individus à risque de fractures, plusieurs facteurs de risque de fracture ont été identifiés. Bien qu’ils aient été associés à l’incidence des fractures, un lien causal ne fut pas établi de façon définitive pour certains d’entre eux. Une liste non exhaustive de ces facteurs est présentée au Tableau 3.
Outils prédictifs et pronostiques en ostéoporose
Densité minérale osseuse par absorptiométrie biphotonique
La DMO mesurée par absorptiométrie biphotonique à rayons X (DXA) est la méthode d’imagerie osseuse la plus utilisée. Elle utilise une source de rayons X sous la table sur laquelle est couché le patient et une série de capteurs placés au-dessus du patient. Une radiation est émise à deux niveaux d’énergie différents et la différence dans l’atténuation de chaque niveau d’énergie est utilisée par un algorithme afin de calculer une DMO, exprimée en g/cm2. Comme chaque fabricant possède un algorithme qui lui est propre, ces mesures sont
standardisées en deux scores permettant la comparaison. Le score-T correspond au nombre d’écarts types (ET) entre la mesure d’un individu et la moyenne d’une population de référence de 20 à 29 ans du même sexe. [155]
TABLEAU 3. Facteurs de risque de fractures ostéoporotiques
Démographie Facteurs de risque de chute
Age avancé [139] Démence [156-159]
Sexe féminin [139] Maladie de Parkinson [160-162] Race blanche et hispanique [163-165] Institutionnalisation [166, 167] Faible niveau d’éducation [168] Fragilité [169-172]
Contexte rural [139] Sarcopénie [173, 174]
Déprivation socioéconomique [139, 175, 176] Faible fonction physique [158, 177-180]
Comorbidités et habitudes de vie Médication
Ostéoporose secondaire* Glucocorticoïdes [181-183] Fracture antérieure [184] Inhibiteurs de l’aromatase [185] Première année post-fracture [186, 187] Inhibiteurs de la GnRH [188, 189] Nombre de fractures antérieures [187, 190] Benzodiazépines [191-193] Fracture antérieure à la hanche [187, 190] Antipsychotiques [194, 195]
Fracture de la hanche chez un parent [196, 197] Antidépresseurs (ISRS, ISRN, Tricycliques) [198-204] Maladie cardiovasculaire [161, 205] Thiazolidinediones [206-208]
IMC (Relation en U) [209-212] Anticonvulsivants [191, 213, 214] Inactivité physique [215-218] Opioïdes [159, 219-221]
Tabagisme [161, 216, 222-224] Inhibiteurs de la pompe à protons [225] *Les causes d’ostéoporose secondaire sont présentées au Tableau 2.
IMC, Indice de masse corporelle; ISRS, Inhibiteurs sélectifs de la recapture de la sérotonine; ISRN, Inhibiteurs sélectifs de la recapture de la noradrénaline
Le score-Z correspond au nombre d’ET entre la mesure d’un individu et la moyenne d’une population de référence du même âge et sexe. [155] Les lignes directrices de l’International Society For Clinical Densitometry (ISCD) recommandent l’utilisation du score-T pour les hommes de plus de 50 ans et les femmes ménopausées et l’utilisation du score-Z dans les autres situations cliniques. [155] La DMO par DXA peut être mesurée à plusieurs sites anatomiques, dont la hanche (col fémoral, hanche totale), la colonne lombaire et le radius. L’ISCD recommande l’utilisation du DXA lombaire ou à la hanche, car ces sites sont les plus fortement associés à l’incidence de fractures. [155, 226] En plus d’être utilisé dans la définition de l’ostéoporose de l’Organisation mondiale de la santé (OMS), le DXA permet de monitorer l’effet d’un traitement et peut être utilisé dans des calculateurs de risque fracturaire. [155] Son utilisation s’est rapidement répandue de par ses faibles niveaux de radiation et sa forte association avec l’incidence des fractures. [226, 227] Les lignes directrices canadiennes recommandent donc la mesure de la DMO par DXA chez tout individu de plus de 65 ans, chez les femmes ménopausées et hommes de plus de 50 ans avec facteur de risque de fracture et chez les autres individus avec une condition prédisposant aux fractures. [228]
Ultrasonométrie
La DMO peut aussi être mesurée par ultrasonométrie quantitative (quantitative ultrasound, QUS). Le QUS utilise un émetteur et un transmetteur d’ultrasons placés de part et d’autre de l’os d’intérêt, lui-même entouré de membranes remplies d’eau ou de gel. L’appareil calcule alors la vitesse (speed of sound, SOS) et l’atténuation
de rigidité (SI, stiffness index). [229] Cette mesure peut ensuite être utilisée pour générer un Z et un score-T. Bien que le QUS soit utilisable à plusieurs sites anatomiques, l’os calcanéal est le plus courant et le seul recommandé par l’ICSD. [155] Comme les valeurs de QUS calcanéal corrèlent fortement avec la DMO calcanéale par DXA mais modérément avec la DMO lombaire ou fémorale, [230, 231] l’ISCD ne recommande pas de considérer les scores-Z et T générés par le QUS et le DXA comme équivalents. [155] Néanmoins, les paramètres de QUS peuvent être utilisés pour prédire les fractures. En effet, deux méta-analyses d’études observationnelles observèrent que les différents paramètres de QUS calcanéal sont fortement associés aux fractures. [232, 233] De plus, les hazard ratios (HR) et les aires sous la courbe (area under the curve, AUC) obtenus avec le QUS calcanéal et le DXA au col fémoral ou lombaire sont comparables. [234, 235] Cependant, bien que le QUS calcanéal soit une méthode de mesure de DMO accessible, peu coûteuse et sans radiation, son usage est limité par l’impossibilité de comparer les scores-T obtenus à ceux du DXA et la variabilité des mesures propriétaires générées par chaque appareil. [236]
Tomodensitométrie
Bien que la DMO par DXA soit associée à l’incidence de fractures, cette méthode de mesure reste imparfaite de par sa nature bidimensionnelle, son impossibilité à distinguer la densité corticale et trabéculaire et sa sous-estimation du risque fracturaire dans certaines populations (diabète de type 2, obésité). La tomodensitométrie (TDM) permet de pallier à quelques-unes de ces faiblesses. La TDM mesure le degré d’absorption de rayons X dans de multiples coupes axiales afin de reconstruire une image tridimensionnelle qui peut être utilisée pour calculer une DMO volumétrique corticale, trabéculaire ou totale. [155] Les mesures de DMO ainsi obtenues ont été associées à l’incidence de fractures et à une augmentation de la discrimination comparativement au DXA. [237-239] Bien que ces mesures aient traditionnellement nécessité l’utilisation d’un fantôme de référence spécifique (limitant l’utilisation d’images générées pour d’autres contextes cliniques) [155], une récente étude sur 84 patients a suggéré que l’usage de DMO obtenue sans fantôme spécifique prédisait davantage la survenue de fractures que la DMO par DXA. [240] La TDM émet davantage de radiations que le DXA et ne peut être utilisée dans les scores de prédiction fracturaire. [155, 241] Toutefois, elle peut être utilisée pour le suivi longitudinal de par sa précision et peut être employée pour le diagnostic d’ostéoporose après normalisation en DMO bidimensionnelle. [155]
Microarchitecture osseuse
La TDM est également utilisée dans une technologie novatrice, le high-resolution peripheral quantitative computed tomography (HRpQCT). Le HRpQCT consiste en un TDM de haute résolution qui permet de mesurer avec précision la microarchitecture et de générer des mesures telles que l’épaisseur et la porosité corticale, l’épaisseur trabéculaire et le nombre de trabécules. [242, 243] Ces mesures tridimensionnelles sont corrélées avec les mesures de microtomographie par synchrotron, l’étalon-or de la densitométrie. [243] Certains de ces paramètres furent associés à l’incidence de fracture dans une cohorte de 589 femmes, et ce, malgré
![TABLEAU 1. Causes d’insuffisance rénale chronique [35, 36]](https://thumb-eu.123doks.com/thumbv2/123doknet/2895878.74223/19.918.126.792.431.579/tableau-causes-insuffisance-rénale-chronique.webp)
![TABLEAU 4. Comparaison des modèles de prédiction de fractures [256, 262, 263, 265, 266]](https://thumb-eu.123doks.com/thumbv2/123doknet/2895878.74223/33.1188.126.1054.137.673/tableau-comparaison-modèles-prédiction-fractures.webp)