Relation entre la durée du sommeil et la réponse au
traitement de l’insomnie
Mémoire doctoral
Amélie Rochefort
Doctorat en psychologie
Docteur en psychologie (D.Psy.)
Relation entre la durée du sommeil et la réponse au
traitement de l’insomnie
Mémoire doctoral
Amélie Rochefort
Sous la direction de :
Charles M. Morin, directeur de recherche
Lynda Bélanger, codirectrice de recherche
Résumé
Malgré l’efficacité reconnue de la thérapie cognitive-comportementale et de la pharmacothérapie pour traiter l’insomnie, les individus souffrant d’insomnie ne bénéficient pas tous de ces interventions. L’objectif principal du mémoire était d’examiner la relation possible entre la durée du sommeil, mesurée objectivement avant le traitement, et la réponse à une thérapie cognitive-comportementale pour l’insomnie (TCC-I), administrée seule ou combinée à la médication (TCC-I+Med). Un objectif secondaire était de documenter la présentation clinique des participants avec une durée normale ou courte du sommeil. Les données utilisées pour répondre à ces objectifs étaient issues d’une étude contrôlée randomisée, menée entre 2002 et 2005, dans la région de Québec. Pour les besoins du mémoire, 159 participants (Mâge = 50,31, ET = 10,14 ; 61,0 % femmes) ont été assignés à l’un des quatre groupes déterminés selon : (1) la durée de leur sommeil tel qu’enregistrée à la polysomnographie et (2) le traitement qu’ils avaient reçu. Ainsi, les groupes suivants ont été formés : les participants avec une durée normale du sommeil (c.-à-d., > 6h) ayant reçu une TCC-I (n = 54) ou une TCC-I+Med (n = 54) et ceux avec une courte durée du sommeil (c.-à-d., ≤ 6h) ayant reçu une TCC-I (n = 26) ou une TCC-I+Med (n = 25). Aucune différence significative entre le groupe avec une durée normale du sommeil et celui avec une courte durée du sommeil en ce qui concerne les variables sociodémographiques, psychologiques et la sévérité des symptômes d’insomnie n’a été observée avant le traitement. Indépendamment du traitement, les participants avec une courte durée du sommeil avant le traitement avaient eu une réduction de la durée des éveils en milieu de nuit et une augmentation de l’efficacité du sommeil significativement plus importantes que ceux avec une durée normale du sommeil. Cependant, ces mêmes participants étaient significativement plus insatisfaits de leur sommeil et rapportaient davantage de conséquences diurnes que ceux avec une durée normale du sommeil. Ces résultats suggèrent que la durée du sommeil recueillie avant le traitement n’influencerait pas la réponse thérapeutique en ce qui a trait aux variables de sommeil, mais elle influencerait les mesures de satisfaction du sommeil et du fonctionnement diurne. Compte tenu de ces résultats plutôt mitigés, d’autres études seront nécessaires pour clarifier le lien possible entre la durée objective du sommeil et la réponse thérapeutique. Des résultats plus concluants permettraient d’orienter les individus souffrant d’insomnie vers un traitement
Table des matières
Résumé ... iii
Table des matières ... iv
Liste des tableaux ... v
Liste des figures ... vi
Avant-propos ... vii
Introduction générale ... 1
Prévalence, critères diagnostiques et modèles étiologiques de l’insomnie ... 1
Durée du sommeil et insomnie ... 3
Courte durée du sommeil ... 4
Durée normale du sommeil ... 8
Traitements de l’insomnie ... 9
Traitement de l’insomnie et durée du sommeil ... 11
Problématique ... 14
Objectifs et hypothèses ... 15
Résumé ... 18
Abstract ... 19
Method ... 23
Participants and Study Design ... 24
Measures ... 25
Treatment Conditions ... 27
Data Management and Analysis ... 28
Results ... 29
Sample and Classification Method ... 29
Treatment Response ... 30
Discussion ... 32
References ... 37
Conclusion générale ... 54
Premier objectif : perception des symptômes d’insomnie et du fonctionnement diurne .. 55
Deuxième objectif : réponse thérapeutique à la TCC-I ou la TCC-I+Med ... 56
Forces et limites méthodologiques ... 60
Pistes de recherches futures ... 62
Liste des tableaux
Tableau 1………...42 Participant Characteristics at Baseline According to Objective Sleep Duration
Tableau 2………...44 Means (SE) and Changes on Sleep Parameters as Measured by Sleep Diary According to Objective Sleep Duration and Treatment
Tableau 3………...46 Means (SE) and Changes on Sleep Parameters as Measured by PSG According to
Objective Sleep Duration and Treatment
Tableau 4………...48 Means (SE) and Changes on Insomnia Severity and Daytime Functioning According to Objective Sleep Duration and Treatment
Liste des figures
Figure 1……….16 Illustration graphique du modèle de Vgontzas et collaborateurs (2013)
Article
Figure 1……….51 Changes on Sleep Parameters as Measured by Sleep Diary for Participants with Short Sleep Duration According to Treatment
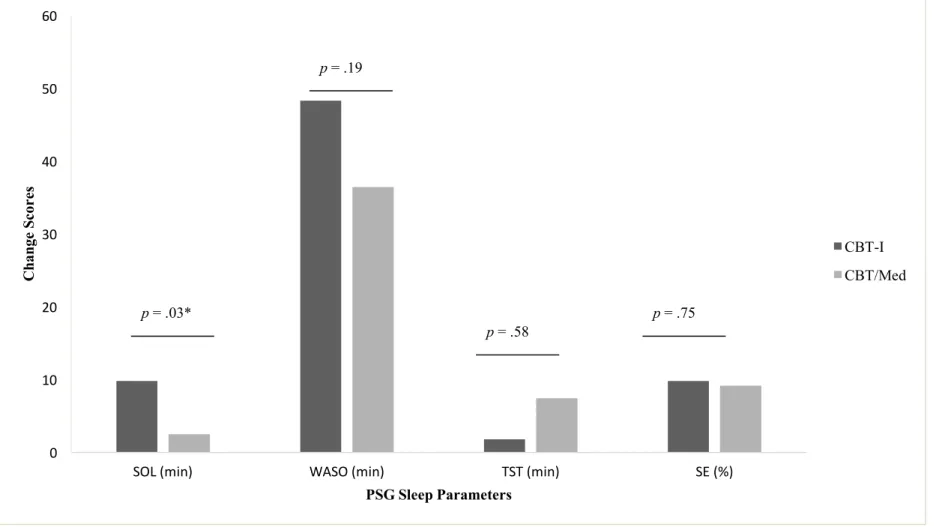
Figure 2……….52 Changes on Sleep Parameters as Measured by PSG for Participants with Short Sleep Duration According to Treatment
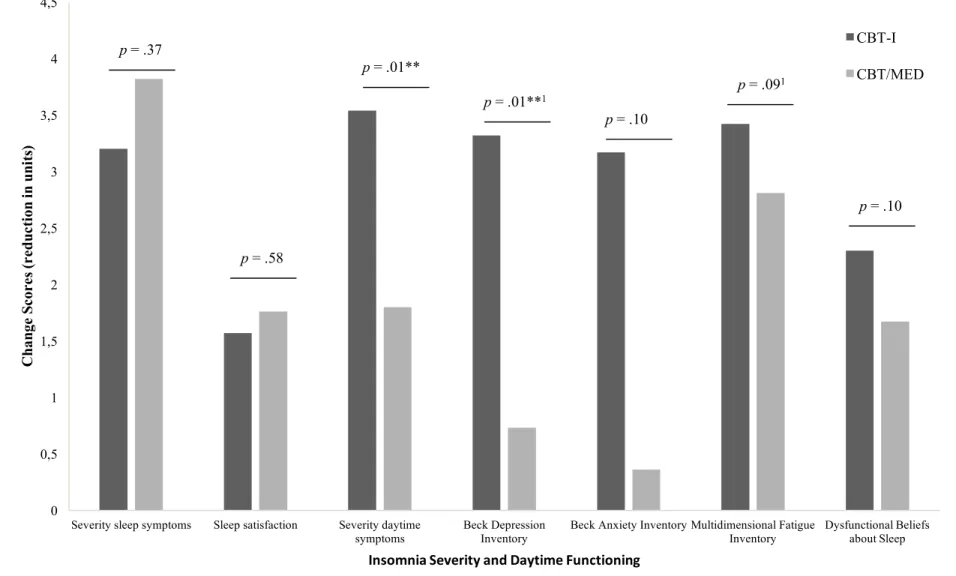
Figure 3……….53 Changes on Insomnia Severity and Daytime Functioning for Participants with Short Sleep Duration According to Treatment
Avant-propos
Ce mémoire inclut un article destiné à la publication. L’auteure de ce mémoire a participé à toutes les étapes de l’élaboration du document : la conception de l’étude, l’analyse et l’interprétation des données, ainsi que la rédaction des différentes sections. L’article a été révisé par Denise C. Jarrin, Lynda Bélanger et Charles Morin, qui sont coauteurs. Les analyses statistiques ont été élaborées avec l’aide de Hans Ivers, Ph. D.
J’aimerais remercier mon directeur de mémoire, Monsieur Charles Morin, pour votre confiance et l’importance que vous accordez à l’implication de vos étudiants dans vos différentes activités de recherche. Vous m’avez offert des opportunités de présentations lors de congrès scientifiques, de conférences et de travail dans le cadre de vos projets de recherche qui m’ont permises de me développer professionnellement et de prendre confiance en moi.
Un énorme merci à ma codirectrice, Lynda Bélanger, de m’avoir grandement guidée et encouragée tout au long de la rédaction de ce travail. Tes conseils pour l’écriture scientifique et ta rigueur me seront toujours utiles. Merci pour ta simplicité et ton écoute!
Un merci à Hans pour ton aide avec les analyses statistiques, mais aussi pour ta disponibilité, ton dynamisme et tes grandes compétences de vulgarisateur des statistiques!
Merci également à mes amis du laboratoire, Olivier, Denise et Ivy qui m’ont aidée par des relectures (et des encouragements) à différents moments de la rédaction.
Un dernier merci spécial à ma famille, pour avoir toujours cru en moi à travers mes études doctorales et pour m’avoir partagé votre fierté! À Alexandre, mon conjoint, merci pour ta patience, tes encouragements (dans leur simplicité, comme tu sais si bien le faire!) et ton support. Je te remercie d’avoir toujours tellement bien compris mes fins de semaine chargées de travail et mes nombreuses absences pour mes études.
Introduction générale
Prévalence, critères diagnostiques et modèles étiologiques de l’insomnie
L’insomnie est un problème de santé fréquent, affectant de 6 à 10% de la population générale adulte (Morin, LeBlanc, Daley, Grégoire, & Mérette, 2006; Ohayon, 2002). Les conséquences de l’insomnie sont multiples et incluent de la fatigue, des perturbations de l’humeur, une diminution de la qualité de vie (LeBlanc et al., 2009; Leger et al., 2012) et des difficultés cognitives liées à la concentration, à l’attention et à la mémoire (Fortier-Brochu, Beaulieu-Bonneau, Ivers, & Morin, 2012).
Les deux systèmes de classification proposant une définition et des critères diagnostiques de l’insomnie les plus fréquemment utilisés sont le Manuel Diagnostique et Statistique des Troubles Mentaux – 5e Édition ([DSM-5]) (American Psychiatric Association [APA], 2013) et la Classification Internationale des Troubles du Sommeil – 3e Édition ([ICSD-3]) (American Academy of Sleep Medicine [AASM], 2014). Selon ces systèmes de classification, poser un diagnostic d’insomnie requiert que la personne rapporte des difficultés de sommeil nocturnes, c’est-à-dire d’endormissement, de maintien du sommeil et/ou un réveil matinal précoce, et des conséquences diurnes qui causent une détresse significative et/ou nuisent à son fonctionnement. Les symptômes nocturnes doivent être présents au moins trois nuits par semaine et persister depuis au moins trois mois (APA, 2013; AASM, 2014). D’autres critères diagnostiques sont fréquemment utilisés dans le domaine de la recherche sur l’insomnie et permettent d’évaluer plus opérationnellement la sévérité des difficultés de sommeil perçues par l’individu. Ces critères sont : un délai d’endormissement ou une durée des éveils en milieu de nuit de plus de 30 minutes, une efficacité du sommeil (temps de sommeil divisé par le temps passé au lit) de moins de 85% et une durée du sommeil inférieure à 6,5h (APA, 2013; Morin & Benca, 2012). Bien que l’évaluation diagnostique de l’insomnie repose en grande partie sur la perception subjective des difficultés de sommeil vécues par l’individu, les perturbations peuvent également être évaluées à l’aide de la polysomnographie (PSG). La polysomnographie regroupe des mesures objectives (électroencéphalographie, électrooculographie et électromyographie) enregistrées pendant une nuit de sommeil et permet d’identifier les stades de sommeil et de détecter une pathologie du sommeil. Cependant, l’opinion des experts sur le sujet diverge quant à l’apport des
mesures objectives au diagnostic d’insomnie. Pour certains, dans le cadre d’une évaluation de routine de l’insomnie, la PSG devrait être recommandée uniquement lorsqu’une autre pathologie du sommeil est suspectée (p. ex., apnée du sommeil, mouvements périodiques des membres et trouble du comportement en sommeil paradoxal), lorsque le diagnostic initial est incertain ou encore lorsque les améliorations du sommeil après un traitement sont modestes (Littner et al., 2003; Schutte-Rodin, Broch, Buysse, Dorsey, & Sateia, 2008). Dans leur étude, Edinger et collègues (2013) ont examiné si les paramètres de sommeil dérivés de la PSG (c.-à-d., latence d’endormissement, durée des éveils en milieu de nuit, temps total de sommeil et efficacité du sommeil) permettaient de bien diagnostiquer les adultes souffrant d’insomnie de ceux sans insomnie (bons dormeurs). Les résultats ont montré que les paramètres dérivés de la PSG ne sont pas suffisamment sensibles (probabilité de poser un diagnostic d’insomnie après l’évaluation initiale lorsqu’il est présent) et spécifiques (probabilité de ne pas poser un diagnostic d’insomnie lorsqu’il n’est pas présent) pour diagnostiquer les adultes souffrant d’insomnie. Ainsi, les résultats de cette étude indiquent que la PSG ne serait pas utile pour opérationnaliser le diagnostic d’insomnie. Toutefois, Vgontzas et collaborateurs (2013) suggèrent que la durée du sommeil, évaluée à l’aide de la PSG, serait utile pour mesurer la présence d’une hyperactivation physiologique chez certains individus souffrant d’insomnie. La notion d’hyperactivation cognitive et physiologique est présente dans plusieurs modèles de l’insomnie, dont le modèle neurocognitif (Perlis, Giles, Mendelson, Bootzin, & Wyatt, 1997) et le modèle psychobiologique (Espie, 2002), afin d’expliquer le développement et le maintien des difficultés de sommeil nocturnes et des conséquences diurnes. L’hyperactivation physiologique réfère au corps (p. ex., augmentation du rythme cardiaque), alors que l’hyperactivation cognitive réfère aux processus mentaux (p. ex., inquiétudes et ruminations excessives au coucher). Le modèle neurocognitif (Perlis et al., 1997) explique la contribution de l’hyperactivation dans l’insomnie selon certaines variables neurobiologiques. Selon ce modèle, l’augmentation de l’activité corticale (c.-à-d., des bandes à haute fréquence beta de l’électroencéphalographie) lors de l’endormissement (Bastien, LeBlanc, Carrier, & Morin, 2003; St-Jean, Turcotte, Perusse, & Bastien, 2013) et l’association entre certains stimuli environnementaux reliés au sommeil (p. ex., le lit ou la chambre à coucher) susciteraient une activation corticale conditionnée. Chez les individus
sensorielle durant le sommeil et contribuerait possiblement à biaiser les perceptions concernant l’état du sommeil en créant l’illusion constante d’être entre l’éveil et le sommeil. Sur une période prolongée, l’activation corticale peut expliquer la tendance chez les individus ayant de l’insomnie à rapporter un temps éveillé supérieur et une durée du sommeil inférieure à l’évaluation par la PSG. En effet, plusieurs études ont montré qu’il existe une différence marquée entre les mesures objectives du sommeil, c’est-à-dire la PSG, et les estimations subjectives des difficultés de sommeil rapportées par un individu souffrant d’insomnie (Harvey & Tang, 2012).
Selon le modèle psychobiologique d’Espie (2002), les individus ayant de l’insomnie développeraient de la colère et de l’anxiété de performance par rapport à leur sommeil, ce qui affecterait leur capacité à désinhiber leur activation physiologique et cognitive et perturberait leur endormissement et/ou le maintien de leur sommeil. Ce modèle stipule donc que l’incapacité à diminuer l’activation physiologique et cognitive maintiendrait l’insomnie. Par exemple, les résultats d’une étude avec des individus souffrant d’insomnie ont révélé qu’un délai d’endormissement prolongé, évalué par l’actigraphie, était associé à la présence de ruminations concernant le sommeil et à l’anticipation d’une mauvaise nuit (Wicklow & Espie, 2000).
Durée du sommeil et insomnie
La durée du sommeil peut être subjective, c’est-à-dire estimée par la personne, ou elle peut être évaluée par des mesures objectives telles que la PSG. Récemment, Vgontzas et collaborateurs (2013) ont proposé un modèle théorique selon lequel les individus ayant de l’insomnie sont classés en deux phénotypes distincts : un phénotype caractérisé par une courte durée du sommeil et un autre associé à une durée dite normale du sommeil. La figure 1 illustre ce modèle. L’élaboration de ce modèle théorique provient des résultats d’une série d’études portant sur une cohorte de la population générale de la Pennsylvanie (Bixler, Vgontzas, Lin, Vela-Bueno, & Kales, 2002). Dans ces études, les participants souffrant d’insomnie doivent rapporter une plainte quant à la quantité et/ou la qualité de leur sommeil. En second lieu, ces participants sont classés en deux groupes distincts selon la durée de leur sommeil, mesurée objectivement par la PSG : les participants dormant moins de 6h et ceux dormant 6h et plus. Ainsi, un participant souffrant d’insomnie sera, tout de même, assigné au
sommeil objective et subjective. Les sections ci-dessous résument les données des études qui ont porté sur ce modèle théorique.
Courte durée du sommeil
Hyperactivation physiologique. Des études suggèrent que l’insomnie avec une courte durée du sommeil, évaluée objectivement, serait associée à un phénotype à prédominance biologique caractérisée par une hyperactivation physiologique. Par exemple, deux études mesurant diverses hormones liées au système de stress (c.-à-d., l’axe hypotalamo-pituitaire-surrénalien (HPS) et le système nerveux autonome) chez les individus souffrant d’insomnie ont montré que le taux de cortisol urinaire sur une période de 24h était positivement corrélé avec la durée totale d’éveils en milieu de nuit, mesurée par la PSG. Ces résultats suggèrent une association importante entre le cortisol et la sévérité des perturbations du sommeil (Vgontzas et al., 1998; Vgontzas et al., 2001). Récemment, des chercheurs se sont intéressés à la relation entre l’hyperactivation physiologique en journée, mesurée à l’aide du Test Itératif de Latence à l’Endormissement (TILE), et la durée du sommeil à la PSG chez les individus souffrant d’insomnie. Le TILE enregistre les données cérébrales afin de mesurer les stades de sommeil et la vigilance en journée. Les résultats au TILE ont montré que les individus avec une durée du sommeil de moins de 6h prennent significativement plus de temps à s’endormir, que ceux avec une durée du sommeil de plus de 6h (Roehrs, Randall, Harris, Maan, & Roth, 2011). Huang et collaborateurs (2012) ont aussi observé que les individus souffrant d’insomnie ayant un long délai d’endormissement au TILE (M = 17,58 min, SD = 1,99) rapportaient un temps total de sommeil à l’agenda et à la PSG significativement plus court que ceux ayant un délai d’endormissement plus court (M = 10,52 min, SD = 3,12). L’agenda du sommeil est une mesure subjective couramment utilisée dans le domaine de l’étude des troubles du sommeil permettant d’analyser le sommeil et l’hygiène du sommeil du participant sur une période prolongée. Les résultats des études de Roehrs et collaborateurs (2011) et de Huang et collègues (2012) suggèrent que les individus souffrant d’insomnie ayant une courte durée du sommeil présenteraient un état d’activation plus élevé durant la journée.
Certaines données suggèrent que l’insomnie avec une courte durée du sommeil serait associée à des déficits neurocognitifs pouvant s’expliquer par un état d’activation élevé en
comme la résolution de problèmes, la mémoire de travail, ainsi que la mémoire épisodique (Fortier-Brochu et al., 2012). Cependant, une étude issue de la cohorte de la Pennsylvanie a montré que seuls les individus ayant de l’insomnie et dormant peu présentent des déficits cognitifs. En effet, les individus souffrant d’insomnie avec une durée du sommeil de moins de 6h à la PSG ont de moins bons résultats aux tests neuropsychologiques évaluant la rapidité du traitement de l’information, l’attention divisée et la mémoire visuelle, que ceux avec une durée normale du sommeil sans déficit neurocognitif (Fernandez-Mendoza et al., 2010). Cette étude est la seule à établir une association entre l’insomnie avec une courte durée du sommeil et des déficits cognitifs. Ainsi, d’autres études seront nécessaires afin de confirmer ces résultats auprès d’autres cohortes de la population générale et d’évaluer si l’insomnie avec une courte durée du sommeil peut prédire la présence de déficits cognitifs.
Problèmes médicaux. Plusieurs études ont montré une association entre l’insomnie avec une courte durée du sommeil, mesurée objectivement, et des problèmes médicaux tels que l’hypertension, le diabète de type 2 et des altérations du système cardiovasculaire.
Hypertension. Les individus ayant de l’insomnie avec une durée du sommeil de moins de 6h à la PSG seraient près de quatre fois plus à risque de développer de l’hypertension, contrairement à ceux qui dorment 6h et plus (Fernandez-Mendoza et al., 2012). Ce risque demeure présent même après que différentes variables associées à l’insomnie et à l’hypertension aient été contrôlées. Selon les résultats de la méta-analyse de Meng, Zheng et Hui (2013), le risque d’incidence de l’hypertension serait de 1,05 fois plus élevé chez les individus rapportant des difficultés d’endormissement et de maintien du sommeil et de 1,21 fois plus élevé chez ceux rapportant une courte durée du sommeil, comparativement aux individus sans difficultés de sommeil. Récemment, Bathgate et collaborateurs (2015) ont confirmé ces résultats en montrant que les individus ayant de l’insomnie avec une courte durée du sommeil à la PSG étaient 3,59 fois plus à risque de rapporter de l’hypertension par comparaison à ceux avec une durée normale du sommeil à la PSG. Ce risque était observé même après que différentes variables associées à l’insomnie et à l’hypertension aient été contrôlées. De plus, dans cette étude, la relation entre la prévalence d’hypertension et la durée du sommeil a été examinée à l’aide de mesures objectives (deux nuits d’enregistrement PSG) et subjectives (deux semaines d’agenda du sommeil). Le risque d’hypertension n’était pas significativement plus élevé lorsque les participants étaient séparés
en sous-groupes selon la durée du sommeil perçue à l’agenda (Bathgate, Edinger, Wyatt, & Krystal, 2015).
Diabète de type 2 et morbidité cardiovasculaire. L’insomnie avec une courte durée du sommeil, mesurée objectivement, a aussi été associée à un risque accru de souffrir de diabète de type 2 (Mallon, Broman, & Hetta, 2005; Vasisht, Kessler, Booth, Imperial, & Penev, 2013; Vgontzas et al., 2009). Dans le cadre de leur étude, Vgontzas et collaborateurs (2009) ont observé que les individus rapportant de l’insomnie avec un temps total de sommeil de moins de 5h à la PSG avaient un risque environ trois fois plus élevé de souffrir de diabète de type 2, comparativement aux individus ayant de l’insomnie, mais dormant 6h et plus et à des bons dormeurs. Ce risque était deux fois plus élevé chez les personnes souffrant d’insomnie et dormant de 5 à 6h à la PSG. Toutefois, le devis transversal de cette étude ne permet pas de tirer des conclusions quant au risque de développer du diabète de type 2 chez les individus rapportant de l’insomnie avec une courte durée du sommeil. Les résultats d’une autre étude, menée auprès d’individus non diabétiques souffrant d’insomnie, ont montré que le taux de sécrétion d’insuline était moins élevé et le niveau d’insulinorésistance plus élevé chez ceux avec une durée du sommeil de 6h et moins à la PSG par comparaison à ceux avec une durée du sommeil de plus de 6h (Vasisht et al., 2013). Une diminution de la sécrétion d’insuline et une augmentation du niveau d’insulinorésistance précèdant généralement l’apparition du diabète de type 2, les résultats de Vasisht et collègues (2013) suggéreraient donc un risque plus élevé de développer ce trouble parmi les individus ayant de l’insomnie avec une courte durée du sommeil. Toutefois, les résultats d’une autre étude ont montré que les hommes (mais non les femmes), qui rapportent dormir 5h et moins avaient un risque significativement plus élevé (RR = 2,80) de développer du diabète sur une période de 12 ans (Mallon et al., 2005).
Dans le cadre de leur étude, Spiegelhalder et collaborateurs (2011) ont examiné l’association entre l’insomnie et les altérations du rythme cardiaque nocturne, de telles altérations étant soupçonnées être un facteur de risque de maladies cardiovasculaires chez l’adulte. Les individus ayant de l’insomnie avec une courte durée du sommeil (définie par une efficacité du sommeil de moins de 85% à la PSG) présentaient une altération de l’activité du système parasympathique, notamment une diminution de la fréquence des variations
cardiaques durant le sommeil. Cette altération n’a pas été retrouvée chez les individus ayant de l’insomnie, mais avec une durée normale du sommeil à la PSG, ni chez les bons dormeurs. En somme, l’ensemble des résultats suggère qu’il existe une association entre l’insomnie, une courte durée du sommeil à la PSG et le risque de maladies cardiovasculaires et de diabète de type 2. Des études longitudinales demeurent toutefois nécessaires afin d’examiner si l’insomnie et la durée du sommeil sont associées au développement d’autres maladies que l’hypertension. Ces études devraient également se pencher sur la nature de ces associations afin de tirer des conclusions plus précises concernant la relation de cause à effet entre les maladies cardiovasculaires et l’insomnie avec une courte durée du sommeil.
Mortalité. L’existence d’un lien entre l’insomnie avec une courte durée du sommeil et la mortalité a été proposée, mais celui-ci est moins clair. En effet, les résultats de la littérature proviennent d’un nombre limité d’études et sont contradictoires. Des données dérivées de la cohorte de la Pennsylvanie ont montré que le risque de mortalité est significativement augmenté chez les hommes (mais non les femmes) souffrant d’insomnie avec un temps de sommeil de moins de 6h à la PSG (RR = 4,00), contrairement à ceux dormant 6h et plus et aux bons dormeurs (Vgontzas et al., 2010). Dans cette étude longitudinale, les évaluations de suivi ont eu lieu 14 ans après l’évaluation initiale chez les hommes et 10 ans après chez les femmes. Selon les auteurs, cette différence de quatre ans au niveau du moment du suivi pourrait possiblement expliquer l’absence de résultats significatifs chez les femmes. Dans une autre étude, Kripke et collègues (2002) ont obtenu des résultats différents, suggérant une augmentation du risque de mortalité à la fois chez les individus rapportant une durée du sommeil de 6h et moins et ceux rapportant dormir 8h et plus et n’ont observé aucune association significative chez les individus souffrant d’insomnie. Toutefois, la durée du sommeil n’avait été mesurée que de manière subjective dans cette dernière étude, ce qui pourrait aussi expliquer cette divergence.
Dépression. Plusieurs travaux suggèrent que l’insomnie est associée à un risque élevé de développer une dépression majeure (Baglioni et al., 2011). Quelques études ont notamment examiné cette association en fonction de la durée du sommeil, mesurée objectivement. Dans le cadre de leur étude, Szklo-Coxe et collaborateurs (2010) ont évalué l’incidence de symptômes dépressifs sur quatre ans chez des individus sans symptôme dépressif à l’évaluation initiale, mais rapportant des difficultés de sommeil. Les résultats ont
montré que les individus ayant de l’insomnie avec une durée du sommeil de moins de 334 minutes à la PSG avaient un risque significativement plus élevé de dépression (RR = 3,18) quatre ans plus tard, comparativement à ceux ayant une durée du sommeil de 334 minutes et plus. Une autre étude a examiné l’incidence de la dépression sur 7,5 ans chez des individus souffrant d’insomnie, mais qui ne rapportaient pas souffrir ou avoir souffert de dépression à l’évaluation initiale (Fernandez-Mendoza et al., 2015). Comparativement aux bons dormeurs, les participants ayant de l’insomnie avec une durée du sommeil de moins de 6h à la PSG et ceux avec une durée du sommeil 6h et plus avaient un risque de dépression significativement plus élevé (RR = 2,81 et 1,80, respectivement). Après le contrôle de différentes variables psychologiques associées à la dépression (c.-à-d., la consommation d’alcool et de drogues, les tentatives de suicide passées, les symptômes dépressifs et l’utilisation de mauvaises stratégies de gestion du stress), la proportion d’individus à risque de dépression demeurait significativement plus élevé uniquement dans le groupe ayant de l’insomnie avec une courte durée du sommeil (24.1 %). Les résultats de cette étude suggèrent que l’association entre l’insomnie avec une courte durée du sommeil et l’incidence de la dépression serait indépendante de certaines variables prédisposant à la dépression, alors que l’association entre l’insomnie avec une durée normale du sommeil et l’incidence de la dépression serait influencée par ces variables (Fernandez-Mendoza et al., 2015). Néanmoins, certaines limites méthodologiques ont pu affecter l’interprétation des résultats de ces études (Fernandez-Mendoza et al., 2015; Szklo-Coxe et al., 2012). Par exemple, la dépression était évaluée uniquement à l’aide d’une question auto-rapportée, ce qui peut avoir surestimé le nombre de participants souffrant de ce trouble. Ainsi, davantage d’études demeurent nécessaires afin de reproduire ces résultats et de mieux comprendre l’association entre la dépression, l’insomnie et la durée objective du sommeil.
Durée normale du sommeil
Quelques études suggèrent que l’insomnie avec une durée normale du sommeil de 6h et plus à la PSG serait caractérisée par une mauvaise perception du sommeil. Dans leur étude, Fernandez-Mendoza et collaborateurs (2011) ont examiné l’association entre la durée du sommeil, mesurée objectivement, le profil psychologique à l’Inventaire Multiphasique de la Personnalité du Minnesota-2 (MMPI-2) et la perception du sommeil. Parmi les participants
et plus à la PSG sous-estimaient la durée de leur sommeil, comparativement à 15,3 % de ceux qui avaient une durée du sommeil de moins de 6h. La sous-estimation de la durée du sommeil était définie par une différence d’une heure et plus entre l’estimation subjective et la mesure objective. De plus, les individus qui sous-estimaient la durée de leur sommeil avaient un profil au MMPI-2 caractérisé par une humeur dépressive, des ruminations, de l’anxiété et rapportaient utiliser des stratégies inadéquates de gestion du stress. Les résultats de Fernandez-Mendoza et collègues (2011) sont cohérents avec ceux d’autres études qui ont montré que les individus ayant de l’insomnie et une perception erronée de leur sommeil rapportaient souffrir d’anxiété et avaient des inquiétudes excessives concernant leur sommeil (Harvey, 2002; Harvey & Tang, 2012). Une autre étude menée auprès d’individus souffrant d’insomnie a révélé que les participants ayant une durée normale du sommeil, c’est-à-dire de plus de 6,5h à la PSG, rapportaient des difficultés d’endormissement et des perturbations du fonctionnement diurne plus sévères et étaient plus insatisfaits de leur sommeil que ceux ayant une courte durée du sommeil (Jarrin, Rochefort, Lamy, Ivers, & Morin, 2014). L’étude de Fernandez-Mendoza et collègues (2011) est la seule étude à observer une association entre l’insomnie avec une durée normale du sommeil et une mauvaise perception du sommeil. Ainsi, d’autres études seront nécessaires afin de reproduire ces résultats et de mieux comprendre cette association.
Dans l’ensemble, la durée du sommeil, mesurée objectivement, permettrait d’identifier une présentation clinique distinguant les individus souffrant d’insomnie avec une courte ou une durée normale du sommeil. Les problèmes médicaux associés au phénotype avec une courte durée du sommeil suggèrent que ce dernier pourrait être un marqueur biologique de la sévérité de l’insomnie tandis que l’insomnie avec une durée normale du sommeil aurait davantage de racines psychologiques. Par exemple, ces individus auraient une perception erronée de la durée de leur sommeil. Si nous poussons le raisonnement plus loin, la classification de l’insomnie en phénotypes permettrait possiblement d’identifier quel traitement pourrait être le plus ciblé selon la présentation clinique de la personne souffrant d’insomnie (Morin & Benca, 2012).
Traitements de l’insomnie
interventions privilégiées pour traiter l’insomnie (NIH, 2005). La thérapie cognitive-comportementale pour l’insomnie (TCC-I) consiste à modifier les facteurs comportementaux (p. ex., horaire de sommeil irrégulier, temps excessif passé au lit), psychologiques (p. ex., inquiétudes excessives et croyances erronées concernant le sommeil) et physiologiques (p. ex., hyperactivation) qui maintiennent l’insomnie (Morin & Benca, 2012). Plusieurs études suggèrent que la TCC-I permettrait de réduire la latence d’endormissement, la durée des éveils en milieu de nuit et qu’elle améliorerait la qualité du sommeil. Au niveau du fonctionnement diurne, les individus souffrant d’insomnie ayant reçu la TCC-I rapporteraient une diminution significative de la fatigue et une amélioration de la qualité de vie (Harvey et al., 2014; Smith et al., 2002; van Straten et al., 2017). Quant à la pharmacothérapie, les résultats d’une méta-analyse ont montré que les benzodiazépines et les hypnotiques (zolpidem et zolpiclone) amélioreraient la qualité du sommeil en diminuant la latence d’endormissement et en augmentant la durée du sommeil (Holbrook, Crowther, Lotter, Cheng, & King, 2000; Sateia, Buysse, Krystal, Neubauer, & Heald, 2017; Smith et al., 2002). Certaines études suggèrent qu’un traitement combinant la TCC-I à une médication pourrait possiblement optimiser les effets bénéfiques sur le sommeil. Dans le cadre de leur étude, Morin et collaborateurs (2014) ont examiné la trajectoire et l’ampleur des changements du sommeil suite au traitement de l’insomnie par la TCC-I ou la TCC-I combinée à une médication (zolpidem, 10 mg). Les changements au niveau des paramètres du sommeil étaient évalués à l’aide de l’agenda complété quotidiennement pendant les six semaines de traitement. Les participants dans la condition TCC-I combinée ont rapportés une amélioration de leur sommeil (une diminution de la latence d’endormissement, de la durée des éveils en milieu de nuit, ainsi qu’une amélioration de la qualité du sommeil), significativement plus rapide (une semaine après le début du traitement) que les participants dans la condition TCC-I seule (deux à trois semaines après le début du traitement). Les résultats ont toutefois montré que la durée du sommeil ne changeait pas de façon significative. En somme, les résultats suggèrent que, comparativement à la TCC-I seule, la TCC-I combinée permettrait une amélioration plus rapide de certains paramètres du sommeil, sans toutefois influencer la durée du sommeil. Une autre étude (Vallières, Morin, & Guay, 2005), menée auprès de 17 individus ayant de l’insomnie, a évalué l’efficacité de différentes séquences de traitements combinant
suivantes : (a) médication pendant cinq semaines, suivi par cinq semaines additionnelles de traitement combiné; (b) traitement combiné pendant cinq semaines, suivi par la TCC-I administrée seule; ou (c) TCC-I administrée seule. Les auteurs ont observé que la séquence de traitement combiné, suivi par la TCC-I administrée seule était associée à une amélioration du sommeil significativement plus rapide et avait peu d’impacts négatifs sur la durée du sommeil due à la restriction du temps au lit par comparaison aux autres séquences de traitement. Ces résultats doivent cependant être interprétés avec précaution, étant donné le nombre restreint de participants dans cette étude.
Traitement de l’insomnie et durée du sommeil
À la lumière des résultats présentés, il est possible de penser que la classification de l’insomnie en fonction de la durée du sommeil, mesurée objectivement, pourrait permettre d’orienter les individus souffrant d’insomnie vers le traitement le plus ciblé. Les individus souffrant d’insomnie avec une courte durée du sommeil pourraient répondre favorablement aux traitements pharmacologiques dont l’objectif principal serait de diminuer l’hyperactivation physiologique et d’augmenter la durée du sommeil. Par exemple, l’utilisation, à faible dose, d’antidépresseurs tels que la doxepine et la trazodone, permettrait de réduire l’activité de l’axe HPS et la concentration de cortisol, deux manifestations associées à l’hyperactivation physiologique (Monteleone, 1991; Rodenbeck et al., 2003). De plus, chez les individus souffrant d’insomnie, la prise d’hypnotiques, de la catégorie des benzodiazépines ou des non-benzodiazépines tels que zolpidem, est associée à une augmentation de la durée du sommeil mesurée par l’agenda du sommeil (Holbrook et al., 2000; Perlis, McCall, Krystal, & Walsh, 2004; Smith et al., 2002; Winkler, Doering, & Rief, 2014).
Considérant les résultats de quelques études suggérant une association entre l’insomnie avec une durée normale du sommeil et la mauvaise perception du sommeil (Fernandez-Mendoza et al., 2011; Jarrin et al., 2014), il est possible de penser que ces individus répondraient favorablement à la TCC-I. Des études portant sur l’efficacité de la TCC-I ont montré qu’à la suite de la thérapie, les participants souffrant d’insomnie rapportaient une diminution significative de leur niveau d’activation cognitive et physiologique sur différentes mesures auto-rapportées (Galuszko-Wegielnik,
Jakuszkowiak-Deng, & Long, 2006) et ils endossaient moins de fausses croyances concernant le sommeil (Morin, Blais, & Savard, 2002). Il serait donc pertinent d’examiner s’il y a une association entre la durée du sommeil, mesurée objectivement, et la réponse thérapeutique.
Les résultats de trois études suggèrent une association entre la courte durée du sommeil, mesurée objectivement, et une moins bonne réponse thérapeutique (Bathgate, Edinger, & Krystal, 2017; Troxel, Conrad, Germain, & Buysse, 2013; Troxel et al., 2012). La première étude (Troxel et al., 2012), une méta-analyse incluant 711 patients provenant de six essais contrôlés randomisés, porte sur l’effet confondant de différentes variables du sommeil sur la rémission de la dépression suite à un traitement pharmacologique, psychologique ou combinant les deux modalités. Les auteurs ont observé que les individus qui rapportaient souffrir d’insomnie avec une durée du sommeil de 6h et moins à la PSG avaient un risque significativement élevé de ne pas être en rémission dans les trois conditions de traitement. Toutefois, dans cette étude, aucun questionnaire mesurant spécifiquement le sommeil n’a été utilisé pour identifier les participants souffrant d’insomnie. Les symptômes d’insomnie étaient mesurés par des items provenant de questionnaires sur l’humeur dépressive.
Une deuxième étude a examiné les prédicteurs de la réponse thérapeutique chez 39 participants âgés souffrant d’insomnie ayant reçu une forme abrégée de thérapie comportementale de l’insomnie (Troxel et al., 2013) pour n’inclure que le contrôle des stimuli et la restriction du temps au lit. Les résultats ont montré qu’une plus grande proportion de participants avec une durée normale du sommeil à l’évaluation initiale (c.-à-d., temps total de sommeil de plus de 6h à la PSG et à l’agenda du sommeil) était en rémission, comparativement aux participants dormant 6h et moins. Plus spécifiquement, le groupe avec une courte durée du sommeil était 4,8 fois plus à risque de ne pas atteindre le critère de rémission (défini par un score de moins de 5 à l’Index de Qualité du sommeil de Pittsburg) lorsque la durée du sommeil était évaluée à l’aide de la PSG et 8,1 fois plus à risque lorsqu’elle était rapportée à l’agenda du sommeil, comparativement au groupe avec une durée normale du sommeil. Ces résultats suggèrent que les individus ayant une courte durée du sommeil répondraient moins bien à un traitement comportemental qui utilise la restriction du temps au lit comme principale composante thérapeutique. Toutefois, l’âge moyen des
participants de cette étude était de 72,54 ans (ÉT = 6,61), ce qui diminue la possibilité de généraliser les résultats à des adultes plus jeunes.
Deux autres études ont examiné l’efficacité de la TCC-I chez des individus souffrant d’insomnie assignés à deux sous-groupes selon la durée de leur sommeil, mesurée objectivement à l’évaluation initiale : soit moins de 6h ou 6h et plus (Bathgate et al., 2017; Lovato, Lack, & Kennaway, 2016). Les résultats de ces études sont contradictoires. Alors que les résultats de l’étude de Bathgate et collègues (2017) ont révélé qu’au post-traitement et 6 mois après la fin du traitement les participants ayant une durée normale du sommeil rapportaient une diminution de la durée des éveils en milieu de nuit et une amélioration de l’efficacité de leur sommeil significativement plus grandes que ceux ayant une courte durée du sommeil, ceux de l’étude menée par Lovato et collègues (2016) ont montré qu’au post-traitement et au suivi de 3 mois, les participants dans les deux groupes (c.-à-d., courte durée et durée normale) rapportaient une diminution significative de la durée des éveils en milieu de nuit et une amélioration de l’efficacité de leur sommeil. Dans l’étude de Lovato et collègues (2016), les participants dans les deux groupes rapportaient également une diminution significative de la sévérité de leurs syptômes d’insomnie, de leur niveau de fatigue, de somnolence, des croyances et attitudes dysfonctionnelles concernant le sommeil et rapportaient une amélioration de leur sentiment d’efficacité personnelle par rapport au sommeil. Néanmoins, aucune différence significative dans la réponse thérapeutique entre le groupe avec une courte durée du sommeil et celui avec une durée normale du sommeil n’a été observée.
En somme, malgré des résultats limités et parfois contradictoires, des données suggèrent que la durée du sommeil, mesurée objectivement, pourrait influencer la réponse thérapeutique au traitement de l’insomnie (Bathgate et al., 2017; Troxel et al., 2013; Troxel et al., 2012). Néanmoins, aucune étude n’a comparé la réponse thérapeutique aux différents traitements de l’insomnie (c.-à-d., pharmacothérapie, TCC-I ou une combinaison des deux interventions) chez les individus souffrant d’insomnie en fonction de la durée de leur sommeil. Trois études (Bathghate et al., 2015; Lovato et al., 2016; Troxel et al., 2013) ont examiné la réponse thérapeutique suite à un traitement psychologique (c.-à-d., comportemental et TCC-I) chez des individus ayant de l’insomnie avec une courte durée du sommeil et ceux avec une durée normale du sommeil à la PSG. Dans l’étude de Troxel et
collègues (2013), la rémission de l’insomnie était mesurée par un questionnaire général sur le sommeil qui ne permet pas d’évaluer spécifiquement les changements dans la sévérité du trouble. Finalement, les résultats de l’étude de Troxel et collègues (2012) sont peu généralisables aux individus ayant de l’insomnie, puisque l’échantillon incluait des individus souffrant de dépression et d’insomnie sous-jacente.
Problématique
L’insomnie est très fréquente dans la population générale et la demande de traitement est grandissante. Malgré l’efficacité reconnue de la TCC-I et de la médication pour traiter l’insomnie, plusieurs facteurs pouvant influencer la réponse thérapeutique sont à examiner. L’un de ces facteurs est la durée du sommeil, et particulièrement lorsqu’elle est mesurée objectivement. Récemment, Vgontzas et collègues (2013) ont proposé l’existence de deux phénotypes distincts d’insomnie : l’insomnie avec une courte durée du sommeil, mesurée à l’aide de la PSG, et l’insomnie avec une durée normale du sommeil, également mesurée par la PSG. Selon ces auteurs, l’insomnie avec une courte durée du sommeil serait associée à un état d’hyperactivation physiologique et à une augmentation du risque de morbidité médicale. Par comparaison, l’insomnie avec une durée normale du sommeil serait caractérisée par une perception erronée du sommeil, de mauvaises stratégies de gestion du stress, de l’anxiété et une humeur dépressive. En raison des particularités propres à chaque phénotype, il est plausible que la réponse aux traitements de l’insomnie diffère selon le phénotype. Toutefois, la littérature disponible sur ce sujet est restreinte et aucune étude n’a examiné directement cette hypothèse.
Le présent projet vise donc à examiner l’influence possible de la durée du sommeil initiale sur la présentation clinique de l’insomnie et la réponse thérapeutique à une TCC-I administrée seule ou en combinaison avec une médication (TCC-I+Med). Les participants souffrant d’insomnie ont été assignés à quatre groupes en fonction de la durée de leur sommeil initiale, mesurée par la PSG, et du traitement qu’ils ont reçu : les participants avec une courte durée du sommeil de 6h et moins traités par la TCC-I ou la TCC-I+Med et les participants avec une durée normale du sommeil de plus de 6h traités par la TCC-I ou la TCC-I+Med. Le projet comporte deux objectifs et trois hypothèses de travail.
Objectifs et hypothèses
Un premier objectif de cette étude est de documenter la perception des symptômes d’insomnie et de leurs conséquences sur le fonctionnement diurne chez des individus ayant de l’insomnie avec une courte durée du sommeil à la PSG et ceux avec une durée normale du sommeil.
Hypothèse 1 : Les individus ayant de l’insomnie avec une durée normale du sommeil à la PSG rapporteront des symptômes d’insomnie plus sévères que les individus avec une courte durée du sommeil à la PSG.
Hypothèse 2 : Les individus ayant de l’insomnie avec une durée normale du sommeil à la PSG rapporteront des symptômes dépressifs et anxieux, de même qu’un niveau de fatigue plus élevés, et ils endosseront plus fortement les croyances dysfonctionnelles concernant le sommeil que les individus avec une courte durée du sommeil à la PSG.
Le deuxième et principal objectif de l’étude vise à évaluer l’influence possible de la durée du sommeil initiale, évaluée à la PSG, sur la réponse thérapeutique à la TCC-I et à la TCC-I+Med.
Hypothèse 1 : Indépendamment de la condition de traitement, les individus ayant de l’insomnie avec une durée normale du sommeil à la PSG rapporteront une plus grande diminution de leurs symptômes d’insomnie, évalués à l’agenda et à l’ISI, que les individus avec une courte durée du sommeil à la PSG. Les individus avec une durée normale du sommeil à la PSG rapporteront aussi une plus grande diminution de leurs symptômes dépressifs et anxieux, de leur niveau de fatigue et de leurs croyances dysfonctionnelles concernant le sommeil que les individus avec une courte durée du sommeil à la PSG.
Hypothèse 2 : Parmi les individus ayant de l’insomnie avec courte durée du sommeil à la PSG, ceux ayant reçu la TCC-I+Med rapporteront une plus grande diminution de leurs symptômes d’insomnie, dépressifs et anxieux, de leur niveau de fatigue et de leurs croyances dysfonctionnelles concernant le sommeil que ceux ayant reçu la TCC-I seule.
Insomnia Treatment Response as a Function of Objectively Measured Sleep Duration
Amélie Rochefort, B.A., Denise C. Jarrin, Ph.D., Lynda Bélanger Ph.D., Hans Ivers, Ph.D., and Charles M. Morin, Ph.D.
Résumé
Malgré l’efficacité reconnue de la thérapie cognitive-comportementale et de la pharmacothérapie pour traiter l’insomnie, les individus souffrant d’insomnie ne bénéficient pas tous de ces interventions. L’objectif principal du mémoire était d’examiner la relation possible entre la durée du sommeil, mesurée objectivement avant le traitement, et la réponse à une thérapie cognitive-comportementale pour l’insomnie (TCC-I), administrée seule ou combinée à la médication (TCC-I+Med). Un objectif secondaire était de documenter la présentation clinique des participants avec une durée normale ou courte du sommeil. Les données utilisées pour répondre à ces objectifs étaient issues d’une étude contrôlée randomisée, menée entre 2002 et 2005, dans la région de Québec. Pour les besoins du mémoire, 159 participants (Mâge = 50,31, ET = 10,14 ; 61,0 % femmes) ont été assignés à l’un des quatre groupes déterminés selon : (1) la durée de leur sommeil tel qu’enregistrée à la polysomnographie et (2) le traitement qu’ils avaient reçu. Ainsi, les groupes suivants ont été formés : les participants avec une durée normale du sommeil (c.-à-d., > 6h) ayant reçu une TCC-I (n = 54) ou une TCC-I+Med (n = 54) et ceux avec une courte durée du sommeil (c.-à-d., ≤ 6h) ayant reçu une TCC-I (n = 26) ou une TCC-I+Med (n = 25). Aucune différence significative entre le groupe avec une durée normale du sommeil et celui avec une courte durée du sommeil en ce qui concerne les variables sociodémographiques, psychologiques et la sévérité des symptômes d’insomnie n’a été observée avant le traitement. Indépendamment du traitement, les participants avec une courte durée du sommeil avant le traitement avaient eu une réduction de la durée des éveils en milieu de nuit et une augmentation de l’efficacité du sommeil significativement plus importantes que ceux avec une durée normale du sommeil. Cependant, ces mêmes participants étaient significativement plus insatisfaits de leur sommeil et rapportaient davantage de conséquences diurnes que ceux avec une durée normale du sommeil. Ces résultats suggèrent que la durée du sommeil recueillie avant le traitement n’influencerait pas la réponse thérapeutique en ce qui a trait aux variables de sommeil, mais elle influencerait les mesures de satisfaction du sommeil et du fonctionnement diurne. Compte tenu de ces résultats plutôt mitigés, d’autres études seront nécessaires pour clarifier le lien possible entre la durée objective du sommeil et la réponse thérapeutique. Des résultats plus concluants permettraient d’orienter les individus souffrant d’insomnie vers un traitement
Abstract
Cognitive behavioral therapy (CBT-I) and pharmacotherapy have been recommended as evidence-based interventions for insomnia. However, there has been limited research investigating potential moderators of treatment response in adults treated with these interventions. The present study examined the potential moderating effect of objectively measured sleep duration at baseline on the response to CBT-I, administered singly or combined with medication (CBT-I+Med) for treating insomnia. A secondary objective was to compare individuals with short sleep duration with those presenting normal sleep duration on baseline measures of subjective sleep disturbances, insomnia severity, and psychological symptoms. Data were derived from a clinical trial conducted between 2002 to 2005 in the Québec City area. Based on the type of treatment received and average PSG-derived sleep duration across two baseline assessment nights, 159 insomnia participants (Mage = 50.31, SD = 10.14; 61.0% women) were classified into one of four groups: participants with insomnia and short sleep duration (i.e., ≤ 6h) treated with CBT-I (n = 26) or CBT-I+Med (n = 25) and participants with normal sleep duration (i.e., > 6h) treated with CBT-I (n = 54) or CBT-I+Med (n = 54). There were no significant baseline differences between participants with short and those with normal sleep durations on socio-demographic variables, insomnia severity, and psychological symptoms. Irrespective of treatment received, participants with short sleep duration exhibited significantly greater improvements in sleep (i.e., reduced wake after sleep onset and increased sleep efficiency) relative to those with normal sleep duration. However, participants with short sleep duration exhibited significantly smaller improvements relative to those with normal sleep duration on measures of sleep satisfaction and daytime symptoms. Globally, there was no moderating effect of baseline sleep duration on the treatment response as measured by sleep parameters, but there was a differential treatment response on some daytime functioning outcomes. Further investigation on how sleep duration impacts treatment response is warranted in order to develop more targeted insomnia treatments as a function of baseline sleep duration.
Insomnia Treatment Response as a Function of Objectively Measured Sleep Duration Insomnia is a common complaint, affecting between 6% and 10% of adults in the general population (Morin, LeBlanc, Daley, Grégoire, & Mérette, 2006; Ohayon, 2002). Insomnia is characterized by subjective difficulties initiating or maintaining sleep and is associated with significant distress or impairments in daytime functioning that occur despite adequate opportunity for sleep (American Academy of Sleep Medicine [AASM], 2014; American Psychiatric Association [APA], 2013). Sleep difficulties can also be assessed by objective measures such as polysomnography (PSG). Although PSG assessment is not recommended for the routine evaluation of insomnia (Littner et al., 2003; Schutte-Rodin, Broch, Buysse, Dorsey, & Sateia, 2008), recent findings suggest that objective measures derived from PSG, particularly sleep duration, may be useful for identifying subtypes of insomnia. PSG-derived sleep duration appears to be helpful in detecting physiological indices of hyperarousal, which is a core feature of insomnia disorder (Vgontzas, Fernandez-Mendoza, Liao, & Bixler, 2013).
Vgontzas and colleagues (2013) have suggested two phenotypes of insomnia based on objectively measured sleep duration, including insomnia with short sleep duration (i.e., < 6 hours) and insomnia with normal sleep duration (i.e., ≥ 6 hours). Previous studies have shown that insomnia with objective short sleep duration is more biologically rooted, as evidenced by indices of physiological activation (e.g., increased activity of the hypothalamic-pituitary-adrenal axis and vigilance during the day) (Huang, Zhou, Li, Lei, & Tang, 2012; Roehrs, Randall, Harris, Maan, & Roth, 2011; Vgontzas et al., 1998; Vgontzas et al., 2001), increased risk of cardiovascular morbidity (e.g., type 2 diabetes, hypertension) (Bathgate, Edinger, Wyatt, & Krystal, 2015; Fernandez-Mendoza et al., 2012; Meng, Zheng, & Hui, 2013; Vasisht, Kessler, Booth, Imperial, & Penev, 2013; Vgontzas et al., 2009), and cognitive deficits (e.g., reduced processing speed and set-switching attention, higher visual memory errors and omissions) (Fernandez-Mendoza et al., 2010). In contrast, insomnia with objective normal sleep duration is neither associated with physiological activation nor with significant medical morbidity. Rather, it is associated with more psychologically rooted factors characterized by eleveted depressive and anxiety symptoms, with poorer stress-related coping strategies, and with a tendency to underestimate sleep duration (Fernandez-Mendoza
tend to report more worries about falling asleep, greater distress and interference of sleep difficulties with daytime functioning, and lower sleep satisfaction than individuals with insomnia and objective short sleep duration (Jarrin, Rochefort, Lamy, Ivers, & Morin, 2014). Should these two insomnia phenotypes proved to be valid, they could be particulary useful in matching treatment modality (drug vs. psychological) to the clinical presentation of individuals with insomnia.
There are two evidence-based interventions for insomnia, including cognitive behavioral therapy and pharmacotherapy (National Institute of Health [NIH], 2005). Cognitive behavioral therapy for insomnia (CBT-I) is a multi-modal intervention that encompasses cognitive (e.g., cognitive restructuring) and behavioral components (e.g., stimulus control, sleep restriction, and relaxation training) (Edinger & Means, 2005; Morin & Espie, 2003). The most widely used pharmacological treatments for insomnia are benzodiazepine receptor agonists, including benzodiazepines (e.g., temazepam) and newer non-benzodiazepine agents (e.g., zolpidem) (Krystal, 2009). These agents exert general inhibitory effects on the brain and work rapidly to alleviate insomnia symptoms (Holbrook, Crowther, Lotter, Cheng, & King, 2000; Smith et al., 2002). Meta-analyses indicate that pharmacotherapy produces small to moderate effet sizes on several sleep parameters, and CBT-I produces moderate to large effect sizes. Pharmacotherapy having an advantage in increase sleep duration and diminish number of awakenings, whereas CBT-I produces larger effects on sleep onset latency and wake after sleep onset (Sateia, Buysse, Krystal, Neubauer, & Heald, 2017; Smith et al., 2002; van Straten et al., 2017).
Considering the unique profile of each insomnia phenotype, it is possible that the therapeutic response may differ depending on whether psychological and pharmacological therapies are used. Individuals with insomnia and short sleep duration, a biologically rooted phenotype, may respond better to interventions that diminish physiological activation and increase sleep duration. For instance, the use of a low dose of antidepressants (i.e., doxepin, trazodone) may reduce the physiological activation by diminishing the hypothalamic-pituitary-adrenal axis’ activity (Monteleone, 1991; Rodenbeck et al., 2003). Several hypnotic agents, in the class of benzodiazepines or non-benzodiazepines, such as zolpidem, produce significant improvement in total sleep time (Holbrook, et al., 2000; Smith et al., 2002; Winkler, Doering, & Rief, 2014). On the other hand, given the psychological profile of
individuals with insomnia and normal sleep duration (i.e., sleep misperception and ruminations about sleep), they may respond better to CBT-I. CBT-I improves the thoughts, attitudes, and beliefs about sleep (Morin, Blais, & Savard, 2002) and helps to decrease perceived cognitive and physiological activation (Galuszko-Wegielnik, Jakuszkowiak-Wojten, Wiglusz, Cubala, & Landowski, 2012; Vincent & Lewycky, 2009; Wu, Bao, Zhang, Deng, & Long, 2006).
To the best of our knowledge, only three studies have examined the association between objective sleep duration and response to treatment for insomnia, and the results have been inconsistent. A study examined predictors of treatment response to brief behavioral treatment for insomnia (i.e., stimulus control and sleep restriction) in 39 older adults (Troxel, Conrad, Germain, & Buysse, 2013). The results showed a poorer treatment response among participants with short sleep duration as defined by 6 hours or less of sleep on PSG and sleep diary, than those with normal sleep duration (i.e., > 6 hours). Follow-up assessment (4 weeks) showed an increased odds of non-remission following treatment among participants with insomnia and short sleep duration as measured by PSG (OR = 4.8; 95% CI: 1.04-21.79) and by sleep diary (OR = 8.05; 95% CI: 1.70-38.1).
Two additional studies have examined the treatment response to CBT-I, one including 60 adults (Bathgate, Edinger, & Krystal, 2017) and another that included 63 older adults (Lovato, Lack, & Kennaway, 2016). Both samples were split into two subgroups based on pre-treatment average sleep duration measured by actigraphy or PSG: participants with short sleep duration (i.e., < 6 hours) and those with normal sleep duration (i.e., ≥ 6 hours). The results of Bathgate and colleagues (2017) indicated that at post-treatment and six month after treatment, participants with normal sleep duration achieved significantly better outcomes according to sleep diary (i.e., sleep efficiency ≥ 85% and ≥ 50% reduction in total wake time) and had higher rates of insomnia symptoms remission, compared to those with short sleep duration. Conversely, Lovato and colleagues (2016) found that therapeutic benefits following CBT-I were comparable between the two sleep duration groups at post-treatment and at the three month follow-up. Participants with either short or normal sleep durations achieved significant reductions in wake after sleep onset, increased sleep efficiency, reductions of insomnia severity, fatigue, sleepiness, dysfunctional beliefs and attitudes about sleep, and an
Despite inconsistent results, these studies suggest that objective short sleep duration is associated with poorer treatment response to brief behavioral treatment for insomnia (Troxel, et al., 2013), and CBT-I (Bathgate et al., 2017). However, no study to date has examined whether the therapeutic response to insomnia treatments (i.e., pharmacotherapy, CBT-I or a combination) differs across individuals with insomnia and objective short or normal sleep duration. Also, the type of objective measures used to estimate sleep duration differ considerably across studies, which makes comparisons across studies difficult. Some studies used actigraphy (Bathgate et al., 2017) and others used one night of in-home PSG (Lovato et al., 2016; Troxel et al., 2013).
The aim of the present study was to examine treatment response as a function of baseline objective sleep duration among participants with insomnia treated with CBT-I, administered singly or combined with medication (i.e., zolpidem; CBT-I+Med). It was posited that individuals with insomnia and objective normal sleep duration would show greater improvements on sleep and daytime functioning than those with objective short sleep duration, independent of the treatment received. Also, among individuals with insomnia and objective short sleep duration, the subgroup treated with CBT-I+Med was expected to show greater improvements on sleep and daytime functioning than those treated with CBT-I only.
A second objective was to compare baseline subjective sleep disturbances (as measured by sleep diary), insomnia severity and psychological disturbances (e.g., depressive, fatigue and anxiety symptoms, and beliefs about sleep) among individuals with insomnia and objective short sleep duration or normal sleep duration. It was posited that insomnia symptoms and impairment of daytime functioning would be more severe among individuals with insomnia and objective normal sleep duration than those with short sleep duration.
Method
This study reports secondary analyses of data extracted from a larger clinical trial examining the impact of different treatment sequences using CBT-I, singly and combined with zolpidem, throughout 6- and 12-month periods. The present study focuses specifically on changes during the first 6-week treatment phase. Study participants, procedures and results pertaining to the primary research questions have been described in more details elsewhere (Morin et al., 2009). The Institutional Research Board of Ethics from the Institut
Participants and Study Design
Participants were recruited between 2002 to 2005 through newspaper advertisements and referrals from health care practitioners in the Québec City area. All participants were 30 years or older and diagnosed with chronic insomnia based on a combination of criteria from the Diagnostic and Statistical Manuel of Mental Disorder, 4th edition [DSM-IV] (APA, 2000) and the International Classification of Sleep Disorders, 2nd edition [ICSD-II] (AASM, 2005). These criteria were further operationalized as: (1) difficulties initiating and/or maintaining sleep, defined as a sleep onset latency (SOL) and/or wake after sleep onset (WASO) greater than 30 min, with a corresponding total sleep time (TST) shorter than 6.5 hours at least three nights per week (as measured by daily sleep diaries); (2) insomnia duration longer than six months; and (3) significant distress or impairment in daytime functioning on item 5 of the ISI (rating ≥ 2 on a scale from 0 to 4).
Exclusion criteria were: (1) presence of a progressive medical illness (e.g., cancer, dementia) directly related to the onset and course of insomnia; (2) use of medications known to alter sleep (e.g., steroids); (3) lifetime diagnosis of any psychotic or bipolar disorder; (4) current diagnosis of major depression, unless treated and in remission; (5) more than two past episodes of major depression; (6) history of suicide attempt; (7) alcohol or drug abuse within the past year; (8) sleep apnea (apnea/hypopnea index >15), restless legs, or periodic limb movements during sleep (movement index with arousal >15 per hour); or (9) night-shift work or irregular sleep pattern. Participants with stable medical conditions (e. g., hypertension) or psychiatric disorders (e.g., dysthymia, anxiety) were included in the study provided that these conditions were not the primary cause of insomnia. Individuals using prescribed or over-the-counter sleep medications no more than twice weekly were enrolled after they withdrew from medications. Individuals using alcohol as a sleep aid were required to discontinue this practice at least two weeks prior to the baseline assessment.
Following a telephone screening interview for eligibility, individuals completed two weeks of sleep diaries and were invited for a baseline assessment. Eligible participants (N = 160) were randomized to CBT-I alone (n = 80) or combined CBT-I with zolpidem (CBT/Med; n = 80). Randomization was based on a computer-generated random allocation schedule. Participants in both conditions received six weekly 90-minutes CBT-I
group-therapy sessions conducted by a psychologist. Participants in the CBT/Med condition had brief weekly consultation sessions with a primary care physician. After completing the 6-week initial treatment, they were randomized a second time to an extended treatment for the next six months. Assessments were conducted at baseline, at the end of the 6-week initial treatment phase (post-I), at the end of the 6-month extended treatment phase (post-II), and at follow-up. The present study focuses solely on the initial treatment phase (i.e., baseline to post-I).
Measures
Screening Instruments. Participants completed a baseline assessment that included a structured clinical interview for insomnia, mental health, and medical conditions. The Insomnia Interview Schedule (Morin, 1993) is a semi-structured interview assessing the nature, severity, and frequency of the current insomnia problem, and its history. The Duke Structured Interview for Sleep Disorders (Edinger et al., 2004) was used to evaluate the presence of various sleep disorders. This instrument has acceptable reliability and discriminant validity (Edinger et al., 2009). Mental health was evaluated by the Structured Clinical Interview for DSM-IV Axis I Disorders (First, Spitzer, Gibbon, & Williams, 2002). The Folstein Mini-Mental State Exam (Folstein, Folstein, & McHugh, 1975) was administered to exclude participants with cognitive deficits (score < 27) that could made them unable to give informed consent or fully participate to an interactive treatment.
Sleep Diary. Participants kept daily sleep diaries during a 2-week baseline period and a 6-week acute treatment phase. The primary dependent variables derived from the diaries were SOL, WASO, TST, and sleep efficiency (SE; ratio of sleep time to the time spent in bed). The sleep diary is a standard assessment instrument in insomnia research that used to monitor sleep patterns over extended periods (Buysse, Ancoli-Israel, Edinger, Lichstein, & Morin, 2006).
Polysomnography. Participants underwent a sleep laboratory evaluation for three nights at baseline and for two nights after the 6-week acute treatment phase. Bedtime and arising times during those nights were based on habitual sleep schedule at home (as determined by sleep diaries). The primary dependent variables were SOL, WASO, TST, and SE. These variables were averaged over two nights for each assessment phase. A standard
PSG montage was used (Rechtschaffen & Kales, 1968). Respiration (air flow, tidal volume, and oxygen saturation) and anterior tibialis electromyogram were recorded during the first night to screen for sleep apnea and periodic limb movements during sleep. Sleep stages were scored visually according to standardized criteria (Rechtschaffen & Kales, 1968) by experienced technicians, who were blinded to participants’ treatment conditions.
Insomnia Severity Index. Participants completed the ISI at each assessment phase. The ISI (Bastien, Vallières, & Morin, 2001) is a seven-item self-reported outcomes assessing the severity of insomnia symptoms, sleep satisfaction, and severity of daytime functioning. A five-point Likert scale is used to rate each item, yielding a total score ranging from 0 to 28. Higher score indicate a more severe insomnia within the following four severity categories: absence of insomnia (score of 0-7); subthreshold insomnia (score of 8-14); moderate insomnia (score of 15-21); and severe insomnia (score of 22-28). The ISI has adequate psychometric properties and it is sensitive to measure treatment response (Bastien et al., 2001; Morin, Belleville, Bélanger, & Ivers, 2011).
Dysfunctional Beliefs and Attitudes About Sleep Scale. Participants completed the brief, 16-item version of the Dysfunctional Beliefs and Attitudes About Sleep Scale [DBAS] at each assessment phase (Morin, Vallieres, & Ivers, 2007). This questionnaire contains five items assessing beliefs related to consequences of poor sleep, six items assessing beliefs related to worry/helplessness about effects of insomnia, two items assessing beliefs related to expectations about sleep, and three items assessing beliefs about medication use. A 10-point (strongly disagree to strongly agree) Likert scale is used to rate each item. The score for each subscale is calculated by computing the average item score for each subscale. The DBAS has been validated for use across various insomnia populations (Carney et al., 2010; Morin et al., 2007).
Multidimensional Fatigue Inventory. Participants completed the Multidimensional Fatigue Inventory [MFI] at each assessment phase. The MFI (Smets, Garssen, Bonke, & De Haes, 1995) is a 20-item questionnaire assessing five dimensions of fatigue: general fatigue, mental fatigue, physical fatigue, reduced activity, and reduced motivation. A five-point Likert scale is used to rate each item, and a higher score indicates greater fatigue. The MFI has adequate psychometric properties to detect fatigue (Smets et al., 1995).