Mésestimation du sommeil et effet de première nuit en
laboratoire
Mémoire doctoral
Patrick St-Hilaire
Doctorat en psychologie
Docteur en psychologie (D.Psy.)
Québec, Canada
Mésestimation du sommeil et effet de première nuit en
laboratoire
Mémoire doctoral
Patrick St-Hilaire
Sous la direction de :
iii
Résumé
L’hyperactivation corticale, principalement retrouvée dans l’insomnie, pourrait être influencée par la qualité du sommeil et le degré de mésestimation des données objectives du sommeil. L’effet de première nuit permet d’observer une diminution de la qualité du sommeil lors de la première nuit d’enregistrement en laboratoire. Les objectifs du présent mémoire sont d’examiner les différences d’activation corticale selon les types de dormeurs entre les nuits et d’évaluer si l’activation corticale varie selon le degré de mésestimation du sommeil. Les résultats suggèrent la présence d’un effet de première nuit observable par une diminution de la qualité objective et subjective du sommeil pour l’ensemble des dormeurs. Toutefois, malgré cette exacerbation des difficultés de sommeil, l’activation corticale est similaire entre les différents types de dormeurs. Finalement, il semblerait exister une hypoactivation corticale, représentée par une élévation des ondes Delta, qui favoriserait une perception biaisée en faveur du sommeil durant la nuit comparativement à ce qui est observé avec la polysomnographie. Jusqu’à maintenant, peu d’études se sont intéressées à cette relation entre les ondes lentes et la surestimation de la qualité du sommeil, et ce, malgré que cette avenue soit prometteuse pour le traitement de l’insomnie, qui est avant tout une plainte subjective de difficultés de sommeil.
iv
Abstract
Cortical hyperarousal, mainly found in insomnia, could be influenced by the sleep quality and the degree of objective sleep misperception. The first night effect allows to observe a decrease in the quality of sleep during the first recording night in the laboratory. The objectives of this research are to examine cortical arousal differences according to sleeper types between nights and to assess if cortical arousal varies according to degree of misperception. Results suggest presence of a first night effect observable by a decrease in the objective and subjective sleep quality for all participants. However, despite this exacerbation of the sleep difficulties, cortical arousal is similar for the different types of sleepers. Finally, it seems that a cortical hypoarousal, represented by an increase in Delta power, would promote an overestimation of sleep quantity compared to what is observed with polysomnography. Until now, only few studies have been interested in the relationship between the slow waves sleep and the overestimation of the sleep quality. Although this could be a promising avenue for the treatment of insomnia, which is foremost a complaint of subjective sleep difficulties.
v
Table des matières
RÉSUMÉ ... III ABSTRACT ... IV LISTE DES TABLEAUX ... VII LISTE DES FIGURES ... VIII LISTE DES ABRÉVIATIONS ET DES SIGLES ... IX REMERCIEMENTS ... X AVANT-PROPOS ... XI
CHAPITRE 1 : INTRODUCTION GÉNÉRALE ... 1
ÉPIDÉMIOLOGIE ET CONSÉQUENCES DE L’INSOMNIE ... 1
DÉFINITION ET MACROSTRUCTURE DE L’INSOMNIE ... 2
HYPERACTIVATION DANS L’INSOMNIE ... 3
Modèle neurocognitif de Perlis ... 3
Hyperactivation physiologique dans l’insomnie ... 3
Hyperactivation cognitive dans l’insomnie ... 4
Modèle psychobiologique de l’insomnie ... 4
Mesures de l’hyperactivation corticale dans l’insomnie ... 5
LIEN ENTRE HYPERACTIVATION ET MÉSESTIMATION ... 8
Distinctions entre l’insomnie psychophysiologique et l’insomnie paradoxale ... 9
VARIABILITÉ INTERNUIT ... 10
Effet de première nuit et première nuit inversée ... 10
ACTIVATION CORTICALE ET QUALITÉ DU SOMMEIL... 11
MÉSESTIMATION : CATÉGORIE OU DIMENSION ... 14
RÉSUMÉ DE L’INTRODUCTION ... 14
OBJECTIFS ET HYPOTHÈSES ... 16
CHAPITRE 2. MÉSESTIMATION DU SOMMEIL ET EFFET DE PREMIÈRE NUIT ... 17
RÉSUMÉ ... 19 ABSTRACT ... 20 INTRODUCTION ... 21 METHODS ... 24 Participants ... 24 Research protocol ... 25 Statistical analyses ... 28 RESULTS ... 29
Socio-demographic and psychological data ... 29
Objective and subjective sleep measures ... 30
Power spectral analysis measures ... 31
vi
Groups classification ... 32
Night effect ... 33
Cortical arousal depending on the night and the insomnia type ... 34
Arousal and misperception ... 34
Limits ... 37 ACKNOWLEDGEMENTS ... 38 DISCLOSURE STATEMENT ... 38 ABBREVIATION LIST ... 38 REFERENCES ... 39 CHAPITRE 3 : CONCLUSION ... 46
CONTRIBUTIONS THÉORIQUES DU MÉMOIRE ... 46
CONTRIBUTIONS CLINIQUES DU MÉMOIRE ... 47
RÉFÉRENCES ... 50 ANNEXES ... 57 ANNEXE A ... 57 ANNEXE B ... 58 ANNEXE C... 59 ANNEXE D... 60 ANNEXE E ... 64 ANNEXE F ... 65
vii
Liste des tableaux
TABLE 1.MEANS (SD) OF SOCIO-DEMOGRAPHIC AND PSYCHOLOGICAL DATA OF GOOD SLEEPERS (GS),
PSYCHOPHYSIOLOGICAL INSOMNIA SUFFERERS (PSY-I) AND PARADOXICAL INSOMNIA SUFFERERS (PARA-I). 42
TABLE 2.MEANS (SD) OF SUBJECTIVE AND OBJECTIVE SLEEP PARAMETERS OF GOOD SLEEPERS (GS),
PSYCHOPHYSIOLOGICAL (PSY-I) AND PARADOXICAL (PARA-I) INSOMNIA SUFFERERS FOR EACH NIGHT. ... 43
viii
Liste des figures
ix
Liste des abréviations et des sigles
Termes français/anglais Abréviations
françaises Abréviations anglaises Analyse spectrale de l’électroencéphalogramme/Power spectral analysis --- PSA
Bon dormeur/Good sleeper BD GS
Électroencéphalogramme/Electroencephalogram EEG
Efficacité de sommeil/Sleep efficiency ES SE
Individus souffrant d'insomnie/Insomnia sufferers INS
Insomnie paradoxale/Paradoxical insomnia IPA PARA-I
Insomnie psychophysiologique/Psychophysiological insomnia IPS PSY-I
Latence de sommeil/Sleep onset latency LS SOL
Polysomnographie/Polysomnography PSG
Temps total de sommeil/Total sleep time TTS TST
x
Remerciements
La remise de ce mémoire doctoral souligne l’aboutissement de mes études universitaires, totalisant 8 années, nécessaires à l’obtention de la tant attendue mention D. Psy. Il symbolise la fin d’un long parcours académique et le début d’une nouvelle étape professionnelle, qui sera empreinte de nombreux défis et d’expériences toutes plus enrichissantes les unes que les autres. Ce mémoire m’a permis de développer plusieurs qualités importantes telles que la persévérance, la rigueur, la débrouillardise et la discipline. Étant donné l’envergure de ce parcours, ces qualités ont été mises à l’épreuve à diverses occasions. Pour ce faire, j’ai dû sortir de ma zone de confort à plusieurs reprises. Hors de cette zone, de nombreuses personnes importantes pour moi ont été présentes et je tiens à les remercier.
Tout d’abord, j’aimerais remercier tout particulièrement ma directrice de recherche Célyne Bastien, qui m’a chaleureusement accueilli dès les premières rencontres. Merci de m’avoir donné l’autonomie nécessaire afin de grandir à travers le monde de la recherche. Cette preuve de confiance inestimable est très appréciée. Malgré tes multiples responsabilités et ton emploi du temps chargé, tu as toujours été disponible et très généreuse de ton temps. Merci pour ton support constant, ton dévouement, ton dynamisme contagieux, ton ouverture d’esprit, ton optimisme et ton humanité. Merci Célyne !
Je remercie Simon Grondin d’avoir accepté de prendre le temps de réviser et de faire de judicieux et rigoureux commentaires afin d’augmenter la qualité générale de ce mémoire. Merci !
Ensuite, je remercie mes collègues et bons amis du laboratoire de sommeil qui ont contribué à agrémenter ce parcours universitaire de nombreux souvenirs mémorables. Merci à vous, on se voit au pub !
Par la suite, je tiens à remercier ma mère et mon père, qui m’ont transmis la valeur importante de l’éducation. Merci de m’avoir sans cesse encouragé à persévérer et à poursuivre mes ambitions. Merci de croire en moi et de m’avoir fourni toutes les ressources essentielles à la réussite de mon cheminement scolaire. Merci à vous !
Je terminerais en remerciant mon amoureuse, ma complice, qui égaye et épice mon quotidien. Merci d’avoir été l’instigatrice de nombreux projets magiques et mémorables. Il est plus agréable de travailler fort lorsqu’on se sait bien accompagné et avec des rêves plein la tête pour se motiver. Merci Lyd !
xi
Avant-propos
L’article inclus dans ce mémoire doctoral a été réalisé par l’auteur du mémoire et sa directrice de recherche, Célyne Bastien. L’auteur du mémoire a contribué à la conceptualisation de l’étude, la réalisation et l’interprétation des analyses statistiques ainsi qu’à la rédaction de l’article. Pour ces raisons, il fait office d’auteur principal.
Les résultats de ce mémoire proviennent de données secondaires, ayant été colligées au laboratoire de neurophysiologie humaine (Sommeil et Potentiels évoqués cognitifs) entre 2004 et 2011. L’auteur principal n’a donc pas participé à la collecte de données. Mme Bastien a également contribué à la conceptualisation et la rédaction de l’article, ainsi qu’à la collecte et interprétation des données, en plus d’avoir rigoureusement supervisé l’auteur principal tout au long du processus scientifique et académique. L’article qui y est inséré a été accepté pour publication à la revue International Journal of Psychiatry en date d’août 2017. La présentation de l’article respecte les exigences de la revue dans laquelle il a été publié. Seule la mise en forme diffère puisqu’elle a été adaptée aux normes de la Faculté des études supérieures et postdoctorales de l’Université Laval.
1
Chapitre 1 : Introduction générale
La majorité des études neurophysiologiques sur les individus souffrant d’insomnie (INS) suggèrent que ces derniers présentent une activation corticale plus élevée que les bons dormeurs (BD). Alors que les écrits scientifiques s’intéressent de plus en plus à ce mécanisme, la plupart se concentrent uniquement sur les caractéristiques statiques de cette pathologie en prenant seulement en compte l’hyperactivation corticale, la qualité du sommeil et/ou la mésestimation de façon indépendante et fixe dans le temps. Or, la présente étude adopte une approche plus dynamique en observant l’influence de la qualité du sommeil et du degré de mésestimation sur l’hyperactivation corticale, aussi bien chez une population clinique, que non-clinique. Après avoir décrit l’insomnie en général et ses principales conséquences, les modèles de l’insomnie et les mesures de l’hyperactivation seront abordés. Par la suite, les quelques études sur la mésestimation et la qualité du sommeil en lien avec l’activation corticale seront examinées afin de soulever les carences dans la littérature, qui feront l’objet de cette étude.
Épidémiologie et conséquences de l’insomnie
Parmi tous les troubles du sommeil, l’insomnie est celui qui est le plus fréquemment rapporté avec environ 30 à 48 % des adultes se plaignant de symptômes d’insomnie (Ohayon, 2002) et entre 6 et 10 % présentant des symptômes assez importants pour répondre aux critères diagnostiques d’insomnie chronique (Morin, Leblanc, Daley, Gregoire & Merette, 2006; Roth, Jaeger, Jin, Kalsekar, Stang & Kessler, 2006). La problématique de l’insomnie ne se limite pas qu’aux difficultés rencontrées pendant la nuit puisque les perturbations du sommeil sont souvent associées à une altération des activités quotidiennes (American Academy of Sleep Medicine, 2014; American Psychiatric Association, 2013). Les conséquences diurnes généralement rapportées sont la fatigue, une perturbation de l’humeur, une diminution des intérêts et de la satisfaction dans les activités de loisir et les relations sociales, ainsi que des déficits cognitifs concernant la mémoire et certains aspects du fonctionnement exécutif (Fortier-Brochu, Beaulieu, Bonneau, Ivers & Morin, 2012; Roth & Ancoli-Israel, 1999; Zammit, 1998). Ces perturbations peuvent exacerber et contribuer aux psychopathologies présentes en comorbidité, telles que les troubles anxieux et les troubles de l’humeur
2
(Dolsen, Asarnow & Harvey, 2014). Ce sont essentiellement ces altérations diurnes causées par les difficultés de sommeil qui amènent les INS à chercher un traitement et à consulter un professionnel (Morin et al., 2006). En ce sens, une augmentation de l’utilisation des services de soins de santé, des accidents de travail (Léger, Guilleminault, Bader, Lévy & Paillard, 2002) et de l’absentéisme au travail (Léger, Massuel & Metlaine, 2006) peuvent engendrer d’importants coûts pour l’individu ainsi que pour la société (Daley, Morin, LeBlanc, Grégoire & Savard, 2009; Ozminkowski, Wang & Walsh, 2007).
Définition et macrostructure de l’insomnie
L’insomnie chronique est définie comme étant une plainte subjective d’insatisfaction concernant la qualité et la quantité de sommeil. Cette insatisfaction se manifeste par une difficulté à engager et/ou à maintenir le sommeil et/ou par un réveil matinal précoce qui est à l’origine d’une souffrance ou d’une altération du fonctionnement social, occupationnel ou d’autres sphères importantes pour la personne. Ces difficultés de sommeil sont présentes au moins trois nuits par semaine pour une durée d’au moins trois mois (American Psychiatric Association, 2013). La polysomnographie (PSG), une méthode d’enregistrement regroupant un ensemble de mesures objectives recueillies pendant une nuit de sommeil, s’avère la mesure étalon pour tout ce qui a trait à la recherche sur le sommeil, notamment l’insomnie. Même si celle-ci n’est pas nécessaire en clinique ou pour poser un diagnostic, des études sur la macrostructure du sommeil ont montré, grâce à la PSG, que les INS ont tendance à avoir un sommeil plus léger et fragilisé que les BD. Ceci s’observe par une latence d’endormissement (LS) plus longue (Frankel, Coursey, Buchbinder & Snyder, 1976; Gaillard, 1978; Dorsey & Bootzin, 1997), un temps total de sommeil (TTS) plus court et une efficacité de sommeil (ES; temps total de sommeil divisé par le temps passé au lit, multiplié par 100) plus faible (Frankel et al., 1976; Gaillard, 1978, Merica & Gaillard, 1992). Il y a également, chez les INS, une augmentation du nombre d’éveils ainsi qu’une diminution des stades de sommeil 3 et 4 (sommeil profond; Gaillard, 1978; Merica et al., 1992).
3
Hyperactivation dans l’insomnie
Modèle neurocognitif de Perlis
Les symptômes de l’insomnie peuvent être conceptualisés et expliqués selon différents modèles, notamment le modèle neurocognitif développé par Perlis et collaborateurs (1997) qui est de plus en plus appuyé empiriquement (voir Annexe A pour l’illustration de ce modèle). Ce modèle postule la présence d’une hyperactivation corticale, incluant des altérations physiologiques, cognitives et psychologiques présentes dans l’insomnie, comme facteur étiologique et perpétuant de ce trouble. Ce modèle stipule que certaines personnes développent une activation corticale conditionnée par l’association entre les stimuli liés au sommeil (ex. : la chambre à coucher) et les difficultés de sommeil qu’elles vivent. De plus, l’adoption de mauvaises stratégies, par exemple de compenser le manque de sommeil en augmentant la durée du temps passé au lit éveillé ou de faire des siestes durant le jour, maintient cet état d’activation corticale plus élevée et consolide ce conditionnement inadapté. Ce processus exacerbe ainsi les difficultés de sommeil initiales par une augmentation du traitement sensoriel et de l’information à l’endormissement et pendant le sommeil, ainsi que par l’altération de fonctions cognitives, telles que la formation de la mémoire à court et à long terme. Par conséquent, ce cercle vicieux perpétue l’insomnie transitoire jusqu’à causer une insomnie chronique, se manifestant dorénavant même sans la présence du stresseur initial. Ce phénomène d’hyperactivation, présent dans l’insomnie, peut s’observer sur le plan physiologique, cognitif et cortical.
Hyperactivation physiologique dans l’insomnie
Une première étude indique que les INS, comparativement aux BD, ont un système nerveux autonome généralement plus activé. Ceci a été mesuré entre autres par une fréquence du rythme cardiaque, une température rectale, une résistance de base de la peau et un taux de vasoconstriction plus élevés à l’endormissement et pendant le sommeil (Monroe, 1967). Des études subséquentes vont dans le même sens en montrant qu’un taux métabolique, aussi bien qu’un taux de cortisol sur 24 heures, seraient également plus élevés chez les INS comparativement aux BD (Bonnet & Arand, 1995; Rodenbeck, Huether, Rüther & Hajak, 2002; Vgontzas et al., 2001). Ces résultats sont compatibles avec l’idée d’une hyperactivation physiologique
4
élevée. Pour une revue plus exhaustive sur les diverses modifications physiologiques présentes dans l’insomnie, voir Riemann et al. (2010) ainsi que Bonnet et Arand (2010).
Hyperactivation cognitive dans l’insomnie
L’hyperactivation cognitive, quant à elle, s’évalue par le biais de mesures subjectives et réfère au flot de pensées souvent rapporté par les INS à l’endormissement. Les pensées sont notamment axées sur des inquiétudes, de la résolution de problèmes et l’anticipation des conséquences d’une mauvaise nuit de sommeil (Harvey, 2000; Wicklow & Espie, 2000). Selon Harvey (2002), cette activité cognitive accrue et négative engendre une activation du système autonome et une détresse émotionnelle. Cet état est à la base d’une hypervigilance par rapport aux sensations internes et externes pouvant interférer avec le sommeil. Cette hausse de l’activation cognitive et de l’attention sélective augmente ainsi les risques de repérer des indices de difficultés de sommeil et de conséquences associées au déficit de sommeil. Par conséquent, lorsqu’un tel indice est perçu, l’activité cognitive négative s’intensifie, dès lors responsable des perceptions erronées de difficultés de sommeil et des conséquences diurnes rapportées par les INS. Ce processus pourrait expliquer, du moins en partie, la tendance chez les INS à mésestimer la qualité de leur sommeil, c’est-à-dire de surestimer leurs difficultés de sommeil (Rosa & Bonnet, 2000). La question de la mésestimation sera abordée un peu plus loin dans ce document. En plus du modèle de Harvey, Perlis et collaborateurs (1997) indiquent à juste titre que l’activation cognitive corrèle fortement avec l’activation corticale et que c’est cette dernière qui devient conditionnée et associée aux stimuli qui sont alors incompatibles avec l’initiation et le maintien du sommeil.
Modèle psychobiologique de l’insomnie
Pour faire suite aux modèles présentés précédemment, Espie (2002) propose une vision complémentaire au phénomène d’hyperactivation dans l’insomnie : les INS auraient également une difficulté à se désengager de l’activation physiologique et cognitive afin de mettre en action les processus automatisés d’initiation et de maintien du sommeil. Cet auteur supporte l’idée qu’une activation accrue ne serait pas suffisante en elle-même pour maintenir l’insomnie, mais que cela nécessite également un problème dans
5
l’inhibition de cette activité. En d’autres mots, en voulant désespérément s’endormir, les INS augmentent leur niveau d’activation corticale, physiologique et cognitive et sont incapables d’inhiber cette activation afin d’amorcer les processus normaux d’initiation et de maintien du sommeil.
Mesures de l’hyperactivation corticale dans l’insomnie
En ce qui concerne l’hyperactivation corticale, les techniques habituellement utilisées pour mesurer cette activation sont l’enregistrement de potentiels évoqués cognitifs, l’analyse du cyclic alternating pattern et l’analyse spectrale de l’électroencéphalogramme (EEG). L’ensemble de ces techniques permet une analyse fine de la microstructure du sommeil. Cette analyse est essentielle étant donné le manque de précision de l'observation sommaire de la macrostructure de la PSG. La tomographie par émission de positon, une méthode très peu utilisée dans l’étude du sommeil, permet également l’observation directe de l’activation corticale.
Potentiels évoqués cognitifs
Tout d’abord, les potentiels évoqués cognitifs, qui sont une mesure de la réponse électrique du cerveau suite à un stimulus sensoriel externe ou un évènement mental interne, permettent d’observer le processus de traitement de l’information. Les études de potentiels évoqués cognitifs grâce au paradigme
oddball (présentation d'un son déviant occasionnel pendant la présentation d'une série de sons répétés)
montrent une plus grande augmentation de l’amplitude N1 (associée à l’attention) et une moins grande diminution de l’amplitude N350 (associée à l’inhibition du traitement de l’information) chez les INS comparativement aux BD, aussi bien à l’éveil qu’à l’endormissement (Bastien, St-Jean, Morin, Turcotte & Carrier, 2008; Yang & Lo, 2007). Ces différences sont en accord avec la présence d’une hyperactivation corticale et la difficulté qu’auraient les INS à l’inhiber. Malgré l’intérêt de cette mesure, les potentiels évoqués cognitifs ne permettent pas l’accès à un tracé de l’EEG « pur », c’est-à-dire sans altérations. Effectivement, ils nécessitent la présentation d’un stimulus, interférant ainsi avec l’état d’activation qui se présenterait normalement sans intervention. Cette méthode est donc limitée par son incapacité à analyser l’EEG tel qu’il se présente réellement.
6
Cyclic Alternating Pattern
L’analyse du cyclic alternating pattern permet d’observer, dans le sommeil non paradoxal, les séquences cycliques d’activation cérébrale exprimées par des évènements liés à l’éveil suivis par des périodes de désactivation. Parmi les différents paramètres du cyclic alternating pattern, le taux est une mesure de l’instabilité du sommeil et sa variation corrèle avec la qualité subjective du sommeil; des taux plus élevés sont associés à une qualité de sommeil plus pauvre (Parrino, Ferri, Bruni & Terzano, 2012). Comparativement aux BD, les INS présentent une augmentation du nombre d’éveils, du temps réveillé et du taux de cyclic
alternating pattern pendant le sommeil (Terzano et al., 2003). Malgré l’utilité du cyclic alternating pattern, cette
technique d’analyse de l’EEG est méconnue et n’est pas utilisée aussi fréquemment que les autres, ce qui ne permet pas un approfondissement aussi détaillé des données.
Tomographie par émission de positons
En plus de ces méthodes conventionnelles, une étude utilisant la tomographie par émission de positons a permis de découvrir une augmentation globale du métabolisme cérébral chez les INS comparativement aux BD, aussi bien à l’éveil que pendant le sommeil non paradoxal. De plus, lors de la transition de l’éveil au sommeil, les INS ont une moins grande diminution du métabolisme des régions du cerveau associées à l’éveil (Nofzinger et al., 2004). Ceci suggère que les systèmes d’éveil restent plus actifs même pendant le sommeil. Cette étude permet l’observation directe de cette hypothèse d’une hyperactivation corticale dans l’INS. Toutefois, le problème avec cet appareil et la principale raison pour laquelle il n’est généralement pas utilisé en sommeil est le fait qu’il génère énormément de bruits, compromettant ainsi le sommeil.
Analyse spectrale de l'électroencéphalogramme
Ce sont finalement les études avec l’analyse spectrale de l’EEG, qui est une mesure de la puissance des différentes bandes de fréquences (voir Annexe B et C), qui offrent les meilleurs résultats pour mesurer l'activation corticale étant donné la validité empirique de cette mesure et du fait qu’elle permet une analyse précise et représentative de l’activité neurophysiologique en temps réel. Contrairement aux potentiels évoqués
7
cognitifs, l’analyse spectrale n’altère pas le tracé de l’EEG et permet donc de l’observer tel qu’il se présente. Pour ces raisons, la présente étude privilégie cette mesure, qui porte entre autres sur l’hyperactivation corticale.
Les résultats montrent habituellement que chez les BD, la transition entre l’éveil et le sommeil est caractérisée par une diminution de la puissance des bandes de fréquences élevées et une augmentation de la puissance des bandes de fréquences lentes, permettant ainsi de promouvoir le sommeil (De Gennaro, Ferrara & Bertini, 2001). Or, étant donné que les INS présentent une altération dans la macrostructure de leur sommeil comparativement aux BD, il est vraisemblable d’affirmer que cette différence se traduit par une altération de la microstructure du sommeil, identifiable grâce à l’analyse spectrale. C’est ce qui est observé chez les INS, qui présentent un patron de distribution des puissances différent de celui des BD, aussi bien à l’endormissement que pendant tout le sommeil. Une diminution de la puissance des ondes lentes, représentées par les bandes Delta, et une augmentation de la puissance des ondes rapides, que sont les bandes Alpha et Beta, sont observées avant et pendant l’endormissement chez les INS (Freedman, 1986; Lamarche & Ogilvie, 1997; Merica & Gaillard, 1992; Staner et al., 2003). Durant le sommeil non paradoxal, les INS présentent une augmentation de la puissance des bandes de fréquences rapides, c’est-à-dire les bandes Beta (Beta1 et Beta2) et Gamma, ainsi qu’une diminution dans la puissance des bandes de fréquences lentes que sont les bandes Thêta et Delta (Merica, Blois & Gaillard, 1998; Perlis, Smith, Andrews, Orff & Giles, 2001). Finalement, pendant le sommeil paradoxal, la puissance des bandes de fréquences rapides Beta et Alpha sont augmentées alors qu’il y a un déficit de la puissance des bandes de fréquences lentes Thêta et Delta (Freedman, 1986; Merica et al., 1998). Globalement, les données obtenues grâce à l’analyse spectrale indiquent une augmentation de l’activité dans la puissance des bandes de fréquences rapides, associées aux processus cognitifs à l’éveil comme l’attention et la perception (Pulvermüller, Birbaumer, Lutzenberger & Mohr, 1997; Basar-Eroglu, Struber, Schurmann, Stadler & Basar, 1996), et une diminution dans la puissance des bandes de fréquences lentes chez les INS. Ces résultats sont en accord avec une activation corticale plus élevée dans cette population et avec une augmentation du traitement de l’information, interférant avec les mécanismes permettant une transition vers le sommeil. Étant donné que les différences d’activation se
8
retrouvent essentiellement dans les fréquences lentes et rapides, ce seront ces bandes de fréquences qui feront l’objet de cette recherche.
Lien entre hyperactivation et mésestimation
L’hyperactivation corticale peut s’observer également par une différence entre les données objectives et celles subjectivement rapportées. En effet, les INS surestiment leurs difficultés de sommeil (Rosa et al., 2000) et rapportent être réveillés pendant de longues périodes de temps durant la nuit alors que ces observations ne sont pas toujourscorroborées par la PSG (Bastien, Vallières, Ivers, Forget & Morin, 2004). De plus, les INS ont tendance à sous-estimer le TTS et à surestimer le temps nécessaire avant de s’endormir comparativement à ce qui est mesuré par la PSG (Perlis et al., 1997). Ces derniers auteurs proposent que l’hyperactivation corticale contribue à cette mésestimation de la quantité de sommeil retrouvée dans l’insomnie. Cette relation serait d’abord expliquée par une augmentation du traitement sensoriel et de l’information, aussi bien au moment de l’endormissement que pendant les transitions entre le sommeil et l’éveil tout au long de la nuit, brouillant ainsi la distinction entre les périodes de sommeil et d’éveil. Ensuite, le renforcement de la formation de la mémoire à court et à long terme à l’endormissement altère l’amnésie mésograde de la période précédant immédiatement le sommeil qui est normalement vécue par les BD. Cette altération influence alors le jugement concernant la LS et le TTS (Wyatt, Bootzin, Allen & Anthony, 1997; Wyatt, Bootzin, Anthony & Bazant, 1994). Pour ce faire, trois études se sont intéressées à la relation entre l’activation corticale et la mésestimation du sommeil.
D’abord, une première équipe de chercheurs ont rapporté une corrélation entre l’activité Beta et le degré de différence observé entre le TTS subjectif et objectif, supportant ainsi une activité accrue en lien avec la mésestimation du sommeil (Perlis et al., 2001). Toutefois, il faut prendre en considération que l’échantillon n’est que de 9 personnes par groupe malgré le type et la quantité de tests statistiques employés. De plus, les données proviennent de la première nuit d’enregistrement de la PSG. Or, ces données sont souvent exclues des analyses étant donné qu’elles sont considérées comme reflétant une période d’adaptation qui n’est pas représentative du patron habituel de sommeil.
9
D’autres chercheurs ont observé une corrélation négative entre le ratio Delta/Beta et la mésestimation de la LS (Maes et al., 2014). En d’autres termes, ceux qui ont un ratio Delta/Beta plus bas sont ceux qui ont un plus haut degré de mésestimation de leur LS. Cette étude est cependant limitée par le fait qu’elle est rétrospective et utilise des bases de données multiples. Par conséquent, les électrodes de l’EEG utilisées (C4, F4, C3, O1) varient selon la base de données prise en considération, diminuant ainsi la standardisation du protocole. De plus, comme pour l’étude précédente, les données proviennent de la première nuit de sommeil en laboratoire.
Finalement, les résultats d’une dernière étude vont à l’encontre des précédentes en démontrant une corrélation négative entre l’activité Beta et la mésestimation du temps passé éveillé après l’endormissement (Buysse et al., 2008), complexifiant ainsi le lien entre l’activation corticale et la mésestimation. En revanche, l’enregistrement de l’EEG a seulement été réalisé bilatéralement au niveau central, ne permettant qu’une vision très restreinte de l’activation corticale.
En bref, les études actuelles sur le sujet semblent suggérer que le degré de mésestimation est lié à l’activation corticale. Néanmoins, l’étude de cette relation est encore à une phase exploratoire et plusieurs limites sont à prendre en considération.
Distinctions entre l’insomnie psychophysiologique et l’insomnie paradoxale
La prévalence des INS présentant des plaintes de difficultés de sommeil alors que le tracé de la PSG est normal varie énormément d’une étude à l’autre, mais pourrait atteindre dans certains cas jusqu’à 50 % (Edinger & Krystal, 2003; St-Jean & Bastien, 2009). Étant donné ce taux de prévalence élevée, certains chercheurs suggèrent que la mésestimation est une caractéristique inhérente à l’insomnie en général (Reynold, Kupfer, Buysse, Coble & Yeager, 1991). Toutefois, d’autres chercheurs proposent que la mésestimation puisse être une caractéristique présente seulement dans un sous-groupe de personnes souffrant d’insomnie. C’est d’ailleurs sur la base de cette distinction que la seconde édition de la Classification Internationale des Troubles du Sommeil (American Academy of Sleep, 2005) a distingué les sous-groupes des individus souffrant d’insomnie paradoxale (IPA) et ceux souffrant d’insomnie psychophysiologique (IPS). Les
10
IPA se distinguent des INS plus typiques que sont les IPS sur la base de l’importante dissemblance observée entre la perception du sommeil et l’enregistrement de la PSG. Les IPA mésestiment la qualité de leur sommeil en affirmant avoir des difficultés de sommeil alors que la PSG semble normale et comparable à celle des BD, contrairement aux IPS chez qui la perception des perturbations est corroborée par la PSG. Malgré que la troisième version de la Classification Internationale des Troubles du Sommeil (American Academy of Sleep, 2014) ait éliminé les sous-groupes de l’insomnie pour des raisons cliniques, il encourage la poursuite de recherches afin de développer davantage d’appuis empiriques auprès de cette population. Pour ce faire, des études montrent que les IPA ont un patron d’activation corticale encore plus prononcé que les IPS (Krystal, Edinger, Wohlgemuth, Marsh, 2002). Ce sous-groupe de l’insomnie, qui se caractérise par une mésestimation importante de la qualité de leur sommeil, est aussi celui qui présente l’activation corticale la plus importante.
Variabilité internuit
La majorité des études suggèrent une association entre l’hyperactivation corticale et le degré de mésestimation de la qualité du sommeil, comme initialement stipulé par le modèle de Perlis et ses collaborateurs (1997). Malheureusement, les quelques études qui ont directement examiné cette relation par le biais de l’analyse spectrale ont soit des résultats divergents (Buysse et al., 2008) ou ont été réalisées sur la première nuit d’enregistrement de la PSG (Perlis et al., 2001; Maes et al., 2014). Dans tous les cas, les résultats de ces études ne comprennent que les données d’une seule nuit (soit la nuit 1 ou la nuit 2), ce qui ne prend pas en compte la variabilité du patron de sommeil des INS. En effet, l’insomnie chronique est caractérisée par une grande variabilité internuit, présentant des alternances entre bonnes et mauvaises nuits dans une semaine normale (Vallières, Ivers, Bastien, Beaulieu-Bonneau & Morin, 2005; Vallières, Ivers, Beaulieu-Bonneau & Morin, 2011). Cette variation dans le patron de sommeil peut également s’observer lors la première nuit en laboratoire chez les INS, mais également chez les BD.
Effet de première nuit et première nuit inversée
Un changement dans le patron habituel de sommeil semble s’observer principalement lors de la première nuit d’enregistrement de la PSG. Il existe, pour certaines personnes, un effet de première nuit, qui
11
réfère à la tendance chez les individus à dormir moins bien qu’à l’habitude lors d’une première nuit d’enregistrement en laboratoire. Ceci s’observe via les mesures objectives qui montrent typiquement une augmentation de la LS, de la latence du sommeil paradoxal et de la latence des stades profonds (stades 3 et 4), une diminution du TTS, moins de sommeil paradoxal et une ES plus basse (Agnew, Webb & Williams, 1966; Mendels & Hawkins, 1967; Toussaint et al., 1995). Alors que plusieurs études ont observé ce phénomène chez les BD et en moindre mesure chez les INS, d’autres au contraire n’observent pas cette différence (Kupfer, Weiss, Detre & Foster, 1974; Kader & Griffin, 1983). Un effet de première nuit inversé a même été observé chez certains INS (Hauri & Olmstead, 1989; Riedel, Winfield & Lichstein, 2001). L’effet de première nuit inversé se définit par la tendance à mieux dormir qu’habituellement lors de la première nuit d’enregistrement de la PSG. Hauri et Olmstead (1989) proposent qu’une partie des INS dorment mieux lors de la première nuit puisque leur mauvaise association entre le sommeil et leur chambre à coucher ne s’est pas généralisée au laboratoire de sommeil, facilitant ainsi l’endormissement et le sommeil tout au long de la nuit.
Activation corticale et qualité du sommeil
La variation dans la qualité du sommeil pourrait donc influencer le niveau d’activation corticale. Pour ce faire, quatre études ont réalisé des analyses quantitatives des bandes de fréquences de l’EEG avec l’analyse spectrale ont été réalisées auprès de BD.
Une première étude démontre que l’effet de première nuit affecte le sommeil paradoxal en augmentant la densité de puissance dans les bandes Delta, Thêta et Beta1 et en diminuant la fréquence moyenne de la deuxième nuit de sommeil comparativement à la première (Toussaint et al., 1997). Ce changement, selon cet auteur, serait dû à la privation partielle du sommeil paradoxal lors de la première nuit de sommeil. Cette étude contient toutefois plusieurs biais méthodologiques et statistiques. D’abord, les critères d’exclusion ne sont pas explicitement formulés, en plus de ne pas y avoir de dépistage objectif, grâce à la PSG, sur la présence de troubles du sommeil. Par conséquent, l’échantillon des INS peut avoir été altéré par la présence de troubles comorbides ou de troubles du sommeil pouvant être confondants (p. ex. le syndrome des jambes sans repos ou l’apnée). L’heure du coucher a été fixée à 22h, indépendamment du
12
patron de sommeil des participants, pouvant ainsi influencer sur ce qui est habituellement observé lors d’une nuit de sommeil typique. Sur le plan statistique, le genre n’a pas été pris en considération dans les analyses malgré la forte proportion d’hommes (13 hommes pour 5 femmes), augmentant les risques que cette variable soit confondante.
Ensuite, d’autres chercheurs démontrent un déficit dans la puissance des ondes lentes lors de la nuit 1 comparativement à la nuit 2, créant ainsi une forme de rebondissement des ondes lentes à la nuit 2 (Le Bon et al., 2001).
Une autre étude, quant à elle, révèle une augmentation dans la puissance de la bande Delta lors de la première nuit, majoritairement dans les régions centrales du cerveau, ainsi qu’une augmentation de la puissance de la bande Beta, seulement au niveau postérieur du cuir chevelu (Curcio, Ferrara, Piergianni, Fratello & De Gennaro, 2004). Les auteurs interprètent ces résultats comme étant la cause d’une réduction du TTS lors de la nuit d’adaptation et d’une hyperactivation corticale. Cependant, l’échantillon de 8 personnes est insuffisant afin d’atteindre la puissance statistique adéquate selon le protocole de recherche employé et aucun dépistage objectif afin de vérifier la présence de troubles de sommeil n’est rapporté dans l’article.
Finalement, les résultats d’une étude démontrent que l’amplitude des bandes Alpha et Gamma est supérieure et celle des bandes Thêta et Sigma est inférieure à l’éveil et pendant l’endormissement lors de la première nuit comparativement à la deuxième (Tamaki, Nittono, Hayashi & Hori, 2005). Ces dernières données suggèrent, selon ces auteurs, que le système favorisant l’éveil est excité alors que le système favorisant le sommeil est inhibé à l’endormissement lors de la première nuit. Ce phénomène serait vraisemblablement responsable des difficultés d’endormissement se produisant lors de l’effet de première nuit. Comme pour l’étude précédente, l’échantillon est petit (11 participants uniquement) et aucun dépistage objectif des troubles du sommeil autre que l’insomnie n’a été effectué.
Malgré l’hétérogénéité des résultats, ces derniers suggèrent une hyperactivation passagère chez les BD lors de la première nuit comparativement aux nuits subséquentes. Ceci pourrait être en partie responsable
13
des difficultés de sommeil typiques de l’effet de première nuit. Toutefois, il faut rester prudent avec l’interprétation de ces données étant donné la présence des différents biais soulevés précédemment, notamment l’absence de dépistage objectif, le nombre restreint de participants, la présence de variables confondantes et l’heure fixe du coucher. De plus, ces études se sont concentrées exclusivement sur une population non clinique. Une question reste donc sans réponse, à savoir ce qu’il en est de la relation entre l’activation corticale et la qualité du sommeil chez les INS. Aucune étude utilisant l’analyse spectrale, à notre connaissance, n’a examiné cette relation dans cette population.
Toutefois, des études utilisant les potentiels évoqués cognitifs suggèrent une relation entre la qualité du sommeil subjective et objective des INS et l’activation corticale, c’est-à-dire qu’une qualité de sommeil moindre semble associée à une activation corticale accrue et vice versa (Devoto et al., 2005; Turcotte & Bastien, 2009; Ceklic & Bastien, 2015). D’abord, Devoto et al. (2005) montrent que l’amplitude du P300, interprétée par l’auteur comme un signe de l’état d’activation, est plus élevée 30 minutes avant et après une mauvaise nuit de sommeil chez les INS. Ainsi, l’activation corticale serait reliée au changement dans la qualité du sommeil. Ensuite, Turcotte et Bastien (2009) observent une association entre les mesures objectives du sommeil et les potentiels évoqués cognitifs dans l’insomnie, démontrant ainsi que la qualité du sommeil objectif de la nuit a un impact sur le niveau d’activation corticale au matin. Le niveau d’activation le soir avant d’aller au lit aurait également un effet sur la qualité du sommeil subséquent. Par la suite, l’étude de Ceklic et al. (2015) s’est penchée sur l’altération du traitement de l’information durant le sommeil, une autre facette de l’hyperactivation corticale. Malgré que ces auteurs aient découvert des distinctions entre les BD et les INS dans le traitement de l’information, il semblerait que pour l’ensemble des participants, les capacités d’inhibition du traitement de l’information seraient négativement influencées par la qualité subjective et objective du sommeil. Les résultats de ces études viennent confronter l’idée d’un trait stable d’hyperactivité présent chez les INS et mettent en lumière une nouvelle perspective d’un état d’hyperactivité dans l’insomnie. Par ailleurs, la majorité des études sur l’insomnie compare habituellement les INS avec les BD de façon statique sans nécessairement prendre en considération la variabilité des nuits, caractéristique des INS. Les études démontrent de plus en plus l’aspect dynamique de l’activation corticale en suggérant que l’hyperactivation
14
dans l’insomnie serait davantage en lien avec la qualité de la nuit plutôt qu’intrinsèquement liée à cette pathologie.
Mésestimation : catégorie ou dimension
Puisque l’activation corticale pourrait se refléter par le degré de mésestimation et que des études récentes appuient une variabilité de cet état selon la qualité de la nuit chez les INS, serait-il possible que cette variation de l’activation se refléterait également dans le degré de mésestimation de la qualité du sommeil de la nuit sous observation ? Une question reste donc sans réponse à savoir si l’hyperactivation, telle que mesurée par une augmentation des ondes rapides et/ou une diminution des ondes lentes, est une caractéristique permettant de différencier les BD, des IPS et des IPA ou serait plutôt en lien avec le degré de mésestimation de la qualité du sommeil, et ce, indépendamment des groupes. En d’autres termes, la mésestimation représente-t-elle une dimension d’un continuum en lien avec l’hyperactivation corticale ou est plutôt une variable permettant de catégoriser les sous-groupes de l’insomnie que sont les IPS et les IPA ?
Résumé de l’introduction
En résumé, la divergence entre la macrostructure du sommeil des INS et celle des BD se reflète dans leur microstructure. Pour ce faire, différentes méthodes sont disponibles afin d’analyser plus finement le sommeil. Parmi ces méthodes, il y a le cyclic alternating pattern, les potentiels évoqués cognitifs, la tomographie par émission de positons et l’analyse spectrale. Alors que le cyclic alternating pattern est une méthode d’analyse encore exploratoire, que les potentiels évoqués cognitifs altèrent le tracé de l’EEG et que la tomographie par émission de positons compromet le sommeil, l’analyse spectrale est une méthode validée empiriquement et représentative de l’activité neurophysiologique réelle du dormeur. L’analyse spectrale est donc la méthode la plus indiquée dans le cadre de cette recherche. Bien que cette méthode soit systématique et répandue, il y a tout de même plusieurs lacunes dans la littérature qui restent à être étudiées, notamment en ce qui a trait au degré de mésestimation selon l’activation corticale en lien avec la fluctuation de la qualité du sommeil. En fait, les quelques études utilisant l’analyse spectrale, qui s’intéressent à la variation dans la qualité du sommeil en laboratoire suite à l’effet de première nuit, présentent de nombreuses limites
15
importantes à prendre en considération. La majorité de ces études n’ont effectué aucun dépistage objectif afin de vérifier la présence de troubles de sommeil. Ensuite, la plupart n’ont utilisé qu’une petite quantité d’électrodes, diminuant ainsi la précision du tracé. Alors que l’échantillon de certaines études est restreint compte tenu du protocole de recherche employé, une autre ne prend pas en compte le genre dans les analyses statistiques et ne respecte pas le patron habituel de sommeil des participants. En plus de ces limites, l’ensemble des études se concentre uniquement sur une population non clinique. Par conséquent, il n’y a aucune donnée disponible à ce sujet chez les gens souffrant de divers troubles tels que l’insomnie, qui représente le problème de sommeil le plus répandu (Ohayon, 2002). Les seules études disponibles sur l’activation corticale et la qualité du sommeil des INS utilisent les potentiels évoqués cognitifs et n’évaluent pas directement l’effet de première nuit. Pour ce qui de la mésestimation, le peu d’études qui la met en relation avec l’activation corticale suggère qu’un niveau d’activation plus élevé serait en lien avec un degré de mésestimation plus important. Cependant, les résultats actuels obtenus via l’analyse spectrale sont encore exploratoires et peu convaincantes. En effet, en plus d’y avoir des résultats contradictoires, plusieurs limites peuvent être faites. Les principales concernent essentiellement la grosseur de l’échantillon, la standardisation du protocole et l’utilisation de données provenant exclusivement de la première nuit d’enregistrement de la PSG.
En plus de l’ensemble des limites mentionnées concernant les études sur la fluctuation de la qualité du sommeil et la mésestimation, aucune ne fait directement le lien entre ces deux concepts et l’activation corticale. Dès lors, cette présente étude a d’abord comme but de répondre aux omissions de la littérature sur le sujet, tout en contournant les principales limites identifiées. Ainsi, de faire un pas de plus dans la compréhension du lien qui semble exister entre la mésestimation et l’activation corticale selon la fluctuation de la qualité du sommeil. Finalement, sur le plan clinique, cette étude pourrait permettre de supporter des interventions de prévention (p. ex. la relaxation) visant à diminuer un état d’activation transitoire et ainsi prévenir, par la diminution des plaintes de sommeil, la chronicisation de l’insomnie.
16
Objectifs et hypothèses
Les objectifs de l'étude sont les suivants :
1. Vérifier la présence d’un effet de première nuit chez les différents types de dormeurs. Il est attendu qu’il y aura un effet de première nuit chez les BD, les IPS et les données objectives des IPA. Il n’y aura pas d’effet de première nuit pour les données subjectives des IPA. La qualité subjective de sommeil des IPA sera semblable lors de chacune des nuits puisque ces derniers mésestiment toujours leur sommeil (Salin-Pascual, Roehrs, Merlotti, Zorick & Roth, 1992).
2. Examiner les différences d’activation des types d’insomnie entre les différentes nuits (nuits 1, 2 et 3). Il est attendu que les BD et les IPS auront une activation corticale plus élevée durant la première nuit comparativement aux nuits subséquentes étant donné l’effet de première nuit. Pour ce qui est des IPA, l’activation corticale sera similaire lors de chacune des nuits puisque ces derniers sont constamment activés. Finalement, il n’y aura pas de différence d’activation corticale entre la deuxième et la troisième nuit puisque les participants auront retrouvé leur patron de sommeil habituel.
3. Évaluer si l’activation corticale varie selon le degré de mésestimation. Il est attendu que l’activation variera selon le degré de mésestimation, c’est-à-dire que plus l’activation corticale sera faible, moins la différence entre les données subjectives et objectives sera grande et vice versa.
17
Chapitre 2. Mésestimation du sommeil et effet de
première nuit
18
Mésestimation du sommeil et effet de première nuit en laboratoire
Sleep misperception and first night effect in laboratory
Patrick St-Hilaire, BA1,2 & Célyne H. Bastien, Ph.D1,2
1. École de Psychologie, Université Laval, Québec, Canada
2. Institut Universitaire en Santé Mentale de Québec, Québec, Canada
19
Résumé
Objectifs : L’hyperactivation corticale, principalement retrouvée dans l’insomnie, pourrait être liée à la qualité du sommeil et au degré de mésestimation des données objectives du sommeil. Les objectifs de l’étude sont d’examiner les différences d’activation corticale selon les types de dormeurs entre les nuits et d’évaluer si l’activation corticale varie selon le degré de mésestimation.
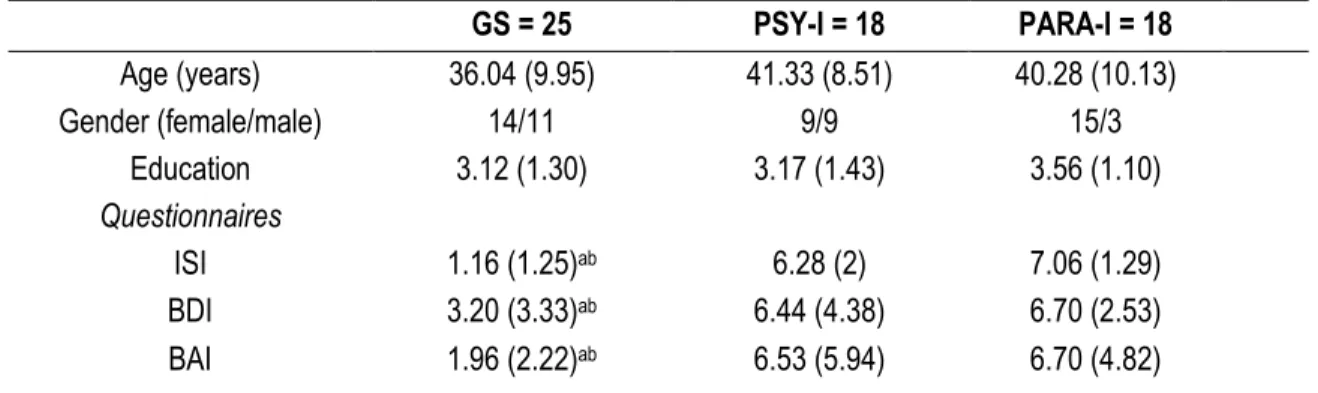
Méthodes : L’analyse spectrale de l’électroencéphalogramme de 61 adultes; 25 bons dormeurs, 18 participants souffrant d’insomnie psychophysiologique et 18 participants souffrant d’insomnie paradoxale, a été réalisée sur trois nuits consécutives.
Résultats : Les résultats suggèrent la présence d’un effet de première nuit pour l’ensemble des dormeurs. Malgré cette exacerbation des difficultés de sommeil, l’activation corticale est similaire pour les différents types de dormeurs. Finalement, les résultats suggèrent qu’il existerait une hypoactivation corticale qui favoriserait une surestimation de la qualité du sommeil comparativement à ce qui est observé avec la polysomnographie. Conclusion : L’étude de cette relation entre les ondes lentes et la surestimation de la qualité du sommeil pourrait être une avenue prometteuse pour le traitement de l’insomnie, qui est avant tout une plainte subjective de difficulté de sommeil.
20
Abstract
Study Objectives: Cortical hyperarousal, observed in insomnia individuals, could be influenced by sleep quality and objective sleep misperception. Usually, to be considered as a first night effect, a decrease in the quality of sleep during the first recording night in the laboratory is observed. The objectives of this study are to examine cortical arousal differences according to sleeper types between nights and to assess if cortical arousal varies according to degree of misperception. Methods: Power spectral analysis has been performed on the EEG of three consecutive nights for 61 adults; 25 good sleepers, 18 participants with psychophysiological insomnia and 18 participants with paradoxical
insomnia.
Results: The results suggest a first night effect for all sleepers, irrespective of type. Despite this exacerbation of sleep difficulties, cortical arousal is similar between the different sleeper types. Finally, results suggest that a cortical hypoarousal, expressed by an increase in Delta power, would promote an overestimation of sleep quantity compared to what is observed with polysomnography. Conclusions: The study of this relationship could be a promising avenue for the treatment of insomnia, this one being foremost a complaint of sleep difficulties.
Keywords: insomnia, hyperarousal, hypoarousal, cortical arousal, first night effect, misperception, overestimation.
21
Introduction
Insomnia is the most frequent reported sleep disorders, with about 30 to 48% of adults presenting symptoms[1] and 10% having symptoms severe enough to meet diagnostic criteria of chronic insomnia[2]. While studies are increasingly focusing on the cortical mechanisms associated with insomnia, most of them concentrate only on different static characteristics, such as cortical hyperarousal, sleep quantity or misperception. The present study is innovative since it is one of the few which actually observes the interaction of all those concepts of interest, that is, the influence of both quantity of sleep and sleep misperception on cortical hyperarousal, mainly found in insomnia individuals (INS).
Chronic insomnia is defined as a subjective complaint of difficulty initiating, maintaining or early morning awakening for at least three months which causes clinically significant distress or impairment in areas of functioning[3]. The International Classification of Sleep Disorders, second edition[4] distinguished several types of insomnia subgroups, the most frequent being psychophysiological insomnia (PSY-I) and paradoxical insomnia (PARA-I). Although suffering individuals both have sleep complaints and daytime consequences, PARA-I differ from PSY-I based on the significant discrepancy observed between sleep perception and polysomnography (PSG) recording. PARA-I misperceive their sleep quality, defined as perception of sleep difficulties which are a longer sleep onset latency (SOL) and wake after sleep onset (WASO) and a shorter total sleep time (TST), while PSG seems normal and comparable to the one of good sleepers (GS). In contrast, the perception of sleep quality in PSY-I is corroborated by PSG. The third version of The International
Classification of Sleep Disorders[5] has removed these subgroups for lack of clarity in clinical settings, but encourages further research work to provide empirical support for classifying these subgroups.
At the core of insomnia resides hyperarousal or increased cortical activity as suggested by the neurocognitive model [6]. Power spectral analysis (PSA), which represents the activity in different frequency bands, is an objective measure of cortical activity. PSA results usually show that in GS, the transition between wakefulness and sleep is characterized by a decrease in the EEG activity in high frequency bands and an increase in low frequency ones, thereby promoting sleep[7]. INS present a power distribution pattern different
22
from that of GS, both at sleep-onset and during sleep. In fact, decreased power in low frequency bands (Theta and Delta) and increased power in high frequency bands (Alpha, Beta and Gamma) are very often observed in INS before and during sleep onset, as well as during the night [8-13]. Increase power in high frequency bands has been associated with waking cognitive processes such as attention and perception [14,15]. These results are consistent with higher cortical arousal in INS and enhanced information processing, interfering with mechanisms allowing the adequate transition from wakefulness to sleep. Interestingly, a relationship between increased cortical activity and sleep quantity underestimation exists. Some researchers have observed that higher Beta activity or lower Delta/Beta ratio is associated with higher degrees of difference between subjective and objective TST [13] and SOL [16], while another study reports a negative correlation between Beta activity and WASO misperception [17].
Altogether, these results provide a complicated picture of the link between cortical arousal and misperception. In short, few studies suggest that the degree of misperception is related to cortical arousal. Moreover, some show that PARA-I display a cortical arousal pattern even more pronounced than PSY-I [18]. Nevertheless, the study of the relationship between cortical arousal and misperception remains very exploratory and several limits are to be considered. In fact, most results derive from a single night of PSG recordings (night 1 or 2). This is problematic as sleep patterns can differ across nights, both for INS and GS [19]. In fact, a first-night effect, which refers to the tendency to sleep less during the first laboratory night than on subsequent ones, is often observed in GS. This effect can be observed through the objective measurement of PSG, which typically shows an increase in SOL, REM sleep and deep sleep stages (stages 3 and 4) latency, a decrease in TST, less REM sleep and lower sleep efficiency (SE) [20-22]. While those studies have observed this phenomenon in GS and in INS, others do not observe any differences whatsoever between the first night and consecutive nights in the sleep laboratory [23,24].
First night effects of REM sleep increased power in Delta, Theta and Beta1 bands and decreased mean power frequency of the second night compared to the first one has been observed in GS [25]. In fact, a slow wave rebound on night 2 can also be observed [26]. As regards to cortical activity distribution over the
23
scalp, an increase in Delta power in the central region during the first night and an increase in Beta power at posterior sites have been observed [27]. Finally, greater activity in Alpha and Gamma bands and lower activity in Theta and Sigma bands was observed during awakenings and while falling asleep on the first night compared to the two subsequent ones [28]. On the other hand, reverse first night effect was even observed in some INS [29,30] thus reporting a better sleep quality night (greater sleep quantity) on the first night than subsequent ones. These results [25-28] altogether, seem most consistent with a transient hyperarousal in GS during the first night compared to subsequent ones. This could be partly responsible for the typical sleep difficulties defined as a first night effect. Strangely, no study has yet used spectral analysis to examine the relationship between cortical arousal and sleep quantity among INS. Would hyperarousal also be transient in these individuals? In addition, could cortical hyperarousal, as measured by an increase in activity of high power frequency bands and/or decrease in activity of low power frequency bands, be linked to the degree of misperception on different nights spent in the laboratory in INS? The present research aims to further the understanding of the link existing between cortical arousal and sleep misperception, which is assessed through sleep quantity fluctuations.
First, we will investigate if a first night effect is present amongst types of sleepers. It is expected that there will be a first night effect for GS, PSY-I and for objective data in PARA-I. The PARA-I subjective sleep quantity will be similar on consecutive nights since they always misperceive sleep [31].
Secondly, we will investigate arousal differences among groups and between nights (nights 1, 2 and 3). It is expected that GS and PSY-I will display higher cortical arousal during the first night compared to subsequent nights because of a first night effect. On the other hand, for PARA-I, cortical arousal will be similar between nights since they are constantly aroused. There will be no arousal difference between the second and third night as all the participants will return to their usual sleep pattern.
Finally, assessing whether cortical arousal varies according to the degree of misperception is a third objective of the present research. It is expected that arousal will vary according to the degree of misperception:
24
lower cortical arousal will be associated with less discrepancy between objective and subjective data and vice versa.
Methods
Participants
Participants originate from a database of studies conducted between 2004 and 2011, as part of research projects in the Sleep and Cognitive Evoked Potentials Laboratory of the Centre de recherche de l’Insitut universitaire en santé mentale de Québec (CERVO), from which the project was approved for ethics (#303-2012).
Good sleepers
Participants report being satisfied with their sleep. Participants do not report any subjective complaints of sleep difficulties or daytime sleep-related consequences do not meet insomnia’s diagnostic criteria and do not use sleep-promoting medication. They have a mean SE of 85% or more on two weeks of sleep diary and a score lower than 8 on the Insomnia Severity Index [32].
Insomnia participants
The INS meet the following inclusion criteria: (a) presence of a subjective complaint of insomnia, defined as difficulty initiating (SOL > 30 minutes) and/or maintaining sleep (WASO > 30 minutes) and/or early-morning awakening for a minimum of three nights per week; (b) insomnia duration had to be at least 6 months; (c) insomnia and/or its perceived consequences is responsible of significant distress and/or alteration of functioning and (d) the presence of a subjective complaint of at least one negative consequence due to lack of sleep (e.g. fatigue, irritability). Inclusion criteria match those of the International Classification of Sleep
Disorders [5] and the Diagnostic and Statistical Manual of Mental Disorder[3] for insomnia [33].
Insomnia subgroups: psychophysiological and paradoxical
To ensure that the two subgroups of INS are distinct, the inclusion criteria for the PARA-I and PSY-I match those defined by St-Jean and Bastien [34]. These criteria, which are based on those of Edinger et al., [35] are preferred to the latter as they propose a better discrimination between PARA-I and PSY-I, by putting
25
more operational criteria on the difference between objective and subjective data. To be part of the PARA-I group, individuals must present on two consecutive PSG recording nights: 1) a TST ≥ 380 minutes and a SE ≥ 85%; 2) an overestimation of ≥ 60 minutes of their SOL, an underestimation of ≥ 60 minutes of their TST or ≥ 15% of their SE based on the difference between objective (PSG recording) and subjective (sleep diary filled in laboratory) sleep measures. If INS do not meet these criteria, they are then included in the subgroup of PSY-I.
Exclusion criteria
Exclusion criteria for all participants are: (a) Current presence of a medical condition (e.g. cancer, diabetes) or neurological disorder (e.g. dementia, Parkinson’s disease) that can significantly disrupt sleep; (b) presence of a major psychopathology (e.g. anxiety disorder, mood disorder); (c) alcohol or drugs abuse during the past year; (d) evidence of another sleep disorder (e.g. sleep apnea index ≥ 10 or periodic limb movement index ≥ 10 during sleep); (e) a score of 23 or higher on the Beck Depression Inventory [36]; (f) use of psychotropic or other medications known to impair sleep (e.g. bronchodilators); and (g) use of a sleep-promoting agent (e.g. benzodiazepines). Participants using medication to facilitate sleep, twice a week or less, had to follow a two-week withdrawal period before entering in the study.
Research protocol
Procedure
All participants were recruited via newspaper advertisements. Participants were asked to complete the Beck Depression Inventory [36] and Beck Anxiety Inventory, [37] sleep; sleep diary for two weeks and the Insomnia Severity Index37. These questionnaires provide all good psychometric validity and reliability [36-38]. Those corresponding to our research criteria were invited for a clinical interview. The Structured Clinical Interview for DSM-IV Axis I Disorders [39] and the Insomnia Diagnostic Interview [32] were administered respectively by a doctoral student in clinical psychology and a sleep specialist. Potential participants were then invited to undergo four consecutive nights of PSG recording at the sleep laboratory. Participants received a thorough evaluation of their sleep and an honorarium for their participation.
26
Materials
The Insomnia Diagnostic Interview[32] is designed in a semi-structured format and evaluates the presence of insomnia and the factors that can potentially contribute.
The sleep diary [32] is a daily diary assessing the subjective quality of sleep. The different sleep-wake parameters measured are: SOL, WASO, morning awakening, awakening frequency during the night, total time spent in bed, TST and SE. The sleep diary is usually completed upon arising each morning for a 2-week baseline period preceding the recording nights. Thereafter, participants complete the sleep diary each morning in the sleep laboratory. A mean value was calculated for each variable of the sleep diary.
The Insomnia Severity Index [32] is an instrument reliable and valid for determining quantitatively the insomnia severity index as perceived by the participant and his entourage [38,40]. To assess the severity of insomnia symptoms, a severity score of 12 points from the first three questions of the ISI was used rather than the total score. Each item is rated on a 5-point Likert scale. Higher scores reflect higher insomnia severity.
Polysomnographic recording
Participants slept four consecutive nights in the sleep laboratory. They arrived at the sleep laboratory at around 8:00 p.m. each night to complete electrodes montage and preparation. They were instructed to refrain from alcohol, drugs, caffeine and nicotine before coming to the laboratory. Bedtime and the time spent in bed are determined by the bedtime and time in bed usually reported in the sleep diary, with a minimum of 8 hours of PSG recording. Lights-out was initiated after bio-calibration and was similar for the three nights of each participant (between 10:30 pm and 7:30 am).
Standard PSG montages (10-20 system) were used for all nights and included electroencephalography (EEG; Fp1, Fp2, F3, F4, Fz, C3, C4, Cz, P3, P4, Pz, O1 and O2), electromyography (chin), electrocardiography (heart) and electrooculography (left and right supra-orbital ridge of one eye and the infra-orbital ridge of the other) recordings. The electrooculography especially allows rejection of EEG artifacts caused by EOG movement or blinking. Moreover, breathing and electromyography (electrodes on the anterior tibialis) are monitored during the first PSG recording night in order to document the presence of other sleep