CULTURE « DYNAMIQUE » : IMPACT SUR LA
RECONSTRUCTION DE TISSUS CONJONCTIFS
PAR GÉNIE TISSULAIRE
Mémoire présenté
à la Faculté des études supérieures de l'Université Laval
dans le cadre du programme de maîtrise en Biologie Cellulaire et Moléculaire pour l'obtention du grade de maître es sciences (M. Sc.)
FACULTE DE MEDECINE UNIVERSITÉ LAVAL
QUÉBEC
2010
Des millions de chirurgies de reconstruction sont réalisées chaque année pour remplacer les tissus endommagés. Grâce au génie tissulaire, il est possible de reconstruire du tissu conjonctif humain par la méthode d'auto-assemblage à partir des fibroblastes dermiques (FD) ou des cellules stromales/souches isolées du tissu adipeux (CSTA), sans biomatériau exogène. Dans le but d'optimiser la production des tissus, nous avons évalué l'impact d'une culture dynamique (milieu en mouvement constant) en utilisant une plate-forme agitatrice. Cette approche s'est traduite par la reconstruction de tissus conjonctifs humains 1,8 fois plus épais à partir des CSTA. De plus, cette approche a permis de réduire les délais de reconstruction tissulaire de 2 semaines, ainsi que la production d'équivalents tissulaires plus épais. Bref, la production de tissus conjonctifs humains est donc améliorée par la culture dynamique.
Abstract
Millions of surgical procedures are performed each year to replace damaged tissues. Tissue engineering approaches to create living tissue equivalents have gained considerable attention. Mesenchymal cells such as dermal fibroblasts (DF) or adipose-derived stromal/stem cells (ASCs) can be used to engineer connective tissues by the self-assembly approach, without the need of exogenous biomaterials. In an effort to optimize tissue reconstruction, we evaluated the effect of a dynamic culture (wave-like movement) by using a rotating platform. This approach lead to the production of 1,8 fold thicker constructs with ASCs. Also, this approach resulted in a reduction of the production time by 2 weeks, as well as the reconstruction of thicker tissues. Therefore, the production of human connective tissues was improved by dynamic culture.
Remerciements
Tout d'abord, je tiens à remercier infiniment ma directrice Julie Fradette Ph.D., pour son support inconditionnel, sa patience, sa grande disponibilité, mais surtout pour m'avoir constamment motivé et encouragé. Je remercie également Lucie Germain Ph.D. et Dr François Auger de m'avoir accueilli au LOEX.
Je désire aussi remercier tous les membres de l'équipe LOETA. Un merci spécial à Caroline Vincent, Valérie Trottier, anciennes étudiantes de l'équipe qui sont devenues les assistantes de recherche. Également, je veux remercier Maryse Proulx, Catherine Villeneuve, Benoît M.-Labbé qui sont les autres étudiants sous la supervision de Julie Fradette, pour leur aide précieuse et leurs encouragements très appréciés. Je remercie spécialement Lucie St-Pierre, notre ancienne assistante de recherche, pour son apport précieux à mes travaux. Aussi, je remercie tous les étudiants stagiaires. Je tiens à exprimer ma gratitude à Maud Vallée Ph.D. pour m'avoir appris les principes du PCR et à Robert Gauvin Ph.D. pour avoir réalisé tous les tests mécaniques.
Merci à toute la grande famille du LOEX qui, selon moi, se distingue particulièrement des autres équipes de recherche à l'échelle internationale.
Un merci personnel à ma mère Lucille (Mom), mon père Pierre (Pa), mon frère Stéphane (Master), ma sœur Amélie (Sister) et ma grand-mère Thérèse (Grand-Ma) et tous mes amis proches pour leur soutien alors que ma présence parmi eux se faisait plus rare.
Finalement, un merci spécial à mon amoureuse Katia (Babe) pour sa patience, son soutien moral et surtout pour sa présence à mes côtés dans les moments les plus importants.
Résumé i Abstract ii Remerciements iii
Table des matières v Liste des abréviations vii Liste des tableaux ix Liste des figures x Chapitre 1 : Introduction générale 1
1.1 Génie tissulaire 2 1.1.1 Reconstruction de tissus conjonctifs in vitro 4
1.1.2 Source cellulaire 6 1.1.3 Types d'échafaudages disponibles pour la reconstruction tissulaire 8
1.2 Éléments du tissu conjonctif 14 1.2.1 Collagènes : Biosynthèse et structure 14
1.2.2 Glycosaminoglycannes 20 1.2.3 Protéoglycannes 20 1.2.4 Glycoprotéines 21 1.2.5 Intégrines 22 1.2.6 Autres composantes 22
1.3 Culture dynamique : méthode complémentaire à la reconstruction tissulaire 23
1.3.1 Utilité et complexité des bioréacteurs 24 1.3.2 Concept du mouvement fluidique 26
1.3.3 Culture dynamique à partir d'un Spinner Flask 27 1.3.4 Autres modèles de tissus conjonctifs reconstruits dans un contexte de culture
dynamique 28 1.4 Hypothèse et objectifs 30
Chapitre 2 : Matériels et méthodes 32 2.1 Provenance des cellules 33
2.1.1 Cellules stromales/souches isolées du tissu adipeux humain (CSTA) 33
2.1.2 Fibroblastes dermiques humains (FD) 33
2.2 Culture cellulaire 34 2.3 Reconstruction de feuillets et de tissus conjonctifs par auto-assemblage 35
2.3.1 Cinétique de reconstruction des tissus conjonctifs humains 36 2.3.2 Reconstruction de feuillets cellulaires humains servant à l'étude des mécanismes
impliqués lors de la culture dynamique 38 2.4 Homogénéisation des feuillets cellulaires par sonication 38
2.5 Analyses histologiques 39 2.6 Test de résistance mécanique 39 2.7 Évaluation de l'expression des transcrits par RT-PCR quantitatif 41
2.8 Dosage des protéines totales par la méthode de microBCA 42 2.9 Dosage fluorométrique de l'ADN total par Picogreen 43 2.10 Analyse par microscopie électronique à transmission 44
2.11 Analyses statistiques 44 Chapitre 3 : Résultats 45
3.1 Impact de la culture dynamique sur la production de tissus conjonctifs humains 46 3.2 Mécanismes influençant la synthèse et l'assemblage des éléments de la MEC en
condition dynamique 50 3.3 Réduction du temps de production des tissus conjonctifs humains 55
3.4 Résistance mécanique des tissus conjonctifs reconstruits 63
Chapitre 4 : Discussion 67 4.1 Impact de la culture dynamique sur la reconstruction de tissus conjonctifs 68
4.2 Avantages et perspectives 72 Chapitre 5 : Conclusion 75
Liste des abréviations
(Termes anglais en italique) AA Acide ascorbique
ADN Acide désoxyribonucléique ARN Acide ribonucléique
ASC Adipose-derived stem/stromal cells BMP-1 Bone morphogenetic protein-1 CE Cellules endothéliales
CSM Cellules souches mésenchymateuses humaines
CSMO Cellules souches mésenchymateuses isolées de la moelle osseuse CSTA Cellules stromales/souches mésenchymateuses isolées du tissu adipeux DHA Déhydroascorbate
FD Fibroblastes dermiques humains FN Fibronectine
FI Fluide interstitiel
GLUT Glucose transporter isoform GAG Glycosaminoglycannes HYL Hydroxylysine
HYP Hydroxyproline IMC Indice de masse corporelle
LOEX LH MEC MMP MET NGF PEG PG P4H PLGA PBS RE RT-PCR SIS SVCT TGF-P TIMP TNF UTS
Laboratoire d'Organogénèse Expérimentale Lysyl hydroxylase
Matrice extracellulaire Métalloprotéinases
Microscopie électronique à transmission Nerve growth factor
Polyéthylèneglycol Protéoglycannes Prolyl-4-hydroxylase
Poly(lactic-co-glycolic acid) Tampon saline phosphate Reticulum endoplasmique
Réaction en chaîne par polymerase en temps réel Small intestine submucosa
Sodium-dependent vitamin C transporter Transforming growth factor beta
Tissue inhibitor of matrix metalloproteinase Tumor necrosis factor
Ultimate tensile strength
Liste des tableaux
Tableau 1.1 : Composition et localisation des différents types de collagènes présents dans
les tissus conjonctifs 15 Tableau 2.1 : Caractérisation des populations cellulaires de CSTA utilisées 33
Tableau 2.2 : Caractérisation des populations cellulaires FD utilisées 34
Tableau 2.3 : Amorces utilisées pour les RT-PCR quantitatifs 42 Tableau 3.1 : Évaluation du pourcentage de feuillets cellulaires manipulables et utilisables
pour la reconstruction des tissus conjonctifs humains 58 Tableau 3.2 : Comparaison de la périodicité et de la densité des fibres de collagène
contenues dans les tissus conjonctifs humains reconstruits selon la condition de
Figure 1.1 : Diversité des approches développées par le génie tissulaire 3 Figure 1.2 : Multipotence des cellules stromales/souches mésenchymateuses isolées du
tissu adipeux 7 Figure 1.3 : Principe de la décellularisation 12
Figure 1.4 : Principe de l'auto-assemblage en génie tissulaire 13 Figure 1.5 : Interaction entre les différents éléments de la MEC et avec la surface des
cellules présentes dans le tissu conjonctif. 14 Figure 1.6 : Étapes de la synthèse, de la sécrétion et de l'assemblage des fibres de
collagène 17 Figure 1.7 : Mécanisme d'intégration de la vitamine C dans la cellule 19
Figure 1.8 : Modélisation de l'interaction entre une molécule de décorine et le collagène.21
Figure 1.9 : Concept de la culture dynamique à l'aide de bioréacteurs 25
Figure 1.10 : Spinner Flask 27 Figure 2.1 : Plate-forme agitatrice 3D 35
Figure 2.2 : Schématisation de la production des tissus conjonctifs par la méthode
d'auto-assemblage 36 Figure 2.3 : Représentation schématique des principales étapes de reconstruction des
feuillets et tissus conjonctifs humains en condition de culture statique et
dynamique 37 Figure 2.4 : Étapes effectuées lors du test de résistance mécanique 40
Figure 3.1 : Aspect histologique représentatif des tissus conjonctifs reconstruits par
auto-assemblage selon les conditions de culture utilisées 47 Figure 3.2 : Épaisseur des tissus conjonctifs humains reconstruits avec les CSTA et les FD
selon la méthode de culture statique ou dynamique 48 Figure 3.3 : Pourcentage de contraction des tissus conjonctifs reconstruits à partir des
CSTA selon la méthode de culture statique ou dynamique 49 Figure 3.4 : Contenu en ADN des feuillets et tissus conjonctifs produits selon les
différentes conditions de culture 50 Figure 3.5 : Ratio des valeurs d'expression relative des transcrits par RT-PCR quantitatif à
partir de feuillets cellulaires de 7 jours selon les conditions de culture 52 Figure 3.6 : Ratio des valeurs d'expression relative des transcrits par RT-PCR quantitatif à
partir de tissus conjonctifs de 35 jours selon les conditions de culture 53 Figure 3.7 : Aspect histologique représentatif des tissus conjonctifs reconstruits en
condition dynamique par auto-assemblage pendant différentes périodes de
culture 56 Figure 3.8 : Épaisseur des tissus conjonctifs humains reconstruits sur une période de 21, 28
et 35 jours selon les conditions de culture 57 Figure 3.9 : Contenu en ADN mesuré dans des feuillets cellulaires cultivés, à différentes
périodes (14, 21 et 28 jours), selon les conditions de culture 59 Figure 3.10 : Influence de la culture dynamique sur le dépôt des protéines totales selon le
temps de culture 61 Figure 3.11 : Résistance mécanique des tissus conjonctifs humains reconstruits en culture
Figure 3.12 : Aspect en microscopie électronique à transmission d'un tissu conjonctif
Chaque année, des millions de chirurgies de reconstruction sont réalisées
(www.plasticsurgery.org) à la suite de la perte de tissus causée par des accidents, des brûlures ou bien suite à la résection de tissu cancéreux. Pour combler la perte des tissus lésés, les médecins effectuent des transplantations de tissus sains pouvant régénérer les parties endommagées. Lorsqu'il est possible de le faire, des greffes de tissus d'un site anatomique sain du patient vers le site lésé sont réalisées. Dans ce cas précis, il est question de greffe autologue. Par exemple, pour des patients ayant subi des brûlures au niveau de la peau, ce type d'intervention s'avère approprié. Par contre, lorsqu'il est impossible de prélever des biopsies de tissus sains (sites donneurs) en raison de la gravité des brûlures pouvant atteindre jusqu'à 90 % du corps, alors on peut avoir recours à l'utilisation de tissus sains provenant d'une autre personne (allogreffe) ou bien du corps d'un cadavre (Cuono et al. 1986) ou d'un animal (xénogreffe) comme le porc (Elliott et al. 1973). Toutes ces alternatives, en considérant la greffe de tissu réalisable, s'avèrent en réalité des approches difficiles à effectuer en raison de la rareté et de la pénurie des tissus disponibles. Le génie tissulaire, qui est une approche multidisciplinaire en pleine expansion, représente donc une stratégie intéressante et originale pour combler le besoin grandissant de tissus et d'organes nécessaires lors de chirurgies de reconstruction. L'un des principaux buts du génie tissulaire est de créer des équivalents tissulaires in vitro qui serviront de substituts de remplacement.
Le terme « génie tissulaire » a été employé pour la première fois en 1980. À l'époque, le génie tissulaire représentait les technologies se spécialisant dans la fabrication de substituts et de prothèses synthétiques. Les études étaient réalisées dans le but d'explorer le comportement des cellules dans une matrice non biologique. Ce concept d'étude a évolué depuis. Les connaissances du comportement cellulaire lors des processus de formation tissulaire dans un contexte tridimensionnel ont grandement avancées depuis ce temps.
Bref, le génie tissulaire apporte d'une certaine manière une solution innovatrice à la pénurie d'organes et de tissus qui se font rares pour des greffes. La figure 1.1 illustre bien les
rapprochent le plus possible des conditions in vivo. En fait, le génie tissulaire est un domaine de la recherche médicale qui combine deux aspects principaux, soit la connaissance approfondie des biomatériaux, et la compréhension accrue du comportement cellulaire. En combinant ces deux aspects, il est possible de produire des équivalents biologiques par ingénierie tissulaire.
Degradation rate
Modification
S I \
Growth Cell Genes factors adhesion DNA
\
peptides /
. I
/
Tissue Engineering Approaches
—
c m
<
In microsphere. attached to polymer scaffolds, mixed into scaffold
Differentiated j cells isolated / Embryonic
from adult Adult s«e m c e l l s
tissue stem cells
Tissue stem cells
\
Implantation
Stimulation (from Scaffolds. External)
. ' ' / I \
Chemical Electrical Mechanical \ Cultivation-Bioreactor (Fcx oxygen, nutrients) Static _ Dynamic Perfusion / Shaking RotatingFigure 1.1 : Diversité des approches développées par le génie tissulaire [tirée de (Levenberg et al. 2004)].
Le tissu conjonctif est, par définition, un tissu d'origine mésodermique servant de support et de soutien. Il est présent dans la majorité des sites anatomiques du corps humain. Il est principalement composé d'une matrice extracellulaire (MEC) formée majoritairement de collagène de type I sécrété et assemblé par les cellules mésenchymateuses telles que les fibroblastes ou les cellules stromales. Des macrophages, de même que des cellules endothéliales qui forment un réseau de capillaires sanguins responsable de l'apport en nutriments et en oxygène, y sont aussi présents. Il existe plusieurs types de tissus conjonctifs dont ceux de type lâche, de type dense ainsi que ceux de type cartilagineux. Le tissu conjonctif lâche est représenté par le tissu adipeux et le derme de la peau. Le tissu conjonctif dense est présent dans les muscles et les os. Le tissu conjonctif de type cartilagineux est particulier puisqu'il est formé d'une matrice entièrement composée de collagène de type II.
À noter que dans le présent travail, une attention particulière est portée sur les composantes principales de la MEC de même que sur les cellules présentes dans le tissu conjonctif. Dans le contexte de reconstruction d'un tissu conjonctif par génie tissulaire, les biomatériaux représentent la MEC dans laquelle se retrouvent les cellules. La production d'un tissu implique donc la création d'un substitut biologique dans un contexte tridimensionnel. L'importance du contexte tridimensionnel réside dans le fait que les cellules, par exemple les fibroblastes, se comportent différemment lorsqu'ils sont cultivés en 2 dimensions versus en 3 dimensions (Cukierman et al. 2001). D'ailleurs, les tissus reconstruits in vitro dans un contexte tridimensionnel ont l'avantage de se rapprocher encore plus des conditions biologiques in vivo.
La reconstruction de tissus conjonctifs par génie tissulaire peut être réalisée selon trois grandes stratégies. La première consiste à utiliser des biomatériaux naturels ou synthétiques capables de soutenir les cellules pendant leurs activités de régénération. Pour ce faire, l'utilisation d'échafaudages comme les gels, les hydrogels de collagènes et les éponges sont nécessaires. La deuxième approche consiste à utiliser une matrice décellularisée dont la
stratégie, nommée l'auto-assemblage, se veut une approche originale et prometteuse pour enrayer les problèmes liés aux réactions immunologiques lors de la greffe de tissu. Cette dernière stratégie permet de reconstruire, entre autres, des substituts composés de matrice extracellulaire entièrement naturelle. L'auto-assemblage se base sur le fait que les propres cellules mésenchymateuses d'un patient ont la capacité de se régénérer et de produire leur propre MEC (Grinnell et al. 1989, Hâta et al. 1989, Ishikawa et al. 1997, L'Heureux et al. 1998). C'est l'une des principales propriétés qui distinguent cette stratégie de celles qui préconisent l'emploi des biomatériaux. Au Laboratoire d'Organogénèse Expérimentale (LOEX), la méthode d'auto-assemblage a été développée depuis les 15 dernières années afin de reconstruire différents types de tissus in vitro sans l'utilisation des biomatériaux exogènes. Grâce à cette technologie, il est possible de reconstruire des dermes de type conjonctifs servant de tissus de remplacement. Ces dermes ou stroma peuvent ainsi servir de support pour la reconstruction de tissus spécialisés tels que la peau (Michel et al. 1999, Trottier et al. 2008) et des substituts urologiques (Bouhout et al. 2010, Magnan et al. 2009).
Il ne faut pas oublier que le choix du type cellulaire influence largement le type d'organe ou de tissu à reconstruire. Dans le domaine de la reconstruction de tissu conjonctif par génie tissulaire, les fibroblastes dermiques constituent une source classique de cellules utilisées notamment pour la reconstruction dermique (Auger et al. 1995). Avec la découverte de cellules post-natales multipotentes provenant de la moelle osseuse ou du tissu adipeux, de nouvelles opportunités sont maintenant disponibles afin de produire des tissus conjonctifs spécialisés tels que les os et le tissu adipeux. Les cellules souches mésenchymateuses isolées de la moelle osseuse (CSMO) décrites par Caplan (Caplan 1991) sont les premières cellules post-natales à avoir été exploitées en génie tissulaire. Ces cellules souches de source mésenchymateuse (CSM) sont reconnues comme étant multipotentes. Une autre source de cellules souches mésenchymateuses a été identifiée depuis 2001. Il s'agit des cellules stromales/souches mésenchymateuses isolées du tissu adipeux (CSTA) (Zuk et al. 2002, Zuk et al. 2001). Les CSTA représentent une population de cellules souches adultes très populaire actuellement en génie tissulaire, mais également en médecine régénératrice,
comportementale des cellules souches (Zuk 2010).
1.1.2 Source cellulaire
Fibroblastes dermiques humains (FD)
Les fibroblastes sont d'origine mésenchymateuse et ils se retrouvent dans une multitude de sites anatomiques. Ils sont facilement amplifiés et conservent leur morphologie fusiforme en culture. Ce type de cellule sécrète la matrice extracellulaire, c'est-à-dire les éléments qui forment le tissu conjonctif comme les fibres de collagènes, les glycoprotéines et les protéoglycannes. En fait, le fibroblaste joue un rôle primordial dans la synthèse de la MEC. Ces cellules possèdent une multitude d'autres fonctions biologiques. Elles sécrètent des facteurs de croissance ainsi que des cytokines influençant la prolifération cellulaire. Les fibroblastes expriment une panoplie de récepteurs de surface leur permettant de répondre aux stimuli produits par l'environnement extérieur (Sorrell et al. 2009). Ainsi, ces cellules mésenchymateuses interagissent avec les autres types cellulaires tels que les kératinocytes qui constituent la partie de la couche épidermique de la peau. Les FD sont notamment utilisés en génie tissulaire afin de reconstruire des substituts cutanés (Auger et al. 1995, Bell et al. 1981, Lamme et al. 2000).
Cellules stromales/souches mésenchymateuses du tissu adipeux humain (CSTA)
Le tissu adipeux est composé d'adipocytes remplis de lipides et d'un stroma constitué de fibroblastes, de préadipocytes, de cellules endothéliales et de macrophages. Dans ce mélange hétérogène, une population de cellules souches multipotentes s'y retrouvent (Zuk et al. 2002, Zuk et al. 2001). Jusqu'à 2 % des cellules stromales du tissu adipeux seraient des cellules souches, comparativement à 0,002 % dans le cas de la moelle osseuse; source la plus connue, mais moins accessible de cellules souches mésenchymateuses (Strem et al. 2005). Ces cellules stromales/souches adultes sont d'origine mésenchymateuse et elles ont une morphologie qui se rapproche de celle des fibroblastes. Elles sont multipotentes et ont la capacité de s'auto-renouveler, de proliférer et de se différencier en chondrocytes, en neurones (Anghileri et al. 2008, Ashjian et al. 2003, Safford et al. 2002), en cellules
cultivées dans un milieu contenant un cocktail d'inducteurs spécifiques (Zuk et al. 2002, Zuk et al. 2001) (Figure 1.2). Les CSTA sont reconnues pour sécréter une panoplie de facteurs de croissance dont le VEGF (vascular endothelial growth factor), des interleukines, des adipokines, le TNF-alpha (tumor necrosis factor-alpha) et même le NGF (nerve growth factor) (Salgado et al. 2010). C'est cette fonction endocrine qui les rend si intéressantes pour les thérapies cellulaires.
Tissu
adipeux DissociationCellules stromales
Cartilage
Préadipocytes
Adipocytes
Cellules souches
Neurones
Muscle
Figure 1.2 : Multipotence des cellules stromales/souches mésenchymateuses isolées du tissu adipeux. (© Julie Fradette, LOEX)
En 2006, The Mesenchymal and Tissue Stem Cell Committee of the International Society for Cellular Therapy a proposé un minimum requis de critères pour définir les CSM en général. Premièrement, les CSM doivent adhérer au plastique lorsqu'elles sont maintenues en culture dans des conditions standards de culture cellulaire. Deuxièmement, elles doivent exprimer les marqueurs de surface cellulaire CD 105, CD73 et CD90 et elles ne doivent pas exprimer CD45, CD34, CD 14 qui sont, entre autres, des marqueurs de cellules hématopoïétiques. Troisièmement, les CSM doivent pouvoir se différencier en ostéoblastes, en adipocytes et en chondroblastes in vitro (Dominici et al. 2006).
En 2008, The International Federation of Adipose Therapeutics and Science (IFATS), société multidisciplinaire internationale axée sur la biologie des cellules stromales/souches issues du gras humain, a défini que le terme ASC (adipose-derived stem/stromal cells) serait utilisé pour identifier les CSTA (Daher et al. 2008), car de multiples équipes utilisaient des terminologies différentes pour le même type de cellules.
Les CSTA font partie de la famille des cellules souches adultes ou des cellules somatiques. Les premières cellules souches adultes ont été découvertes en 1963 (Becker et al. 1963) et, en fait, elles étaient des cellules de type hématopoïétiques. Par la suite, les CSMO ont été découvertes en 1968 (Friedenstein et al. 1968). En 1985, des cellules souches adultes ont été découvertes dans le cordon ombilical (Emerson et al. 1985) et en 1992, l'équipe de Reynolds et ses collaborateurs (Reynolds et al. 1992) a démontré la pluripotence des cellules souches neuronales. Ce n'est qu'au début des années 2000 qu'ont été découvertes les CSTA par l'équipe de Marc H. Hedrick (Zuk et al. 2002, Zuk et al. 2001).
Les cellules souches adultes sont typiquement isolées à partir de la moelle osseuse ou du sang. Les procédures pour obtenir les CSMO peuvent être douloureuses et elles peuvent nécessiter une opération médicale avec anesthésie. Il faut préciser que dans le cas du prélèvement des CSMO, l'opération s'avère très pénible pour les patients. Toutefois, dans le cas du prélèvement des CSTA par lipoaspiration, les procédures sont moins invasives. De plus, cette population cellulaire a l'avantage d'être facilement accessible en plus d'être abondante. Grâce à la multipotence des CSTA, ces cellules sont grandement intéressantes pour diverses applications en génie tissulaire (Gimble et al. 2007).
1.1.3 Types d'échafaudages disponibles pour la reconstruction tissulaire
Une panoplie de types d'échafaudage ou de biomatériaux furent développés dans le but d'étudier le comportement des cellules dans un contexte tridimensionnel. Ces modèles ont aussi été produits afin de fournir un environnement mimant les conditions des tissus natifs dans lesquelles les cellules prolifèrent et se différencient pour former des tissus spécialisés fonctionnels tels que les os, la peau, le cartilage et bien d'autres. Chaque type
développement d'une aussi grande variété de biomatériaux afin de rencontrer les spécificités de chaque tissu à l'étude. Ils sont catégorisés en trois groupes. Le premier, et probablement le plus couramment utilisé, consiste à cultiver les cellules à l'intérieur de biomatériaux produits à partir de substances naturelles ou synthétiques. Différents biomatériaux ont été développés et divisés en plusieurs groupes dont les gels, les hydrogels et les éponges de collagène. La seconde catégorie pour produire des structures d'échafaudage consiste à utiliser tout simplement la matrice extracellulaire d'un tissu existant, puis de retirer toutes les cellules par un procédé nommé décellularisation. Ainsi, il est possible d'obtenir une matrice entièrement naturelle, avec des structures déjà établies, dans laquelle des cellules voulues peuvent y être ajoutées à nouveau. La dernière catégorie nommée auto-assemblage consiste à stimuler les cellules à sécréter et à organiser leur propre MEC in vitro (Grinnell et al. 1989, Hâta et al. 1989, Ishikawa et al. 1997, L'Heureux et al. 1993), sous l'action de l'acide ascorbique, dans le but de produire une matrice entièrement naturelle. À l'aide de cette approche, il est même possible de produire des substituts cutanés en ajoutant des cellules épidermiques (kératinocytes) sur le derme reconstruit par génie tissulaire (Michel et al. 1999). En outre, l'un des avantages les plus intéressants de l'auto-assemblage réside dans l'absence d'utilisation de biomatériaux exogènes, ce qui élimine la majorité des problèmes liés aux réactions immunologiques à la suite d'une greffe de tissu, si les cellules proviennent du patient même.
Gels de collagène
Le gel de collagène peut être conçu à partir de collagène bovin ou même de collagène recombinant humain. Ce type de biomatériau peut servir comme matière de délivrance graduelle de drogues (Wallace et al. 2003). En 1962, Grillo et Gross (Grillo et al. 1962) furent les premiers à proposer l'utilisation du gel en tant qu'implant médical. Ce biomatériau est couramment employé et a l'avantage d'être simple à produire. En dépit de leurs avantages, les gels de collagènes ont des limitations. Ils sont fragiles lors de manipulations chirurgicales en plus de ne supporter que de faibles charges extensibles in vivo (Wallace et al. 2003). Le gel de collagène peut également servir comme tissu de
remplacement pour traiter des ulcères cutanés sur les pieds de patients diabétiques. Au Canada, des entreprises spécialisées dans la vente de produits biologiques comme le Neomem , une membrane à base de collagène bovin de la compagnie Cytagenix, produisent des tissus de remplacement réalisés à base de gel de collagène.
Hydrogels
Les hydrogels sont constitués d'un réseau de chaînes polymères préalablement solubles dans l'eau dans lesquels des cellules y sont ajoutées ou non. Après un processus de reticulation (cross-linking), les substances deviennent insolubles et les cellules s'y retrouvent emprisonnées. Ce type d'échafaudage est particulièrement intéressant pour son potentiel de rétention d'eau très élevé. Ainsi, lors de l'utilisation de tels matériaux comme tissu de recouvrement temporaire pour traiter de sévères brûlures, ces biomatériaux représentent d'excellents pansements pour maintenir un environnement humide (Burd 2007).
Il existe différents types d'hydrogels dont certains sont formés de polymères naturels et d'autres synthétiques. Les polymères naturels sont fabriqués à partir d'éléments de la MEC tels que le collagène, la fibrine ou bien l'acide hyaluronique. Ceux à base de fibrine sont reconnus pour être de bons modèles d'échafaudage pour la différenciation des CSTA (Park et al. 2010). Les polymères synthétiques sont formés à partir de PLGA (poly(lactic-co-glycolic acid)), PEG (poly(ethylene glycol)) et PVA (polyvinyl alcohol)) (Lee et al. 2001). Les hydrogels représentent des matériaux facilement manipulables dont la fabrication s'avère rapide. Cependant, ces produits fabriqués à partir de substances synthétiques peuvent occasionner des problèmes de toxicité en plus d'induire des réactions immunologiques lors de la greffe de tissus, entre autres, tel que vu chez la souris (Cronin et al. 2004). Les hydrogels conçus à partir de substances naturelles tels que les collagènes bovins peuvent également produire des réactions antigéniques. Lors du choix d'un biomatériau pour la reconstruction d'un tissu, il ne faut pas oublier les coûts liés à l'utilisation de certaines substances dispendieuses comme le collagène purifié ou bien recombinant.
Éponge de collagène
L'éponge de collagène lyophilisé (Chvapil 1977, Yannas et al. 1980) peut servir pour le revêtement temporaire de plaies causées par des brûlures (Berthod et al. 1997, Damour et al. 1994). Elle est également reconnue en tant qu'agent chemoattractant pour les cellules inflammatoires. Plusieurs méthodes physiques ou chimiques pour réticuler le collagène sont réalisables après l'étape de lyophilisation. L'irradiation aux UV et la déshydratation par un traitement thermique constituent les approches physiques (Lew et al. 2007, Weadock et al. 1983) tandis que l'utilisation du glutaraldéhyde (Weadock et al. 1983) et du polyéthylèneglycol (PEG) (Doillon et al. 1994) représente des méthodes chimiques. Le glutaraldéhyde s'avère toutefois moins intéressant dû à son effet cytotoxique bien qu'il soit le plus fréquemment employé. C'est d'ailleurs la principale raison pour laquelle les biomatériaux utilisés cliniquement sont réticulés selon les méthodes physiques plutôt que chimiques. Le collagène peut aussi être réticulé avec le chitosane. D'un point de vue mécanique, l'éponge de collagène a le désavantage d'être très rigide, c'est-à-dire qu'elle ne possède pratiquement pas de propriétés élastiques qui sont nécessaires pour reconstruire des vaisseaux sanguins ou des équivalents vésicaux, par exemple (Magnan et al. 2006).
Décellularisation
La décellularisation est un procédé qui permet d'obtenir une matrice mature déjà assemblée, naturelle et dépourvue de cellules. Par la suite, la matrice décellularisée est utilisée pour y ensemencer divers types cellulaires et reconstruire différents tissus par génie tissulaire (Figure 1.3). La matrice décellularisée est obtenue à la suite d'une série de rinçages qui éliminent les cellules. Cependant, cette étape engendre des risques de réactions immunologiques lors de greffe puisqu'il peut y avoir des résidus toxiques qui restent emprisonnés dans la matrice provenant des produits de rinçage. L'un des avantages de cette technique s'inscrit dans l'utilisation d'une matrice mature bien définie et assemblée. Comme modèle de matrice décellularisée, le placenta représente un tissu abondant et très vascularisé. Il a été montré que ce dernier peut servir de modèle pour la reconstruction d'un tissu adipeux (Flynn et al. 2006). La décellularisation de l'os trabéculaire est un autre
exemple concret de biomatériau utilisé en génie tissulaire pour la reconstruction de tissus osseux et ce à cause de sa composition et de ses propriétés mécaniques. Ce type de matrice est employé, entre autres, pour accroître la différenciation des cellules souches mésenchymateuses humaines en cellules osseuses (hMSC) (Grayson et al. 2008). Le SIS (small intestine submucosa) représente un troisième modèle de tissu décellularisé utilisable en génie tissulaire comme tissu de remplacement (Brown-Etris et al. 2002). Cette matrice préalablement stérilisée, dans laquelle des cellules peuvent y croître (Badylak et al. 1998), est obtenue à la suite d'une série d'étapes de rinçage. La capacité du biomatériau à soutenir la guérison et la réparation tissulaire demeure présente à la suite des rinçages répétitifs (Voytik-Harbin et al. 1997). Une panoplie d'études a été publiée concernant l'utilisation de cette matrice décellularisée et montre qu'il est même possible de reconstruire un substitut vesical (Kropp et al. 1996), de même qu'un équivalent osseux (Suckow et al. 1999) à partir de SIS.
1. Extraction des cellules
2. Ajout de cellules
Méthode d'auto-assemblage en génie tissulaire
La méthode d'auto-assemblage exploite le potentiel des cellules mésenchymateuses à sécréter, à assembler et à organiser leur propre matrice extracellulaire afin de former un feuillet ou un tissu manipulable, sans l'utilisation de biomatériaux exogènes (Figure 1.4) (Grinnell et al. 1989, Hâta et al. 1989, Ishikawa et al. 1997, L'Heureux et al. 1998). La formation de la matrice nécessite l'utilisation d'un milieu de culture contenant de l'acide ascorbique (cofacteur) et du sérum pour l'apport en facteurs de croissance. Bien que cette méthode nécessite plusieurs semaines de culture pour l'obtention d'un équivalent tissulaire, les risques de réactions immunologiques sont grandement réduits dans des circonstances où le tissu est greffé. La présence de l'acide ascorbique dans le milieu de culture est la base du principe de l'auto-assemblage puisqu'il est un cofacteur de la prolyl-4-hydroxylase (P4H). L'acide ascorbique, en transférant ses électrons aux enzymes (oxydation), facilite la conversion de certains acides aminés du procollagène lors du processus de maturation du collagène (Gould et al. 1957). L'action de la P4H et de son cofacteur (acide ascorbique), qui est impliqué dans la biosynthèse des fibres de collagène et qui constitue l'élément structurel majeur de la MEC, est expliquée plus en détail à la section suivante (1.2.1).
Cellules
Synthèse de la MEC
Acide ascorbique + sérum
1.2 Éléments du tissu conjonctif
Le tissu conjonctif est composé d'une matrice extracellulaire (MEC) abondante qui entoure les cellules. Cette MEC est constituée de plusieurs éléments, dont les fibres de collagènes, les glycoprotéines, les protéoglycannes (PG), les glycosaminoglycannes (GAG), le système élastique, qui comprend notamment l'élastine et la fibrilline. Également, des enzymes comme les métalloprotéinases se retrouvent dans la MEC et sont responsables du remodelage de la matrice. L'interaction entre la MEC et les cellules s'effectue par le biais des intégrines. La figure 1.5 illustre bien les interactions entre les différentes composantes de la MEC de même que l'interaction des cellules avec la MEC.
EXTRACELLULAR SPACE
Figure 1.5 : Interaction entre les différents éléments de la MEC et avec la surface des cellules présentes dans le tissu conjonctif [modifiée de (Fernandes et al. 2006)].
1.2.1 Collagènes : Biosynthèse et structure
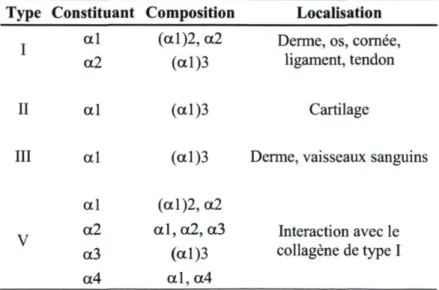
La fonction principale du collagène est de maintenir l'intégrité et la stabilité du tissu. Il soutient les cellules dans le tissu. Jusqu'à ce jour, 30 types de collagène ont été définis et regroupés dans deux grandes familles, soit les fibrillaires et les non fibrillaires
(membranaires). Les collagènes fibrillaires sont des collagènes de type I, II, III, V et X (Ricard-Blum et al. 2005). Ceux de type I, II et III sont en partie responsables de l'organisation structurale de la MEC. Le collagène de type I est majoritairement présent dans tous les types de tissu conjonctif à l'exception du cartilage où l'on y retrouve principalement du collagène de type II. Les collagènes fibrillaires possèdent une structure particulière qui les distingue des autres types de collagènes non fibrillaires. Le collagène est d'abord assemblé en hélice par l'association de trois chaînes alpha polypeptidiques. Les acides aminés tels que Glycine-X-Y sont assemblés selon une répétition particulière. La plupart du temps, X et Y sont remplacés par la proline et l'hydroxyproline respectivement. De plus, les chaînes polypeptidiques sont composées d'environ 33 % de glycine et de 10 à
13 % d'hydroxyproline (Stenzel et al. 1974). Le tableau 1.1 présente les principaux collagènes de la famille fibrillaire, ainsi que leur localisation dans les différents tissus conjonctifs. Pour produire une fibre de collagène, il faut une association entre plusieurs fibrilles qui est le résultat de l'enchaînement de plusieurs protéines de tropocollagène tel qu'illustré à la figure 1.6.
Certains collagènes de types non fibrillaires sont plutôt responsables de la liaison des collagènes structuraux entre eux. Il existe également des collagènes typiques des membranes basales tel que le collagène de type IV.
Tableau 1.1 : Composition et localisation des différents types de collagènes présents dans les tissus conjonctifs [modifié de (Abraham et al. 2008)].
Type Constituant Composition Localisation I al (ctl)2, a2 Derme, os, cornée, a2 (al)3 ligament, tendon
II al (a 1)3 Cartilage III al (a 1)3 Derme, vaisseaux sanguins
al (a 1)2, a2
a2 a l , a2, a3 Interaction avec le a3 (al)3 collagène de type I a4 a l , a4
Les étapes de la synthèse et de l'assemblage des fibres de collagène sont illustrées à la figure 1.6. Une brève explication de la synthèse et de l'assemblage du collagène de type I est présentée en exemple afin de mieux comprendre les nombreux processus qui mènent à la formation des fibres de collagène dans le tissu conjonctif.
Dans un premier temps, les gènes codants pour les différentes chaînes alpha polypeptidiques tels que COLI a l et COLla2 sont transcrits en ARN messagers puis traduits dans la lumière du reticulum endoplasmique (RE) à l'aide des ribosomes se trouvant dans la membrane du RE. Par la suite, différentes modifications vont se produire via le passage des chaînes alpha dans le RE (Trackman 2005). D'abord, une étape d'hydroxylation par la prolyl-4-hydroxylase (P4H) (Kivirikko et al. 1998) et la lysylhydroxylase (LH) avec l'aide de l'acide ascorbique (vitamine C), agissant comme cofacteur, est effectuée pour transformer les prolines et les lysines en hydroxyprolines (HYP) et en hydroxylysines (HYL). Ensuite, les polypeptides vont transiter dans l'appareil de Golgi et subir une étape de glycosylation qui permet d'ajouter des sucres (glucose et galactose) sur les HYL via la glycosyl-transférase et la galactosyl-transferase respectivement. Ceci sert à réguler le diamètre des fibres par encombrement stérique. Une fois ces modifications apportées aux chaînes polypeptidiques alpha, trois chaînes vont se lier afin de former une hélice avec des extrémités C et N-terminales particulières et produire des précurseurs de collagène nommés procollagène I. Par la suite, le procollagène I est dirigé à l'extérieur de la cellule où ses extrémités sont clivées par les enzymes procollagène C protease connues sous le terme BMP-1 (bone morphogenetic protein-1) et la procollagène N protease. Cette étape de clivage modifie le procollagène en tropocollagène. La polymérisation en fibrille de collagène se produit grâce à la lysyl oxydase (LOX) qui crée des liaisons covalentes entre les résidus de lysines et d'hydroxylysines situés aux extrémités du tropocollagène. Par la suite, plusieurs fibrilles vont s'unir pour former une fibre de collagène qui confère à la matrice une certaine rigidité (Kolacna et al. 2007).
Polymerization
Crossl inking
Figure 1.6 : Étapes de la synthèse, de la sécrétion et de l'assemblage des fibres de collagène [modifiée de (Culav et al. 1999, Stadelmann et al. 1998)].
La prolyl-4-hydroxylase est l'enzyme clef de l'assemblage précoce du collagène. Elle catalyse l'hydroxylation des résidus proline en HYP pour former des groupements OH qui sont responsables de la stabilité des fibres de collagène. Une modification de l'hydroxylation engendre la rétention des chaînes alpha dans le RE (Walmsley et al. 1999).
La lysyl oxydase est un enzyme extracellulaire qui catalyse la formation d'aldéhydes sur les résidus de lysine du collagène. Les aldéhydes sont très réactifs et créent des réactions chimiques instantanées avec d'autres résidus d'aldéhydes. Le résultat de la modification des résidus de lysine produit la reticulation (cross-linking) des collagènes et permet de stabiliser et de conserver l'intégrité des fibres de collagènes. Il existe plus de cinq formes de lysyl oxydase dont la LOX représentant la forme la plus abondante et quatre autres protéines LOX-Like (LOXLl-4) (Kim et al. 1995).
La périodicité représentative des fibres de collagène observée en microscopie électronique à transmission (MET) est déterminée par l'assemblage spécifique des tropocollagènes. Tel qu'illustré à la figure 1.6, les tropocollagènes s'associent latéralement et transversalement via des liens covalents. L'extrémité C-terminale d'une molécule de tropocollagène se lie à l'extrémité N-terminale de la molécule de tropocollagène juste en dessous, en se décalant d'environ 1/4 de sa longueur. Ceci crée un petit espace qui sépare la tête d'un tropocollagène par rapport à la queue d'un autre tropocollagène. Ainsi, la périodicité est définie par la mesure entre l'espace sombre et l'espace clair. Normalement, la périodicité d'une fibre de collagène de type I est d'environ 67 nm.
L'acide ascorbique (AA) ou vitamine C est une molécule qui n'est pas produite par le corps humain. Les humains et les primates sont incapables de sécréter cette vitamine à cause d'une mutation du gène codant pour l'enzyme L-glucono-gamma-lactone oxydase requis pour sa biosynthèse (Dayan 2008). Ainsi, le seul moyen de fournir le corps en vitamine C est par l'absorption de nutriments provenant des légumes et des agrumes. Une carence de cette vitamine engendre des modifications de la MEC et peut mener à la maladie du scorbut qui peut être fatal à long terme. Dans l'organisme, on retrouve deux formes de vitamine C, soit l'AA sous forme réduite et la déhydroascorbate (DHA) sous forme oxydée.
La vitamine C est une céto-lactone de six carbones possédant une structure semblable au glucose et autres hexoses. À la suite d'une oxydation impliquant la perte d'électrons, l'AA se transforme en DHA. La vitamine C est internalisée par les récepteurs spécifiques GLUT (glucose transporter isoform) et SVCT (sodium-dependent vitamin C transporter) présents sur la membrane cellulaire (Figure 1.7). La forme oxydée pénètre dans la cellule via des récepteurs hexoses GLUT 1, 3 et 4 (Rumsey et al. 2000, Rumsey et al. 1999). Une fois internalisée, elle est retransformée en vitamine C à l'intérieur de la cellule. La forme réduite de la vitamine C est quant à elle internalisée par un mécanisme actif qui requiert les récepteurs SVCT1 et 2. Ces récepteurs sont des glycoprotéines membranaires faisant partie de la famille des Solute Carrier Family. Ce sont en fait des sodium dependent transporters responsables du transfert et de la distribution des vitamines dans le corps humain. L'AA est intégré par un gradient électrochimique (Savini et al. 2008). Les récepteurs SVCT ont plus d'affinités avec l'AA que les récepteurs GLUT en ont pour la DHA.
^ ^ — ► « . ^ T O
Figure 1.7 : Mécanisme d'intégration de la vitamine C dans la cellule. Internalisation via les récepteurs GLUT (A) et les récepteurs SVCT (B) [tirée de (Li et al. 2007)].
1.2.2 Glycosaminoglycannes
Les glycosaminoglycannes (GAG) sont formés de polymères de disaccharides portant des carboxylates ou des sulfates. En s'associant, ils forment des réseaux responsables de la viscoélasticité. Les GAG sont unis aux différents PG. Les principaux GAG présents dans la MEC sont l'acide hyaluronique, le sulfate d'héparine et le sulfate de chondroïtine.
1.2.3 Protéoglycannes
Les protéoglycannes (PG) sont des protéines associées à un ou plusieurs GAG. Grâce à la grande diversité structurale des PG combinés avec différents GAG, ceci permet de produire différents sites protéiques pouvant interagir de manière spécifique avec d'autres composants de la MEC ou bien avec des récepteurs cellulaires (Hardingham et al. 1992). Les PG sont divisés en deux groupes. Il y a ceux de type aggregating tels que l'aggrécan, le versican et il y a ceux de type non-aggregating tels que la décorine, le biglycane et le perlécan.
La décorine est associée avec un seul GAG et elle est considérée comme le plus petit PG. La forme de cette protéine ressemble à un demi-cercle dans lequel une fibre de collagène peut s'insérer (Figure 1.8). L'une des fonctions de la décorine est de se lier aux fibres de collagène de type I et III et d'influencer la régulation de la fibrillogenèse (Reed et al. 2002). Elle serait également impliquée dans l'activation ou l'inhibition du TGF-pi (Transforming growth factor beta) qui est impliqué dans le contrôle de la prolifération. Une étude suggère qu'une modification de la décorine pourrait impliquer un dérèglement du TGF-P et occasionner le syndrome de Marfan reconnu comme une maladie génétique du tissu conjonctif (Pulkkinen et al. 1990). Le syndrome de Marfan peut résulter d'une fragmentation des fibres élastiques ou d'une mutation du gène FBN1 (fibrilline-1), l'une des composantes intervenant avec les intégrines dans l'adhésion cellulaire à la MEC. Le gène codant pour la décorine humaine est désigné par DCN.
Figure 1.8 : Modélisation de l'interaction entre une molécule de décorine et le collagène. (A et B) Vues tridimensionnelles d'une molécule de décorine liée à une fibre de collagène. (C) Attachement de la décorine sur la partie C-terminale d'un tropocollagène [modifiée de (Reed et al. 2002)].
1.2.4 Glycoprotéines
Les glycoprotéines sont caractérisées par des structures répétitives. Elles peuvent s'unir entre elles ou bien s'associer avec d'autres protéines présentes dans la MEC. Par exemple, les glycoprotéines telles que la fibronectine s'unissent normalement avec des intégrines. Deux catégories de glycoprotéines sont définies selon leur rôle. Les protéines telles que la fibronectine et la laminine constituent le premier ensemble dont la fonction principale est de soutenir et maintenir l'intégrité de la MEC. La fibronectine (FN) existe sous deux formes. La forme soluble se retrouve dans le plasma sanguin et la forme insoluble est présente dans la matrice extracellulaire du tissu conjonctif lâche, notamment celui du tissu adipeux (Kubo et al. 2000). La fibronectine est une protéine dimérique en forme de V dont les extrémités C-terminales sont reliées par des ponts disulfures. Chaque chaîne est composée d'environ 2500 acides aminés. La FN est une protéine de structure qui contribue à l'organisation de la matrice extracellulaire et à l'adhésion cellulaire via les intégrines. Elle peut également se lier aux autres éléments de la matrice telles que les fibrilles de collagène (I, II, III et V) et même à d'autres protéines de fibronectine pour former un réseau fibrillaire (Wierzbicka-Patynowski et al. 2003). Le second groupe de glycoprotéines est défini comme étant de type matricellulaire. Dans ce groupe on retrouve SPARC, la ténascine C et X, CCN1, la thrombospondine 1-2 et l'ostéopontine. Les fonctions de ces glycoprotéines sont plus élargies et impliquent des processus cellulaires tels que la migration, la différenciation et la prolifération cellulaire. Ce sont des glycoprotéines au même titre que la laminine et la
fibronectine, mais qui ne contribuent pas directement à la structure et au maintien des propriétés physiques de la matrice extracellulaire. Ces protéines sont généralement surexprimées durant le développement embryonnaire, puis réduite et même absente durant la vie normale sauf lors d'une réponse à la suite d'une blessure. Ces protéines matricellulaires réapparaîtraient lors d'une réponse immunitaire et lors de la croissance d'une tumeur cancéreuse (Bornstein et al. 2004).
1.2.5 Intégrines
Les intégrines sont responsables de la connexion entre la MEC et les cellules. Elles agissent comme récepteurs d'adhésion cellulaire. Ces protéines transmembranaires sont constituées d'une sous-unité alpha (a) et d'une sous-unité bêta (P) et constituent une famille d'intégrines de 24 hétérodimères ap (Barczyk et al. 2010). La région extra-cellulaire d'une intégrine interagit avec l'environnement extérieur et l'autre extrémité interagit avec des composantes intracellulaires. Les intégrines se lient aux molécules de la matrice extracellulaire comme la fibronectine et le collagène. Également, ces protéines transmembranaires servent comme transducteurs mécano-chimiques. Les signaux sont propagés via différentes voies de signalisation dont celle incluant l'activation des Rho GTPase (Rac, Cdc42 et Rho). Ces GTPases jouent des rôles majeurs en régulant le comportement cellulaire en réponse aux changements de l'environnement extracellulaire (DeMali et al. 2003). Par la suite, une série de réactions en chaîne vont mener à la modification du cytosquelette de la cellule ou à une modification de la production de protéines structurales comme le collagène.
1.2.6 Autres composantes
Les métalloprotéinases (MMP) sont des enzymes impliqués dans le remodelage de la MEC, la dégradation de molécules de surface cellulaire, mais aussi dans des processus de régulation du comportement cellulaire tels que la prolifération, la migration et la
différenciation (Streuli 1999). Les MMP sont également connues pour être des promoteurs dans la modulation du cancer (Stemlicht et al. 2000). Les MMP sont des endopeptidases qui font partie de la famille des metzincin à cause de leur dépendance aux ions métalliques responsables d'activer une réaction catalytique (Stocker et al. 1995). Ces protéines de dégradation, lorsque sécrétées par la cellule, sont d'abord présentées sous forme inactive (zymogène), puis elles sont activées par d'autres MMP actives ou bien par des serines proteinases. L'activité protéolytique des MMP se divise en trois étapes. La première se veut l'expression du gène et de la sécrétion en protéine. La deuxième étape, est l'activation de l'enzyme et la troisième étape consiste en l'inhibition de l'activité enzymatique via des protéines telles que les TIMPs (Tissue Inhibitor of Matrix Metalloproteinase) (Bauer et al.
1975). Il existe une variété de MMP regroupées selon leurs activités enzymatiques : les collagénases (MMP 1, 8 et 13), les gélatinases (MMP 2 et 9), les stromélysines (MMP 3, 10 et 11) et les élastases. D'ailleurs, MMP-1 est reconnue pour être impliquée dans la dégradation des collagènes de type I, II et III.
1.3 Culture dynamique : méthode complémentaire à la
reconstruction tissulaire
En génie tissulaire, plusieurs méthodes de culture dynamique ont été développées afin de mimer le mieux possible les conditions environnantes des tissus natifs lors de la production d'équivalents tissulaires. En fait, le concept de la culture dynamique se veut une approche originale pour laquelle le milieu de culture est propagé sur les échantillons de manière à produire un flux. Ce flux peut être continu, puisé ou induire une pression (Brown 2000). Ainsi, ce concept dans lequel le milieu se déplace constamment de façon spécifique permet d'engendrer soit une modification de la prolifération (Mizuno et al. 2002b, Wang et al. 2003), soit des changements au niveau de la différenciation cellulaire (Bancroft et al. 2002) et/ou un remodelage de la MEC (Connelly et al. 2010, Elhadj et al. 2002, Gemmiti et al. 2009, Wang et al. 2003, Zhao et al. 2009). Également, les méthodes de culture employées pour imiter les conditions in vivo et pour améliorer la reconstruction tissulaire ont nécessité l'emploi de bioréacteurs. La culture dynamique représente donc un moyen habile pour
tenter de reconstruire des tissus comme les os et les vaisseaux sanguins structurellement et physiologiquement comparables aux tissus natifs.
1.3.1 Utilité et complexité des bioréacteurs
Dans un premier temps, il faut comprendre l'importance de l'utilisation des bioréacteurs. En effet, grâce à ces appareils, il est possible de contrôler plusieurs paramètres simultanément. Par exemple, le pH, la température, de même que la concentration des différents éléments ajoutés dans le milieu de culture représentent les quelques exemples de paramètres de culture contrôlables. Des facteurs de croissance peuvent également être ajoutés via les bioréacteurs à différentes périodes.
Dans un deuxième temps, l'utilisation des bioréacteurs a permis de développer des méthodes de culture pour lesquelles il est possible d'instaurer des conditions de culture expérimentales spécifiques au tissu qui est à l'étude. Ainsi, en appliquant différentes forces mécaniques, brièvement décrites et résumées par Brown (Brown 2000), il est intéressant de constater les effets induits sur les cellules et leur environnement composé d'un biomatériau ou d'une matrice extracellulaire produite par les cellules. Différents stress mécaniques sont produits pour induire une réponse cellulaire. Ces stress peuvent être de type compression, à étirement longitudinal ou à étirement bi-axial. Il y a aussi ceux dans lesquels un fluide permet de déformer les biomatériaux composés de cellules ou ceux dans lesquels le milieu de culture circule de façon fluide à intervalle constant pour être puisé comme dans les vaisseaux sanguins. La figure 1.9 illustre bien le concept des bioréacteurs et de la culture dynamique.
r
Oxygène, nutriments, cytokines Autres cellulesMatrice extracellulaire Facteurs physiques
Gradients, profil de temps
In vivo
(exigences biologiques)
Cellules
Échafaudage
Bioréacteur Production de tissu
par génie tissulaire
r
^Contrôle de l'environnement Co-culture de cellules
Biomatériaux
Flux, signal électrique
Facteurs immobilisés et libérés
In vitro
(conception technique)
Figure 1.9 : Concept de la culture dynamique à l'aide de bioréacteurs [modifiée de (Grayson et al. 2009)].
Plusieurs équipes de recherche ont exploité le concept de la culture dynamique dans différents types de bioréacteurs et à partir de différents types cellulaires. Ils ont utilisé les cellules souches mésenchymateuses provenant de la moelle osseuse (CSMO) (Bancroft et al. 2002, Connelly et al. 2010, Datta et al. 2006, Grayson et al. 2008, Knippenberg et al. 2005, Kreke et al. 2008) et les CSTA (Frye et al. 2006, Knippenberg et al. 2005) pour tenter de reconstruire des tissus fonctionnels de type osseux, cartilagineux et adipeux. Ces modèles de culture dynamique se sont avérés prometteurs puisqu'ils ont permis d'accroître la différenciation des cellules et d'augmenter la synthèse de la matrice extracellulaire (Bancroft et al. 2002, Connelly et al. 2010, Datta et al. 2006, Frye et al. 2006, Grayson et al. 2008, Knippenberg et al. 2005, Kreke et al. 2008).
1.3.2 Concept du mouvement fluidique
À l'origine, les modèles de culture dynamique avec un mouvement fluidique ont surtout été utilisés pour l'étude du comportement des cellules endothéliales (CE) présentes dans les vaisseaux sanguins. Récemment, certaines études ont été réalisées en exploitant le potentiel des CSTA à se différencier en CE dans un contexte de culture dynamique (Fischer et al. 2009, Stolberg et al. 2009). Toutes ces recherches ont non seulement montré qu'il était possible d'augmenter la prolifération, la différenciation et la synthèse de la matrice extracellulaire, mais aussi que ces modèles pourraient servir pour faire des études physiologiques in vitro.
Dans la littérature, on retrouve plusieurs études qui ont été réalisées pour caractériser différents modèles de culture dynamique. Il y en a qui produisent un mouvement orbital ou de balancier (Berson et al. 2008, Sucosky et al. 2004, Zhou et al. 2010). Les modèles imitant un fluide dynamique orbital ont montré qu'il pouvait engendrer une activation de la prolifération, une augmentation de la différenciation des cellules et, dans certains cas, une augmentation de la synthèse des éléments de la MEC (Dardik et al. 2005, Elhadj et al. 2002, Yamamoto et al. 2003).
D'autres modèles de culture dynamique ont été développés, cette fois-ci, dans le but de mimer les forces mécaniques présentes in vivo dans les tissus. Cette force est définie comme le fluide interstitiel (FI) (Chary et al. 1989). Ce fluide transfère les différents éléments moléculaires présents dans la matrice extracellulaire du tissu conjonctif par exemple (Rutkowski et al. 2007). Évidemment, les vaisseaux sanguins sont responsables d'une bonne partie du transport des nutriments et de l'oxygène vers les cellules, mais le fluide interstitiel représente lui aussi une autre source de transport. Les forces mécaniques présentes dans les tissus à cause du FI permettent de maintenir un gradient moléculaire et affectent le comportement des cellules. Ces changements physiques jouent un rôle sur l'environnement cellulaire et ils sont cruciaux pour le développement du tissu puisqu'ils remodèlent la matrice extracellulaire (Rutkowski et al. 2007). Ce type de mouvement fluidique semble plus représentatif pour la reconstruction de tissu par génie tissulaire, en particulier pour la reconstruction de tissu conjonctif à l'aide de biomatériaux.
Il ne faut surtout pas oublier que l'épaisseur des biomatériaux peut s'avérer un obstacle important en réduisant la diffusion des nutriments et de l'oxygène. En l'absence d'une vascularisation, les tissus reconstruits par génie tissulaire d'épaisseur supérieure à 150-200 pm constituent des modèles où l'on retrouve de l'hypoxie et nécessitent donc l'implantation d'un système de perfusion qui alimente les cellules en oxygène (Folkman et al. 1973, Grayson et al. 2009). Bref, les modèles de culture dynamique via l'utilisation de bioréacteurs permettent d'augmenter la diffusion des nutriments et de l'oxygène qui sont essentiels aux cellules lors de la prolifération, de la différenciation et même de l'activation de la synthèse des éléments de la MEC (Buckley et al. 2010).
1.3.3 Culture dynamique à partir d'un Spinner Flask
En génie tissulaire, le bioréacteur de type Spinner flask est très utilisé. Une illustration de ce type de bioréacteur est présentée à la figure 1.10. Cet appareil a la particularité d'avoir des échantillons fixés de manière permanente durant toute la période de culture. Le milieu de culture circulant produit un vortex, c'est-à-dire qu'il forme un mouvement fluidique constant qui permet d'augmenter la diffusion des nutriments et améliore l'apport en oxygène. Ce type de bioréacteur permet de cultiver des tissus formés à partir de biomatériaux, par exemple une éponge, dans un contexte tridimensionnel.
3 ) cap > ft -2 ^ > J -2 ^ v tSûm. ^ v construct
BI
; arrays vesselM
» i ' stir barMeinel et ses collaborateurs (Meinel et al. 2004) ont étudié l'influence d'un tel appareil sur le comportement des cellules souches mésenchymateuses provenant de la moelle osseuse combinées à différents biomatériaux à base de collagène. Ils ont démontré que le spinner flask permettait d'augmenter la sécrétion du calcium, un élément important de la
différenciation des CSMO vers le type ostéoblastique. Fischbach et ses collaborateurs (Fischbach et al. 2004) ont comparé deux types de culture dynamique. L'une d'elles consistait à cultiver des préadipocytes ajoutés dans un polymère (PLGA) et de les placer sur une plate-forme agitatrice à mouvement orbital. L'autre méthode consistait à cultiver les échantillons dans un spinner flask. Ainsi, à partir des résultats qu'ils ont obtenus, ils ont montré que la culture dynamique (spinner flask ou plaque agitatrice) représentait un moyen efficace pour augmenter la différenciation cellulaire des préadipocytes.
1.3.4 Autres modèles de tissus conjonctifs reconstruits dans un contexte
de culture dynamique
Certaines équipes de recherche en génie tissulaire se sont intéressées à la formation d'un tissu conjonctif à partir de différents biomatériaux et ce, dans des conditions de culture dynamique diverses (perfusion, orbital). En 2003, Wang et ses collaborateurs (Wang et al. 2003) ont montré qu'en cultivant des fibroblastes dans un polymère, à l'intérieur d'un spinner flask, il était possible d'augmenter la prolifération cellulaire, de même que le dépôt des GAG et des collagènes. Une autre étude réalisée en 2010 par Wang et ses collaborateurs (Wang et al. 2010) a montré qu'en utilisant différents types de matériaux synthétiques, il était possible de contrôler la formation du tissu tout en affectant la prolifération et le dépôt des collagènes. Pour cette étude, ils se sont intéressés à la formation du tissu conjonctif, avec différents polymères, à partir de cellules stromales provenant du tissu adipeux. Une autre équipe, celle de Zhao et ses collaborateurs (Zhao et al. 2009), a constaté que la diffusion du milieu par un système de perfusion affectait le développement du tissu reconstruit à partir de cellules souches mésenchymateuses humaines (CSM) cultivées dans un polymère. De façon générale, les résultats présentés dans ces articles suggèrent que la culture dynamique augmente la production de la matrice et favorise la prolifération cellulaire.
Il est à noter que pour tous les modèles mentionnés dans cette section, les travaux de recherche ont été réalisés en utilisant des biomatériaux et qu'aucune étude combinant la méthode d'auto-assemblage et la culture dynamique n'a été tentée jusqu'à présent dans un contexte tridimensionnel. De plus, aucune étude comparative entre le comportement des FD et des CSTA pour reconstruire des tissus conjonctifs n'a été réalisée jusqu'à ce jour d'où l'intérêt de mes travaux de recherche.
1.4 Hypothèse et objectifs
Nous avons vu qu'il existe une forte demande pour la production de supports matriciels et de tissus pour combler les besoins croissants en chirurgie de reconstruction. C'est pour cette raison, d'ailleurs, que différents types d'échafaudage servant à l'élaboration de tissus de remplacement ont été développés. La nature des composantes utilisées pour reconstruire des tissus peut toutefois causer des réactions immunologiques. La méthode d'auto-assemblage permet la reconstruction de tissus dont la matrice naturelle est produite à partir des cellules même du patient. Malgré des périodes de culture relativement longues, cette méthode permet de produire des tissus malléables et riches en éléments de la MEC humaine.
Il existe une panoplie de bioréacteurs servant à augmenter la diffusion des nutriments et de l'oxygène pour ainsi accroitre la prolifération et la production de la MEC. Ainsi, une stratégie favorisant l'augmentation de la synthèse des éléments de la matrice via une méthode de culture dynamique, sans l'emploi de biomatériaux exogènes et sans l'utilisation de bioréacteur dispendieux et complexe, serait avantageuse.
Pour ce projet, deux types cellulaires ont été utilisés et comparés pour la production de tissus conjonctifs humains : les fibroblastes dermiques (FD), une source cellulaire classique employée abondamment dans le domaine cutané, de même que les cellules stromales/souches isolées du tissu adipeux (CSTA), une source cellulaire récente utilisée par notre équipe.
L'objectif général de mon projet de maîtrise était de vérifier si la méthode d'auto-assemblage en génie tissulaire, développée au LOEX, pouvait être optimisée à l'aide d'une culture dite dynamique. Notre hypothèse est que la culture dynamique, qui induit un mouvement continu du milieu de culture, aurait un impact sur la reconstruction des tissus conjonctifs: 1) au niveau cellulaire via une modification de la prolifération, une augmentation de la synthèse de la MEC et/ou un effet post-traductionnel; 2) au niveau physique via une augmentation du dépôt des collagènes et d'autres éléments de la MEC.
Le premier objectif spécifique consistait à produire des tissus conjonctifs par génie tissulaire en condition dynamique et en condition statique usuelle. Une fois fait, l'épaisseur des équivalents tissulaires a été mesurée puis comparée. De plus, nous avons vérifié si la culture dynamique exerçait un effet sur la reconstruction des tissus et si cet effet provenait de la prolifération, la synthèse et/ou l'organisation accrue de certains éléments majeurs de la MEC.
Le deuxième objectif spécifique consistait à vérifier si la culture dynamique permettait de réduire le temps requis pour produire des tissus conjonctifs manipulables. Comme analyses, l'épaisseur des tissus a été évaluée et des tests de résistance mécanique ont été réalisés à partir des tissus reconstruits durant différents temps.
Ces travaux ont permis aussi de faire une étude comparative entre le comportement des FD et des CSTA lors de la reconstruction de tissus conjonctifs. Il est important d'optimiser la production par génie tissulaire de ces tissus étant donné leur grand potentiel en médecine régénératrice. De plus, l'utilisation d'une autre source cellulaire que les FD, c'est-à-dire les CSTA, ouvre la porte à de nouveaux développements en génie tissulaire.
2.1 Provenance des cellules
2.1.1 Cellules stromales/souches isolées du tissu adipeux humain (CSTA)
Les CSTA utilisées pour la reconstruction de tissus conjonctifs proviennent d'une banque cellulaire établie par l'équipe de Julie Fradette Ph.D (LOEX). Les cellules proviennent de lipoaspirations (LA) de gras sous-cutané de femmes en santé ayant subit une chirurgie cosmétique. L'indice de masse corporelle (IMC) moyen des patientes est de 22,6 ± 1,8. Ces valeurs, situées entre 21 et 25 kg/m , représentent la moyenne établie pour être considéré sans embonpoint. L'âge moyen des patientes est de 37,0 ± 4,8 ans. Les étapes d'extraction des cellules sont décrites plus en détail dans l'article de Vermette et ses collaborateurs (Vermette et al. 2007). Les cellules fraîchement extraites sont cultivées durant un passage (PO) puis conservées dans l'azote liquide jusqu'à leur utilisation.
Tableau 2.1 : Caractérisation des populations cellulaires de CSTA utilisées.
Population cellulaire Age IMC Passage utilisé (P) Types d'analyses * 200705LA33 33 21 3à6 H, M, Q
070207LA35 35 23,2 3à6 A,H,M,Pr,Q,T 070207LA36 36 25 3à6 A, H, M, Pr, Q, T
140605LA44 44 21,5 3 A_H
* A: Dosage de l'ADN, H: Histologie, M: Test mécanique, Pr: Dosage protéique, Q: RT-PCR quantitatif T: Microscopie électronique à transmission, IMC: indice de masse corporelle
2.1.2 Fibroblastes dermiques humains (FD)
Les fibroblastes dermiques proviennent de biopsies de peau issues de réductions mammaires et sont extraits tel que décrit par Auger et ses collaborateurs (Auger et al. 1995) à l'exception de la population 200705FLP33 qui provient de la banque cellulaire de Julie Fradette Ph.D et qui a été extraite de façon similaire aux CSTA. D'ailleurs, ces cellules
sont issues de la même patiente pour laquelle les 200705LA33 ont été extraites. La moyenne d'âge des FD utilisés est de 29,6 ± 10,4 ans. Les cellules fraîchement extraites sont cultivées durant un passage (PO) puis conservées dans l'azote liquide jusqu'à leur utilisation.
Tableau 2.2 : Caractérisation des populations cellulaires FD utilisées.
Population cellulaire Âge Passage utilisé (P) Types d'analyses * FMUi638X 38 3à6 A, H, M, Pr, Q, T FMhE718X 18 3à6 A, H, M, Pr, Q, T 200705FLP33 33 3_à6 H, M, Q
* A: Dosage de l'ADN, H: Histologie, M: Test mécanique, Pr: Dosage protéique, Q: RT-PCR quantitatif T: Microscopie électronique à transmission
2.2 Culture cellulaire
Les cellules sont amplifiées et trypsinées sur quelques passages pour accroître la quantité de cellules disponibles pour reconstruire plusieurs tissus conjonctifs. Les étapes d'amplification cellulaire consistent à ensemencer 8 x 103 cellules/cm2 dans des flacons de
75 cm NUNC. Tout au long de la culture, les cellules sont immergées dans un milieu 1 :1 Dulbecco's modified Eagle's medium (DME) : Ham's F12 (H) medium (Invitrogen, Burlington, ON, Canada) avec 10 % de sérum de veau foetal (SVF, Hyclone, Logan, UT, USA) et des antibiotiques (100 UL/mL pénicilline et 25 ug/mL de gentamicine, Sigma-Aldrich, St-Louis). Durant la période d'expansion, les cellules ont été incubées à 37°C avec 8 % de CO2 et le milieu de culture a été changé à tous les 2 ou 3 jours. Après 7 jours de culture, qui correspond à la période où les cellules ont atteint la confluence, les cellules ont été trypsinées (0,5 %, Intergen), puis des comptes au bleu de trypan et au Coulter (Coulter, Counter, Beckman Coulter, FL, USA) ont été effectués pour déterminer le nombre de cellules, évaluer la grosseur et la viabilité. Les cellules ont été utilisées entre les passages 3 et 6.


![Figure 1.3 : Principe de la décellularisation [modifiée de (Green et al. 2007)].](https://thumb-eu.123doks.com/thumbv2/123doknet/5540186.132499/24.898.154.801.573.807/figure-principe-décellularisation-modifiée-green-al.webp)