Université du Québec
Mémoire présenté à
L'INSTITUT NATIONAL DE LA RECHERCHE SCIENTIFIQUE
comme exigence partielle de la
maîtrise ès sciences par
Michel Lebeuf
Etude de la réaction du zinc avec un sédiment lacustre riche en oxyhydroxydes de fer
REMERCIEMENTS
En présentant ce mémoire, je désire remercier d'une façon très spéciale, monsieur André Tessier D.Sc., professeur titulaire au centre INRS-Eau, Université du Québec, qui a accepté de diriger cette étude et a su, au-del à de son enseignement, m'offrir sa disponibil Hé et me prodiguer de précieux conseils.
Je tiens à exprimer ma reconnaissance aux docteurs P.G.C. Campbell et R. Carignan pour leur collaboration efficace et pour les discussions fruc-tueuses que nous avons eues.
Je sui s égal ement très reconnai ssant au personnel technique de l' INRS-Eau, parti cul i èrement à madame Li se Hamel pour l' expéri ence et 1 a compétence dont elle a su me faire profiter.
Mes remerciements vont égal ement au fond FCAC (programme de formation de chercheurs et d'action concertée) pour le support financier qui a permis
RÉSUMÉ
On a itudiê la riaction du zinc avec un sêdiment du lac Tantarê riche en oxyhydroxydes de fer (22,9% du sêdiment, poids sec). À des quantitês du sêdiment mis en suspension dans l'eau du lac (~ 1,72 g/L; pH
=
5,55), on a ajouté des concentrations de zinc variant entre 10-6 et 10-2 mole/L; les quantitês de base nêcessaires pour réajuster périodiquement le pH i 5,55 ont été notées pendant 25 jours, temps nécessaire pour que le pH cesse de dimi-nuer en fonction du temps. Après une attente de 10 jours supplémentaires 1 es concentra ti ons de zi nc ont ité mesuries dans l'eau et dans diverses fracti ons du sédiment (obtenues par extracti ons chimi ques). Ces mesures permettent de calculer des constantes d'adsorption du zinc (K) et des coefficients de distribution (Kd).
Les risultats montrent que la ripartition du zinc entre diffirentes fractions du sidiment varie en fonction de la concentration de zinc ajouti. Les val eurs de constantes d'iquil ibre (ou coefficients de distribution) diminuent avec une augmentation de la densiti d'adsorption,
r.
Une telle diminution de K est giniralement attribuie, pour l'adsorption sur les oxyhy-droxydes de fer en milieu bien définis, à des sites d'inergie d'adsorption variable. Par ailleurs, on n'observe pas, pour le sédiment lacustre, une val eur constante de K en foncti on der,
aux faibl es val eurs der:
un tel comportement est attribui, pour les oxyhydroxydes isolis, à l'adsorption du mital sur des sites de haute inergie, qui sont en excès à ces faibl es val eurs der.
Le transfert du zinc, de la solution vers le sidiment, implique ~ 1,2 H+ libiré par Zn associé. La même valeur (~ 1,2 H+/Zn++) a été observée pour l' adsorpti on, à différents pH, du Zn sur des sédiments 1 acustres (présumément sur 1 es oxyhyd roxydes de fer de ces sidiments). Des val eurs semblables ont ité rapportées dans la littérature pour l'adsorption du zinc sur des oxyhydroxydes en milieux bien définis.
La stabilité du pH observée après 25 jours nlest pas une preuve qulun équilibre complet d'adsorption est atteint. En effet, après ce~te période, on n'observe pas une valeur identique de l'activité spécifique de 65Zn dans l leau et dans les différentes fractions du sédiment, notamment dans la frac-tion correspondant aux oxyhydroxydes de fer (telle que déterminée par des extractions chimiques).
Le fait que K varie avec
r,
même à des faibles valeurs der,
suggère que 1 es si tes dl adsorpti on ne sont pas tous identi ques et en excès et peut avoir des conséquences importantes. En effet, plusieurs auteurs ont suggéré récemment des modèles d'adsorption compétitive pour calculer la distribution des métaux traces entre l'eau et les diverses phases des sédiments; ces modèl es font i nterveni r 1 es constantes dl adsorpti on. Il peut Si avérer nécessaire pour ces modèles de considérer l 1 effet de r dans l'expression des constantes dl adsorpti on, ce qui ni est pas le cas actuell ement. DI autres chercheurs préconisent l'emp10i de coefficients de distribution d'un métal entre 11 eau et 1 e sédiment. Ces coefficients de di stribution doivent être uti1 i sés avec prudence, étant donné qu 1 il s peuvent être foncti on de la concentrati on de M dans 1 e système. Fi na1 ement, li infl uence de r sur K peut auss i comp1 i quer 11 examen de la dépendance de K sur dl autres paramètres comme 1 e pH.TABLE DES MATIÈRES
REMERCIEMENTS ... e • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • •
RÉSUMÉ
...
TABLE DES MATIÈRES
LISTE DES TABLEAUX
...
...
LISTE DES FIGURES •••••••••••••••••••••••••••••••••••••••••••••••••••
1. 2.
INTRODUCTION
...
1.1 1.2 1.3 1.4 1.5 1.6 Problématique...
Mécanismes responsables de la distribution des métauxtraces dans le milieu lacustre
...
Modèle de répartition...
Adsorption sur les oxydes métalliques •••••••••••••••••••••Variation de K avec r ... . Objecti fs du travail
...
PROTOCOLE EXPÉRIMENTAL
..... ..
2.1 2.2 2.3 2.4 2.5 2.6 2.7 Échantillonnage...
Concentrations de fer et de zinc dans le sédiment •••••••••Caractéristiques de l'eau du lac
...
Procédures expérimentales Extractions séquentielles
...
...
...
Dosage des métauxRéactifs et verrerie v i i i i v vii ix 1 3 4 6 8 10 10 13 15 17 17 20 23 27 28
3. 4. 5.
RËSULTATS
. ... .
~ 3.1 3.2 3.3de base ajoutée
Concentrations
Répartition du zinc
Activité spécifique
...
après 36 jours de réaction
du zi nc
...
DISCUSSION •••••••••••••••••••••••••••••••••••.•••••••••••••••••4.1
4.2 4.3
Rapport Xs
=
{nombre de H+ libéré/nombre de Zn associé au
sédiment}
...
Atteinte de l'équilibre •.•....•.•.•.•..••.••....•..•...•..Variation de log K avec log
r ... .CONCLUSION
...
RÉFÉRENCES BIBLIOGRAPHIQUES
...
29 31 31 38 41 43 47 50 61 65 ANNEXES ••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••• 75vi
LISTE DES TABLEAUX
TABLEAU 2.1a} Concentration du fer et du zinc dans le sédiment du
lac Tantaré
...
18TABLEAU 2.1b} Répartition du fer et du zinc dans le sédiment du
TABLEAU 2.2 TABLEAU 2.3 TABLEAU 2.4 TABLEAU 2.5 TABLEAU 3.1 TABLEAU 4.1 TABLEAU 4.2 lac Tantaré
...
Concentrations de cations et d'anions dans l'eau du lac Tantaré •••••••••••••••••••••••••••••••••••••••••• Indice de saturation (SI
=
log IAP/Ks) de l'eau
surnageante par rapport aux oxyhydroxydes de fer, tel que calculé avec WATEQ2 •••••••••••••••••••••••••••••• Caractéristiques des mélanges réactionnels utilisés
18
19
21
pour les études d'adsorption ••••••••••••••••••••••••• 22
Digestion complète des sédiments •••••••••••.••••••••.
Concentrations de zinc et de fer dans l'eau surnageante et dans différentes fractions des sédiments des
mélanges réactionnels après un temps de réaction de
25
36 jours (FO: mol e/L; F1 à F4: mol e/g) ••••••••••••• 33 Valeurs de X(X
s) obtenues pour l'association du zinc
par divers substrats ••••••••••••••••••••••••••••••••• 45
Conditions expérimentales utilisées pour les études de la variation de K en fonction de
r ...
56TABLEAU A.1 TABLEAU A.2 TABLEAU A.3 TABLEAU A.4 TABLEAU A.5 TABLEAU A.6 TABLEAU A.7
Concentration de fer extrait en variant la
concentration de NH20H • HCl ••••••••••••••••••••••••• 77 Concentration cumulative (10- 5 mole/L) de base ajoutée pour rétabl ir le pH à 5,5 •••••••••••••••••••••••••••• 78 Activité spécifique du zinc (65zn/znT) dans les
différentes fractions après 36 et 72 jours de
réacti on ... 79
Mole de H+ libéré par mole de zinc associé ••••••••••• 80 Valeurs de log Kd des mélanges E5 et E15 après 36 et
72 jours de réaction ••••••••••••••••••••••••••••••••• 81
Valeurs de log K et log
r
calculées avec les équations (1.8) et (1.7) en utilisant diverses combinaisons dessolutions d'extraction pour obtenir {FeT} et (SOM) 82
Valeurs de log Kd (K
d
=
(SOM}/(M)) et de log (SOM)obtenues
à
partir du tableau 3.1 ••••••••••••••••••••• 83LISTE DES FIGURES
FIGURE 1.1 Cycle biogéochimique simplifié des métaux traces dans
les lacs (adapté de Hart, 1982) ••••••••••••••••••••••••• 5
FIGURE 1.2 Schéma de la variation de la constante d'équilibre (K) avec la densité d'adsorption (r) (d'après les résultats
de Benjamin et Leckie, 1981) •••••••••••••••••••••••••••• 11
FIGURE 2.1 Localisation de la station d'échantillonnage de l'eau et du sédiment nécessaire pour les expériences
d'adsorption •••••••••••••••••••••••••••••••••••••••••••• 16
FIGURE 2.2 Variation de la quantité de fer extrait en fonction de
la quantité d'hydrochlorure d'hydroxylamine (NH20H • HC1)
util i sée
...
'... .
FIGURE 3.1 Concentration cumulative de OH- ajouté pour ramener le
26
pH à 5,55 ••••••••••••••••••••••••••••••••••••••••••••••• 32
FIGURE 3.2 Concentrations de zinc associé aux fractions (F1, F2, F3A, F3B, F4) du sédiment en fonction des concentrations
de zinc total ajouté aux mélanges (EH à E16) ••••••••••• 35
FIGURE 3.3 Concentrations de zinc associé aux fractions (F1, F2, F3A, F3B, F4) du sédiment en fonction des concentrations
de zinc total ajouté aux mél anges (E6 à E10) •••••••••••• 36
FIGURE 3.4 Concentrations de zinc associé aux fractions (FI, FZ, F3A, F3B, F4) du sédiment en fonction des concentrations
de zinc total ajouté aux mél anges (El à E5) ••••••••••••• 37
FIGURE 3.5 Activité spécifique du zinc dans les fractions (FO, F1, F2, F3A, F3B, F4) du mélange réactionnel E5 (Zn
T ajouté
=
7,06 x 10-6 M), en fonction du temps •••••••••••••••••• 39FIGURE 3.6 Activité spécifique du zinc dans les fractions (FO, FI, F2, F3A, F3B, F4) du mélange réactionnel E15 (Zn
T ajouté
=
5,51 x 10-3 M), en fonction du temps •••••••••••••••••• 40FIGURE 4.1 Concentrations de H+ libéré lors de l'adsorption du Zn2+
par le sédiment du lac Tantaré
...
FIGURE 4.2 Coefficient de distribution (Kd) du 65Zn en fonction du
temps, pour les mélanges réactionnels E5 (Zn T ajouté
44
=
7,06 X 10-6 M) et E15 (ZnT ajouté
=
5,51 x 10-3 f4) •••• 49FIGURE 4.3 Constantes d'équilibre d'adsorption du zinc en fonction de la densité d'adsorption du zinc: comparaison des
résultats obtenus pour le sédiment du lac Tantaré
(K
=
[Zn(F3B)]/[Fe(F3B)] • [Zn]) avec ceux obtenus dansdes milieux bien définis •••••••••••••••••••••••••••••••• 52
FIGURE 4.4 Constantes d'équilibre d'adsorption du zinc par le sédiment du lac Tantaré en fonction de la densité
d'adsorption du zinc: comparaison des valeurs obtenues
en se servant de di fférentes bases de cal cul de r ... 54
FIGURE 4.5 Coefficients de distribution Kd du Zn en fonction des concentrations de zinc associé au sédiment; comparaison des résultats obtenus pour le lac Tantaré (sédiment lacustre: pH
=
5,55) avec ceux obtenus pour un sédimentmarin (pH
=
7,55) ••••••••••••••••••••••••••••••••••••••• 58CHAPITRE 1
1. INTRODUCTION 1.1 Problématique
Depuis quelques décennies l'activité humaine a conduit à une augmenta-ti on de l a mi se en ci rcul aaugmenta-ti on des métaux traces dans l'envi ronnement (Garrels et al., 1975). Particulièrement pour le zinc, Nriagu (1979) estime, à l'échelle mondiale, un apport anthropique annuel dans l'environne-ment aquatique 7,4 fois supérieur à celui des sources naturelles; Lantzy et Mackenzie (1979) arrivent à des conclusions semblables. Forstner et Wittmann (1981) ont rapporté une augmentation du flux de plusieurs éléments traces des
aquatique.
sources atmosphériques et terrestres vers l'environnement Cette contamination des eaux de surface crée un danger potentiel pour les eaux de consommation et peut aller jusqu'à entraîner une accumula-tion nette de différents métaux dans 1 a chaine al imentaire. Selon Luoma (1983) cette contamination par les métaux traces amenerait des effets toxi-ques pour certains organismes aquatitoxi-ques.
Les métaux rejetés dans l'environnement aquatique sont soumis à des réactions faisant intervenir l'interface sol ide-1 iquide. Une partie impor-tante des métaux traces se retrouve associée au sédiment de fond, ce dernier agissant comme "réservoir". Si on veut prédire les impacts conséquents à des changements de conditions environnementales (ex.: acidification des eaux, rejets miniers, etc ••• ) il est essentiel de comprendre les processus et de connaître les facteurs qui régissent la distribution des métaux traces entre l'eau et les différentes phases du sédiment.
Jusqu'à mai ntenant une hypothèse souvent retenue par 1 es scientifi ques suggère que des réactions d'adsorption contrôlent la distribution des métaux traces entre l'eau ambiante oxique (interstitielle; surnageante) et quelques phases importantes du sédiment oxique (Krauskopf, 1956; Oak1ey et al., 1981; Luoma et Davis, 1983). Parmi ces phases, les oxyhydroxydes de fer et de manganèse sont des cand idats très souvent ci tés (ex.: Jenne, 1968; 1977). Par ailleurs, seuls quelques chercheurs (Lion et a1., 1982; Balistrieri et
4
-Murray, 1983; 1984) ont tenté de vérifier cette hypothèse d'adsorption en utilisant des sédiments naturels. Il reste donc beaucoup à faire dans cette voie et notre travail s'inscrit à titre de contribution à l'étude de la répartition des métaux traces entre l'eau et les phases du sédiment oxique. 1.2 Mécanismes responsables de la distribution des métaux traces dans le
mil ieu 1 acustre
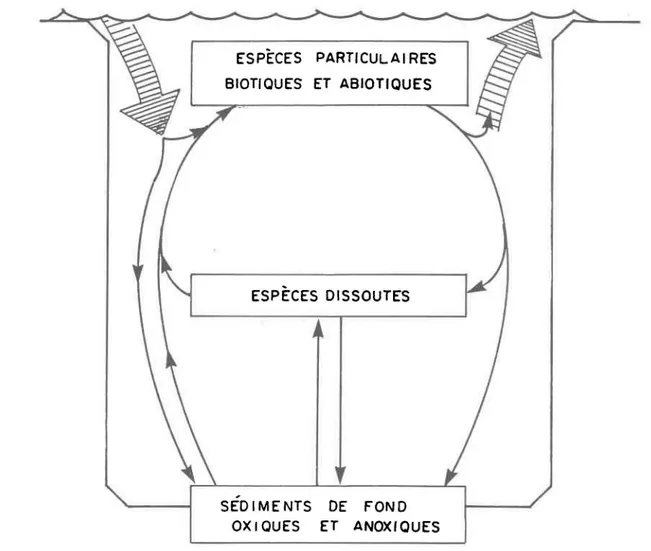
Les fi ux prédominants des métaux traces dans les lacs sont schémati sés d'une façon simplifiée à la figure 1.1. On y distingue trois réservoirs des métaux traces:
1) les espèces dissoutes, lesquelles regroupent les ions métalliques
libres (Mz+) et les complexes aqueux organiques et inorganiques;
2) les espèces particu1aires en suspension, lesquelles comprennent des particul es biotiques (phytop1 ancton et bactéries) et abiotiques
(matière organique et inorganique);
3) 1 es sédiments de fond, composés d'une zone oxi que qui correspond, lorsque présente, aux premi ers mil 1 imètres ou centimètres de 1 a
phase solide à l'interface eau/sédiment et d'une zone anoxique. Seul s quel ques chercheurs ont tenté de quanti fi er ces fi ux (Hessl ein et ~, 1980; Carignan et Tessier, 1985; Sundby et Si1verberg, 1985).
La répartition des métaux traces entre ces compartiments pourrait être contrôlée par des processus d'adsorption, de précipitation, de
co-précipita-tion ou de prise en charge par certains organismes vivants (Hart, 1982). Pour vérifier si le processus de précipitation peut expliquer l'accumulation des métaux traces dans les sédiments, on peut effectuer des calculs thermo-dynamiques de saturation. Ces calculs thermothermo-dynamiques, effectués pour les eaux interstitielles de sédiments oxiques, présentent souvent une insatura-ti on par rapport aux phases sol ides connues des métaux traces (i nc1 uant 1 e
5
-ES PÈC-ES PARTI CUL A 1 R-ES BIOTIQUES ET ABIOTIQUES
ESPÈCES DISSOUTES
SEDIMENTS DE FOND OXIQUES ET ANOXIQUES
FIGURE 1.1 Cycle biogéochimique simplifié des métaux traces dans les lacs (adapté de Hart, 1982).
6
-zinc) sauf pour le fer (Tessier et al., 1985) qui semble être contrôlé par des oxyhydroxydes de fer (goethite, magnétite, hématite). Les"eaux inter-stitielles des sédiments oxiques ont un temps de contact beaucoup plus long avec 1 es phases sol ides du sédiment que 1 es eaux surnageantes; 1 es métaux traces qui y sont présents sont donc plus aptes à atteindre un état d'équi-1 ibre avec l es phases sol ides du sédiment que ceux présents dans l'eau
surnageante.
Pui sque l' équil ibre de sol ubil i té avec l es phases sol ides pures ne sembl e pas expl i quer les concentrati ons des métaux traces dans l es eaux naturelles, sous condition oxique, l'adsorption par les surfaces sol ides a été suggérée comme un mécanisme important du contrôle de la concentration de certains métaux traces dans ces conditions (Krauskopf, 1956; Schind1er, 1967) •
1.3 Modèle de répartition
Les sédiments oxiques sont des mé1 anges compl exes de pl usieurs phases sol ides pouvant incl ure des argil es, de 1 a matière organique et des carbo-nates aussi bien que des oxyhydroxydes de fer, de manganèse, d'aluminium et de silicium et d'autres minéraux. Ces phases géochimiques du sédiment oxi que sont des substrats potenti el s pour l' adsorpti on. Pour prédi re la répartition de métaux traces dans les sédiments aquatiques, Oak1ey et al. (1981) ont proposé un modèle d'adsorption qui prend en compte cette complexité. D'après ce modèle, l'adsorption d'un métal trace M par les différents substrats peut-être caractéri sée d'une manière simpl ifiée par:
K(1) M + S(1)
-...
MS(I)----
K(2) M + S(2)-...
MS(2) (1.1 )• •
----
•
•
•
K( k)•
• •
•
M + S(k)-...
----
MS(k)avec K( k) =
7
-[MS(k)] [S( k)] [M]
(1.2 ) où K(I<) représente la constante d'équilibre de la réaction d'adsorption et [M], [S(k)] et [MS(k)] représentent respectivement la concentration de l'ion libre, le nombre de sites libres pour la phase géochimique "k" et la
concen-tration du métal trace associé au substrat "k". Jenne (1968; 1977) a mis en lumière les rôles de premier ordre joués par les oxydes et la matière
orga-nique comme substrats pour contrô1 er l a concentration des métaux dans les eaux naturelles. Par ailleurs, des études empiriques, faisant appel à des techniques d'extraction chimique des sédiments, confirment l'importance des oxyhyd roxydes de fer et de manganèse et d-e l a mati ère organ i que comme "réservoi rs" des métaux traces (T ess i er et al ., 1980; Luoma et Bryan, 1981;
Lion et al., 1982; Rapin et al., 1983; Hickey et Kittrich, 1984). Mathéma-ti quement, 1 e modèl e de Oakl ey et al. (1981) est simil ai re à ceux util i sés pour calculer la distribution d'un métal trace dissous parmi un mélange de ligands. Pour être utilisable, un tel type de modèle nécessite comme données initiales les valeurs de K(k) et [S(k)]. Des valeurs de K(k) peuvent être obtenues des nombreuses expériences d' adsorpti on effectuées dans des mil ieux bien définis, c'est-à-dire en util isant un seul substrat (oxyhydroxydes de fer, de manganèse, acides humiques, argiles) pour l'adsorption d'un seul métal dans un milieu où on effectue un contrôle strict des paramètres comme la force ionique, la température et les concen-trations de 1 igands (James et Healy, 1972; Tewari et al., 1972; Brown, 1979;
Kinniburg et Jackson, 1981; Tipping et al., 1983; Davis, 1984). Les valeurs de S(k) ont parfois été évaluées également dans ces études. Avant d'extra-poler ces valeurs, obtenues pour les mil ieux simples, à des milieux complexes comme les sédiments, il est nécessaire de démontrer qu'on est justifié de le faire. Par exemple, il serait souhaitable de mesurer des val eurs de K( k) et S(k) sur des sédiments naturel s et de comparer ces val eurs à ce11 es obtenues pour 1 es mil ieux simpl es. Une tell e comparai son des valeurs de K(k) a été amorcée dans les travaux de Tessier et al. (1985).
8 -1.4 Adsorption sur les oxydes métalliques
..
Dans le but de mieux comprendre le rôle potentiel des oxydes métalli-ques au niveau du contrôle des concentrations de métaux traces dans les eaux naturelles, plusieurs études en laboratoire ont été produites afin d'exa-miner les réactions d'adsorption sur ces substrats (ex.: Loganathan et Burau, 1973; Murray, 1975; Schind1er et al., 1976; Davis et Leckie, 1978; Swallow et al., 1980; Ba1istrieri et f>1urray, 1982; Millward et f>1oore, 1982). Plusieurs modèles mathématiques ont été développés dans le but d'interpréter l'adsorption des ions métalliques sur des surfaces d'oxydes en milieux simples (Stumm et al., 1970; Davis et al., 1978). Toutefois, Benjamin et al. (1982) considèrent que l'extension de ces modèles à des systèmes plus complexes, tels les sédiments, est difficile à envisager pour l'instant.
L'adsorption d'un ion métallique "M" sur une surface d'oxyhydroxyde peut être décrite, d'une manière simplifiée, par la réaction suivante (Benjamin et Leckie, 1981; Ba1istrieri et Murray, 1983):
SOH + M
x
*K
SOM + xH+ (1. 3)
où SOH et SO~1 représentent respecti vement 1 es si tes de surface 1 ibres et
x
ceux occupés par M et x est 1 e nombre moyen d'ions H+ 1 ibérés lorsqu'un M est adsorbé. Afin de simplifier les équations, les charges ont été omises. Comme il y a évidence que les surfaces d'oxyhydroxydes regroupent plusieurs types de sites couvrant un spectre d'énergies de liaisons, *K correspond à une constante d'équilibre globale (Benjamin et Leckie, 1981). On peut écrire selon l'équation (1.3):
*K
=
(SOM) [H+]x (SOH
x) [M]
9
-où 1 es crochets représentent des concentrati ons en mol e/L et 1 es paren-thèses, des concentrations en mole de ~ites/gramme de sédiment sec. A un pH donné, on peut définir +K comme une constante qui est fonction du pH:
*K
(SOM)+t<
=
= (1.5)Parmi 11 ensembl e des oxyhyd roxydes naturel s,les oxyhyd roxydes de fer et de manganèse sont ceux qui sont les plus susceptibles de lier les métaux, étant données leur abondance relative et leurs valeurs de constante d'équi-1 ibre dl adsorpti on. Dans ce travail, nous nous intéresserons parti cul ière-ment aux oxyhydroxydes de fer comme substrat dl adsorption des métaux traces, étant donnée leur abondance dans le sédiment étudié.
Le rapport du nombre de moles de sites d'oxyhydroxydes de fer occupés par 11ion M par gramme de solide sec, (SOM), sur le nombre de mole de substrat par gramme de solide sec, {Fel}' correspond à la densité d'adsorp-tion r:
r
=
(1.6)Sion accepte que 1 a concentrati on total e des si tes, (SOHx)l est à peu près égale à la concentration des sites libres à l'équilibre, (SOH
x)' et que cette concentration est proportionnel l e au nombre de mol es dl adsorbant par gramme de solide sec, on peut écrire:
(1.7)
où n représente 1 e nombre de sites dl adsorpti on par mol écul e dl oxyhydroxyde de fer. La valeur de n devrait varier selon les caractéristiques de surface des oxyhydroxydes de fer.
10
-Par substitution de (1.6) et (1.7) dans 11
équation (1.5), on obtient:
r (sor",)
K
=
+K·
n=
=0.8 )
K est une constante qulon peut mesurer pratiquement.
On doit noter que les constantes *K,
+K
et K ne sont pas des constantesthermodynamiques et peuvent être infl uencées par différents facteurs, tel s le pH, la concentration d'adsorbant, le type de métal adsorbé ou encore la
densité d'adsorption. La variation de K avec ce dernier facteur nous
inté-resse particu1 ièrement car une contamination en métal conduit à une
augmen-tation de r.
1.5 Variation de K avec r
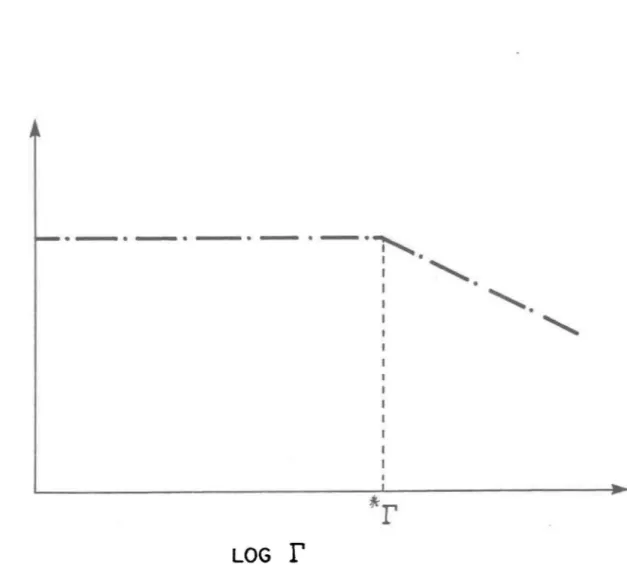
Benjamin et Leckie (1981) ont montré que pour 1 1 adsorption d'un métal
sur des oxyhydroxydes de fer amorphes, dans des mil ieux simp1 es, 1 a
cons-tante d ' équi1ibre varie avec r de la façon schématisée à la figure 1.2. On
y di sti ngue aux faib1 es val eurs de log r un pl ateau où log K demeure inva-ri ab1 e avec log r suivi e dl une chute de log K aux pl us fortes val eurs de
log
r.
La densité d'adsorption critique,*r,
correspond au début de lachute du log K. Benjamin et Leckie (1981) expliquent cette chute de K par
une saturation des sites d'adsorption de haute énergie lorsque la densité
d'adsorption r augmente. La concentration des sites dont la liaison est
trèsénergéti que peut être extrêmement faibl e comparée à l a concentration
totale des sites de surface (Benjamin et Leckie, 1981).
1.6 Objectifs du travail
Dans ce travail, notre objectif spécifi que est dl êtud ier le
comporte-ment de K en fonction d'une augcomporte-mentation de
r,
d'évaluer*r,
et la(!)
o
...J 11--_. - - ---. -
.
_.~ 1 • l " "LOG
r
•FIGURE 1.2 Schéma de la variation de la constante d'équilibre (K) avec la densité d'adsorption (r) (d'après les résultats de Benjamin et Leckie, 1981).
12
-fer. À cette fin, on utilise un sédiment naturel très riche en fer pour effectuer des expériences en laboratoire. On compare ensuite l'adsorption obtenue sur ce type de sédiments à celle obtenue soit sur d'autres types de
r
so li des, soi t sur des oxyhydroxydes de fer en mi lieux bi en défi ni s. Ce travail s'inscrit dans le cadre des études qui visent à évaluer l'importance que jouent, dans les eaux naturelles, les réactions d'adsorption dans la distribution de métaux traces entre l'eau et différentes phases solides des sédiments oxiques.
CHAPITRE 2
PROTOCOLE EXPERIMENTAL
2. PROTOCOLE EXPÉRIMENTAL 2.1 Échantillonnage
Le sédiment et l'eau nécessaires pour les expériences ont été prélevés dans le lac Tantaré en janvier 1985. Ce lac a été choisi parce que dans une zone bien définie (voir figure 2.1), on y retrouve des sédiments très riches en fer, 1 equel est présent surtout sous formes de granul es de quel ques millimètres de diamètre. D'autres raisons qui ont motivé son choix sont sa proximité, puisqu'il est situé à environ 40 kilomètres au nord de Québec, dans la réserve écologique de Tantaré (4r09'03"; 71°32'44"). De plus le lac Tantaré montre des symptômes classiques d'un lac en voie d'acidification (transparence él evée; peu de phytopl ancton; présence d'al gues benthi ques) • Le pH de l 'épilimnion varie entre 5,1 et 5,5 en été (Campbell et al., 1982). La première phase de l'échantillonnage a consisté à prélever par étape, 40 litres d'eau du lac à une profondeur approximative de 9 mètres, à l'aide d'une bouteill e Van-Dorn. Par l a sui te, une benne Ekman (50 cm x 50 cm x 50 cm) a été utilisée pour prélever le sédiment à une profondeur d'environ 10 mètres. Avec une cuillère de polyéthylène, le premier centimètre de sédiment, contenant beaucoup de granul es, a été récupéré dans un contenant de pOlypropylène, auquel a été ajouté "in situ" suffisamment d'eau du lac
pour obtenir un sédiment dilué par un facteur d'environ 10.
Peu de temps après l'échantillonnage (moins de 24 heures), le sédiment dilué a été passé au travers d'un tami s de nylon dont les mail 1 es ont 1 l1Il1
de côté. Les gros débris de matière organique restant sur le tamis ont été retirés, alors que les nodules d'oxydes de fer supérieurs en dimension aux maill es du tamis, ont été récupérés, broyés et rajoutés au sédiment qui se présentait alors sous forme d'une boue de particules de diamètre inférieur à 1 11Il1. Le sédiment expérimental ainsi constitué a été agité de façon
continue en présence d'air introduit par barbottage afin de lui conserver ses caractéri sti ques oxi ques. Cette agitati on en présence d'ai r s'avérait nécessaire pour éviter le développement de conditions anoxiques. On a
,
LAC
TAN TA RE
\
~\
ÉCHELLE: o 400 800m l ' !..
FIGURE 2.1 Localisation de la station d'échantillonnage de l'eau et du sédiment nécessaire pour 1 es expéri ences d'ad sorpti on.
...
17
-mesuré, en effet, avec une électrode à O2 (Oxymètre YS1. modèle 58; électrode YS1 57-39) une baisse rapide de 1 1 oxygène dissous (~ 80% en quel-ques heures) lorsque 11agitation était arrêtée. La perte d'eau par évapora-tion, mesurée par pesée a été compensée par des ajouts d'eau déminéralisée. 2.2 Concentrations de fer et de zinc dans le sédiment
Une partie du sédiment expérimental a été centri fugée et séchée à l'étuve à 70
Oc
jusqu'à ce que le poids sec soit stable (~ 18 heures). L 'échantill on de sédiment sec a ensuite été mis en sol ution à 11 aide de 1 a méthode de digestion décrite à la section 2.5. Les rés~tats de l'an~yse du fer et du zi nc fai te par spectrométrie dl absorpti on atomi que à 1 a f1 amme(Varian Techtron, modèle 575ABQ) sont présentés au tableau 2.1a. Une autre parti e du sédiment expérimental a été soumi se à 1 a procédure dl extracti on séquentielle {voir la section 2.5}; les résultats sont présentés au tableau 2.1b. Ces résultats confirment la richesse en oxyhydroxydes de fer du sédiment prélevé et suggèrent que ces oxyhydroxydes de fer constituent un piège important pour 1 e zi nc. Une anal yse de diffracti on-X des granul es montre la présence de lépidocrocite, de goethite et de matériel amorphe; en chauffant, cette matière solide se transforme en hématite.
2.3 Caractéristiques de 1 leau du lac
Quelques caractéristiques principales de l'eau du lac Tantaré sont présentées dans le tableau 2.2. Le pH a été obtenu à l'aide d'un pH-mètre (Radiometer/Copenhagen pH Meter 26; électrode combinée Fisher No 13-639-90). Les concentrations d'anions (Cl-, N03 , SO~) ont été mesurées par chromato-graphie ionique (Dionex Auto 10n-12; colonne PIN 030985) dans un échantillon d'eau du lac non acidifié. Les concentrations de cations (Zn++, Fë+I+++,
Mn++, Ca++, Mg++, Na+, K+, Al +++, Ba++) ont été obtenues par spectrométrie d'émission à plasma (Jarrel1-Ash 1CAP 9000) dans un échantillon d'eau du lac
filtré (Nuclepore 0,45 ~) et acidifié {O,5% {v/v} HC1}.
Des calculs thermodynamiques effectués avec le modèle d' équi1ibre chimique WATEQ2 (Ball et al., 1980) indiquent que le zinc dans 11eau du lac
18
-TABLEAU 2.1 a) Concentrati on du fer et du zi nc dans 1 e sédiment du 1 ac Tantaré.
..
Mole/g (poids sec) % poids
Fe 3,50 x 10-3 22,9
Zn 2,28 x 10-6 0,0015
b) Répartition du fer et du zinc dans le sédiment du lac Tantaré. Fraction Fe Zn (%) (%) Fl 0,1 20,4 F2 0,7 10,6 F3A 0,3 6,3 F3B 87,5 40,4 F4 11,3 22,2
19
-TABLEAU 2.2 Concentrations de cations et d'anions dans l'eau du lac Tantaré.
Espèces Mol e/L Cl- 1,18 x 10-5
-N03 7,26 x 10-6 SO~ 3,80 X 10-5 Zn++ 2,57 x 10-7 Fe++I+++ 5,35 x 10-7 Mn++ 2,82 x 10-7 Ca++ 3,04 x 10-5 Mg++ 1,24 X 10-5 Na+ 2,50 x 10-5 K+ 8,86 X 10-6 Al+++ 2,73 X 10-6 Ba++ 9,32 x 10-8 H+ 2,82 X 10-620
-est définitivement insaturé par rapport aux phases sol ides sous lesquelles il peut précipiter. De plus on note une sursaturation de l'eatJ du lac par rapport à la goethite, à la magnétite et à l'hématite (tableau 2.3). Pour ces calculs, on a utilisé les données du tableau 2.2, en plus de considérer l a val eur de 1,69 x 10-5 t4 pour
[HCO~];
cette dernière val eur a été obtenue à partir de la concentration de carbone inorganique total évaluée à 1,75 ~ par Carignan (communication personnelle) au même site à un pH de 5,2.2.4 Procédures expérimentales
Dans le but de vérifier la variation de la constante d'équilibre d'adsorption avec la densité d'adsorption, les expériences ont été réalisées de la façon suivante. Des quantités données de sédiment expérimental du lac Tantaré (~ 7,5 g de poids humide; équivalent en moyenne à 1,2869 g de poids sec) étaient placées dans des bouteilles de polypropylène de 1 litre et on complétait les volumes à 750 ml avec de l'eau du lac contenant des quantités variables de zinc ajouté (entre 10-6 M et 10-2 M) sous forme de Zn(N0
3 )2' les concentrations exactes de sédiment et de zinc utilisées pour toutes les experlences sont données au tableau 2.4. Chacun des mélanges réactionnels était agité de façon continue et, périodiquement, le pH de chaque mélange réactionnel était réajusté à 5,55 (le pH original de l'eau du lac Tantaré) avec une solution de NaOH 0,1 M. le volume ajouté était noté; ces ajouts ne modifiaient pas de façon significative les volumes réactionnels (au plus 0,08%). Il était nécessaire de procéder à ces ajouts sur une période de 25 jours avant que le pH se stabilise à 5,55, suggérant l'atteinte d'un état d'équilibre. Après une attente de 10 jours supplémentaires, les milieux réactionnel s étaient centrifugés et fil trés (Nucl epore; 0,45 !lm) pour Y mesurer les concentrations de zinc dissous dans les filtrats et la réparti-tion du zinc dans différentes fracréparti-tions du sédiment. Cette dernière mesure était effectuée en soumettant les sédiments à des attaques chimiques séquen-tielles décrites à la section 2.5.
Afin de vérifier si l'équilibre d'adsorption était réalisé dans les mil i eux réacti onnel s décrits ci -dessus, on a égal ement mené l' expéri ence
- 2 1
T A B L E A U 2 . 3 I n d i c e d e s a t u r a t i o n ( S I = 1 o g I A P / K ' ) d e
rapport aux oxyhydroxydes de fer, tel que
I ' e a u s u r n a g e a n t e p a r c a l c u l é a v e c W A T E Q Z . I A P e s t 1 e p r o d u i t K s e s t l e p r o d u i t d ' a c t i v i t é d e s io n s . d e s o l u b i ' l i t é d u s o l i d e . G o e t h i t e Magnêti te Hêmati te 3 , 5 6 3 7 ,081 L 2 , 0 3 4
2 2 -T A B L E A U 2 . 4 C a r a c t é r i s t i q u e s d e s m é l a n g e s * r é a c t i o n n e l s u t i l i s é s p o u r l e s é t u d e s d ' a d s o r p t i o n . Numéro de mé1 ange rêacti onnel C o n c e n t r a t i o n d e séd i ment ( g d e p o i d s s e c / L ) C o n c e n t r a t i o n d e zinc ajouté au système
(mol e/L ) E 1 E 2 E 3 E 4 t 5 E 6 E 7 E 8 E 9 8 1 0 E 1 1 ELz E 1 3 E 1 4 E 1 5 E 1 6 I , 7 L I , 7 t L , 7 t 1 , 7 1 L , 7 L 1 , 7 1 L , 7 L L , 7 t I , 7 l L , 7 2 L , 7 2 L , 7 2 L , 7 2 t , 7 2 t , 7 2 t , 7 3 1 , 3 7 x 1 0 - 5 3 , 3 3 x 1 0 - 5 5 , 1 5 x 1 0 - 6 7 , 0 6 x 1 0 - 5 1 , 4 3 x 1 0 - s 3 , 3 2 x 1 0 - s 4 , 9 9 x 1 0 - 5 7 , 0 0 x 1 0 - s 2 , 3 7 x 1 0 - a 3 , 9 3 x 1 0 - a 8 , 0 2 x 1 0 - a 2 , I 2 x ! 0 - 3 3 , 9 5 x L 0 - 3 5 , 5 1 x 1 0 - 3 1 , 4 5 x 1 0 - 2
* Le volume d'eau utilisé êtait 750 mL sauf pour E5 et E15 ayant reçu en p a r t i e d u s s z n p o u r le s q u e ' l s o n a u t i l i s é 3 7 5 0 m L .
2 3 -s u i v a n t e : d e u x m é l a n g e -s r ê a c t i o n n e l s (E 5 e t E 1 5 ) r e c e v a i e n t in i t i a l e m e n t u n e p a r t i e d e I e u r z i n c a j o u t ê s o u s f o n n e r a d i o a c t i v e ( 5 5 Z n C t z i . C e s d e u x m ê l a n g e s o n t ê t ê p r ê p a r é s , e n r e s p e c t a n t le m ê m e r a p p o r t s ê d i m e n t / e a u ( v o i r t a b l e a u 2 . 4 ) m a i s e n a i o u t a n t d e s q u a n r . i t ê s d e s é d i m e n t e t d ' e a u 5 f o i s p l u s é l e v ê e s . À t = 3 6 j ( c o i n c i d a n t a v e c I' a r r ê t d e s e x p ê r i e n c e s p r é c ê d e n t e s ) e t à t = 7 2 j , d e s ê c h a n t i l l o n s ( 3 0 0 m L ) ê t a i e n t p r ê l e v ê s , c e n t r i f u g ê s e t f i l t r é s ; l e s c o n c e n t r a t i o n s d e z i n c d a n s I' e a u e t d a n s le s d i f f é r e n t e s f r a c -t i o n s d u s ê d i m e n -t ê t a i e n t m e s u r é e s . L ' a c t i v i t ê s p é c i f i q u e d u z i n c d a n s c h a c u n e d e s f r a c t i o n s ê t a i t u t i l i s é e a f i n d ' ê v a l u e r s i ' l ' é q u i l i b r e i s o t o -p i q u e é t a i t a t t e i n t -p o u r 1 ' e n s e m b l e d e s f r a c t i o n s d u s ê d i m e n t . 2 . 5 E x t r a c t i o n s s ê q u e n t i e l I e s P o u r ê v a l u e r o ù s e f i x a i t l e z i n c a j o u t é d a n s le s m i l i e u x r é a c t i o n n e ' l s , o n a s o u m i s , à l a f i n d e s e x p é r i e n c e s , d e s a l i q u o t e s d e s é d i m e n t ( = 1 , 8 g d e p o i d s h u m i d e ; ê q u i v a l e n t e n m o y e n n e à 0 , 1 8 6 8 g d e p o i d s s e c ) à u n e p r o c é d u r e d ' e x t r a c t i o n s s é q u e n t i e l l e s ê l a b o r ê e p o u r s ê p a r e r l e z i n c e n c i n q f r a c t i o n s : ( a ) Z n ( F 1 ) : z i n c é c h a n g e a b l e . L ' ê c h a n t i l l o n d e s ê d i m e n t ê t a i t m i s
en contact pendant 30 minutes avec 8 mL de MgCl 2 1 M à
p H i n i t i a ' l d e 7 , 0 ; ( b ) 7 n f 2 l : z i n c l i é a u x c a r b o n a t e s o u s p ê c i f i q u e m e n t a d s o r b é . L e r é s i d u d e l ' é t a p e ( a ) ê t a i t m i s e n c o n t a c t p e n d a n t 5 h e u r e s a v e c I m L N a 0 A c 1 . , 0 M a j u s t ê à p H = 5 , 0 a v e c H O A c ; ( c ) Z n ( F 3 A ) : z i n c l i ê a u x o x y h y d r o x y d e s d e m a n g a n è s e . L e r é s i d u d e 1 ' é t a p e ( b ) ê t a i t m i s e n c o n t a c t p e n d a n t 3 0 m i n u t e s , à l a t e m p ê r a t u r e d e l a p i è c e , a v e c 2 0 m L d e N H 2 0 H . H C I 0 , 0 1 . M d a n s H N 0 3 0 , 0 1 M ;
( d ) Zn(F3B): zinc liê aux oxyhydroxydes d e f e r e t a u x o x y h y d r o x y d e s d e m a n g a n è s e r é s i d u e l s . L e r ê s i d u d e l ' é t a p e ( c ) ê t a ' i t
2 4 -mi s en contact pendant 6
96 "C, avec 30 mL de NH20H
H O A c ;
heures, à une température . HCI 0,1. M dans 25% (v/v) È de de ( e ) Z n ( F 4 ) : z i n c l i ê à I a m a t i è r e o r g a n i q u e e t z i n c r é s i d u e l . L e r é s i d u d e l ' é t a p e ( d ) é t a i t d i g é r é e n u t i l i s a n t l a m é t h o d e d e d i g e s t i o n d é c r i t e a u t a b l e a u 2 . 5 . L e s ê t a p e s ( a ) , ( b ) , ( d ) e t ( e ) d e c e t t e p r o c é d u r e o n t ê t é d é c r i t e s p a r T e s s i e r e t a l . ( 1 9 7 9 ) ; l' ê t a p e ( c ) , s u g g ê r é e p a r C h a o $ 9 7 2 ) a ê t é i n c l u s e p o u r d i s t i n g u e r e n t r e l e s o x y h y d r o x y d e s d e f e r e t d e m a n g a n è s e . L ' é t a p e ( d ) , d é c r i t e p a r T e s s i e r e t a l . ( 1 9 7 9 ) a ê t é m i s e a u p o i n t p o u r d e s s ê d i -m e n t s c o -m p r e n a n t d e s c o n c e n t r a t i o n s " n o r m a l e s " d ' o x y h y d r o x y d e s d e f e r ( i . e .
- 2-3%1. Un calcul simple a rpntré que pour un sédiment r i c h e e n f e r , c o m n e
c e l u i u t i l i s é d a n s c e t r a v a i l ( 2 2 , 9 % d e f e r ) , l e s c o n c e n t r a t i o n s d ' a g e n t r é d u c t e u r p r é c o n i s é e s p a r T e s s i e r e t a l . ( 1 9 7 9 ) s ' a v ê r a i e n t i n s u f f i s a n t e s
( Z O mL de NH20H. HCI 0,04 M) pour réduire tous les oxyhydroxydes d e f e r
c o n t e n u s d a n s 1 g d e s ê d i m e n t s e c . 0 n a d o n c e f f e c t u é u n e s é r i e d ' e x p é -r i e n c e s d ' e x t -r a c t i o n s o ù o n v a -r i a i t s o i t l a q u a n t i t é d e s é d i m e n t à e x t , r a i r e , l a c o n c e n t r a t i o n d e N H 2 0 H . H C I o u l e v o l u m e d e s o l u t i o n d ' e x t r a c t i o n . L e s r é s u l t a t s p r é s e n t é s à l a f i g u r e 2 . 2 n o u s o n t a m e n é à c h o i s i r l e s c o n d i t i o n s a c t u e l l e s ( u n m a x i m u m d e 0 , 2 5 0 g d e s é d i m e n t s e c ; 3 0 m L d e N H z O H ' H C I 0 , 1 M ) ; l e s v a l e u r s n u m é r i q u e s d e s r é s u l t a t s s o n t d o n n é e s e n a n n e x e a u t a b l e a u A . 1 . M e n t i o n n o n s ê g a l e m e n t q u e I ' o x y d a t i o n d e l a m a t i è r e o r g a n i q u e ( a v e c H z } z e n m i l i e u H N O g ) n ' a p a s ê t é s é p a r é e d e l a d i s s o l u t i o n d e l a m a t i è r e c r i s t a l l i n e é t a n t d o n n é q u e p e u d e z i n c e s t h a b i t u e l l e m e n t l i b é r é p a r o x y d a t i o n d e ' l a m a t i è r e o r g a n i q u e ( T e s s i e r e t a l . , 1 9 8 0 ; L 9 8 2 ; 1 9 8 5 ) . L a p r o c ê d u r e s u i v i e a v e c c h a q u e m é l a n g e ré a c t i o n n e l é t a i t d o n c l a s u i v a n t e . À l a f i n d e I ' e x p ê r i e n c e u n v o l u m e d u n É l a n g e r é a c t i o n n e l
( 3 0 0 mL) était centrifugê pendant 1 5 m i n u t e s à 1 0 8 2 5 g ( S 0 R V A L L R C Z - B ) . U n é c h a n t i l l o n d e l a s o l u t i o n ( - Z 0 m L ) ê t a i t r e t i r ê à l ' a i d e d ' u n e s e r i n g u e d e p o l y p r o p y l è n e e t p o l y é t h y l è n e ( F o r t u n a ) e t f i l t r é ( N u c t e p o r e 0 , 4 5 Hn) à l ' a i d e d ' u n s y s t è m e d e f i l t r a t i o n c o n s t i t u é d e p o l y c a r b o n a t e e t d e p o l y é t h y -I è n e ( N u c l e p o r e ) . L e z i n c r e s u r é d a n s l e f i l t r a t e s t d é s i g n é d a n s c e
2 5 -TABLEAU 2.5 Digestion complète des sêdiments.
a ) C h a u f f e r u n e p l a q u e à 3 5 0 " C pendant L heure avant 1 e début de I a d i g e s t i o n ;
Peser exactement, environ 250 mq de sédiment sec;
I n t r o d u i r e l' é c h a n t i l l o n d a n s u n b ê c h e r d e T e f l o n d e 1 2 5 m L ;
A j o u t e r 1 5 m L d e H N 0 3 c o n c e n t r ê , m e t t r e l e b é c h e r s u r l a p l a q u e et c h a u f f e r % heure sous reflux (avec un verre de montre);
B a i s s e r l a t e m p é r a t u r e d e l a p ' l a q u e à 2 0 0 o c e t l a i s s e r r e f r o i d i r l e b ê c h e r p e n d a n t L h e u r e a v a n t d ' e n ' l e v e r l e v e r r e d e m o n t r e ;
É v a p o r e r â s e c le c o n t e n u c l u b ê c h e r â 2 0 0 " C (2-4 heures);
E n l e v e r le b ê c h e r d e l a p l a q u e et chauffer à 350 " C pendant % heure;
Ajouter 4 mL de HCI 04 70%, remettre I e bêcher sur 1 a pl aque et
c h a u f f e r p e n d a n t L h e u r e a v e c le v e r r e d e m o n t r e e n p l a c e ;
B a i s s e r la t e m p é r a t u r e d e ' l a p ' l a q u e à 2 0 0 o C e t l a i s s e r r e f r o i d i r l e b é c h e r p e n d a n t % h e u r e a v e c ' l e v e r r e d e m o n t r e e n p l a c e ;
tnl ever 1 e verre de montre et 1 aver en ajoutant 10 mL de HF c o n c e n t r ê ;
A j o u t e r 2 0 m L d e H C l 5 % (v / v l et chauffer % heure à 200 " C ; T r a n s f é r e r l a s o l u t i o n d a n s u n b a l l o n j a u g é d e 5 0 m L ;
Si - nêcessai re, aj_outer quel ques cri staux de NH20H .
_HCl afi n cle f a i r e d i s p a r a î t r e le r é s i d u d ' o x y d e d e f e r e t d e m a n g a n è s e ; c o r ' r p l é t e r l e b a l l o n a v e c H C I 5 % l o r s q u e la s o ' l u t i o n e s t r e f r o i d i e . b ) c ) d ) e ) f )
e )
h ) i ) j ) k ) l ) m) n )(u L 5 L O t : . Ç ) o L !
t
r(u u . : ( l , i r o È (o - 5, . 4 8 s
; - ç . u. E 9 < u H ! . c trr .3 \ Ë o r 5 IL o c, o r ô $l l. PF a O . ! : o q r ( uu
x ( ,
T v . F -. ! ' F ( l ) + ' I ( F = . v â r ^ N Ë -- L ) 5 T,.q z
.3;
fu r-r ' F-e = ( 9 Ë " * ^ 5 T \, cr= J .U F ( u c g F v t l J F c > , o x . r O r ^ + ' t . Y . u ç t O ' r à I L - g G t -> E (\J (\l trJ É C' tL () ç \ \ O - - O Oo
'oQ
O ' -N ç o q 2 6 -\ \o :
" o
ol qo
o
o d \\ o
\ \o
|(l \I
I
g o
I
I l o I I I Il
o
II
o l
tt
o
\ \q
(\l tri F? |ft? 7
-t r a v a i l p a r Z n ( F 0 ) . U n e p a r -t i e d u c u l o -t ( - 2 A 0 m g d e p o i d s s e c ) ê -t a i -t s o u m i s e à l ' e x t r a c t i o n s é q u e n t i e l l e d ê c r i t e c i - d e s s u s . M e n t i o n n o n s q u e chaque extraction êtait effectuée dans des tubes à centrifugation de poly-p r o poly-p y l è n e ( 5 0 m l - ) ; a poly-p r è s chaque e x t r a c t i o n , l a s ê p a r a t i o n ê t a i t e f f e c t u é e p a r centrifugation (S0RVALL, m o d è l e R C 2 - B ) à L Z 0 6 2 g p e n d a n t 1 5 m i n u t e s . L e s u r n a g e a n t ê t a i t d é c a n t é e t a n a l y s ê p o u r l e z i n c e t l e f e r , a ' l o r s q u e l e r é s i d u ê t a i t l a v é a v e c d e I ' e a u d é m i n é r a l i s é e ( 8 m L ) ; a p r è s c e n t r i f u g a t i o n , c e s e c o n d s u r n a g e a n t ê t a i t c o n s e r v é e t a n a l y s é p o u r c o r r i g e r p o u r I a c o n t a -m i n a t i o n e n -m é t a u x i n t r o d u i t e d a n s l' e x t r a c t i o n s u i v a n t e . M e n t i o n n o n s f i n a l e m e n t q u e l e s r é s u l t a t s o b t e n u s a v e c d e s p r o c é d u r e s d ' e x t r a c t i o n s s é q u e n t i e l l e s , s e m b l a b l e s à c e l le d é c r i t e c i - d e s s u s , s o n t i n f l u e n c é s p a r d e s f a c t e u r s c o m m e 1 e c h o i x d e s r é a c t i f s u t i l i s é s p o u r l e s d i v e r s e s e x t r a c t i o n s , l a s é q u e n c e d e s e x t r a c t i o n s , l e t e m p s d ' e x t r a c t i o n , l e r a p p o r t e x t r a c t a n t / s é d i m e n t e t p a r d e s p r o b l è m e s a n a l y t i q u e s i n h é r e n t s ,
comme une sêlectivité incomplète ou une réadsorption des nÉtaux extraits
( G u y e t a l . , 1 9 7 8 ; R e n d e l l e t a l . , 1 9 8 0 ) . I l s ' e n s u i t d o n c q u e la d i s t r i b u -t i o n d u z i n c e n -t r e l e s d i v e r s e s f r a c -t i o n s n e r e f l è -t e p a s n é c e s s a i r e m e n -t ' l ' a s s o c i a t i o n a v e c d e s p h a s e s d i s c r è t e s , m a i s d e v r a i t p l u t ô t ê t r e c o n s i d é r é e c o r ù n e d é f i n i e o p é r a t i o n n e l l e m e n t p a r l e s m é t h o d e s d ' e x t r a c t i o n s . P o u r r e f l é t e r c e m a n q u e d e s é l e c t i v i t é , I e s c i n q f r a c t i o n s s o n t d é s i g n ê e s Z n ( F l )
7nff4) (it en est de mênre pour le fer) plutôt que par référence à des
p h a s e s g é o c h i m i q u e s p r é c i s e s . 2 . 6 D o s a g e d e s m é t a u x
L e s c o n c e n t r a t i o n s d e r n é t a u x tr a c e s d a n s l ' e a u ( F 0 ) e t d a n s l e s
extraits de sédiment (Fl à f4) ont êté mesurées par spectrométrie
d'adsorp-t i o n a d'adsorp-t o m i q u e a v e c o u s a n s f l a m m e ( V a r i a n Techtron, modèle 575 ABQ; Varian T e c h t r o n , m o d è l e L 2 7 5 , G T A - 9 5 ) , L e s c o n c e n t r a t i o n s o n t ê t é d é t e r m i n é e s p a r c o m p a r a i s o n a v e c l e s c o u r b e s d e c a l i b r a t i o n p r é p a r é e s a v e c l e s c o m p o s a n t e s d e s s o l u t i o n s d ' e x t r a c t i o n .
D a n s l e s c a s o ù l e r a d i o i s o t o p e 6 5 Z n a ê t ê u t i l i s é , l e s c o n c e n t r a t i o n s
2 8 -N a I ( T l ) ( C o m p u g a m m a , m o d è l e L 2 8 2 1 . A f i n t i o n s p o u r t e n i r c o m p t e d e l a d e m i e - v i e d u é c h a n t i l l o n s a ê t é a n a l y s é à l a f i n d e s p ê r i o d e d e 5 iours conduisant à u n e e r r e u r 2 . 7 R ê a c t i f s e t v e r r e r i e d ' é v i t e r d ' e f f e c t u e r d e s c o r r e c
-zi nc (245 jours) , I '?nsembl e des
e x p é r i e n c e s à l ' i n t ê r i e u r d ' u n e i n f ê r i e u r e à 0 , 4 % . L e s p r o d u i t s c h i m i q u e s u t i l i s ê s p o u r I a p r é p a r a t i o n d e s s o l u t i o n s d ' e x t r a c t i o n ê t a i e n t t o u s c o n f o r m e s a u x c r i t è r e s d e " l ' A m e r i c a n Chemical S o c i e t y " , o u s u p é r i e u r s d a n s le c a s d e s a c i d e s o u d e s b a s e s . L ' e a u d ê m i n ê -r a l i s ê e n é c e s s a i -r e à I a p r ê p a r a t i o n d e s s o l u t i o n s o u à d i f f ê r e n t s a u t r e s u s a g e s ( l a v a g e , tr e m p a g e , . . . ) a ê t é o b t e n u e à l ' a i d e d ' u n s y s t è m e M i ' l l i p o r e ( M i l 1 i- Q 3 R o / M i l I i - Q 2 ) . T o u t l e m a t é r i e l e n c o n t a c t a v e c l ' e a u o u l e s s ê d i m e n t s a ê t é n e t t o y é d e l a f a ç o n s u i v a n t e : - trempage d a n s H N 0 3 1 5 % p e n d a n t 2 4 h e u r e s ; - trempage d a n s H 2 0 d ê m i n ê r a l i s é e e t l o u ; r i n ç a g e s s u c c e s s i f s a v e c H 2 0 d é m i n ê r a l i s é e i u s q u ' à a t t e i n d r e u n p H s u p ê r i e u r à 6 ; - s ê c h a g e s o u s h o t t e â f l u x l a m i n a i r e a v e c fi l t r e ( H . E . P . A . ) . L a p l u p a r t d e s c o n t e n a n t s e t d e s b o u t e i l l e s d e r a n g e m e n t d e s o l u t i o n s u t i l i s é s ê t a i e n t e n p o l y é t f r y l è n e o u e n p o l y p r o p y l è n e , a u c u n e p i è c e d e v e r r e o u d e c a o u t c h o u c n ' a ê t é e n c o n t a c t a v e c l' e a u o u l e s s é d i m e n t s . D e s g a n t s à u s a g e u n i q u e e n p o ' l y ê t n y l è n e ê t a i e n t u t i l i s é s p o u r l e s m a n i p u l a t i o n s . 0 n a v é r i f i ê q u e le s m a n i p u ' l a t i o n s , l ' u t i l i s a t i o n d u m a t é -r i e l e t d e s -r ê a c t i f s o u l e c o n t a c t p -r o l o n g é ( 4 8 i o u -r s ) d e s s o l u t i o n s d a n s l e u r c o n t e n a n t , n ' e n t r a î n a i e n t p a s d e c o n t a m i n a t i o n s i m p o r t a n t e s e n z i n c d u m o i n s p o u r la g a m m e d e s c o n c e n t r a t i o n s d e z i n c u t i l i s ê e s .
C H A P I T R E
3 . RESULTATS 3 . 1 C o n c e n t r a t i o n s d e b a s e a i o u t é e L a c o n c e n t r a t i o n c u m u l a t i v e d e 0 H - q u ' o n a d û a j o u t e r p o u r r a m e n e r à 5 , 5 5 l e p H d e s m i l i e u x r é a c t i o n n e l s e s t p r é s e n t é e à l a f i g u r e 3 . 1 p o u r c h a c u n d e s m é l a n g e s r é a c t i o n n e l s ; l e s v a l e u r s n u m é r i q u e s s o n t d o n n é e s a u t a b l e a u A . 2 ( e n a n n e x e ) . P o u r le s r n é l a n g e s r é a c t i o n n e l s o ù l ' a j o u t d e z i n c é t a i t f a i b l e ( E 2 E 4 ) , la v a r i a t i o n d e p H ê t a i t n o n d é t e c t a b l e ; c e s c o n c e n -t r a -t i o n s d e z i n c -t o -t a l s o n -t p r è s d e c e l l e d u m i l i e u n a -t u r e l . E n c e q u i c o n c e r n e l e s m é l a n g e s r é a c t i o n n e l s o ù I ' a i o u t d e z i n c ê t a i t p l u s é l e v é ( E 5 - E 1 6 ) , l e p H n e s e s t a b i l i s a i t q u ' a p r è s u n e p é r i o d e p o u v a n t a l l e r j u s q u ' à e n v i r o n 2 5 j o u r s . T o u s l e s m ê l a n g e s r é a c t i ô n n e l s s e s o n t c o m p o r t é s d e l a m ê m e f a ç o n , c ' e s t - à - d i r e q u ' i l s n é c e s s i t a i e n t u n e c o n c e n t r a t i o n d e 0 H -p r o -p o r t i o n n e l l e à I ' a j o u t d u z i n c i n i t i a l . 0 n n o t e t o u t e f o i s u n e e x c e p t i o n p o u r l e m é l a n g e E 1 5 ( 0 H - a j o u t é = 4 4 , 1 x 1 0 - s m o l e / L ) o ù l a c o n c e n t r a t i o n d e 0 H - a j o u t é e e s t i n f é r i e u r e à c e l l e d u m é l a n g e E 1 4 ( O t t - a i o u t é = 5 1 . , 3 x 1 0 - 5 m o l e / L ) . C e c i p o u r r a i t s ' e x p l i q u e r p a r l e f a i b ' l e é c a r t d a n s l e s c o n c e n t r a t i o n s d e z i n c t o t a l a j o u t é ( t a U t e a u 2 . 4 ) c o m b i n é a u x e r r e u r s q u i s e g l i s s e n t d ' u n m é l a n g e r ê a c t i o n n e l à I ' a u t r e ( c o n c e n t r a t i o n d e s é d i m e n t , c o m p o s i t i o n d u s é d i m e n t , a i o u t d e l a b a s e , e t c . . . ) . 3 . 2 R é p a r t i t i o n d u z i n c a p r è s 3 6 iours de réaction L e s c o n c e n t r a t i o n s d e z i n c e t d e f e r d a n s l' e a u s u r n a g e a n t e t t M ( F 0 ) l ) e t d a n s d i f f é r e n t e s f r a c t i o n s d e s s é d i m e n t s d e s m é l a n g e s ré a c t i o n n e l s ( t M ( F l ) l â [ M ( F 4 ) ] ) , a p r è s u n t e m p s d e r é a c t i o n d e 3 6 j o u r s s o n t d o n n é e s d a n s le t a b l e a u 3 . 1 . L e s d o n n é e s c o n c e r n a n t l e s f r a c t i o n s F 1 à F 4 q u i a p p a
-raissent dans ce tableau sont exprimées en termes de poids sec de sêdiment;
l e p o i d s s e c n ' a c e p e n d a n t p a s é t é m e s u r é d i r e c t e m e n t . 0 n a p l u t ô t r e s u r é , d a n s c h a q u e fr a c t i o n , l a c o n c e n t r a t i o n d e f e r e t o n s ' e s t s e r v i d e l a c o n c e n t r a t i o n t o t a l e d e f e r ( i F e ( F i ) ) p o u r e x p r i m e r e n p o i d s s e c l e s é d i -m e n t u t i l i s é p o u r l e s e x p é r i e n c e s , s a c h a n t q u ' i l c o n t e n a i t a u d é p a r t 2 2 , 9 % d e f e r ( t a U t e a u 2 . 1 ) . L e s d o n n é e s o n t a u s s i ê t ê c o r r i g é e s p o u r t e n i r c o m p t e
N rt o rf,, @ . N l r ) rr, a tr, , ( O ao N - o-o ^ r .n b ! t ( l , o F N . - Y Ê v l U L ! v t = ù P r o ! . | J , 3 F = o .t, \t I O (u Ë (u .F {J d ) . u -E F - 3 E o .F {J (ë r f L {J c (l) (-, g o c) O ' Ê { (Y) lrj É (5 H l-L 3 2 -(\l r O m o o., o r-,id r l l I . I ù |rr trl u.l ulrll! g I lr, lf to ll' t r l l! l! l!
ilr
Ti fr
4i++
r l l r
j i i l
llll
11tl
i l l i
iq
{1
i i t
1\r
s!1?
ï i
l1
\ i 1
t r \
'..
"tt\
r
+
t
II
ït
I
I
I
t
\ \t
\J"
'b
\ \ ' tr I I I tr I Ir
t I o I I I tr
I I I r l l o t l I I I I I n I I tr t t \ \ r EI EI \'. \ 1b \
\ : \\ o b h
\ \ \ \ \'. 1 \ \ , ' \\ I I l! tr I I I I tr I I tr I I tr n I I I I I tr I I I I I I t q \il
J Iit
\ o \ u \ \ \ \ tr Et. s -tJ) sf o (o( t t 3 - l o h t
s - o l )
,3rnorv [ *o]
3 3 -L o u t r t r t t t l l l l l r l r l x x x x x x x x x x x x x x x x o ç t s o € o 6 0 F N æ È h b 6 6 € N 9 € æ O ô t s N F È Ê @ O O æ € b N N 9 9 d 6 N N O O N d N -t N È è È N È F F F F È N t s F t s È @ t r t t t r t l l l l l l l r l x x x x x x x x x x x x x x x x 6 Ê € h N N o t s d t s € C C O S N @ O t s È O o € N O O N € o € N O È r 6 @ b b € b 9 € € È @ F € F È 4 o L t t t t r t r t t r r r t t l l o o o o o o o o c o e o c o o o x x x x x x x x x x x x x x x x O q Ê O € O € O i @ 9 h È O 6 € 6 6 6 @ h € æ O € t s È È b 6 0 @ o o o o o o o a o o o o o m o o s N À @ @ @ 6 0 @ @ @ o @ @ o 6 6 6 t t t t l t l t t l l l t t t r x x x x x x x x x x x x x x x x o ô ô € ç 6 È ç € € o 9 N O æ € Ê 6 ô O 6 @ e Ê 6 O i O È O d Ê N o N 6 æ O o r 6 6 O 6 @ 6 6 b 6 6 6 6 6 6 6 6 l t t l t l l l t r t l t r t l x x x x x x x x x x x x x x x x o 6 o ç - o o 6 o N Q É € 9 o F É e N € @ N O Ê € 9 ç È F q b € N È F È È t s È @ O @ O O O 6 6 6 6 t l l t t t t t t t t t t r r l x x x x x x x x x x x x x x x x N € h t s O d d Ê O O È Ê O g N € 9 6 N € 6 o Ê o o O 6 O o È o o H È N O o F ç € O È N N o N L t r t t t t t t t t t t t l t l x x x x x x x x x x x x x x x x o 6 È 6 F d d O É N 9 C O F 6 È 6 6 0 È Q i Ë d t s O N € O È S Ê N N N O N O o O O O o O È O O O t N È F È È È @ @ @ @ 6 6 6 0 6 6 J t t t t t l t t t t t t t t l l x x x x x x x x x x x x x x x x N ç O O æ ç 6 S N N O N O O F 6 É æ @ ç € 6 t s 6 0 N O @ : ç @ ô N O 6 È È d N N € ê d N 6 t s € H L o L @ @ @ 6 @ @ @ @ @ @ @ @ @ @ @ @ 5 à à â à 5 9 5 5 9 5 à 5 è à à x x x x x x x x x x x x x x x x o o o N 9 b o 6 € o 6 € b 6 ç 9 o 9 o N s € o o o N N o o o È 9 o N € d N N 6 N 6 6 € b ô 6 ç ç N È È @ o @ @ 6 6 0 6 6 6 i J t i t t t r t r t t t t t t t t t l o o o o o o o o e o o o o o o o x x x x x x x x x x x x x x x x h 6 F æ N d È @ € O O È ç 6 € € € d o o N o È 6 o 6 È o N € É @ 9 æ É N N ç b t s o o r è t s È È è è È F È È È O @ @ O @ t t t t r r r r t t t t r t t l o o o o o o o o o o o o o o ô o x x x x x x x x x x x x x x x x N N N € O O O N € € O 6 6 6 O O € ç O Ô Ê @ € È 6 6 d O H ç ç ç ç € ç ç + N N d 6 N N ç 6 N È È È @ @ @ 0 6 6 J J t l t t t t t t t r r t l l l l l o o o o o c ) o a o c ) o o o o o o x x x x x x x x x x x x x x x x o o o 6 € ç o 6 0 t s ç È È N 6 0 ç o 6 o o o q o o o È 6 È 6 Q o Ô ç È d N O È È i d N 6 d O 6 È o d N o ç 6 9 d N o ç 6 € È € O U U H U U U U U U U U U U U U U o E o @ r o L o ! E o t o ! ç a I o r O ! e r O o E o € r O o G ! o I r o o o o G o € L o c \ 6 0 ! F ç Ê o È r u N à E Ë 9 ! Ê = o o t o 9 g F
3 4
-des concentrations de méta'l provenant -des fractions prêcédentes €t,
êgale-m e n t , d e s d i l u t i o n s p a r I ' e a u r e t e n u e d a n s le s s é d i êgale-m e n t s . E n e f f e t , l e s s é d i m e n t s c o n s e r v e n t , s u i t e à u n e c e n t r i f u g a t i o n d e 1 5 r n i n u t e s à 1 2 0 6 2 g , u n p o i d s t o t a l 1 0 f o i s s u p é r i e u r a u p o i d s s e c d u s é d i m e n t , d û à l ' e a u retenue. Cette solution contient des concentrations de métaux qui peuvent a m e n e r u n e s u r e s t i m a t i o n d e s c o n c e n t r a t i o n s rê e l l e s d a n s l ' e x t r a i t s u b s é -q u e n t .
La gafirne de concentrations de Zn aiouté lors des expériences est
g r a n d e , c o u v r a n t q u a t r e o r d r e s d e g r a n d e u r ; p o u r c e t t e r a i s o n , l a r é p a r t i -t i o n d u z i n c e n -t r e l e s f r a c -t i o n s F l , F 2 , F 3 A , F 3 B e -t F 4 e s -t p r é s e n -t é e d a n s t r o i s g r a p h i q u e s ( f i g u r e s 3 . ? à 3 . 4 ) p o u r l e s e x p é r i e n c e s E l à E 1 6 . L a f i g u r e 3 . 2 m o n t r e q u e [ z n ( r a ) ] d e m e u r e à p e u p r è s à s a c o n c e n t r a t i o n i n i t i a l e d a n s le s é d i m e n t ; le z i n c a j o u t é n e s e m b l e d o n c p a s s e f i x e r d a n s l a f r a c t i o n F 4 , m a i s p l u t ô t s e r é p a r t i r e n t r e l e s f r a c t i o n s F l . , F 2 , F 3 A e t F 3 8 . D ' a p r è s le s f i g u r e s 3 . 2 à 3 . 4 , l e s c o u r b e s d e [ Z n ( F l ) ] , I Z n ( F 2 ) ] , [ Z n ( F 3 A ) ] , [ Z n ( F 3 B ) ] e n f o n c t i o n d e Z n , a i o u t é r e s s e m b l e n t à d e s i s o t h e r m e s d ' a d s o r p t i o n ; e l l e s p r é s e n t e n t u n e a u g m e n t a t i o n l i n é a i r e a u x f a i b l e s c o n c e n -t r a -t i o n s d e Z n , a i o u -t é , a i n s i q u ' u n e -te n d a n c e à l a s a t u r a t i o n à d e s c o n c e n -t r a -t i o n s d e Z n , a j o u -t é p l u s g r a n d e s .
La répartition du 7n dans le sédiment naturel est dominée par [ Z n ( F 3 B ) ] , s u i v i e d e [ Z n { F 4 ) ] , [ Z n ( F 1 ) ] , L z n F Z ) l e t [ Z n ( F 3 A ) ] ( o r d o n n é e s à l a f i g u r e 3 . 4 ) . I l s u f f i t c e p e n d a n t d e p e u d e Z n , a j o u t ê ( - 3 x L 0 - 6 U ) p o u r q u e [Zn(Fl)] devienne plus importante que les autres fractions. Aux c o n c e n t r a t i o n s d e z i n c a j o u t é s u p é r i e u r e s à 3 x 1 0 - 5 M , l a f r a c t i o n [ Z n ( F Z ) ] a s s o c i e p l u s d e z i n c q u e l e s f r a c t i o n s ( F 3 A ) , ( F 3 B ) e t ( F 4 ) . P a r a i l l e u r s , [ Z n ( F 3 B ) ] d e m e u r e p l u s g r a n d e q u e [ Z n ( F 3 A ) ] p o u r d e s c o n c e n t r a t i o n s d e Z n t a j o u t ê p l u s p e t i t e s q u e ! , 2 5 x L 0 - 3 M ; p o u r l e s v a l e u r s p l u s ê l e v é e s , [ z n ( F 3 A ) J s u r p a s s e l ê g è r e m e n t [ Z n ( F 3 B ) ] .
^ arl Y ( t ) l E | ( ' c . o .Ê P () E o rÈ Ë (u P c (lJ .F ! r(l, vl - E J _ J s r L' 1l-x q r r { g - J h . O = € ô V z , < -oô r! v L L ,tt' ci-r 'trl tr' il F- a-f i i . " / - \ v = ( l ) ct) ? , Â c .:.9 F . p t ( J _ r c 1 o 3 ' - . N È , o = t_t _r(l) x 3 t t r t . u 6 O ro io, .F ( J _ O ' 6 (, +) U ) a tE j5 t t ( J L g N N ( 1 , ( t , ç E o . h E E o o . P . J .tt Gt T L { J P c Ê o ( u ( J T ' E ç o o c ) u (\J (Y) lrl É (J L! (\l I o x |f, 3 5
-I
lr,;
3
1 g r r-I -I
i !
l
l
I i
i l
l i
i I
! l
i :
l l
l t
I i
i L
\ i
i t
\ !
i r \ tr \ \ (\l ll. tr \ ; II
II
I I II
tI
II
I I tr, g lrj rO lr, (\, lr, t! wo -
o .
I o î |r! ci rf I I x qt I o ; |rt( les lueu,rpps
ôz groru )
a^ (u E g o . F {J (J c o lF c (l, +, r l c . - ( u a F : o - = E I rq, N . h 5 ! <f LL â ( n |! J . : \ < o o ô È lrJ t! ur J -rtu