THÈSE DE DOCTORAT
Présentée par
ABBAS Younes
Discipline : Biologie
Spécialité : Ecophysiologie végétale
Soutenue le 27 décembre 2014
Devant le jury :
Président :
Mr. EL Houssine ZAÏD : Professeur- Faculté des Sciences - Rabat Examinateurs :
Mr. Moustapha ARAHOU : Professeur - Faculté des Sciences -Rabat
Mr. Jamal AURAG : Professeur - Faculté des Sciences -Rabat
Mr. Atmane ROCHDI : Professeur - Faculté des Sciences - Kenitra
Mr. Mohamed ABOUROUH : Docteur-chercheur au Centre de Recherche
Forestière - Rabat
Mr. Salaheddine BAKKALI YAKHLEF :
Docteur, Chef de Division de l’Enseignement
Supérieur et de la R&D, Direction de l'Enseignement, de la Formation et de la Recherche - Rabat.
Microorganismes de la rhizosphère des Tétraclinaies :
un outil
pour optimiser la régénération assistée du Tetraclinis articulata
Vahl. Master
FACULTÉ DES SCIENCES
Rabat
D
édicaces
A mes défunts parents. Que Dieu leur accorde sa Pleine Miséricorde.
A ma très chère femme Jamila qui a su supporter mes soucis et mon absence,
qu’elle trouve dans ce travail toute ma reconnaissance et tout mon amour.
A mon adorable fille Rania
A ma très chère sœur Samira, son défunt mari Abdelkader, ses enfants (Rabab et
Omar)
A mes frères (Tarik, Abdelkader, Jamal et Abdelmajid)
A mes beaux parents
Avant-propos
Le travail présenté dans ce mémoire a été réalisé au laboratoire de Botanique, Mycologie et Environnement de la Faculté des Sciences de Rabat et au Centre de Recherche Forestière de Rabat, Service de Sylviculture, Unité des Symbioses Racinaires. Il a fait l’objet de plusieurs coopérations bilatérales maroco-française et maroco-espagnole (PRAD 03/14, PRAD 06/05, JEA-IRD et Projet CSIC).
C’est avec un réel plaisir que j’exprime mes très vifs remerciements à tous ceux qui, de près ou de loin, m’ont accordé leur soutien.
Je remercie vivement, Monsieur le Président de l’Université Mohamed V et Monsieur le Doyen de la Faculté des Sciences de Rabat.
Je remercie Monsieur ARAHOU Moustapha, Professeur à la Faculté des Sciences de Rabat, de m’avoir encadré, supporté et soutenu tout au long de ce travail.
Je remercie Monsieur ABOUROUH Mohamed, Ingénieur en Chef et Docteur-chercheur au Centre de Recherche Forestière de Rabat, pour avoir co-dirigé ce travail, pour ses remarques pertinentes, ses orientations et sa patience qu’il a manifestée à mon égard durant cette thèse, ainsi que ses suggestions à améliorer la qualité de ce mémoire, je lui en suis très reconnaissant.
Je remercie Monsieur ZAÏD El Houssine, Professeur à la Faculté des Sciences de Rabat, qui a accepté mon inscription dans son UFR et m’a fait l’honneur d’assurer la présidence de ce jury de thèse.
Je remercie également, Monsieur AURAG Jamal, Professeur à la Faculté des Sciences de Rabat, d’avoir accepté de rapporter et examiner mon travail de thèse et de faire partie de ce jury.
J’exprime mes remerciements et ma gratitude à Monsieur ROCHDI Atmane, Professeur à la Faculté des sciences de Kénitra, d’être rapporteur de cette thèse et pour l’honneur qu’il m’a fait en examinant ce travail.
J’adresse mes remerciements sincères à Monsieur BAKKALI YAKHLEF Salah
Rabat, tout d’abord parce qu’il a accepté de faire partie de ce jury et pour sa grande disponibilité et et son soutien à réaliser plusieurs travaux de recherche en communs au niveau du Centre de Recherche Forestière. Son aide technique en biologie moléculaire m’a été très précieuse. Qu’il trouve dans l’aboutissement de ce travail, toute ma profonde reconnaissance.
Je remercie également, Monsieur Robin DUPONNOIS, Directeur de Recherche à l’IRD, qui malgré ses voyages, ses mutations et ses responsabilités a su tenir notre collaboration, je ne peux pas oublier ses remarques pertinentes. Qu’il me soit permis de lui exprimer ma respectueuse gratitude et ma profonde reconnaissance pour ses aides et ses encouragements.
Mes sincères remerciements vont à Messieurs DREYFUS Bernard, Directeur Général Délégué à la Science de l’IRD et BAREA José Miguel, Directeur du Laboratoire des Symbioses Raçinaires à la Station Expérimentale Del Zaidin à Granada (Espagne), de m’avoir accueilli dans leurs équipes de recherche et de m’avoir facilité le contact et l’échange scientifique entre chercheurs du pourtour méditerranéen.
Je tiens à remercier et à témoigner toute ma reconnaissance à Madame AZCON
Rosario, Professeur à la Station Expérimentale Del Zaidin à Granada (Espagne), pour
l’expérience enrichissante et pleine d’intérêt qu’elle m’a fait vivre durant mes séjours à Granada (Espagne), pour son accueil et la confiance qu’elle m’a accordée dès mon premier jour au sein de son unité de recherche. Egalement, tous mes remerciements à l’équipe du Département de Microbiologie du Sol et Systèmes Symbiotiques de la Station Expérimentale Del Zaïdin à Granada.
Mes plus sincères remerciements vont à Messieurs KERDOUH Benaïssa et
KHRAOUCH Aziz, pour leur générosité, leur aide au laboratoire et sur le terrain.
Je tiens à exprimer toute mon amitié à toutes les personnes que j’ai côtoyées durant mon séjour au Laboratoire des Symbioses Tropicales et Méditerranéennes de Baillarguet à Montpellier (France) et durant la réalisation de ce travail. L’ambiance qu’on a su créer ensemble durant les périodes de mes missions était agréable et enrichissante.
Je ne pourrais pas finir ces remerciements sans penser aux collègues, au personnel et aux chauffeurs du CRF : EL ANTRY-TAZI Salwa, AAFI Abderrahmane, AOUJDAD Jalila, OUAJDI Mohamed, GHANEMI Mohamed, EL BAYED Ghizlane, DOUKKALI Ouafae, EL BAHI Samira, SATRANI Badr, SAAD Hanane et BOULMANE Mohamed, BOUNIMI Zhor, MAAZOUZ Naïma, …
FICHE PRESENTATIVE DE THESE
Nom et Prénom de l’auteur : Younes ABBAS
Intitulé du Travail : Microorganismes de la rhizosphère des Tetraclinaies: un outil pour
optimiser la régénération assistée du Tetraclinis articulata Vahl. Master
Nom et Prénom du Directeur des travaux de recherche :
ARAHOU Moustapha : Professeur de l’Enseignement Supérieur: Laboratoire de
Botanique, Mycologie et Environnement, Faculté des Sciences de Rabat, Maroc.
Laboratoires où les travaux ont été réalisés :
- Laboratoire de Botanique, Mycologie et Environnement, Département de Biologie,
Faculté des Sciences de Rabat, Maroc.
- Laboratoire du Centre de Recherche Forestière de Rabat, Service de Sylviculture et
Santé des Forêts, Unité des Symbioses Racinaires, Maroc.
- Laboratoire des Symbioses Tropicales et Méditerranéennes (LSTM), Campus de
Baillairguet Montpellier France.
- Département de Microbiologie du Sol et Systèmes Symbiotiques à la Station
Expérimentale del Zaidín (CSIC), Granada, Espagne.
Cadres de coopération-soutien financier :
- Projets de Recherche Agronomique pour le Développement : PRAD 03/14 et 05/06 - Projets issus de la collaboration CNRST (Maroc)/CSIC (Espagne)
- Projet Jeune Equipe Associée à l’IRD.
Publications et communications : I. Chapitre dans l’ouvrage
Bakkali Yakhlef S., Abbas Y., Abourouh M. 2013. La symbiose mycorhizienne des écosystèmes forestiers marocains : diversité naturelle et perspectives d’application. Dans : Des champignons symbiotiques contre la désertification des écosystèmes méditerranéens, tropicaux et insulaires. Editions IRD, ISBN : 978-2-7099-1827-5. pp. 351-390.
II. Publications
Abbas Y., Bakkali Yakhlef S.E., Prin Y., Arahou M., Duponnois R. et Abourouh M.,
2013 Growth and nutrition of Tetraclinis articulata (Vahl) Masters cultivated in different rhizosphere soils collected from Tetraclinis stand. Biotechnol. Agron. Soc. Environ. 17(1) :
3-11.
Abbas Y., Arahou M., Duponnois R. et M. Abourouh, 2013. Effet des mycorhizes à
arbuscules sur la croissance et la nutrition de trois provenances de Tetraclinis articulata (Vahl) Masters. Annales de la Recherche Forestière au Maroc, Tome 42 : 7-16.
K. Benabdellaha, Y. Abbas, M. Abourouh, R. Aroca, R. Azcón, 2011. Influence of two bacterial strains isolated from semi-arid zone and their interaction with native arbuscular mycorrhizae on the growth of Trifolium repens under drought conditions: Mechanisms related to bacterial effectiveness. European Journal of Soil Biology, 47: 303-309.
Bakkali Yakhlef S.E., Abbas Y., Prin Y., Abourouh M., Perrineau M. and Duponnois R., 2011. Effective AMF population in roots of Tetraclinis articulata and Lavandula multifida in Moroccan Tetraclinis woodlands. Mycology, 2 (2) : 79-86.
Abbas Y. 2009. Régénération artificielle du thuya : Intérêt des Mycorhizes à arbuscules
des tetraclinaies marocaines dans la ré-implantation du thuya. Revue d’Activité du Centre de
Recherche Forestière, 2007-2008 : 10-11.
Abbas Y., Ducousso M., Abourouh M., Azcon R. and Duponnois R. (2006). Diversity
of arbuscular mycorrhizal fungi in Tetraclinis articulata (Vahl) Masters woodlands in Morocco. Annals of Forest Science, 63 : 285- 291.
III. Communications
Abbas Y., Bakkali Yakhlef S.E., Arahou M., Azcon R., Duponnois R. et Abourouh M.,
2014. Practical applications of AM on Tetraclinis production and reforestation in Morocco.
16th congress of the AABNF & 4th International Conference of the AMM à Rabat du 02 au 07 Novembre 2014.
Bakkali Yakhlef S., Abbas Y., Abourouh M., Hafidi M. et Duponnois R., 2009. Diversité phénotypique et moléculaire des champignons mycorhiziens de l’association
Quercus ilex-Tetraclinis articulata. Conférence Internationale sur la Biotechnologie microbienne au service du developpement (MICROBIOD), Marrakech du 02 au 05 Novembre 2009.
Bakkali Yakhlef S.E., Abbas Y., Chakir S., Abourouh M., et Duponnois R. 2008. Analyse de la diversité génétique des champignons mycorhiziens arbusculaires dans l’écosystème à thuya. Vème Journées Nationales de Biodiversité « Biodiversité au service du développement durable ». 18 au 20 décembre 2008, Fès, Maroc.
Abbas Y., Bakkali Yakhlef S., Duponnois R. et Abourouh M., 2007. Biodiversité des
microorganismes symbiotiques de deux écosystèmes forestiers. Actes de la Conférence
Internationale sur les Biotechnologies Microbiennes et leurs Applications à Meknès les 24 et 25 Octobre 2007.
Abbas Y., Abourouh M., Bakkali Yakhlef S., Ducousso M., Arahou M., Azcon C.,
Hafidi M. and Duponnois R., 2006. Necessity to manage mycorrhizae in tetraclinis woodland ecosystems. ICOM 5, Granada-Espagne du 23 au 27 Juillet 2006.
RESUME
Le statut mycorhizien du thuya [Tetraclinis articulata (Vahl) Masters] a été étudié dans sept tetraclinaies marocaines. Les examens microscopiques de ses racines ont révélé la présence des champignons mycorhiziens arbusculaires (CMA), des taux de colonisation élevés (plus de 80 %) et des structures de type Paris″. Les spores isolées sont dominées par le genre Glomus. L’analyse par PCR, nichée du gène du Large sous Unité Ribosomique (LSU), a montré que les racines du thuya hébergent au moins sept phylotypes distincts appartenant au genre Glomus, Scutellospora et Gigaspora. Des tests de sélection, de préparation des inocula autochtones (champignons et bactéries) et d’inoculation ont été réalisés au laboratoire et en pépinière. Ensuite, des essais de réimplantation des plants de thuya inoculés ont été effectués à Khémisset et Ben Slimane. Ces opérations ont montré un effet significatif de l’inoculation par les CMA et/ou les bactéries sur la croissance des plants et sur leur taux de mortalité (réduction de 50 %). Parallèlement, d’autres expérimentations ont montré que le Potentiel Infectieux Mycorhizien (PIM) des sols des tétraclinaies peut être amélioré par la gestion d’espèces arbustives existantes au niveau de ces écosystèmes. En effet, les quatre espèces cibles choisies dans cette étude (Withania frutescens, Lavandula multifida, Pistacia atlantica et Olea oleaster) ont montré qu’elles peuvent être considérées comme espèces facilitatrices pour le thuya, en particulier la lavande.
Cette étude montre que la symbiose mycorhizienne constitue un élément clé dans la réussite des programmes de régénération du thuya. Mais, il est important de distinguer entre la spécificité des CMA et des bactéries associées en infectivité et en efficience. L’ioculation contrôlée repose sur le choix des souches (mycorhiziennes et/ou bactériennes) performantes et compétitives vis-à-vis de la microflore native du site à régénérer.
Mots-clés : Tetraclinis articulata (Vahl) Masters, tétraclinaies, champignons mycorhiziens à
arbuscules, diversité, Potentiel Infectieux Mycorhizien, analyses moléculaires, inoculation, croissance, nutrition.
ABSTRACT
Mycorrhizal statut of T. articulata (Vahl) Masters was studied in seven Tetraclinis woodlands. Root microscopic analysis revealed only Arbuscular Mycorrhiza Fungi (AMF). The rates of mycorrhizal colonisation were high (more than 80 %). A "Paris-type" mycorrhizal structure was noted and spores isolated were dominated by Glomus genus. Molecular analysis of the Large Sub-Unit (LSU) Ribosomal RNA gene amplified, by nested PCR, showed at least seven separate phylotypes in T. articulata roots belonged to Glomus,
Scutellospora and Gigaspora genus. Selection tests, preparation of indigenous inocula (fungi
and bacteria) and inoculation were performed in the laboratory and in the nursery. Then, two trial plantations with inoculated seedlings were performed in Khémisset and Ben Slimane. These experiments showed a significant effect of inoculation by AMF and/or indigenous bacteria on the growth of the seedlings and their mortality (50 % reduction). Meanwhile, other experiments have shown that Mycorrhizal Inoculum Potential (MIP) of soils can be improved by management of shrub species existing in Tetraclinis ecosystems. Indeed, the four target species chosen in this study (Withania frutescens, Lavandula multifida, Pistacia atlantica and
Olea oleaster) showed that they can be considered as facilitators plants for Tetraclinis,
especially lavender.
Our research showed that the symbiotic mycorrhizal fungi are a key element for T.
articulata establishment. But, it is important to distinguish between the infectivity and
effectiveness of AM fungi and associated bacteria. Controlled inoculation is based on the efficient and competitive strains (mycorrhizal and/or bacterial).
Key-words: Tetraclinis articulata (Vahl) Masters, Tetraclinis woodlands, Arbuscular Mycorrhizal
Fungi (AMF), Diversity, Indigenous Mycorrhizal Potential, Molecular analysis, Inoculation, Growth, Nutrition.
TABLE DES MATIERES
DEDICACES ... i
AVANT-PROPOS ... ii
FICHE PRESENTATIVE DE THESE ... iv
RESUME ... vii
ABSTRACT ... viii
TABLE DES MATIERES ... ix
LISTE DES FIGURES ...xiv
LISTE DES TABLEAUX ... xv
LISTE DES PHOTOGRAPHIES ...xvi
ABREVIATIONS ... xvii
LISTE DES ANNEXES ... xviii
INTRODUCTION ...1
SYNTHESE BIBLIOGRAPHIQUE ...6
I. Thuya au Maroc ...7
I.1. Généralités ...7
I.2. Classification ...7
I.3. Aire naturelle ...8
I.4. Ecologie ...8
I.5. Biologie ...9
I.6. Biomasse et productivité ... 10
I.7. Végétation associée au thuya ... 10
I.8. Régénération du thuya et conduite des peuplements ... 11
I.9. Problématique de la régénération des essences forestières ... 12
II. Symbioses mycorhiziennes ... 13
II.1. Définition des mycorhizes ... 13
II.2. Types de mycorhizes ... 14
III. Mycorhizes à arbuscules (MA) ... 15
III.1. Historique et systématique ... 15
III.2. Taxonomie actuelle ... 16
V. Processus d’infection par les champignons mycorhiziens à arbuscules ... 20
VI. Importance des mycorhizes à arbuscules ... 22
VI.1. Nutrition phosphatée : ... 22
VI.2. Nutrition azotée ... 23
VI.3. Absorption des autres éléments minéraux ... 23
VI.4. Résistance aux stress biotiques et abiotiques ... 23
VI.5. Amélioration de la qualité du sol ... 24
VII. Facteurs limitant la mycorhization ... 25
VIII. Mycorhizes naturelles du thuya et de quelques espèces de la strate arbustive ... 25
VIII.1. Mycorhization naturelle du thuya ... 25
VIII.2. Les CMA et la strate arbustive : effet "Plantes nurses" ... 26
IX. Influence de la strate arbustive sur le processus de revégétation ... 27
X. Potentiel mycorhizogène du sol... 28
XI. Etude de la diversité des CMA... 29
XI.1. Analyses sporales et description morpho-anatomique... 29
XI.2. Caractéristiques générales du génome des CMA ... 31
XI.3. Outils moléculaires utilisés dans l'étude de la diversité des CMA ... 32
XI.4. Difficultés de caractérisation des CMA dans les racines des plantes ... 33
XII. Mycorhization contrôlée des essences forestières ... 34
XII.1. Sélection des CMA ... 34
XII.2. Isolement des spores de CMA... 34
XII.3. Production de l’inoculum... 35
XII.4. Inoculation du matériel végétal ... 36
XIII. Interactions des CMA avec les autres groupes microbiens du sol... 37
XIV. Rôle des PGPR en cas de stress abiotiques ... 38
MATERIEL ET METHODES ... 39
I. Statut mycorhizien du thuya ... 40
I.1. Sites d’étude et analyses pédologiques ... 40
I.1.1. Sites d’étude ... 40
I.1.2. Analyses physico-chimiques des sols étudiés ... 41
I.2. Echantillonnage et extraction des spores de CMA ... 41
I.2.1. Echantillonnage sol/plante ... 41
I.1.2. Extraction des spores de CMA ... 42
I.3. Description morpho-anatomique des spores rencontrées ... 43
I.4. Abondance relative ... 43
I.5. Quantification de la mycorhization ... 43
I.6. Identification des spores de CMA ... 44
1.6.1. Identification moléculaire des spores de CMA isolés de la rhizosphère du thuya 45 I.6.2. Identification des CMA en association avec les racines du thuya ... 46
a. Extraction de l’ADN ... 46
b. Amplification du Large Sous Unité (LSU) d’ADN ribosomique par PCR nichée ... 46
c. Construction d’une banque d’inserts de l’ADNr (LSU) des CMA ... 47
d. Polymorphisme de Longueur des Fragments de Restriction (RFLP) ... 47
e. Séquençage ... 47
f. Analyse phylogénétique ... 47
II. Isolement des rhizobactéries ... 48
III. Tests de sélection des microorganismes rhizosphériques du thuya ... 48
III.1. Cas des CMA ... 49
III.2. Cas des bactéries ... 49
IV. Réponse du thuya à l’inoculation par les CMA ... 50
IV.1. Production de l’inoculum ... 50
IV.2. Production de plants de thuya ... 50
IV.3. Inoculation des plants ... 51
IV.4. Protocole expérimental ... 51
IV.5. Evaluation de la croissance et de la nutrition ... 51
V. Evaluation et effet comparatif du potentiel mycorhizien naturel de quelques espèces végétales associées au thuya. ... 52
V.1. Echantillonnage sol/plante... 52
V.2. Potentiel mycorhizien des sols : Méthode du Nombre le Plus Probable... 52
V.3. Evaluation de la mycorhization des différentes espèces associées au thuya ... 53
V.4. Croissance et nutrition des plantules de thuya... 53
VI. Essais sur le terrain ... 54
VII. Analyses statistiques ... 55
RESULTATS ET DISCUSSIONS ... 56
PARTIE I. DIVERSITEDESMICROORGANISMESSYMBIOTIQUESDES TETRALINAIES ... 57
I. Introduction ... 57
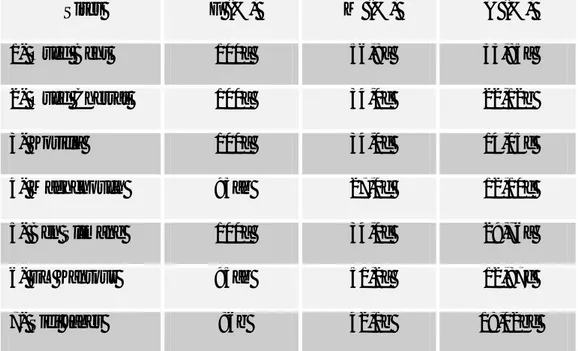
II. Caractérisation des sites d’étude ... 57
II.1. Caractéristiques physico-chimiques ... 57
II.2. Couvert végétal au niveau des tétraclinaies étudiées ... 58
III. Associations symbiotiques chez le thuya à l’état naturel... 59
III.1. Statut mycorhizien et Organisation cytologique... 59
III.2. Quantification de l’association mycorhizienne ... 60
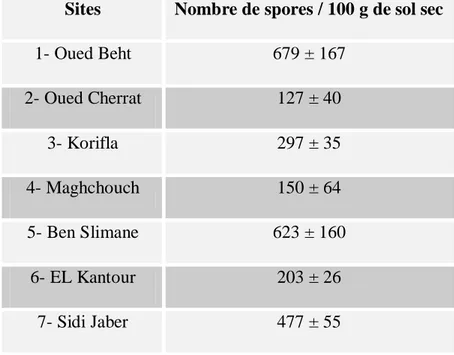
III.3. Isolement et identification des spores de CMA ... 60
III.3.1. Abondance relative ... 60
III.4. Description morpho-anatomique des spores de CMA rencontrées au niveau des
tétraclinaies ... 62
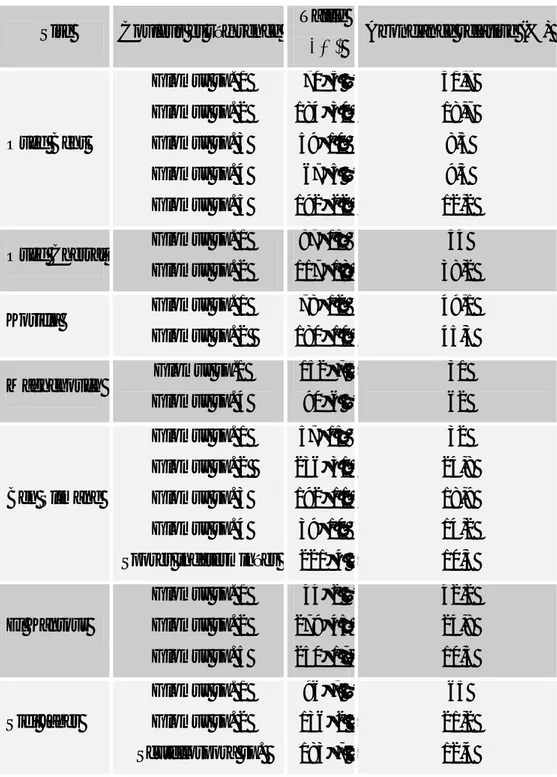
III.5. Diversité et abondance des communautés de spores de CMA au niveau des tétraclinaies étudiées ... 65
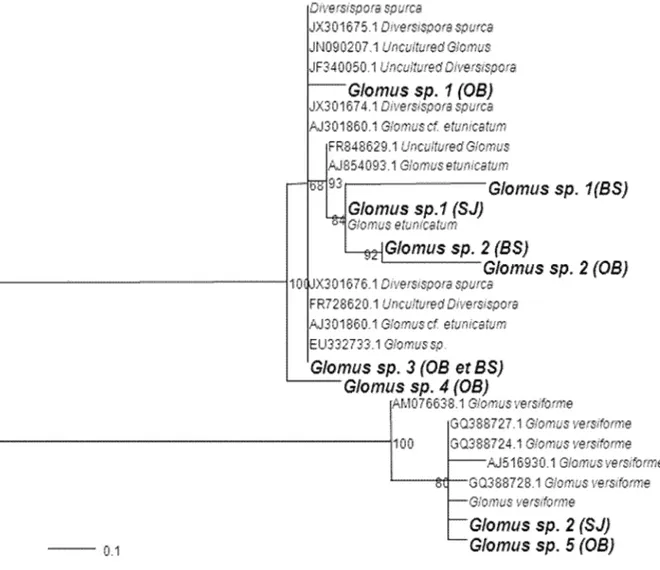
III.6. Identification moléculaire des CMA du thuya ... 66
III.7. Caractéristaion et dénombrement des rhizobactéries ... 68
III.7.1. Diversité phénotypique des bactéries de la rhizosphère des deux sols étudiés ... 68
III.7.2. Dénombrement des populations de bactéries dans les deux sols étudiés ... 68
IV. Population de CMA dans l’association T. articulata/L. multifida ... 69
IV.1. PCR nichée et amplification de l’ADNr de la LSU des CMA ... 69
IV.2. RFLP et analyses phylogénétiques ... 70
IV.3. Préférence de l’hôte et impact de l’interaction des plantes sur la communauté des CMA ... 73
V. Discussion ... 75
Conclusion ... 80
PARTIE II. SELECTION DES MICROORGANISMES DE LA RHIZOSPHERE DES TETRACLINAIES ET LEUR IMPORTANCE DANS L’INOCULATION CONTROLEE DU THUYA ... 82
I. Introduction ... 82
II.Sélection des microorganismes rhizosphériques du thuya ... 82
II.1. Sélection des CMA... 82
II.2. Cas des bactéries ... 84
III. Effet des mycorhizes à arbuscules sur la croissance et la nutrition de trois provenances de thuya ... 86
III.1. Effet provenance des semences du thuya ... 86
III.2. Mycorhization contrôlée en pépinière ... 86
III.3. Croissance des plants ... 87
III.4. Nutrition ... 89
IV. Discussion ... 91
PARTIE III. EFFET DE QUELQUES PLANTES ARBUSTIVES DES TETRACLINAIES SUR LA CROISSANCE ET LA NUTRITION DU THUYA ... 95
I. Introduction ... 95
II. Statut mycorhizien des espèces arbustives associées au thuya ... 96
II.1. Mycorhization naturelle ... 96
II.2. Populations de spores de CMA ... 97
II.3. Potentiel Mycorhizogène du sol ... 98
II.4. Croissance et nutrition du thuya se développant dans le sol rhizosphèrique des espèces cibles ... 99
II.4.1. Quantification mycorhizienne ... 99
II.4.2. Croissance et nutrition des plantules de thuya ... 99
III. Discussion ... 100
PARTIE IV. EFFET DE LA MYCORHIZATION SUR LA REUSSITE DES OPERATIONS DE REBOISEMENT PAR LE THUYA ... 104
I. Introduction ... 104
II. Essais de réimplantation du thuya ... 104
II.1. Essai à Khémisset ... 104
II.2. Essais à Ben Slimane ... 105
II.2.1. Effet de l’inoculation contrôlée sur la croissance et la survie des plants ... 105
II.2.2. Effet de la lavande sur la croissance du thuya au champ ... 107
III. Discussion ... 108
CONCLUSION GENERALE ET RECOMMANDATIONS ... 111
REFERENCES BIBLIOGRAPHIQUES ... 116
LISTE DES FIGURES
Figure 1. Principaux types de mycorhizes représentés sur une coupe transversale de la
racine ... 14
Figure 2. Classification des CMA ... 17
Figure 3. Schéma de la structure d’une endomycorhize à arbuscules formée par une espèce du genre Glomus ... 19
Figure 4. Cycle de développement des champignons MA ... 20
Figure 5. Caractéristiques morphologiques des spores de CMA ... 31
Figure 6. Structures des gènes ribosomiques nucléaires des eucaryotes ... 33
Figure 7. Localisation des sites d’échantillonnage ... 40
Figure 8. Arbre phylogénétique basé sur le séquençage de 600 pb de l’ADNr 18S ... 67
Figure 9. Arbre phylogénique et maximum de vraisemblance des CMA colonisant les racines du thuya et de la lavande ... 72
Figure 10. Communautés de CMA retrouvées au niveau des racines du thuya et de la lavande ... 73
Figure 11. Analyse en composantes principales des communautés de CMA colonisant les racines de T. articulata et de L. multifida ... 74
Figure 12. Activités biochimiques des deux bactéries B1 et B2 mises en culture axénique additionné de 0, 15 ou 30 % du PEG ... 85
Figure 13. Effets de l’inoculation sur la croissance des plants de thuya ... 88
Figure 14. Effets de la mycorhization sur la nutrition des plants ... 90
Figure 15. Abondance des spores de CMA au niveau du sol hors couvert végétal et celui de la rhizosphère de T. articulata, L. multifida, P. atlantica, O. oleaster, W. frutescens ... 98
Figure 16. Hauteur et diamètre au collet des plants de thuya une année après plantation ... 105
Figure 17. Croissance aérienne des jeunes plants de thuya en fonction du temps ... 106
Figure 18. Hauteur et diamètre au collet du thuya inoculé ou non après 3 ans de plantation ... 106
LISTE DES TABLEAUX
Tableau I. Principaux familles et/ou genre d’arbres formant les mycorhizes à
arbuscules ... 18
Tableau II. Liste des échantillons étudiés ... 45
Tableau III. Caractéristiques physico-chimiques des sols étudiés ... 58
Tableau IV. Quantification des MA de T. articulata dans les différents sites étudiés ... 60
Tableau V. Abondance relative des spores des CMA au niveau des sites étudiés ... 61
Tableau VI. Diversité et abondance des spores de CMA au niveau des tétraclinaies ... 65
Tableau VII : caractérisation phénotypique des colonies bactériennes observées ... 68
Tableau VIII : dénombrement des colonies de bactéries ... 68
Tableau IX. Phylotypes, types de séquence et abondance des clones de types RFLP obtenus à partir de la banque d’ADN de chaque type de racine ... 71
Tableau X. Effet des différents isolats du genre Glomus sur la mycorhization du trèfle ... 83
Tableau XI. Infectivité des différents inocula ... 87
Tableau XII. Evaluation des paramètres de la mycorhization naturelle des différentes plantes cibles ... 96
Tableau XIII. Estimation des Potentiels Mycorhizogènes Indigènes des sols par la méthode du nombre le plus probable (MPN) ... 98
Tableau XIV. Quantification de l’extension mycorhizienne du thuya en culture sur des substrats rhizosphériques des différentes plantes cibles et sur le sol nu ... 99
Tableau XV. Evaluation de la croissance et de la nutrition et des jeunes plants de thuya se développant pendant 9 mois sur les sols rhizosphériques des différentes plantes cibles et sur sol nu ... 100
LISTE DES PHOTOGRAPHIES
Photo 1. Feuilles et cônes de Tetraclinis articulata ... 9
Photo 2. Echantillonnage sol/racines ... 42
Photo 3. Production d’inoculum de CMA sur Plectranthus australis ... 50
Photo 4. Exemple de sites d’étude (Tetraclinaie de Ben Slimane) ... 59
Photos 5. A et B- Colonisation raçinaire du thuya par les CMA (x 10) ; C- Hyphe colloïdale de CMA à l’intérieure des cellules racinaires du thuya (x 100) ... 59
Photo 6. A et B : morphotype 1, C : morphotype 2, D : morphotype 3, E : morphotype 4, F : morphotype 5, G : morphotype 6, H : morphotype 7 ... 64
Photo 7. Electrophorèse de l’ADN des CMA analysés ... 66
Photo 8. Electrophorèse des produits d’amplification de la PCR nichée réalisée sur l’ADN des CMA colonisant les racines de Thuya et de la Lavande ... 69
Photo 9. Electrophorèse du produit PCR de l’amplification, par M13F et M13R, de l’insert des différents clones (L :1-5, Lt : 6-10, T : 11-15, Tl : 16-20, M : 100 pb Leader) ... 70
Photo 10. Electrophorèse du produit de digestion, par AluI (A) et HinfI (B), de l’insert (M : 100 pb Ladder, L : 2, Lt : 6, T : 7, Tl : 10) ... 70
Photo 11. Inoculation du trèfle par l’isolat Glomus sp.1 ... 83
Photo 12. Exemple de colonisation racinaire de T. articulata par les CMA (grossissement 40x) ... 86
Photo 13. Comparaison entre la croissance du thuya non mycorhizé et celui inoculé par Glomus sp. d’Oued Beht et Ben Slimane ... 88
Photo 14. Exemple de diversité sporale des CMA isolés à partir des sols de tétraclinaie. ... 97
ABREVIATIONS
ACP : Analyse en composantes principales
ADN : Acide désoxyribonuclèique
APX: Ascorbate peroxidase
ARN: Acide ribonuclèique
ARNr : Acide ribonuclèique ribosomique
BSA: Bovine serum albumine
CAT: Catalase
CMA : Champignons Mycorhiziens Arbusculaires
dNTP : Désoxynucléoside 5’ triphosphate
EDTA : Ethylène diamine tétra acetate
GEE : Glycerol – Ethanol – Eau distillée
IAA: Indol Acétique Acide
LSU : Large sous unité
MA : Mycorhizes à Arbuscules
MPN : Most Probable Number
N: Azote
P: Phosphore
PEG : Polyéthylèneglycol
Pfa: Poids frais aérien
Pfr: Poids frais racinaires
PGPR : Plant Growth Promiting Rhizaobacteria
PIM Potentiel Infectieux Mycorhizien
PVLG : Polyvenyl-lacto-glycerine
RFLP : Restriction Fragment Lenght Polymorphism
SDS : Sodium dodécyl sulfate
SOD: Superoxide dismutase
TBE : Tris acide borique EDTA
Tr/mn : Tour par minute
LISTE DES ANNEXES
Annexe 1. Technique de calcul des paramètres de mycorhization ... 153
Annexe 2. Protocole d'extraction de l'ADN à l'aide du "Dnaeasy Plant Mini Kit" ... 154 Annexe 3. Réaction de Polymérisation en Chaîne (PCR) ... 155 Annexe 4. Extraction et purification des produits PCR par électrophorèse préparative à
l'aide du kit "QIAgen-gel extraction Kit". ... 156
Il est bien établi que le fonctionnement, la stabilité et la productivité des écosystèmes terrestres dépendent en grande partie de la richesse en espèces du cortège floristique, sa diversité et la structure de ses populations (Tilman et Downing, 1994). Cependant, l’installation et le développement de ces espèces au sein de l’écosystème dépendent des interactions qui se produisent entre celles-ci et de leur concurrence spatio-temporelle vis-à-vis des ressources limitées du sol. Les interactions avec les différents groupes d'organismes qui constituent la biocénose peuvent favoriser l'établissement de certaines espèces de plantes et/ou leur développement postérieur selon divers processus (Bever et al., 1997).
Actuellement, les conditions écologiques de la zone méditerranéenne deviennent de plus en plus sévères et se retentissent essentiellement sur la qualité des sols (structure, teneurs en micro- et macro-éléments, etc.) en entrainant une augmentation de l’érosion (Mace et Masundire, 2005). En conséquence, on assiste à court terme, à une disparition de nombreuses espèces épigées et une régression significative de l’activité et de la diversité des communautés microbiennes telluriques (Kennedy et Smith, 1995). Or, le fonctionnement d’un écosystème est fortement assujetti à l’évolution de ces communautés de microorganismes (Benthlenfalvay et Linderman, 1992). La dégradation du sol, à son tour, est principalement liée à la réduction de leur diversité et/ou du fonctionnement des cycles biogéochimiques majeurs (Requena et
al., 2001). Ces effets se traduisent par une raréfaction du couvert végétal et une diminution
des teneurs en matière organique et en nutriments des sols (Barea et Jeffries, 1995).
Parmi ces microorganismes figurent les champignons mycorhiziens qui sont présents dans la majorité des écosystèmes terrestres et associés à plus de 90 % des espèces végétales terrestres (Van der Hejden et al., 1998a). Ces microorganismes symbiotiques sont considérés comme un groupe microbien "clés" dans le fonctionnement des écosystèmes terrestres en particulier pour leur capacité à promouvoir le développement des plantes dans des milieux dégradés. Au sein de ce groupe de champignons existe un type de taille microscopique et à habitat commun de la majorité des sols, ce sont les champignons mycorhiziens arbusculaires (CMA). Ces entités fongiques établissent une symbiose mutualistique avec la majorité des plantes terrestres allant des Bryophytes jusqu’aux Angiospermes (Boullard, 1990 ; Demars et Broener, 1995) en leur permettant d’acquérir une surface d’absorption racinaire plus grande grâce à la prolifération de leurs hyphes. Les champignons mycorhiziens à leur tour reçoivent les carbohydrates issus de la photosynthèse de la plante, indispensables pour leurs processus métaboliques. C’est ainsi que ces champignons sont appelés "symbiotes obligatoires".
L’avantage de cette symbiose ne se limite pas aux deux partenaires, mais concerne aussi l’intégrité de l’écosystème puisqu'elle améliore la qualité du sol (Caravaca et al., 2002), la diversité et la productivité du couvert végétal (Van der Heijden et al., 1998b), ainsi que l'établissement d'autres microorganismes bénéfiques, comme les Rhizobactéries Promotrices de la Croissance des Plantes (PGPR) (Herrera et al., 1993 ; Barea et al., 2002 ; Marschner et Timonen, 2006 ; Saxena et al., 2006). En effet, grâce au développement de cette symbiose, il y a apparition de changements dans la quantité et la qualité des exsudats racinaires, ce qui se répercute sur la diversité des communautés microbiennes rizosphériques (Azcon-Aguilar et Barea, 1992 ; Barea, 1997 ; Gryndler, 2000 ; Marschner et al., 2001 ; Marschner et Baumann, 2003). Un autre groupe d'organismes qui interagit avec les CMA sont les bactéries solubilisatrices des phosphates. Cette interaction, fort intéressante, peut être due à l'exploration par les hyphes du champignon de micro-habitats où le phosphore n’est pas accessible (Azcon et al., 1976). D'autre part, il a été décelé occasionnellement des accroissements dans l'activité phosphatasique au niveau de la rhizosphère des racines mycorhizées (Tarafdar et Marschner, 1994), ce qui en partie, peut être attribué à l'accroissement de populations microbiennes avec cette activité (Dodd et al., 1987).
Au Maroc, malgré le paysage mosaïque de ses formations forestières, ses écosystèmes sont fortement dégradés suite aux aléas climatiques, comme la sécheresse, à l’expansion démographique des populations locales qui est couplée à des besoins accrus en terres cultivables, aux exploitations abusives de certaines essences forestières et au surpaturage. Cette situation s’observe dans les aires naturelles de plusieurs essences forestières, en particulier au niveau des tétraclinaies. Ces écosystèmes à base de thuya de Berbérie [Tetraclinis articulata (Vahl) Master] étaient considérés parmi les potentialités forestières autochtones les plus anciennes et constituaient la base résistante de l’armature boisée du Maroc en reliant entre elles les autres masses forestières. Ils apportaient aussi, aux populations locales qui les exploitaient, le tribut dominant de la richesse forestière du pays (Direction des Eaux et Forêts, 1931). Le thuya occupe en effet une place importante dans le patrimoine forestier national. Son importance écologique, socio-économique et culturelle n’est plus à démontrer, aussi bien sur le plan régional que national et international. Il est considéré comme l’une des essences les plus précieuses de l’Afrique du Nord et l’un des éléments les plus stables, les plus solides de sa végétation forestière (Boudy, 1950).
Diverses opérations de conservation de cette ressource ont été entreprises (création d’aires protégées, programme d’amélioration génétique, etc.) mais ces interventions restent négligeables devant l’ampleur de la dégradation. Depuis 1960, plusieurs programmes de reboisement ont été entrepris, mais le rythme annuel de plantations fixé par ces plans n'a jamais été atteint. La production des plants en pépinière constitue l’un des principaux maillons de la chaîne globale de reboisement, visant essentiellement à améliorer la production forestière. Cependant, l’absence de critères de sélection et d’évaluation des plants avant la plantation, obtenus par des techniques culturales classiques, constitue un frein et une source d’échec des plantations du thuya. Quand à sa régénération naturelle, les données fragmentaires (Metro et Sauvage, 1955) rapportent qu’elle se fait par voie de semis et par rejets de souche. Cependant, la régénération par semis n’est qu’une contribution occasionnelle et très rarement observée à nos jours ; l’irrégularité de cette voie tient à la nature du substratum, au climat difficile et surtout à l’influence du pâturage fort néfaste aux jeunes semis, dont la croissance est très lente dans les premières années (Boudy, 1950).
Au siècle dernier et plus précisement dans les années soixante, des essais de régénération artificielle du thuya par plantation effectués dans la région orientale ont donné des résultats prometteurs (Anonyme, 2002). Dans les années quatre vingt, les recherches sur le thuya ont été surtout focalisées sur les aspects phytoécologiques (Benabid, 1982 ; Fennane, 1987). L’adiministration forestière a consenti un effort en matière d’aménagement des tétraclinaies et ce dans la perspective de protection, de reconstitution et de valorisation de ces écosystèmes. Il a été remarqué cependant, que les opérations de régénération artificielle n’aboutissaient pas aux résultats escomptés. La réussite après transplantation des jeunes plants est faible voir même nulle dans certaines régions, comme c’est le cas de Fès-Boulemane et Tadla Azilal pendant la campagne 2011/2012 (HCEFLCD, 2013). Mais dans toutes ces actions, le rôle de la microflore tellurique et plus particulièrement celui des champignons mycorhiziens n’a jamais été pris en compte. Or, il est maintenant parfaitement établi que ces microorganismes interviennent significativement dans tous les stades de développement des espèces forestières (Smith et Read, 1997). Cet effet "mycorhizien" sur la croissance d’une espèce forestière peut être obtenu : (i) soit par l’introduction d’un symbiote fongique préalablement sélectionné pour sa capacité à stimuler la croissance de la plante-hôte dans des conditions environnementales données (Duponnois et al., 2005), (ii) soit par la gestion du Potentiel Infectieux Mycorhizogène (PIM) in situ (Duponnois et al., 2001). Cette seconde
fongiques indigènes présents dans le sol des sites de plantation. Le succès de cette technique repose sur l’utilisation de plantes (herbacées, arbustes) susceptibles de promouvoir rapidement la multiplication des champignons mycorhiziens dans le sol (plantes hautement mycotrophes) et de se développer en association avec les essences forestières cibles.
C’est pour la première fois qu’une étude sur les associations symbiotiques du thuya au Maroc est réalisée. L’amélioration de la qualité des plants de thuya produits en pépinière forestière et la gestion du PIM des sites à reboiser pourraient avoir des répercussions positives sur la régénération artificielle de cette essence avec des incidences positives sur la préservation des tetraclinaies, le développement économique et la protection de l’environnement.
Les objectifs de ce travail de recherche sont donc :
1. étudier le statut mycorhizien du thuya (Tetraclins articulata) ;
2. analyser la diversité morpho-anatomique et moléculaire des champignons mycorhiziens ;
3. évaluer le potentiel de la symbiose mycorhizienne sur le développement des plants de thuya en pépinière forestière et par suite sur le terrain de reboisement ; 4. étudier les espèces arbustives accompagnatrices du thuya dans son aire naturelle
quant à leur capacité d’héberger des microorganismes bénéfiques comme les CMA et les PGPR.
SYNTHESE
I. Thuya au Maroc I.1. Généralités
La famille des Cupressacées du Maroc était considérée comme la souche où se recrutent, d’un bout à l’autre du pays, les forces forestières autochtones les plus anciennes de la Berbérie (Direction des Eaux et Forêts, 1931). Le thuya ou Tetraclinis articulata (Vahl) Masters est une essence de cette famille qui couvre une superficie estimée à 565 798 ha (Benabid et Fennane, 1999), soit environ 6,2 % de la superficie totale des forêts marocaines. C’est une espèce résineuse qui constitue un élément important dans la végétation nord-africaine (Benabid, 1976) et qui est placée dans la catégorie des plantes vasculaires à multiples rôles tant pour la valeur que la diversité de ses produits (bois d’œuvre, bois de feu, goudron végétal, gomme sandaraque, tanin…). Les peuplements formés par le thuya, communément appelés tétraclinaies, sont aussi des espaces de vie rurale dans lesquels les populations assurent en permanence le pâturage pour leur bétail. Boudy en 1950 a signalé que ces écosystèmes connaissent dans tout le Maroc des reculs remarquables de leurs superficies et que cela est du essentiellement au surpâturage, aux incendies, à l’exploitation du bois et au gemmage. Le même auteur a suggéré que la reconstitution des peuplements de thuya pour la production par exemple du bois d’œuvre nécessite au moins deux siècles.
I.2. Classification Embranchement : Pinophyta Sous-Embranchement : Pinophytina Classe : Pinopsida Sous-Classe : Pinidae Ordre : Pinales Famille : Cupressaceae Genre : Tetraclinis
Espèce : Tetraclinis articulata (Vahl) Masters Nom vernaculaire : Thuya de Berbérie
Nom arabe: Arar Nom Amazigh: Azouka
I.3. Aire naturelle
Le thuya est une essence cantonnée essentiellement dans la portion méridionale du bassin méditerranéen occidental (Afrique du Nord) à l’exception de deux ilots : l’un au sud-est de l’Espagne (Almeria) et l’autre à l’île de Malte (Achhal, 1986). C’sud-est au Maroc que cette espèce individualise les peuplements les plus étendus et les plus diversifiés (Benabid, 1976, 1982, 1985 ; Fennane, 1982, 1988). Son aire de répartition s’étend en gros dans la partie orientale du pays, sur le Plateau Central, et dans le secteur de l’Arganier. Le tempérament plastique et la résistance du thuya lui permettent d’occuper une frange altitudinale comprise entre le bord de la mer et 1 000 m dans le Maroc septentrional voire 1 600 m dans le Maroc méridional (Benabid, 1982).
L’aire de répartition du thuya est subdivisée en six grandes zones : zone rifaine; zone du Maroc Oriental ; zone du Moyen Atlas Oriental ; zone des vallées du Plateau Central et la Meseta Occidentale ; zone du Moyen Atlas Occidental et Haut Atlas (zones subatlasiques, Nord Atlasiques, revers Sud du Haut Atlas, région d’Essaouira, Haut Atlas Occidental) et zone de l’Anti-Atlas (Direction des Eaux et Forêts et de la Conservation des Sols, 1994).
I.4. Ecologie
Le thuya, par sa rusticité, s’accommode aux climats très secs et aux sols les plus déshérités. Ses peuplements sont remarquablement liés aux variantes chaude et tempérée du thermo-méditerranéen semi-aride exceptionnellement subhumide inférieur ou aride (Benabid, 1985). En effet, le thuya peut se développer aussi dans le subhumide chaud, doux et tempéré sur sol filtrant, calcaire, sur une forte pente et sur des expositions sud et sud-est. En outre, il est retrouvé aussi dans l’aride supérieur sous un état mal venant largement dominé par des espèces plus xérophiles : Argania spinosa, Acacia gummifera et Stipa tenacissima.
Le thuya est donc réputé par ses caractères écologiques : thermophile, xérophile et rustique. Si les influences océaniques modérées favorisent le développement de cette espèce, le froid l’élimine surtout avec l’augmentation de l’humidité de l’air. Tetraclinis articulata est connu pour son indifférence à la nature chimique du substratum. Cependant, il préfère le calcaire, plus sec (Boudy, 1950) et il est éliminé des roches siliceuses par le chêne-liège, lorsqu’il s’agit de roches dures et résistantes, et par l’oléastre et le lentisque en cas de sols argileux (Rübel et Lüdi, 1939).
I.5. Biologie
Le thuya est un arbre monoïque, de 15-25 m de hauteur, au port d’abord pyramidal, élancé, puis au feuillage diffus et léger (Fennane et al., 1999). Son tronc est droit à rhytidome gris clair, puis devenant plus sombre, fendillé longitudinalement, à rameaux dressés et minces, composés de petites branches plates, vertes, articulées selon la disposition des feuilles. Le système raçinaire est profond mais pas trop ramifié.
Les feuilles sont en aiguilles bleutées, de 1-2 cm chez les jeunes plantes (Photo 1A). Elles vont ensuite, chez les plantes adultes, laisser la place aux feuilles en écailles, persistantes, opposées et plus ou moins verticillées par 4, enveloppant le rameau aplati inégal, 2 larges alternant 2 étroites.
Les fleurs mâles sont groupées à l’extrémité des rameaux courts. Les fleurs femelles sont localisées sur des rameaux latéraux. Les cônes plus ou moins globuleux, constitués de 4 écailles ligneuses, en 2 paires, en forme de cœur (Photo 1B) ; graine petite avec des poches de résine et 2 ailes latérales (Benabid, 2000).
Photo 1. Feuilles (A) et cônes (B) de Tetraclinis articulata (Source: hipernatural.com et oshba.net)
A B
0.5cm
I.6. Biomasse et productivité
T. articulata se caractérise par la diversité et la valeur de ses produits : bois d’œuvre, bois de service, bois de feu, loupe, gomme sandaraque, goudron végétal et tanin. Il produit un bois facile à scier et à trancher, peu dense, esthétique, prend un beau poli et s’apprête bien à l’assemblage et l’usinage. Le bois du thuya est recherché pour la marqueterie et la confection des objets décoratifs.
Au cours de série 1990-2002, les données sur l’évolution des coupes de thuya, traitée par année et par service forestier (HCEFLCD, 2003), ont montré une prédominance de bois de feu et une production faible de bois d'œuvre. Ceci a été expliqué par la nature des traitements sylvicoles adoptés (la plupart des forêts sont traitées en taillis simple à courte révolution).
L’Inventaire Forestier National (IFN) de 1999 a montré que le stock de bois de thuya sur pied dans les tétraclinaies s’élève à 5 409 764 m3 représentant 3,36 % du volume de la totalité de la forêt marocaine émanant d’une surface globale de 565 798 ha de thuya, soit un accroissement annuel au alentour de 0.24 m3/ha/an et un volume de 9,56 m3/ha.
Avec le développement de la marqueterie, l’approvisionnement en bois d’œuvre de thuya est devenu problématique vue l’offre trop limitée et vue l’état actuel des forêts de thuya. En effet, les activités humaines ont bâti autour de cette espèce une production artisanale qui a toujours contribué à l'amélioration du niveau de vie. La majorité des produits confectionnés en bois de thuya est classée comme produits de luxe, destinés à l’export, ce qui constitue un plus pour l’économie marocaine. L’ONUDI (2003) a rapporté que le secteur du bois de thuya représente 75 % de l’activité artisanale de la ville d’Essaouira, la ville la plus connue en ce qui concerne la fabrication d’objets divers à base de ce bois.
I.7. Végétation associée au thuya
La diversité floristique d’une région donnée est reflétée par le nombre d’espèces végétales qui y cohabitent. Au niveau des tétraclinaies marocaines, plusieurs associations végétales ont été décrites en détail dans les travaux phytoécologiques réalisés par Benabid (1976, 1982) et Fennane (1982). Ces associations sont développées en bioclimat subhumide inférieur dans le Maroc septentrional. Les autres, préforestières ou localement présteppiques, se trouvent dans le Maroc méridional (Benabid, 2000).
Le nombre relativement très élevé d’associations et de séries de végétation organisées par le thuya, illustre la grande diversité dans la structure et les cortèges floristiques de ces unités. Les tétraclinaies marocaines possèdent un fond d’espèces qui lui sont remarquablement fidèles, suivant les régions géographiques, et contribue au façonnement de leur paysages. Il s’agit en particulier de : Ceratonia siliqua, Pistacia lentiscus, P. atlantica,
Olea europea, Ebenus pinnata, Cistus villosus, Brachypodium ramosum, Viola arborescens, Jasminum fruticans, Clamatis cirrhosa, Genista tricuspidata, Lavandula multifida, L. dentata, etc. (Rübel et Lüdi, 1939 ; Benabid, 2000).
Les autres éléments floristiques jouant un rôle remarquable dans l’organisation des séries et des associations végétales, confèrent des particularités spéciales aux différentes régions à thuya. Selon Benabid (2000), il s’agit de :
i. Rosmarinus officinalis, R. tournefortii, Anthyllis cytisoides et de Genista retamoide au niveau de certaines associations du Maroc septentrional.
ii. Rhus pentaphylla, Rosmarinus tournefortii, Anthyllis cytisoides, Withania frutescens et
Coronilla viminalis qui apparaissent au niveau du Plateau Central.
iii. Olea maroccana, Argania spinosa, Acacia gummifera et de Lavandula dentata var.
candicans qui caractérisent les paysages à thuya dans le Haut Atlas et l’Anti-Atlas Occidental.
I.8. Régénération du thuya et conduite des peuplements
Le thuya est une espèce à croissance lente. La reconstitution de ses peuplements capables de fournir du bois d’œuvre de qualité nécessite une production de plants de qualité et une bonne gestion de ses superficies.
A l’état naturel, le thuya se régénère aisément si les conditions écologiques le permettent. Il rejette vigoureusement des souches lorsqu’il est coupé. C’est le seul conifère endémique marocain qui offre cette faculté de régénération (Benabid, 2000). Des jeunes semis de thuya sont encore observables dans les peuplements présentant des conditions favorables de sol et de climat et qui sont à l’abri de l’action perturbatrice de l’homme et de ses cheptels. Mais cette régénération naturelle reste très faible ou quasiment nulle dans plusieurs régions du Maroc.
En matière de conduite des peuplements, les actions entreprises sont très limitées, en raison d’absence de techniques confirmées par l’expérimentation. Parmi les forêts aménagées, le thuya n'a pas eu la place qu'il mérite dans le sens où ces forêts sont dans la plupart des cas, traitées en taillis simple à courte révolution, traitement qui privilégie la production de petits bois inaptes aux usages intéressants (HCEFLCD, 2003).
I.9. Problématique de la régénération des essences forestières
Au Maroc, les pratiques culturales de production des plants en pépinières, sont toujours classiques et invariantes, tandis que les exigences et les conditions du milieu naturel sont en perpétuels changements et nécessitent des efforts soutenus afin de combler les défaillances observées sur le terrain. La recherche de solutions pratiques, où seront conjuguées méthodes de cultures et qualité des plants, pourraient être un atout important pour la réussite des programmes de régénération artificielle des essences forestières. L’enjeu important pour notre pays est le reboisement artificiel qui se manifeste actuellement par un taux de réussite des fois n’atteignant pas les 20 % (M’Hirit et Benchekroun, 2006). Ceci peut être lié à plusieurs facteurs tels que le choix des semences, la non coordination des actions sur le terrain, un suivi insuffisant des périmètres replantés, l’absence de mise en défens efficace, la mauvaise qualité des plants au moment de la plantation (Abourouh, 1992 ; M’Hirit et Benchekroun, 2006). Or, un bon succès des reboisements est défini comme étant une survie élevée (supérieure à 85 %) associée avec une croissance rapide des plants (Russel, 1977).
Au moment de la plantation, la partie aérienne du jeune plant, qui aura des besoins importants en eau, est intimement dépendante de l’ancrage du système racinaire dans le sol. Pour cela, dans les normes de qualité des plants en pépinière, on insiste sur l’état des racines et leur niveau de mycorhization (Abourouh, 1992). En effet, les champignons symbiotiques font partie intégrante et fonctionnelles de ce système. De plus, la reprise et le comportement des plants introduits en forêts dépendent pour beaucoup des symbiotes mycorhiziens qui leur sont associés (Le Tacon et al., 1997). Le Tacon et collaborateurs (1992) signalent que la présence de mycorhizes permet de diminuer la crise de transplantation et peut éventuellement assurer une meilleure croissance après plantation. Des observations sur le terrain ont montré que les plants non mycorhizés introduits dans un milieu à faible fertilité (cas des sols forestiers) ont des difficultés à s’installer et peuvent mourir plus ou moins rapidement s’ils ne rencontrent pas rapidement des symbiotes mycorhiziens (Le Tacon et al., 1997).
II. Symbioses mycorhiziennes
Depuis leur extension dans l’écosystème terrestre, les plantes ont adopté des stratégies en relation avec leur pouvoir d’adaptation. Parmi celles-ci, les systèmes racinaires ont établi des relations mutualistiques, avec des microorganismes telluriques, désignées sous le nom de mycorhizes. Ces dernières sont apparues sur terre il y a environ 400 millions d’années (Simon
et al., 1993) et sont considérées comme étant à l’origine de la flore terrestre (Selosse et Le
Tacon, 1997). Ces relations symbiotiques sont caractérisées par un état d’équilibre physiologique permettant aux symbiotes impliqués, d’en retirer des bénéfices mutuels. Parmi ces interactions, les plus fréquentes sont celles qui intéressent plus de 90 % des plantes terrestres (Sanders et al., 1996) et qui font intervenir un groupe de champignons de la classe des Glomeromycètes : ce sont les Champignons Mycorhiziens à Arbuscules, connus depuis la fin du dix huitième siècle (Strullu, 1990). Ces champignons sont cosmopolites et colonisent la majorité des familles de plantes, depuis les Bryophytes jusqu’aux Angiospermes (Boullard, 1990 ; Demars et Broener, 1995) et particulièrement les plantes à valeurs économiques importantes. Ces microorganismes à haut niveau d’organisation dans cette association, déterminent les conditions de liaison dans lesquelles le champignon peut croître, se reproduire et évoluer (Morton, 1993). En effet, le champignon se nourrit des sucres et des acides aminés synthétisés par la plante-hôte et procure à cette dernière les éléments nécessaires à sa nutrition minérale en lui permettant une meilleure extension et absorption racinaire (Harley et Smith, 1983).
II.1. Définition des mycorhizes
Le terme "Mycorhize" définit une association symbiotique entre les racines d’une plante et certains champignons du sol. Littéralement, il veut dire "champignon/racine" (du grec mukês : champignon, et rhiza : racine). Les champignons se développent aussi bien à l’intérieur des racines qu’autour d’elles en formant un réseau de filaments qui amplifie considérablement la surface du contact entre les racines et le sol.
II.2. Types de mycorhizes
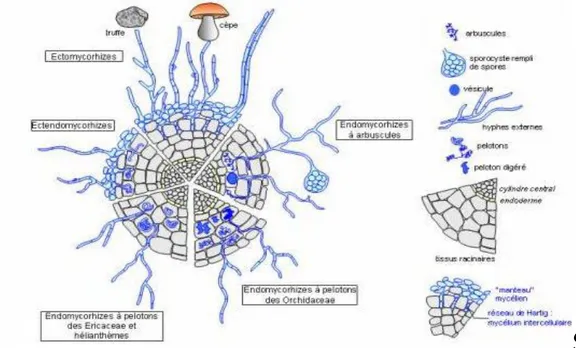
D’après la morphologie, on distingue différents types de mycorhizes (figure 1) :
Figure 1. Principaux types de mycorhizes représentés sur une coupe transversale de la racine
(d’après LeTacon, 1985).
Les ectomycorhizes (du grec ektos : à l’extérieur) chez lesquelles les champignons
se développent essentiellement autour de la racine, en formant un manchon mycélien ; de ce manteau part un réseau d’hyphes qui se développe entre les cellules corticales de la racine (réseau de Hartig) sans jamais entrer à l’intérieur de ces dernières. Ce type d’association est représenté surtout chez les essences forestières des régions tempérées et de la forêt boréale, mais il a été décrit aussi chez quelques espèces tropicales de la famille des Dipterocarpaceae, Euphorbiaceae, Cesalpiniaceae, Myrtaceae et Fagaceae (Redhead, 1980). Les champignons ectomycorhiziens appartiennent surtout aux Basidiomycètes (Bolets, Russules, Laccaire, etc) mais aussi aux Ascomycètes (Tuber, Elaphomyces, etc) et rarement aux Zygomycètes (Endogone).
Les ectendomycorhizes caractérisées à la fois par la présence du manteau mycélien
et le développement d’hyphes inter et intracellulaires ; elles se rencontrent chez les Arbutacées, les Monotropacées et sont formées par des Basidiomycètes (Cortinarius, Boletus, etc) (Mikola, 1988).
Les endomycorhizes (du grec endon : à l’intérieur) sont caractérisées par l’absence
de manchon mycélien externe et par la pénétration des hyphes fongiques dans les cellules corticales. Trois types sont rencotrés :
Les endomycorhizes des Orchidées et des Ericacées formées respectivement par des Basidiomycètes et des Ascomycètes de la famille des Pezizaceae ; dans ces deux cas, le mycélium forme des pelotons à l’intérieur des cellules du parenchyme cortical.
Les endomycorhizes des Cistacées où les pénétrations endocellulaires prennent une forme coralloïde ; les champignons symbiotiques responsables appartiennent aux Ascomycètes hypogés, de la famille des Terfeziaceae.
Les mycorhizes à arbuscules, formées par des champignons inférieurs et qui concernent environ 90 % des espèces végétales (Barea et Honrubia, 1993). Ces associations doivent leur nom aux structures fongiques résultant des hyphes intracellulaires qui se ramifient intensément à l’intérieur des cellules du cortex racinaire donnant des branchements appelés arbuscules. Les mêmes hyphes ou d’autres intercellulaires peuvent former des vésicules (Bofante-Fasola, 1984). Compte tenu de l'objet de cette étude, ce type de mycorhizes sera discuté plus en détail dans les sections suivantes.
III. Mycorhizes à arbuscules (MA) III.1. Historique et systématique
La plus ancienne notion d’endomycorhizes remonte à 1849 (Boullard, 1990), malgré que Morton et al. (1995) suggèrent qu’elles sont apparues il y a 250 millions d’années. Frank eut, dès 1887, le mérite de distinguer les ectomycorhizes et les endomycorhizes (Boullard, 1990). En 1974, Gerdmann et Trappe ont pu résumer la diversité de ces champignons endomycorhiziens en évoquant une première classification basée essentiellement sur la similarité des phénotypes de leurs spores. Ainsi, 5 genres ont été définis : Endogone, Glomus,
Sclerosystis, Acaulospora et Gigaspora. Ensuite, les mêmes auteurs ont révisé la famille des
Endogonacées. 44 espèces au sein de 7 genres ont été caractérisées. Parmi elles, beaucoup de taxons ont été redéfinis, 2 genres (Acaulospora, Gigaspora) et 12 nouvelles espèces ont été décrites.
Ames et Schneider (1979) mettaient en évidence le nouveau genre Entrophospora dans la famille des Endogonaceae, avec Entrophospora infrequens, espèce qui existait avant dans
le genre Glomus sous le nom de Glomus infrequens (Hall, 1977). Walker et Sanders (1986) ont séparé entre deux genres, Gigaspora et Scutellospora. En 1987, Schenck et Perez comptaient plus de 150 espèces décrites. Morton et Benny (1990) ont ensuite subdivisé l’ordre des Glomales en deux sous-ordres : les Glomineae et les Gigasporineae. Ces derniers comportent trois familles et six genres séparés selon des critères morphologiques comme par exemples :
la présence des vésicules attribuée au sous-ordre des Glomineae ;
la formation des sporocarpes séparant les Glomaceae des Gigasporaceae et des Acaulosporaceae ;
la forme d’hyphe d’attachement, allongé chez les Glomaceae, conique et non persistant après maturation chez les Acaulosporaceae et conique mais plus arrondi chez les Gigasporaceae.
Redecker et al. (2000) ont utilisé à la fois les données morphologiques et moléculaires et ont transféré Sclerocystis coremioides dans le genre Glomus, éliminant ainsi le genre
Sclerocystis. Se basant sur les données morphologiques, moléculaires et biochimiques,
Morton et Redecker (2001) ont décrit deux autres familles : Archaeosporaceae et Paraglomaceae. La première famille renferme le genre Archaeospora, avec trois espèces et la seconde le genre Paraglomus avec aussi deux espèces.
III.2. Taxonomie actuelle
Les concepts utilisés dans la systématique des champignons endomycorhiziens à arbuscules sont basés essentiellement sur la morphologie de la spore (Rosendahl et al., 1994 ; Morton et Benny, 1990), mais cette identification reste très difficile puisqu’elle permet d’obtenir peu de données sur la diversité de ces champignons (Giovanetti et Gianinazzi-Pearson, 1994). Le problème est encore exacerbé par la difficulté de leur obtention dans les cultures axéniques (Dodd et al., 1996)..
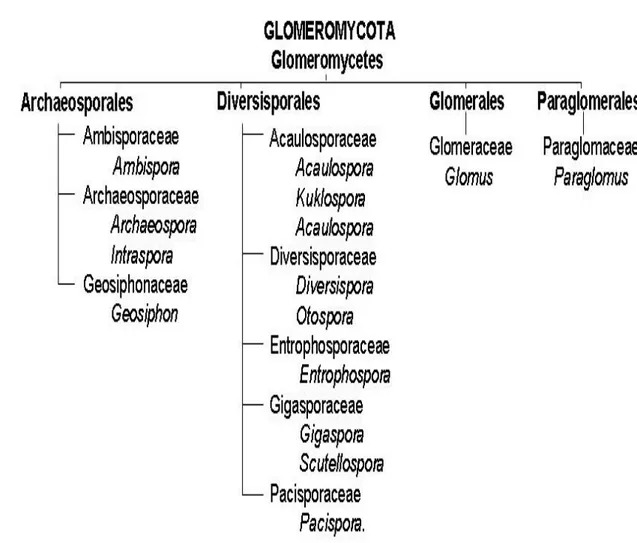
Actuellement, et grâce à l’outil de biologie moléculaire, toute la classification des CMA a été revue. Ces champignons sont maintenant classés dan le phylum des Glomeromycota (Schüssler et al., 2001) avec quatre ordres, dix familles et approximativement 200 espèces décrites (Raab et Redecker, 2006) (figure 2).
Figure 2. Classification des CMA [Selon Schüßler et al. (2001) avec corrections de Oehl et
Sieverding (2004), Walker et Schüßler (2004), Sieverding et Oehl (2006), Spain et al. (2006), Walker
et al. (2007a, b) et Palenzuela et al. (2008)]
III.3. Distribution géographique et plantes concernées
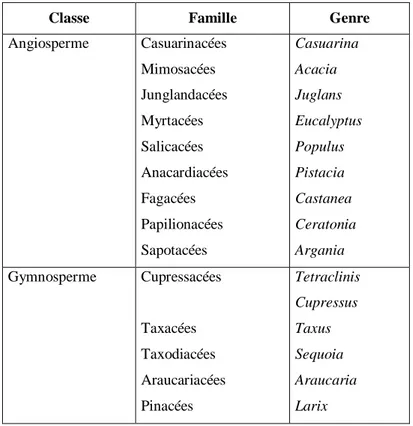
Les endomycorhizes arbusculaires sont présentes dans tous les écosystèmes et on les rencontre aussi bien chez des arbres des forêts tempérées (merisier, frêne, érable, if, thuya, etc) que chez les arbres des forêts tropicales et équatoriales (Readhead, 1980 ; Janos, 1980). Les principales familles et/ou genres d’espèces forestières formant ce type d’association sont données dans le tableau I.
Tableau I. Principaux familles et/ou genre d’arbres formant les mycorhizes à arbuscules
(Strullu, 1991)
Classe Famille Genre Angiosperme Casuarinacées Mimosacées Junglandacées Myrtacées Salicacées Anacardiacées Fagacées Papilionacées Sapotacées Casuarina Acacia Juglans Eucalyptus Populus Pistacia Castanea Ceratonia Argania Gymnosperme Cupressacées Taxacées Taxodiacées Araucariacées Pinacées Tetraclinis Cupressus Taxus Sequoia Araucaria Larix
Au Maroc, peu de travaux ont été réalisés sur les mycorhizes à arbuscules des essences forestières ou des arbustes. Ceux de Hatimi (1993) ont porté sur l’inoculation d’une légumineuse (Retama monosperma) par Glomus mosseae. Les résultats ont montré l’efficacité de cette souche sur la biomasse et la teneur en phosphore de la plante-hôte dans le cas de sol non fertilisé. De même, Nouaïm et Chaussod (1997) ont observé la grande efficacité d’une souche de collection (Glomus intraradices) sur la croissance de l’arganier. D’autres recherches ont essayé de montrer l’intérêt des CMA soit dans la croissance et la nutrition des plantes en cas de stress abiotiques (Abbas, 1998 ; Meddich et al., 2000) soit dans la réimplantation de certaines essences forestières (Ouahmane, 2007).
A l’échelle internationale, les CMA ont été signalées chez plusieurs essences forestières, Ces champignons ont montré des effets significatifs sur des taxons, telles que
Eucalyptus spp. (Ajoud et al., 1996), Cupressus sp. (Milagros et Cuenca, 1996), Fraxinus sp.
et Acer sp. (Le Tacon et al., 1992), des espèces des familles des Cupressacées et Taxodiacées (Stockey et al., 2001).
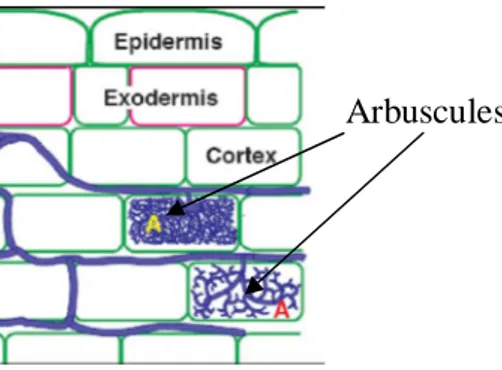
IV. Structure des mycorhizes arbusculaires En général, dans une mycorhize active, il existe :
une partie extraracinaire qui inclut le mycélium externe du champignon développé dans le sol, les spores et dans quelques cas les cellules auxiliaires ;
une phase intraracinaire qui inclut les hyphes intracellulaires (mycorhizes Paris-type) et fréquemment intercellulaires (Arum-type) ;
des arbuscules qui se forment par division dichotomique répétée des hyphes et occasionnellement des vésicules (Figure 3).
Il est important de signaler que la colonisation racinaire par les champignons formant les MA ne produit pas de modifications morphologiques de la racine, appréciables à l’œil nu et par simple observation macroscopique, et que le champignon colonise seulement l'épiderme et le parenchyme cortical des racines, sans pour autant atteindre le cylindre central ni les zones méristèmatiques (Bonfante-Fasolo, 1984).
Figure 3. Schéma de la structure d’une endomycorhize à arbuscules formée par
une espèce du genre Glomus (Brundrett et al., 1996).
La formation d'une mycorhize arbusculaire s’installe grâce à la succession des interactions entre le champignon et la plante-hôte, qui conduisent à une intégration morphologique et fonctionnelle des deux symbiontes (Gianinazzi-Pearson et al., 1996). Pendant la formation de la symbiose, la plante accepte le champignon sans manifester des réactions généralisées de défense (Dumas-Gaudot et al., 2000). Ceci est du à l'établissement d’un "dialogue" moléculaire continu entre les deux symbiontes, dirigé par l'échange de signaux qui conduisent à une reconnaissance mutuelle et au développement de programmes génétiques de compatibilité (Vierheilig et Piché, 2002).