© Frédéric Mc Cune, 2018
Impact de l’apiculture urbaine et du paysage urbain sur
les abeilles sauvages
Mémoire
Frédéric Mc Cune
Maîtrise en biologie végétale - avec mémoire
Maître ès sciences (M. Sc.)
II
Impact de l’apiculture urbaine et du paysage
urbain sur les abeilles sauvages
Mémoire
Frédéric McCune
Sous la direction de :
Valérie Fournier, directrice de recherche Marc J. Mazerolle, codirecteur de recherche
III
Résumé
Les abeilles sauvages contribuent significativement au service de pollinisation et connaissent présentement un déclin important. L’une des causes de ce déclin serait la compétition par l’abeille domestique. L’apiculture urbaine, une pratique assez récente, devient rapidement populaire. On ne connait pas de quelle façon la compétition entre les abeilles sauvages et domestiques s’exprime en milieu urbain, d’autant plus que ce milieu a déjà des impacts importants sur les abeilles, sauvages comme domestiques, notamment par la présence d’îlots de chaleur. Les objectifs de ce projet étaient de déterminer comment les paramètres environnementaux (abondance de l’abeille domestique, proportion des îlots de chaleur à l’intérieur de 1500 m, quantité et diversité des ressources florales) expliquent les communautés d’abeilles sauvages en milieu urbain. Nous avons émis les hypothèses : 1) que la compétition avec l’abeille domestique influence négativement les abeilles sauvages, 2) que les sites avec des ressources florales abondantes soutiennent des communautés d’abeilles sauvages plus diversifiées et abondantes et que ces ressources minimisent l’impact négatif de la compétition et 3) que l’urbanisation a des impacts variables sur les abeilles sauvages en fonction de leurs traits fonctionnels. Nous avons testé ces hypothèses à l’aide d’un jeu de données récoltées à Montréal en 2012 et 2013 sur 25 sites où les abeilles furent échantillonnées à l’aide de pièges-bols colorés. Nous avons étudié les patrons des communautés de 166 espèces d’abeilles sauvages ainsi que de l’abondance des espèces les plus communes après avoir tenu compte de la probabilité de détection. Nos analyses n’ont pas permis de détecter de compétition entre les abeilles sauvages et domestiques. Nos résultats indiquent cependant des effets variables des îlots de chaleur et positifs des ressources florales. Les villes permettent potentiellement la cohabitation harmonieuse entre l’apiculture urbaine et les abeilles sauvages à des densités modérées de ruches.
IV
Abstract
Wild bees are currently declining at a global scale. One of the possible contributors to this decline is the competition with domesticated honey bees for floral resources. Urban beekeeping, a fairly new activity, is rapidly gaining popularity. Competition between domesticated honey and wild bees occurs in some agricultural and natural settings. However, the extent of such potential competition in urban setting is unclear, given that this environment imposes pressures on bees, both wild and domesticated, namely by the presence of impervious surfaces and urban heat islands. The objectives of this project were to determine how environmental parameters (abundance of honey bees, proportion of urban heat islands within 1500 m, and availability and diversity of floral resources) affect wild bee communities in Montreal, Canada. We hypothesized that: 1) competition with honey bees influences wild bees negatively, 2) that high floral resources support abundant and diversified wild bee communities and mitigate the negative impacts of competition with honey bees, and 3) that urbanization has variable impacts on wild bees depending on their functional traits. We tested these hypotheses using an extensive data set collected in 2012 and 2013 on 25 sites where bees were sampled with pan-traps. Floral resources were sampled along transects at 15 of the 25 sites in 2016 and 2017. We investigated community patterns and abundance after accounting for imperfect detection probability. We found no evidence of competition between wild and domesticated bees. However, results indicate mixed effects of the proportion of urban heat islands and positive effects of floral resources. Thus, cities potentially allow the coexistence of urban beekeeping and wild bees under moderate hive densities. However, it will be important to further investigate the competitive interactions between wild and honey bees as urban beekeeping is rapidly gaining in popularity.
V
Table des matières
Résumé ... III Abstract ... IV Table des matières ... V Liste des tableaux ... VII Liste des figures ... VIII Remerciements ... XI Avant-propos ... XIII
Chapitre 1 : Introduction générale ... 1
1.1. Importance de la pollinisation ... 2
1.2. Déclin des pollinisateurs ... 3
1.3. Importance des ressources florales pour les abeilles ... 4
1.4. Impacts de l’abeille domestique ... 5
1.4.1. L’abeille domestique, un organisme exotique envahissant ... 5
1.4.2. Impact de l’abeille domestique sur les plantes indigènes et exotiques ... 7
1.4.3. Transmission de parasites et de maladies par l’abeille domestique ... 7
1.5. Compétition pour les ressources par l’abeille domestique ... 8
1.5.1. Introduction à la compétition ... 8
1.5.2. Quand l’abeille domestique en est victime ... 9
1.5.3. Superposition de niches écologiques et utilisation des ressources ... 9
1.5.4. Abeille domestique et abeilles sauvages ... 11
1.5.5. Impacts sur la valeur adaptative (fitness) des abeilles sauvages ... 12
1.5.6. Cohabitation harmonieuse ... 13
1.5.7. Compétition pour les nids ... 14
1.5.8. Apiculture urbaine ... 14
1.6. Impacts du paysage urbain sur les abeilles sauvages ... 15
1.6.1. Introduction à l’urbanisation ... 15
1.6.2. Pollinisateurs sauvages en milieu urbain : la diversité en ville ... 15
1.6.3. Pollinisateurs sauvages en milieu urbain : impact de l’urbanisation ... 16
1.6.4. Pollinisateurs sauvages en milieu urbain : les ressources florales ... 18
1.6.5. Pollinisateurs sauvages en milieu urbain : urbanisation et nidification ... 19
1.6.6. Pollinisateurs sauvages en milieu urbain : urbanisation et spécialisation ... 20
1.6.7. Pollinisateurs sauvages en milieu urbain : urbanisation et taille des abeilles sauvages ... 21
1.6.8. Pollinisateurs sauvages en milieu urbain : autres considérations ... 21
1.6.9. Îlots de chaleur ... 22
1.7. Objectifs et hypothèses de recherche ... 24
1.7.1. Objectif général ... 24
1.7.2. Objectif spécifique 1 ... 24
1.7.2.1. Hypothèses : ... 24
1.7.3. Objectif spécifique 2 ... 24
VI
Chapitre 2 : Impacts of urban beekeeping, urban heat islands and floral resources on
wild bees. ... 26
Résumé ... 27
Abstract ... 28
Introduction ... 29
Materials and Methods ... 31
Study sites and wild bee sampling ... 31
Floral resource sampling ... 33
Spatial analyses and urban heat islands ... 33
Statistical Analyses ... 34
Results ... 38
Community patterns ... 42
Abundance of common target species ... 47
Discussion ... 54
Urban heat islands and size of sites ... 54
Competition with honey bees ... 56
Floral resources ... 59 Detection probability ... 59 Shortcomings ... 60 Management implications ... 61 Conclusion ... 61 Acknowledgments ... 62 References ... 62 Appendix 1 ... 69 Appendix 2 ... 75 Appendix 3 ... 81 Appendix 4 ... 82
Chapitre 3 : Conclusion générale ... 83
VII
Liste des tableaux
Table 1 Covariates used in abundance models of the common target species captured at urban sites in Montreal, QC in 2012 and 2013 ... 39 Table 2 Biological hypotheses tested on abundance in the N-mixture models on wild bee
capture data from urban sites in Montreal, QC in 2012 and 2013. Each scenario on abundance was tested on each of two scenarios on detection probability: 1) Sampling effort + Date (linear effect) + Method, 2) Sampling effort + Date (linear and quadratic effects) + Method. The null model consisted of log area on abundance and sampling effort on detection probability. Note that log area was included on abundance in all models to account for differences in site area ... 41 Table 3 List of species for the community analysis sorted by phylogenetic order. Numbers
refer to the x axis of Fig. 2 to 8 ... 70 Table 4 Model selection based on QAICc of N-mixture models used to estimate the
abundance of the common target species captured in Montreal, QC in 2012 and 2013. Only models with ∆QAICc < 4 are shown for brevity. Note that explanatory variables on abundance are designated between parentheses in lambda(), whereas variables tested on detection probability are shown between parenthesis in p() ... 75 Table 5 Model-averaged estimates and 95% confidence intervals of parameters on
abundance of common target species captured in Montreal, QC in 2012 and 2013 ... 81 Table 6 Model-averaged estimates and 95% confidence intervals of parameters on detection
VIII
Liste des figures
Fig. 1 Map of study sites of the Montreal metropolitan area. White triangles represent the 15 sites sampled for floral resources and black triangles represent the 10 remaining sites. Insert locates the study area in northeastern North America ... 32 Fig. 2 Estimate of heat island proportion within 1500 m on occurrence and 95% credible
intervals for the community analysis of 166 wild bee species captured in Montreal, QC in 2012 and 2013 ... 43 Fig. 3 Estimate of log area of site on occurrence and 95% credible intervals for the
community analysis of 166 wild bee species captured in Montreal, QC in 2012 and 2013 ... 43 Fig. 4 Estimate of honey bee capture rate on occurrence and 95% credible intervals for the
community analysis of 166 wild bee species captured in Montreal, QC in 2012 and 2013 ... 44 Fig. 5 Estimate of sampling effort on detection probability and 95% credible intervals for
the community analysis of 166 wild bee species captured in Montreal, QC in 2012 and 2013 ... 44 Fig. 6 Estimate of Julian day squared on detection probability and 95% credible intervals
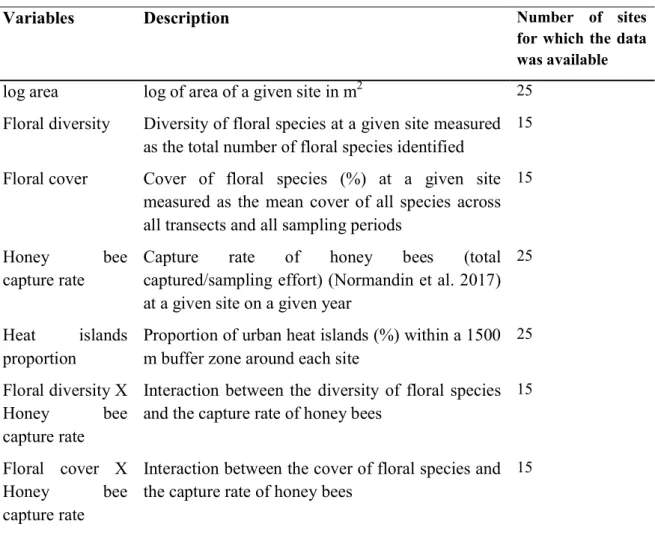
for the community analysis of 166 wild bee species captured in Montreal, QC in 2012 and 2013 ... 45 Fig. 7 Estimate of yellow bowls compared to blue bowls on detection probability and 95%
credible intervals for the community analysis of 166 wild bee species captured in Montreal, QC in 2012 and 2013 ... 45 Fig. 8 Estimate of white bowls compared to blue bowls on detection probability and 95%
credible intervals for the community analysis of 166 wild bee species captured in Montreal, QC in 2012 and 2013 ... 46
IX
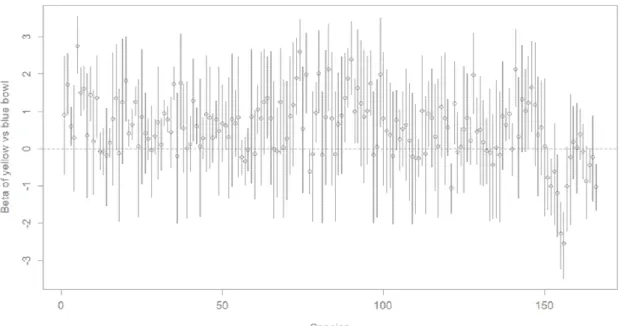
Fig. 9 Estimated species richness and raw counts of wild bees in Montreal, QC in 2012 and 2013 ... 46 Fig. 10 Model-averaged predictions showing the effect of heat island proportion within
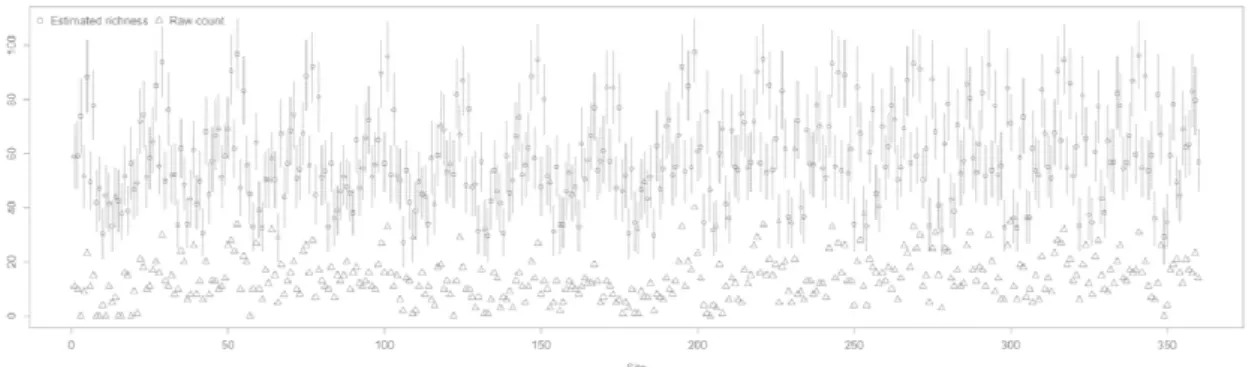
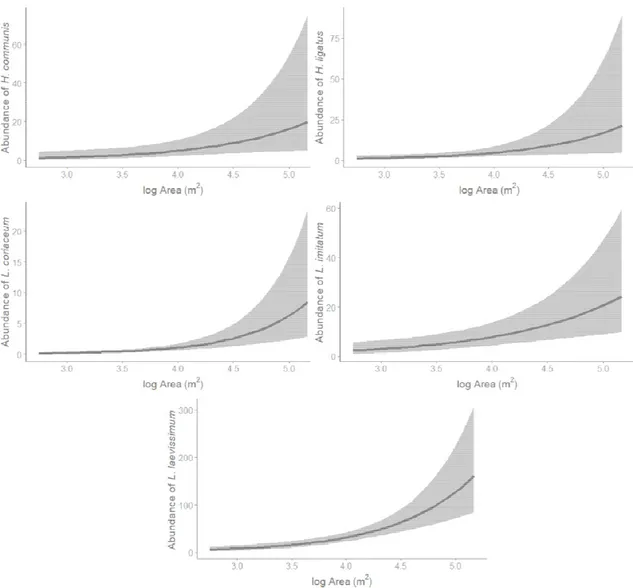
1500 m on the abundance of the common target species captured in Montreal, QC in 2012 and 2013 ... 48 Fig. 11 Model-averaged predictions showing the effect of log area of size on the abundance
of the common target species captured in Montreal, QC in 2012 and 2013 ... 49 Fig. 12 Model-averaged predictions showing the effect of floral diversity on the abundance
of the common target species captured in Montreal, QC in 2012 and 2013 ... 50 Fig. 13 Model-averaged predictions showing the effect of the interaction between floral
diversity and honey bee capture rate on the abundance of the common target species captured in Montreal, QC in 2012 and 2013 ... 50 Fig. 14 Model-averaged predictions showing the effect of Julian day squared on the
detection probability of the common target species captured in Montreal, QC in 2012 and 2013 ... 51 Fig. 15 Model-averaged predictions showing the effect of sampling effort on the detection
probability of the common target species captured in Montreal, QC in 2012 and 2013 ... 52 Fig. 16 Model-averaged predictions for the effect of bowl color on the detection probability
X
XI
Remerciements
Je veux commencer en remerciant ma directrice Valérie Fournier et mon codirecteur Marc J. Mazerolle. Merci pour votre aide tout au long du projet, pour votre encadrement, votre passion et vos conseils. Merci surtout pour la confiance dont vous avez fait preuve à mon égard et pour la liberté que vous m’avez accordée.
Merci à Amélie, Marianne, Mouna, Sabrina et Stéphanie pour votre aide, votre soutien et votre collaboration, mais merci surtout pour les activités socio-sociales et sportives, pour les fous rires, pour les moments où l'on a pu décrocher. Merci d’avoir fait du bureau un endroit paisible où l’ambiance de travail était optimale. Merci de m’avoir permis de m’impliquer dans vos projets dans les tâches les plus stimulantes. Merci aussi à Mélanie et Phanie qui même à distance ont contribué à la force de cette équipe de feu.
Merci à Jean-Philippe Lessard et Scott MacIvor d’avoir accepté d’évaluer ce mémoire.
Merci aussi à toutes les personnes qui ont contribué de près ou de loin à ce projet. À Olivier Samson-Robert sans qui le labo n’est plus le même. À Guillaume Guengard, Thaïs Andro, Lucie Alexandre, Aurélie Boilard et Andréa Duclos pour votre aide dans le travail de terrain et de laboratoire. J’espère que vous ne m’en voulez plus pour la saisie de milliers d’étiquettes d’abeilles. À Marie-Pierre Lamy, Claudette Roy, Gilles Ayotte et Mélodie Paquet pour votre savoir inégalable en botanique. À Alexandre Beaudoin de Miel Montréal et Éric Duchemin du laboratoire d’Agriculture Urbaine de l’UQAM pour votre connaissance de la situation de l’apiculture urbaine. À Jean-Phillippe Lessard, Emma Despland et Sergio Vega de l’université Concordia, Madeleine Chagnon, professeure associée à l’UQAM et Stéphanie Tellier du MAPAQ pour vos conseils lors de l’élaboration du projet. Merci à tous les gestionnaires de parcs, cimetières et jardins qui m’ont permis d’utiliser leurs sites pour mon projet.
Merci infiniment Nathalie pour ton hospitalité et ta bonne compagnie! C’était toujours plaisant grâce à toi de se rendre dans la métropole.
XII
Merci à tous ceux qui m’ont soutenu dans cette aventure. Merci à mes amis. Merci aux 266 pour les soupers, les sorties et les voyages. Je n’aurais pu espérer de meilleurs compagnons pour ces deux ans d’aventure! Merci aux Champs-Élysées pour les soirées autour des pichets, les jeux de société et les nuits d’été autour du feu. Merci aussi à tous les autres pour les bons moments. Vous êtes les meilleurs! Simplement merci d’exister et d’être ceux que vous êtes.
Finalement, le plus grand des mercis à ma famille. Merci Alex d’être le plus génial des frères et de me suivre dans mes plans de fou. Merci aussi bien sûr à mes parents. Merci d’avoir toujours été là pour moi et de m’avoir soutenu et encouragé tout au long de mes études. Même si vous ne compreniez pas toujours ce que je faisais, vous faisiez toujours comme si ça vous passionnait autant que moi et je vous en remercie. C’est grâce à vous si je suis la personne que je suis aujourd’hui. Merci tellement!
XIII
Avant-propos
Le chapitre II de ce mémoire est présenté sous forme d’un article scientifique rédigé en anglais. Ce chapitre sera soumis pour publication dans la revue avec comité de révision par les pairs Urban Ecosystems.
La récolte des données, l’analyse des résultats ainsi que la rédaction de l’ensemble des textes sont issues du candidat. Valérie Fournier (directrice), Ph.D. professeure d'entomologie à l'Université Laval et Marc J. Mazerolle (co-directeur), Ph.D. professeur à l’Université Laval ont collaboré aux textes et sont coauteurs du chapitre II. Étienne Normandin-Leclerc est également coauteur du chapitre II pour son rôle dans la réalisation, en 2012 et 2013, du jeu de données original.
1
2 1.1. Importance de la pollinisation
La pollinisation est un service écosystémique indispensable en agriculture. Plus du tiers (35%) de la production globale de nourriture requiert une pollinisation animale, la plupart du temps par les abeilles. De plus, 87 des 115 cultures les plus importantes en dépendent directement (Klein et al. 2007). À l’échelle mondiale, la valeur de ce service écologique est estimée à 153 milliards € annuellement (Gallai et al. 2009). Au Canada, la valeur de la pollinisation par l’abeille à miel a été évaluée à plus de 2 milliards $ annuellement (Agriculture et Agroalimentaire Canada 2016). Aux États-Unis, la valeur de la pollinisation globale des cultures par les insectes sauvages a été évaluée entre 2 et 3 milliards $ annuellement (Losey and Vaughan 2006). La pollinisation par les abeilles sauvages vaut en moyenne 3251 ± 547 $ par hectare, soit à peu près la même chose que l’abeille domestique (2913 ± 574 $) (Kleijn et al. 2015).
L’environnement bénéficie aussi grandement de la pollinisation. Plus de 75% des plantes angiospermes de la planète dépendent de plus de 200 000 espèces animales pour leur reproduction sexuée. Des 250 000 espèces connues de plantes à fleurs, 15% dépendent de l’abeille domestique pour la pollinisation et au moins 80% de d’autres animaux tels que des abeilles sauvages, des guêpes, des papillons, des mouches, des coléoptères, des thrips, des fourmis, des escargots, des oiseaux, des chauves-souris, des marsupiaux, des primates, des rongeurs et des geckos (Abrol 2012). Ces plantes sauvages rendent à leur tour des services écosystémiques variés, ex. : support du milieu, régulation, ressources pour animaux sauvages, production de ressources (Breeze et al. 2011). Ainsi, les abeilles sauvages procurent des services d’approvisionnement, de régulation et socioculturels (Matias et al. 2017). Les abeilles sauvages (Apoidea) sont l’un des groupes de pollinisateurs les plus efficaces et les plus importants. On retrouve plus de 20 000 espèces d’abeilles sauvages dans le monde dont environ 750 au Canada et 365 au Québec (Ascher and Pickering 2014). Elles sont réparties dans six familles, soit les Andrenidae, les Apidae, les Colletidae, les Halictidae, les Megachilidae et les Melittidae.
Une diversité de pollinisateurs permet la pollinisation optimale d’une diversité de plantes à fleurs (Biesmeijer et al. 2006). C’est le cas notamment des syrphes et des
3
bourdons qui offrent un meilleur service de pollinisation lorsqu’ils travaillent de concert plutôt que séparément (Fontaine et al. 2006). La complémentarité entre les abeilles sauvages et l’abeille domestique permet aussi une meilleure pollinisation de la fraise (Chagnon et al. 1993) et de la pomme au Québec (Martins et al. 2015).
1.2. Déclin des pollinisateurs
Plusieurs facteurs laissent craindre une crise des pollinisateurs un peu partout dans le monde (Biesmeijer et al. 2006; Cameron et al. 2011; Potts et al. 2010a; Potts et al. 2010b; van Engelsdorp et al. 2007; Winfree et al. 2009). Leur déclin pourrait avoir des conséquences importantes sur les cultures et la biodiversité (Potts et al. 2010a). L’abondance des abeilles sauvages a diminué sur 23% du territoire des États-Unis entre 2008 et 2013 et les pertes d’habitat par l’agriculture en seraient la principale cause (Koh et al. 2016). Les pesticides, herbicides, fongicides et acaricides sont identifiés comme la cause des pertes d’abeilles domestiques (Desneux et al. 2007; Johnson et al. 2010).
Les abeilles sauvages sont indispensables pour la pollinisation puisque les ruchers d’abeilles domestiques dans le monde ne pourraient pas y parvenir seuls. Les données des Nations Unies (FAO) indiquent une augmentation globale de 45% des stocks d’abeilles domestiques depuis 1961 et une augmentation de 100% de la production de miel durant cette période, au même rythme que la population humaine. Le cheptel d’abeilles domestiques semble donc surtout servir à la production de miel plutôt qu’à la pollinisation (Aizen and Harder 2009). On observe aussi une augmentation très importante de l’agriculture dépendante des animaux pour la pollinisation, beaucoup plus rapide que l’augmentation du stock d’abeilles domestiques (300% d’augmentation). Cela suggère que les abeilles sauvages jouent un rôle très important dans la pollinisation puisque l’augmentation beaucoup plus faible du nombre de ruches d’abeille domestique par rapport à la demande ne pourrait pas subvenir à la pollinisation des cultures (Aizen and Harder 2009).
L’abeille domestique est utilisée à grande échelle pour la pollinisation des cultures, mais serait un pollinisateur peu efficace comparée aux pollinisateurs sauvages (Breeze et al.
4
2011; Ollerton et al. 2012). En effet, elle transfère souvent mal le pollen d’une fleur à l’autre (Vaughton 1996; Wilson and Thomson 1991). La pollinisation par les abeilles commerciales est complémentaire aux pollinisateurs sauvages et ne peut ni les remplacer ni maximiser la pollinisation seule. Il existe une association positive entre le nombre de visites de pollinisateurs sauvages aux fleurs et la mise à fruit chez 41 cultures (Garibaldi et al. 2013). Cependant, cette association était présente chez seulement six de ces cultures en ce qui concerne l’abeille domestique. Les pollinisateurs sauvages augmentent même la mise à fruit deux fois plus que l’abeille domestique (Garibaldi et al. 2013). Cela a notamment été démontré dans le bleuet nain, où l’abeille domestique est un pollinisateur moins efficace que les reines et ouvrières bourdons (Bombus spp.) et les abeilles solitaires des genres Andrena, Megachiles et Halictus (Javorek et al. 2002).
1.3.Importance des ressources florales pour les abeilles
La disponibilité des ressources florales est le facteur le plus important pour la structure des communautés de pollinisateurs (Roulston and Goodell 2011). La richesse des communautés de pollinisateurs est fortement affectée par la richesse en plantes fleuries et le couvert de ces plantes (Ebeling et al. 2008; Grundel et al. 2010; Pardee and Philpott 2014), de même que par la répartition spatiale des parcelles de fleurs (Plascencia and Philpott 2017). Ces impacts positifs de la richesse en plantes fleuries peuvent s’expliquer par la plus grande diversité de sources de nectar et de pollen qu’elles procurent (Ebeling et al. 2008; Ghazoul 2006). Les ressources de nidification (sol à nu et cavités) expliquaient aussi la structure des communautés d’abeilles sauvages (Grundel et al. 2010; Potts et al. 2005).
L’augmentation de la densité de plantes hétérospécifiques autour d’une plante focale permet d’augmenter la proportion de visites de pollinisateurs indigènes (Bruckman and Campbell 2014). Cela a notamment été démontré dans le bleuet en corymbes, où les bleuetières ayant des aménagements plantés de fleurs sauvages abritaient davantage d’abeilles sauvages et de syrphes (Blaauw and Isaacs 2014). Les rendements de ces bleuetières (taux de mise à fruit, poids des fruits et nombre de graines par fruit) étaient aussi plus élevés que ceux des bleuetières sans fleurs sauvages. L’ajout de seulement une plante d’une autre espèce à une parcelle de Raphanus raphanistrum (Brassicaceae)
5
permettait d’augmenter le nombre de visites de pollinisateurs et d’améliorer la pollinisation (plus de graines par fruit) (Ghazoul 2006). Les mécanismes expliquant ces observations incluent une réduction de la compétition par les pollinisateurs généralistes, la complémentarité de l’attractivité des différentes espèces florales et la complémentarité des ressources. Selon le dernier mécanisme, des plantes auraient avantage à offrir des ressources complémentaires (nectar et pollen) aux pollinisateurs afin d’augmenter l’attractivité des parcelles d’espèces florales différentes (Ghazoul 2006).
1.4.Impacts de l’abeille domestique
1.4.1. L’abeille domestique, un organisme exotique envahissant
L’abeille domestique Apis mellifera L. (Hymenoptera : Apidae) est considérée comme une espèce exotique envahissante un peu partout sur terre (Goulson 2003; Kenis et al. 2008). Les espèces exotiques envahissantes ont été définies comme possédant trois caractéristiques : elles prolifèrent et se répandent dans la nature, elles sont nuisibles pour l’environnement, l’économie ou la santé humaine et elles sont introduites dans certaines régions d’où elles étaient absentes (Lodge et al. 2006). Ces caractéristiques correspondent à la situation de l’abeille domestique. Elle est en effet originaire de l’Afrique subsaharienne et du bassin méditerranéen (Crane 1999; Dohzono and Yokoyama 2010; Goulson 2003; Moritz et al. 2005) et fut domestiquée par les Égyptiens environ 2400 ans av. J.-C. (Crane 1999). Elle se retrouve maintenant dans presque tous les pays et sur tous les continents sauf l’Antarctique (Goulson 2003). Des souches européennes ont été introduites en Amérique du Nord, dans la moitié sud de l’Amérique du Sud, en Asie, en Australie, en Nouvelle-Zélande et dans les îles du Pacifique (Crane 1999; Goulson 2003). La souche africaine a pour sa part été introduite au Brésil et s’est répandue dans toute l’Amérique tropicale (Goulson 2003; Moritz et al. 2005). L’abeille domestique a une excellente capacité de colonisation de pratiquement tous les milieux (Moritz et al. 2005). Elle fait preuve d’une bonne plasticité phénotypique au niveau des comportements de butinage et de reproduction lui permettant de faire face à une large gamme d’habitat et de conditions climatiques, allant de l’environnement tropical humide aux déserts secs en passant par les régions subarctiques (Moritz et al. 2005).
6
Les risques liés aux pollinisateurs exotiques sont nombreux. Ils incluent l’hybridation avec les populations locales (Kenis et al. 2008), la compétition avec les populations locales pour les ressources florales et de nidification (Stout and Morales 2009), la co-introduction d’ennemis naturels, de parasites ou de maladies (Goulson 2003), la mauvaise pollinisation entraînant la diminution de la valeur adaptative (fitness) des plantes indigènes (Gross and Mackay 1998), la surpollinisation pouvant causer la prolifération de plantes exotiques envahissantes (Goulson and Derwent 2004) et l’interruption de la reproduction par l’arrêt des processus mutualistes (Traveset and Richardson 2006). Sept autres risques découlant de l’introduction de l’abeille domestique et de sa consommation de pollen et de nectar sur les abeilles sauvages ont été identifiés (Cane and Tepedino 2016). Il s’agit de la diminution des ressources de nectar et pollen disponibles (Carneiro and Martins 2012), de l’allongement des périodes de collecte de ressources (Zurbuchen et al. 2010), d’un débalancement du sex-ratio vers les mâles (Bosch 2008), de progénitures plus petites (Bosch 2008), d’une augmentation du parasitisme (Goodell 2003), de l’exclusion des pollinisateurs de certaines ressources (Roubik and Villanueva-Gutierrez 2009) et de la transmission de pathogènes (Furst et al. 2014).
L’introduction d’abeilles domestiques a causé à plusieurs endroits dans le monde un déclin chez les populations locales de pollinisateurs sauvages et d’oiseaux (Dupont et al. 2004; Hansen et al. 2002). L’archipel d’Ogasawara pourrait en être un exemple puisque l’introduction de l’abeille domestique, combinée à la destruction des habitats par l’homme menace d’extinction plusieurs abeilles endémiques (Kato et al. 1999). Les systèmes plantes-pollinisateurs mutualistes de Nouvelle-Calédonie seraient aussi menacés depuis que l’abeille domestique y est le pollinisateur le plus abondant (Kato and Kawakita 2004). Une controverse a d’ailleurs opposé, en Australie, l’apiculture et la protection de l’environnement. La concentration d’abeilles domestiques dans des zones protégées faisait craindre pour la faune et la flore australienne (Pyke 2000).
Une revue de littérature sur l’impact des pollinisateurs domestiques (abeille domestique et bourdons domestiques) sur les abeilles sauvages a révélé que 53% des études sur le sujet observaient des effets négatifs dus à la compétition, que 28% n’observaient pas d’effets et que 19% observaient des effets mixtes (Mallinger et al. 2017). Ainsi, aucune
7
étude n’observait de résultats tout à fait positifs des pollinisateurs domestiques sur les pollinisateurs sauvages. Il y avait davantage d’effets négatifs lorsque les pollinisateurs domestiques étaient utilisés hors de leur aire de répartition.
1.4.2. Impact de l’abeille domestique sur les plantes indigènes et exotiques
L’impact direct de l’abeille domestique sur la valeur adaptative (fitness) des plantes peut occasionner des changements dans leur répartition et leur abondance (Stout and Morales 2009). Pour occasionner de tels effets sur les plantes, l’abeille domestique doit causer une diminution de la qualité ou de la quantité de pollen transféré entre les fleurs, occasionnant une diminution du taux de graines formées et donc de la valeur adaptative (fitness) de la plante (Traveset and Richardson 2006). Il existe plusieurs exemples où la valeur adaptative (fitness) de plantes a été réduite par l’introduction de pollinisateurs exotiques (Dohzono and Yokoyama 2010; Dupont et al. 2004; Gross and Mackay 1998).
Les effets des pollinisateurs exotiques envahissants sur les plantes indigènes et exotiques sont bien différents. Ainsi, si les pollinisateurs sauvages préfèrent les plantes indigènes (Morandin and Kremen 2013), il en va autrement des abeilles exotiques qui visitent davantage les plantes exotiques (Telleria 1993). Une étude réalisée en Ontario a même démontré que 75% du pollen transporté par les abeilles domestiques provenait de plantes exotiques (Stimec et al. 1997). La pollinisation par l’abeille domestique sur certaines plantes exotiques envahissantes pourrait donc participer à la problématique des plantes envahissantes (Goulson 2003; Goulson and Derwent 2004).
1.4.3. Transmission de parasites et de maladies par l’abeille domestique
L’introduction d’organismes exotiques représente un important potentiel d’introduction simultanée de leurs parasites et pathogènes. L’abeille domestique peut agir comme réservoir de pathogènes pour les populations sauvages (Furst et al. 2014). Une étude a démontré que la prévalence des maladies et parasites était plus importante chez les populations sauvages de bourdons situées à proximité de fermes utilisant des bourdons ou des abeilles domestiques (Graystock et al. 2014). Une diminution de la défense immunitaire des bourdons due au stress causé par la compétition avec l’abeille domestique pourrait être
8
en cause (Brown et al. 2000; Elbgami et al. 2014; Goulson and Sparrow 2008). Il a aussi été démontré que des virus à ARN, que l’on soupçonne de jouer une part importante dans le syndrome d’effondrement des colonies d’abeilles, peuvent être transmis de colonies d’abeilles domestiques vers des hyménoptères sauvages, à la fois des abeilles solitaires, des bourdons et des guêpes (Singh et al. 2010).
1.5.Compétition pour les ressources par l’abeille domestique
1.5.1. Introduction à la compétition
Il existe deux principaux types de compétition. La compétition par interférence se produit lorsqu’une espèce empêche directement l’accès à une ressource à une autre espèce au moyen d’interactions agressives (comportement territorial). La compétition par exploitation des ressources se produit lorsque deux espèces utilisent la même ressource et que la raréfaction de cette ressource mène à une réduction de la fécondité, des tailles de portée ou de la survie d’une ou des deux espèces (Begon et al. 2005). La compétition par interférence est un phénomène rare chez les abeilles domestiques puisqu’elles ne sont pas agressives lors du butinage (Schaffer et al. 1979). Cependant, des comportements agressifs ont été observés chez l’abeille domestique lorsqu’elle pille les nids des espèces sauvages pour y voler du miel (Sakagami 1959). Cela pourrait même avoir contribué au déclin d’une espèce d’abeille japonaise (Sakagami 1959). Des évènements de « cleptolectie » ont aussi été observés, où des abeilles domestiques volent du pollen directement des corbeilles d’espèces sauvages (Thorp and Briggs 1980).
Une compétition pour les ressources peut survenir entre des pollinisateurs exotiques et indigènes lorsque trois conditions sont rencontrées : l’utilisation des ressources par les deux espèces doit se chevaucher, les ressources doivent être limitées et une diminution dans l’acquisition des ressources doit résulter en une diminution de la reproduction ou de la valeur adaptative (fitness) de l’espèce la moins compétitive ou des deux espèces (Paini 2004; Stout and Morales 2009). La largeur et le chevauchement des niches écologiques, l’efficacité à prélever des ressources, l’épuisement des ressources et les corrélations spatiales et temporelles entre pollinisateurs introduits et exotiques sont autant d’indicateurs
9
de la compétition entre pollinisateurs sauvages et exotiques (Stout and Morales 2009). Cependant, seules des études sur la survie, la fécondité ou la densité de population peuvent établir une relation de cause à effet (Elbgami et al. 2014; Goulson et al. 2002b; Paini 2004; Paton 1993).
1.5.2. Quand l’abeille domestique en est victime
La compétition pour les ressources peut avoir des impacts très importants sur les communautés de pollinisateurs en présence d’un compétiteur très efficace (Balfour et al. 2015). Par exemple, les bourdons sont d’excellents pollinisateurs de la lavande, bien meilleurs que l’abeille domestique (Balfour et al. 2013). Dans une étude où l’un et l’autre de ces compétiteurs ont été exclus de champs de lavande et comparés à un témoin, une augmentation importante du nombre d’abeilles domestiques a été observée lors de l’exclusion des bourdons (Balfour et al. 2015). L’inverse n’était cependant pas vrai, les bourdons n’étant pas plus abondants en absence d’abeilles. L’exclusion des bourdons a aussi causé la diminution du temps de recherche de fleurs, la diminution du nombre de fleurs rejetées, la diminution de la proportion du nombre de vols entre les fleurs, l’augmentation du temps passé à une fleur et l’augmentation du temps passé à une parcelle (Balfour et al. 2015). Encore une fois, ces paramètres sont restés inchangés chez les bourdons même en absence d’abeilles. L’exclusion des bourdons a causé l’augmentation du volume de nectar dans les fleurs et donc le gain d’énergie pour l’abeille (Balfour et al. 2015). Cette expérience démontre bien qu’un compétiteur très efficace peut avoir des impacts importants sur le comportement, mais aussi le budget énergétique de ses compétiteurs, pouvant mener à des effets sur la valeur adaptative (fitness) des organismes.
1.5.3. Superposition de niches écologiques et utilisation des ressources
La superposition des niches écologiques donne une idée de la similarité entre les ressources utilisées par deux organismes. Les ressources utilisées par l’abeille domestique sont principalement du nectar et du pollen, mais aussi, dans une plus faible mesure, du miellat, de la sève, de la cire, de la résine et de l’eau. Elle partage ces ressources avec de nombreux organismes, dont des abeilles sauvages, d’autres hyménoptères, des lépidoptères,
10
des coléoptères, des diptères, des oiseaux, des chauves-souris et d’autres mammifères (Goulson 2003). Une superposition de niches entre 41 et 70%, avec des maximums à 80-90% lorsque les ressources sont peu abondantes, a été observé pour l’abeille domestique et les bourdons (Bombus spp.) (Thomson 2006). Des pourcentages de superposition des niches entre l’abeille domestique et les abeilles sauvages variant de 17 à 97% ont été observés en Allemagne et Australie (Goulson et al. 2002b; Paini and Roberts 2005; Steffan-Dewenter and Tscharntke 2000). Cependant, une telle superposition de niches écologiques n’implique pas nécessairement qu’il y ait compétition (Goulson 2003). Il faut aussi que les ressources soient limitées et que cette limitation cause une diminution de la valeur adaptative (fitness) d’un ou plusieurs compétiteurs.
L’abeille domestique peut causer une diminution importante de l’accessibilité aux ressources de pollen et de nectar (Carneiro and Martins 2012). Elle a la possibilité d’être un compétiteur très efficace (Hudewenz and Klein 2013) considérant ses besoins élevés en nectar et en pollen, ses importantes colonies pérennes, sa capacité à se déplacer loin de la ruche pour prélever des ressources (Seeley 1985), ses moyens de communication pour indiquer l’emplacement des ressources (Seeley 1985; Visscher and Seeley 1982) et les ressources alimentaires apportées par les apiculteurs (Goulson 2003). En Espagne, l’abeille domestique et, de façon marginale, Bombus impatiens ont été identifiés comme les principaux consommateurs de nectar et de pollen de romarin et de thym, diminuant la disponibilité de ces ressources pour les autres abeilles (Torné-Noguera et al. 2016). Aux États-Unis, un seul bon rucher peut collecter l’équivalent en pollen et nectar de 102 colonies de bourdons, soit 38 400 individus (Heinrich 1979). Il a été évalué que la récolte estivale de pollen par une colonie d’abeilles domestiques correspond à la quantité de pollen nécessaire à l’alimentation d’environ 110 000 larves d’abeilles sauvages (Cane and Tepedino 2016). Ainsi, un rucher de 40 ruches consomme, en un été, l’équivalent du pollen nécessaire à nourrir la progéniture de quatre millions d’abeilles sauvages (Cane and Tepedino 2016). Dans les forêts tropicales du Mexique, l’arrivée de l’abeille domestique africanisée a forcé les abeilles sauvages à changer les sources de pollen qu’elles utilisaient, et même à abandonner deux familles de plantes qu’elles utilisaient abondamment (Anacardiaceae et Euphorbiaceae) (Roubik and Villanueva-Gutierrez 2009).
11
1.5.4. Abeille domestique et abeilles sauvages
La compétition avec l’abeille domestique peut avoir des impacts négatifs sur l’abondance ou la diversité des abeilles sauvages. En Tasmanie, l’abondance des abeilles sauvages était trois fois plus grande aux sites où l’abeille domestique était absente (Goulson et al. 2002b). En Allemagne, des effets négatifs de la proximité de ruches ont été observés sur la richesse des abeilles qui nichent dans des tiges, mais pas sur leur succès de reproduction déterminé par le nombre de nids (Hudewenz and Klein 2013). En Guyane Française, l’introduction expérimentale de ruches d’abeilles domestiques africanisées a mené à une réduction de l’abondance des abeilles méliponides et de la quantité de ressources qu’elles collectent (Roubik 1978). En Israël, l’introduction de ruches d’abeille domestique a mené à une diminution de la fréquence des visites aux fleurs de certaines plantes par les abeilles sauvages (Shavit et al. 2009).
L’ajout de ruches pour la pollinisation des cultures influence négativement les pollinisateurs sauvages. Dans l’état de New York, une étude comparative entre des champs de citrouilles avec et sans ruches d’abeilles domestiques pour la pollinisation a démontré un effet négatif de cette pratique (Artz et al. 2011). Ainsi, le nombre de Peponapis pruinosa, l’abeille sauvage la plus commune dans ce système, et même le nombre total d’abeilles (domestiques et sauvages combinées) étaient plus faibles dans les champs avec des ruches (Artz et al. 2011). En Suède, la comparaison de champs de colza avec et sans ruches a permis de prouver que la compétition causée par l’abeille domestique affecte négativement les pollinisateurs sauvages (Lindström et al. 2016). L’ajout de ruches pour la pollinisation du colza provoque en effet le déplacement des pollinisateurs sauvages. La densité de bourdons et de mouches diminuait avec l’augmentation de la distance depuis le bord du champ alors qu’elle augmentait avec l’augmentation de la distance depuis les ruches. Ces deux tendances soutiennent l’idée du déplacement des pollinisateurs plutôt que d’un changement au niveau des populations (Lindström et al. 2016). Au Mexique, dans les plantations de café, la richesse et l’indice de diversité de Shannon-Wiener des pollinisateurs sauvages étaient négativement corrélés à l’abondance des abeilles domestiques. Les plantations avec une plus grande diversité de pollinisateurs sauvages (richesse et indice de
12
diversité) produisaient une meilleure mise à fruit, alors que le nombre d’abeilles domestiques était négativement corrélé avec ce paramètre (Badano and Vergara 2011).
Les communautés d’abeilles sauvages sont influencées par la proximité avec les ruchers d’abeille domestique. En Espagne, la biomasse des abeilles sauvages était effectivement plus faible près des ruchers (Torné-Noguera et al. 2016). La plus grande susceptibilité des grosses abeilles à la compétition explique ce résultat (Torné-Noguera et al. 2016). Elles sont forcées d’élargir leur rayon de recherche de ressources pour s’éloigner des ruches, leur rayon de recherche dépendant de leur taille (Greenleaf et al. 2007; Guedot et al. 2009). Les petites abeilles ont en effet besoin de moins de ressources pour voler, subvenir à leurs besoins (Heinrich 1975) et produire une nouvelle génération (Muller et al. 2006). À Tenerife, une île de l’archipel des Canaries, l’abondance des pollinisateurs sauvages était plus faible sur Echium wildpretii au site où l’abeille domestique était plus abondante (Dupont et al. 2004). Cette situation pourrait résulter d’un phénomène de compétition par exploitation des ressources puisque le niveau de nectar des fleurs de la population où l’abeille domestique était abondante était beaucoup plus faible, atteignant presque zéro (Dupont et al. 2004).
1.5.5. Impacts sur la valeur adaptative (fitness) des abeilles sauvages
La compétition avec l’abeille domestique peut réduire la valeur adaptative (fitness) des abeilles sauvages. L’abeille domestique réduit en effet la reproduction d’Osmia bicornis en conditions expérimentales (Hudewenz and Klein 2015). En conditions réelles, il est connu que l’augmentation du temps passé à rechercher des ressources cause une diminution de l’effort de reproduction chez les abeilles sauvages (Zurbuchen et al. 2010). Aussi, des ressources insuffisantes peuvent forcer les femelles à réduire la taille de leur portée et féconder moins d’œufs, de façon à déséquilibrer le sex-ratio vers le sexe le moins cher à produire énergétiquement, c’est-à-dire les mâles (Bosch 2008). L’effet de la compétition avec l’abeille domestique a été observé chez Hylaeus alcyoneus, une espèce d’abeille indigène en Australie, en comparant des sites avec et sans ruchers. Le nombre de nids produit par l’espèce indigène était plus faible aux sites traitements qu’aux sites témoins (Paini and Roberts 2005).
13
La présence d’abeilles domestiques a des effets négatifs sur l’abondance (Forup and Memmott 2005; Thomson 2016) et la valeur adaptative (fitness) des bourdons (Elbgami et al. 2014; Thomson 2004). Des colonies de bourdons à proximité de ruchers d’abeilles domestiques produisent des reines plus petites et moins nombreuses que celles éloignées des ruchers (Elbgami et al. 2014; Thomson 2004). La présence de ruches d’abeilles domestiques peut causer une telle réduction de la taille chez plusieurs espèces de bourdons (Goulson and Sparrow 2008). Les colonies de bourdons près des ruches sont aussi plus légères que celles qui en sont éloignées. Cela peut s’expliquer à cause du poids des bourdons ou de celui de la nourriture emmagasinée dans la colonie, le poids de la colonie étant une mesure du succès de la collecte de ressources (Elbgami et al. 2014). Les ouvrières plus légères sont moins efficaces que les plus lourdes pour la collecte des ressources (Goulson et al. 2002a). Les plus petites s’occupent en effet surtout des tâches à l’intérieur de la colonie et ne la quittent que lorsque les ressources sont limitées et que les grosses ouvrières sont éloignées (Goulson et al. 2002a). La réduction du poids des ouvrières peut donc indiquer une réduction des ressources qui forcent les petites ouvrières à sortir butiner ou bien une réduction de la quantité et de la qualité des ressources et donc une alimentation insuffisante au stade larvaire (Ribeiro et al. 1993; Sutcliffe and Plowright 1988).
1.5.6. Cohabitation harmonieuse
Certaines études n’ont cependant pas observé d’effets de la compétition. En Allemagne, l’abondance des abeilles sauvages aux fleurs, la richesse spécifique des abeilles sauvages, le nombre d’espèces nicheuses, le nombre de cellules de nidification et l’activité des abeilles sauvages nicheuses de sol n’étaient pas liés à la densité de ruches d’abeilles domestiques ni à l’abondance des abeilles domestiques aux fleurs (Steffan-Dewenter and Tscharntke 2000). La compétition entre les abeilles africanisées et les abeilles méliponides n’a pas non plus pu être expliquée grâce à des modèles statistiques (Roubik 1983). Cette absence de relation négative entre l’abeille domestique et les abeilles sauvages peut s’expliquer par plusieurs facteurs, notamment une utilisation différente des ressources par les deux groupes, par une compétition intraspécifique plus importante que celle avec l’abeille domestique, une faible densité d’abeilles domestiques, une abondance de ressources florales ou d’autres pressions qui limitent les populations d’abeilles sauvages
14
(Roubik 1983; Steffan-Dewenter and Tscharntke 2000). Une étude sur 17 ans réalisée au Panama a aussi échoué à démontrer l’effet de l’introduction d’abeilles africanisées sur les populations d’abeilles sauvages. L’abondance des abeilles sauvages n’a pas diminué dans les 10 années suivant l’introduction des abeilles africaines (Roubik and Wolda 2001). Les mêmes conclusions peuvent être tirées d’une étude au Yucatan (Roubik 2009). L’abondance des abeilles sauvages n’était pas non plus liée à celle de l’abeille domestique sur Larrea tridentata (Zygophyllaceae) dans les déserts du sud-ouest américain (Minckley et al. 2003). L’introduction de différentes densités de ruches d’abeilles domestiques dans le nord de la Grèce n’a pas permis de confirmer un effet de l’abeille domestique sur les abeilles sauvages (Goras et al. 2016). Comme c’est le cas pour plusieurs études conduites en Europe ou dans le bassin méditerranéen, d’où l’abeille domestique est indigène, la coévolution naturelle entre l’abeille domestique et les abeilles sauvages a probablement limité la compétition entre ces groupes (Goras et al. 2016).
1.5.7. Compétition pour les nids
Les abeilles domestiques nichent dans des cavités, tout comme des abeilles sauvages, des mammifères et des oiseaux. Cette situation pourrait entraîner de la compétition entre ces organismes pour l’accès aux sites de nidification (Goulson 2003; Veiga et al. 2013). Peu d’exemples existent en lien avec les abeilles sauvages, mais ce fut la cas pour le pétrel des Bermudes, où l’abeille domestique occupait les terriers de l’espèce et nuisait à son rétablissement (Madeiros et al. 2012). La présence de l’abeille domestique peut aussi compliquer les projets de conservation d’oiseaux ou de polatouches utilisant des nichoirs, car elle colonise ceux-ci plus rapidement que les locataires désirés (Efstathion et al. 2015; Prange and Nelson 2007).
1.5.8. Apiculture urbaine
L’apiculture urbaine connait une popularité grandissante depuis quelques décennies (Geslin et al. 2013). Plus de 1000 ruches ont été installées à Paris (Rubin 2018) et Montréal (Duchemin, 2018, communication personnelle). De 2008 à 2013, le nombre d’apiculteurs londoniens a triplé, passant de 464 à 1237, pendant que le nombre de ruches doublait,
15
passant de 1677 à 3500 (Alton and Ratnieks 2016). On retrouve maintenant 373 ruches sur les toits de New York alors que l’apiculture urbaine y était interdite jusqu’en 2010 (Licea 2018).
1.6. Impacts du paysage urbain sur les abeilles sauvages
1.6.1. Introduction à l’urbanisation
L’urbanisation est l’augmentation du taux de la population vivant en ville et les modifications à l’environnement et à l’utilisation des sols qui en découlent. Elle modifie de façon importante les milieux naturels en causant notamment la perte ou la fragmentation de ceux-ci (McKinney 2006). L’augmentation des surfaces imperméables (routes, bâtiments) et l’aménagement de la végétation sont probablement les modifications les plus visibles à l’environnement (Ahrné et al. 2009; Kearns and Oliveras 2009). Globalement, le tiers de la surface terrestre est maintenant urbanisé et un demi pourcent est même recouvert de surface imperméable (Liu et al. 2014). Selon les Nations Unies, près de la moitié de la population mondiale vit maintenant en ville et ce taux grimpera à 66% d’ici 2050 (United Nations 2014).
Certaines espèces vont être impactées négativement alors que d’autres vont tirer profit des modifications de l’habitat dues à l’urbanisation, particulièrement la fragmentation (Koh and Sodhi 2004; Magura et al. 2004; McGeoch and Chown 1997). Deux caractéristiques de base définissent la fragmentation, soit une réduction de la surface totale d’habitat et une réduction de la connectivité entre les parcelles (Fahrig 2003). Une conséquence de la fragmentation est souvent l’augmentation de l’hétérogénéité spatiale, c’est-à-dire du nombre de types d’utilisation de sol et de leur complexité spatiale (Fahrig et al. 2011). Les villes sont d’ailleurs considérées comme des milieux très hétérogènes (Cadenasso et al. 2007; Rebele 1994). La fragmentation et les pertes d’habitat sont souvent identifiées comme les causes principales du déclin chez les communautés de pollinisateurs (Harrison et al. 2015; Senapathi et al. 2015).
16
Plusieurs études ont démontré que les villes abritent souvent des communautés importantes de pollinisateurs et qu’elles doivent faire l’objet de considérations importantes en termes de conservation (Banaszak-Cibicka and Zmihorski 2012; Hall et al. 2017). Cent-quatre espèces ont notamment été capturées dans une ville de Pologne (Banaszak-Cibicka and Zmihorski 2012), 108 à Boulder (Kearns and Oliveras 2009), 58 à Birmingham (Bates et al. 2011), 74 à Paris (Geslin et al. 2016), 291 à Lyon, 177 à Montréal et 152 à Québec (Normandin et al. 2017). Au Royaume-Uni, 22% des espèces et 58% des genres d’abeilles du pays ont été récoltés dans un rayon de 500 mètres du centre de Northampton (Sirohi et al. 2015). Une étude de faible envergure a aussi permis la capture de 62 espèces à Berlin, soit 20% des taxons connus pour la région (Fischer et al. 2016). Les jardins communautaires jouent un rôle important pour la conservation des abeilles à New York (Matteson et al. 2008), 54 espèces représentant 13% des espèces répertoriées dans l’état de New York y ayant été collectées. La récolte de 110 espèces dans le comté de Westchester dans l’état de New York a permis d’obtenir une communauté d’abeilles très semblable à celle d’une réserve naturelle à proximité (Fetridge et al. 2008).
1.6.3. Pollinisateurs sauvages en milieu urbain : impact de l’urbanisation
L’urbanisation a parfois des impacts négatifs sur les pollinisateurs (Deguines et al. 2012), particulièrement à de plus forts niveaux d’urbanisation (McKinney 2008). Dans une étude le long d’un gradient d’urbanisation à Birmingham, l’abondance et la richesse des abeilles étaient plus élevées en milieu rural qu’urbain (Bates et al. 2011). Au niveau individuel, davantage d’espèces répondaient de façon négative à l’urbanisation que de façon positive. Dans ce gradient, le niveau d’urbanisation était généralement colinéaire à la qualité de l’habitat en terme de ressources florales et de microclimats (faible altitude et exposition aux vents) (Bates et al. 2011). Des effets semblables de l’urbanisation sur l’abondance et la richesse des pollinisateurs ont été observés à Paris (Geslin et al. 2013), dans l’ensemble de la France (Deguines et al. 2016), autour de la baie d’Osaka (Ushimaru et al. 2014), à Phoenix (McIntyre and Hostetler 2001), dans le Kentucky (Larson et al. 2014) et dans les jardins communautaires de New York (Matteson et al. 2008) et de la Californie (Plascencia and Philpott 2017). Au Michigan, l’abondance et la diversité des bourdons diminuaient avec l’urbanisation, mais seulement les femelles étaient affectées
17
(Glaum et al. 2017). En Californie, même l’abondance de l’abeille domestique diminuait avec l’urbanisation, alors qu’elle augmentait lorsque les ressources florales étaient davantage dispersées (Plascencia and Philpott 2017).
Certaines études présentent des réponses mitigées des pollinisateurs à l’urbanisation. Les abeilles peuvent notamment être plus tolérantes à la trame urbaine que les autres insectes (Deguines et al. 2012). Ainsi, l’urbanisation a un impact variable sur les communautés d’abeilles des prairies urbaines de Berlin, certaines espèces étant affectées négativement par le degré d’urbanisation alors que d’autres profitent de ces transformations à l’habitat (Fischer et al. 2016). L’abondance et la diversité des abeilles sauvages ne diminuent pas non plus avec l’urbanisation de la ville de Poznań en Pologne (Banaszak-Cibicka and Zmihorski 2012), de Northampton au Royaume-Uni (Sirohi et al. 2015), de l’ensemble du Royaume-Uni (Baldock et al. 2015), de la Belgique (Verboven et al. 2014), de l’île de Vancouver (Wray et al. 2014) ou de Boulder au Colorado (Kearns and Oliveras 2009). L’étude de données historiques au Royaume-Uni a révélé que l’urbanisation cause une diminution du nombre d’espèces de pollinisateurs plus faible que l’augmentation de l’agriculture (Senapathi et al. 2015).
Aussi, même si l’urbanisation provoque la fragmentation de l’habitat et une perte de milieux naturels, il n’en demeure pas moins qu’elle apporte des composantes intéressantes pour les pollinisateurs (Banaszak-Cibicka and Zmihorski 2012; Martins et al. 2017a). Le paysage urbain comporte en effet des espaces verts ayant une importante diversité de plantes à fleurs (Baldock et al. 2015; Frankie et al. 2005; Loram et al. 2007), des opportunités de nidification dans les cavités de plusieurs structures anthropiques et naturelles (Cane et al. 2006; McFrederick and LeBuhn 2006; Neame et al. 2013) et une hétérogénéité spatiale importante apportant son lot d’habitats variés (Thompson et al. 2003). La richesse, l’abondance et la diversité fonctionnelle des abeilles augmentait notamment avec l’urbanisation en Montérégie (Martins et al. 2017a). Les villes constituent donc, dans bien des cas, des sites névralgiques pour la conservation des abeilles (Hall et al. 2017).
18
L’hétérogénéité du milieu urbain peut influencer positivement les communautés d’abeilles. La richesse des communautés d’abeilles sauvages est maximale à un niveau moyen de surfaces imperméables, soit autour de 50%, ce qui correspond aux prédictions du modèle d’hétérogénéité des perturbations (Fortel et al. 2014). Ce modèle veut que l’hétérogénéité d’un habitat soit optimale pour une grande diversité d’espèces autour de 50% de surfaces perturbées, la diversité diminuant sous et au-dessus de ce seuil puisque l’habitat devient plus homogène (Kolasa and Rollo 1991; Porter et al. 2001). Conformément à ce modèle, il a été démontré en Caroline du Nord qu’une urbanisation modérée peut avoir des effets positifs sur les abeilles. Ainsi, les forêts suburbaines abritent une abondance et une richesse d’abeilles plus élevées, et ce, peu importe les traits d’histoire de vie des abeilles (Carper et al. 2014). De la même manière, autour de Phoenix (Arizona, É-U), l’abondance des abeilles sauvages est maximale dans les parcelles de désert bordant le milieu urbain, des secteurs moyennement perturbés (McIntyre and Hostetler 2001). L’échelle à laquelle se produit la fragmentation et la taille des parcelles peuvent aussi être très importantes pour les communautés d’abeilles sauvages (Hinners et al. 2012). Les parcelles de prairie plus grandes et celles entourées d’un milieu périurbain possèdent en effet des communautés d’abeilles plus diversifiées. Cela s’explique par l’abondance plus importante en ressources dans les grandes parcelles et par la diversité de ressources favorisée par la proximité du milieu urbain (Hinners et al. 2012).
1.6.4. Pollinisateurs sauvages en milieu urbain : les ressources florales
Les ressources florales (pollen et nectar) étant les ressources les plus importantes pour les abeilles sauvages, elles expliquent souvent leur abondance et leur diversité en ville (Kearns and Oliveras 2009). Cependant, ces ressources ne sont pas distribuées aléatoirement et certains types d’aménagements urbains, d’espaces verts et de quartiers sont plus intéressants. Les communautés d’abeilles sont donc liées indirectement aux humains par le lien entre les humains et les fleurs. Ainsi, les quartiers ayant une densité humaine plus élevée (maisons multifamiliales) possèdent une plus grande diversité de fleurs que les secteurs moins denses (maisons unifamiliales, secteurs commerciaux ou industriels) (Lowenstein et al. 2014; Matteson et al. 2008). Les secteurs densément peuplés possèdent
19
aussi des opportunités de nidification dans les structures humaines et un couvert de surface imperméable semblable aux secteurs peu peuplés (Lowenstein et al. 2014).
Les parcs urbains sont considérés comme des sites importants pour la conservation des pollinisateurs en milieu urbain, notamment parce qu’ils possèdent d’importantes ressources florales. Les pollinisateurs sont, en effet, plus abondants ou plus diversifiés dans les parcs et les espaces naturelles de Melbourne, de New York et de la Montérégie que dans d’autres types de milieux (jardins résidentiels, terrains de golf, secteurs commerciaux) (Martins et al. 2017a; Matteson et al. 2013; Threlfall et al. 2015). Il a aussi été observé à Paris, Montréal et Buenos Aires que les grands parcs peuvent supporter des communautés d’abeilles diversifiées (Geslin et al. 2015; Mazzeo and Torretta 2015; Normandin et al. 2017).
Les jardins et plates-bandes représentent aussi des habitats très intéressants pour les abeilles (Ahrné et al. 2009; Gunnarsson and Federsel 2014; Matteson and Langellotto 2009; Normandin et al. 2017). Les jardins ayant des communautés florales riches et diversifiées abritent souvent plus d’abeilles (Frankie et al. 2005). À Montréal et Québec, les jardins abritent des communautés d’abeilles plus abondantes que les cimetières (Normandin et al. 2017). À New York, San Francisco et Chicago, les pollinisateurs sauvages peuvent offrir un service de pollinisation très important pour l’agriculture urbaine dans les jardins communautaires (Lowenstein et al. 2015; Matteson and Langellotto 2009; Potter and LeBuhn 2015).
1.6.5. Pollinisateurs sauvages en milieu urbain : urbanisation et nidification
Le comportement de nidification des pollinisateurs semble être à la base de leur capacité d’adaptation au milieu urbain (Cane et al. 2006; Xie et al. 2013). Les espèces nicheuses de sol sont particulièrement sensibles à l’urbanisation puisqu’elles requièrent un sol nu pour établir leur nid (Cane et al. 2006; Xie et al. 2013) et que les conditions de nidification dans le sol en zones urbaines sont souvent mauvaises dû à l’érosion, l’absence de sol nu et la compaction des sols (Cane 2005; Cane et al. 2006). De plus, l’entretien des parcs et prairies urbaines (tonte, retrait de la litière de feuilles, pâturage) nuit à la
20
nidification des abeilles qui nichent dans le sol (Kearns and Oliveras 2009; Mazzeo and Torretta 2015; Wastian et al. 2016). Ces terrains permettent pourtant la nidification des abeilles et fournissent d’importantes ressources florales (Lowenstein et al. 2014).
L’augmentation de la proportion de surfaces imperméables cause une diminution de l’abondance et de la richesse des abeilles nicheuses de sol à Paris (Geslin et al. 2016; Geslin et al. 2015), Chicago (Lowenstein et al. 2014), dans les prairies du Colorado (Kearns and Oliveras 2009) et à Tucson en Arizona (Cane et al. 2006). D’un autre côté, en Pologne et dans l’état de New York, les espèces nichant au sol sont plus abondantes dans le milieu urbain (Banaszak-Cibicka and Zmihorski 2012; Fetridge et al. 2008) et des nids d’abeilles sont observés dans le sol de plusieurs jardins de la Californie (Frankie et al. 2005). Dans les jardins, la taille des sites et le type de recouvrement du sol (sol nu, feuilles mortes ou paillis) expliquent l’abondance et la richesse des espèces nicheuses de sol (Quistberg et al. 2016).
De leur côté, les espèces nicheuses de cavité peuvent profiter des opportunités offertes par les structures humaines pour établir leur nid (Cane et al. 2006; Lowenstein et al. 2014; Matteson et al. 2008). Le mortier des murs, les cabanes à oiseaux (Bates et al. 2011; Sirohi et al. 2015) et les structures artificielles dans les jardins (Matteson et al. 2008) peuvent notamment être utilisés. Le couvert de feuilles mortes et l’abondance des plantes herbacées peuvent représenter des opportunités de nidification pour ces espèces, tout comme les jardins de grande taille, qui abritent notamment davantage de ressources florales, mais aussi davantage de structures humaines où les abeilles peuvent nicher (Quistberg et al. 2016). Les nichoirs à abeilles et les carrés de sol aménagés par l’homme permettent aussi la nidification des abeilles en ville (Fortel et al. 2016; MacIvor 2017; Macivor and Packer 2015).
1.6.6. Pollinisateurs sauvages en milieu urbain : urbanisation et spécialisation
Le niveau de spécialisation des abeilles par rapport aux ressources florales semble aussi avoir un impact sur leur tolérance face à l’urbanisation. L’abondance des espèces généralistes est souvent plus importante que celle des spécialistes en milieu urbain. En
21
Belgique, la communauté d’abeilles en ville est davantage homogène et dominée par quelques espèces bien adaptées (Verboven et al. 2014). Les abeilles observés en ville dans toute la France étaient notamment plus généralistes (Deguines et al. 2016), tout comme ceux d’un gradient d’urbanisation à Birmingham (Bates et al. 2011), des jardins de l’état de New York (Fetridge et al. 2008), des parcs de Buenos Aires (Mazzeo and Torretta 2015) et à Montréal (Normandin et al. 2017). De façon générale, tout changement environnemental aura des impacts plus grands sur les espèces spécialistes qui ont moins de marge de manœuvre pour s’adapter aux modifications de leur milieu (Clavel et al. 2011; Scheper et al. 2014). Les abeilles généralistes sont plus aptes à trouver les ressources alimentaires dont elles ont besoins dans les sites où les plantes exotiques ont remplacé la flore indigène (Frankie et al. 2009) et elles sont moins sensibles que les espèces spécialistes à l’extinction (Packer et al. 2005).
1.6.7. Pollinisateurs sauvages en milieu urbain : urbanisation et taille des
abeilles sauvages
La taille des abeilles influence aussi leur réponse à l’urbanisation. Puisque les grosses abeilles peuvent parcourir une distance plus importante lors de la recherche de ressources et qu’elles ont de meilleures capacités de vol (Greenleaf et al. 2007), elles sont généralement moins sensibles à l’urbanisation que les petites qui se déplacent sur de plus faibles distances et sont donc davantage influencées par la qualité des parcelles à proximité (Gathmann and Tscharntke 2002; Geslin et al. 2013; Geslin et al. 2016). La taille du corps étant corrélée à celle des pièces buccales (Stang et al. 2006) et la distance de vol, ces petites espèces seraient aussi plus spécialistes et moins mobiles, rendant difficile les déplacements entre les parcelles d’habitats hautement rentables dans un milieu fragmenté (Gathmann and Tscharntke 2002; Greenleaf et al. 2007). Il a toutefois été observé que les espèces habitant la ville sont parfois plus petites que celles habitant en périphérie (Banaszak-Cibicka and Zmihorski 2012; Wray et al. 2014). Les ressources florales limitées au cœur de la ville peuvent expliquer cette différence (Banaszak-Cibicka and Zmihorski 2012).
22
Les espèces sociales et actives tard en saison coloniseraient plus facilement les milieux urbains (Banaszak-Cibicka and Zmihorski 2012). L’importance de la date d’activité des abeilles peut s’expliquer par les ressources florales insuffisantes au printemps dans le centre-ville (Banaszak-Cibicka and Zmihorski 2012). Pour ce qui est de la sociabilité, elle permettrait une plus grande plasticité comportementale et écologique, ce qui faciliterait l’adaptation au milieu urbain (Banaszak-Cibicka and Zmihorski 2012).
1.6.9. Îlots de chaleur
La température des grandes villes est généralement plus élevée que celle des milieux naturels ou agricoles environnants (Hart and Sailor 2009; OECD 2010; Oke 1973). On appelle îlots de chaleur ces secteurs anormalement chauds. Plusieurs raisons expliquent cette augmentation artificielle de la température, dont la diminution du couvert de végétation (Jenerette et al. 2011) et l’augmentation des surfaces imperméables (Hart and Sailor 2009). En effet, les surfaces imperméables réfléchissent moins de rayons du soleil (faible albédo), absorbent davantage de chaleur (capacité thermique des bâtiments) et la retiennent plus longtemps que ne le fait la végétation (OECD 2010; Oke and Maxwell 1975). De plus, à cause de l’énergie qui y est consommée, il y a davantage de chaleur perdue en ville (OECD 2010) et la pollution crée un dôme qui retient davantage de chaleur (Oke and Maxwell 1975). Les surfaces imperméables modifient aussi le cycle de l’eau en réduisant l’évapotranspiration (Oke and Maxwell 1975), comparativement à la végétation qui procure ombre et humidité rafraîchissante (OECD 2010). La température de ces îlots de chaleurs urbains augmente de façon logarithmique avec la population d’une ville (Oke 1973), étant en moyenne de 1 à 3 °C plus élevée (Voogt 2002), mais pouvant atteindre une différence de 10 (OECD 2010) ou 12 °C par rapport au milieu rural dans les agglomérations importantes (Angilletta et al. 2007; Voogt 2002). Les îlots de chaleur sont non seulement caractérisés par des températures plus élevées le jour, mais aussi par un refroidissement beaucoup moins important la nuit (Oke and Maxwell 1975). Les îlots de chaleur deviennent maintenant de plus en plus importants avec l’augmentation de l’urbanisation, mais aussi avec le réchauffement climatique global (Kalnay and Cai 2003).
23
La température étant un facteur clé de la plupart des processus biologiques (Angilletta et al. 2002; Brown et al. 2004; Huey and Stevenson 1979), il est attendu que les conditions de température particulières des villes aient des impacts importants sur la physiologie et la phénologie (Fründ et al. 2013) des organismes y habitant. Les ectothermes, dont les insectes, pourraient être particulièrement affectés puisque la température est responsable du développement chez plusieurs taxons (Briere et al. 1999). Parmi les impacts possibles, une plus grande tolérance à la chaleur et une plus faible tolérance au froid sont attendues des individus urbains (Angilletta et al. 2007; Lynch and Gabriel 1987). Une plus grande tolérance à la chaleur a été observée chez les fourmis de São Paulo par rapport à celles du milieu rural, sans impact sur leur tolérance au froid (Angilletta et al. 2007). L’acclimatation à la chaleur semble aussi expliquer les épidémies plus importantes du parasite Parthenolecanium quercifex sur les arbres de Raleigh en Caroline du Nord (Meineke et al. 2013).
La température plus élevée des milieux urbains pourrait agir comme un filtre en fonction de la tolérance des espèces de pollinisateurs aux températures élevées et même occasionner des changements dans leur phénologie (Harrison et al. 2015). Les espèces printanières émergeaient d’ailleurs plus tôt avec une augmentation de la température hivernale, alors que certaines abeilles d’été retardaient leur émergence (Fründ et al. 2013). Les températures chaudes affectent aussi la masse des espèces qui hibernent à l’état adulte, celles-ci perdant davantage de poids durant l’hiver à cause de leur activité métabolique élevée (Fründ et al. 2013).