COMPARAISON DES EFFETS DIFFERENTIELS
DES ACIDES GRAS SATURÉS ET TRANS ET DES
ACIDES GRAS MONOINSATURÉS ET
POLYINSATURÉS SUR LA LIPÉMIE
POSTPRANDIALE ET L'EXPRESSION DE GÈNES
DU MÉTABOLISME LIPIDIQUE CHEZ DES
SUJETS SAINS
Mémoire présenté
à la Faculté des études supérieures et postdoctorales de l'Université Laval dans le cadre du programme de maîtrise en nutrition
pour l'obtention du grade de maître es sciences (M.Sc.)
DEPARTEMENT DES SCIENCES DES ALIMENTS ET DE NUTRITION FACULTÉ DES SCIENCES DE L'AGRICULTURE ET DE L'ALIMENTATION
UNIVERSITÉ LAVAL QUÉBEC
2012
La réponse postprandiale suite à une prise alimentaire serait reliée au risque cardiovasculaire. Le type de lipides alimentaires pourrait influencer cette réponse, entre autres via leurs effets sur les chylomicrons et la lipémie postprandiale, mais également via des effets potentiels sur le métabolisme lipidique global. Aucun consensus n'existe sur les effets postprandiaux aigus des différents lipides alimentaires, nécessitant d'investiguer les mécanismes sous-jacents potentiels. L'objectif de ce mémoire est donc d'étudier les effets différentiels aigus des gras saturés et trans et des gras monoinsaturés et polyinsaturés sur la lipémie postprandiale, mais également sur l'expression de gènes clés impliqués dans le métabolisme lipidique. Les résultats indiquent qu'un seul repas riche en gras saturés-Krans diminue la lipémie postprandiale et induit une régulation à la baisse d'un gène impliqué dans l'absorption intestinale des lipides alimentaires.
Il y a déjà un an et demi, je me présentais à l'LNAF pour ma première journée en tant qu'étudiante à la maîtrise. Je n'avais pas eu la chance de travailler en recherche pendant mes études au baccalauréat en nutrition et je ne savais donc pas trop par où commencer. J'ai eu la chance de côtoyer une équipe formidable, qui m'a accueillie comme si j'avais toujours été parmi elle et qui m'a donné tout l'aide dont j'avais besoin. L'INAF a été pour moi un milieu de travail formidable, où beaucoup d'amitiés se sont créées.
Je tiens à remercier spécialement mon directeur de recherche, le Dr Patrick Couture, qui m'a acceptée dans son équipe de recherche et m'a donné la possibilité de me plonger dans le monde de la recherche pour la toute première fois. J'ai eu la chance de travailler à plusieurs étapes d'un projet de recherche stimulant. Je le remercie pour sa confiance et pour m'avoir donné l'opportunité de développer mon autonomie, ce qui m'a permis d'apprendre énormément sur le monde de la recherche et sur moi-même. Même avec un horaire des plus chargé, il a chaque fois pris le temps de répondre à mes questions, et toujours avec un calme déconcertant! Il a été un très bon modèle pendant toutes mes études, merci!
Je tiens également à souligner l'appui de mon co-directeur de recherche, le Dr Benoît Lamarche, qui m'a dès le départ inclut dans son équipe au même titre que ses autres étudiantes. Je le remercie pour cette jovialité, ce dynamisme dont il fait preuve au quotidien. Même quand on se demande s'il lui reste du temps pour dormir, il prend le temps de discuter avec chacune d'entre nous, de répondre à nos questions et de suivre l'évolution de nos projets respectifs. Merci beaucoup pour tout ce soutien!
Je veux aussi remercier André Tremblay, qui m'a été d'une grande aide tout au long de ma maîtrise. Il a été un excellent « professeur » de laboratoire et a contribué à me faire sentir à l'aise dans un élément qui m'effrayait quelque peu. Je le remercie aussi pour les discussions toujours enrichissantes, qui ont quelques fois servi à me rassurer!
Qu'aurait été mon passage à l'LNAF sans la rencontre d'Amélie Charest et de Marie-Claude Lépine? Il y aurait certes eu un manque, car ce sont deux personnes exceptionnelles qui ont
des personnalités magnifiques! Dès le départ, elles ont été une référence dans l'orientation de mon projet et elles ont toujours été disponibles quand je ne trouvais pas les réponses à mes questions! C'est très apprécié de voir des gens qui ont le souci de transmettre leurs connaissances. Merci à vous deux, j'ai énormément apprécié vous côtoyer à travers vos rires et votre bonne humeur!
Je remercie également le personnel infirmier de l'unité clinique, Steeve Larouche, Myriam Bouchard et Danielle Aubin. Sans votre travail impeccable, le projet n'aurait pu se dérouler! Merci d'avoir si bien pris soin de mes participants qui ont passé près de l'évanouissement! Merci également à l'équipe de la cuisine, Sandra Gagnon, Marie-Pier Devost et Stéphanie Ouellet, qui ont été présentes pour m'aider et avec qui j'ai eu beaucoup de plaisir!
Un énorme merci aux participants du projet de recherche, qui n'aurait pu avoir lieu sans leur précieuse collaboration. Je les remercie infiniment d'avoir investi de leur temps!
Un merci tout spécial à mes collègues étudiants et étudiantes gradués ainsi qu'à toute l'équipe de professionnelles de recherche de l'LNAF!! Une équipe merveilleuse qui nous donne envie de venir travailler même les journées où la motivation est moins au rendez-vous. Le soutien que j'ai reçu de votre part n'a pas d'égal et c'est ce qui a contribué au plaisir de l'enrichissement de mon cheminement. Des activités sociales aux remises en questions professionnelles, en passant par les frustrations occasionnelles des études supérieures, je ne garderai que de bons souvenirs. Merci du plus profond de mon cœur!
Je termine en remerciant sincèrement mes amis, ma famille et mon amoureux qui, bien que ne connaissant pas grand chose à la recherche en nutrition, ont toujours eu le souci de s'informer de mon cheminement, de m'encourager et de me supporter dans les moments plus difficiles. J'ai la chance de côtoyer des personnes exceptionnelles avec un cœur gros comme la Terre. Merci d'être qui vous êtes et de contribuer à mon bonheur!
Résumé i Avant-Propos ii
Table des matières iv Liste des tableaux vi Liste des figures vii
Liste des abréviations 1 Chapitre I : Introduction générale 1
Chapitre II : Problématique 4 1. Métabolisme des lipoprotéines 4
1.1 Les lipoprotéines 4 1.2 Voies de synthèse 6
1.2.1 Synthèse exogène 6 1.2.2 Synthèse endogène 7 1.2.3 Transport inverse du cholestérol 8
1.3 Les lipoprotéines dans les maladies cardiovasculaires 8
2. Physiologie postprandiale 9 2.1 Un aperçu de la digestion 9 2.2 Les chylomicrons 10 2.2.1 Synthèse et sécrétion 10 2.2.2 Utilisation et clairance 12 2.3 La lipémie 14 2.4L'apoB-48 14 2.5 Les acides gras libres 15
2.6 L'insuline 16 2.7 Les effets de la consommation chronique des acides gras alimentaires de la
diète sur les paramètres postprandiaux 17
2.7.1 Lipémie postprandiale 18 2.7.2 Nombre et taille des particules 19
2.7.3 Insuline et acides gras libres 19 2.8 Les effets aigus des acides gras alimentaires sur les paramètres
postprandiaux 20 2.8.1 Lipémie postprandiale 20
2.8.2 Nombre et taille des particules en circulation 22
2.8.3 Insuline et acides gras libres 23
3. Gènes modulant le métabolisme des lipides et des lipoprotéines 24
3.1 Gènes modulant le métabolisme des chylomicrons 24 3.1.1 Trafic intracellulaire des acides gras à longues chaines 24
3.1.2 Assemblage et sécrétion 25 3.1.3 Utilisation et clairance 27 3.2 Facteurs de transcription 28
4. Hypothèses et objectifs 33
Chapitre m : Effets différentiels d'un repas riche en acides gras saturés et
trans et en acides gras monoinsaturés et polyinsaturés sur la lipémie
postprandiale 34
Chapitre IV : Conclusion 62
Tableau 1 : Caractéristiques des lipoprotéines 5
Tableau 2: Résumé des facteurs influençant la lipémie postprandiale 22
Figure 1 : Structure de base d'une lipoprotéine 5
Figure 2 : Métabolisme des lipoprotéines 6
Figure 3 : Absorption et synthèse du chylomicron 12
Figure 4 : Métabolisme des chylomicrons 13
Figure 5 : Concentrations postprandiales typiques de metabolites plasmatiques
ABCAl: Transporteur à cassette Al liant l'ATP {ATP-binding cassette transporter, sub-family A, member 1)
ACAT2 : Acétyl-CoA acétyltransférase 2 (Acetyl-CoA acetyltransferase 2) AG: Acides gras
AGL: Acides gras libres
AGMI: Acides gras monoinsaturés AGPI: Acides gras polyinsaturés AGS: Acides gras saturés
AGT: Acides gras trans Apos: Apolipoprotéines
ATGL : Lipase des triglycérides adipeux {Adipose triglycerides lipase)
CETP: Protéine de transfert des ester de cholestérol (Cholesterol ester transfer protein) Chol-HDL : Cholestérol des lipoprotéines de haute densité
Chol-LDL: Cholestérol des lipoprotéines de faible densité CM: Chylomicrons
CM-R: Résidu de chylomicron
DGAT1: Diacylglycérol O-acyltransférase-1 (Diacylglycerol O-acyltransjerase-1) DGAT2: Diacylglycérol O-acyltransférase-2 (Diacylglycerol O-acyltransferase-2) DHA: Acide docosahexaénoïque (Docosahexaenoic acid)
EPA: Acide eicosapentaéonïque (Eicosapentaenoic acid)
FAT/CD36: Translocase des acides gras/Groupe de Différenciation 36 (Fatty acid translocase/Cluster of Differentiation 36)
FATP4: Protéine de transport 4 des acides gras (Fatty acid transfer protein) HDL: Lipoprotéines de haute densité (High density lipoproteins)
IDL: Liprotéines de densité intermédiaire (Intermediate density lipoproteins)
LEABP: Protéine de liaison des acides gras associée à l'intestin (Intestinal fatty acid binding protein)
LL-6 : Interleukine 6
LNAF: Institut des nutraceutiques et des aliments fonctionnels
HMGCR : Reductase du 3-hydroxy-3-méthylglutaryl-coenzyme A (3-hydroxy-3-methylglutaryl-coenzyme A reductase)
IREip: Protéine 1 beta nécessitant l'inositol (Inositol-requiring I beta) LCAT: Lécithine cholestérol acyle transferase
LDL: Lipoprotéines de faible densité (Low density lipoproteins)
LFABP: Protéine de liaison des acides gras associée au foie (Liver fatty acid binding protein)
LHS: Lipase hormono-sensible LPL: Lipoprotéine lipase
LRP: Protéine apparentée aux récepteurs des LDL (LDL receptor-related protein) MCV: Maladies cardiovasculaires
MGAT2: Monoacylglycérol acyltransférase-2 (Acyl-CoA .monoacylglycerol acyltransferase-2)
NPC1L1: Transporteur de sterol Niemann-Pick Cl-like 1 (Niemann-Pick CI-like protein 1) PCSK9 : pro-protéine convertase subtilisine / kexine type 9 (Proprotein convertase
subtilisin/kexin type 9)
PL: Phospholipides
PPAR: Récepteur actif par les proliférateurs des peroxysomes (Peroxisome proliferated activated receptor)
r-ApoB48 : Récepteur de l'apoB-48
r-LDL : Récepteur des lipoprotéines de faible densité r-LRP : Récepteur de la protéine reliée aux lipoprotéines RE: Reticulum endoplasmique
RXR : Récepteurs aux rétinoïdes (Retinoid X receptor)
SARlp : Protéine de trafic membranaire SARip (Secretion-Associated and Ras-superfamily-related protein)
SCD : Désaturase stéaroyl-CoA (Stearoyl-CoA desaturase)
SREBP : Protéine liant l'élément de réponse aux sterols (Sterol regulatory element binding protein)
SR-B1 : Récepteur « éboueur » classe B type 1 (Scavenger receptor class B type 1)
TG: Triglycérides
TNF-a : Facteur de nécrose tumorale alpha (Tumor necrosis factor alpha) VLDL: Lipoprotéines de très faible densité (Very low density lipoproteins)
Le dernier siècle a été marqué par des changements drastiques de nos modes de vie qui ont eu des répercussions importantes sur l'état de santé des populations. Ainsi, nous avons pu observer un retrait presque complet des maladies infectieuses parallèlement à une augmentation fulgurante de d'autres problèmes de santé, telles que les maladies cardiovasculaires (MCV). Depuis le milieu des années 60, période où le taux de mortalité par MCV a atteint son maximum, on note une régression constante des décès d'environ 2% par an [1]. Bien que cette diminution soit positive, il n'en reste pas moins que les MCV représentaient près du tiers de tous les décès en 2008, engendrant des coûts économiques faramineux de près de 21 milliards de dollars par année [2, 3]. Il va sans dire qu'une amélioration constante de la compréhension des mécanismes associés aux MCV permettra une prise en charge précoce de celles-ci.
À travers les années, les recherches ont permis d'identifier plusieurs facteurs de risque associés aux MCV. Certains sont dits « non-modifiables », comme l'âge, le sexe et certaines prédispositions génétiques tandis que d'autres sont qualifiés de « modifiables ». Parmi ceux-ci on retrouve entre autres le tabagisme, la sédentarité, l'obésité ainsi que l'alimentation, incluant la consommation de gras saturés et trans [4]. Toutefois, la présence d'un bilan lipidique à jeun détérioré, i.e. des concentrations élevées de cholestérol non associés aux lipoprotéines de haute densité (non-HDL) et de faibles concentrations de cholestérol-HDL (chol-HDL), constitue le facteur de risque modifiable le plus fortement associé aux MCV [5].
Récemment, de plus en plus d'études rapportent que les concentrations postprandiales de triglycérides (TG), ou lipémie postprandiale, représenteraient aussi un facteur de risque de MCV, et ce indépendamment de tous les autres. D'ailleurs, deux études de grande envergure ont montré des associations beaucoup plus fortes entre les concentrations de TG non à jeun et l'incidence d'événements cardiovasculaires, suggérant que des réponses pourraient résider dans les mécanismes régulant la période postprandiale [6, 7]. Ainsi, des études se sont attardées aux chylomicrons (CM), les
De ce fait, des études ont rapporté des liens directs entre l'alimentation et la lipémie postprandiale. Lairon et coll. rapportent entre autres que la quantité de lipides du repas ainsi que la présence de d'autres composants tels que les fibres alimentaires, les glucides digestibles et l'alcool, représenteraient les facteurs alimentaires ayant le plus d'influence sur les valeurs de lipémie postprandiale [8]. Plusieurs auteurs attribuent également des effets aux différents types de lipides alimentaires, mais il semble plus difficile de tirer des conclusions claires à ce sujet, étant donné les résultants divergents observés dans les études [9], Il serait donc utile d'investiguer de nouveaux éléments pouvant nous donner davantage d'informations sur les effets différentiels des acides gras (AG) alimentaires sur le métabolisme lipidique postprandial et également sur le risque cardiovasculaire.
C'est donc dans cette perspective que nous avons réalisé, à l'Institut des nutraceutiques et des aliments fonctionnels (LNAF) de l'Université Laval, un repas expérimental en chassé-croisé et à simple insu, dans le but de comparer les effets aigus postprandiaux des acides gras alimentaires saturés et trans avec ceux des AG mono- et polyinsaturés. Plus précisément, l'objectif du projet était d'examiner les effets de ces acides gras sur la lipémie postprandiale et l'expression de gènes du métabolisme lipidique, afin de voir si des effets différentiels pouvaient être observés et associés à des variations de l'expression génique.
Ce mémoire est divisé en plusieurs chapitres. Le chapitre II présentera des éléments de la littérature en lien avec le métabolisme des lipoprotéines, la physiologie postprandiale ainsi que l'expression de gènes du métabolisme lipidique. Le chapitre ITJ présentera un article scientifique qui sera soumis pour publication et qui décrit les effets différentiels d'un repas riche en gras saturés et trans et riche en gras mono- et polyinsaturés sur la lipémie postprandiale et explore l'expression de gènes du métabolisme lipidique.
1. Métabolisme des lipoprotéines
Le métabolisme des lipoprotéines constitue un terme général pour définir l'ensemble des mécanismes associés à la transformation de celles-ci, via leur synthèse, leur utilisation et leur clairance. Il s'agit d'un processus dynamique complexe impliquant plusieurs récepteurs et enzymes qui compliquent l'étude de ces mécanismes. Toutefois, une compréhension adéquate de ces derniers est essentielle afin d'optimiser la gestion des lipides et du cholestérol plasmatiques et ainsi pouvoir agir plus efficacement et plus rapidement sur certains facteurs de risques de MCV.
1.1 Les lipoprotéines
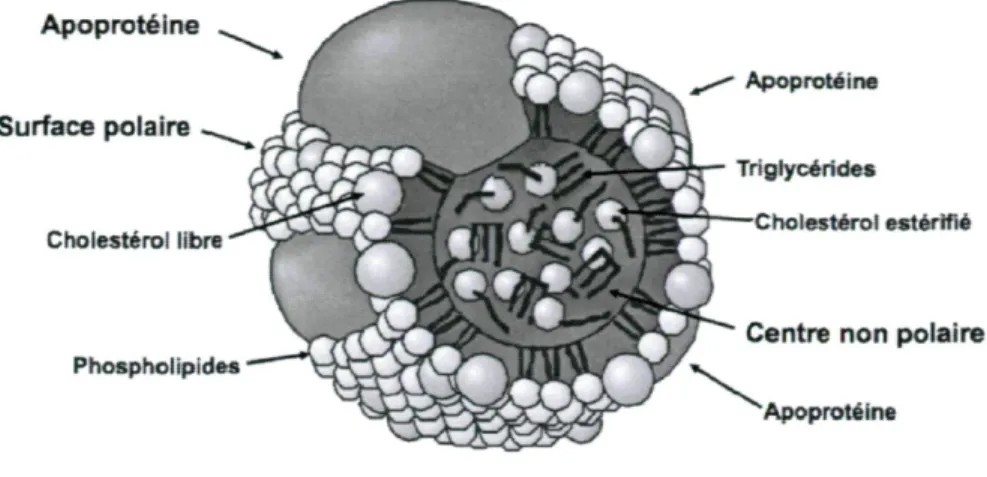
Les lipoprotéines sont des particules servant au transport de différents nutriments dans l'organisme, dont des TG, du cholestérol et des vitamines liposolubles. Elles sont constituées d'un noyau non polaire de TG et de cholestérol estérifiés recouvert d'une surface polaire de phospholipides (PL) et de cholestérol libre [10] (Figure 1). Elles diffèrent de par leurs compositions et leurs caractéristiques physico-chimiques et sont regroupées en différentes classes (Tableau 1). Chacune de ces classes assurent des fonctions particulières, déterminées par les apolipoprotéines (apos), constituants protéiques solubles synthétisés par le foie et l'intestin et régulant le métabolisme des lipoprotéines [11]. Les apos remplissent plusieurs rôles, dont celui d'assurer la structure de la lipoprotéine. Elles permettent également la liaison tissulaire via différents récepteurs ainsi que la modulation d'enzymes spécifiques. Tout comme les lipoprotéines, on retrouve plusieurs classes et sous-classes d'apos qui ont chacune un rôle distinctif. Plusieurs de ces apos peuvent être interchangées entre les lipoprotéines tandis que d'autres, comme l'apoB-100 et l'apoB-48, ne le sont pas.
Apoprotéine Surface polaire Cholestérol libre Phospholipides Apoprotéine Triglycérides Cholestérol estérifié
Centre non polaire Apoprotéine
Tableau 1 : Caractéristiques des lipoprotéines
Lipoprotéines Diamètre Densité ApoUpoprotÊiaes (nm) (g/dL) principales Lipides (%) Chylomicrons 75-1200 0,95 TG £hfll PL B-48,C-II,E 80-95 2-7 3-9 VLDL 30-80 0,95-1,006 B-100,C-II,E 55-80 5-15 2-10 IDL 25-35 1,006-1,019 B-100.E 20-50 20-40 2-15 LDL 18-25 1,019-1,063 B-100 5-15 40-50 2-20 HDL 5-12 1,063-1,210 A,E 5-10 15-25 20-30
Adapté de : Lamarche B. Métabolisme des lipoprotéines. Cours : Lipidologie 1 : Métabolisme des lipoprotéines, Université Laval. 2011, et Tulenko, T, et Sumner A. J Nucl Cardiol. 2002 [12, 13].
Les lipoprotéines sont produites par deux voies principales : la voie exogène et la voie endogène. La régulation de ces deux voies est étroitement liée et permet l'atteinte d'un équilibre essentiel entre les taux de production et de clairance, dans lequel le transport inverse du cholestérol joue un rôle majeur (figure 2).
Figure 2 : Métabolisme des lipoprotéines [12]
CHYLO
Constituants de
CHVLO et VLDL
LH, EL
1.2.1 Synthèse exogène
L'intestin est le principal organe impliqué dans la synthèse des CM, ces lipoprotéines dites exogènes étant donné leur transport des lipides d'origine alimentaire [14]. Cette voie reflète donc l'absorption des lipides alimentaires, du cholestérol et des PL, leur intégration subséquente dans les CM et leur apparition éventuelle dans la circulation sanguine. L'explication détaillée de la voie de synthèse exogène fera l'objet de la section 2. Bien que cette voie ait eu moins de considérations antérieurement, de plus en plus d'évidences
1.2.2 Synthèse endogène
Le foie est également un organe majeur de la régulation du métabolisme lipidique. En plus d'être impliqué dans la clairance des résidus de CM (CM-R) de la circulation sanguine, il est également le chef d'orchestre de la synthèse des lipoprotéines endogènes en plus d'être fortement impliqué dans leur clairance.
Les lipoprotéines de faible densité (VLDL) sont produites par le foie, lequel transfère des TG et du cholestérol estérifié d'origine exogène et endogène ainsi que des vitamines liposolubles à une molécule d'apoB-100 [13]. Ces lipoprotéines peuvent différer de par leur diamètre et leur contenu en TG. D'ailleurs, ce sont les VLDL qui sont majoritairement responsables des variations plasmatiques de TG à jeun [16]. Une fois matures, les VLDL contiennent d'autres apos à leur surface, dont l'apoE et l'apoC-II [13]. Cette dernière permettra la liaison à la lipoprotéine lipase (LPL) présente à la surface endothéliale des tissus musculaires, cardiaques et adipeux principalement, pour permettre l'hydrolyse des TG et la captation des AG et de d'autres nutriments par la cellule [17]. La diminution du contenu en TG a pour conséquence de réduire la taille des VLDL jusqu'à l'obtention de lipoprotéines de densité intermédiaire (LDL). Une bonne proportion de ces dernières seront directement captées par le foie, mais environ 30 à 40% d'entre elles verront leur TG et leurs PL hydrolyses par la lipase hépatique pour former ultimement des lipoprotéines de faible densité (LDL) ayant perdu leurs apoE et apoC et ne présentant elles aussi qu'une seule molécule d'apoB-100 par particule [12]. À ce stade, les LDL ne contiennent que très peu de TG, mais beaucoup de cholestérol [12, 18]. Il est important de noter encore une fois que le processus de synthèse hépatique et d'hydrolyse des lipoprotéines est dynamique et que les différentes classes ne sont pas clairement définies. D'ailleurs, de par leur contenu en TG, on retrouvera en circulation des LDL de différentes tailles et densité [19]. Les LDL se lieront subséquemment à différents récepteurs reconnaissant l'apoB et l'apoE, principalement les récepteurs LDL (r-LDL) et la protéine apparentée aux récepteurs des
1.2.3 Transport inverse du cholestérol
Le foie et les cellules de la muqueuse intestinale produisent également des lipoprotéines de haute densité (HDL) qui sont responsables du transport inverse du cholestérol des tissus périphériques vers le foie [13]. Elles sont tout d'abord produites sous forme de pré-|3-HDL et capteront différentes apos (A-I, A-LV et E) provenant de la dégradation des CM et des VLDL. Les HDL3 ainsi formées capteront du cholestérol des tissus périphériques et formeront, sous l'action de la lécithine cholestérol acyle transferase (LCAT), des HDL2 matures qui conduiront le cholestérol vers le foie [13]. De plus, la protéine de transfert des esters de cholestérol (CETP) permettra l'échange de TG des VLDL et LDL contre des esters de cholestérol des HDL2. Le récepteur « éboueur » classe B type 1 (SR-B1) exprimé dans la membrane de plusieurs tissus dont le foie, est également essentiel afin de permettre la liaison du HDL aux cellules pour ainsi assurer le transport du cholestérol des tissus périphériques au foie [21].
1.3 Les lipoprotéines dans les maladies cardiovasculaires
Il y a déjà plusieurs décennies, certaines lipoprotéines ont été associées à la survenue d'événements cardiovasculaires. L'étude de Framingham a été une étude majeure dans l'établissement de certains facteurs de risque dont l'hypercholestérolémie [22]. D'un côté, le chol-HDL a été inversement associé aux MCV et de l'autre, les taux de cholestérol des LDL (chol-LDL) ont été associés au risque cardiovasculaire [13]. En effet, il est bien établi que ce dernier est étroitement impliqué dans le développement de la strie lipidique et sa diminution via l'utilisation des statines constitue une stratégie primaire dans la prévention et la régression des maladies coronariennes [23, 24].
En plus des taux de chol-LDL, une augmentation concomitante de l'apoB-100 augmenterait encore davantage le risque de MCV [25]. L'apoB-100 reflète le nombre de particules LDL en circulation ainsi que le nombre de particules de d'autres lipoprotéines athérogènes telles les VLDL, les IDL et la lipoprotéine (a) qui est une variante de particule LDL [12, 26]. De
important [27]. Des auteurs suggèrent également l'utilisation de l'apoA-I, reflétant le nombre de particules de HDL en circulation, ainsi que du ratio apoB/apoA-I, afin de dépister le risque cardiovasculaire chez des gens aux concentrations plasmatiques de TG, de chol-LDL et de chol-HDL normales [5, 28].
Outre les concentrations de lipoprotéines d'origine endogène, on considère de plus en plus l'implication des lipoprotéines d'origine intestinale ou exogène dans le risque cardiovasculaire [29, 30]. En effet, des auteurs suggèrent que les CM-R, qui sont petits et enrichis en cholestérol, pourraient agir comme initiateurs du processus athérosclérotique en pénétrant dans l'espace sous-endothéliale [31, 32]. Toutefois, des évidences démontrent que toutes les lipoprotéines riches en TG, soit les CM, les VLDL ainsi que leurs résidus respectifs, contribueraient au développement de la plaque athéromateuse [29, 33, 34]. Une étude de Proctor et coll. rapporte cependant que l'accumulation net de cholestérol dans la paroi artérielle proviendrait principalement des CM-R plutôt que de d'autres lipoprotéines, malgré une affinité similaire de ces derniers pour les différents ligands [35]. Les CM-R ont également été associés à une détérioration de la fonction endothéliale, un des principaux marqueurs d'athérosclérose, et méritent donc une attention particulière [36, 37].
2. Physiologie postprandiale
Étant donné les prises alimentaires multiples présentes quotidiennement, la majorité des gens passent la plus grande partie de leur temps éveillé à l'état postprandial. Cet état est dynamique, irrégulier et un remodelage continuel s'opère entre les différentes fraction de lipoprotéines, ce qui en rend l'étude de cet état plus complexe que celui de l'état à jeun [9].
2.1 Un aperçu de la digestion
Nous consommons quotidiennement plusieurs repas contenant une quantité variable de lipides ou TG alimentaires, allant de 20 à 70g [8]. Suite à une hydrolyse et émulsification partielle dans l'estomac, les lipides arrivent dans l'intestin grêle, où ils sont émulsionnés davantage par les sels biliaires afin d'améliorer leur solubilité et de les rendre accessibles
aux différentes enzymes [38]. Par la suite, il y a hydrolyse des positions externes 1 et sn-3 des TG par la lipase pancréatique. Les produits finaux de la digestion sont du cholestérol libre, des PL, des acides gras libres (AGL) et des molécules de 2-monoacylglycérol (MAG), qui pourront être absorbés avec les vitamines liposolubles par les entérocytes, principalement au niveau du jéjunum [39].
2.2 Les chylomicrons
Le plasma étant un milieu aqueux, les constituants lipidiques hydrophobes doivent subir une réorganisation afin de pouvoir y circuler. C'est donc pour permettre la solubilisation et la circulation des lipides qu'il y aura production de CM dans l'entérocyte. Les CM produits par les cellules intestinales varient beaucoup dans leur diamètre et dans leur nombre, mais de façon générale, une diète riche en gras causera l'augmentation du diamètre de ces derniers [14], On peut en retrouver avec une taille similaire aux VLDL et même aux LDL, dépendamment de la disponibilité en lipides et du fonctionnement du processus d'assemblage [40]. Ces caractéristiques auront un impact sur l'utilisation subséquente des CM et revêtent d'une grande importance.
2.2.1 Synthèse et sécrétion
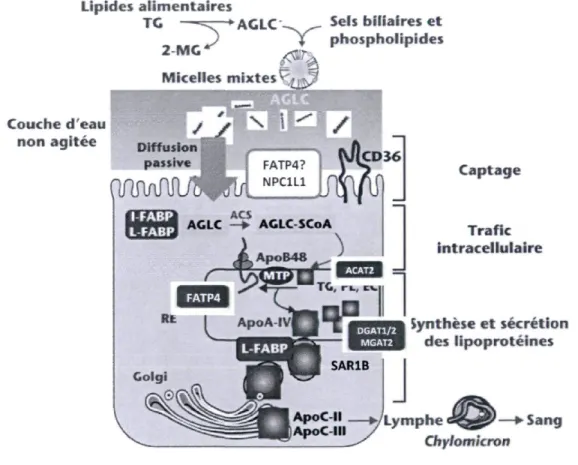
Plusieurs protéines et enzymes sont impliquées dans le processus de formation du CM et à ce propos, la figure 3 présente un résumé des principales étapes de synthèse, qui débute par l'absorption des AG et des MAG par les entérocytes. Ce processus s'effectue par diffusion simple, mais aussi par transport facilité. Il semblerait toutefois que les protéines majeures impliquées dans l'absorption intestinale ne soient pas encore bien connues. Malgré cela, certaines évidences semblent émerger. En effet, on retrouve la protéine transmembranaire translocase des acides gras/Groupe de Différenciation 36 (FAT/CD-36), exprimée dans la membrane apicale des villosités duodénales et jéjunales, qui participe modestement à l'absorption des AG à longues chaines [39]. De plus, bien que les mécanismes clairs ne soient pas élucidés, elle joue un rôle important afin de diriger les AG absorbés vers la formation des CM [41].
Une fois dans l'entérocyte, les AG se lieront à d'autres protéines afin d'être dirigés adéquatement vers différents sites métaboliques. Parmi ces protéines, on retrouve les protéines cytosoliques liant les AG associées à l'intestin (LFABP ou FABP2) et au foie (LFABP ou FABP1), qui sont impliquées dans le transport intracellulaire des AG (LFABP) et de d'autres constituants comme le cholestérol, les acyl-CoA et les PL (LFABP) [42, 43]. Ces protéines transporteront ultimement les AG vers le reticulum endoplasmique (RE). D'ailleurs, on retrouve au niveau de la membrane de ce dernier d'autres protéines ayant comme fonction d'activer les AG afin de permettre leur incorporation dans les mono- et les diglycérides. On retrouve ainsi le membre 4 des protéines de transfert des AG (FATP4) et les membres 1, 3 et 5 de la famille des synthetases d'acyl-CoA à longue chaine (ACSL) principalement [39]. Ces dernières participent au « piégeage métabolique », où l'activation des AG requise pour la re-synthèse des TG favorise la captation et le transport intra-entérocytaires de d'autres AG [44,45].
L'assemblage des CM se déroule dans le RE de l'entérocyte et débute avec la translocation de l'apoB naissante dans la lumière de celui-ci. En même temps, les enzymes monoacylglycérol acyltransférase-2 (MGAT2) et diacylglycérol O-acyltransférase-1 (DGAT1) situées dans la membrane du RE, sont indispensables et catalysent les réactions nécessaires à la reconstitution des TG [39]. En plus des TG, le cholestérol absorbé sera transporté au RE via la protéine transporteur de sterol Niemann-Pick Cl-like 1 (NPC1L1) et estérifié grâce à l'enzyme acétyl-CoA acétyltransférase 2 (ACAT2), ce qui permettra son incorporation dans les CM [46]. Au fur et à mesure que les TG sont reconstitués, ils sont assemblés avec le cholestérol estérifié et des PL, et transférés à une molécule d'apoB-48 se trouvant maintenant dans le RE. Cette lipidation de l'apoB-48 est rendue possible grâce à sa fusion à la protéine microsomale de transfert des triglycérides (MTP) [47]. Aussi, bien que son rôle précis ne soit pas élucidé, la FAT/CD36 aurait également un rôle important dans la coordination de l'incorporation des AG et du cholestérol dans le CM naissant [39].
Le CM naissant sort ensuite du RE et est transporté à l'aide d'une vésicule de transport jusqu'à l'appareil de Golgi où il est sujet à une lipidation et maturation finales. Pour ce faire, plusieurs protéines sont essentielles, dont les protéines FAT/CD-36 et LFABP, qui
interagissent avec la membrane du RE afin d'initier la formation de la vésicule [48]. On retrouve aussi la protéine de trafic membranaire SARip (SARip), membre de la famille des GTPases du système COPII impliqué dans la gestion du transport du CM vers le RE [49]. Le CM sera finalement expulsé de la cellule par exocytose et rejoindra les conduits lymphatiques mésentériques [50, 51].
Figure 3 : Absorption et synthèse du chylomicron
Sels biliaires e t Lipides a l i m e n t a i r e s TG — « = ^ — * A G L C ~ ^ - - *eis Biliaires e t J | p h o s p h o l i p i d e s 2 M C Micelles m i x t e s ' Couche d'eau / A n o n a g i t é e D i f fu s i on passive FATP4?
çfiMwimlj^
I FABP LFABP ACS AGLC —► ACLC-SCoA C a p t a g e T r a f i c i n t r a c e l l u l a i r e Synthèse e t sécrétion des l i p o p r o t é i n e s Golgi ApoC II — W L y m p h e ' ApoC III 7 * ■'_ Chylomicron SangAdapté de : Tran et coll. 2012 [52]
2.2.2 Utilisation et clairance
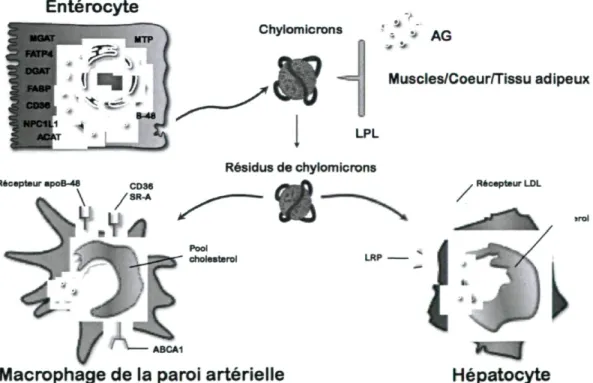
Les CM rejoignent la circulation sanguine au niveau du canal thoracique. Une fois en circulation, les CM se lient à la LPL présente à la surface endothéliale de plusieurs tissus grâce à l'apoC-II agissant comme co-facteur [17]. Cette liaison permettra l'hydrolyse des TG des CM (figure 4). La LPL hydrolyse préférentiellement les TG des CM, mais
également ceux des VLDL, créant ainsi une compétition pour ce ligand dans la période postprandiale [53]. L'hydrolyse libérera des AG qui seront captés par les différents tissus dont les muscles, le tissu adipeux et le cœur pour servir à la P-oxydation ou pour être stockés sous forme de TG. Au fur et à mesure que l'hydrolyse a lieu, la taille des CM diminue et on obtient des CM-R qui ont deux destinées possibles. La première est d'être captés par les hépatocytes grâce à des récepteurs sensibles à l'apoE, soit les r-LDL et r-LRP [54]. La deuxième est d'être captés par des cellules des tissus périphériques, comme les macrophages de la paroi artérielle, via ces mêmes récepteurs ou encore d'autres tels FAT/CD-36, le récepteur éboueur de classe A (SR-A) et le récepteur de l'apoB-48 (r-apoB48) [55]. Cette deuxième finalité explique comment les CM-R peuvent, même s'ils ne sont pas modifiés, participer à l'initiation et au développement de l'athérosclérose. D'ailleurs, des études avec des modèles animaux ont observé que la grosseur des particules de CM-R déterminerait leur vitesse d'entrée dans l'artère [11].
Figure 4 : Métabolisme des chylomicrons
Entérocyte Récepteur apoB-48 CD36 \ / S R - A Chylomicrons ' . v" « Q Muscles/Coeur/Tissu adipeux LPL Résidus de chylomicrons Récepteur LDL
2.3 La lipémie
Un TG est composé de trois AG et d'une molécule de glycerol. La triglycéridémie, ou lipémie, mesure donc les TG présents dans toutes les fractions lipoprotéiques. Les facteurs de risque actuels des MCV tiennent compte de la lipémie à jeun, normalement exempte de TG des CM. Néanmoins, comme il a été mentionné antérieurement, la lipémie postprandiale, représentée par les concentrations de TG des lipoprotéines riches en TG, soit majoritairement les CM, mais aussi les VLDL [56], est maintenant considérée comme un facteur de risque de MCV [29, 33]. À ce propos, deux études prospectives de grande envergure ont observé des associations indépendantes plus importantes entre les concentrations postprandiales de TG et la survenue d'événements cardiovasculaires divers, par rapport aux valeurs à jeun [6, 7]. D'ailleurs, la présence d'une hyperlipémie postprandiale coïncide souvent avec l'obésité, le diabète ou encore le syndrome métabolique, suggérant son association à une altération métabolique sous-jacente [57].
Bien qu'une hyperlipémie à jeun soit souvent un indicateur d'une lipémie postprandiale exagérée ou retardée, cette relation n'est pas observée en tout temps, indiquant qu'une mesure à jeun n'est pas toujours suffisante [58, 59]. D'autre part, une lipémie postprandiale caractérisée par une amplitude ainsi qu'une durée d'élévation exagérées a été associée positivement à différentes conditions du risque cardiovasculaire dont l'épaississement de l'intima-média des carotides et l'activation leucocytaires [60, 61]. Comme 75% des TG postprandiaux sont présents dans les CM [62], cela suggère que l'étude de ces derniers peut donner un reflet assez fidèle de la période postprandiale.
2.4 L'apoB-48
V
A cause de la clairance rapide des CM, on retrouve en temps normal environ 40 fois plus d'apoB-100 que d'apoB-48 en circulation [63]. Toutefois, lorsque l'on ne considère que les lipoprotéines riches en TG, le ratio apoB-100/apoB-48 chute drastiquement à 5/1, montrant encore une fois l'implication majeure des CM dans la période postprandiale [62]. Bien que l'apoB-48 soit un des principaux régulateurs de l'assemblage des CM, il semblerait que suite à un apport élevé en lipides, l'augmentation du nombre de particules de CM soit marginale par rapport à l'augmentation de leur taille [14].
Au même titre que l'apoB-100 retrouvée sur les LDL, IDL et VLDL, le rôle de l'apoB-48 des CM dans les MCV a également été étudié. De ce fait, il semblerait que des concentrations augmentées d'apoB-48 à jeun, où on ne retrouve habituellement pas de CM, soit prédictives d'une hyperlipémie postprandiale [64] et reliées au développement de maladies athérosclérotiques [65, 66]. Par ailleurs, une étude utilisant un modèle animal a observé une rétention plus importante d'apoB-48 que d'apoB-100 suite à une infusion contenant des CM ou des LDL dans du tissu carotidien de lapin [15]. L'observation d'apoB-48 a également été faite dans des prélèvements de plaques athérosclérotiques humaines, suggérant l'implication importante du nombre de particules de CM dans le développement de la plaque athéromateuse [67]. Finalement, il semblerait que même avant leur maturation en macrophages, les monocytes en circulation montrent une régulation à la hausse de la transcription du gène APOB48R et accumulent des lipides en présence d'une quantité significative de CM, suggérant un rôle possible de l'apoB-48 dans l'activation des monocytes circulants [62].
2.5 Les acides gras libres
Que ce soit à jeun ou pendant la période postprandiale, on retrouve constamment des AGL en circulation. Leur régulation est assurée par les processus de lipogenèse et de lipolyse [68]. À jeun, moment où on retrouve les concentrations plasmatiques les plus importantes, les AGL proviennent de l'hydrolyse des TG du tissu adipeux qui les libère grâce à trois lipases majeures, soit la lipase hormono-sensible (LHS), la lipase des triglycérides adipeux (ATGL) et la lipase des monoacylglycérols (MGL) [68], afin que des tissus comme le muscle, le cœur et le foie puissent les utiliser comme substrat pour la P-oxydation [69]. En période postprandiale, l'insuline en circulation inhibe la lipolyse et active la LPL du tissu adipeux, ce qui permet l'hydrolyse des TG des CM et des VLDL et la libération subséquente d'AG qui sont captés par les adipocytes afin d'être stockés sous forme de TG [70]. Ceci causera donc une diminution des concentrations plasmatiques d'AGL dans les premières heures suivant le repas. Toutefois, 40 à 50% de ces AG s'échappent dans la circulation sanguine et contribuent à la modification du pool d'AGL plasmatiques, reflétant le contenu en AG du repas [71, 72].
On rapporte une augmentation des taux d'AGL chez les obèses, qui serait attribuable à la masse adipeuse plus importante qui augmente la lipolyse globale [73]. On rapporte également une diminution moindre des AGL plasmatiques suite à la consommation de repas riches en gras chez des obèses ainsi qu'une réduction de l'activité de la LPL malgré un hyperinsulinisme [74]. Des concentrations élevées d'AGL ont d'ailleurs été associées à l'insulino-résistance [75], mais aussi à la détérioration de la fonction endothéliale [76], à une augmentation de la pression artérielle [73] ainsi qu'à la production du facteur de nécrose tumorale a (TNF-a) et d'interleukine-6 (IL-6) [75], pouvant ainsi suggérer une implication dans le risque cardiovasculaire. D'ailleurs, plusieurs études associent les AGL à l'incidence de MCV ou à la mortalité par événements cardiovasculaires [77-79].
2.6 L'insuline
L'insuline est une hormone sécrétée par les cellules P du pancréas suite à l'arrivée du glucose dans le sang. En plus de son rôle majeur dans l'absorption du glucose par les cellules, elle est essentielle à la bonne régulation du métabolisme lipidique et est impliquée dans la régulation de la lipogenèse et de la lipolyse. En temps normal, l'augmentation des concentrations d'insuline inhibe les lipases intracellulaires du tissu adipeux et active la LPL de ce dernier, tandis que la LPL est inhibée dans le tissu musculaire [70, 80]. Ceci favorisera l'hydrolyse des lipoprotéines plasmatiques et favorisera la captation du glucose par les cellules musculaires. Toutefois, dans les cas où les taux d'AGL et d'insuline sont augmentés, comme dans les cas d'obésité, on remarque une altération dans ce fonctionnement. En effet, l'augmentation de la sécrétion d'AG du tissu adipeux dans la circulation sanguine accroit la quantité d'AG arrivant au foie et de ce fait, la production de VLDL [70]. Ceci aurait comme effet d'atténuer la signalisation de l'insuline dans ces tissus [81] et pourrait ainsi exacerber l'insulino-résistance. D'ailleurs, la résistance à l'insuline est souvent associée à des dyslipidémies [82] et affecterait le métabolisme des CM-R en diminuant l'expression du r-LDL et en augmentant la synthèse hépatique de VLDL [83]. De plus, le degré de sensibilité à l'insuline serait un déterminant influençant la réponse lipémique postprandiale [84].
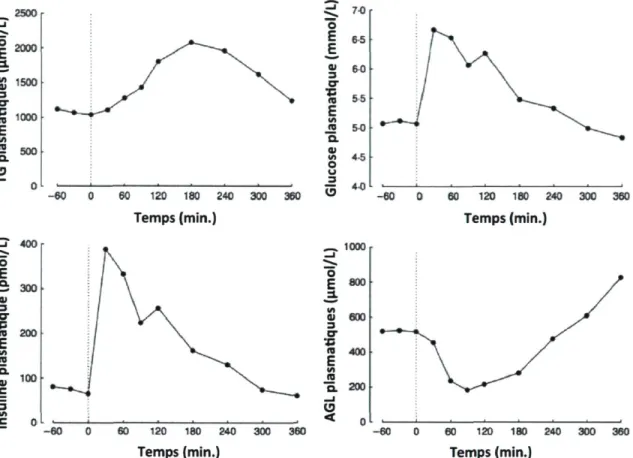
La figure 5 illustre un modèle de réponse postprandiale normale de certains metabolites plasmatiques mentionnés ci-haut, suite à un repas typique.
Figure 5 : Concentrations postprandiales typiques de metabolites plasmatiques chez des sujets sains après un repas typique
2500 2000 2 1S0O 3 M 1000 E in "S 500 Q. O - i 400 ^ . O E 0) 3 o-V 10 200 E </> JS 3 m C -60 0 60 120 180 240 Temps (min.) 300 360 -60 60 120 180 240 Temps (min.) 300 360 ~ - 1000 60 120 180 240 Temps (min.) 60 120 180 240 Temps (min.) 360
Traduction libre de : Fielding et coll. 2011 [70]
2.7 Les effets de la consommation chronique des acides gras alimentaires
de la diète sur les paramètres postprandiaux
Il semble clair que la composition en AG de la diète influence la réponse de plusieurs paramètres métaboliques à jeun et ainsi le risque cardiovasculaire [85, 86]. Il s'avérerait également que les AG de la diète habituelle influence les paramètres de la réponse postprandiale et certains auteurs proposent la période postprandiale comme étant initiatrice des effets différentiels observés [87]. Prenons la diète méditerranéenne, composée majoritairement d'huile d'olive (acide oléique), comme exemple des effets bénéfiques potentiels associés aux AG de la diète habituelle. Celle-ci a été associée à des améliorations
du profil métabolique et de certains facteurs de risque de MCV [87-89]. Néanmoins, la réponse postprandiale aux AG alimentaires consommés de façon chronique résulte d'un phénomène multifactoriel impliquant plusieurs éléments et nutriments et présentant une variabilité interindividuelle considérable [88, 90]. Bien que des études n'aient observé aucun effet de la composition en AG de la diète sur les paramètres postprandiaux [91], plusieurs résultats méritent d'être soulevés.
2.7.1 Lipémie postprandiale
Il semble établi qu'une supplementation chronique en AGPI co-3 d'origine marine, soit l'acide eicosapentaénoïque (EPA) et l'acide docosahexaénoïque (DHA) (C20:5, n-3 et C22 :5, n-3 respectivement) de l'ordre de 2,7 à 5g par jour diminue les concentrations postprandiales de TG par rapport à une supplementation contrôle en AGMI [8, 92-94]. Des auteurs suggèrent que ce pourrait être via une synthèse intestinale de TG diminuée. Toutefois, lorsque l'on ne considère que la diète, les résultats divergent. Les AGPI végétaux (C:18 :3, n-3 et C18 :2, n-6) diminueraient [88] ou augmenteraient [95] la lipémie postprandiale par rapport aux AGMI. D'autre part, en les comparant aux AGS, les AGPI d'origine végétale ainsi que les AGMI diminueraient la lipémie postprandiale [96, 97]. L'étude de Zampelas et coll. a observé, chez une population du Sud de l'Europe consommant de grandes quantités d'AGMI, une augmentation plus marquée des TG dans le début de la période postprandiale (2-3h), suivi d'un retrait rapide de la circulation [98]. Toutefois, on rapporte tout de même des études à court ou moyen terme n'ayant montré aucun effet différentiel des AG [87, 99].
En ce qui concerne les AGS, il semblerait que la longueur de leur chaine carbonée corrèle avec l'ampleur de lipémie postprandiale mesurée. Une étude a rapporté une lipémie postprandiale augmentée et prolongée avec l'acide stéarique (Cl8:0) par rapport à d'autres AGS à moins longues chaines, comme l'acide palmitique (C16:0), l'acide myristique (C14:0) et l'acide laurique (C12:0) suite à une diète de sept jours [100]. Dans un même ordre d'idée, la substitution croissante d'huile de maïs (C18:l et C18:2, n-6 principalement) par des AGS à chaines moyennes (C8:0 et C10:0 principalement) a causé une diminution
de la lipémie postprandiale chez des sujets hypertriglycéridémiques, bien que les concentrations de TG à jeun n'ait pas été modifiées [101].
2.7.2 Nombre et taille des particules
La consommation chronique d'une diète riche en AGMI sous forme d'acide oléique (Cl8:1) a été associée à une diminution du nombre de lipoprotéines riches en TG, par rapport à une diète riche en AGPI et en AGS [88]. Par ailleurs, la substitution d'AGS par des AGMI pendant huit semaines a diminué la réponse globale de l'apoB-48 de 54% [87]. Ces études ont également rapporté une proportion plus importante de CM de grande dimension ayant un risque athérogène moindre suite aux AGMI, lorsque comparés aux mêmes AG. [87, 88]. Aussi, des études ont observé un pattron de réponse accéléré quant aux concentrations postprandiales de TG et d'apoB-48 chez des populations saines consommant une diète riche en AGMI par rapport aux AGS, ce qui suppose une diminution du temps de circulation des CM [87, 97]. Une autre étude a noté que neuf jours de diète riche en AGPI ont diminué les concentrations intégrées d'apoB-48 sur 24h de 43%, toujours par rapport aux AGS [102]. Différents auteurs rapportent qu'il y aurait également une augmentation de la vitesse de clairance des CM-R et des résidus de VLDL (VLDL-R) avec les AGPI, surtout par rapport aux AGS [93, 102]. En effet, les AGS sont caractérisés par une plus grande accumulation dans la circulation et une clairance ralentie lorsque les lipoprotéines et leurs résidus en sont enrichis [99, 103, 104]. Toutefois, d'autres études des effets chroniques à court ou à moyen terme des AGPI n'ont observé aucune différence dans les réponses d'apoB-48 suite à diverses diètes [99]. Par ailleurs, une diminution des valeurs postprandiales d'apoB-48 et d'apoB-100 a été observée chez des diabétiques suite à une diète riche en acide oléique comparativement à une diète riche en acide linoléique (Cl8:2, n-6), suggérant que la condition métabolique des sujets peut influencer les résultats [95].
2.7.3 Insuline et acides gras libres
Les études des effets différentiels de la composition en AG de la diète sur les concentrations postprandiales d'AGL et d'insuline sont peu nombreuses. Plusieurs d'entre elles n'ont observé aucune différence entre les AGMI, AGPI ou AGS [105, 106]. Toutefois, des auteurs ont pu observer que les AGS sont associés à une détérioration du fonctionnement de l'insuline [107], alors qu'une amélioration de la sensibilité à l'insuline a
été mesurée suite à la substitution d'AGS par des AGPI [108, 109], mais également par des AGMI [109, 110].
2.8 Les effets aigus des acides gras alimentaires sur les paramètres
postprandiaux
Des évidences suggèrent que les AG alimentaires influenceraient la lipémie postprandiale après un seul repas et ce, indépendamment de la diète habituelle. Toutefois, la divergence des résultats actuels observés dans la littérature complexifie l'établissement de conclusions claires [9]. D'ailleurs, il semblerait qu'en plus des AG alimentaires et de la diète habituelle, la quantité totale de lipides et de cholestérol, la présence ainsi que le type de glucides et de protéines influenceraient tous la réponse postprandiale suite à un repas riche en lipides [8, 111, 112]. De plus, des évidences récentes suggèrent que la longueur des chaines carbonées, le degré et la géométrie d'insaturation ainsi que la composition positionnelle des AG influencent les résultats en plus de tous les autres facteurs [113]. Le tableau 2 résume une partie des évidences actuelles à ce sujet.
2.8.1 Lipémie postprandiale
Il semble entendu que les AGS à chaines courtes et moyennes (dont la chaine carbonée contient 14 atomes de carbone ou moins) ont un impact limité sur la lipémie postprandiale, étant donné leur entrée dans la circulation portale plutôt que leur intégration dans les CM [9, 114]. Plusieurs études rapportent d'ailleurs que ce serait pour cette raison que les AGS laitiers, contenant une grande proportion de ces AG, induisent une lipémie postprandiale diminuée comparativement à d'autres AGS [8, 9, 115]. En ce qui a trait aux autres AGS, les effets aigus et chroniques semblent différer. En effet, certaines études rapportent que les AG palmitique (C16:0) et stéarique (C18:0) seraient associés à une lipémie réduite par rapport à des AG insaturés et trans suite à une consommation aiguë [116, 117]. Le mécanisme proposé pour les AGS à plus longue chaine est l'effet potentiel de la distribution de ces AG sur le TG, où un ralentissement de l'absorption serait observé lorsque ceux-ci se retrouvent en position centrale sn-2, à cause d'un changement dans les propriétés physico-chimiques [118]. Malgré ces constats, les résultats des études sont divergents. En effet, des auteurs ont associé les AGS à une lipémie augmentée [119, 120]
ou encore diminuée [115, 117] par rapport aux AGPI et aux AGMI, alors que plusieurs d'entre eux n'ont vu aucune différence [59, 113, 121-124]. Néanmoins, les effets semblent plus facilement observables chez des sujets ayant des niveaux augmentés de TG à jeun, où les AGMI et AGPI semblent atténuer la réponse lipémique par rapport aux AGS [59, 125]. Des études utilisant des modèles de cultures de cellules Caco-2 ont démontré que l'acide oléique serait un meilleur stimulateur de la sécrétion des TG que les AG palmitique et stéarique [126], Ceci résulterait en une augmentation plus prononcée et plus abrupte des concentrations postprandiales de TG et expliquerait les valeurs augmentées mesurées suite à un repas, comparativement aux AGS et AGPI [115, 117]. Les AG trans quant à eux, principalement l'acide élaidique (Cl8 :1 trans), ont été associés à une lipémie similaire à celle observée suite aux AGMI de configuration cis [116,117].
En ce qui concerne les AGPI, l'EPA et le DHA ont également montré un effet hypotriglycéridémiant suite à un seul repas, par rapport aux AGPI végétaux, mais il semblerait que cet effet dépende de la quantité d'AGPI marins du repas, à défaut de quoi on ne retrouverait pas de différence par rapport aux AGPI végétaux [127, 128]. Par ailleurs, la lipémie postprandiale mesurée suite aux AGPI végétaux s'avère souvent similaire à celle observée suite aux AGMI [115, 116, 121]. Certaines études soulèvent que d'autres éléments, tels que les concentrations plasmatiques à jeun de TG, la présence du syndrome métabolique, de diabète de type 2 ou d'hypertension artérielle, influenceraient davantage le patron de réponse postprandiale suite à une surcharge en lipides [59, 129, 130]. À la lumière de ces informations, il ne semble donc pas possible de statuer sur des effets aigus précis des AG sur la lipémie postprandiale.
Tableau 2: Résumé des facteurs influençant la lipémie postprandiale
A m p l e u r de c h a n g e m e n t de la lipémie p o s t p r a n d i a l e Composition du repas testé
Quantité de lipides
+++
Types de lipides
±
(dépend du type)Glucides
++
Fibres Pas d'effet ou 4 (dépend du type)
Protéines Pas d'effet ou 4 (dépend du type)
Alcool ++
Type de lipides (diète) ± (dépend du type)
Exercice physique
Tabagisme ++
Sexe + (Hommes)
Âge +
Statut ménopausique + (Femmes ménopausées)
Triglycéridémie à jeun +++
Obésité abdominale
++
Résistance à l'insuline/
Diabète type 2
++
Traduction libre de : Lopez-Miranda et coll. 2007 [9]
2.8.2 Nombre et taille des particules en circulation
Certains auteurs rapportent des niveaux postprandiaux d'apoB-48 augmentés ou encore un diamètre des CM moindre lorsque des AGS sont comparés à des AGMI et des AGPI, suggérant un effet délétère des AGS sur le risque cardiovasculaire [88, 115, 116].
Au sujet de l'acide oléique, l'augmentation potentielle de la formation des CM suite à cet AG est parfois concomitante à une plus grande augmentation des valeurs d'apoB-48 ou encore à une élévation plus rapide de cette dernière dans le début de la période postprandiale par rapport à l'AGS palmitque [118]. Par contre, Jackson et coll. ont observé une plus grande proportion de CM de grande dimension (Sf >400) suite à un repas riche en huile d'olive, par rapport à l'huile de palme, de carthame et à un mélange d'huile de poisson et de carthame [131]. Cependant, l'augmentation de l'apoB-48 concomitante à celle des TG n'est pas toujours observée ce qui amène des auteurs à suggérer que l'huile d'olive mène à la formation de CM de grande dimension [119]. Cette hypothèse est également soulevée pour les AGPI, bien que les évidences soient plus limitées [122]. Les CM produits seraient alors moins athérogènes, entre autres à cause de leur plus grande affinité pour la LPL accélérant leur hydrolyse et leur passage en circulation [132]. Néanmoins, d'autres études n'ont pas observé d'effets significatifs des AG sur les éléments mentionnés ci-haut [115, 125]
2.8.3 Insuline et acides gras libres
Des études démontrent que la consommation d'un repas riche en AGS résulterait en une diminution plus marquée des AGL dans les premières heures par rapport aux AGMI [9, 116, 123]. En effet, certains auteurs suggèrent que les AGMI, causant la sécrétion rapide des CM en circulation, augmenteraient l'activité de la LPL et ainsi causeraient un plus grand débordement des AG dans le plasma [133]. Des études ont également remarqué que la diminution des AGL au début de la période postprandiale était suivi d'une augmentation plus importante des AGL dans la période postprandiale tardive suite aux AGS par rapport aux AG insaturés [119, 134]. A ce sujet, il semblerait que les AGMI soient stockés préférentiellement aux AGS et même aux AGPI par le tissu adipeux dans la période postprandiale tardive, ce qui pourrait expliquer les différences observées [135].
Les effets aigus des AG alimentaires sur la sensibilité à l'insuline ne sont pas bien connus. Par contre, il se pourrait que des effets différentiels existent via des changements dans les concentrations d'AGL [119]. De ce fait, des études ont observé des niveaux d'insuline augmentés après la consommation d'un repas riche en AGMI par rapport aux AGPI [136], alors que d'autres n'ont pas vu de différence dans la réponse des AGL, de l'insuline et du
glucose suite aux AGMI et aux AGPI d'origine marine et végétale [121, 134, 137]. En les comparant aux AGS, les AGPI ont montré améliorer la sensibilité à l'insuline du muscle squelettique chez des sujets insulino-résistants et diminuer l'insulinémie [134, 138] tandis que les AGMI ont amélioré la sensibilité à l'insuline chez différentes populations [139,
140]. Toutefois, il demeure que plusieurs autres études n'ont pas observé d'effets significatifs aigus des différents AG sur ces metabolites [115, 123, 141].
3. Gènes modulant le métabolisme des lipides et des
lipoprotéines
Les gènes régulant le métabolisme lipidique sont nombreux et les rôles de chacun ne sont pas tous élucidés. Toutefois, il semble clair que des anomalies du métabolisme lipidique et lipoprotéique puissent être expliquées par des altérations dans la transcription de gènes impliqués dans les processus de lipogenèse et de lipolyse [90].
3.1 Gènes modulant le métabolisme des chylomicrons
3.1.1 Trafic intracellulaire des acides gras à longues chaines
L'intestin possède une capacité d'adaptation impressionnante et les rôles des protéines de l'entérocyte impliquées dans la formation des CM ne sont pas tous clairement définis, ce qui fait que plusieurs protéines peuvent participer à des activités similaires dans la cellule. Entre autres, plusieurs gènes associés au métabolisme intracellulaire des AG ont un impact dans la formation des CM, notamment les gènes FAT/CD36, FABP1 et FABP2, qui régulent de façon importante plusieurs aspects du transport intracellulaire des AG dans la cellule [39].
Des études ont tenté d'observer les effets métaboliques des changements dans l'expression de certains de ces gènes afin de mieux cerner leur implication dans l'absorption des lipides alimentaires et le métabolisme des CM. Ceci a permis d'observer que pour plusieurs des gènes mentionnés ci-haut, dont FATP4, FAT/CD36 et FABP1, l'absence d'expression ne cause pas de malabsorption de lipides, suggérant que d'autres mécanismes peuvent compenser [132, 142, 143]. Le polymorphisme humain Gly-209-Ser, diminuant l'expression de la protéine FATP4 présentée plus haut, causait une diminution de la lipémie
postprandiale [144]. D'autres auteurs ont toutefois rapporté qu'une diminution de l'expression intestinale de la protéine FATP4 était associée à l'accumulation de TG dans l'entérocyte [142]. Malgré ces observations, les répercussions de la diminution d'expression de cette protéine semblent pouvoir être compensées par d'autres mécanismes. D'autre part, il a été démontré que la régulation des gènes des deux protéines de la famille des FABP exprimées abondamment dans l'intestin a des répercussions sur le métabolisme lipidique. En effet, la perturbation de l'expression du gène FABP1 a été reliée à une rétention des TG dans l'entérocyte ainsi qu'à une diminution de la sécrétion des CM chez des souris assujetties à une surcharge en lipides [145]. Par ailleurs, bien que les mécanismes soient encore obscurs, il semblerait que la régulation du gène FABP2, codant pour la protéine LFABP, joue un rôle dans le syndrome métabolique [132]. Plus précisément, le polymorphisme Ala-54-Thr a été associé à des concentrations plasmatiques élevées de TG [146], à une résistance à l'insuline [147] et à un indice de masse corporelle (IMC) élevé [148]. D'ailleurs, au niveau intestinal, ce génotype causerait une augmentation de l'incorporation des TG dans les CM, possiblement via une affinité plus importante pour les AG à longues chaines [147].
Comme il a été mentionné antérieurement, la protéine ubiquitaire FAT/CD36 est impliquée à plusieurs niveaux dans l'entérocyte et aussi dans le reste du corps. De ce fait, une déficience du gène associé a été reliée à une hypertriglycéridémie postprandiale, à une diminution de la taille des CM produits, à de hauts taux plasmatiques d'apoB-48, d'AGL et de glycerol chez l'humain [44]. D'ailleurs des auteurs suggèrent que le défaut de cette protéine cause la production de petits CM restant plus longtemps en circulation et augmentent ainsi les niveaux de CM-R circulants qui sont impliqués dans l'athérosclérose [44].
3.1.2 Assemblage et sécrétion
Une revue récente de Warnakula et coll. rapporte que les gènes APOB et MTP seraient deux régulateurs majeurs du processus d'assemblage et de sécrétion des CM [14]. Ainsi, ces régulateurs se doivent d'interagir de façon précise afin de faciliter et d'optimiser la sécrétion des lipides en circulation [39]. Dans un contexte sain, l'arrivée de cholestérol et
de TG dans l'entérocyte cause une augmentation de l'activité transcriptionnelle du gène MTP tandis que la régulation à la hausse du gène APOB constitue une adaptation critique lors d'apports élevés en gras [149, 150]. D'autre part, le gène MTP serait sujet à une régulation posttranscriptionnelle par la protéine IREip, impliquée dans la signalisation entre le noyau et le RE [151]. Cette dernière jouerait le rôle de senseur et régulerait la réponse de la MTP via une dégradation posttranscriptionnelle et ce sans affecter l'expression du gène APOB [151]. Par ailleurs, on a observé une régulation à la hausse du gène MTP chez des patients diabétiques, suggérant une plus grande production de lipoprotéines intestinales [149, 152, 153]. Cette régulation à la hausse a aussi été associée à une hypersécrétion d'apoB-48 dans une situation d'insulino-résistance [154]. D'ailleurs, des stratégies pharmacologiques inhibant l'activité de la MTP et causant potentiellement la dégradation subséquente de l'apoB existent pour atténuer la formation des lipoprotéines [155].
En plus des gènes APOB et MTP, les gènes MGAT2 et DGAT1 sont eux-aussi essentiels afin de favoriser l'incorporation adéquate des TG dans les CM [153, 156]. À ce sujet, des études ont observé chez la souris que l'absence d'expression intestinale du gène MGAT2 causait un ralentissement de la vitesse d'incorporation des TG dans les CM [157] tandis que l'absence d'expression du gène DGAT1 pouvait résulter en une diminution de la production des CM [158]. De ce fait, des auteurs rapportent que ceci pourrait ainsi protéger de l'obésité (MGAT2 et DGAT1) [157, 159], mais aussi de l'intolérance au glucose (MGAT2) [157]. À l'inverse, l'arrivée d'AG dans l'entérocyte a causé une régulation transcriptionnelle à la hausse du gène MGAT2 et une incorporation augmentée des TG dans les CM [160]. Le gène DGAT2 quant à lui, bien qu'il soit exprimé dans l'intestin, aurait davantage d'implication dans la synthèse de TG dans d'autres tissus [153, 161].
La maturation adéquate du CM est essentielle pour permettre une sécrétion normale de ces derniers. Dans cette optique, il semblerait que l'apoA-IV soit utile pour stabiliser le CM avant sa sortie du RE [162]. De plus, l'expression du gène APOA4 serait reliée au contenu en lipides de la diète ainsi qu'à la grosseur des particules de CM produits [163, 164].
Le gène SARA2 codant pour la protéine SARip est intimement impliqué dans la régulation du processus de maturation du CM. On comprend bien son rôle en constatant que des
mutations du gène SARA2, comme celles vues dans les cas de la maladie d'Anderson (maladie de rétention des CM), sont associées à une accumulation de gouttelettes lipidiques dans les cellules intestinales et entravent de façon importante le métabolisme lipidique [165]. Les gènes FAT/CD36 et FABP1 sont également impliqués dans la régulation de la sécrétion des CM, et on se rappelle que la perturbation du gène FABP1 est également associée à une diminution de la sécrétion des CM [145].
3.1.3 Utilisation et clairance
Suite à un repas, l'arrivée de l'insuline en circulation induit la transcription du gène LPL au niveau du tissu adipeux tandis que ce même gène sera inhibé au niveau du muscle squelettique [166]. Ceci favorisera la lipogenèse dans le tissu adipeux et la captation du glucose par le muscle. Une régulation adéquate de la LPL est nécessaire afin de maintenir cette homéostasie lipidique et des perturbations importantes sont observées dans les situations d'insulino-résistance. En effet, l'insulino-résistance entrave la régulation du gène LPL et cause une augmentation du temps de circulation des CM et des CM-R [17]. De plus, l'inhibition non-optimale de la LPL dans les cellules musculaires peut causer une accumulation de lipides dans ces dernières. Notons également l'implication du gène APOC3 dans le métabolisme des CM. En effet, bien que l'apoC-IU représente l'apo-C la plus abondante dans le plasma, sa surexpression altère la clairance des CM-R et des VLDL-R en diminuant leur affinité pour la LPL [167] ainsi qu'en inhibant la clairance de ces résidus par les récepteurs apoE du foie [168]. De plus, le niveau d'expression du gène APOC3 est associé à rhypertriglycéridémie postprandiale ainsi qu'à l'évolution de l'athérosclérose [167].
Après quelques heures en circulation, les CM-R sont retirés de la circulation par endocytose grâce à leur liaison à différents récepteurs membranaires hépatiques ou extra-hépatiques sensibles à l'apoE [20]. De ce fait, les gènes LRP1, LDLR et VLDLR, associés à différents récepteurs, sont impliqués dans la vitesse de clairance des CM-R de la circulation. De plus, ces mêmes récepteurs participent aussi à la clairance et la captation des VLDL-R et des LDL, via leur liaison à l'apoE et à l'apoB [11, 20]. D'ailleurs, en plus de la LPL, une régulation inadéquate du gène LDLR est associée à une clairance altérée des CM
et au risque cardiovasculaire [169]. Les gènes FAT/CD-36 et SR-A [170] ainsi que le gène indépendant de l'apoE APOB48R [171], régulent la production de d'autres récepteurs des CM-R et participent également à l'internalisation des CM-R par les différents tissus, dont les monocytes sanguins et macrophages de tissus périphériques. En effet, bien que la régulation du gène APOB48R ait pour fonction d'assurer les apports d'AG, de cholestérol et d'autres nutriments aux cellules, cette voie peut être surchargée, par exemple en présence de diabète de type 2 ou d'hypertriglycéridémie. D'ailleurs, l'incubation de monocytes humains avec des CM et des VLDL a causé l'augmentation de la transcription du gène APOB48R et la maturation finale de monocytes en macrophages [172]. Il est d'autant plus intéressant de noter que des études de cultures de macrophages humains ont montré que l'insuline pouvait induire une augmentation de l'expression du gène FAT/CD-36 via une régulation posttranscriptionnelle ainsi qu'une diminution de l'expression du gène ABCA1 impliqué dans l'estérification du cholestérol. Elle serait donc associé à une plus grande accumulation de cholestérol dans les macrophages, exposant encore une fois l'implication majeure de l'insuline dans l'athérosclérose [170,173].
Finalement, malgré l'internalisation possible des CM et de d'autres lipoprotéines par les cellules des tissus périphériques, le gène SCARB1 codant pour le récepteur SR-B1 est connu pour ses effets cardioprotecteurs. En effet, la régulation de ce gène permet une augmentation de l'activité du récepteur SR-B1 pour ainsi assurer le transport inverse du cholestérol vers le foie [21]. D'ailleurs, la régulation de l'expression du gène SCARB1 est critique dans l'optique où l'absence du récepteur SR-B1 a résulté en une progression de l'athérosclérose, et ce malgré des niveaux élevés de HDL [174]. Il est aussi intéressant de noter qu'au niveau de l'intestin, l'insulino-résistance augmente l'expression de SR-B1 et est associée à une production accrue de CM [175].
3.2 Facteurs de transcription
Plusieurs facteurs de transcription sont intimement reliés à la régulation du métabolisme des lipides et des lipoprotéines. Notons ceux de la famille des récepteurs actifs par les proliférateurs des peroxysomes (PPARs), plus précisément PPARa et PPARy. Une fois lié au récepteur rétinoïde X (RXR), ces récepteurs ubiquitaires peuvent agir comme
coactivateurs et corépresseurs de gènes ou encore comme transactivateurs en agissant directement sur d'autres facteurs de transcription [176]. Les PPARs assurent de nombreuses fonctions notamment dans le métabolisme énergétique et le métabolisme du cholestérol
[177]. Pour ce qui est de PPARa, il est fortement exprimé dans l'intestin et se lie naturellement aux AG endogènes [178]. Son expression est associée à une augmentation de la P-oxydation et à la diminution des dyslipidémies associées au syndrome métabolique
[179]. Il collabore aussi à la régulation de plusieurs gènes du métabolisme des CM dont FATP4, MGAT2, NPC1L1, ABCA1 et les gènes de la famille des ACSL [132, 180-182]. D'ailleurs, les gènes ACSL sont également exprimés dans la mitochondrie et sont impliqués dans l'activation des AG à longues chaines requise pour leur utilisation comme substrat énergétique [183]. Bien qu'il ait été davantage associé à la captation des AG par la cellule, le gène FATP4 est lui aussi de plus en plus reconnu pour avoir une fonction de synthetase similaire aux ASCL [184]. De son côté, PPARy régule notamment la différenciation des adipocytes, le stockage des AG et le métabolisme du glucose [185]. D'ailleurs, des agonistes de PPARy sont utilisés comme médication antidiabétique à cause de leurs impacts sur la résistance à l'insuline [185]. Il régule également l'expression du gène LPL ainsi que de d'autres gènes associés à la captation des lipoprotéines circulantes, notamment LRP1 et LDLR [186]. Finalement, les agonistes de PPARa et PPARy sont associés à une diminution de l'expression du gène APOB48R [172].
Notons également les facteurs de transcription de la famille des protéines 1 et 2 régulant la liaison à l'élément de réponse aux sterols (SREBP1 et SREBP2). Plus précisément, le promoteur du gène SREBPlc régule principalement la synthèse des AG via les gènes de trois désaturases principales soit SCD, FADS1 et FADS2 [187]. Quant à SREBP2, il régule les gènes associés à la biosynthèse du cholestérol et principalement l'activité de l'enzyme reductase 3-hydroxy-3-methylglutaryl-CoA (HMGCR) [187]. Ces facteurs de transcription sont donc essentiels afin d'assurer une homéostasie lipidique dans la cellule. En présence d'altérations métaboliques, par exemple d'obésité, l'hypertrophie adipocytaire mène à un déficit intracellulaire de cholestérol et cause une augmentation de l'expression de HMGCR via l'activation de SREBP2 [188]. Par ailleurs, SREBPlc et SREBP2 sont aussi impliqués dans la captation et la clairance des lipoprotéines plasmatiques. En effet, l'utilisation de
![Figure 2 : Métabolisme des lipoprotéines [12]](https://thumb-eu.123doks.com/thumbv2/123doknet/7491166.224484/18.918.169.717.366.802/figure-métabolisme-des-lipoprotéines.webp)