HAL Id: dumas-01780614
https://dumas.ccsd.cnrs.fr/dumas-01780614
Submitted on 7 Jun 2018HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Intérêt de la recherche de signes dysmorphiques dans les
Troubles du Spectre Autistique
Cyrille Robert
To cite this version:
Cyrille Robert. Intérêt de la recherche de signes dysmorphiques dans les Troubles du Spectre Autis-tique. Sciences du Vivant [q-bio]. 2017. �dumas-01780614�
N° d'ordre : ANNÉE 2017
THÈSE D'EXERCICE / UNIVERSITÉ DE RENNES 1
FACULTÉ DE MÉDECINE
sous le sceau de l’Université Européenne de Bretagne
THÈSE
EN VUE DU DIPLÔME D'ÉTAT DE DOCTEUR EN MEDECINE
présentée par
Cyrille
Robert
né le 23 mai 1985 à PabuIntérêt de la
recherche de signes
dysmorphiques dans
les Troubles du
Spectre Autistique
Thèse soutenue à Rennes le 06 janvier 2017
devant le jury composé de :
Dominique DRAPIER
PU-PH, CHGR de Rennes / président du jury Sylvie TORDJMAN
PU-PH, CHGR de Rennes / directeur de thèse Sylvie ODENT
PU-PH, CHU de Rennes / co-directeur de thèse Jacques DAYAN
PU-PH, CHGR de Rennes / examinateur Laurent PASQUIER
Sommaire
Liste des enseignants...2
Remerciements...12 Intitulé...13 Résumé...14 Mots-clés et abréviations...15 Introduction...16 État de la question...16
Syndromes génétiques associés à l’autisme...19
Objectifs de l’étude...27
Méthodes...28
Population...28
Évaluations comportementales et cognitives...28
− Diagnostic et sévérité des troubles autistiques...29
− Niveau de fonctionnement intellectuel...32
− Rythme veille/sommeil...32
Face2Gene...33
Procédure...33
− 1ere partie : étude de génétique clinique et pédopsychiatrique...33
− 2eme partie : étude informatique avec Face2Gene...37
Statistiques...38
Résultats...40
− Comparaison de l'analyse des photographies par le staff de généticiens et le programme Face2Gene...40
− Importance de l'examen de génétique …...42
− Relations entre les variables de dysmorphie et la sévérité des troubles autistiques...44
− Recherche d'une dysmorphie faciale spécifique des TSA...46
Discussion...48
Conclusion...50
Références bibliographiques...52
Liste des enseignants
PU-PH
ANNE-GALIBERT MarieDominique
Biochimie et biologie moléculaire
BELAUD-ROTUREAU Marc-Antoine
Histologie; embryologie et cytogénétique
BELLISSANT Eric Pharmacologie fondamentale; pharmacologie clinique; addictologie BELLOU Abdelouahab Thérapeutique; médecine d'urgence;
addictologie
BELOEIL Hélène Anesthésiologie-réanimation; médecine d'urgence
BENDAVID Claude Biochimie et biologie moléculaire
BENSALAH Karim Urologie
BEUCHEE Alain Pédiatrie
BONAN Isabelle Médecine physique et de réadaptation
BONNET Fabrice Endocrinologie, diabète et maladies métaboliques; gynécologie médicale BOUDJEMA Karim Chirurgie générale
BOUGET Jacques Thérapeutique; médecine d'urgence; addictologie
BOURGUET Patrick
Professeur des Universités en surnombre
Biophysique et médecine nucléaire
BRETAGNE Jean-François Gastroentérologie; hépatologie; addictologie
BRISSOT Pierre
Professeur des Universités en surnombre
Gastroentérologie; hépatologie; addictologie
CARRE François Physiologie
CATROS Véronique Biologie cellulaire
CHALES Gérard
Professeur des Universités émérite
Rhumatologie
CORBINEAU Hervé Chirurgie thoracique et cardiovasculaire
CUGGIA Marc Biostatistiques, informatique médicale et technologies de communication
DARNAULT Pierre Anatomie
DAUBERT Jean-Claude Professeur des Universités émérite
Cardiologie
DAVID Véronique Biochimie et biologie moléculaire
DAYAN Jacques
Professeur des Universités associé
Pédopsychiatrie; addictologie
DE CREVOISIER Renaud Cancérologie; radiothérapie
DECAUX Olivier Médecine interne; gériatrie et biologie du vieillissement; addictologie
DELAVAL Philippe Pneumologie; addictologie
DEUGNIER Yves
Professeur des Universités en surnombre
Gastroentérologie; hépatologie; addictologie
DONAL Erwan Cardiologie
DRAPIER Dominique Psychiatrie d'adultes; addictologie
DUPUY Alain Dermato-vénéréologie
ECOFFEY Claude Anesthésiologie-réanimation; médecine d'urgence
EDAN Gilles Neurologie
FERRE Jean Christophe Radiologie et imagerie Médecine
FEST Thierry Hématologie; transfusion
FLECHER Erwan Chirurgie thoracique et cardiovasculaire
FREMOND Benjamin Chirurgie infantile
GANDEMER Virginie Pédiatrie
GANDON Yves Radiologie et imagerie Médecine
GANGNEUX Jean-Pierre Parasitologie et mycologie
GARIN Etienne Biophysique et médecine nucléaire
GAUVRIT Jean-Yves Radiologie et imagerie Médecine
GODEY Benoit Oto-rhino-laryngologie
GUIGUEN Claude
Professeur des Universités émérite
Parasitologie et mycologie
GUILLÉ François Urologie
GUYADER Dominique Gastroentérologie; hépatologie; addictologie
HOUOT Roch Hématologie; transfusion
HUGÉ Sandrine
Professeur des Universités associé
Médecine générale
HUSSON Jean-Louis Professeur des Universités en surnombre
Chirurgie orthopédique et traumatologique
JEGO Patrick Médecine interne; gériatrie et biologie du vieillissement; addictologie
JEGOUX Franck Oto-rhino-laryngologie
JOUNEAU Stéphane Pneumologie; addictologie
KAYAL Samer Bactériologie-virologie; hygiène hospitalière
KERBRAT Pierre Cancérologie; radiothérapie
LAMY DE LA CHAPELLE Thierry
Hématologie; transfusion
LAVIOLLE Bruno Pharmacologie fondamentale; pharmacologie clinique; addictologie LAVOUE Vincent Gynécologie-obstétrique;
gynécologie médicale
LE BRETON Hervé Cardiologie
LE TULZO Yves Réanimation; médecine d'urgence
LECLERCQ Christophe Cardiologie
LEGUERRIER Alain Chirurgie thoracique et cardiovasculaire
LEJEUNE Florence Biophysique et médecine nucléaire
LEVEQUE Jean Gynécologie-obstétrique; gynécologie médicale
LIEVRE Astrid Gastroentérologie; hépatologie; addictologie
MABO Philippe Cardiologie
MALLEDANT Yannick Anesthésiologie-réanimation; médecine d'urgence
MEUNIER Bernard Chirurgie digestive
MICHELET Christian Maladies infectieuses; maladies tropicales
MOIRAND Romain Gastroentérologie; hépatologie; addictologie
MORANDI Xavier Anatomie
MORTEMOUSQUE Bruno Ophtalmologie
MOSSER Jean Biochimie et biologie moléculaire
MOULINOUX Jacques Biologie cellulaire
MOURIAUX Frédéric Ophtalmologie
OGER Emmanuel Pharmacologie fondamentale; pharmacologie clinique; addictologie
PERDRIGER Aleth Rhumatologie
PLADYS Patrick Pédiatrie
POULAIN Patrice Gynécologie-obstétrique; gynécologie médicale RAVEL Célia Histologie; embryologie et
cytogénétique RIFFAUD Laurent Neurochirurgie
RIOUX-LECLERCQ Nathalie
Anatomie et cytologie pathologiques
ROBERT-GANGNEUX Florence
Parasitologie et mycologie
SAINT-JALMES Hervé Biophysique et médecine nucléaire
SEGUIN Philippe Anesthésiologie-réanimation; médecine d'urgence
SEMANA Gilbert Immunologie
SIPROUDHIS Laurent Gastroentérologie; hépatologie; addictologie
SOMME Dominique Médecine interne; gériatrie et
biologie du vieillisement; addictologie SULPICE Laurent Chirurgie générale
TARTE Karin Immunologie
TATTEVIN Pierre Maladies infectieuses; maladies tropicales
THIBAULT Vincent Bactériologie-virologie; hygiène hospitalière
THOMAZEAU Hervé Chirurgie orthopédique et traumatologique
TORDJMAN Sylvie Pédopsychiatrie; addictologie
VERGER Christian
Professeur des Universités émérite
Médecine et santé au travail
VERHOYE Jean-Philippe Chirurgie thoracique et cardiovasculaire
VERIN Marc Neurologie
VIEL Jean-François Epidémiologie, économie de la santé et prévention
VIGNEAU Cécile Néphrologie
VIOLAS Philippe Chirurgie infantile
WATIER Eric Chirurgie plastique, reconstructrice et esthétique; brûlologie
WODEY Eric Anesthésiologie-réanimation; médecine d'urgence
MCU-PH
AME-THOMAS Patricia ImmunologieAMIOT Laurence Hématologie; transfusion
BARDOU-JACQUET Edouard
Gastroentérologie; hépatologie; addictologie
BEGUE Jean-Marc Physiologie
BOUSSEMART Lise Dermato-vénéréologie
CABILLIC Florian Biologie cellulaire
CAUBET Alain Médecine et santé au travail
DAMERON Olivier Informatique
DE TAYRAC Marie Biochimie et biologie moléculaire
DEGEILH Brigitte Parasitologie et mycologie
DUBOURG Christèle Biochimie et biologie moléculaire
DUGAY Frédéric Histologie; embryologie et cytogénétique
EDELINE Julien Cancérologie; radiothérapie
GALLAND Françoise Endocrinologie, diabète et maladies métaboliques; gynécologie médicale GARLANTEZEC Ronan Epidémiologie, économie de la santé
et prévention
HAEGELEN Claire Anatomie
JAILLARD Sylvie Histologie; embryologie et cytogénétique
LAVENU Audrey Sciences physico-chimiques et technologies pharmaceutiques LE GALL François Anatomie et cytologie pathologiques
LE RUMEUR Elisabeth Physiologie
MAHÉ Guillaume Chirurgie vasculaire; médecine vasculaire
MARTINS Raphaël Cardiologie
MASSART Catherine Biochimie et biologie moléculaire
MATHIEU-SANQUER Romain
Urologie
MENARD Cédric Immunologie
MENER Eric Médecine générale
MILON Joëlle Anatomie
MOREAU Caroline Biochimie et biologie moléculaire
MOUSSOUNI Fouzia Informatique
MYHIE Didier Médecine générale
PANGAULT Céline Hématologie; transfusion
RIOU Françoise Epidémiologie, économie de la santé et prévention
ROBERT Gabriel Psychiatrie d'adultes; addictologie
ROPARS Mickaël Anatomie
SAULEAU Paul Physiologie
TADIÉ Jean-Marc Réamination; médecine d'urgence
TATTEVIN-FABLET Françoise
Médecine générale
TURLIN Bruno Anatomie et cytologie pathologiques
VERDIER Marie-Clémence Pharmacologie fondamentale; pharmacologie clinique; addictologie VINCENT Pascal Bactériologie-virologie; hygiène
Remerciements
Chère Pr Tordjman, un immense merci pour votre aide, votre investissement personnel, votre énergie incroyable et votre écoute.
Chère Pr Odent, merci beaucoup pour votre accueil lors de mon stage dans votre service, votre disponibilité, votre bienveillance et vos conseils si pertinents.
Cher Pr Drapier, merci pour votre accompagnement tout au long de mon internat, votre pédagogie et l'honneur que vous me faites de présider ce jury.
Cher Pr Dayan, merci pour tout ce que j'ai appris auprès de vous et pour votre ouverture d'esprit. Vous m'avez entre autre transmis votre intérêt tout particulier pour la parentalité. Cher Laurent, merci pour ta curiosité intellectuelle et humaine. Ton humanisme transparaît tout autant que ta rigueur scientifique auprès des patients et de leurs familles.
Merci à chacun de vous de m'avoir fait le plaisir et l'honneur de participer à ma thèse de médecine.
Je dédie ce travail aux trois personnes qui ont le plus influé et influent encore particulièrement sur ma pensée et sur le cours de ma vie :
Virginie, tout ce que je fais, je le peux grâce à ton soutien et ta présence à mes côtés. Auprès de toi, j'essaie chaque jour de m’imprégner de ce qui te caractérise tant et constitue la seule et véritable intelligence : celle du cœur.
Maman, tu t'es donnée presque tout entière pour nous élever, mes frères et sœurs et moi. Je suis tellement reconnaissant et heureux de t'avoir pour mère.
Papa, je t'ai trop peu connu, mais je ne doute pas que, tout au fond de moi, tu continues de me façonner et me guider, comme un père apprend à marcher à son enfant en lui tenant les mains.
Intérêt de la recherche
de signes dysmorphiques
Résumé
Les troubles du spectre autistique (TSA) sont caractérisés selon la plus récente classification américaine des troubles mentaux (DSM-5) par un déficit précoce et permanent en communication/interaction sociale et par la présence de comportements répétés, stéréotypés et d’intérêts restreints. Pour les patients qui en sont atteints, un bilan étiologique est recommandé comportant systématiquement une consultation de génétique clinique. Les dernières études montrent qu’une origine génétique est retrouvée dans 35 à 40 % des cas, ce chiffre augmentant d’année en année à mesure que s’améliorent les techniques de génétique moléculaire et les connaissances dans ce domaine. À notre connaissance, il n’existe aucune étude évaluant l’intérêt de la recherche des signes dysmorphiques dans une population de patients avec TSA dans un but étiologique.
L’objectif principal de notre étude est de comparer la fiabilité des hypothèses étiologiques de généticiens expérimentés en dysmorphologie avec celle d’hypothèses émises par un algorithme informatique nommé Face2Gene, sur une population de 79 jeunes patients présentant un TSA associé à une déficience intellectuelle.
La variable qualitative de « dysmorphie clinique » est significativement et modérément corrélée à la variable qualitative « dysmorphie Face2Gene » (coefficient Phi = 0,3534, p=0,0039). L'indice de concordance inter-juges représenté par le coefficient Alpha de Cronbach est de 0,51. L'autre résultat majeur de cette étude est l'absence de corrélation significative entre le score de dysmorphie et la sévérité globale de l'autisme tant basée sur l'ADOS (sévérité actuelle) avec un coefficient de corrélation de Spearman r=0,07 (p=0,55), que sur l'ADI-R (période de vie de 4 à 5 ans) avec r=0,16 (p=0,24), ou l'ADI-R (période de vie actuelle) avec r=0,09 (p=0,50).
En conclusion, tous les enfants recevant un diagnostic de TSA doivent pouvoir bénéficier d’une consultation de génétique afin de rechercher des signes associés évocateurs d’anomalies génétiques connues. Les logiciels d'analyse biométrique pourront trouver une place complémentaire dans le parcours de soins des patients avec TSA, soit en aval de la consultation de génétique clinique pour consolider ou compléter le raisonnement diagnostique du généticien, soit en amont pour motiver et sensibiliser les patients et leurs familles à l'intérêt de la génétique médicale dans les TSA. Il n'est pas question à ce jour de faire un tri parmi les patients avec TSA afin de décider ceux qui pourraient bénéficier d'une consultation de génétique clinique, tant que de tels logiciels n'intégreront pas l'ensemble des variables cliniques que les généticiens prennent en considération dans leur cheminement diagnostique.
Mots-clés et Abréviations
Mots-clésTrouble du spectre autistique ; dysmorphie ; génétique clinique ; algorithme
Abréviations
ACPA : analyse chromosomique par puce à ADN
CFTMEA : Classification Française des Troubles Mentaux de l’Enfant et de l’Adolescent CIM-10 : Classification Internationale des Maladies, de l’OMS
CNV : Copy Variant Number DI : Déficience Intellectuelle
DSM-IV-TR : Manuel Diagnostic et Statistique des Troubles Mentaux, 4ème version révisée
DSM-5 : Manuel Diagnostic et Statistique des Troubles Mentaux, 5ème version
ET : Ecart-Type
QI : Quotient Intellectuel
Introduction
État de la questionLes troubles du spectre autistique (TSA) sont caractérisés selon la plus récente classification américaine des troubles mentaux (DSM-5) premièrement par un déficit précoce et permanent en communication et en interaction sociale, incluant des difficultés de réciprocité sociale, de communication non-verbale et deuxièmement par la présence de comportements répétés, stéréotypés et d’intérêts restreints (Asperger, 1944 ; Kanner, 1995). Les premiers symptômes doivent apparaître dans la petite enfance. Le diagnostic se pose actuellement sur des critères exclusivement cliniques. Les TSA se présentent sous des formes variées en terme de sévérité, de pronostic et de symptomatologie et sont fréquemment associés à d’autres pathologies neurodéveloppementales, psychiques ou comportementales : déficience intellectuelle (DI), épilepsie, dyspraxies, trouble d’hyperactivité avec déficit attentionnel, tics, anxiété... (Moreno-De-Luca et al., 2013 ; Gillberg, 2010)
Pour des raisons probablement plus critériologiques qu’épidémiologiques, la prévalence de ce trouble n’a cessé d’augmenter au cours des dernières décennies. Certaines études estiment actuellement qu’un pour cent de la population mondiale pourrait recevoir un diagnostic de TSA (Elsabbagh et al., 2012). Sans que nous ayons encore compris pourquoi, les TSA affectent davantage les garçons que les filles, ce qui est particulièrement vrai en l’absence de DI (ratio supérieur à 5 garçons pour une fille), moins en ce qui concerne la population avec DI (ratio 2 pour 1), le ratio s’équilibrant en présence de caractéristiques dysmorphiques (Miles et al., 2005 ; Miles and Hillman, 2000).
Beaucoup d'auteurs avancent que l’étiopathogénie des TSA serait plurifactorielle et associerait des facteurs génétiques à des facteurs environnementaux tels qu’une souffrance prénatale ou néonatale, la pollution, une migration parentale, le contexte psycho-social… (Tordjman et al., 2014) En effet, les études portant sur les jumeaux concluent dans leur ensemble à une concordance de taux d’autisme plus élevée chez les paires de jumeaux homozygotes (de 60 à 90%) comparativement aux paires de jumeaux hétérozygotes (0 à 30%) (Ronald and Hoekstra, 2011 ; Sandin et al., 2014). Les apports de la génétique au sujet de l’autisme nous permettent également de mieux comprendre les mécanismes neurobiologiques à l’œuvre. L’architecture génétique des TSA est complexe et repose sur les concepts de
variants génétiques (Bourgeron, 2015) et d’épistasie, c'est-à-dire les interactions entre plusieurs gènes. Certains variants sont rares et particulièrement délétères, d’autres communs à une part relativement importante de la population et ne favorisent le déclenchement de la maladie que lorsqu’ils s’accumulent au-delà d’un certain seuil. Cependant, les examens génétiques de routine ne sont pas encore capables de prendre en compte l’accumulation de ces variants génétiques communs. Dans l’état actuel des connaissances et des techniques, une altération génétique unique et délétère (par exemple un réarrangement chromosomique, un CNV (Copy Variant Number), une mutation) est retrouvée chez 35 à 40% des individus avec TSA (Huguet et al., 2013 ; Betancur, 2011). Une liste détaillée mais non exhaustive de ces altérations génétiques connues comme étant associées à l’autisme est mise en annexe de ce travail et va prochainement faire l’objet d’une publication. À ce jour, plus de 200 gènes de susceptibilité ont été identifiés, et des anomalies cytogénétiques ont été rapportées pratiquement sur tous les chromosomes (Miles, 2011). La majorité des gènes concernés sont impliqués dans des processus physiologiques tels que le remodelage de la chromatine, le métabolisme et la synaptogénèse (Bourgeron, 2015). Certains auteurs suggèrent que, pour un patient donné, plus la part génétique dans le TSA est importante, plus les signes dysmorphiques et les déficits cognitifs seront présents (Miles and Hillman, 2000 ; Miles et al., 2005). Ainsi, la probabilité de retrouver des anomalies génétiques augmente avec le déficit intellectuel, et les anomalies chromosomiques déséquilibrées sont davantage retrouvées chez les enfants autistes présentant des caractéristiques dysmorphiques. L’association d’une DI ou de signes dysmorphiques avec une symptomatologie autistique est évocatrice de ce que certains cliniciens nomment « autisme syndromique » (Cohen et al., 2005). Le concept d'autisme syndromique ou “autisme complexe” qualifie les individus présentant, en plus du syndrome autistique, une dysmorphie ou une déficience intellectuelle sévère, ou une malformation. Ces symptômes sont évocateurs d'une association de l'autisme avec un syndrome génétique. Il est opposé au concept d'autisme non-syndromique (ou autisme pur/simplex/idiopathique) qui qualifie les individus avec ou sans déficience intellectuelle légère ou modérée et aucun autre signe ou symptôme associé (exceptée l'épilepsie) (Cohen et al., 2005). Il est important de noter ici que les techniques de génétique moléculaire ont permis de mettre en évidence des centaines de mutations (ponctuelles ou CNV) associées à l'autisme non-syndromique. Des auteurs (Miles et al., 2005) ont suggéré que l'autisme syndromique est, comparativement à l'autisme non-syndromique, associé à un moins bon pronostic, un sex ratio homme/femme plus faible (3/1 dans l'autisme syndromique versus 6/1 dans l'autisme non-syndromique), un risque plus faible dans la fratrie (autisme syndromique : 4 à 6 %, autisme
non-syndromique : jusqu'à 35 %) et une moindre survenue de l'autisme dans la famille (autisme syndromique : 9 %, autisme non-syndromique : jusqu'à 20 %). On utilise de manière similaire les concepts de déficience intellectuelle syndromique, c'est-à-dire associée à une dysmorphie ou des signes/symptômes médicaux ou comportementaux, et de déficience intellectuelle non-syndromique (sans autre anomalie associée). La limite de cette distinction est qu'elle dépend des progrès scientifiques et techniques. On peut supposer, comme le soulignent Tordjman et al. (article soumis), qu'un autisme non-syndromique chez un individu donné pourrait devenir un autisme syndromique si de nouvelles anomalies génétiques sont identifiées révélant des signes cliniques discrets, des petites malformations ou des anomalies biologiques. Ainsi, il pourrait apparaître plus judicieux de considérer l'autisme comme un syndrome comportemental associé à des anomalies génétiques connues ou à ce jour non connues.
Après avoir éliminé les causes sensorielles (surdité, cécité) lors de consultations ORL et ophtalmologique, ainsi que les causes neurologiques lors d’une consultation neuropédiatrique, la recherche de signes associés constitue la première étape du diagnostic étiologique en génétique. Cette recherche requiert premièrement une investigation complète des antécédents familiaux, notamment d’une consanguinité et d’éventuelles fausses couches spontanées répétées, deuxièmement de retracer précisément les étapes développementales des périodes prénatales, néonatales et postnatales, troisièmement un examen physique minutieux par un généticien formé en dysmorphologie. Les investigations complémentaires constituent la deuxième étape du diagnostic étiologique génétique. La plupart des équipes de génétique utilisent des outils d’investigation plus récents et précis que le caryotype standard, tels que l’analyse chromosomique par puce à ADN (ACPA). Cette technique met en évidence des anomalies 10 à 100 fois plus petites que les anomalies visibles sur un caryotype, ce qui permet de détecter des variations du nombre de copies de régions chromosomiques, c’est-à-dire des duplications ou des délétions, qui n’étaient pas détectables à partir d’un caryotype standard. À noter toutefois que cette technique ne permet pas de mettre en évidence les remaniements chromosomiques équilibrés (tels que les translocations, qui sont rarement à l’origine de trouble du développement), ni les anomalies présentes dans moins de 10 à 20 % des cellules (mosaïque génétique). Enfin, en cas de suspicion de syndrome génétique orientée par la clinique, le généticien effectue des investigations ciblées (bilan métabolique, biologie moléculaire…).
En conséquence, ces investigations peuvent aboutir à un diagnostic étiologique précis, un traitement personnalisé, un conseil génétique adapté à chaque famille et peuvent permettre aux parents de se déculpabiliser par rapport à l'éducation qu'ils ont apportée à leur enfant. Ainsi, tous les enfants recevant un diagnostic de TSA doivent pouvoir bénéficier d’un bilan génétique afin de rechercher les signes associés évocateurs d’anomalies génétiques connues. Or, pour diverses raisons, tous les patients diagnostiqués TSA ne peuvent pas bénéficier d’une consultation de génétique clinique et peu d’alternatives s’avèrent réalisables en routine : (i) former les psychiatres à la dysmorphologie ? (ii) envoyer des photos de patients pour avis à des généticiens ? (iii) trier selon des critères cliniques les patients nécessitant une consultation de génétique ? C’est dans cette problématique que s’inscrit notre étude.
Syndromes génétiques associés à l’autisme
Ci-après sont détaillés pour exemple quelques syndromes génétiques associés aux TSA avec dysmorphie. Une liste beaucoup plus complète des syndromes génétiques associés à l’autisme est disponible en annexe de ce travail et fait l’objet d’un article en cours de publication. Les descriptions cliniques proviennent du site internet Orpha.net, l’originalité de la présente approche a constitué à rechercher, à partir de la littérature scientifique, quelles caractéristiques ces syndromes génétiques partagent avec les TSA et en quelle proportion.
• Trisomie 21 (syndrome de Down) :
La trisomie 21 est une anomalie chromosomique définie par la présence dans le noyau des cellules d'un troisième exemplaire, en totalité ou en partie, du chromosome 21. La trisomie 21 n'est pas une anomalie rare, mais son incidence à la naissance a diminué significativement dans plusieurs pays, après la mise en place du dépistage prénatal. La prévalence à la naissance est actuellement estimée à 1/2000 naissances vivantes en France. Une DI variable, souvent légère, une hypotonie musculaire et une laxité articulaire quasi-constantes sont les conséquences habituelles, souvent accompagnées de signes morphologiques et d'un risque de complications. Les particularités morphologiques (fentes palpébrales en haut et en dehors, épicanthus, nuque plate, visage rond, nez petit, pli palmaire unique bilatéral) peuvent être discrètes et ne sont pas pathognomoniques. Les principales malformations et complications possibles incluent : malformations cardiaques (canal atrio-ventriculaire) et digestives (atrésie duodénale), cataracte congénitale, maladie de
Hirschsprung, petite taille, syndrome de West, épilepsies, leucémies, apnées du sommeil, déficits sensoriels, pathologies auto-immunes et endocriniennes (hypothyroïdie, intolérance au gluten, diabète, alopécie), vieillissement plus précoce et maladie d'Alzheimer. Bien que la plupart des personnes atteintes de trisomie 21 ne présentent pas de symptômes autistiques, les études épidémiologiques estiment le taux d’autisme dans cette population de l’ordre de 5 à 10%, ce qui est donc bien au-dessus de la prévalence en population générale. Bien que très connue et relativement fréquente, cette pathologie n’est pas toujours évidente à diagnostiquer du fait de la possible absence des signes caractéristiques, notamment lorsque la trisomie ne touche pas toutes les cellules (mosaïque génétique) ou lorsque la trisomie est partielle (Bregman and Volkmar, 1988 ; Moss and Howlin, 2009).
• Syndrome de l'X fragile :
Le syndrome de l'X fragile (FXS) est une maladie génétique s'exprimant par un déficit intellectuel léger à sévère, qui peut être associé à des troubles du comportement, et à des signes physiques caractéristiques. Sa prévalence estimée est d'environ 1/2 500 (prévalence de la mutation complète) à 1/4 000 (cas symptomatiques) dans les deux sexes. Dans l'enfance, les garçons ont un retard des acquisitions motrices et/ou du langage. Chez les garçons et 50 % des filles, les troubles intellectuels s'associent à des troubles du comportement et/ou à des signes dysmorphiques. Otites et sinusites récidivantes et convulsions sont possibles. Le déficit intellectuel va de troubles mineurs de l'apprentissage avec QI normal, à un déficit sévère pouvant toucher la mémoire immédiate et de travail, les fonctions exécutives, les capacités visuo-spatiales et mathématiques. Les troubles du comportement peuvent être discrets (humeur instable) ou sévères, de type autisme (battements de mains, contact oculaire pauvre, évitement du regard, morsures de mains, défense tactile et désinhibition). Troubles de l'humeur, anxiété et agressivité sont possibles. Chez les filles, les troubles intellectuels et du comportement sont en règle discrets, à type de troubles affectifs et de l'apprentissage. Dans les deux sexes les signes physiques sont plus ou moins discrets : visage étroit et allongé, oreilles et front proéminents, hyperlaxité des doigts, pieds plats et macro-orchidie chez le garçon après la puberté.
Le FXS est dû à l'inhibition de la transcription du gène FMR1 (Xq27.3), causée par l'expansion de la répétition de triplets (CGG)n dans sa région 5' non traduite et les méthylations qui s'en suivent. Ces mutations complètes proviennent d'allèles instables, prémutés (55 à 200 répétitions de CGG). Les prémutations sont notamment associées à un risque d'insuffisance ovarienne précoce (IOP) chez les femmes et au syndrome
tremblement-ataxie lié à une prémutation de l'X fragile. De rares cas de mutations ponctuelles intragéniques de FMR1 sans expansion de répétitions CGG ont été décrits. Le gène FMR1 code pour FMRP, une protéine de liaison de l'ARN qui régule la synthèse protéique et d'autres voies de signalisation dendritiques. L'inhibition transcriptionnelle de FMR1 réduirait la plasticité et la modulation synaptique dans l'ensemble du cerveau, y compris l'hippocampe.
La proportion de syndrome autistique chez les individus avec X-Fragile a longtemps fait débat, si bien qu'il est difficile d'avancer un chiffre. A l'inverse, le taux de l'X Fragile dans la population avec TSA est mieux connu, entre 2 et 8 % selon Harris et al. (2008).
• Délétion 1p36 :
Le syndrome de délétion 1p36 est une anomalie chromosomique caractérisée par une dysmorphie faciale, une hypotonie, un retard de développement, une DI, une épilepsie, des malformations cardiaques, une détérioration de l'ouïe et l'apparition prénatale d'un déficit de croissance. Le syndrome de délétion 1p36 est le syndrome délétionnel le plus courant, avec une incidence de 1/5000 à 1/10000 naissances vivantes. Environ 50% des cas sont dus à une délétion terminale de novo en 1p36, environ 29% à une délétion interstitielle, et le reste des cas à des réarrangements chromosomiques plus complexes. La dysmorphie crânio-faciale est caractérisée par des sourcils droits, des yeux enfoncés dans les orbites, une arête nasale large et plate, une partie moyenne du visage hypoplasique, un philtrum long, un menton pointu et un retard fréquent de fermeture de la fontanelle antérieure (>3 cm à la naissance), une microbrachycéphalie et des oreilles retournées d'implantation basse et malformées. Une brachydactylie, une camptodactylie et des pieds courts sont fréquents. Presque tous les patients présentent une hypotonie congénitale entraînant des difficultés de déglutition, un retard du développement moteur et de la motricité, et une absence de l'acquisition du langage. Un degré variable de déficit intellectuel est observé chez tous les patients. Ce syndrome est dû à une délétion hétérozygote partielle sur la partie distale du bras court du chromosome 1, avec des points de rupture allant de 1p36.13 à 1p36.33. Beaucoup de ces enfants ont des problèmes comportementaux : accès de colère, auto-agressivité, fascination pour l’eau. Bien qu’il n’y ait pas d’étude épidémiologique sur le sujet, des symptômes autistiques ont également été rapportés. (Bello and Rodríguez-Moreno, 2016)
Le syndrome de délétion 22q11.2 est une anomalie chromosomique congénitale, caractérisée le plus souvent par des malformations cardiaques et palatines, une dysmorphie faciale, un retard du développement et une immunodéficience. La prévalence est estimée entre 1/2000 et 1/4000 naissances vivantes. La délétion apparaît de novo dans environ 90% des cas. Il y a 50% de risque de transmission à leur descendance. Les malformations cardiaques congénitales (77% des cas) incluent des malformations conotroncales (tronc artériel commun, tétralogie de Fallot, communication interventriculaire). Plus de 75% des patients présentent des malformations palatines (fente palatine ou labio-palatine, insuffisance vélopharyngienne) pouvant causer hypernasalité (voie nasillarde) et dysphagie. Le retard de développement est fréquent. Beaucoup présentent une dysmorphie faciale modérée (ptosis, hypertélorisme, épicanthus, base nasale proéminente, hypoplasie malaire) et des anomalies vertébrales (vertèbre en papillon, hémivertèbre). Soixante-quinze pour cent ont une imunodéficience secondaire à une aplasie/hypoplasie thymique qui les expose à des infections. Ils ont aussi un risque plus élevé de développer une maladie auto-immune. Une hypocalcémie néonatale est notée dans 50% des cas. D'autres manifestations peuvent inclure des malformations gastro-intestinales (malrotation intestinale, imperforation anale), rénales (agénésie), dentaires (hypoplasie de l'émail), une surdité, des difficultés d'apprentissage et/ou des troubles psychiques (difficultés de communication, déficit de l'attention, hyperactivité, schizophrénie). L’association de ce syndrome avec les TSA ne fait pas encore consensus. Pourtant, selon de récentes études, le taux de TSA parmi les patients présentant ce syndrome est évalué autour de 11%. (Lo-Castro et al., 2009)
• Microdélétion 8p :
Le syndrome de microdélétion 8p23.1 implique une délétion partielle du bras court du chromosome 8, conduisant à un faible poids à la naissance, un retard de croissance postnatale, une DI légère, une hyperactivité, des anomalies cranio-faciales et des malformations cardiaques congénitales. La prévalence est inconnue mais les délétions 8p23.1 sont rares. La plupart des délétions 8p23.1 surviennent de novo. Cependant, les parents peuvent aussi être porteurs et transmettre le réarrangement chromosomique à leurs enfants, avec un risque de 50% pour chaque enfant. Les manifestations les plus fréquentes incluent un retard de croissance pré- et postnatale, un faible poids à la naissance, une DI légère à modéré, un retard psychomoteur, un trouble du langage, des convulsions et des troubles comportementaux tels qu'une hyperactivité et une impulsivité. Les anomalies cranio-faciales et dysmorphiques fréquentes incluent une microcéphalie, un front haut et étroit, une arête nasale large, un
épicanthus, un palais ogival, un cou court et des oreilles basses et dysplasiques. De plus, des malformations cardiaques congénitales (communication interatriale, communication interventriculaire, anomalie du canal atrioventriculaire et sténose pulmonaire) ont été fréquemment rapportées, ainsi qu'une hernie diaphragmatique congénitale, une cryptorchidie et un hypospadias chez les garçons. Certains patients ne présentent pas de déficience intellectuelle.
L’association de ce syndrome avec les TSA n’a été rapportée que dans peu de publications. Cependant, elle semble l’être de plus en plus, probablement du fait de l’arrivée et de l’utilisation en pratique clinique depuis quelques années d’une nouvelle technique de cytogénétique, l’ACPA (analyse chromosomique par puce à ADN). En effet, son utilisation en pratique courante a permis de détecter l’anomalie dans des formes pauci-symptomatiques, par exemple sans caractéristique dysmorphique, chez des patients qui, jusqu’alors, n’étaient pas testés. (Nucaro et al., 2011) Un gène inclus dans cette région chromosomique, le gène de la microcéphaline 1, semblerait être responsable de la symptomatologie autistique.
• Duplication 15q11-q13 :
Le syndrome de microduplication 15q11-q13, se caractérise de manière inconstante par des troubles du comportement, une hypotonie, des déficits cognitifs, un retard du langage et une épilepsie. La prévalence est inconnue. Il se manifeste dès la petite enfance par des troubles du développement en particulier du langage, une hypotonie, une épilepsie volontiers rebelle, des troubles comportementaux comme une hyperactivité ou des TSA, une dysmorphie faciale et des membres discrète et inconstante (macrocéphalie, fentes palpébrales obliques en bas et dehors, épicanthus, visage inexpressif, clinodactylie, syndactylie), et une petite taille. Le tableau clinique est très variable même au sein d'une même famille. Les duplications paternelles sont rarement symptomatiques (troubles du développement et du comportement). Le syndrome est dû à des duplications touchant la région critique de Prader-Willi/Angelman soumise au phénomène d’empreinte (c’est-à-dire qui s’exprime différemment selon l'origine parentale du chromosome), et dont des délétions sont en cause dans les syndromes de Prader-Willi et d'Angelman. Les duplications symptomatiques touchent avec prédilection le chromosome maternel. En effet, les gènes en cause, soumis à empreinte, ne sont exprimés qu'à partir de l'allèle maternel.
Après le syndrome du X-Fragile, il s’agit probablement de la plus fréquente des anomalies génétiques associée aux TSA. Cette anomalie est décrite comme se manifestant généralement par un tableau d’autisme et de DI sévères chez plus de 80% des patients. Cependant, pour les
mêmes raisons qu’indiqué plus haut liées aux progrès des techniques génétiques et à leur généralisation, cette anomalie est de plus en plus mise en évidence chez des patients qui présentent des formes moins sévères. (Bolton et al., 2001)
• Délétion 2q37
La délétion 2q37, ou monosomie 2q37, concerne la région terminale du chromosome 2 avec des points de cassure dans la bande 2q37 et se manifeste par trois signes cliniques majeurs : un retard du développement, des malformations squelettiques et une dysmorphie faciale. Son incidence annuelle est estimée à moins de 1/10 000. La plupart des cas présentent un phénotype de syndrome d'ostéodystrophie héréditaire d'Albright-like avec un retard du développement ou un déficit intellectuel, une petite taille chez 23 % des patients, une tendance, avec l'âge, à l'obésité et une brachymésophalangie (50 % des patients). Les manifestations cliniques suivantes sont également fréquentes : une clinodactylie du cinquième doigt et des petits pieds/mains, une syndactylie des doigts des mains ou des pieds, et une microcéphalie ou une macrocéphalie. La dysmorphie faciale est caractéristique et comprend un visage rond, des cheveux clairsemés, un front proéminent, des fentes palpébrales obliques, des yeux profondément situés dans les orbites, des sourcils peu fournis et arqués, une hypoplasie médiofaciale, une racine nasale enfoncée, des ailes du nez basses et une columelle proéminente, une pointe de nez en forme de V, un vermillon des lèvres fin, et un palais ogival. Les mamelons sont souvent très écartés ou supernuméraires. Un eczéma est souvent présent. Environ 30 % des patients présentent des malformations majeures. Des malformations congénitales cardiaques, gastrointestinales (30 % des patients), génitales (11 % des cas) et du système nerveux central (6 % des patients) ont été rapportées. Une hypotonie est souvent présente. Des convulsions (35 % des patients) et des troubles du comportement (30 % des cas) ont été rapportés.
Un syndrome autistique est associé dans 25 à 35% des cas avec au premier plan : un comportement répétitif et des difficultés sévères de communication et d'interaction sociale, des mouvements stéréotypés, une agressivité intermittente, une hyperactivité, un trouble déficitaire de l'attention. Un trouble obsessif-compulsif et des troubles du sommeil sont également souvent retrouvés. (Fisch et al., 2016)
• Syndrome de Williams-Beuren :
Le syndrome de Williams-Beuren (souvent nommé syndrome de Williams) est une maladie génétique développementale rare dont la prévalence est estimée entre 1/7500 et 1/25000
naissances vivantes. Le syndrome est dû à une délétion de l’un des chromosomes 7 au niveau de la région 7q11.23. Cette microdélétion, survenant la plupart du temps de façon sporadique, entraîne la suppression de plusieurs gènes dont celui de l'élastine, conduisant à une sténose aortique supravalvulaire dans 75% des cas. Le phénotype inclut une petite taille, des anomalies cranio-faciales avec une dysmorphie faciale caractéristique (visage de type elfique), une démarche atypique, des anomalies affectant différents systèmes : vasculaire, musculosquelettique, endocrine, ophtalmologique (strabisme et troubles de la réfraction) et une hypercalcémie évoluant vers la néphrocalcinose. En outre, des problèmes d’alimentation (sélection des aliments) et des troubles du sommeil ont souvent été rapportés. Ces patients présentent généralement un profil cognitif et comportemental atypique avec une DI légère à modérée, une hyperacousie, un attrait pour la musique, des difficultés de repérage visuo-spatial, contrastant avec une bonne mémoire à court terme et un langage correct. La personnalité est souvent marquée par un contact hypersociable et familier, paraissant à l’opposé des comportements autistiques. Pour autant, plusieurs études rapportent la co-existence du syndrome de Williams avec les TSA qui concernerait 5% des patients atteints de ce syndrome. (Lincoln et al., 2007)
• Syndrome d’Angelman :
Le syndrome d’Angelman est une maladie neurogénétique caractérisée par une DI sévère et des traits dysmorphiques. Sa prévalence mondiale est estimée de 1/20 000 à 1/10 000. Il est dû à un défaut de transcription du gène maternel de l’UBE3A (une biquitin-protein ligase). Ce gène se situe dans la région 15q11-q13, région soumise au phénomène d’empreinte décrit plus haut. Dans 2/3 des cas, le remaniement chromosomique survient par une délétion apparue de novo. D’autres mécanismes sont possibles, tels que les translocations, les inversions, la disomie uniparentale paternelle (présence de la copie d’origine paternelle en double dose) dans 5 % des cas ; la mutation d’empreinte ou la petite délétion du centre d’empreinte, dont la conséquence est l’absence de méthylation de la région 15q11/15q12 (5–10 % des cas) ; une mutation du gène UBE3A, dont la fréquence semble être de l’ordre de 4 à 5% ; enfin, pour moins de 15 % des patients, le mécanisme moléculaire reste inconnu. À noter que le syndrome de Prader-Willi résulte d’une perte de la contribution paternelle de la même région chromosomique et ne partage pas le même phénotype.
Les profils cognitifs et comportementaux des enfants avec syndrome d’Angelman partagent plusieurs caractéristiques avec les TSA. Ils présentent une DI modérée à sévère et une absence de langage, des comportements stéréotypés (frapper des mains, objets mis à la bouche). La
marche est instable et généralement ataxique (marche sur la pointe des pieds). Ces enfants sont excitables et hyperactifs. L’hyperactivité motrice est souvent associée à un déficit attentionnel, rendant difficiles les interactions sociales et particulièrement le contact oculaire. Deux signes comportementaux sont considérés comme caractéristiques : les rires excessifs et paroxystiques et les crises de colère qui, comme dans l’autisme paraissent inadaptés au contexte. Le phénotype inclut d’autres signes également associés à l’autisme tels que l’intolérance au changement, les auto-mutilations, la fascination pour l’eau, les troubles du sommeil et l’épilepsie. Davantage d’études sont nécessaires pour préciser la fréquence des TSA dans le syndrome d’Angelman (48 à 80% des cas selon les études) et la part de ce syndrome dans la population des individus atteints de TSA. (Steffenburg et al., 1996 ; Walz, 2007)
• Syndrome de Cornelia de Lange :
Le syndrome de Cornelia de Lange est un syndrome malformatif d'expression variable caractérisé par une dysmorphie faciale très reconnaissable accompagnée d'un déficit intellectuel de sévérité variable, d'un important retard de croissance à début anténatal (deuxième trimestre), d'anomalies des extrémités (oligodactylie, voire amputation plus sévère, brachymétacarpie du premier métacarpien constante), parfois de malformations associées (cardiaques, rénales...) et d'un risque de surdité. La prévalence en Europe est comprise entre 1/62 500 et 1/45 000. Presque tous les cas sont sporadiques. Les caractéristiques distinctives du visage incluent des sourcils bien dessinés, arqués et confluents (synophrys), des cils longs, des narines antéversées, une bouche aux coins tombants avec une lèvre supérieure très fine, et une micrognathie. Les problèmes d'alimentation sont généralement importants les premières années, souvent aggravés par un reflux gastro-oesophagien. L'affection évolue toujours vers un retard psychomoteur et des difficultés d'acquisition du langage, et parfois vers des troubles du comportement de la série autistique. Des mutations ont été identifiées dans trois gènes impliqués dans la cohésion des chromosomes (complexe cohésine). Le gène NIPBL (5p13.2) est muté chez environ 50 % des patients et correspond au gène majeur du syndrome. Des mutations associées à des formes mineures de la maladie ont été récemment décrites au niveau du gène SMC1A (SMC1L1 ; Xp11.22-p11.21), associé à une forme de syndrome Cornelia de Lange liée à l'X, et au niveau du gène SMC3 (10q25).
Selon une étude récente, 43% de ces patients présenteraient un TSA. (Moss and Howlin, 2009) Les comportements les plus caractéristiques seraient l’auto-agressivité, les comportements répétitifs et les difficultés d’acquisition du langage.
On notera qu’en France, le diagnostic prénatal de ces syndromes est possible par amniocentèse ou biopsie de trophoblaste pour les cas familiaux ou pour les grossesses pour lesquelles des malformations associées ont été observées lors d'une échographie fœtale. Le diagnostic génétique préimplantatoire est également possible.
Objectifs
Objectif général :
Evaluer l’intérêt de la recherche de signes dysmorphiques dans une population de patients avec TSA dans un but étiologique. A notre connaissance il n'existe pas d'étude portant sur ce thème.
Plus globalement, nous espérons d’une part sensibiliser les psychiatres à l’intérêt d'un examen de génétique clinique pour leurs patients, d’autre part évaluer quelle place un algorithme informatique pourrait prendre dans la prise en charge médicale des personnes souffrant de TSA et de leurs familles.
Objectif spécifique :
Comparer les hypothèses étiologiques de généticiens expérimentés en dysmorphologie avec celles émises par un algorithme informatique, sur une même population de jeunes patients avec TSA. Ces hypothèses ont été par la suite vérifiées par des examens de cytogénétique et de génétique moléculaire.
Méthodologie
Population
La population a été recrutée par le Pr Sylvie Tordjman dans le cadre d’un contrat de recherche INSERM ERCA (Equipe de Recherche Clinique Associée : contrat PARMERCA 9619, Responsable : Sylvie Tordjman). Les consentements libres, éclairés et signés des parents ont été recueillis et l’avis favorable du Comité de Protection des Personnes de l’hôpital Bicêtre a été obtenu. Les photographies et autres données cliniques ont toutes été anonymisées. Les participants ont été recrutés de façon systématique dans des hôpitaux de jour et IME (Institut Médico-Educatif) de la région parisienne et Champagne-Ardenne. Toutes ces personnes sont d’origine caucasienne. L’échantillon comporte au final 79 enfants et adolescents, dont 54 garçons et 25 filles. Le sex ratio se rapproche donc de 2 garçons pour une fille, ce qui de manière attendu est inférieur au sex ratio de 4/1 cité dans la littérature concernant les TSA et correspond au ratio observé lorsque l'on considère uniquement la population autiste avec DI (cf plus haut dans la partie « Etat de la question »). L’âge moyen au moment de la prise des photographies est de 10,4 ans avec un écart-type (ET) de 4,4 ans. Tous les patients sont en bonne santé physique, mais il est retrouvé pour 32 d’entre eux dans les antécédents personnels une épilepsie idiopathique diagnostiquée par un neuropédiatre avec électro-encéphalogramme. Les courbes de croissance (poids, taille, périmètre cranien actuels et de 0 à 3 ans) ont été recueillies auprès des parents à partir des carnets de santé.
− Diagnostic et sévérité des troubles autistiques
Tous les sujets ont reçu un diagnostic d’autisme infantile, posé par deux pédopsychiatres, l’un appartenant à l’institution dans laquelle se trouve l’enfant, l’autre travaillant à l’extérieur, sur les critères des trois classifications suivantes: DSM-IV-TR (classification américaine, Manuel Diagnostique et Statistique des Troubles Mentaux, 4ème version révisée), CIM-10 (classification de l’OMS : Classification Internationale des Maladies, 10ème version) et la Classification Française des Troubles Mentaux de Enfant et de l'Adolescent. Le diagnostic a également été confirmé à l’aide de l’échelle ADI-R (Autism Diagnostic Interview-Revised) et de l'échelle ADOS module 1 (Autism Diagnostic Observation Schedule).
• L'ADI-R :
L'ADI-R est un entretien semi-structuré réalisé avec les personnes vivant avec l'enfant, en général les parents. Sa caractéristique semi-structurée signifie que les questions sont ciblées et ouvertes (c'est-à-dire dont la réponse attendue n'est pas oui ou non). L'objectif principal est d'obtenir une description détaillée des comportements de l'enfant, à la recherche des symptômes requis pour porter le diagnostic de Trouble Envahissant du Développement selon la CIM-10 et le DSM IV, dans les quatre domaines suivants :
− la réciprocité des interactions sociales,
− le langage,
− la communication non verbale,
− les intérêts restreints, répétitifs et stéréotypés.
L'ADI-R est le seul instrument diagnostique de l'autisme tenant compte des critères de la CIM-10 et du DSM IV pour l'élaboration des principaux axes d'exploration de ce syndrome. Cet entretien passe par une description clinique très détaillée des différents symptômes qui,
une fois regroupés selon les axes du DSM IV et de la CIM-10, permettent de poser le diagnostic d'autisme, ce qui a été le cas de tous les sujets de notre étude. Les passations de l'ADI-R ont été réalisées par le Dr Frédéric Slama dans le cadre de son master 2, formé à l'ADI-R à l'université de Chicago dans le service du Pr Catherine Lord, qui a conçu l'ADI-R en 1982 avec M. Rutter, professeur de psychiatrie à Londres..
La structure de cet entretien repose sur le choix entre les différentes cotations proposées pour chaque item comportemental. L'entretien comprend six sections :
− informations générales : sur le sujet et sa famille,
− développement précoce : l'âge auquel les parents ont commencé à s'inquiéter à propos de leur enfant et pour quelle raison, les différentes étapes des acquisitions psycho-motrices, en demandant aux parents de contextualiser ces informations pour obtenir des souvenirs précis ,
− communication et langage,
− développement social et jeu,
− intérêts et comportements inhabituels,
− et enfin difficultés non spécifiques et aptitudes particulières.
Ces six sections comportent en tout 111 items, explorant la période actuelle et les premières années avec un focus sur la période de 3 à 5 ans, pendant laquelle la symptomatologie autistique s'exprime généralement la plus intensément.
Son administration nécessite en moyenne 1h30 à 2h00. L'investigateur doit être formé à l'utilisation de cet instrument et connaître les distinctions conceptuelles sous-jacentes à chaque codage et la nature des informations qu'il est nécessaire de rechercher sur le comportement pour décider d'une cotation. Concernant notre population, un score global de sévérité de l'autisme a été établi à partir de l'ADI-R sur les troubles des interactions sociales, les troubles de la communication verbale et non verbale et les comportements anormaux.
La présence ou l'absence de langage verbal a été évalué par l'item 19 de l'ADI-R. La présence de langage est définie par l' utilisation quotidienne d'un langage adapté avec des phrases d'au moins 3 mots incluant un verbe.
• L' échelle ADOS module 1 :
Les comportements autistiques actuels (c'est-à-dire au moment de la prise des photographies) des sujets de l'étude ont été évalués à partir d'une situation d'observation standardisée de l'enfant au moyen de l'ADOS module1. Les passations ont été réalisées par les professionnels de 11 équipes différentes que le Pr Sylvie Tordjman a formées à cette échelle.
L'ADOS évalue trois grands domaines comportementaux : les interactions sociales, la communication verbale et non verbale, et les stéréotypies idéïques et comportementales. L'ADOS module 1 est une échelle d'évaluation des troubles autistiques conçue pour les enfants à partir de 30 mois ayant un langage verbal limité ou absent. Cette évaluation se fait à partir de 8 situations de jeux standardisés d'une durée d'environ 30 minutes. L'ordre des situations est flexible, il est déterminé par l'évolution de l'interaction. Les parents ou personnes qui s'occupent de l'enfant sont invités à rester auprès de lui durant la passation ; ils pourront être appelés à participer lorsque l'enfant n'entre pas en interaction avec le clinicien. La passation débute par une période de jeu libre durant laquelle l'enfant peut s'habituer à la pièce et aux jouets.
L'échelle ADOS permet une évaluation de la sévérité des troubles autistiques suivant une cotation graduée de 0 à 3 pour chaque item (0 : absence de troubles autistiques, 1 : troubles autistiques légers, 2 : troubles autistiques moyens, 3 : troubles autistiques sévères). Chacun des items de l'ADOS est coté sur une échelle ordinale. Or, l'utilisation des moyennes nécessite une échelle d'intervalle. Il n'était donc pas possible de constituer des moyennes en additionnant simplement les scores des items. En conséquence, de manière à conserver un paramètre de tendance centrale pour les trois domaines de comportements et afin de respecter la nature ordinale de la cotation de chaque variable, la médiane de tous les items appartenant au même domaine a été utilisée. De façon à utiliser toute la richesse descriptive de ces échelles, il a été établi pour chaque évaluation un profil de scores concernant les domaines suivants : communication verbale et non-verbale, jeu, interaction sociale, ruminations idéïques, stéréotypies comportementales, affects. Ces sept sous-domaines incluent tous les items de l'ADOS.
− Niveau de fonctionnement intellectuel
Les capacités cognitives de chacun des patients ont été évaluées par Elisabeth SPITZ, actuellement professeur en psychologie, à l’aide de trois échelles de Wechsler (WPPSI-R, WISC-R, WAIS-R) administrées aux patients en fonction de leur âge. Les résultats de ces tests montrent une population très homogène concernant les capacités cognitives, puisque tous présentent une déficience mentale légère ou moyenne, avec un QI (Quotient Intellectuel) total de 42,2 (ET : 3,2) et une étendue de QI total allant de 40 à 58. La moyenne du QI verbale est de 45,5 (2,2) et celle du QI performance 45,6 (4,1). Beaucoup de patients obtiennent le score le plus bas prévu par les étalonnages des échelles de Wechsler (45 au QI verbal et QI performance et 40 au QI total) notamment dans les subtests verbaux et cet effet plancher ne permet pas une bonne discrimination entre les sujets de très bas niveau. Ces échelles ont été utilisées pour vérifier que le groupe est de bas niveau intellectuel et ce de manière homogène.
− Rythme veille/sommeil
Le sommeil a été évalué à partir d'un questionnaire élaboré avec le Pr Sylvie Tordjman en collaboration avec le Pr D.J. Cohen et le Dr G. Anderson (Yale Child Study Center, USA), portant sur les dimensions quantitatives et qualitatives du sommeil. Quatre aspects ont été pris en compte : le sommeil diurne (nombre de siestes et durée, degré de conscience), l'endormissement (heure, régularité, durée, comportements, rituels), le sommeil nocturne (durée, régularité, réveils nocturnes, présence ou non de parasomnies, comportement autistique) et le réveil (heure, régularité, temps resté au lit après le réveil, comportements, habitudes alimentaires, comportement autistique). Cette évaluation a porté sur deux périodes : la période actuelle et la période la plus difficile en terme de troubles du sommeil. Les passations duraient entre 30 à 45 minutes et ont été réalisées au cours d'un entretien semi-structuré mené par Nadège Pichard, psychologue, auprès des familles et des équipes soignantes.
Face2Gene
Disponible sur le web depuis environ trois ans, un algorithme permet de calculer des probabilités de syndromes génétiques à partir de photographies de visage et de signes cliniques de patients. Il se nomme Face2Gene et se base sur la technologie FDNA® (Facial Dysmorphology Novel Analysis). Il s’agit d’un logiciel détectant des caractéristiques faciales dysmorphiques et des marques reconnaissables de syndromes à partir de critères biométriques de la face. La solution tire profit d’algorithmes sophistiqués et de l'expérience cumulée de centaines de professionnels de la génétique et de centaines de milliers de cas analysés. La technologie FDNA s'améliore au fil du temps, référençant des bases croissantes de données phénotypiques, notamment la London Medical Database (LMD) très riche en cas et clichés et reconnue par les généticiens cliniciens depuis plus de 20 ans. Cet algorithme pourrait donc constituer une alternative intéressante dans le bilan génétique des patients avec TSA. Nous nous sommes donc mis en relation avec Nicole Fleischer de la FDNA incorporation pour ce partenariat.
Procédure
− 1ere partie : étude de génétique clinique et pédopsychiatrique
Les visages de chacun des 79 enfants et adolescents ont tous été photographiés de face et de profil, par une psychologue, Nadège Pichard, qui a été formée par des généticiens à la prise de photo. En effet, les photographies de face doivent être prises de manière à ce que le visage soit bien dégagé, les yeux bien ouverts, sans port de lunettes, l’expression doit être neutre. Les photos de profil doivent bien montrer l’oreille et le profil du visage. Leurs mains (faces dorsale et palmaire) ont également été photographiées. Toutes les photographies ont été
transformées en diapositives et anonymisées. Elles ont ensuite été visionnées par un staff réunissant plusieurs généticiens cliniciens expérimentés en dysmorphologie ne connaissant pas ces patients (Clarisse Baumann, Alain Verloes, Delphine Héron), une neuropédiatre (Lydie Burglen), une psychologue clinicienne (Nadège Pichard) et deux pédopsychiatres (Sylvie Tordjman et David Cohen). Les généticiens avaient également connaissance de la présence d’une DI pour tous les participants, la présence ou l’absence d’antécédent épileptique, la présence ou non de troubles du sommeil, les courbes de croissance (poids, taille et périmètre crânien) allant de la naissance à 3 ans et, au moment de l’étude, la sévérité de l’autisme selon l'ADI-R et l'ADOS, et enfin la présence ou non de langage verbal (selon l'ADI-R).
A partir des diapositives visionnées en staff (faces, profils et mains), les généticiens se sont prononcés de façon concertée sur la présence ou non d’une dysmorphie faciale et d’une dysmorphie des mains, ainsi que la caractérisation de chaque trait dysmorphique détecté. Au final, à partir de l'examen de ces photographies combiné avec les variables cliniques décrites ci-dessus, des hypothèses étiologiques ont été discutées. Tous les patients présentant une dysmorphie ou un doute sur une dysmorphie ont bénéficié avec leurs parents d'une consultation de génétique clinique, comprenant la réalisation d’un examen clinique complet et, si l’hypothèse étiologique le justifiait, d’examens complémentaires afin de rechercher les mutations supposées.
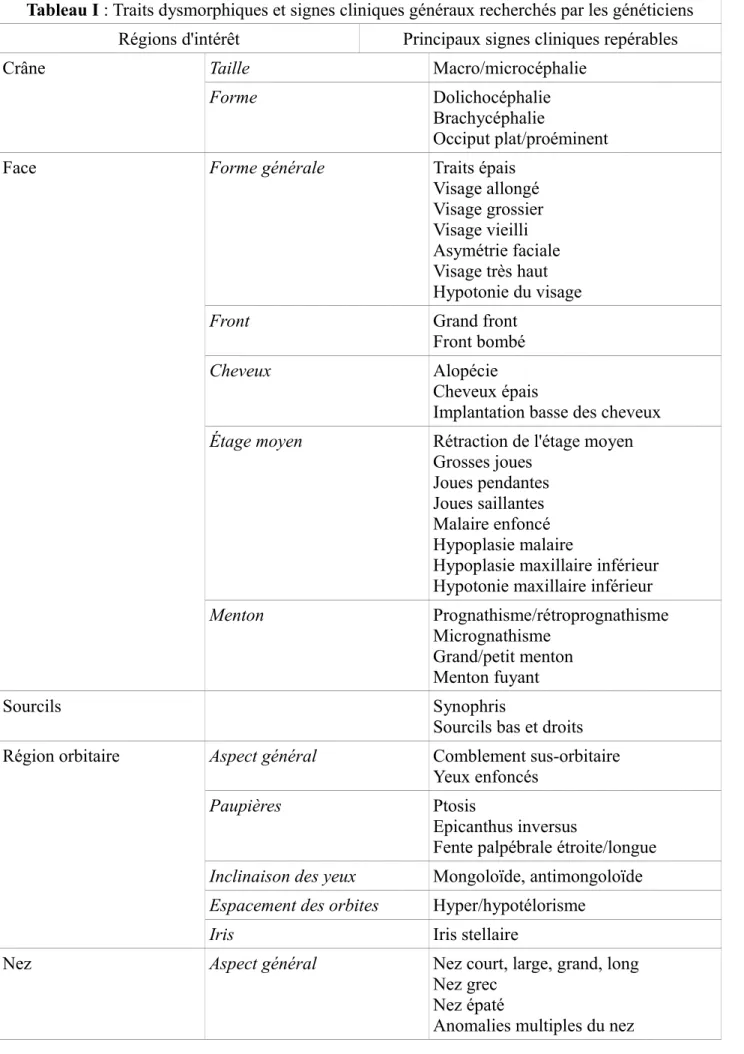
Les traits dysmorphiques et signes cliniques généraux recherchés par les généticiens sont présentés dans le Tableau I qui suit.
Tableau I : Traits dysmorphiques et signes cliniques généraux recherchés par les généticiens Régions d'intérêt Principaux signes cliniques repérables
Crâne Taille Macro/microcéphalie
Forme Dolichocéphalie
Brachycéphalie
Occiput plat/proéminent
Face Forme générale Traits épais
Visage allongé Visage grossier Visage vieilli Asymétrie faciale Visage très haut Hypotonie du visage
Front Grand front
Front bombé
Cheveux Alopécie
Cheveux épais
Implantation basse des cheveux Étage moyen Rétraction de l'étage moyen
Grosses joues Joues pendantes Joues saillantes Malaire enfoncé Hypoplasie malaire
Hypoplasie maxillaire inférieur Hypotonie maxillaire inférieur
Menton Prognathisme/rétroprognathisme
Micrognathisme Grand/petit menton Menton fuyant
Sourcils Synophris
Sourcils bas et droits Région orbitaire Aspect général Comblement sus-orbitaire
Yeux enfoncés
Paupières Ptosis
Epicanthus inversus
Fente palpébrale étroite/longue Inclinaison des yeux Mongoloïde, antimongoloïde Espacement des orbites Hyper/hypotélorisme
Iris Iris stellaire
Nez Aspect général Nez court, large, grand, long
Nez grec Nez épaté
Tableau I : Traits dysmorphiques et signes cliniques généraux recherchés par les généticiens Gros nez bulbeux
Petit nez arrondi
Racine Racine du nez fine
Racine du nez en arrière Crête nasale Etroite/large
rectiligne/concave ou convexe Extrémité du nez Narines antéversées
Ailes du nez Hypoplasie des ailes
Septum Columelle anormale
Bouche Aspect général Grande/petite
Bouche en chapeau de gendarme
Philtrum Court/long
Lèvres Lèvres éversées
Lèvres supérieures fines/épaisse/retroussées/courte Lèvres épaisses Palais Plat Ogival, étroit Large, court
Langue Petite, grosse, proéminente
En glossoptose, protruse État dentaire Grandes incisives
Dents mal implantées Dents écartées
Organes génitaux externes Micropénis
Hypospadias Criptorchidie Testicule ascenseur Ectopie testiculaire Hypertrichose
Oreilles Orientation postérieure
Oreilles basses Petites/grandes oreilles Oreilles simplifiées Oreilles décollées Oreilles anormales Absence de lobules
Extrémités Membres Membres courts
Mains Bifidité des doigts
Polydactilie postaxiale (mains et pieds) Syndactilie
Tableau I : Traits dysmorphiques et signes cliniques généraux recherchés par les généticiens interphalangiennes
Métacarpe court
Phalange terminale courte Hypoplasie de l'ongle Pouce digitalisé
Doigts courts/longs/larges/fuselés Pli palmaire unique
Extrémités fines/carrées
Cou Cou court
Signes cliniques généraux Obésité
Pilosité précoce Hypotonie Régression
Taches achromiques Naevus
− 2eme partie : étude informatique avec Face2Gene
Toutes les diapositives de face et de profil ont été numérisées au format jpeg et envoyées à Nicole Fescher, membre de la FDNA incorporation (société qui a créé et commercialise Face2Gene), ainsi que les renseignements cliniques suivants : DI pour tous les sujets, présence/absence de langage et d'antécédent épileptique, sévérité de l'autisme, troubles du sommeil. Les ingénieurs ont étudié via le logiciel Face2gene les photographies de face de chaque sujet, en aveugle. Cependant, ces données cliniques n'ont pas été prises en compte par le logiciel, qui n'est actuellement pas conçu pour intégrer ces variables aux analyses biométriques, mais le sera plus tard. Les données qu'ils nous ont transmises se composaient pour chaque sujet du nombre et de la description des traits dysmorphiques retrouvés (seuil de significativité pour chaque trait dysmorphique était de 2), des 20 premières hypothèses étiologiques de syndromes génétiques avec pour chaque hypothèse un score intitulé « Face2Gene (Gestalt) score » proportionnel à la probabilité du syndrome génétique (le seuil du score Face2Gene Gestalt était de 2), et enfin pour chaque enfant et adolescent d'un score quantitatif global de dysmorphie faciale sur une échelle continue allant de 0 (pas de dysmorphie) à 1 (très dysmorphique). La définition exacte du score de dysmorphie était la suivante : «The dysmorphic score is a relative value based on Gestalt scores only, normalized
to the highest possible value. The possible values range is between 0-1, where 0 is non-dysmorphic and 1 is a very non-dysmorphic face.” Ce score a aussi été transformé en variable binaire 0 ou 1 (< 0,50 : non dysmorphique, > 0,50 : dysmorphique). Afin d'affiner les hypothèses étiologiques en tenant également compte des variables cliniques, nous avons éliminé des hypothèses proposées par le logiciel tous les syndromes génétiques ayant une probabilité inférieure au seuil donné par le programme informatique (Face2Gene score < 2) et ensuite tous les syndromes non associés à la DI puisque tous les patients de l'étude étaient déficitaires (QI total < 70). Le choix de n'intégrer que la variable DI dans nos analyses des résultats de Face2Gene s'est fait en concertation avec le Pr Sylvie Odent (Service de Génétique Médicale du CHU de Rennes) sur les arguments suivants :
− nous ne pouvions pas éliminer les syndromes pouvant donner une DI mais n'étant pas connus comme favorisant l'autisme, car la limite diagnostique et étiologique entre DI et TSA est parfois floue pour les professionnels et dans les publications. En outre, de nombreux gènes ont été associés à l’un ou l’autre.
− concernant les patients de notre étude qui ont un antécédent d'épilepsie, nous ne pouvions pas éliminer les syndromes ne donnant pas d'épilepsie. En effet, avec les nouvelles techniques de New Generation Sequencing, la génétique moléculaire nous permet de découvrir des nouveaux phénotypes, où l’épilepsie est le symptôme d’entrée chez certains patients, alors que d'autres patients n’en ont pas (FOXG1 est un exemple de gène pouvant donner ces phénotypes).
Statistiques
J’ai saisi les données étudiées sur la matrice Excel et les analyses statistiques ont été réalisées avec le Pr. Sylvie Tordjman en utilisant le logiciel SAS.
La concordance entre la variable de dysmorphie faciale (dysmorphique, non dysmorphique) établie par le staff de généticiens et la variable de dysmorphie faciale résultant du programme Face2 Gene (score de dysmorphie transformé en variable binaire) a été étudiée avec le coefficient Phi et le coefficient Alpha de Cronbach (KR-20). La relation entre la



![Table 1 (Continued) Genetic disorder [References] Estimated rate (%) of the disord er in autis m Estima ted rate (%) of autism in the disorder Degree of intellectual disability(ID) Autistic behaviors Other behaviors Other symptoms Down syndrome*](https://thumb-eu.123doks.com/thumbv2/123doknet/7536262.228010/68.892.62.873.173.1153/continued-references-estimated-intellectual-disability-autistic-behaviors-behaviors.webp)
![Table 1 (Continued) Genetic disorder [References] Estimated rate (%) of the disord er in autis m Estima ted rate (%) of autism in the disorder Degree of intellectual disability(ID) Autistic behaviors Other behaviors Other symptoms Joubert syndro](https://thumb-eu.123doks.com/thumbv2/123doknet/7536262.228010/76.892.84.867.203.1144/continued-references-estimated-intellectual-disability-autistic-behaviors-behaviors.webp)