HAL Id: dumas-01737232
https://dumas.ccsd.cnrs.fr/dumas-01737232
Submitted on 5 Jun 2018HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
pneumopathies acquises sous ventilation mécanique :
diagnostic clinique conventionnel versus algorithme du
Centers for Disease Control and Prevention
Natacha Boulon
To cite this version:
Natacha Boulon. Étude comparée du mode de surveillance des pneumopathies acquises sous ventilation mécanique : diagnostic clinique conventionnel versus algorithme du Centers for Disease Control and Prevention. Médecine humaine et pathologie. 2016. �dumas-01737232�
THÈSE D'EXERCICE / UNIVERSITÉ DE RENNES 1
FACULTÉ DE MEDECINESous le sceau de l’Université Européenne de Bretagne
THÈSE EN VUE DU
DIPLÔME D'ÉTAT DE DOCTEUR EN MEDECINE
Présentée par
Natacha
Boulon
née le 20 novembre 1986 à Saint-Malo
Etude comparée du mode
de surveillance des
pneumopathies acquises
sous ventilation
mécanique : diagnostic
clinique conventionnel
versus algorithme du
Centers for Disease
Control and Prevention
Thèse soutenue à RENNES le 27 avril 2016
devant le jury composé de :
Yannick MALLEDANT Professeur – CHU Rennes - Président Philippe SEGUIN
Professeur – CHU Rennes – Juge Pierre-Yves DONNIO Professeur – CHU Rennes - Juge Ronan GARLANTEZEC
Maître de conférences – CHU Rennes - Juge Sonia ISSLAME
Praticien hospitalier – CHU Rennes – Directeur de thèse
PROFESSEURS DES UNIVERSITES – PRATICIENS
HOSPITALIERS
Nom Prénom
Sous-section de CNU
ANNE-GALIBERT Marie Dominique Biochimie et biologie moléculaire
BELAUD-ROTUREAU Marc-Antoine Histologie; embryologie et cytogénétique
BELLISSANT Eric Pharmacologie fondamentale; pharmacologie clinique; addictologie BELLOU Abdelouahab Thérapeutique; médecine d'urgence; addictologie
BELOEIL Hélène Anesthésiologie-réanimation; médecine d'urgence BENDAVID Claude Biochimie et biologie moléculaire
BENSALAH Karim Urologie
BEUCHEE Alain Pédiatrie
BONAN Isabelle Médecine physique et de réadaptation
BONNET Fabrice Endocrinologie, diabète et maladies métaboliques; gynécologie médicale
BOUDJEMA Karim Chirurgie générale
BOUGET Jacques Thérapeutique; médecine d'urgence; addictologie BOURGUET Patrick
Professeur des Universités en surnombre Biophysique et médecine nucléaire
BRASSIER Gilles Neurochirurgie
BRETAGNE Jean-François Gastroentérologie; hépatologie; addictologie BRISSOT Pierre
Professeur des Universités en surnombre Gastroentérologie; hépatologie; addictologie
CARRE François Physiologie
CATROS Véronique Biologie cellulaire CHALES Gérard
Professeur des Universités émérite Rhumatologie
CORBINEAU Hervé Chirurgie thoracique et cardiovasculaire
CUGGIA Marc Biostatistiques, informatique médicale et technologies de communication
DARNAULT Pierre Anatomie
DAUBERT Jean-Claude
Professeur des Universités émérite Cardiologie
DAVID Véronique Biochimie et biologie moléculaire DAYAN Jacques
Professeur des Universités associé Pédopsychiatrie; addictologie DE CREVOISIER Renaud Cancérologie; radiothérapie
DECAUX Olivier Médecine interne; gériatrie et biologie du vieillissement; addictologie DELAVAL Philippe Pneumologie; addictologie
DESRUES Benoît Pneumologie; addictologie DEUGNIER Yves
Professeur des Universités en surnombre Gastroentérologie; hépatologie; addictologie
DONAL Erwan Cardiologie
DRAPIER Dominique Psychiatrie d'adultes; addictologie
DUPUY Alain Dermato-vénéréologie
ECOFFEY Claude Anesthésiologie-réanimation; médecine d'urgence
EDAN Gilles Neurologie
FERRE Jean Christophe Radiologie et imagerie Médecine FEST Thierry Hématologie; transfusion
FLECHER Erwan Chirurgie thoracique et cardiovasculaire FREMOND Benjamin Chirurgie infantile
GANDEMER Virginie Pédiatrie
GANDON Yves Radiologie et imagerie Médecine GANGNEUX Jean-Pierre Parasitologie et mycologie
GARIN Etienne Biophysique et médecine nucléaire GAUVRIT Jean-Yves Radiologie et imagerie Médecine
GODEY Benoit Oto-rhino-laryngologie
GUGGENBUHL Pascal Rhumatologie
GUIGUEN Claude
Professeur des Universités émérite Parasitologie et mycologie
GUILLÉ François Urologie
GUYADER Dominique Gastroentérologie; hépatologie; addictologie
HOUOT Roch Hématologie; transfusion
HUGÉ Sandrine
Professeur des Universités associé Médecine générale HUSSON Jean-Louis
Professeur des Universités en surnombre Chirurgie orthopédique et traumatologique
JEGO Patrick Médecine interne; gériatrie et biologie du vieillissement; addictologie JEGOUX Franck Oto-rhino-laryngologie
JOUNEAU Stéphane Pneumologie; addictologie
KAYAL Samer Bactériologie-virologie; hygiène hospitalière KERBRAT Pierre Cancérologie; radiothérapie
LAMY DE LA CHAPELLE Thierry Hématologie; transfusion
LAVOUE Vincent Gynécologie-obstétrique; gynécologie médicale
LE BRETON Hervé Cardiologie
LE GUEUT Maryannick Médecine légale et droit de la santé LE TULZO Yves Réanimation; médecine d'urgence LECLERCQ Christophe Cardiologie
LEGUERRIER Alain Chirurgie thoracique et cardiovasculaire LEJEUNE Florence Biophysique et médecine nucléaire
LEVEQUE Jean Gynécologie-obstétrique; gynécologie médicale LIEVRE Astrid Gastroentérologie; hépatologie; addictologie
MABO Philippe Cardiologie
MALLEDANT Yannick Anesthésiologie-réanimation; médecine d'urgence MEUNIER Bernard Chirurgie digestive
MICHELET Christian Maladies infectieuses; maladies tropicales MOIRAND Romain Gastroentérologie; hépatologie; addictologie
MORANDI Xavier Anatomie
MORTEMOUSQUE Bruno Ophtalmologie
MOSSER Jean Biochimie et biologie moléculaire MOULINOUX Jacques Biologie cellulaire
MOURIAUX Frédéric Ophtalmologie
ODENT Sylvie Génétique
OGER Emmanuel Pharmacologie fondamentale; pharmacologie clinique; addictologie
PERDRIGER Aleth Rhumatologie
PLADYS Patrick Pédiatrie
POULAIN Patrice Gynécologie-obstétrique; gynécologie médicale RAVEL Célia Histologie; embryologie et cytogénétique
RIFFAUD Laurent Neurochirurgie
RIOUX-LECLERCQ Nathalie Anatomie et cytologie pathologiques ROBERT-GANGNEUX Florence Parasitologie et mycologie
SAINT-JALMES Hervé Biophysique et médecine nucléaire
SEGUIN Philippe Anesthésiologie-réanimation; médecine d'urgence
SEMANA Gilbert Immunologie
SIPROUDHIS Laurent Gastroentérologie; hépatologie; addictologie
SOMME Dominique Médecine interne; gériatrie et biologie du vieillisement; addictologie SULPICE Laurent Chirurgie générale
TATTEVIN Pierre Maladies infectieuses; maladies tropicales
THIBAULT Ronan Nutrition
THIBAULT Vincent Bactériologie-virologie; hygiène hospitalière THOMAZEAU Hervé Chirurgie orthopédique et traumatologique TORDJMAN Sylvie Pédopsychiatrie; addictologie
VERGER Christian
Professeur des Universités émérite Médecine et santé au travail
VERHOYE Jean-Philippe Chirurgie thoracique et cardiovasculaire
VERIN Marc Neurologie
VIEL Jean-François Epidémiologie, économie de la santé et prévention
VIGNEAU Cécile Néphrologie
VIOLAS Philippe Chirurgie infantile
WATIER Eric Chirurgie plastique, reconstructrice et esthétique; brûlologie WODEY Eric Anesthésiologie-réanimation; médecine d'urgence
MAITRES DE CONFERENCES DES UNIVERSITES –
PRATICIENS HOSPITALIERS
Nom Prénom
Sous-section de CNU
AME-THOMAS Patricia Immunologie
AMIOT Laurence Hématologie; transfusion
BARDOU-JACQUET Edouard Gastroentérologie; hépatologie; addictologie
BEGUE Jean-Marc Physiologie
BOUSSEMART Lise Dermato-vénéréologie CABILLIC Florian Biologie cellulaire
CAUBET Alain Médecine et santé au travail
DAMERON Olivier Informatique
DE TAYRAC Marie Biochimie et biologie moléculaire DEGEILH Brigitte Parasitologie et mycologie DUBOURG Christèle Biochimie et biologie moléculaire
DUGAY Frédéric Histologie; embryologie et cytogénétique EDELINE Julien Cancérologie; radiothérapie
GALLAND Françoise Endocrinologie, diabète et maladies métaboliques; gynécologie médicale GARLANTEZEC Ronan Epidémiologie, économie de la santé et prévention
GUILLET Benoit Hématologie; transfusion
HAEGELEN Claire Anatomie
JAILLARD Sylvie Histologie; embryologie et cytogénétique
LAVENU Audrey Sciences physico-chimiques et technologies pharmaceutiques LE GALL François Anatomie et cytologie pathologiques
LE RUMEUR Elisabeth Physiologie
MAHÉ Guillaume Chirurgie vasculaire; médecine vasculaire
MARTINS Raphaël Cardiologie
MASSART Catherine Biochimie et biologie moléculaire MATHIEU-SANQUER Romain Urologie
MENARD Cédric Immunologie
MENER Eric Médecine générale
MILON Joëlle Anatomie
MOUSSOUNI Fouzia Informatique
MYHIE Didier Médecine générale
PANGAULT Céline Hématologie; transfusion
RENAUT Pierric Médecine générale
RIOU Françoise Epidémiologie, économie de la santé et prévention ROBERT Gabriel Psychiatrie d'adultes; addictologie
ROPARS Mickaël Anatomie
SAULEAU Paul Physiologie
TADIÉ Jean-Marc Réamination; médecine d'urgence TATTEVIN-FABLET Françoise Médecine générale
TURLIN Bruno Anatomie et cytologie pathologiques
VERDIER Marie-Clémence Pharmacologie fondamentale; pharmacologie clinique; addictologie VINCENT Pascal Bactériologie-virologie; hygiène hospitalière
Remerciements
A Monsieur le Professeur Yannick Mallédant, qui me fait l’honneur de présider cette thèse, et pour votre précieux enseignement en réanimation.
A Monsieur le Professeur Philippe Seguin, pour avoir accepté de juger ma thèse et pour ma formation en réanimation.
A Monsieur le Professeur Pierre-Yves Donnio, pour votre disponibilité et pour avoir accepté de juger ma thèse.
A Monsieur le Docteur Ronan Garlantezec, pour avoir accepté de juger mon travail.
A Madame le Docteur Sonia Isslame, qui m’a confiée ce travail. Merci pour ton soutien, ta gentillesse et ta patience, je ne pouvais pas espérer meilleure directrice de thèse !
A mes parents, grands-parents, frères, et beaux-parents, une famille unie sur qui je peux toujours compter.
A Yann, pour ton soutien sans faille et ta résistance à ma mauvaise humeur ! A Franck, pour m’avoir transmis sa passion de l’anesthésie !
A mes amis et amies de médecine et d’ailleurs,
A mes co-internes, et chefs des différents services, pour ces bonnes années passées à vos côtés.
Etude comparée du mode de surveillance des pneumonies acquises
sous ventilation mécanique : diagnostic clinique conventionnel versus
algorithme du Centers for Disease Control and Prevention
Differences between conventional approach and the Centers for
Disease Control and Prevention algorithm for surveillance of
Résumé
Introduction : Les critères diagnostiques des pneumonies acquises sous ventilation mécanique (PAVM) sont largement débattus. Afin d’harmoniser leur surveillance, le Centers for Disease Control and Prevention (CDC) a proposé en 2013 un nouvel algorithme.
Méthodes : Cette étude rétrospective incluait les patients hospitalisés en réanimation chirurgicale du CHU de Rennes en 2013 et 2014 ayant développé une PAVM. L’objectif principal était de déterminer si ces patients présentaient une Ventilator-associated Pneumonia (VAP) selon les critères du CDC.
Résultats : Les données de 95 patients étiquetés PAVM ont été analysés. 15 patients remplissaient les critères de VAP du CDC. Les 80 autres patients ne remplissaient pas les critères en raison d’une dégradation insuffisante des paramètres ventilatoires. Les seules différences entre les groupes étaient des durées de ventilation plus longues et une plus grande proportion de pneumonies précoces dans le groupe VAP+.
Conclusion: En accord avec la littérature, notre étude montre les limites de l’algorithme du CDC à diagnostiquer les PAVM.
Abstract
Background : The diagnosis of ventilator-associated-pneumonia (VAP) is known to be problematic. In 2013, the Centers for Disease Control and Prevention (CDC) has established a new paradigm to improve reproducibility of VAP surveillance.
Methods : This retrospective study included all VAP cases that were identified using conventional definitions, in 2013 and 2014 in the intensive care unit of Rennes Hospital. The objective was to assess patients for VAP using CDC criteria.
Results : We analyzed data from 95 patients with VAP identified by conventional surveillance. 15 patients met the CDC definition for VAP. The others did not fulfilled the CDC criteria of deterioration in respiratory status. Patients meeting CDC criteria had longer durations of mechanical ventilation and reported more early-onset pneumonia.
Conclusion : In agreement with several studies, we showed that detection of VAP by the CDC surveillance paradigm is poor.
Mots clés : Pneumonie acquise sous ventilation mécanique, réanimation, surveillance Key words : Ventilator associated pneumonia, intensive care, surveillance
Liste des abréviations
ACCP American College of Chest Physicians
CCLIN Centre de coordination de la lutte contre les infections nosocomiales CDC Centers for Disease Control and Prevention
CHU Centre Hospitalier Universitaire CPIS Clinical Pulmonary Infection Score ECMO Extra Corporeal Membrane Oxygenation FiO2 Fraction inspirée en Oxygène
NHSN National Healthcare Safety Network
PaO2 Pression partielle en Oxygène dans le sang artériel PAVM Pneumonie Acquise sous Ventilation Mécanique PEEP Positive End Expiratory Pressure
RAISIN Réseau d’Alerte d’Investigation et de Surveillance des Infections Nosocomiales REA Réanimation
SAPS II Simplified Acute Physiology Score II SDRA/ARDS Syndrome de Détresse Respiratoire Aigüe SOFA Sepsis-related Organ Failure Assesment VAE Ventilator Associated Event selon le CDC VAC Ventilator Associated Condition selon le CDC
IVAC Infection-related Ventilator-Associated Complication selon le CDC VAP Ventilator Associated Pneumoniae selon le CDC
INTRODUCTION
Les pneumonies acquises sous ventilation mécanique (PAVM) sont la première cause d’infections liées aux soins dans les services de réanimation – soins intensifs (1). Ce sont des infections graves, associées à une augmentation de la morbi-mortalité, de la durée de ventilation mécanique, de la durée et des coûts d’hospitalisation (2).
De nombreuses mesures préventives sont recommandées et mises en place dans les services de réanimation dans une optique d’amélioration continue de la qualité et de la sécurité des soins (3).
Le « gold standard » diagnostique – l’analyse histopathologique du parenchyme pulmonaire- n’est pas applicable en routine. Le diagnostic des PAVM est donc basé, en pratique clinique, sur un faisceau de critères cliniques, radiologiques et biologiques. Ceux-ci sont souvent subjectifs, en particulier l’interprétation de la radiographie thoracique. De fait, malgré le développement de plusieurs scores diagnostiques, on observe une grande variabilité d’interprétation entre les services hospitaliers, et même entre les praticiens d’un même service (4,5). Il n’est donc pas surprenant que les incidences relevées dans la littérature varient considérablement : de 5 à 67% selon les études (1,2,6), et de 0,0 à 5,8 pour 1000 jours de ventilation selon les services aux Etats-Unis (7).
L’absence de critères objectifs et reproductibles rend difficile la surveillance, l’évaluation des stratégies de prévention, la mise en place d’études cliniques notamment sur le calcul du nombre de sujets nécessaires, et la comparaison entre les établissements de santé. D’ailleurs, l’utilisation de l’incidence des PAVM comme critère qualité des établissements, avec des pénalités financières pour inciter la mise en œuvre de mesures préventives aux Etats-Unis (8), a été largement critiquée (9), et a pu induire une sous estimation du taux de survenue des PAVM (10,11). Malgré tout, l’importance d’un système de surveillance et des mesures de sensibilisation et de prévention qui en découlent n’est plus à prouver (12,13).
Afin d’harmoniser la surveillance des PAVM, The Centers for Disease Control and Prevention (CDC)/National Healthcare Safety Network (NHSN) a développé, en 2013, un nouvel algorithme de diagnostic rétrospectif, basé sur des critères plus objectifs, reproductibles, et potentiellement automatisables (14).
L’objectif de notre étude était d’appliquer l’algorithme du CDC et les scores diagnostiques publiés dans la littérature, chez des patients ayant présentés une PAVM dans notre service de réanimation.
PATIENTS ET METHODES
Cette étude, volontairement rétrospective, s’est déroulée dans le service de Réanimation Chirurgicale du Centre Hospitalier Universitaire de Rennes. Environ 1000 patients y sont admis chaque année, pour des pathologies traumatologiques, post-chirurgicales ou médicales. D’après les données du Centre de coordination de la lutte contre les infections nosocomiales (CClin), le taux d’incidence des PAVM dans le service était de 11,6 et 7,8 pour 100 patients intubés, avec une densité d’incidence de 16,7 et 11,5 pour 1000 jours d’intubation en 2013 et 2014.
Le protocole de notre étude ayant été approuvé par le comité d’éthique du Centre Hospitalier Universitaire de Rennes (avis nº 15122), nous avons sélectionné, de manière rétrospective, les dossiers des patients pour lesquels a été déclarée une PAVM, entre le 01/01/2013 et le 31/12/2014.
Le diagnostic conventionnel de PAVM est laissé à la discrétion du médecin sénior prenant en charge le patient et se base sur des critères cliniques (fièvre, sécrétions purulentes, hyperleucocytose ou leucopénie, auscultation suggestive, dégradation des paramètres ventilatoires), radiographiques (infiltrat pulmonaire localisé ou diffus, apparition ou progression de l’infiltrat) et microbiologiques (Culture positive, > 25 neutrophiles/champ). Tous les cas diagnostiqués de PAVM sont déclarés au CClin au travers du réseau REA RAISIN (Reseau d’alerte d’investigation et de surveillance des infections nosocomiales).
Selon la définition des infections liées aux soins, une PAVM est une pneumonie survenant chez un malade dont la respiration est assistée par une machine dans les 48 heures précédant la survenue de l’infection (15). Les patients qui n’avaient pas été ventilés dans les 48 heures précédant la survenue de l’infection étaient donc exclus. Etaient également exclus les patients sous assistance extracorporelle (ECMO), rendant impossible l’application de l’algorithme du CDC (14).
Nous avons collecté les caractéristiques démographiques, les comorbidités, les motifs d’admission, les scores de gravité de ces patients, ainsi que leur durée d’hospitalisation, de ventilation mécanique, de sevrage après la survenue de la PAVM, et la mortalité dans le service. Les données bactériologiques ont été notées.
Nous avons relevé les données permettant l’application de l’algorithme du CDC (figure 1) : FiO2 (Fraction inspirée en oxygène) et PEEP (Positive end expiratory pressure) minimales par jour, température, taux de leucocytes, instauration ou non d’un traitement antibiotique, données microbiologiques. Nous avons ainsi déterminé si les patients présentaient une complication liée à la ventilation mécanique (VAE) selon les critères du CDC (figure 1) : dégradation des paramètres ventilatoires (Ventilator-Associated Condition, VAC), une complication respiratoire liée à une infection (Infection-related Ventilator-Associated Complication, IVAC), ou une possible ou probable pneumonie associée à la ventilation mécanique nommée Ventilator-associated Pneumoniae (VAP). (Annexes 1-2)
Par souci de clarté, nous avons choisi de réserver le terme VAP pour désigner la pneumonie acquise sous ventilation mécanique selon les critères du CDC. Le groupe VAP + correspond aux patients remplissant les critères de probable VAP, et le groupe VAP – aux patients ne les remplissant pas.
Figure 1. Algorithme de surveillance des événements liés à la ventilation mécanique selon the Centers for Disease Control and Prevention (14).
VAE = associated event, VAC = associated condition, IVAC = infection-related ventilator-associated complication, VAP = ventilator-ventilator-associated pneumonia.
Patient ventilé depuis minimum 2 jours avec une FiO2 ou une PEEP
stable ou en baisse
Augmentation de la PEEP minimale ≥ 3 cm H₂O ou de la FiO₂ ≥ 20 points pendant plus de
2 jours
Température > 38°C ou < 36°C ou leucocytes ≥ 12000/mm³ ou ≤ 4000/mm³
ET
Antibiothérapie de plus de 4 jours
POSSIBLE VAP Sécrétions respiratoires purulentes ( > 25 neutrophiles/champ) OU Culture bactériologique qualitative ou quantitative respiratoire positive PROBABLE VAP
Sécrétions respiratoires purulentes ET culture bactériologique quantitative ou semi-quantitative
respiratoire positive ou
Anathomopathologie pulmonaire ou culture de liquide pleural ou test viral ou pour la legionellose
positif NON Pas de VAE OUI NON Pas de VAE OUI = VAC NON VAC seule OUI = IVAC
Les différents critères cliniques, biologiques, radiologiques, permettant d’appliquer le Clinical Pulmonary Infection Score (CPIS) modifié (16) (tableau 1), et les critères de l’American College of Chest Physicians (ACCP) (17) (tableau 2) ont été recueillis. Pour l’interprétation des radiographies thoraciques, si un compte-rendu de lecture était noté dans le dossier du patient il était pris en compte, sinon les radiographies étaient relues par un sénior du service.
Tableau 1. Score CPIS modifié, d’après Singh et al (16). Un score > 6 est en faveur d’une PAVM.
Paramètres Valeurs Score
Température 36,5-38,4 °C 0 38,5-38,9 °C 1 ≤ 36 ou ≥ 39 °C 2 Leucocytes 4000 – 11000/mm3 0 < 4000 ou > 11000/mm3 1 Neutrophiles immature ≥ 500 2
Sécrétions trachéales Aucune 0
Moyenne abondance, non purulentes 1
Purulentes 2 Radiographie thoracique Progression radiologique Pas d’infiltrat 0 Infiltrat diffuse 1 Infiltrat localisé Non Oui 2 0 2 Résultats bactériologiques Culture negative 0
Culture positive 1
Isolement bactériologique 2 Oxygénorequérance (PaO2/ FiO2) > 240 ou SDRA 0
≤ 240 et absence de SDRA 2
Tableau 2. Critères diagnostiques de l’American College of Chest Physicians (ACCP) (17). Progression ou apparition d’un nouvel infiltrat à la radiographie thoracique
ET au moins 2 critères parmi :
- Fièvre > 38°C
- Taux de leucocytes < 4000 ou >12000/mm³
- Sécrétions trachéales purulentes
L’objectif principal était de déterminer si ces patients présentaient une VAP selon les critères du CDC et de les confronter au CPIS et aux critères de l’ACCP.
Les différences entre les patients qui ne présentaient pas de VAP selon les critères du CDC et ceux qui en présentaient ont été analysées.
Analyse statistique
La base de données anonymisée a été constituée à l’aide du logiciel Microsoft Excel ® Les variables quantitatives sont exprimées en moyenne ± écart-type ou en médiane
[interquatiles].Les variables qualitatives sont exprimées en nombre et en pourcentage (%). Les caractéristiques des groupes VAP + et VAP- ont été comparées en analyse univariée par un test de Student ou de Wilcoxon pour les variables quantitatives. Pour les variables
qualitatives, le test du Chi-2, ou le test exact de Fisher ont été utilisés. Le seuil de significativité est p < 0.05.
RESULTATS
Population étudiée
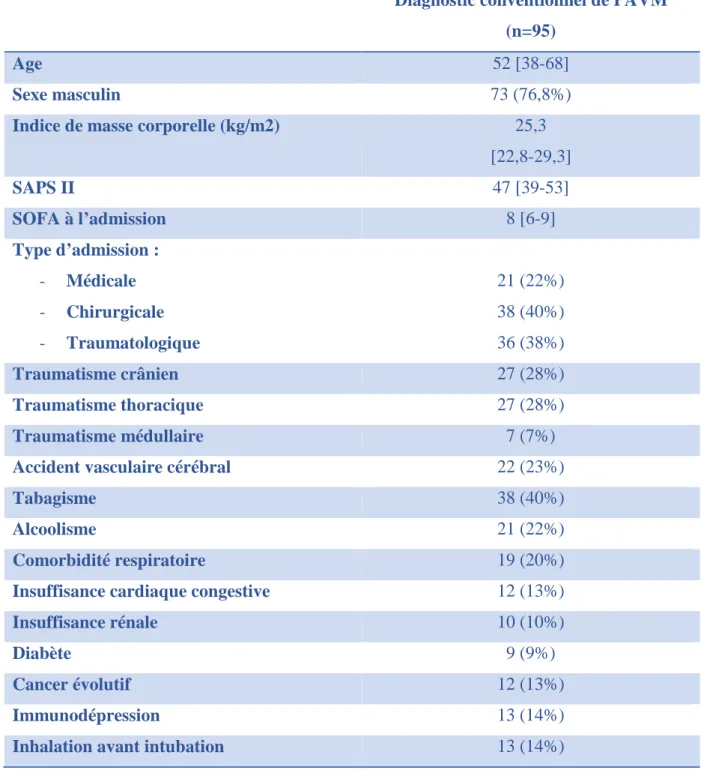
Cent-six épisodes de PAVM ont été déclarés dans notre service du 01/01/2013 au 31/12/2014. Onze patients ont été exclus : 8 car ils ne répondaient pas à la stricte définition de la PAVM, 3 pour avoir bénéficié de la pose d’une ECMO. Au total, les données de 95 patients ont été analysées.
Les caractéristiques de la population étudiée sont présentées dans le tableau 3.
Tous les patients avaient une culture bactériologique quantitative des sécrétions respiratoires positive (aspiration endo-trachéale ou lavage broncho-alvéolaire). Les cultures bactériologiques retrouvaient principalement les germes suivants : Staphylocoque Aureus Sensible à la Méthicilline (n=35 (37%)), Haemophilus Influenzae (n=25 (26%)), Streptocoque Pneumoniae (n=12 (13%)), Pseudomonas Aeruginosa (n=10 (10%)), Escherichia Coli (n=7(7%)).
Tableau 3. Caractéristiques démographiques et comorbidités de la population étudiée à l’admission.
Diagnostic conventionnel de PAVM (n=95)
Age 52 [38-68]
Sexe masculin 73 (76,8%)
Indice de masse corporelle (kg/m2) 25,3
[22,8-29,3] SAPS II 47 [39-53] SOFA à l’admission 8 [6-9] Type d’admission : - Médicale - Chirurgicale - Traumatologique 21 (22%) 38 (40%) 36 (38%) Traumatisme crânien 27 (28%) Traumatisme thoracique 27 (28%) Traumatisme médullaire 7 (7%)
Accident vasculaire cérébral 22 (23%)
Tabagisme 38 (40%)
Alcoolisme 21 (22%)
Comorbidité respiratoire 19 (20%)
Insuffisance cardiaque congestive 12 (13%)
Insuffisance rénale 10 (10%)
Diabète 9 (9%)
Cancer évolutif 12 (13%)
Immunodépression 13 (14%)
Inhalation avant intubation 13 (14%)
Application de l’algorithme du CDC
Chez ces 95 patients pour lesquels une PAVM avait été diagnostiquée de manière conventionnelle, 80 ne remplissaient pas les critères du CDC pour une probable pneumopathie liée à la ventilation mécanique (probable VAP) (Figure 2). En effet, ils ne présentaient pas d’aggravation suffisante et prolongée de la Fi02 ou de la PEEP après une période de stabilité, première étape requise par le CDC pour définir une complication liée à la ventilation mécanique (VAC)
Les 15 patients qui avaient une dégradation suffisante des paramètres ventilatoires pour valider cette première étape présentaient ensuite tous les critères de probable VAP (température > 38ºC ou < 36ºC ou taux de leucocytes >12000/mm3 ou <4000/mm3, instauration d’un traitement antibiotique pour une durée de plus de 4 jours, et aspirations trachéales purulentes avec culture bactériologique positive). L’étape VAC était atteinte par augmentation de la PEEP de plus de 3 cm d’H20 pendant plus de 2 jours consécutifs chez 7 d’entre eux, par l’augmentation de la FiO2 de plus de 20 points pendant plus de 2 jours consécutifs chez 6 d’entre eux, par l’augmentation de la PEEP et de la FiO2 chez 2 patients.
16%
84%
Figure 2. Répartition des 95 patients selon le CDC
VAP +
-Comparaison des groupes VAP + et VAP –
Il n’y avait pas de différence significative entre les caractéristiques démographiques et les critères de gravité à l’entrée, entre les groupes VAP + et VAP - (tableau 4).
Tableau 4. Critères démographiques et comorbidités selon les groupes VAP + (n=15) VAP- (n=80) P Age 42 [31-61] 53 [41-68] 0,16 Sexe masculin 11 (73%) 62 (77,5%) 0,74
Indice de masse corporelle (kg/m2) 27,3
[22,6-33,3] 25,3 [22,8-29,3] 0,33 SAPS II 47 [40-56] 47 [38-53] 0,46 SOFA à l’admission 8 [6-9] 9 [5-9] 0,60 Type d’admission : - Médicale - Chirurgicale - Traumatologique 3 (20%) 5 (33%) 7 (46%) 18 (22%) 33 (41%) 29 (36%) 0,77 Traumatisme crânien 5 (33%) 22 (27%) 0,76 Traumatisme thoracique 5 (33%) 22 (27%) 0,76 Traumatisme médullaire 0 (0%) 7 (9%) 0,59
Accident vasculaire cérébral 5 (33%) 17 (21%) 0,33
Tabagisme 6 (40%) 32 (40%) 1,00
Alcoolisme 2 (13%) 19 (24%) 0,51
Comorbidité respiratoire 2 (13%) 17 (21%) 0,73
Insuffisance cardiaque congestive 2 (13%) 10 (12%) 1,00
Insuffisance rénale 0 (0%) 10 (12%) 0,35
Diabète 3 (20%) 6 (7%) 0,15
Cancer évolutif 0 (0%) 12 (15%) 0,20
Immunodépression 0 (0%) 13 (16%) 0,12
Inhalation avant intubation 2 (13%) 11 (14%) 1,00
La PEEP et la FiO2 de base étaient similaires chez les patients répondant aux critères du CDC (groupe VAP +) et ceux ni répondant pas (groupe VAP -). Les patients VAP + avaient une augmentation de la FiO2 et de la PEEP significativement plus importante que les patients VAP - (tableau 5).
Tableau 5. Paramètres ventilatoires selon les groupes. VAP + (n=15)
VAP – (n=80)
P
PEEP minimale pendant la période de stabilité
5 [5-6] 5 [5-6] 0,93
FiO2 minimale pendant la période de stabilité
35 [30-40] 35 [30-40] 0,46
Variation de la PEEP
minimale
3 [2-4] 0 [0-1] < 0,0001 *
Variation de la FiO2 minimale 25 [20-30] 10 [5-15] < 0,0001 *
Valeurs présentées en médiane [interquartiles]
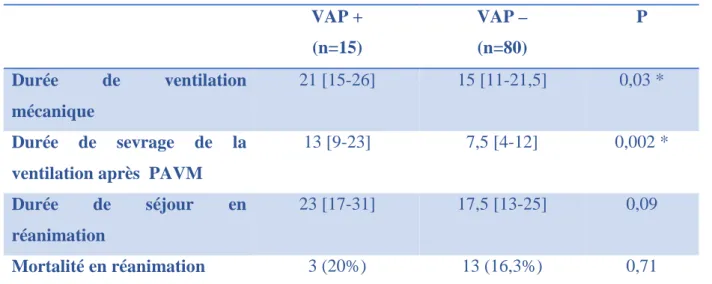
Les patients VAP + avaient des durées de sevrage ventilatoire après la PAVM et de ventilation mécanique plus longues. La durée de séjour en réanimation et la mortalité n’étaient pas significativement différentes entre les 2 groupes (tableau 6).
Tableau 6. Pronostic des patients selon les groupes. VAP + (n=15) VAP – (n=80) P Durée de ventilation mécanique 21 [15-26] 15 [11-21,5] 0,03 * Durée de sevrage de la ventilation après PAVM
13 [9-23] 7,5 [4-12] 0,002 *
Durée de séjour en
réanimation
23 [17-31] 17,5 [13-25] 0,09
Mortalité en réanimation 3 (20%) 13 (16,3%) 0,71
Valeurs présentées en médiane [interquartiles] ou n (%) Durées en jours. * différence significative : p<0,05
Il y avait significativement plus de pneumopathies précoces, c’est-à-dire survenant moins de 5 jours après le début de la ventilation mécanique, chez les patients VAP + (n=10 (66%) versus n=30 (37,5%). p=0,04).
Application des autres scores diagnostiques
Dans notre population de 95 patients pour lesquels le diagnostic conventionnel de PAVM avait été porté, le CPIS modifié était supérieur à 6, et donc en faveur d’une PAVM, dans 88% des cas. Selon les critères de l’ACCP, 65% des patients de cette population présentaient une PAVM (tableau 6). Les critères de l’ACCP n’étaient pas réunis chez 34 patients : 1 patient n’avait pas eu de radiographie thoracique, 25 patients n’avaient pas de progression ou d’apparition d’un infiltrat sur la radiographie thoracique, 8 patients ne présentaient qu’un seul des trois critères parmi fièvre, hyperleucocytose, sécrétions purulentes.
Le CPIS modifié, ainsi que les critères de l’ACCP, n’étaient pas significativement différents entre les groupes VAP + et VAP - (tableau 7).
Tableau 7. Score CPIS et critères ACCP selon les critères CDC Diagnostic conventionnel de PAVM (n=95) VAP probable (n=15) Critères CDC non remplis (n=80) P CPIS modifié ¹ > 6 84 (88%) 13 (86%) 71 (89%) 0,68
PAVM selon ACCP 61 (65%) 9 (60%) 52 (66%) 0,66
¹ selon Singh et al (16) Valeurs présentées en n(%)
DISCUSSION
Dans cette étude, nous avons montré que seules 16 % des pneumonies acquises sous ventilation mécanique diagnostiquées cliniquement dans notre service étaient identifiées comme telles par l’algorithme de surveillance du CDC/NHSN.
Nos résultats sont comparables à ceux retrouvés dans la littérature : les études récentes concluaient qu’entre 13 et 33% des PAVM diagnostiquées conventionnellement étaient classifiées VAP possible ou probable selon l’algorithme de surveillance du CDC (18–22). Ego et al, quant à eux, retrouvaient un coefficient de concordance entre l’algorithme du CDC et les autres scores diagnostiques de la littérature entre 0,22 et 0,26 (23).
Un des objectifs du CDC était de permettre une surveillance des PAVM plus objective et donc plus reproductible, afin d’évaluer les stratégies de prévention et de pouvoir comparer les établissements de santé entre eux de manière fiable (24). Klompas et al, en 2011, trouvaient une plus grande homogénéité dans la surveillance des VAC que dans celle des PAVM diagnostiquées de manière conventionnelle (25). Dans notre étude, plus de la moitié des cas de VAP identifiés par les critères du CDC l’étaient grâce à l’augmentation de la PEEP et non grâce à l’augmentation de la FiO2. En effet, dans notre réanimation, un protocole de service permet aux infirmières de diminuer toutes les heures la FiO2 tant que la saturation pulsée en oxygène est supérieure à 96%. Toute amélioration transitoire de l’oxygénation du patient est donc immédiatement suivie d’une baisse de la FiO2 sur le respirateur. Hors, dans la définition VAC du CDC, c’est la FiO2 minimale de la journée qui est prise en compte, ne reflétant pas parfaitement l’oxygénorequérance du patient sur la journée. Il est probable que dans les services de réanimation où seuls les médecins modifient les paramètres ventilatoires, la baisse de la FiO2 sur le respirateur soit plus lente que dans notre service, du fait de son adaptation moins fréquente. Le management des paramètres ventilatoires et la densité médicale/paramédicale du service influenceraient l’obtention des critères VAC (22).
De plus, certaines études montrent des variations importantes des taux de détection des critères CDC dues à des différences dans les systèmes de recueil électronique (19) et d’autres mettent en garde contre le caractère facilement manipulable des données (22). D’autres travaux sont donc nécessaires pour valider l’utilisation de ces critères comme comparaison entre les différents établissements de santé.
Une autre volonté du CDC était d’identifier et ainsi de sensibiliser les praticiens à toute dégradation respiratoire pouvant survenir chez un patient sous ventilation mécanique (24). En effet, il a été montré que les patients qui présentaient un VAE avaient un moins bon pronostic que ceux n’en présentant pas (20,25,26), ce que corrobore notre travail, où nous retrouvons une augmentation de la durée de ventilation et de la durée de sevrage ventilatoire après PAVM chez les patients répondants aux critères du CDC. Bouadma et al avaient également trouvé que les taux de VAC et d’IVAC étaient directement corrélés à la consommation d’antibiotiques du service (27). Il est toutefois difficile de déterminer si la détection des VAC permet d’améliorer le pronostic des patients (26). En effet, les VAC incluent de nombreuses pathologies pulmonaires graves, en majorité des SDRA (22), mais aussi PAVM, atélectasies, œdème pulmonaire cardiogénique, qui ne relèvent pas des mêmes mesures thérapeutiques et préventives. En regroupant des pathologies extrêmement variées, il parait plus difficile de mettre en œuvre des meures de prévention adéquates (27). Muscedere et al, avaient tout de même, montré que l’application de mesures préventives pour les PAVM réduisait l’incidence des VAC et VAP (21). Cependant, Klein Klouwenberg et al avaient montré que la mortalité des patients VAC seule était plus importante que celle des patients VAP et concluaient que la mortalité était liée à d’autres pathologies que les infections pulmonaires (19). Dans ce sens, Boyer et al ont trouvé que seulement 37% des VAC représentaient des complications liées aux soins qui auraient pu être prévenues (18). Des études supplémentaires sont donc nécessaires afin de déterminer si la détection d’une VAE chez un patient entraine des mesures préventives ou thérapeutiques spécifiques (18,19).
De nombreux auteurs mettent en avant le risque de « sous diagnostic » des PAVM avec les critères du CDC (21) puisque moins d’un tiers de PAVM sont détectées, ce qui est aussi retrouvé dans notre travail. On peut craindre qu’une sous évaluation du taux de PAVM puisse minimiser l’importance de la prévention de ces infections (22).
Toutefois, avec le diagnostic conventionnel, de nombreux patients qui présentaient les critères cliniques de PAVM avaient en fait d’une autre pathologie (SDRA, œdème cardiogénique, hémorragie intra alvéolaire, atélectasie) comme l’ont montré des études autopsiques (9,28). Ceci est d’autant plus vrai pour les populations chirurgicales ou traumatisées pour lesquelles l’interprétation de la radiographie peut être encore plus délicate et que la fièvre peut être d’origine non infectieuse…(29,30). Le risque de sur diagnostic avec les critères
conventionnels est donc grand, avec ses risques de surconsommation d’antibiotiques, de développement de bactéries multi résistantes et d’effets indésirables potentiels (31).
L’approche diagnostique conventionnelle dans notre service paraît cohérente avec les données de la littérature puisque 88% des PAVM diagnostiquées remplissaient les critères du CPIS, score sensible mais peu spécifique (32), toutefois utilisé comme score diagnostique dans la plupart des études.
65 % des patients remplissaient les critères de l’ACCP. Trois quarts des patients ne remplissant pas les critères de l’ACCP n’avaient pas d’apparition ou de progression d’un infiltrat sur la radiographie thoracique. Ce résultat est évidemment empreint de subjectivité du fait de l’interprétation de la radiographie thoracique, particulièrement difficile dans notre population de réanimation chirurgicale. On peut également se questionner sur la proportion de trachéobronchites liées à la ventilation mécanique (VAT) dans la population étudiée. En effet, il s’agit d’une pathologie fréquente, avec une incidence d’environ 10 % (33), définie par l’association d’une fièvre > 38°C sans autre cause, de sécrétions trachéales purulentes, d’une culture bactériologique positive, et par l’absence de nouvel infiltrat pulmonaire à la radiographie (34). La frontière entre VAT et PAVM est donc ténue et subjective, et il est possible qu’une proportion des PAVM actuellement diagnostiquées avec des « doutes » sur un infiltrat à la radiographie pulmonaire ou avec une radiographie pulmonaire difficilement interprétable (du fait d’un traumatisme thoracique par exemple) soient en fait des VAT (35). La déclaration auprès du CCLIN sous sa forme actuelle ne permet pas de différencier ces deux pathologies puisqu’elles sont regroupées sous le terme « pneumopathie liée à l’intubation ». D’ailleurs, pour 3 patients étiquetés pneumopathie liée à l’intubation et n’ayant pas de modification de la radiographie thoracique, le diagnostic de bronchite ou trachéobronchite liée à la ventilation était spécifié dans le dossier. Différencier VAT et PAVM pourrait apporter plus de précision dans la surveillance de ces pathologies.
Enfin, un résultat nous interpelle d’autant qu’il n’est pas retrouvé dans la littérature : les patients répondant aux critères du CDC présentaient plus de pneumonies précoces que ceux n’y répondant pas. Une hypothèse pourrait être la plus grande proportion de trachéobronchites acquises sous ventilation mécanique, avec une moindre dégradation des paramètres ventilatoires, parmi les diagnostics de PAVM tardives. Il paraitrait donc intéressant de
déterminer pourquoi les pneumonies précoces répondraient plus favorablement aux critères du CDC.
Notre travail présente plusieurs limites. Son caractère rétrospectif a pu jouer sur le recueil de certaines données pour le CPIS et les critères de l’ACCP. Toutefois, en ce qui concerne l’application de l’algorithme du CDC, cela représentait plutôt une force, les critères étant forcément rétrospectifs, il n’y a pas pu avoir de modification de la prise en charge habituelle des patients. Nous n’avons sélectionné et analysé que les données des patients étiquetés pneumonies liées à l’intubation par les praticiens du service. Cela ne nous a pas permis de calculer des taux d’incidence des VAE (VAC, IVAC, VAP). Enfin, le caractère monocentrique nous empêche toute comparaison dans l’application de l’algorithme du CDC selon les services.
CONCLUSION
En accord avec la littérature, notre étude montre les limites de l’algorithme du Centers for Disease Control and Prevention pour la détection et la surveillance des pneumonies acquises sous ventilation mécanique. Il ne parait pas légitime, en l’absence d’autres études, de l’utiliser comme critère de surveillance des PAVM.
Toutefois, l’ambition du CDC était également de mettre en avant toutes les complications liées à la ventilation. Changer les pratiques, non plus en se focalisant sur les pneumonies liées à la ventilation mais en regroupant toutes les complications liées la ventilation mécanique, permettra peut être d’améliorer la surveillance, la prévention et la prise en charge de ces pathologies graves.
REFERENCES BIBLIOGRAPHIQUES
1. Chastre J, Fagon J-Y. Ventilator-associated pneumonia. Am J Respir Crit Care Med. 1 avr
2002;165(7):867-903.
2. Safdar N, Dezfulian C, Collard HR, Saint S. Clinical and economic consequences of
ventilator-associated pneumonia: a systematic review. Crit Care Med. oct 2005;33(10):2184-93.
3. Bouadma L, Deslandes E, Lolom I, Le Corre B, Mourvillier B, Regnier B, et al. Long-term
impact of a multifaceted prevention program on ventilator-associated pneumonia in a medical intensive care unit. Clin Infect Dis Off Publ Infect Dis Soc Am. 15 nov 2010;51(10):1115-22.
4. Klompas M. Interobserver variability in ventilator-associated pneumonia surveillance. Am J
Infect Control. avr 2010;38(3):237-9.
5. Schurink CAM, Van Nieuwenhoven CA, Jacobs JA, Rozenberg-Arska M, Joore HCA, Buskens
E, et al. Clinical pulmonary infection score for ventilator-associated pneumonia: accuracy and inter-observer variability. Intensive Care Med. févr 2004;30(2):217-24.
6. Suetens C, Morales I, Savey A, Palomar M, Hiesmayr M, Lepape A, et al. European surveillance
of ICU-acquired infections (HELICS-ICU): methods and main results. J Hosp Infect. juin 2007;65 Suppl 2:171-3.
7. Dudeck MA, Horan TC, Peterson KD, Allen-Bridson K, Morrell G, Pollock DA, et al. National
Healthcare Safety Network (NHSN) Report, data summary for 2010, device-associated module. Am J Infect Control. déc 2011;39(10):798-816.
8. Mietto C, Pinciroli R, Patel N, Berra L. Ventilator associated pneumonia: evolving definitions
and preventive strategies. Respir Care. 2013;58(6):990-1007.
9. Klompas M. Does this patient have ventilator-associated pneumonia? JAMA J Am Med Assoc.
11 avr 2007;297(14):1583-93.
10. Drees M, Hausman S, Rogers A, Freeman L, Frosch K, Wroten K. Underestimating the impact of ventilator-associated pneumonia by use of surveillance data. Infect Control Hosp Epidemiol. juin 2010;31(6):650-2.
11. Thomas BW, Maxwell RA, Dart BW, Hartmann EH, Bates DL, Mejia VA, et al. Errors in administrative-reported ventilator-associated pneumonia rates: are never events really so? Am Surg. août 2011;77(8):998-1002.
12. Bénet T, Allaouchiche B, Argaud L, Vanhems P. Impact of surveillance of hospital-acquired infections on the incidence of ventilator-associated pneumonia in intensive care units: a quasi-experimental study. Crit Care Lond Engl. 2012;16(4):R161.
13. Bénet T, Ecochard R, Voirin N, Machut A, Lepape A, Savey A, et al. Effect of standardized surveillance of intensive care unit-acquired infections on ventilator-associated pneumonia incidence. Infect Control Hosp Epidemiol. oct 2014;35(10):1290-3.
14. NHSN VAE Protocol - April 2015 - 10-VAE_FINAL.pdf [Internet]. [cité 27 oct 2015]. Disponible sur: http://www.cdc.gov/nhsn/PDFs/pscManual/10-VAE_FINAL.pdf
15. HAS infection liees aux soins 2007.pdf. Disponible sur http://www.social-sante.gouv.fr/IMG/pdf/rapport-vcourte.pdf
16. Singh N, Rogers P, Atwood CW, Wagener MM, Yu VL. Short-course empiric antibiotic therapy for patients with pulmonary infiltrates in the intensive care unit: a proposed solution for
indiscriminate antibiotic prescription. Am J Respir Crit Care Med. 2000;162(2):505-11. 17. Guidelines for the Management of Adults with Hospital-acquired, Ventilator-associated, and
Healthcare-associated Pneumonia. Am J Respir Crit Care Med. 15 févr 2005;171(4):388-416. 18. Boyer AF, Schoenberg N, Babcock H, McMullen KM, Micek ST, Kollef MH. A prospective
evaluation of ventilator-associated conditions and infection-related ventilator-associated conditions. Chest. janv 2015;147(1):68-81.
19. Klein Klouwenberg PMC, van Mourik MSM, Ong DSY, Horn J, Schultz MJ, Cremer OL, et al. Electronic implementation of a novel surveillance paradigm for ventilator-associated events. Feasibility and validation. Am J Respir Crit Care Med. 15 avr 2014;189(8):947-55.
20. Chang H-C, Chen C-M, Kung S-C, Wang C-M, Liu W-L, Lai C-C. Differences between novel and conventional surveillance paradigms of ventilator-associated pneumonia. Am J Infect Control. févr 2015;43(2):133-6.
21. Muscedere J, Sinuff T, Heyland DK, Dodek PM, Keenan SP, Wood G, et al. The clinical impact and preventability of ventilator-associated conditions in critically ill patients who are
mechanically ventilated. Chest. nov 2013;144(5):1453-60.
22. Lilly CM, Landry KE, Sood RN, Dunnington CH, Ellison RT, Bagley PH, et al. Prevalence and test characteristics of national health safety network ventilator-associated events. Crit Care Med. sept 2014;42(9):2019-28.
23. Ego A, Preiser J-C, Vincent J-L. Impact of diagnostic criteria on the incidence of ventilator-associated pneumonia. Chest. févr 2015;147(2):347-55.
24. Klompas M. Complications of mechanical ventilation--the CDC’s new surveillance paradigm. N Engl J Med. 18 avr 2013;368(16):1472-5.
25. Klompas M, Khan Y, Kleinman K, Evans RS, Lloyd JF, Stevenson K, et al. Multicenter evaluation of a novel surveillance paradigm for complications of mechanical ventilation. PloS One. 2011;6(3):e18062.
26. Stevens JP, Silva G, Gillis J, Novack V, Talmor D, Klompas M, et al. Automated surveillance for ventilator-associated events. Chest. déc 2014;146(6):1612-8.
27. Bouadma L, Sonneville R, Garrouste-Orgeas M, Darmon M, Souweine B, Voiriot G, et al. Associated Events: Prevalence, Outcome, and Relationship With Ventilator-Associated Pneumonia. Crit Care Med. sept 2015;43(9):1798-806.
28. Tejerina E, Esteban A, Fernández-Segoviano P, Frutos-Vivar F, Aramburu J, Ballesteros D, et al. Accuracy of clinical definitions of ventilator-associated pneumonia: Comparison with autopsy findings. J Crit Care. mars 2010;25(1):62-8.
29. Croce MA, Swanson JM, Magnotti LJ, Claridge JA, Weinberg JA, Wood GC, et al. The Futility of the Clinical Pulmonary Infection Score in Trauma Patients: J Trauma Inj Infect Crit Care. mars 2006;60(3):523-8.
30. Pham TN, Neff MJ, Simmons JM, Gibran NS, Heimbach DM, Klein MB. The Clinical
Pulmonary Infection Score Poorly Predicts Pneumonia in Patients With Burns: J Burn Care Res. janv 2007;28(1):76-9.
31. Nussenblatt V, Avdic E, Berenholtz S, Daugherty E, Hadhazy E, Lipsett PA, et al. Ventilator-associated pneumonia: overdiagnosis and treatment are common in medical and surgical intensive care units. Infect Control Hosp Epidemiol Off J Soc Hosp Epidemiol Am. mars 2014;35(3):278-84.
32. Fàbregas N, Ewig S, Torres A, El-Ebiary M, Ramirez J, de la Bellacasa JP, et al. Clinical diagnosis of ventilator associated pneumonia revisited: comparative validation using immediate post-mortem lung biopsies. Thorax. 1999;54(10):867-73.
33. Martin-Loeches I, Povoa P, Rodríguez A, Curcio D, Suarez D, Mira J-P, et al. Incidence and prognosis of ventilator-associated tracheobronchitis (TAVeM): a multicentre, prospective, observational study. Lancet Respir Med. nov 2015;3(11):859-68.
34. Nseir S, Martin-Loeches I, Makris D, Jaillette E, Karvouniaris M, Valles J, et al. Impact of appropriate antimicrobial treatment on transition from ventilator-associated tracheobronchitis to ventilator-associated pneumonia. Crit Care. 2014;18(3):R129.
ANNEXES
BOULON Natacha – Etude comparée du mode de surveillance des pneumonies
acquises sous ventilation mécanique : diagnostic clinique conventionnel versus algorithme du Centers for Disease Control and Prevention
35 feuilles, 4 graphiques, 7 tableaux , 30 cm.- Thèse : Médecine ; Rennes 1; 2016 ; N° .
Résumé
Introduction : Les critères diagnostiques des pneumonies acquises sous ventilation mécanique
(PAVM) sont largement débattus. Afin d’harmoniser leur surveillance, le Centers for Disease Control and Prevention (CDC) a proposé en 2013 un nouvel algorithme. Méthodes : Cette étude rétrospective incluait les patients hospitalisés en réanimation chirurgicale du CHU de Rennes en 2013 et 2014 ayant développé une PAVM. L’objectif principal était de déterminer si ces patients présentaient une Ventilator-associated Pneumonia (VAP) selon les critères du CDC. Résultats : Les données de 95 patients étiquetés PAVM ont été analysés. 15 patients remplissaient les critères de VAP du CDC. Les 80 autres patients ne remplissaient pas les critères en raison d’une dégradation insuffisante des paramètres ventilatoires. Les seules différences entre les groupes étaient des durées de ventilation plus longues et une plus grande proportion de pneumonies précoces dans le groupe VAP+. Conclusion: En accord avec la littérature, notre étude montre les limites de l’algorithme du CDC à diagnostiquer les PAVM.
Abstract
Background : The diagnosis of ventilator-associated-pneumonia (VAP) is known to be
problematic. In 2013, the Centers for Disease Control and Prevention (CDC) has established a new paradigm to improve reproducibility of VAP surveillance. Methods : This retrospective study included all VAP cases that were identified using conventional definitions, in 2013 and 2014 in the intensive care unit of Rennes Hospital. The objective was to assess patients for VAP using CDC criteria. Results : We analyzed data from 95 patients with VAP identified by conventional surveillance. 15 patients met the CDC definition for VAP. The others did not fulfilled the CDC criteria of deterioration in respiratory status. Patients meeting CDC criteria had longer durations of mechanical ventilation and reported more early-onset pneumonia. Conclusion : In agreement with several studies, we showed that detection of VAP by the CDC surveillance paradigm is poor.
Rubrique de classement : REANIMATION
Mots-clés : pneumonie acquise sous ventilation mécanique, réanimation, surveillance
Mots-clés anglais MeSH : ventilator associated pneumonia, intensive care, surveillance
JURY :
Président : Pr Yannick Mallédant, PU-PH, CHU Rennes, président
Assesseurs : Dr Sonia Isslame, PH, CHU Rennes, Directrice de thèse Pr Philippe Seguin, PU-PH, CHU Rennes
Pr Pierre-Yves Donnio, PU-PH, CHU Rennes Dr Ronan Garlantezec, MCU-PH, CHU Rennes



![Tableau 4. Critères démographiques et comorbidités selon les groupes VAP + (n=15) VAP- (n=80) P Age 42 [31-61] 53 [41-68] 0,16 Sexe masculin 11 (73%) 62 (77,5%) 0,74](https://thumb-eu.123doks.com/thumbv2/123doknet/7390313.216371/24.892.95.796.352.1134/tableau-critères-démographiques-comorbidités-groupes-vap-sexe-masculin.webp)