Étude de l’expression génique dans les cellules de
granulosa bovines provenant de différents statuts
folliculaires et dans les cellules de granulosa humaines
provenant de différents protocoles de stimulation
Mémoire
Gabriel Douville
Maîtrise en Sciences Animales
Maitrise ès sciences (M.Sc.)
Québec, Canada
© Gabriel Douville, 2013
Résumé
Ce mémoire porte sur l’analyse de la croissance folliculaire dans l’ovaire chez la vache et l’humain. La transcription des gènes dans les cellules folliculaires indique quels mécanismes moléculaires sont modulés dans le follicule. Le premier volet de ce projet, chez le bovin, avait pour but de déterminer le profil transcriptomique des follicules de taille moyenne, entre 6 et 9 mm, appartenant à la phase de développement portant les ovocytes les plus compétents. Dans le deuxième volet, réalisé avec des tissus humains, l’impact de l’administration de hCG, une hormone pré-ovulatoire, a été évalué au niveau transcriptomique dans un cycle stimulé. Pour la première fois, des indicateurs géniques sont associés spécifiquement à trois phases clés du développement folliculaire, mais plus particulièrement à la phase plateau, ou atrésie précoce, correspondant à une compétence accrue des ovocytes à produire un embryon. Ces résultats apportent une contribution importante dans la définition des mécanismes moléculaires agissant dans le développement folliculaire.
Abstract
This master’s thesis focused on the analysis of follicle growth in the ovary of both cows and humans. Genes’ transcription in follicular granulosa cells indicates which molecular mechanisms are modulated in the follicle. The first part of this project, in bovine, aimed to determine the transcriptomic profile of medium-sized follicles, between 6-9 mm, belonging to the follicular phase containing the most competent oocytes. In the human facet, the impact of hCG administration, a pre-ovulatory hormone, was evaluated at the transcriptomic level in a stimulated cycle. For the first time, genic indicators are specifically associated to three key phases of follicular development, especially the plateau phase, or early atresia, which correspond to an enhanced competence of the oocyte to produce an embryo. These results are an important step towards further defining the molecular mechanisms at work during follicular development, or folliculome.
Table des matières
Résumé ... iii
Abstract ... v
Table des matières ... vii
Liste des tableaux ... ix
Liste des figures ... xi
Liste des abréviations et des sigles ... xiii
Remerciements ... xix
Avant-Propos ... xxi
Introduction ... 1
Chapitre 1 Introduction ... 3
1.1 Section 1 : Le follicule ovarien ... 3
1.1.1 La composition du follicule ovarien ... 3
1.1.2 La réserve ovarienne ... 5
1.1.3 La croissance folliculaire ... 6
1.1.4 La croissance ovocytaire ... 8
1.1.5 Le cycle œstral/menstruel ... 14
1.1.6 Modèle « deux cellules deux gonadotrophines » ... 23
1.1.7 Les activines, inhibines et follistatines ... 26
1.1.8 Les facteurs de croissance apparentés à l'insuline (IGF) ... 30
1.1.9 L’interaction granulosa/ovocyte ... 33
1.1.10 La reprise de la méiose ... 36
1.1.11 L’atrésie folliculaire ... 39
1.2 Section 2: La maturation in vitro ... 42
1.2.1 Chez la vache ... 42
1.2.2 Chez la femme ... 44
1.3 Section 3 : Objectifs et hypothèses ... 51
1.4 Bibliographie ... 52
Chapitre 2 Étude de l’expression génique dans les cellules de granulosa provenant de follicules de taille moyenne en phase de croissance, plateau et atrétique chez le bovin ... 69
2.1 Résumé ... 70
2.2 Abstract ... 71
2.3 Introduction ... 72
2.4 Materials and methods ... 73
2.4.1 Granulosa cells collection ... 73
2.4.2 Flow Cytometry ... 74
2.4.3 Sample selection for Micro array analysis ... 76
2.4.4 Microarray ... 76
2.4.5 Analysis of differentially-expressed genes ... 78
2.5 Results ... 80 2.5.1 Cytometry ... 80 2.5.2 Microarray ... 81 2.6 Discussion ... 83 2.7 Acknowledgements ... 93 2.8 References ... 93
FIGURES ... 101
SUPPLEMENTAL DATA ... 110
Chapitre 3 L’hétérogénéité des follicules préparés pour la maturation in vitro pourrait expliquer les faibles taux de succès observés ... 117
3.1 Résumé ... 118
3.2 Abstract ... 119
3.3 Introduction ... 120
3.4 Material & Method ... 121
3.4.1 Experimental Subjects ... 121 3.4.2 RNA Extraction ... 122 3.4.3 Microarray ... 122 3.4.4 Real-Time PCR ... 124 3.5 Results ... 125 3.5.1 Microarray ... 125 3.5.2 Real-time PCR ... 125 3.6 Discussion ... 126 3.6.1 Response to hCG ... 126
3.6.2 Genes related to apoptosis ... 127
3.6.3 Gene related to pregnancy success ... 128
3.6.4 Clinical relevance ... 129 3.7 Acknowledgements ... 130 3.8 References ... 131 FIGURES ... 135 SUPPLEMENTAL DATA ... 137 Conclusion ... 139 Bibliographie ... 145
Liste des tableaux
Table 1.1 Résumé des études utilisant la stimulation aux gonadotrophines pour améliorer
l’efficacité de l’IVM dans les femmes ayant des cycles normaux. NS = non
significatif. Les lettres supérieures indiquent des nombres significativement différents. ...Erreur ! Signet non défini.
Supplemental Table S2.1 qRT-PCR primer sequences, product size, annealing
temperature and accession number. ... 110
Supplemental Table S2.2 Functions analysis in Ingenuity Pathway Analysis (IPA)
software for the P vs. G (A) and A vs. P (B) contrasts. Only functions annotations that obtained a Regulation z-score value higher than the absolute value of 2, which is considered significant and therefore for which IPA could predict the Activation State, are presented. P-value < 0.05 calculated by Fisher’s Exact test, # Molecules: number of molecules associated to annotation in user’s dataset. ... 111
Supplemental Table S2.3 Gene names of qRT-PCR-validated candidates ... 114 Supplemental Table S2.4 Summary or qRT-PCR results as compared with Microarray
results. Sym. FC: symmetrical fold change, MAC: mean across condition, All: One-way ANOVA results with all qRT-PCR samples included (hybridized samples and additional samples), Hyb. only: One-way ANOVA results with only the 4 hybridized samples included from each treatment, NS: non-significant as per Newman-Keuls Multiple Comparison Test (P>0.05), NT: No significant linear trend as per Post test for linear trend (P>0.05), = : no significant difference in relative expression between treatments (P > 0.05), > or <: significantly higher or lower expression, respectively (P<0.05), G, P, A: Growing, Plateau and A follicle GC, respectively, as categorized by cytometry. ... 115
Supplemental Table S3.1 qRT-PCR primer sequences, product size, annealing
Liste des figures
Figure 1.1 A et B : Image de sections histologiques de follicule ovarien montrant la
délimitation par la membrane basale (« basement membrane ») entre les cellules de la thèque et les cellules de granulosa (A) et les cellules de cumulus entourant l’ovocyte (B). C : Un schéma d’un follicule antral. A et B : (Boston University), C : (Aerts et Bols 2010b) ... 4
Figure 1.2 Croissance folliculaire chez l’humain. (Gougeon 1996) ... 8 Figure 1.3 Diamètre ovocytaire en fonction du diamètre folliculaire. La durée
approximative des stades de développement folliculaire est indiquée par la ligne en fonction du diamètre folliculaire. Des schémas démontrant le développement de l’ovocyte et des cellules de granulosa qui l’entourent sont présentés pour chaque stade folliculaire. (Fair 2003) ... 12
Figure 1.4 Cycle œstral chez la vache. (Forde, et al. 2011) ... 19 Figure 1.5 Profils des diamètres moyens (± erreur type) du follicule dominant et du plus
gros subordonné et aire de la section transversale du corps jaune pour les intervalles inter-ovulatoire avec 2 ou 3 vagues folliculaires. Régression (P < 0.05) du corps jaune commençant entre les jours 18 et 20 pour les intervalles avec 3 vagues et les jours 15 et 16 pour les intervalles avec 2 vagues. OV = ovulation. (Ginther, et al. 1989) ... 22
Figure 1.6 Modèle « deux cellules deux gonadotrophines ». cAMP indique l’adénosine
monophosphate cyclique; CYP11A, cytochrome P450, family 11, subfamily A, polypeptide 1; CYP17, cytochrome P450, family 17, subfamily A, polypeptide 1; CYP19A, cytochrome P450, family 19, subfamily A, polypeptide 1; DHEA,
déhydroépiandrostérone; 17β-HSD1, hydroxysteroid (17-beta) dehydrogenase 1; 3β-HSD, hydroxy-delta-5-steroid dehydrogenase, 3 beta- and steroid delta-isomerase 1. (Carr, et al. 2005) ... 25
Figure 1.7 Rôles hypothétique de l’inhibine et de l’activine dans le contrôle de la synthèse
folliculaire d’estrogène. (a) Développement folliculaire précoce. (b) Développement folliculaire avancé. Knight et Glister (2001) adapté à partir de Hillier (1991)... 29
Figure 1.8 Modèle des interactions ovocyte-cumulus et comment celles-ci peuvent
s’intégrer pour contrôler la reprise de la méiose dans l’ovocyte. (Gilchrist 2011) ... 38
Figure 2.1 Follicular wave in a cow’s natural cycle showing the three growing phases. Ov:
ovulation, S: selected for growth, D: at or near dominance, A: atretic. Adapted from Aerts et Bols 2010. ... 101
Figure 2.2 Histogram of modeled DNA content using FlowJo software for follicles 6-9mm
in diameter at different growing phases. ... 101
Figure 2.3 Venn diagram showing genes modulated according to a cut off set at 1.5 for
symmetrical fold change and a p-value < 0.05. 932 genes modulated in both contrasts ... 102
Figure 2.4 BGA analysis using all probe data ... 102 Figure 2.5 Graphical representation of Cell Cycle (A, C) and Cell Death (B, D) functional
annotations for P vs. G and A vs. P respectively. Dashed blue lines indicate the z-score threshold for statistical significance (-2.00 and +2.00). All annotations were above the –log(p-value) threshold indicating statistically significant overlap between genes from the study’s dataset and genes associated to the annotation in the IPA database
Figure 2.6 Graphs of genes’ expression profile as measured by qRT-PCR. Different letters
above bars correspond to significantly different expression levels (P<0.05). Error bars represent the standard error of the mean (SEM). ... 105
Figure 3.1 Graphs of genes’ expression profile as measured by qRT-PCR. Different letters
above the bars correspond to significantly different expression levels (P<0.05). Error bars represent the standard error of the mean (SEM) ... 136
Liste des abréviations et des sigles
Abréviation Nom17β-HSD1 hydroxysteroid (17-beta) dehydrogenase 1
3β-HSD hydroxy-delta-5-steroid dehydrogenase, 3 beta- and steroid delta-isomerase 1 A phase atrétique, atretic phase
ACTB actin, beta
ADN acide désoxyribonucléique ALK4 activin receptor-like kinase 4 ALK5 activin receptor-like kinase 5 AMH hormone antimullérienne ANOVA one-way analysis of variance AREG amphiregulin
aRNA antisense ribonucleic acid ARNm acide ribonucléique messager ARNr acide ribonucléique ribosomique B2M beta-2-microglobulin
BAX BCL2-associated X protein BCL2 B-cell CLL/lymphoma 2
BGA analyse « between group », between group analysis bHLH dominant negative of basic helix loop helix
BMP bone morphogenetic proteins BMP15 bone morphogenetic protein 15 BRCA1 breast cancer 1, early onset
cAMP adénosine monophosphate cyclique, cyclic adenosine monophosphate CC cellule de cumulus
CCNB1 Cyclin B1 CCND2 Cyclin D2
CCT2 Chaperonin containing TCP1, subunit 2 (beta) CCT7 chaperonin containing TCP1, subunit 7 (eta) CG cellule de granulosa
cGMP guanosine monophosphate cyclique, cyclic guanosine monophosphate CKS1B CDC28 protein kinase regulatory subunit 1B
COC complexe ovocyte-cumulus, cumulus-oocyte complex CT cellule de la thèque
CYP11A cytochrome P450, family 11, subfamily A, polypeptide 1 CYP17A1 cytochrome P450, family 17, subfamily A, polypeptide 1 CYP19A1 cytochrome P450, family 19, subfamily A, polypeptide 1 DAB2 Disabled-2
DEG determination of differentially expressed genes DHEA déhydroépiandrostérone
DNAJC11 heat shock proteins DnaJ (Hsp40) homolog subfamily B, members 11 DNAJC15 heat shock proteins DnaJ (Hsp40) homolog subfamily B, members 15 DNAJC18 heat shock proteins DnaJ (Hsp40) homolog subfamily B, members 18 DSG2 Desmoglein-2
E2 estradiol
EC expanded cumulus
eCG hormone gonadotrophine chorionique équine, equine chorionic gonadotropin EC-MII matured oocytes surrounded by expanded cumulus
EDTA ethylenediaminetetraacetic acid EGF epidermal growth factor
EGFR epidermal growth factor receptor EREG epiregulin
ERP29 endoplasmic reticulum protein 29 FAS TNF receptor superfamily, member 6 FASLG Fas ligand (TNF superfamily, member 6) FGF facteur de croissance des fibroblastes FIV fécondation in vitro
FKBP5 FK506 binding protein 5 FOSL1 FOS-like antigen 1 FOXO3 forkhead box O3 FOXO4 forkhead box O4 FSC forward light scatter
FSH hormone folliculo-stimulante, follicle-simulating hormone
FSHR récepteur à l’hormone folliculo-stimulante, follicle-simulating hormone receptor
G phase de croissance, growth phase
GABPB1 GA binding protein transcription factor, beta subunit 1 GADD45A growth arrest and DNA-damage-inducible, alpha GAPDH glyceraldehyde-3-phosphate dehydrogenase GC granulosa cells
GDF9 Growth differentiation factor-9
GnRH gonadolibérine, gonadotropin-releasing hormone GSH glutathione
GST01 glutathione S-transferase omega 1
GSTM3 glutathione synthase complex proteins glutathione S-transferase mu 3 (brain) GSTT1 glutathione S-transferase theta 1
GSTT2 glutathione S-transferase theta 2 GV vésicule germinale, germinal vesicle
GVBD décompostion de la vesicule germinale, germinal vesicle breakdown HAS2 hyaluronan synthase 2
hCG hormone gonadotrophine chorionique, human chorionic gonadotropin HSD3B1 Hydroxy-delta-5-steroid dehydrogenase, 3 beta- and steroid delta-isomerase
ID3 Inhibitor of DNA binding 3, dominant negative helix-loop-helix protein IGF facteur de croissance apparenté à l'insuline, insulin-like growth factor IGF1 facteur de croissance apparenté à l'insuline 1, insulin-like growth factor 1 IGF1R récepteur à l’IGF de type 1, insulin-like growth factor 1 receptor
IGF2 facteur de croissance apparenté à l'insuline 2, insulin-like growth factor 2 IGFBP insulin-like growth factor binding protein
IGFBP2 insulin-like growth factor binding protein 2 IGFBP4 insulin-like growth factor binding protein 4 INHA inhibine alpha
INHA : INHBB inhibine B INHA :INHBA inhibine A INHBA inhibine beta A INHBA :INHBA l’activine A INHBB inhibine beta B
IPA Ingenuity Pathway Analysis IU international unit
IVF in vitro fertilization
IVM in vitro maturation
IVT in vitro transcription
JNK c-Jun N-terminal kinases KL ligand kit, kit ligand
LH hormone lutéinisante, luteinizing hormone LHCGR luteinizing hormone/choriogonadotropin receptor
LHR récepteur à l’hormone lutéinisante, luteinizing hormone receptor MAPK3/1 mitogen-activated protein kinase 1/2
MEF mouse embryonic fibroblasts
MEKK4/MTK1 mitogen-activated protein kinase kinase kinase 4
MII métaphase 2
MIV maturation in vitro
MPF maturation promoting factor mRNA messenger ribonucleic acid MYOD1 myogenic differentiation 1
NFE2L2 NRF2 transcription factor, nuclear factor (erythroid-derived 2)-like 2 NRF2 see NFE2L2
NSERC Natural Sciences and Engineering Research Council of Canada
OHSS syndrome d’hyperstimulation ovarienne, ovarian hyperstimulation syndrome OLR1 Low density lipoprotein (lectin-like) receptor 1
OPU ovum pick up
P phase plateau, plateau phase
P4 progestérone
PAPPA pregnancy-associated plasma protein A PBS phosphate buffered saline
PCNA Proliferating cell nuclear antigen PCOS Polycystic ovary syndrome PDE phosphodiestérases
PDE3 phosphodiestérases de type 3 PDE4 phosphodiestérases de type 4 PGF prostaglandine F2α
PI propidium iodide
PI3K Phosphoinositide-3-kinase PIV production d’embryons in vitro PKA protéine kinase A, protein kinase A PPIA cyclophilin A
PTGS2 prostaglandin synthase 2 PTX3 pentraxin 3
QPCR quantitative polymerase chain reaction qRT-PCR real-time polymerase chain reaction RIN RNA integrity number
ROS reactive oxygen species rRNA ribosomal ribonucleic acid RSE relative standard error
SCF facteur des cellules souche, stem cell factor SEM standard error of the mean
SMAD2/3 SMAD family member 2/3
SOD2 superoxide dismutase 2, mitochondrial STAR steroidogenic acute regulatory protein STK17A serine/threonine kinase 17a
TC thecal cell
TF transcription factors
TGF-β facteur de croissance de transformation beta, transforming growth factor beta
TGM2 Transglutaminase 2 (C polypeptide, protein-glutamine-gamma-glutamyltransferase)
TNFAIP6 tumor necrosis factor alpha-induced protein 6
TNFRSF21 Tumor necrosis factor receptor superfamily, member 21 TP53 Tumor protein p53
TP63 tumor protein p63 TP73 tumor protein p73
UGP2 UDP-glucose pyrophosphorylase 2 XIRP1 Xin actin-binding repeat containing 1
Remerciements
La maîtrise a été une expérience riche d’apprentissage et de cheminement personnel et j’aimerais remercier ceux qui en ont fait partie.
Je voudrais remercier Marc-André Sirard, mon directeur de recherche, qui m’a non seulement permis de travailler au sein d’un laboratoire bénéficiant de grandes ressources et d’une équipe tissée solide, mais de qui j’ai pu apprendre ce qui était nécessaire pour bâtir de telles choses. Marc-André m’a apporté un support constant tout en nécessitant que je travaille de façon autonome afin d’évoluer dans le processus de résolution de problème, un atout qui me sera utile toute ma vie et pour lequel je lui serai toujours reconnaissant.
Merci à Isabelle Dufort pour son aide tout au long de ma maitrise et pour sa patience parfois mise à rude épreuve. Merci également à Dominic Gagné et Julie Nieminen, pour leurs réponses à mes questions. Et merci aux trois pour leur sens de l’humour toujours au rendez-vous qui égayaient même les longues journées dans le labo.
Parmi les chercheurs du CRBR, merci en particulier à Claude Robert, François Richard et Pierre Leclerc. Leur accessibilité, autant sur le campus que durant des congrès ou des activités, a été grandement appréciée, ne serait-ce que pour leurs conseils que pour le fait qu’elle favorisait l’échange entre les chercheurs et les étudiants. Je remercie aussi Maurice Dufour, Johan Smitz et Tom Adriaenssens pour leur collaboration et leur aide.
Merci à toute l’équipe d’étudiants dont j’ai fait partie. Particulièrement à Angus Macaulay, mon « partner in crime » tout au long de la maitrise, et Gael Cagnone, tous deux de bon conseil dans le bureau et des alliés de cran dans les rues de Québec et en colocation. Rémi Labrecque, un modèle d’assiduité au travail comme dans les partys. Anne-Laure Nivet, Audrey Brunel, Isabelle Gilbert et Maëlla Gohin qui ont été de bon conseil et m’ont redonné un coup d’optimisme dans les passes difficiles. Je remercie aussi les autres membres de cette belle équipe : Élise Mondou, Ernesto Orozco, Nicolas Guillemin, Florence Pagé-Larivière, Luis Baldoceda, Sara Scantland, Éric Fournier et Habib Allah. Merci à mes parents et mes sœurs pour leur support inébranlable dans tout ce que j’entreprends.
Avant-Propos
Deux articles scientifiques sont insérés dance ce mémoire.
L’article traitant de l’étude effectuée chez le bovin a comme auteur principal l’étudiant. Ce dernier a exécuté toutes les opérations en laboratoire, jusqu’à l’analyse des résultats, mis-à-part les analyses cytométriques qui elles ont été effectuées par Maurice Dufour, directeur du centre de cytométrie du Centre Hospitalier de l’Université Laval. L’article a été entièrement rédigé par l’étudiant et révisé par le co-auteur, Marc-André Sirard, le superviseur de recherche de l’étudiant, professeur titulaire au département des sciences animales de l’Université Laval et détenteur de la Chaire du Canada Sénior en génomique appliquée à la reproduction.
L’article traitant de l’étude réalisée avec des tissus humains a comme auteur principal l’étudiant. Ce dernier a exécuté toutes les opérations en laboratoire, suite à la récolte des échantillons biologiques, jusqu’à l’analyse des résultats. Les échantillons biologiques humains ont été récoltés au Centrum voor Reproductieve Geneeskunde (CRG ou Centre de la Reproduction Humaine) de l’Universitair Ziekenhuis Brussel (UZ Brussel), sous la supervision de Johan Smitz et Tom Adriaenssens, du Research group for Follicle Biology (FOBI), deux des co-auteurs. L’article a été entièrement rédigé par l’étudiant et révisé par les co-auteurs : Marc-André Sirard, Johan Smitz et Tom Adriaenssens.
Introduction
Une meilleure compréhension de la biologie de l’ovocyte et du follicule qui l’entoure est cruciale pour intervenir de façon efficace dans le système reproducteur afin d’améliorer ou préserver la fertilité et élucider les mystères de cette cellule qui est à la genèse de la vie. Au Canada, environ un couple sur six éprouve des problèmes de fertilité (OVO Consulting 2009). En 2008, l’année la plus récente pour laquelle les données sont disponibles, 9904 cycles de fécondation in vitro (FIV) ont été entrepris dans les 28 cliniques à travers le pays et donnèrent des taux de naissance de 29% par cycle entrepris ou 31% par cycle où des ovocytes ont pût être récoltés (Canadian Fertility and Andrology Society 2010). Chez la vache, l’industrie laitière dépend grandement de la fertilité de ces animaux, particulièrement des bonnes productrices. Pour ces animaux, l’IVF précédée de la maturation in vitro (MIV) donne de meilleurs taux de grossesse que l’IVF conventionnelle en plus d’augmenter de trois fois le nombre de grossesses obtenues par l’insémination artificielle (Bousquet, et al. 1999). La MIV consiste à retirer l’ovocyte du follicule, à un stade plus précoce qu’en IVF conventionnelle, pour lui faire compléter sa maturation en milieu de culture plutôt que par simulation hormonale dans l’ovaire. Suite à un protocole de stimulation développé durant les dernières années (Blondin, et al. 2002), les taux de gestation sont maintenant à 55% dans l’industrie laitière (Nivet, et al. 2012). Malheureusement, cette tendance n’est pas observée chez l’humain ou les taux suite à l’IVF conventionnelle demeurent deux fois plus élevés qu’en MIV (Smitz, et al. 2011).
Le bovin demeure tout de même le meilleur modèle expérimental pour l’avancement des connaissances chez l’humain vue les similitudes dans la physiologie reproductrice de ces deux espèces, du moins au stade pré-implantatoire, que l’on ne retrouve pas chez d’autres mammifères communément utilisés en recherche comme la souris (Baerwald, et al. 2012). Contrairement à cette dernière, le bovin et l’humain sont tous les deux des espèces mono-ovulantes et par conséquent sont très similaires en ce qui a trait à la dynamique de la croissance de leurs follicules ovariens, la régulation des hormones gonadotrophines et la progression entre différents stades développementaux, autant au niveau du follicule que de l’ovocyte (Mihm et Evans 2008).
Le séquençage du génome bovin a mené au développement d’outils permettant l’analyse de la physiologie reproductive au niveau moléculaire. Une biopuce détectant la présence de transcrits et leurs variants a récemment été développée chez la vache et permet donc de déterminer quels gènes sont exprimés dans un tissu donné (Robert, et al. 2011). Cet outil, combiné à une abondance de tissus ovariens provenant d’abattoir, permet donc de faire de grands pas dans la compréhension de la modulation des gènes durant le cycle reproducteur, à un rythme plus important que chez l’humain où les tissus sont rares. Cette étude avait donc deux volets : la récolte d’un grand nombre de tissus folliculaires bovins pour définir, au niveau transcriptomique, les différentes phases de développement du follicule au cours du cycle, suivi d’une étude comparative avec des tissus folliculaires humains où le développement du follicule avait été modulé par stimulation hormonale en préparation pour l’IVM. L’objectif était d’évaluer si la stimulation hormonale pour la reproduction assistée chez l’humain engendrait un profil moléculaire dans le follicule particulier à une des phases de développement naturel chez le bovin et déterminer si cette signature d’expression génique est corrélée avec le potentiel développemental de l’ovocyte qu’il contient.
Chapitre 1
Introduction
1.1 Section 1 : Le follicule ovarien
1.1.1 La composition du follicule ovarien
L’ovocyte se trouve dans une structure nommée le follicule. Le follicule est composé de cellules de la thèque (CT) dans sa périphérie et ces dernières sont séparées par la membrane basale des cellules de granulosa (CG) qui couvrent la paroi intérieure du follicule. Les cellules de granulosa qui entourent l’ovocyte sont spécifiquement appelées cellules du cumulus (CC) et sont physiologiquement distinctes des CG murales, malgré qu’elles forment un agencement continu avec ces dernières (Aerts et Bols 2010b). La zone pellucide se trouve entre les cellules du cumulus et l’ovocyte. C’est une coque glycoprotéique essentielle durant le processus de fécondation et au début du développement embryonnaire (Gupta, et al. 2012).
B
C
Figure 1.1 A et B : Image de sections histologiques de follicule ovarien montrant la
délimitation par la membrane basale (« basement membrane ») entre les cellules de la thèque et les cellules de granulosa (A) et les cellules de cumulus entourant l’ovocyte (B). C : Un schéma d’un follicule antral. A et B : (Boston University), C : (Aerts et Bols 2010b)
1.1.2 La réserve ovarienne
Environ deux mois après avoir été conçu, le fœtus humain femelle possède environ 600 000 cellules germinales, soit environ 300 000 dans chaque ovaire (Baker 1963). Parmi ces cellules germinales, 260 000 environ sont au stade d’ovogonie, le stade où la cellule germinale femelle est encore dans sa phase de multiplication par mitose. Des 40 000 autres, 20 000 environ ont débuté la méiose et sont à la phase leptotène de la prophase I. « Ovocyte » est le nom donné à une cellule germinale ayant débuté la méiose. La prophase est la première étape de la méiose suite à la duplication du matériel génétique et elle est divisée en cinq stades : leptotène, zygotène, pachytène, diplotène et diakinèse. Le reste des cellules germinales, soit environ 20 000 également, sont en dégénération par apoptose, un type de mort cellulaire contrôlée. Un total de 6 800 000 cellules germinales sera atteint à cinq mois, mais, dû à une apoptose prononcée, ce chiffre descendra à 2 000 000 à la naissance, ou plutôt à 1 000 000 considérant que 50% seront déjà en apoptose (Baker 1963, Gougeon 2010). Chez la vache, un maximum de 2 700 000 cellules germinales sera atteint après 110 jours de gestation, mais comme chez l’humain, l’apoptose réduira considérablement ce nombre, ne laissant qu’environ 130 000 cellules germinales à la naissance (Erickson 1966).
Le follicule primordial comprend un ovocyte immature arrêté à la prophase I de la méiose, et est entouré par une seule couche de cellules somatiques, les cellules de granulosa (Aerts et Bols 2010b). Plus spécifiquement, les ovocytes contenus dans les follicules primordiaux vont s’arrêter dans la phase diplotène de la prophase I, une étape atteinte après 90 jours de gestations chez la vache (Yang et Fortune 2008).
La puberté a lieu à environ un an chez la vache. Ceci est déterminé d’après le comportement visible des chaleurs, la présence d’un corps jaune, une structure formée par le follicule suite à l’ovulation, et par le niveau élevé de progestérone (P4), une hormone produite par le corps jaune (Patterson, et al. 1992). Le nombre de follicules primordiaux à cet instant sera encore le même qu’à la naissance, soit entre 100 000 et 130 000 (Erickson 1966, Silva-Santos, et al. 2011), contrairement à la femme chez qui la réserve aura continué à chuter, et ce de plus de moitié, atteignant un nombre entre 300 000 et 400 000 follicules primordiaux à la puberté qui a lieu douze ans après la naissance (Faddy, et al. 1992, Oktem
et Oktay 2008). Les follicules primordiaux contenant des ovocytes arrêtés à la phase diplotène de la prophase I de la méiose constituent la réserve ovarienne proprement dite car c’est seulement à partir de ce stade que leur croissance vers l’ovulation peut être activée, un processus nommé initiation. La croissance des follicules contenant un ovocyte à un stade plus précoce de la prophase I ne peut être activée (Yang et Fortune 2008). Après la puberté, les follicules et l’ovocyte qu’ils contiennent sont destinés à deux fins, l’ovulation ou l’atrésie, le dernier étant un processus consistant à l’apoptose globale des cellules folliculaires (Hughes 1991). Considérant que seulement 400 ovocytes seront ovulés durant une vie humaine, plus de 99.9% des follicules succomberont donc à l’atrésie (Morita et Tilly 1999).
1.1.3 La croissance folliculaire
Une fois sa croissance activée, le follicule primordial commencera par passer à travers trois stades : primaire, secondaire et tertiaire. Dans les follicules primordiaux au repos, l’ovocyte arrêté à la phase diplotène de la prophase I est entouré d’une seule couche de moins de 5-8 cellules de granulosa aplaties et le diamètre folliculaire est inférieur à 0.04 mm (Braw-Tal et Yossefi 1997). Pour les follicules primordiaux dont la croissance a été activée, on retrouve toujours une seule couche de cellules de granulosa, par contre certaines de ces dernières prennent une forme cubique. Les follicules sont catégorisés comme primaires une fois que 10 à 40 cellules de granulosa cubiques les entourent, formant une couche simple ou partiellement double. Au stade secondaire, les follicules sont entourés par 41 à 100 cellules de granulosa formant une couche partiellement double ou même jusqu’à trois couches (Braw-Tal et Yossefi 1997). Le follicule tertiaire a plus de deux couches de cellules de granulosa, ces dernières étant aux nombre de 101 à 250 entourant l’ovocyte (Braw-Tal et Yossefi 1997, Fair, et al. 1997b). Quand le nombre de cellules de granulosa entourant l’ovocyte dépasse 250, ce qui correspond à un diamètre folliculaire entre 0,25 et 0,5 mm chez la vache ou entre 0,1 et 0,2 mm chez l’humain, on observe la formation de l’antrum, une cavité qui est remplie de liquide (Braw-Tal et Yossefi 1997, Fauser et Van Heusden 1997). La formation de l’antrum marque aussi l’instant où la couche interne des cellules de la thèque devient clairement définie, étant séparée des cellules de granulosa par la membrane basale et étant elle-même entourée par les cellules de la thèque de la couche externe (Figure 1.1 A). Le nombre de cellules de la thèque continuera d’augmenter tout au
long de la croissance antrale, par contre ce taux de prolifération sera réduit en arrivant en croissance antrale tardive (McNatty 1981). Chez l’humain, les cellules de granulosa continueront de proliférer à un taux relativement élevé par rapport aux cellules de la thèque, ne ralentissant qu’en entrant dans la phase pré-ovulatoire, entre 16 et 24 mm, point auquel la croissance du diamètre folliculaire est majoritairement due à une expansion de l’antrum (McNatty 1981). C’est également à la formation de l’antrum qu’une distinction est établie entre les cellules de granulosa entourant directement l’ovocyte : les cellules du cumulus (CC), et les cellules de granulosa bordant la membrane basale en périphérie de l’antrum, maintenant appelées les cellules de granulosa murales (Figure 1.1 A, B et C).
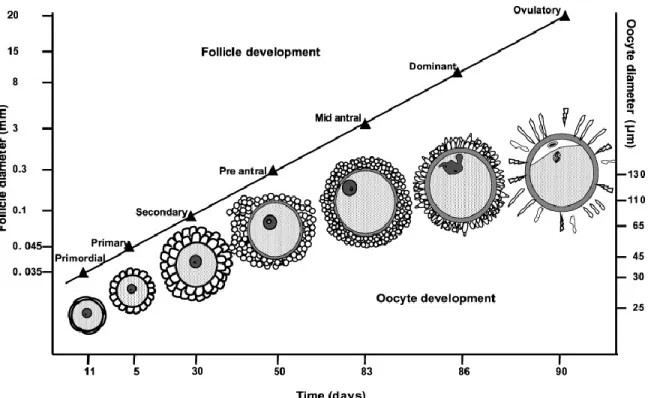
Chez l’humain, les follicules primordiaux dont la croissance a été activée prendront quelques mois pour arriver au stade pré-antral, défini par un diamètre folliculaire d’environ 0,15 mm (Gougeon 1998). 70 jours seront ensuite nécessaires pour que le follicule passe du stade pré-antral, forme un antrum entre 0,2 et 0,4 mm et atteigne un diamètre folliculaire de 2 mm(Gougeon 1998). Le développement de 2 mm de diamètre jusqu’à l’ovulation, point auquel le follicule humain a une taille d’environ 20 mm de diamètre, prendra 20 jours (Figure 1.2) (Gougeon 1998). Plus spécifiquement, la période entre 10 mm et un diamètre folliculaire de 20 mm, est de 7 jours (Baerwald, et al. 2009). Chez la vache, le développement du stade pré-antral, à un diamètre d’environ 0,13 mm, jusqu’à un diamètre d’environ 8,5 mm, prendra 42 jours (Lussier, et al. 1987). Les diamètres folliculaires de 10 mm, chez la femme (Mihm et Evans 2008), et de 8,5 mm, chez le bovin (Ginther 2000), correspondent à la taille qu’un seul follicule atteindra dans un cycle conventionnel et qui, dans des espèces mono-ovulantes comme l’humain et le bovin, ira jusqu’à l’ovulation. Les mécanismes impliqués dans la sélection du follicule dominant seront explorés plus en détails dans la section : 1.1.5 Le cycle d’oestrus/menstruel.
Figure 1.2 Croissance folliculaire chez l’humain. (Gougeon 1996) 1.1.4 La croissance ovocytaire
Le rôle du follicule ovarien est de soutenir le développement de l’ovocyte qu’il contient, jusqu’à ce qu’il soit compétent à produire une progéniture, et d’ensuite le libérer par le processus d’ovulation afin qu’il soit fécondé. L’ovogenèse et la folliculogenèse ont lieu simultanément. La section qui suit mettra donc en perspective la croissance de l’ovocyte par rapport à la croissance du follicule dans lequel il se trouve.
Premièrement, il est important de comprendre les stades que l’ovocyte doit traverser au niveau de son matériel génétique. Comme expliqué ci-dessus, l’ovocyte dans le follicule primordial est arrêté dans la phase diplotène de la prophase I. À ce stade de la méiose, le matériel génétique a été dupliqué, et les chromosomes se retrouvent composés de deux
chromatides sœurs identiques reliées par un centromère. L’enjambement (crossing-over) a lieu entre les chromatides non-sœurs des chromosomes homologues (Hunt et Hassold 2008). Par exemple, une chromatide du chromosome #5 maternel échange du matériel génétique avec sa chromatide non-sœur du chromosome #5 paternel. L’enjambement est une des caractéristiques qui distinguent la méiose de la mitose, dans laquelle il n’y a habituellement pas d’appariement des homologues qui le permette (Hunt et Hassold 2008). Dans un cycle, la méiose reprendra une fois que le follicule aura atteint la phase pré-ovulatoire, suite au pic de LH. L’ovocyte progressera ensuite jusqu’à la métaphase II avant d’être ovulé et restera à ce stade de la méiose jusqu’à la fécondation. Ce n’est qu’après la fécondation que la méiose sera complétée. Durant la progression entre la prophase I et la métaphase II, l’anaphase I distingue également la méiose de la mitose car les centromères demeurent intacts. Par exemple, les deux chromatides-sœurs du chromosome #5 resteront liés par leur centromère et iront d’un côté ou d’un autre durant la division de la télophase I, tandis que les chromatides sœurs du chromosome #5 maternel iront du côté opposé. Il est également important de noter que, du moins chez la femelle, les divisions durant la télophase I et II ne consistent pas en un partage égal du cytoplasme, mais plutôt, une des « cellules filles » n’obtiendra essentiellement que des chromosomes, tandis que l’autre gardera la quasi-totalité du cytoplasme et formera l’ovule proprement dit. Les cellules extraites sans cytoplasme sont dénommées globules polaires. Le deuxième globule polaire est extrait durant la télophase II, suite à la fécondation, et équilibre ainsi l’apport génétique haploïde de l’ovule et du spermatozoïde respectivement (revue dans Sirard 2001).
Au stade de prophase I, le noyau de l’ovocyte est nommé vésicule germinale (GV, ou vésicule germinative). On caractérise alors l’œuf d’ovocyte primaire. Chez l’humain, il contient 46 chromosomes qui correspondent à 23 paires de chromatides sœurs, décrites ci-dessus. Durant la reprise de la méiose, on observe la décomposition de la vésicule germinale (GVBD, germinal vesicle breakdown). Une fois la métaphase II atteinte, la cellule ayant gardé la majeure partie du cytoplasme ainsi que des chromosomes (chromatides sœurs séparés) est l’ovocyte secondaire, et celle contenant majoritairement des chromosomes est le premier globule polaire. C’est l’ovocyte secondaire qui sera expulsé par le follicule durant l’ovulation (revue dans Sirard 2001).
La compétence méiotique est atteinte de façon progressive dans l’ovocyte au cours de son développement. Pour les ovocytes ayant un diamètre de ≤100 μm, 100 - <110 μm, 110 - <120 μm et >120 μm, le taux de maturation nucléique in vitro jusqu’à la métaphase II est de 21,2%, 42,3%, 75,9% et 80,7%, respectivement (Fair, et al. 1995). On conclut donc qu’en général la compétence à reprendre la méiose est atteinte à un diamètre ovocytaire de 100 μm, mais que la pleine compétence méiotique, soit celle de compléter la maturation méiotique jusqu’à la métaphase II, est atteinte à un diamètre ovocytaire d’environ 110 μm, ce qui correspond à un diamètre folliculaire d’environ 2 mm, chez le bovin (Fair, et al. 1997b).
Malgré que l’ovocyte soit arrêté en prophase I au stade de follicule primordial jusqu’au stade pré-ovulatoire, une croissance marquée de l’ovocyte est observée conjointement avec celle du follicule. Chez le bovin, l’ovocyte passera d’un diamètre de moins de 30 μm dans le follicule primordial à un diamètre de plus de 120 μm dans le follicule antral d’environ 3 mm (Hyttel, et al. 1997). Au-delà d’un diamètre folliculaire de 3 mm, la croissance ovocytaire atteindra un plateau entre 120 et 130 μm (Figure 1.3) (Fair 2003), ce qui correspond à une augmentation de pratiquement 64 fois le volume que l’ovocyte de 30 μm avait dans le follicule primordial (Aerts et Bols 2010b). Le développement de l’ovocyte durant cette période est marqué par une modulation de l’activité transcriptionnelle de ce dernier. L’activité transcriptionnelle de l’ovocyte est un aspect important dans son développement car l’accumulation d’ARN messager (ARNm) dans l’ovocyte durant sa phase de croissance est essentielle à l’acquisition d’une compétence développementale (Fair 2003, Sirard, et al. 2006). La transcription est active dans le noyau des cellules de granulosa dans le follicule primordial, mais l’activation de la transcription dans le noyau de l’ovocyte, tel qu’observé par autoradiographie mesurant l’ARN totale (ARNt : ARN ribosomale; ARNr, et l’ARNm) n’est observée que dans les follicules ayant atteint le stade secondaire (Fair, et al. 1997a), soit un diamètre ovocytaire de 45 μm environ (Hulshof, et al. 1994). La condensation de la chromatine dans le noyau de l’ovocyte concorde avec l’atténuation de la transcription dans ce dernier (Lodde, et al. 2008). Chez le bovin, les ovocytes où la chromatine a un aspect diffus et filamenteux à travers tout le noyau, une configuration nommée GV0, proviennent seulement de follicules antraux-précoces, entre 0,5 et 2 mm, et ont un ovocyte de 109 μm en moyenne (Lodde, et al. 2007). Dans ces
ovocytes, un signal élevé est observé, correspondant à une synthèse élevée d’ARN et la configuration de leur nucléole correspond à une synthèse d’ARNr encore active. La configuration GV0 est donc associée à un ovocyte encore en croissance, accumulant les molécules nécessaires pour atteindre la compétence méiotique, ce qui expliquerait pourquoi très peu d’entre eux reprennent et complètent la méiose in vitro (25 et 6,4%, respectivement) (Lodde, et al. 2007). Les configurations GV1, GV2 et GV3 correspondent à une chromatine de plus en plus condensée, la GV3 étant associée à une chromatine condensée en un seul amas (Lodde, et al. 2007). Malgré que les GV1 et GV2, trouvés dans des follicules allant de 0,5 à 6 mm et ayant un diamètre ovocytaire moyen de 117 et 119 μm respectivement (Lodde, et al. 2007), ont une baisse marquée de signal relativement à GV0, cela indique une transcription atténuée mais toujours présente (Lodde, et al. 2008). Aucun signal n’est observé dans les ovocytes GV3 (Lodde, et al. 2008), cette configuration étant associée à un diamètre moyen de 122 μm (Lodde, et al. 2007). L’atténuation de la transcription associée à la condensation de la chromatine semble être un bon indicateur de la compétence acquise par l’ovocyte, tel que démontré par les taux significativement plus élevés de maturation, 81, 83 et 91%, relativement à GV0 (6.4%), pour GV1, GV2 et GV3 respectivement (Lodde, et al. 2008). Cela se reflète également dans les taux de production de blastocystes qui sont significativement plus élevés dans GV2 et GV3 (22,7 et 19,1%) que dans GV1 (8,9%) (Lodde, et al. 2008).
Figure 1.3 Diamètre ovocytaire en fonction du diamètre folliculaire. La durée
approximative des stades de développement folliculaire est indiquée par la ligne en fonction du diamètre folliculaire. Des schémas démontrant le développement de l’ovocyte et des cellules de granulosa qui l’entourent sont présentés pour chaque stade folliculaire. (Fair 2003)
Le taux plus élevé de production d’embryons des ovocytes GV2 et GV3 pourrait être relié à leur morphologie montrant les signes typiques de pseudo-maturation (Lodde, et al. 2008). La « pseudo-maturation » fait référence à la similitude entre les changements structurels ayant lieu durant la dégénération de l’ovocyte et ceux ayant lieu dans l’ovocyte du follicule dominant au cours du développement final de la période pré-ovulatoire (Assey, et al. 1994), nommé capacitation de l’ovocyte (Hyttel, et al. 1997). Cela concorde avec les observations que les ovocytes compétents provenant de follicules de taille moyenne sont associés à l’atrésie précoce (Blondin et Sirard 1995), tel que les follicules « plateaux » étudiés dans le chapitre 2.
Spécifiquement, la capacitation de l’ovocyte a lieu durant la période suivant la sélection du follicule dominant et précédant la montée de l’hormone lutéinisante (LH) qui induira la maturation finale et l’ovulation. On parle de compétence méiotique, quand l’ovocyte a la
capacité de reprendre la méiose et atteindre la métaphase II. Cette compétence semble dépendre de l’atténuation de la transcription et de la condensation adéquate de la chromatine, ce qui est vrai des ovocytes ayant atteint un diamètre moyen de >115 μm (Lodde, et al. 2007), correspondant à un follicule d’environ 2 mm (Fair 2003), tel que décrit plus haut. Effectivement, les ovocytes <110 μm, majoritairement en configuration GV0, ne donnent que 6.4% de taux de maturation jusqu’à métaphase II, tandis que ceux s’étant développés au-delà de 110 μm se rendent en grande majorité jusqu’à la métaphase II une fois mis en IVM (Fair, et al. 1995, Lodde, et al. 2007). Pour ce qui est du diamètre folliculaire, la majorité des ovocytes bovins provenant de follicule de 2 à 6 mm mis en culture pour la maturation in vitro (IVM), ayant une configuration GV1 à GV3, atteignent la métaphase II (Lodde, et al. 2007). Par contre un taux bien plus bas, soit environ 35% des ovocytes récoltés dans des follicules de 6 à 10 mm et 56% pour les ovocytes provenant de follicule de 11 à 15 mm, atteignent le stade de blastocyste (Machatkova, et al. 2004). Il est donc de plus en plus clair que les ovocytes récoltés dans des follicules > 3 mm, ayant donc atteint un diamètre au-delà de 110 μm, ont complété leur pleine maturation nucléaire et donc que la déficience développementale qui est moindre dépend de la maturation cytoplasmique et moléculaire (Hyttel, et al. 1997, Izadyar, et al. 1998, Sirard, et al. 2006). Comme mentionné plus haut, la maturation cytoplasmique, ou capacitation de l’ovocyte, ou pseudo-maturation, a lieu une fois que le follicule a atteint la dominance lorsque le follicule entre en atrésie précoce. Cela pourrait expliquer la raison pour laquelle des ovocytes provenant de follicules n’ayant pas atteint la dominance peuvent tout de même se développer en embryon une fois fécondés. Durant la croissance de l’ovocyte, soit du follicule primordial jusqu’au petit antral de 3 mm, des changements ultrastructuraux peuvent être observés (Hyttel, et al. 1997). Ceux-ci incluent des changements au nucléole, en lien avec son activité transcriptionnelle, l’apparition de la zone pellucide et des jonctions communicantes gap entre l’ovocyte et les cellules de granulosa qui sont établies quand le follicule atteint le stade secondaire. La distribution des organelles passe d’uniforme au stade tertiaire précoce, ovocyte de 80 μm, à périphérique au stade tertiaire avancé, ovocyte >110 μm (Hyttel, et al. 1997). Le stade tertiaire avancé, marquant la fin de la croissance ovocytaire, est associé à un nombre élevé dans l’ovocyte de mitochondries, de gouttes lipidiques, de vacuoles et d’une augmentation de la taille de l’appareil de Golgi par rapport
au début de la croissance dans le follicule primordial (Hyttel, et al. 1997). L’ultrastructure de l’ovocyte, une fois que son follicule a atteint la dominance, à environ 8,5 mm chez la vache, est identique à celle observée à la fin de sa croissance, environ 3 jours plus tôt, dans le follicule de 3 mm (Hyttel, et al. 1997).
La maturation finale a lieu suite au pic de LH. Elle consiste à produire un ovocyte secondaire haploïde, tel que décrit plus haut, prêt à être fécondé par un spermatozoïde. Cela ne correspond pas à l’activation d’un gamète quiescent mais bien à la préparation finale d’une cellule ayant traversé plusieurs stades de développement, tel que décrit ci-dessus. Suite au pic de LH, l’enveloppe nucléaire est dissoute, le matériel nucléaire est relâché dans le cytoplasme et les chromosomes traversent les derniers stades de la méiose I pour ensuite s’arrêter en métaphase II (Fair 2003). De plus, les mitochondries encerclent les gouttes lipidiques qui seront utilisées comme réserves d’énergie jusqu’au stade blastocyste. Le pic de LH survient suite à la régulation endocrinienne complexe qui caractérise le cycle œstrale, chez la vache, ou menstruel, chez l’humain. La dynamique de ce cycle et les mécanismes qui y sont impliqués sont présentés dans les sections qui suivent.
1.1.5 Le cycle œstral/menstruel
Globalement, la croissance folliculaire est caractérisée par quatre événements clés. L’initiation marque le moment où la croissance des follicules primordiaux de la réserve ovarienne est activée. Durant le recrutement, de petits follicules antraux seront recrutés pour poursuivre leur croissance. La sélection défini la période où un seul follicule antral parmi la cohorte en croissance, appelé follicule dominant, sera sélectionné pour atteindre le quatrième et dernier évènement, l’ovulation. Suite à l’ovulation, le follicule se transforme en une structure nommée le corps jaune qui reste à la surface de l’ovaire et a pour rôle de sécréter des hormones afin de supporter une gestation éventuelle. Comme présenté dans la section 1.1.3 La croissance folliculaire, la période entre l’initiation et le recrutement durera plusieurs mois, autant chez la vache que chez la femme. Entre le recrutement et l’ovulation par contre, il ne se déroulera que quelques semaines. C’est cette période qui correspond au cycle œstrale, pour le bovin (Figure 1.4), ou cycle menstruel, chez la femme (Driancourt, et al. 2001).
Les facteurs et mécanismes menant à l’initiation, soit l’activation de la croissance des follicules primordiaux au repos, ne sont pas encore bien définis (Oktem et Urman 2010). Entre autre, on démontre que l’activation de la voie Phosphoinositide-3-kinase (PI3K), spécifiquement dans l’ovocyte, induit l’initiation, soit l’activation de la croissance des follicules primordiaux (Reddy, et al. 2008). On a confirmé que cela est exécuté par l’inactivation du facteur de transcription forkhead box O3 (FOXO3), menant à son transfert hors du noyau de l’ovocyte, et qui, par un mécanisme qui reste à être défini, mène à l’activation de la croissance de l’ovocyte et du follicule en général (Castrillon, et al. 2003, John, et al. 2008). Ce processus pourrait être enclenché par l’expression du ligand Kit (KL), ou facteur des cellules souche (SCF), produit par les cellules de granulosa qui se lierait à son récepteur sur l’ovocyte et activerait la voie PI3K (Reddy, et al. 2005). D’autres facteurs importants dans l’initiation et produits par les cellules somatiques du follicule sont les facteurs de croissance des fibroblastes (FGF), les « bone morphogenetic proteins » (BMP) et l’hormone antimullérienne (AMH) (revue dans Buratini et Price 2011). L’interaction granulosa-ovocyte au cours de la folliculogénèse sera présentée en détails dans la section 1.1.9 L’interaction granulosa/ovocyte.
Il a été établi que cette activation initiale de croissance ne nécessite pas de support hormonal. L’hormone folliculo-stimulante (FSH) et l’hormone lutéinisante (LH) sont des hormones glycoprotéiques sécrétées par l’hypophyse antérieure, suite à une pulsatilité de gonadolibérine (GnRH) provenant de l’hypothalamus. La FSH et la LH, aussi nommées gonadotrophines sont les deux régulateurs principaux de la folliculogénèse, et par conséquent, du cycle menstruel et cycle œstral. Les composantes neuroendocriniennes et ovariennes contribuant à la régulation des gonadotrophines sont collectivement appelées : l’axe hypothalamo-hypophyso-ovarien. Des fœtus humains atteints d’un syndrome affectant sérieusement la formation de l’hypothalamus, et donc la sécrétion des gonadotrophines, possèdent des follicules primordiaux se développant normalement, par contre aucun follicule possédant plus d’une couche de cellules de granulosa n’est observé, indiquant que les gonadotrophines sont nécessaires pour surpasser le stade primaire (Baker et Scrimgeour 1980). Par contre, chez des femmes souffrant d’un syndrome similaire, on observe tout de même des follicules ayant jusqu’à trois couches de cellules de granulosa (Goldenberg, et al. 1976). Il est intéressant que la présence de récepteurs à l’hormone
folliculo-stimulante (FSHR) soit détectée dans les cellules de granulosa dès l’initiation, moment de transition vers le stade primaire, où elles prennent une forme cubique (Oktay, et al. 1997). Chez le bovin les récepteurs pour la FSH apparaissent aussi au stade primaire (Wandji, et al. 1992). On suggère donc qu’une sécrétion tonique, ou basale, de FSH est nécessaire à la croissance folliculaire jusqu’à une grosseur de 5 mm, chez l’humain (Govan et Black 1975), ce qui explique aussi pourquoi on retrouve des follicules de cette taille chez des femmes n’ayant pas encore atteint la puberté, à quel moment les niveaux de gonadotrophines sont bien plus bas qu’à l’âge adulte (Gougeon 1996). Les récepteurs à l’hormone lutéinisante (LHR) sont également exprimés très tôt dans le développement folliculaire mais, tout comme les récepteurs à la FSH qui sont exclusifs aux cellules de granulosa, les récepteurs à la LH sont seulement exprimés dans les cellules de la thèque, du moins à ces stades précoces de la folliculogénèse. Spécifiquement, les LHR commencent à être exprimés dans les cellules de la thèque des follicules arrivant à la transition entre les stades secondaire et tertiaire (Peng, et al. 1991).
Donc, dès le début de sa croissance, le follicule exprime les récepteurs aux gonadotrophines et répond à une sécrétion basale d’hormone permettant un développement jusqu’à une grosseur de 2 à 5 mm, chez l’humain (Gougeon 1996). Cette marge de diamètre folliculaire correspond au stade de développement à partir duquel les follicules peuvent être recrutés et poursuivre leur croissance dans le cycle menstruel/œstral une fois la puberté atteinte. Il est important de noter, comme mentionné plus haut, que par défaut les follicules atteignant ce stade iront vers l’atrésie, et qu’un apport suffisant en FSH est essentiel à la poursuite de leur croissance, un mécanisme qui permettra éventuellement la sélection d’un seul follicule pour l’ovulation (Fauser et Van Heusden 1997). Malgré que certains follicules puissent atteindre une grosseur de 5 mm avec des niveaux basaux de FSH, tel qu’indiqué ci-dessus, le point critique où une concentration plus élevée de FSH est nécessaire à la poursuite de la croissance folliculaire est 2 mm chez l’humain (Gougeon 1996) et environ 3 mm chez le bovin (Lussier, et al. 1994). Afin de garder une perspective sur la chronologie, cette phase est atteinte environ 33 jours après la formation de l’antrum chez le bovin (Lussier, et al. 1987). Le recrutement repose sur le concept « FSH treshold/window» (Brown 1978, Fauser et Van Heusden 1997)qui suggère que les follicules commencent à être recrutés pour la poursuite de leur croissance une fois que le niveau de FSH dépasse un certain seuil et que
cette fenêtre de recrutement restera « ouverte » pour les petits follicules antraux tant que le niveau de FSH restera au-dessus de ce seuil. Cela a été démontré chez la femme en maintenant le niveau de FSH au-dessus du seuil pour une durée prolongée, ce qui mène à une augmentation du nombre de follicules recrutés dans la cohorte (Schipper, et al. 1998). La dynamique du cycle menstruel et œstral, chez la femme et la vache, respectivement, est très similaire, en commençant par le fait que ce sont deux espèces mono-ovulantes. Chez la femme, une étude à grande échelle a évalué la durée moyenne d’un cycle à 29.1±7.46 jours (Chiazze, et al. 1968) tandis qu’il se trouve entre 21 et 23 jours chez la vache (Aerts et Bols 2010a). Cette période représente essentiellement l’intervalle entre les ovulations. Suite à l’ovulation, comme mentionné plus haut, les cellules folliculaires se modifieront à travers un processus appelé lutéinisation afin de former le corps jaune. Le corps jaune a non seulement la fonction de permettre le maintien d’une grossesse suite à une éventuelle fécondation, mais il prévient aussi l’ovulation d’un autre follicule durant une certaine période de temps. La phase lutéale du cycle est la période durant laquelle un corps jaune est présent sur l’ovaire et dure environ 13 jours chez la vache (Lamming et Darwash 1998). La phase folliculaire est la période durant laquelle le corps jaune est en régression et n’est plus fonctionnel ce qui permet à nouveau l’ovulation. Cette période dure environ 8 jours chez la vache (Lamming et Darwash 1998). Le recrutement d’une cohorte de follicules, ou vague folliculaire, durant laquelle ces derniers continuent leur croissance grâce à un niveau suffisamment élevé de FSH, peut avoir lieu que le cycle soit en phase lutéal ou folliculaire. Une différence se manifeste plutôt à un stade plus avancé de la vague, c'est-à-dire que la vague menant à l’ovulation du follicule dominant débutera en phase lutéale mais se terminera en phase folliculaire, tandis qu’une vague non-ovulante a lieu quand celle-ci progresse dans un cycle toujours en phase lutéale, menant dans ce cas à l’atrésie du follicule dominant (Figure 1.4) (Ginther, et al. 1989). Dans les deux espèces, on retrouve 2 à 3 vagues folliculaires par cycle (Baerwald, et al. 2003). Donc, que ça soit durant la phase lutéale, folliculaire ou même durant d’autres contextes reproducteurs comme la grossesse (Ginther 2000), une montée de FSH dans le sang va mener au recrutement d’une cohorte de 24 follicules sélectionnables, en moyenne, chez la vache (Ginther, et al. 1996). Il est important de noter que ce nombre est très variable d’un individu à l’autre (entre 11 et 54 follicules de plus de 3 mm par vague) mais reste relativement constant d’une vague
folliculaire à une autre pour un individu donné, du moins chez la vache (Burns, et al. 2005). L’« émergence » de la vague folliculaire est le moment où cette cohorte de follicules est détectée par ultrason. En suivant la croissance de ces follicules de 3 mm par ultrason, chez la vache, Ginther, et al. (1996) ont observé qu’en moyenne, onze d’entre eux ont atteint un diamètre maximal de 4 mm, six ont atteint un diamètre maximal de 5 mm et sept ont dépassé 6 mm. Dans les deux premières catégories, les follicules ont succombé à l’atrésie et c’était également le cas pour la plupart des follicules dépassant 6 mm, par contre, dans cette dernière catégorie, le plus gros follicule était destiné à l’ovulation s’il se retrouvait en phase folliculaire. La montée de FSH menant au recrutement et à l’émergence d’une vague folliculaire atteindra sa concentration maximum dans le sang quand les plus gros follicules de la cohorte atteindront 4-5 mm de diamètre (Bodensteiner, et al. 1996, Kulick, et al. 1999, Ginther 2000). Ceci est dû au fait que les follicules en croissance ayant atteint 3 à 5 mm acquièrent la capacité de réduire les niveaux de FSH (Gibbons, et al. 1999). Le recrutement des follicules entre 3 et 4 mm coïncide avec l’enclenchement de l’activité aromatase, une enzyme produisant de l’œstradiol à partir des précurseurs que sont les androgènes sécrétés par les cellules de la thèque (Driancourt 2001). Ce processus sera présenté en détails dans la section 1.1.6 Modèle « deux cellules deux gonadotrophines ». L’œstradiol, ainsi que l’inhibine A, sont produits par le follicule en croissance et ont un effet inhibiteur sur les niveaux de FSH à travers un mécanisme de rétroaction sur l’hypophyse antérieur, tel que démontré par la corrélation entre l’augmentation des niveaux de ces derniers et la réduction des niveaux de FSH (Ginther 2000, Bleach, et al. 2001). C’est cette réduction des niveaux de FSH qui mènera éventuellement à la sélection du follicule dominant. La sélection du follicule dominant est caractérisée par un moment bien précis nommé « déviation ». C’est à cet instant que l’on commence à observer un écart dans le taux de croissance entre le plus gros follicule et le deuxième plus gros follicule de la cohorte. Le follicule dominant continuera sa croissance tandis que le reste des follicules de la vague entreront en atrésie (Gibbons, et al. 1999). En général, chez la vache, la déviation a lieu 2,5 jours après l’émergence du plus gros follicule. Ce dernier a alors atteint un diamètre moyen de 8,5 mm, tandis que le deuxième plus gros follicule de la cohorte est à 7,7 mm en moyenne (Ginther 2000, Ginther, et al. 2003). Chez la femme, la taille folliculaire à ce stade est similaire à celle observée chez le bovin, soit 10 mm pour le futur dominant et entre 7 et 8 mm pour le
plus gros follicule subordonné (Mihm et Evans 2008). Il est important de noter par contre que les follicules subordonnés ont tous un potentiel égal de devenir dominant. Cela a été démontré en sélectionnant un follicule de 5 mm au hasard et en le dirigeant ensuite vers la dominance en éliminant les autres follicules de 5 mm au fur et à mesure qu’ils atteignaient cette grosseur (Gibbons, et al. 1997). En se développant, la cohorte de follicules mène essentiellement à sa propre atrésie vue l’effet négatif de l’œstradiol, que les follicules sécrètent, sur les niveaux de FSH. Le follicule dominant échappe à l’atrésie en devenant relativement indépendant de la FSH (Mihm et Evans 2008). Entre autre, le follicule acquiert la capacité de répondre à la LH en exprimant les récepteurs de LH sur ses cellules de granulosa (Nogueira, et al. 2007). Il a été observé que les follicules ne progressaient pas plus loin que le stade de 7 à 9 mm si la LH était supprimée, confirmant la transition nécessaire de la FSH vers la LH comme stimulant de croissance une fois la dominance atteinte (Gong, et al. 1995, Gong, et al. 1996). Contrairement à la vache, chez l’humain les vagues folliculaires multiples durant le cycle ne possèdent pas toutes une phase de sélection et ne produisent donc pas toutes un follicule atteignant le stade dominant. Les termes « vagues majeures » et « vagues mineures» sont utilisés pour décrire les vagues où le développement d’un follicule dominant a lieu et les vagues où ce n’est pas le cas (Baerwald, et al. 2003).
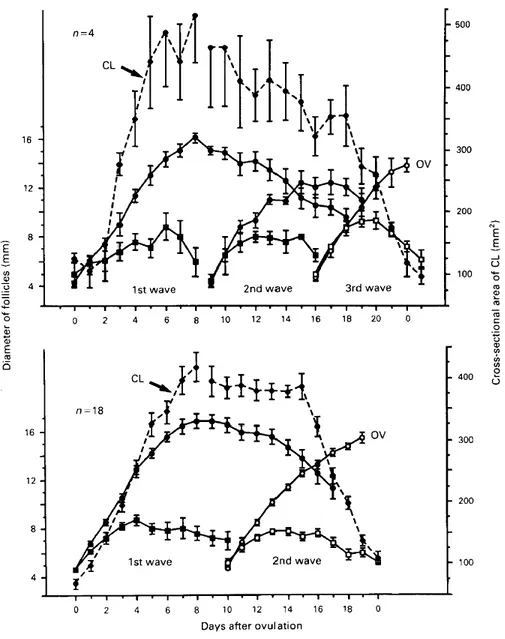
Comme mentionné plus haut, chez la vache, la vague ovulatoire est celle dont le follicule dominant ira jusqu’à l’ovulation et émergera pendant que le corps jaune est toujours présent, donc en phase lutéale. Ceci est le cas que ce soit un cycle ayant deux ou trois vagues (Figure 1.5) (Ginther, et al. 1989). Le Dr. Oliver J. Ginther et son équipe ont effectué plusieurs des premières études utilisant l’imagerie échographique par ultrason pour décrire la dynamique du développement folliculaire chez la vache. Certains de leurs résultats sont présentés ci-dessous. Les journées du cycle durant lesquelles a lieu l’émergence de la 1ère et 2e vague dans les cycles de deux ou trois vagues ne sont pas significativement différentes, soit au jour 0 (jour de l’ovulation) pour la première vague et entre le jour 9-10 pour la deuxième (Ginther, et al. 1989). La 3e vague, dans les cycles qui en ont une, émerge 16 jours après l’ovulation. Par contre, la durée des cycles à deux vagues est significativement plus courte que les cycles à trois vagues, soit environ 20 et 23 jours respectivement (Ginther, et al. 1989). Le diamètre du follicule dominant ovulatoire le jour avant l’ovulation était significativement plus grand dans les cycles à deux vagues, soit 16,5 mm environ, que dans les cycles à trois vagues, soit 14 mm. Cela est peut-être dû à l’intervalle plus long entre la détection du follicule dominant et son ovulation, environ onze jours pour les cycles à deux vagues, et sept jours pour les cycles à trois vagues. Spécifiquement, l’intervalle entre l’émergence du follicule ovulatoire et la cessation de croissance du plus gros subordonné, la déviation, est de 3 et 2,3 jours environ, pour les cycles à deux et trois vagues, respectivement. C’est durant cette période que le follicule dominant et le plus gros subordonné maintiennent le même taux de croissance (Ginther, et al. 1989, Ginther, et al. 2003). Comme mentionné précédemment, au moment de la déviation, qui marque la fin de la phase de croissance commune, le follicule dominant a atteint un diamètre de 8,5 mm en moyenne et le plus gros subordonné est à 7,7 mm en moyenne (Ginther 2000, Ginther, et al. 2003). Il est pourtant important de noter que cette différence est établie 2,5 à 3 jours plus tôt, moment où le futur follicule dominant émerge à 3 mm, en moyenne 6 heures plus tôt que le plus gros subordonné (Ginther, et al. 1997). Le futur follicule dominant maintiendra alors un avantage de 0,5 mm de diamètre sur le plus gros subordonné (Kulick, et al. 1999) tout au long de leur croissance parallèle, au même taux, jusqu’à la déviation (Ginther, et al. 1997). Comme mentionné plus haut, plusieurs follicules peuvent être sélectionnés tout au long de la phase de croissance commune. Par
contre, la plupart arrêteront de croître et régresseront avant la fin de cette dernière (Ginther, et al. 1997). Durant les 16 heures précédant la déviation, le futur dominant et le plus gros subordonné grossissent toujours au même taux, soit entre 1,0 et 1,4 mm de diamètre par période de 16 heures, tandis que les 2e et 3e plus gros subordonnés grossiront plus lentement (Ginther, et al. 2001). Dans les 16 heures suivant la déviation, le follicule dominant continuera de grossir au même taux, tandis que la croissance des autres subordonnés devient quasiment nulle (Ginther, et al. 2001). Les trois plus gros follicules, après la déviation et la sélection du follicule dominant, arrêtent de croître mais ne commencent pas à régresser immédiatement, restant plutôt dans une phase plateau, ou statique, pour ensuite commencer leur régression entre 24 et 32 heures après la déviation (Ginther, et al. 2001). Cela indique que les follicules subordonnés restent viables pour environ une journée après la déviation. L’étude présentée au chapitre 2 porte sur ces follicules subordonnés « plateau ». Donc, vu l’avantage de grosseur du futur dominant dès l’émergence, il peut être suggéré que le plus gros follicule parmi ceux pouvant répondre à la montée de FSH est désigné par chance (Gibbons, et al. 1997, Ginther 2000). Les autres follicules ont le même potentiel intrinsèque d’atteindre la dominance. Le futur dominant est tout simplement au stade optimal, étant le plus gros, étant en croissance active et donc n’ayant pas amorcé l’atrésie au moment où le niveau de FSH monte à un niveau permissif à la poursuite de la croissance.
Figure 1.5 Profils des diamètres moyens (± erreur type) du follicule dominant et du plus
gros subordonné et aire de la section transversale du corps jaune pour les intervalles inter-ovulatoire avec 2 ou 3 vagues folliculaires. Régression (P < 0.05) du corps jaune
commençant entre les jours 18 et 20 pour les intervalles avec 3 vagues et les jours 15 et 16 pour les intervalles avec 2 vagues. OV = ovulation. (Ginther, et al. 1989)