Université de Montréal
ETUDE DE LA SIGNALISATION VIRALE DE L’INDUCTION DU GÈNE DE L’IL-15 DANS LES CELLULES MONOCYTAIRES THP-1
Par
Jamila Ennaciri
Département de microbiologie et immunologie Faculté de médecine
Thèse présentée à la faculté des études supérieures en vue de l’obtention du grade de
Docteur ès sciences (Ph.D) En microbiologie et immunologie
Option Immunologie-virologie
Août 2006
©
37
Université
de Montréal
Direction des bibliothèques
AVIS
L’auteur a autorisé l’Université de Montréal à reproduite et diffuser, en totalité ou en partie, pat quelque moyen que ce soit et sur quelque support que ce soit, et exclusivement à des fins non lucratives d’enseignement et de recherche, des copies de ce mémoire ou de cette thèse.
L’auteur et les coauteurs le cas échéant conservent la propriété du droit d’auteur et des droits moraux qui protègent ce document. Ni la thèse ou le mémoire, ni des extraits substantiels de ce document, ne doivent être imprimés ou autrement reproduits sans l’autorisation de l’auteur.
Afin de se conformer à la Loi canadienne sur la protection des renseignements personnels, quelques formulaires secondaires, coordonnées ou signatures intégrées au texte ont pu être enlevés de ce document. Bien que cela ait pu affecter la pagination, il n’y a aucun contenu manquant. NOTICE
The authot of this thesis or dissertation has granted a nonexclusive license allowing Université de Montréal to reproduce and publish the document, in part or in whole, and in any format, solely for noncommercial educational and research purposes.
The author and co-authors if applicable retain copyright ownership and moral rights in this document. Neither the whole thesis or dissertation, nor substantial extracts from it, may be printed or otherwise reproduced without the author’s permission.
In compliance with the Canadian Privacy Act some supporting forms, contact information or signatures may have been removed from the document. While this may affect the document page count, it does not represent any Ioss of content from the document.
II
Université de Montréal
Faculté des études supérieures
Cette thèse intitulée
ETUDE DE LA SIGNALISATION VIRALE DE L’INDUCTION DU GÈNE DE L’IL-J5 DANS LES CELLULES MONOCYTAIRES THP-1
Présentée par
Jamila Ennaciri
A été évaluée par un
jury
composé de personnes suivantes:Dr Serge Montplaisir, président-rapporteur Dr José Menezes, directeur de recherche
Dr Hassan Fahmi, member du
jury
Dr Denis Girard, examinateur externe Dr , représentant du doyen de la FES
III
Résumé
Le virus respiratoire syncytial (VRS) est un virus à ARN simple brin, de polarité négative, appartenant à la famille des Paramyxoviridae. Il est responsable de plusieurs maladies respiratoires sévères. Des études ont démontré que le VRS est parmi les agents biologiques les plus inducteurs de production de chimiokines et de cytokines, ce qui engendre une réaction exacerbée, responsable en majeure partie de sa pathogénèse. Le virus herpès simplex 1 (HSV-1) est un virus à ADN double brin, appartenant à la famille des Herpesviridae. L’HSV-l est responsable d’infections oculaires, labiales, génitales ainsi que des infections des voies aériennes supérieures et peut aussi causer l’encéphalite. Des études antérieures ont démontré que l’HSV-l induit l’expression d’interféron (IFN)-V et d’IL-15 chez les souris et que ces deux cytokines jouent un rôle primordial dans la réponse immunitaire innée anti-HSV-1.
L’lL-15 est une cytokine impliquée dans l’activation de plusieurs cellules du système immunitaire et joue un rôle central dans l’immunité antivirale. Des études effectuées dans notre laboratoire avaient démontré que différents virus induisaient l’expression d’IL-15 dans les PBMCs. Des résultats préliminaires ont démontré aussi que le RSV et l’HSV-l induisent la sur-expression du gène de l’lL-15 chez la lignée monocytaire THP-1. Cependant, les voies de signalisation impliquées dans cette sur-expression n’ont pas été identifiées. Notre objectif était donc d’explorer la ou les voies empruntées par le RSV et l’HSV-l dans la signalisation de l’lL-15 et d’examiner si les deux virus empruntent les mêmes voies ou des voies séparées. La littérature montre que ces deux virus utilisent les protéines kinases de type sérine thréonine kinase ou tyrosine kinase dans la signalisation de différentes cytokines dans les cellules infectées. Ainsi, notre hypothèse était que le RSV et I’HSV-l régulent la sur expression d’IL-15 en activant une ou plusieurs de ces kinases et transactivent son gène via le facteur de transciption NF-KB. Pour ce faire, les cellules THP-1 sont infectées par le RSV et l’HSV-l et incubées pendant 7h. Le taux d’expression d’ARNm de l’IL-15 est détecté par RT-PCR et celui de la protéine par cytométrie en flux. La phosphorylation des différentes kinases est évaluée par Western blot et par
Iv
un test d’activité kinase. La fixation de la forme active de NFKB sut la séquence promotrice de l’IL-15 est détectée par le test de mobilité électrophorétique EMSA et par un test ELISA. Nous avons démontré que le RSV induit la sur-expression de l’IL 15 dans les cellules THP-1 en phosphorylant la PKCa/. L’inhibition de cette kinase par des inhibiteurs spécifiques a abrogé cette induction. En revanche, l’HSV-l en plus d’induire la phosphorylation de PKC/À, active des kinases de type tytosine. Nous avons aussi démontré que le RSV et l’HSV-l transactivent le gène de ‘IL-15 via le même site, NFKB.
Les TolI-like receptors (TLR5) jouent un rôle considérable dans l’immunité innée et acquise. En 2001, l’équipe d’Alexopoulou a démontré la contribution du TLR3 dans la réponse antivirale à travers la reconnaissance d’ARN double brin (dsRNA) (étape importante lots de la réplication virale) ou son analogue le poiy (l:C). Cette réponse se manifeste par une surproduction du TLR3 et par l’activation des protéines adaptatrices TRIF et TRAF6 et le facteur de transcription NE-KB. Cette cascade de signalisation résulte en l’expression de cytokines proinflammatoires et d’interféron. Dans l’étude présentée ici, nous avons exploré le rôle du TLR3 dans l’induction de l’IL-15 par le RSV dans la lignée monocytaire THP-1. II a été démontré que les cellules THP-1 expriment le TLR3 et répondent à sa stimulation. Notre hypothèse
était que le RSV induit l’expression d’IL-15 à travers la voie du TLR3 en activant les protéines TRIE et TRAF6 et le facteur de transcription NF-KB. A cette fin, les cellules THP-1 ont été transfectées ou non par différents siRNA ciblant IeTLR3, TRIE, MyD88 et TRAF6 pendant 2 jours et après infectées par le RSV ou le mock pendant 7h. Ensuite l’ARNm a été isolé et le taux d’expression du messager IL-15 a été quantifié par RT-PCR. Nous avons remarqué une nette diminution d’expression du gène d’IL 15 dans les cellules transfectées et infectées par le RSV comparativement aux cellules témoins non transfectées. Nous avons confirmé la faible expression (knock down) des protéines ciblées par les ARN d’interférences par Western Blot. La contribution de NE-KB dans ce mécanisme d’expression d’IL-15 a été évaluée par Western blot. Nos résultats démontrent que les protéines TLR3, TRIE et TRAE6 sont impliquées dans la voie de signalisation de l’lL-15 par le RSV dans la lignée THP-1 et
V
que la protéine adaptatrice MyD88 généralement utilisée par les différents TLR n’est pas impliquée. Nous avons aussi montré l’implication de NF-KB dans cette induction.
Cette étude permet de mieux comprendre les voies de signalisation induites par deux virus différents et de mieux cerner la réponse enclenchée par le système immunitaire inné en réponse à ce type d’infection. Cette étude a permis de confirmer la contribution du TLR3 dans la réponse immunitaire antivirale. Elle permettra également de cibler les cytokines pro-inflammatoires impliquées en réponse innée, dans le but de développer une approche immuno-thérapeutique dans le traitement des pathologies associées au RSV ou au HSV-1.
Mots clés: VRS, HSV-1, IL-15, monocytes, PKC, PTK, TLR3, TRIE, TRAF6, NF-KB, signalisation.
VI
Abstract
Respiratory syncytial virus (RSV) is a single-stranded negative sense RNA virus, member of the Paramyxoviridae family. It is the primary cause of hospitalisation in the first year 0f life for infants in most parts of the world. In vitro and in vivo studies demonstrated that RSV is a powerful inducer of pro-inflammatory cytokines. One of these is interleukin-15 (IL-15), an important anti-viral cytokine. Herpes simplex vitus 1 (HSV-1) is a double-stranded DNA virus, member of the Herpesviridae family. It is the most common cause of fatal sporadic vital encephalitis in North America. In vitro and in vivo studies demonstrated that HSV-1 induces type I interferon and IL-15 expression in infected celis and mice. IL-15 plays an important role in NK and T ceil development and differentiation; it activates their proliferation, their cytotoxicity and their cytokine and chemokine production. IL-15 also regulates NK cell/macrophage interaction and promotes regulation of monocytes/macrophages and granulocytes. Previous studies from our Iaboratory have demonstrated that different viruses
upregulated IL-15 gene expression in human PBMCs. Out tecent results
demonstrated that RSV and HSV-1 also induces the expression of IL-15 mRNA in the monocytic celI une THP-1. Signalling pathway involved in such virus-induced up regulatïon 0f IL-15 has not yet been identified. Here, we report a study with RSV- and HSV-1-treated THP-1 celis describing this mechanism. Dur hypothesis was that RSV and HSV-1 induced the expression of IL-15 in THP-1 ceils through the involvement of the serine/threonine kinase and/or the tyrosine kinase pathway, kinases usually known to be involved in these viral infections. Using RT-PCR, we demonstrate here for the first Urne that RSV and HSV-1 induce the expression of IL-15 mRNA in THP-1 celis, and show that this induction involves the phosphorylation of PKC a/Ç3 by RSV, and the phosphorylation of PKC and tyrosine kinase by HSV-1. Further, inhibition 0f these kinases by different specific inhibitors was found to prevent the RSV- and HSV 1-induced up-regulation of IL-15. Since previous studies had described the important role of the nuclear transcription factor NF-KB in the regulation of IL-15 transcription, we then examined the role of NF-KB in the transactivation of the IL-15 gene by RSV and HSV-1-infected THP-1 cells. We show by electrophoretic mobility shift assay that the activated forrn of NF-kB binds to the IL-15 prornoter sequence. We then confirm
VII
by an ELISA assay the involvement cf NE-KB fl the transcription cf IL-15 in RSV- and
HSV-1-infected THP-1 ceNs.
Furthermore, it has been clearly assumed that the innate immune Toil-like Receptor
(TLR) 3 plays a fundamental role in the recognition cf double stranded RNA virus and contributes in host response to viral infection. Ptevious studies have reported that RSV enhances the expression cf the TLR3, which mediates inflammatory cytokine and chemokine production in RSV-infected epithelial ceils. In our study, we sought to investigate whether TLR3 is involved in mediating the RSV-induced IL-15 gene expression in monocytic celis. We present data showing that targeting the expression of TLR3 with specific small interfering RNA (5iRNA) reduces the IL-15 mRNA expression in RSV-treated celis. In addition, transfection cf THP-1 celis with sIRNA
targeted to TRIF and TRAF6 also decreases RSV-upregulated IL-15 mRNA
comparatively with control 5IRNA and non-transfected celis. It is known that TRAF6 activates IKK which phosphorylates 1KB, causing its degradation and the subsequent release cf NF-KB. We then examined the phosphorylation cf 1KB kinase and the activation of N F-KB in RSV infected cells and found that RSV induces the activation cf NF-KB. We also examined the role cf MyD88 in RSV-induced IL-15 expression and found that MyD88 is flot involved. These resuits demonstrate that RSV activates the inflammatory cytokine IL-15 expression through TLR3-mediated pathway and that adapter protein MyD88 is net involved in this mechanism.
These studies provide new insights into the signaling mechanism activated by a single-stranded RNA virus, RSV and a double-stranded DNA virus, HSV-1 and allow a better understanding of the cascade cf events mediated by different receptors including TLR3, via which the innate immune system may respond to different viral infections.
Keywords: RSV, HSV-1, IL-15, monocytes, PKC, PTK, TLR3, TRIF, TRAF6, NE-KB, signaling.
VIII
Table des Matières
Titre de la thèse .1
Identification du Jury Il
Résumé lii
Abstract VI
Table des matières VIII
Liste des tableaux Xl
Liste des figures XII
Liste des abréviations XIV
Remerciements XVI
CHAPITRE I: INTRODUCTION
J
1- Le virus respiratoire syncytial (RSV)
2
l-l)
Structure
2
1-2)
Réplication
4
1-3)
La réponse immunitaire
4
1-4)
La pathogénèse
8
1-5)
Le traitement
10
2- Le vïrus herpès simplex f (HSV-1)
10
2-1)
Structure
10
2-2)
Réplication
112-3)
La réponse immunitaire
122-4)
La pathogénèse
14
3- L’interleukïne 15
15
Ix
3-2)
Expression physiologique de l’IL-15
.18
3-3)
Régulation de l’expression du gène de l’IL-15
19
3-4)
L’IL-15 et les cellules immunitaires
20
3-4-1) Les cellules NK
3-4-2) Le tôle de ‘IL-15 dans les fonctions des cellules T et B
3-4-3)La régulation des monocytes/macrophages et des granulocytes par l’lL 15
3-4-4) Le tôle de l’IL-15 dans le développement, l’homéostasie et l’activation des cellules T dendtitiques épidermiques TCRyÔ, les cellules intraépithéliales intestinales et les cellules NK-T
3-5)
L’IL-15 et les cellules non immunitaires
26
3-6)
L’IL-15 et les maladies humaines
27
3-6-1) Le rôle de I’IL-15 dans l’immunité anti-infectieuse
3-6-2) Le rôle de l’IL-15 dans les maladies auto-immunes et inflammatoires 3-6-3) L’IL-15 et le cancer 3-7) Conclusion 31
4- La lignée monocytaire THP-1
33
5- Projet de recherche
34
5-1)Articlel
34
5-2) Article 2
355-3) Article 3
36
CHAPITRE II: ARTICLE I
39
X
CHAPITRE IV: DISCUSSION
...98
CHAPITRE V: CONCLUSION ET PERSPECTIVES
110
CHAPITRE VI: BIBLIOGAPHIE
112
LISTE DES TABLEAUX
Tableau 1 : Le rôle joué par I’IL-15 dans les fonctions des différentes sous populations des cellules du système immunitaire.
Tableau 2: Le rôle joué par l’IL-15 dans différentes infections.
XII LISTE DES FIGURES
1) Introduction
Figure 1: Structure du virus respiratoire syncytial
Figure 2: La fixation du VRS et la réponse immunitaire engendrée
Figure 3: Les cellules immunitaires impliquées dans la réponse anti-VRS Figure 4: Structure du virus herpès simplex type I
Figure 5: La structure de I’ARNm et de la protéine de l’IL-15 humain
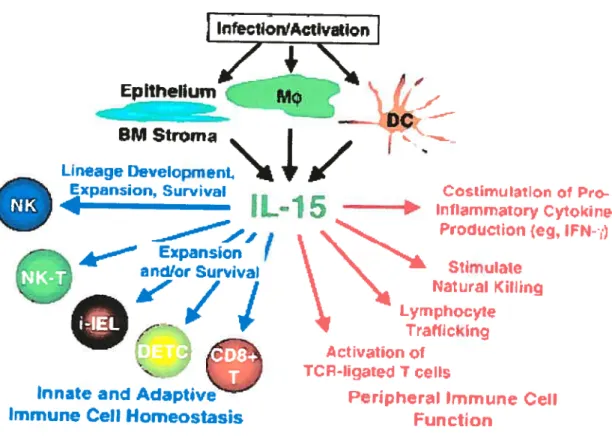
Figure 6: L’IL-15 est une cytokine pleiotropique agissant au niveau de plusieurs cellules immunitaires
Figure 7 s Différenciation des cellules souches hématopoïétiques
2) Article I
Figure 1: Time course of RSV- induced IL-15 mRNA in THP-1 celis Figure 2: U.V- and heat-inactivated RSV induced IL-15 mRNA
Figure 3: Inhibition of Serine/Threonine Kinases reduces RSV induction of IL-15 expression
Figure 4: RSV induces the phosphorylation of PKC
Figure 5: Effect of RSV treatment on DNA-binding activity of NE-KB
Figure 6: Effect of RSV and treatments with PKC inhibitors on NF-KB unit p65 activation
3) Article II
Figure lA: HSV-1-induced upregulation of IL-15 expression in THP-1 cells Figure 1 B: FACS analysis of surface expression of IL-15
Figure 1C: IL-15 mRNA expression in human monocytes and CD3+ T cells
Figure 2A: HSV-1 dose-dependent expression of IL-15
XIII Figure 3A: Effect of PTK inhibitots on HSV-1-induced IL-15 mRNA
Figure 3B: Effect of PTK inhibitors on HSV-1-induced IL-15 protein Figure 3C: HSV-1 induces the phosphorylation of tyrosine kinases
Figure 3D: Effect cf PTK inhibitors on HSV-1-induced phosphorylation cf tyrosine kinases
Figure 4A: Effect of PKC inhibitors on HSV-1-induced IL-15 mRNA Figure 4B: Effect of PKC inhibitors on HSV-1-induced IL-15 protein Figure 4C: Kinetic of HSV-1-induced PKC phosphorylation
Figure 4D: Effect cf PKC inhibitors on HSV-1-induced PKC 1R. phosphorylation Figure 4E: Effect of PKC inhibitors on HSV-1-induced phosphorylation cf tyrosine
kinases
Figure 5A: Effect of combined PKC and PTK inhibitors on HSV-1-induced IL-15 mRNA
Figure 5B: Effectofcombined PKC and PTK inhibitors on HSV-1-induced IL-15 protein
Figure 5C: Effect of PTK inhibitors on HSV-1-induced PKC Ç/. phosphorylation Figure 6 : HSV-l induced NE-kB activation can be inhibited by PTK and PKC
inhibitors
4) Article III
Figure 1: Treatment of THP-1 celis by TLR3 sIRNA reduced RSV-induced IL-15 Figure 2: Treatrnent cf THP-1 celis by TRIE siRNA reduced RSV-induced IL-15 Figure 3: Treatment ofTHP-1 celis byTRAF6 siRNA reduced RSV-induced IL-15 Figure 4: Treatment of THP-1 cells by TRAF6 siRNA teduced RSV
phosphcrylation and degradation of 1KB
Figure 5: Treatment of THP-1 celis by TRAF6 siRNA reduced RSV-induced NF
KB activation
Figure 6: RSV-induced IL-15 expression does not involve MyD88 protein
XIV LISTE DES ABRÉVIATIONS
Ag: antigène Ac: anticorps
AIL: Aduit T-ceII Leukemia CD: crohn disease
CMH: complexe majeur d’histocompatibilité DC: dendritic cells
DETC: dendritic epidermal 1CR yô T ceils UsRNA: double-stranded RNA
HHV-6: human herpes virus 6 HCV: hepatitis C virus
HRP: horse radish peroxydase HSV-1: herpes simplex virus-1
HTLV-1: human T-ceII leukemia virus 1 IBD: inflammatory bowel disease IFN: interferon
1g: immunoglobuline
i-IEL: intestinal intraepithelial lymphocytes IL-15: interleukine-15
i-NOS: inducible nitric oxide synthase IRE: interferon regulatoryfactor JAK: janus kinase
LSP: long signal peptide NF-KB: nucléal factor KB
NK: natural killer
N K-T: natu rai kilier-T celi
PBMC: peripheral blood mononuclear celis PKC: protein kinase C
PTK: protein tyrosine kinase RA: rheumatoid arthritis
xv
RSV: respiratory syncytial virusROS: reactive oxygen species s1RNA: small interference RNA
SIDA: syndrome d’immunodéficience acquise SSP: short signal peptide
STAT: signal transducer and activator of transcription STK: serine threonine kinase
TAK: TGF-3 associated kinase TBK: Tank-binding kinase TCR: T celi receptor 1h: T helper
TIR: TolI/IL-1 Receptor TLR: toli like receptor
TNF: tumour necrosis factor
TRAF: TNF receptor-associated factor
TRIF: ToIl/IL-1 Receptor domain-containing adaptor Inducing IFN-VIH: virus d’immunodéficience humaine
xv’
REMERCIEMENTSTout d’abord j’aimerais remercier mon directeur de recherche le Dr José Menezes de m’avoir accueillie dans son laboratoire.
J’aimerais sincèrement remercier mes collègues de laboratoire Paulo, Rkia, Emily et Annie de m’avoir supportée, soutenue et encouragée jusqu’au jour du dépôt de ma thèse. J’aimerais aussi les remercier pour leur disponibilité, les bonnes conversations scientifiques et la bonne ambiance de travail. Je tiens à remercier particulièrement Paulo pour le support technique et les explications intéressantes. Rkia d’avoir corrigé et révisé mon manuscrit sur la signalisation de ‘IL-15 par le RSV. Emily pour les corrections portées à mon introduction de thèse.
Un grand merci aux membres du centre de recherche, plus particulièrement Madame Pauline Bareffe, le Dr Emile Lévy, Sylvie Cossette et le Dr Alain Moreau pour le financement qui m’ont accordée de la fondation de l’hôpital Sainte-Justine et de la thématique de l’axe d’immunologie-virologie. Cette aide financière m’a été d’un grand soutien pour finit les derniers mois de mon doctorat.
J’aimerais aussi remercier les membres de ma famille, ainsi que mon copain Antoine pour son soutien moral et financier, les repas prêts à mon retour du laboratoire et ses encouragements incessants.
Enfin, j’aimerais remercier toute personne qui a contribué de loin ou de près à l’aboutissement de ce travail malgré tous les obstacles rencontrés lors de ces cinq années de doctorat. Un projet de doctorat est le travail d’une équipe même si tout le mérite va à une personne. Je n’oublierai jamais la contribution de chaque membre dans la réalisation de ce projet.
I
1-Le Virus Respiratoire Syncytial (VRS)
Le VRS fut découvert en 1956 chez un groupe de chimpanzés ayant développé un
rhume dans une banlieue de Washington, DC (USA). Morris et ses collègues ont ainsi isolé un agent cytopathique à partir d’un des chimpanzés qui avait plusieurs symptômes respiratoires. Ils ont nommé cet agent infectieux l’agent causant le coryza chez les chimpanzés (CAA) (31). Par la suite, ils se sont rendus compte que tous les chimpanzés étaient infectés. Ils ont remarqué également que les humains au contact avec les animaux avaient aussi développé des infections respiratoires, mais moins sévères que celles développés par les chimpanzés. Des études ultérieures ont identifié deux souches majeures isolées à partir de patients se présentant avec des symptômes respiratoires. La souche Long, communément utilisée en laboratoire et la souche Schneider (44, 45). A partir d’observations faites sur l’effet cytopathique causé par les différentes souches en culture de tissus et les similitudes entre ces dernières, Chanock et ses collègues ont choisi le nom virus respiratoire syncytial (VRS) pour englober tous les isolats. Ils ont aussi fourni une description classique de la pathologie observée chez les enfants (44, 45). Quelques temps plus tard, Beem et ses collègues ont décrit en détails l’épidémiologie de l’infection à VRS (22).
1-J) Structure
Le VRS est doté d’une structure ribonucléoprotéique interne, la nucléocapside
hélicoidale: tube creux flexible et embobiné, d’environ 1000 nm de long, 12 à 17 nm de diamètre externe et 5 nm de diamètre interne, formé par l’encapsidation du filament d’ARN sur toute sa longueur, par plusieurs milliers d’unités de la même protéine virale. A l’extérieur, le VRS est formé d’une enveloppe lipoprotéique, consistant en un double feuillet lipidique dont la surface est couverte de fins spicules glycoprotéiques. Le génome contenant 15 222 nucléotides, est un ARN simple brin de polarité négative, non segmenté. Il fait partie de la famille des Paramyxoviridae, du genre Pneumovirus (173). Le génome du VRS code pour dix protéines. Parmi celles-ci, huit sont présentes dans le virion et dans les cellules infectées et sont donc structurales (Figure 1). Les glycoprotéines F (protéine de fusion) et G (protéine
3
d’attachement) sont des protéines d’enveloppe, présentes à la surface du virus. Elles sont des déterminants antigéniques majeures, capables d’induire une immunité humorale protectrice. Les glycoprotéines F et G ont plusieurs sites antigéniques distincts. La petite protéine hydrophobique (SH), la protéine de matnce (M) et la protéine (M2) sont associées à l’enveloppe virale. La nucléoprotéine (N), la phosphoprotéine (P) et la large protéine (L) sont présentes au niveau de la nucléocapside. Les protéines non structurales (NSI) et (NS2) sont présentes
seulement dans les cellules infectées (173).
F (fusion) protem
M (mtrix) protem
Fig.1. Structure du virus respiratoire syncytial(tiré de Hacking D,etal. ,2002. Jou. of Infection)
Le VRS présente un mïnimum d’hétérogénéité génétique. Cependant, deux groupes antigéniques majeures A et B ont été identifiés avec des différences au niveau des protéines G, F, N et P. La protéine G est la plus variable avec seulement 53%
G (attacliment) protem Negative strand RNA genome
4 d’homologie de séquences d’acides aminés entre les protéines des groupes A et B, 20% d’homologie entre des protéines du sous-groupe A et 9% entre les protéines du sous-groupe B. Par contre, les protéines F et N ont un haut degré d’homologie entre les deux groupes (154).
1-2) La réplication
Le virus s’attache à la cellule hôte via la protéine G. Cette protéine a une homologie
de structure avec la chimiokine nommée fractalkine CX3C, ce qui permet ainsi à la protéine G de se fixer sur le récepteur CX3CR présent sur la cellule hôte (198). L’enveloppe du virus fusionne avec la membrane plasmique de la cellule hôte grâce à
la protéine F qui se fixe sur le récepteur TOLL, TLR4 et sur le CD14 présent à la
surface des monocytes (113). Après la pénétration, la nucléocapside est libérée dans
le cytoplasme cellulaire où la réplication prend forme. L’ARN vital sert de matrice pour l’ARN messager (ARNm). Ce dernier sert de matrice pour la traduction des protéines
virales, tandis que l’ARN complémentaire sert de matrice pour la transcription de l’ARN des virions. Les antigènes viraux peuvent être détectés à partir de 9h de culture cellulaire et les virus infectieux à partir de 11 à 13h. Le VRS humain se réplique chez plusieurs espèces animales dont la souris, le rat, le cobaye, le furet et
le chimpanzé (173).
1-3) La réponse immunitaire
L’infection virale à VRS suscite une réponse immunitaire exacerbée due à l’infiltration
de plusieurs cellules inflammatoires secrétant différents médiateurs chimiques (110). Tout d’abord, la fixation de la glycoprotéine de surface G sur le récepteur CX3CR comme annoncé auparavant, induit la chimiotaxie de toutes les cellules qui portent ce récepteur à leur surface ou les cellules qui répondent habituellement au CX3CL. La glycoprotéine de surface F, en se fixant sur le récepteur TLR4, augmente l’expression membranaire de ce dernier. Ainsi, elle sensibilise les cellules épithéliales des voies aériennes aux endotoxines qui se fixent habituellement sur ce récepteur pour envahir la cellule hôte. Cette fusion avec le TLR4 entraîne du côté cellulaire, une cascade de
5
signalisatïon, qui aboutit à la translocation du facteur de transcription nucléaire kB (NF KB) (82) au noyau et ainsi à son activation. Une fois, NF-KB au noyau, il transactive plusieurs médiateurs inflammatoires dont le TNF-a, IL-6, IL-8 (62), IL-11, IL-1, MIP-la,
Rantes et IL-15 (81). Également, le VRS active la voie de STAT à travers les
intermédiaires réactifs oxygénés (ROS) (122) ce qui mène à la libération des médiateurs inflammatoires dont le TNF et I’INF-a/f3. Ces évènements qui suivent l’entrée du virus sont prééminents non seulement dans la détermination de la balance entre sa multiplication et son élimination mais aussi dans l’induction de la réponse immunitaire innée et acquise comme le résume la figure 2.
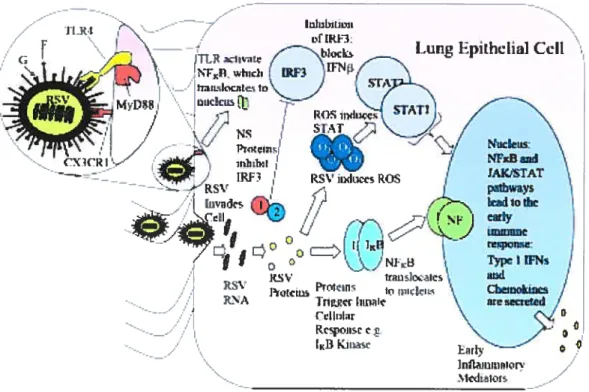
—---_.. - tihibiiitii “S’ flirt f .. 1 G -Lun Epibelial Cdl N. \ inc]i I tRH 1tFN11 I \... iiicsiciiIn’\ / Ii \ Ros,.ITdT4T1 I f1çRIl- / -id
lRF KSV itdicROS i’ lA.TAt
—— ? RV j I vi&s .4 kd10dc • f’Ll ‘‘%b
/
-.,—. r; ‘i j , &J %5 11flff3UnC 55 1 j JfÇflg
f
C o J ‘j LFNs / . 1(5V ItdU’liXlks Prnwpç j ,,‘ R::’. -JTII’•rf’rr-ir ftt!f!1h!d / CefliiIw I w’iice “ / i11 FIfiV5 O ]nflinrtiior — _‘k’.hIutFig. 2. La fixation du VRS et la réponse cellulaire engendrée. Le VRS se fixe par les glycosaminoglycannes présentssur la surfacecellulaire. La protéine F se fixe sur le TLR4 tandis que la protéine G se fixe sur le récepteur de la ftactalkine CX3CR1. L’interaction de F avec TLR4 active NF-KB via la protéine adaptatrice MyD88. Également le VRS active NF-KB via 1KB et STAT1 et 3 àtravers les espèces oxygénées (ROS). L’ARN du VRS active la protéine kinase R et les protéines NS1 et NS2 inhibent la voie du interferon response factor (IRF3). (Tiré de Openshaw PJM, et aI., 2005. Clin. Microb. Rev)
6 Les cellules NK et les neutrophiles sont recrutées durant les trois premiers jours qui suivent l’infection (200). Les cellules NK produites précocement, est une source abondante d’IFN-y qui stimule la prolifération des cellules T. En parallèle, les cellules dendritiques portent les antigènes viraux aux ganglions lymphatiques locaux et les présentent aux lymphocytes T CD4 . Une fois ces cellules activées, elles migrent au site infectieux où elles libèrent d’autres médiateurs inflammatoires et recrutent plusieurs cellules immunitaires telles que les lymphocytes TCD8, les lymphocytes B et les granulocytes incluant les neutrophiles et les éosinophiles. Ainsi, le VRS induit une réponse immunitaire innée qui influence le développement d’une réponse acquise. L’lL-12 produite par les cellules présentatrices d’antigènes, stimule les cellules NK, qui à leur tour sécrètent l’IFN-y (94). Cette cascade de réactions engendrées suite à l’infection des voies respiratoires par le VRS est schématisée sur la figure 2 (159).
7
B ciIl
Fig. 3. Les cellules immunitaires impliquées dans la réponse anti-VRS. L’infection cellulaire provoque la
libération des médiateurs inflammatoires précoces tels que le TNF et les interférons o et. Lescellules NK etles
PMN sont recwtées pendant les 3 premiers jours de l’infection. En parallèle, les cellules dendntiques (DC) transportent les antigènes viraux vers les ganglions lymphatiques et les présentent aux cellules TCD4. Ces
cellules s’activent et migrent au site infectieux ou elles libèrent davantage de médiateurs et recrutent d’autres cellules inflammatoires, incluant les lymphocytes TCD8, les lymphocytes B et les granulocytes. (Tiré de Openshaw PJM, et aL. 2005. Clin. Microb. Rev.)
Le VRS enclenche une forte réponse inflammatoire à travers l’induction de l’expression de plusieurs chimiokines (110) dont CCL5 (Rantes) et l’IL-8. L’IL-8, secrétée par les cellules épithéliales est un chimioaftractant pour les neutrophiles ce qui cause une bronchiolite sévère (73) et une neutrophilie pulmonaire (181). Le CCL5 est d’un intérêt particulier car il est produit par plusieurs cellules dont les cellules épithéliales, en réponse à différents stimuli tels que l’INF-y, l’lL-la, l’ll-113 et le TNF. A des stades tardifs d’infection, le CCL5 est produit aussi par les cellules infiltrantes comme les cellules T y. Le CCL5 recrute sélectivement les monocytes, les lymphocytes T mémoires et les éosinophiles et en grandes concentrations, il peut activer les lymphocytes T. Le traitement des cellules Hep-2 avec la CCL5
Kl1 ml&ied ç g L2 Jc• ([-a. [2 4.,__ UU. I feU: fi.’. RSV
e
g ]?FÇCij Sbrrrpha {tLtL t3p L 1E 1X -PC o tCD$t, tt»(6 TcdiINNATE
DAY I-3
ACQt]1RED
DAY 44
DAY 79
$
recombinante inhibe l’infection par le VRS
in vitro
(56). La réponse des cellules Tauxiliaires (Thi et Th2) a aussi été évaluée dans les voies aériennes de personnes avec une infection à VRS. Les cellules Thi secrètent des cytokines de type 1(IL-2,
IFN-y). Les cellules Th2 secrètent des cytokines de type 2 (IL-4, IL-5, IL-6 et IL-13).
L’IL-4 et l’IL-5 favorisent la production d’IgE et I’éosinophilie (158). Les cytokines de type 2 induisent aussi la dégranulation des mastocytes et la libération des leukotriènes et des prostaglandines, contribuant donc à l’inflammation des voies aériennes. L’IL-9 est produite majoritairement pat les neutrophiles au niveau des poumons d’enfants présentant une bronchiolite à VRS (138). L’IL-9 est aussi associée à une réponse Th2 et au développement de l’asthme (152).
En termes d’immunité humorale, l’infection à VRS entraîne le développement d’IgM, d’lgG et d’lgA sériques et mucosaux. La primo-infection induit une réponse lgM dans
les 5 à 10 jours suivant l’infection, dépendamment de l’âge du patient. Une réponse IgM faible a même été constatée chez des patients âgés de moins de 6 mois. Les
lgM persistent en moyenne 1 à 3 mois dans le sang. Cependant, des études ont
trouvé la présence d’IgM une année après l’infection (173). Une réponse lgG spécifique peut être détectée chez la plupart des patients. Elle atteint son maximum 20 à 30 jours après le début des symptômes. Également, une faible réponse chez les enfants en bas âge a été rapportée. Un an après la primo-infection, on décèle une baisse dans le taux d’IgG, mais lors d’une réinfection, nous pouvons noter une réponse importante dans les 5 à 7 jours (204). Les IgA sériques apparaissent quelques jours plus tard, après les lgM et lgG. Les IgA peuvent être sous forme libre ou liée aux cellules dans les secrétions nasopharyngiques. La réponse des IgA nasopharyngiques est très importante chez les bébés ayant plus que 6 mois. Les 19E ont aussi été détectés dans les secrétions nasales (204).
1-4) La pathogenèse
En 2002, l’organisation mondiale de la santé tOMS) a estimé à 18.3 millions, le
9
respiratoires. 95 pour cent de ces infections sont des infections des voies aériennes inférieures (L’OMS, The world health report 2004, Genève, Suisse). Le VRS est la cause la plus courante de ces infections, telle que la bronchiolite et la pneumonie. Les chiffres annuels d’infection et de mortalité relatifs au VRS dans le monde sont estimés à 64 millions et 160 000, respectivement (173). Les populations considérées comme les plus exposées au risque de contracter une maladie liée au VRS sont les enfants nés avant terme et les enfants souffrant d’une cardiopathie congénitale hémodynamiquement significative. Chez la plupart des enfants, le VRS cause des symptômes semblables à ceux du rhume: congestion et écoulement nasale, toux, otite, faible fièvre et mal de gorge (159). Le VRS disparaît habituellement du corps
par lui-même, sans nécessiter de visite à l’hôpital ni de traitement médical spécifique. Ses symptômes peuvent durer U’ une à deux semaines. Chez les enfants plus âgés et les adultes, l’incubation est en moyenne de 5 jours (extrêmes : 2-8 jours) et la durée du portage est de 2 à 3 jours, pouvant atteindre 4 semaines chez le jeune enfant (80). Les symptômes sont généralement bénins (159).
Les cellules cibles du VRS sont les cellules épithéliales. La bronchiolite à VRS résulte de l’obstruction de la lumière des bronchioles, liée à l’hyperplasie réactionnelle de la muqueuse et à la nécrose d’origine virale de l’épithélium, à I’hypersécrétion de mucus, à l’infiltration bronchiolaire de cellules inflammatoires, et surtout à la libération de médiateurs chimiques à effet bronchoconstricteur (157).
La transmission se fait par inoculation de grosses gouttelettes de salive dans les yeux
ou le nez, lors de contacts rapprochés avec un sujet infecté ou par auto-inoculation manuelle vers les muqueuses oculaires et nasales à partir de surfaces contaminées.
La transmission par voie aérienne à partir de fines particules d’aérosols est un mode
mineur de contamination (80). Le VRS persiste de façon prolongée dans l’environnement : il peut persister 6 heures sur des surfaces contaminées, 90 minutes sur des gants, 30 à 45 minutes sur du papier, et 20 minutes sur la peau (80). En institution, la dissémination nosocomiale est fréquente. Il est vraisemblable que le personnel soignant joue un rôle central dans l’introduction et la diffusion du virus.
10
1-5) Traitement
Le Synagis(r) (palivizumab) est un Ac monoclonal IgGi administré intra musculairement, mensuellement. li se fixe de façon sélective sut la glycoprotéine de surface F et inhibe spécifiquement la réplication du RSV en empêchant la fusion du virus avec la membrane de la cellule endothéliale respiratoire. Les études cliniques ont démontré que Synagis a réduit de 55% le taux d’hospitalisation des enfants à risque (116). Actuellement, Synagis est le médicament de référence dans la prévention du VRS. Il a été homologué en 1999 en Europe et en 1998 aux États-Unis. Récemment, l’utilisation de ce médicament a été officiellement étendue aux enfants de moins de deux ans souffrant d’une cardiopathie congénitale en Europe (octobre 2003) mais également aux États-Unis (septembre 2003).
2- Le virus herpes simplex I (HSV-I):
2-1) Structure
Virus appartenant à la famille des herpesviridae, enveloppé, avec un génome très
grand et complexe, caractérisé par un ADN double brin linéaire. Le virus est constitué de 4 éléments. De l’intérieur vers l’extérieur on trouve le core qui contient l’acide
nucléique, une capside icosaédrique faisant à peu prés 100 nm, un tégument entourant la capside et l’enveloppe (Figure 4). Le génome viral a un poids moléculaire de 150 Kb, et code pour plus de 70 polypeptides. Peu de choses sont connues concernant ces protéines. La capside est formée de 162 capsomères et elle est entourée du tégument. L’enveloppe est constituée de 10 glycoprotéines (gB, gC, gO,
gE, gG, gH, I, gK, gL, gM), de lipides et de polyamines (182). Les glycoprotéines gB,
gC et gD, permettent l’attachement du virus aux récepteurs présents sur la cellule hôte et la fusion des membranes virale et cellulaire (38, 87, 88, 171). Les glycoprotéines de l’enveloppe suscitent aussi la réponse de l’hôte et ont un effet immunomodulateur(12, 128, 129, 161, 182).
11
Lp:d erwclop.
2-2) La réplication
Pour initïer l’infection, le virus doit s’attacher aux récepteurs à la surface de la cellule hôte. Un des récepteurs de l’HSV-l est l’héparane sulfate (183). La déletion de l’héparane sulfate de la surface des cellules ou l’utilisation de cellules mutées déficientes pour la synthèse de l’héparane sulfate réduit l’attachement et ainsi l’infection à 85% (180, 208). Ceci démontre que rhépacane sulfate est un récepteur majeur de l’HSV-l. Une fois l’attachement fait, le virus fusionne son enveloppe avec la membrane plasmique de l’hôte, et la capside nue se trouve transportée vers les pores nucléaires. L’ADN est ainsi libéré dans le noyau de la cellule où la transcription, la réplication et l’assemblage se produisent.
La transcription de l’ADN est caracténsée par l’expression de 3 classes de gènes: alpha, bêta et gamma, qu’on appelle respectivement pré-précoces, précoces et tardifs. Ces gènes sont exprimés d’une façon contrôlée et régulée. Les gènes alpha
Fig. 4. Structure du virus herpès simplex type I (Tiré du site web:
12 sont responsables de l’initiation de l’infection. Les cinq gènes alpha sont transcrits dans les cellules infectées en absence de la synthèse de protéines virales. Les gènes bêta codent pour les enzymes nécessaires à la réplication virale telle la thymidine kinase. L’expression des gènes bêta dépend de l’expression fonctionnelle des gènes alpha. Une fois les gènes beta exprimés les gènes alpha arrêtent leurs expressions et
la synthèse protéique cellulaire s’arrête également. Les gènes gamma sont impliqués
dans la synthèse des protéines structurales. Leur expression qui est lente et qui nécessite la synthèse de l’ADN viral, dépend des gènes bêta. L’assemblage des virus se fait dans le noyau, avec l’acquisition de l’enveloppe. La capside bourgeonne avec la membrane nucléaire, et le virus complet est transporté à travers le cytoplasme vers la membrane plasmique, où la libération de particules virales a lieu (205).
2-3) La réponse immunitaire de l’hôte
La pathogénicité de l’infection à HSV-1 dépend de la réponse immunitaire non
spécifique et spécifique de l’hôte, se traduisant par la participation des macrophages, des neutrophiles, des cellules NK, des sous populations spécifiques de cellules T, des anticorps spécifiques et des cytokines. La réponse immunitaire de l’hôte peut influencer l’établissement de la maladie, la sévérité de l’infection, et la résistance de
l’hôte au maintien et à la réactivation du virus (205).
L’immunité innée joue un rôle crucial et déterminant dans la défense antivirale. Dans le cas d’infection herpétique, elle se manifeste particulièrement par l’expression des
interférons tIEN). Le complexe interféron inhibe la réplication virale, protège les cellules voisines d’une infection secondaire, et stimule le système immunitaire en activant les cellules NK, les macrophages, les lymphocytes et en sur-exprimant l’expression des molécules du complexe majeure d’histocompatibilité (CMH) (184). L’importance de la réponse IFN dans la susceptibilité face à une infection herpétique
a été remarqué dans des études
in vivo
utilisant l’HSV-l. Des expériences faites sur des souris, ont identifié des souches qui étaient à la fois, résistantes (C57BLJ6) et13
sensibles (BALB/C) à l’infection au HSV-1. H a été remarqué que cette résistance naturelle observée, était due à une production rapide d’IFN. Ce qui avait été confirmé par l’utilisation d’un sérum anti-lFN-a/3 (84, 111, 125, 185). Ces IFN retardent la diffusion du virus du site d’inoculation vers le système nerveux périphérique (83).
La résistance des souris à l’HSV-l corrèle aussi avec la participation des cellules NK
(125, 126, 130). Dans un modèle d’infection oculaire, l’étude faite par Ghiasi H et al.,
a démontré que la déplétion des cellules NK chez des souris C57BL16 résistantes, résulte en une grande mortalité (67). Le fait que les cellules NK et lIEN de type I, ensemble, jouent un rôle fondamental dans la résistance aux infections herpétique,
n’a tien d’étonnant, étant donné que l’IFN de type I joue un rôle essentiel dans
l’activation des cellules NK (25, 27). Également, des souris qui ne possèdent pas de cellules NK et/ou ni de cellules NK-T ou ni l’IL-15, cytokine essentielle pour les fonctions de ces deux types cellulaires, sont significativement (100 fois) plus susceptibles à l’infection au HSV-1 (14). Au fait, les cellules NK et NKJT sont la seule source d’IFN-V après l’infection par le HSV-1, formant ainsi un lien entre l’immunité innée et acquise.
De plus en plus, des études montrent que les infections virales (incluant le HSV) et
l’IFN de type I sont des inducteurs potentiels de l’IL-15 (58, 63). Ces études démontrent aussi que l’lL-15 induite suite à l’infection virale, augmente l’activité cytotoxique des cellules NK (3, 4, 58, 63, 75). Très peu d’études ont examiné si l’IL
15 avait un effet antiviral direct, indépendant des cellules NK et NK-T. Récemment,
Liu g et al. ont rapporté que le traitement des cellules macrophagiques RAW264.7 par l’lL-15 induit l’expression de l’IFN-13, du gène d’oxyde nitrique synthétase inductible (iNOS) et une activité antivirale contre le virus de la vaccine (120). Une autre étude
faite par Ashkar et al. a démontré que le traitement des cellules RAW264.7 par de l’IL-15 mutine, empêche la réplication de virus HSV-2. Également, dans cette même
étude, ils ont démontré que les cellules RAW264.7 traitées pat l’lL-15 expriment le TNF-o et produisent liFN- dans leur surnageant (68). Ces résultats expliquent
l’activité antivirale médiée par l’lL-15. En conclusion, L’IFN de type I, ‘IL-15, les
14 contre l’HSV-l. Les mécanismes de feed-back positifs intensifient ces systèmes et provoquent des lourdes armes antivirales comme les radicaux libres oxygénés (ROS) et l’oxyde nitrique.
La réponse humorale suite à l’infection se traduit par l’apparition transitoire d’IgM
trois semaines post-infection, suivie d’lgG et d’lgA, qui tendent à persister longtemps, mais ne neutralisent pas complètement le virus, et donc ne protègent pas contre la récurrence, ni contre la surinfection exogène (205).
2-4) Le pouvoir pathogène
Le virus HSV-1, à la fois dermotrope et neurotrope, cause des infections d’une
remarquable diversité quant à leurs manifestations cliniques et leur degré de gravité. Virus très lytique dans les cellules épithéliales, il peut être très pathogène. Il cause des infections oculaires qui se manifestent par une kératoconjonctivite, des infections labiales et buccales telle la gingivostomatite, des infections des voies aériennes supérieurs comme la pharyngite, l’œsophagite, la trachéite, la trachéobronchite et des infections génitales (205). L’HSV est souvent latent dans les cellules nerveuses, plus exactement dans le corps cellulaire des neurones sensitifs périphériques innervant le territoire de la primo-infection, où il peut se réactiver et gagner par voie axonale centrifuge la jonction cutanéo-muqueuse pour y donner les vésicules caractéristiques d’herpès labial récurrent (205).
L’HSV-l est impliqué dans 30% des cas d’infections herpétiques néonatales (206).
Une des manifestations les plus sévères de l’herpès type J, est l’encéphalite, habituellement localisée au lobe temporal, volontiers unilatérale, sous forme d’un foyer de nécrose hémorragique. L’encéphalite débute brutalement par de la fièvre et des signes encéphalitiques : des crises convulsives, des troubles du comportement, des paralysies, des troubles de la conscience qui vont s’aggraver jusqu’au coma. La
15
mortalité spontanée est de 50 ¾ et la survie se trouve marquée par des séquelles neurologiques (206).
Chez l’adulte, la transmission peut se faire par contact direct avec les vésicules des lésions cutanéo-muqueuses, contenant les particules virales ou par voie sexuelle concernant l’herpès génital. L’infection du nouveau-né peut survenir de trois manières: intra-utérine, périnatale, et postnatale. Pour les deux premiers modes de transmission, la mère est le réservoir du virus. Cependant, la transmission périnatale,
où il y a contact entre le foetus et les sécrétions génitales maternelles, représente 75 à 80% des cas. La transmission postnatale représente 15 à 20% des cas. La
transmission intra-utérine représente un très faible pourcentage car 30 bébés ont été identifiés dans le monde avec une infection congénitale (205). Dans l’ensemble,
l’HSV-l représente 30% des infections néonatales, dont la majorité sont des
infections post-natales. Cependant, c’est ce type qui cause des manifestations sévères telle l’encéphalite et non pas le type 2 (192).
3- L’ïnterleukine 15 (IL-15)
Depuis la découverte de l’interleukine (IL)-15 en 1994 (76), plusieurs équipes se sont penchées sur le sujet en étudiant la biologie moléculaire et cellulaire de cette cytokine.
L’IL-15 est une protéine de 14-15 kDa (9, 76, 109). Elle ressemble beaucoup à l’IL-2
dans ses propriétés biologiques
in-vitro
(20, 76). Les deux cytokines, partagent lesmêmes sous-unités 13 (CD122) et y(CD132) du récepteur (R) de signalisation
(IL-2IlL-15R13y) (20). Cependant, la spécificité de chaque cytokine est apportée par la chaîne
cx qui est propre à chacune d’elles et ce qui complète ainsi les deux récepteurs à IL
l5Ra13y et lL-2Rcx13y(202). La sous-unité cx du récepteur de l’IL-15, lL-l5Ro, fixe l’lL-15
avec une très grande affinité et transduit un signal intracellulaire (202). En revanche, le lL-2Ra lie l’lL-2 avec une très faible affinité, sans transduction d’un signal subséquent (140, 202).
16
La sous-unité Yc (CD132) du récepteur de l’IL-15 et de l’IL-2 est partagée par les
récepteurs d’autres cytokines (IL-4, IL-7, IL-9 et IL-21) (76). Cette sous-unité est essentielle dans la signalisation à travers les récepteurs de ces différentes cytokines, elle joue un rôle important en ce qui concerne la maturation et le bon fonctionnement des cellules immunitaires. Une mutation au niveau du gène codant la sous-unité Yc entraîne un déficit immunitaire combiné sévère (DICS) ou “SCID” (Severe Combined lmmunodeficiency) (39, 49). Ces malades ont une absence de lymphocytes T et NK matures et une lymphocytose B (39). Le thymus est dépourvu de corpuscules de hassal et la différenciation cortexlmedulla est absente (169). Un phénotype analogue est observé après invalidation du gène Yc chez la souris (48, 50). Le déficit en cellules
T est en grande partie dû à l’absence de récepteur fonctionnel d’IL-7 (153), tandis que le déficit en cellules NK est dû à l’absence de signal induit par l’IL-l 5 (41, 71).
3-1) Biologie moléculaire et cellulaire de l’IL-15
L’IL-15 a été découverte par deux groupes indépendants suite à sa capacité à stimuler la prolifération de la lignée cellulaire T dépendante de l’lL-2, CTLL-2, en présence
d’anticorps anti-IL-2 neutralisant (76). Dans un autre laboratoire, l’activité identifiée dans le surnageant de culture de la lignée cellulaire l-lut-102 infectées par le virus
HTLV-1 (virus causant la leucémie des cellules T) a été purifiée et nommée IL-T (20) (35).
L’IL-15 fait partie de la famille des hématopoïétines comme de nombreuses cytokines
telles que l’-1L2, l’IL-3, l’IL-6, l’IL-7, l’lL-ll, I’IL-13, le GM-CSF et le G-CSF. Toutes ces cytokines ont un haut degré de structure a-hélicoïdale et très peu de structure en feuillet 3. Ces protéines ont en commun un même repliement polypeptidique avec quatre régions a-hélicoïdale (21, 76). Le gène codant pour l’IL-15 fait 34 kb ou plus, il est situé sur la partie q31 du chromosome humain 4 ou sur la région centrale du chromosome murin 8 (9, 109). La structure génomique de l’IL-15 contient 9 exons (7 codants) et 8 introns. Deux isoformes d’ARNm d’IL-15 ont été décrits, un classique avec un signal peptide long (LSP) et un autre alternatif avec un signal peptide court
17
(SSP). Les deux codent pour la même protéine mature qui fait 114 acides aminés (aa)
(59). L’lL-15 est codée entre les exons 5 à 8 comme le montre la figure suivante:
Human IL-15 Gene
(bp i ?5 .1• I 9S L5 137 11 3?
InIrDnPkb
jj.
U-
111
‘JJ
--I
ISP-IL-15 SSP-LL-15
cJssicaI IL--15 mRNA Fsoforms
5’ UTR LSP I.4S ‘LfTR S,irn SP iL-S IUTR
liii
ii I 111111
1
[1f I
Ii1fjuLt
J
4 7 44.A5 7
IL-15 Precursor Proteins
LSP IL-15 SSP IL-15
(4AA 4A:l 21A.) 11AA)
Nf __C NtZZI C nI• Zc
14 4A,5
V
IL-15 Makire Pmein
N FEZ - C
Fig. 5. La structure de I’ARNm et de b protéinede I’IL-15 humain. Le locus d’IL-15 humain est situé sur le
chromosome 4q31 et consiste en 9 exons et 8 introns. Deux isoformes d’ARNm ont été décrits, le classique LSP et
un alternatif SSP, mais les deux codent pour la même protéine mature de Il4aa. ‘Site de début de traduction et. pour codon stop. (Tiré de FehnigerTA,etat Blood, 2001).
Les deux isoformes d’ARNm de l’lL-15 présentent quelques différences concernant la
portion N terminale de leur peptide leader. Ce dernier détermine la localisation
intracellulaire et le potentiel de sécrétion de la protéine associée. Les deux isoformes ont un potentiel de secrétions faible comparativement à VIL-2 (188). Des études ciblant la sécrétion des deux isoformes ont démontré que l’isoforme LSP-lL-15 est associé avec le réticulum endoplasmique et l’appareil de golgi, tandis que l’isoforme SSP-lL-15
18 semble être restreint au noyau et au cytoplasme (65, 114, 188). Le LSP-IL-15 est exprimé au niveau du muscle squelettique, du placenta, du coeur, des poumons, du
foie, du thymus et des teins. Alors que, le SSP-lL-15 est plutôt exprimé au niveau de
l’appendice, des testicules, et aussi du coeur et du thymus (139, 188).
En ce qui concerne les voies de transduction de signal d’activation, I’lL-2 et l’lL-15
empruntent approximativement les mêmes voies étant donné qu’elles partagent les mêmes récepteurs Ces voies renferment les Janus kinase (Jak) et les activateurs de transcription (STAT) (95). L’IL-2/15Rf3 (CD122) est associé avec Jakl et le l’IL
2I15Ry(CD132) est associé avec Jak3, il en résulte une phosphorylation de STAT3 et
STAI5 respectivement une fois l’IL-15 liée à ses récepteurs (119, 142). D’autres voies de signalisations à travers les récepteurs de l’lL-2/IL-15 incluent la tyrosine kinase src,
l’induction de Bd-2 et la voie des Ras/Raf/MAPK (143).
3-2) Expression physiologique de l’IL-15
L’ARNm de l’lL-lS est produit par plusieurs tissus et cellules notamment le placenta, le
muscle squelettique, les reins, les poumons, le coeur, les monocytes/macrophages (43), les cellules présentatrices d’antigènes (Ag) comme les cellules dendritiques (DC)
(30, 99), les cellules stromales primaires de la moelle osseuse (147), l’épithélium
thymique (117) et l’épithélium intestinal fetal, impliquant le rôle de l’IL-15 durant l’hématopoïèse (148). Les cellules épithéliales et fibroblastiques de différents tissus (76), les monocytes/macrophages ainsi que certaines lignées monocytaires expriment aussi la protéine (43, 52). Récemment par des techniques de biologie moléculaire plus sensibles, l’équipe de Waldmann, T.A. a pu démontrer l’expression de l’ARNm de l’lL
19 3-3) Régulation de l’expression du gène de l’IL-15
Trois points de contrôle régulant la traduction de I’ARNm de l’IL-15 en protéine précurseur ont été identifiés. Ces points de contrôle se manifestent au niveau de la traduction, du trafic intracellulaire et de la sécrétion. Il a été démontré que plusieurs codons Start (AUG5) au 5’ UTR, les peptides signaux SSP et LSP inhabituels et un régulateur négatif proche du C terminal de la protéine précurseur, réduisent drastiquement l’efficacité de la traduction. Tout d’abord, le LSP-lLl5 5’UTR est relativement long (plus de 316 nucléotides) et contient 12 AUG en amont du site de début de traduction, ce qui apparemment réduit de façon dramatique l’efficacité de la traduction (18, 76, 108). Tagaya et al. ont démontré qu’en remplaçant le peptide signal endogène de l’IL-15 par celui de l’lL-2, la quantité d’IL-15 détectée dans le surnageant des cellules COS transfectées, augmente de façon remarquable (188). Le LSP-IL-15, qui est repéré au niveau du réticulum endoplasmique et du golgi (voie sécrétoire), a une capacité de traduction moins élevée que celle du SSP-lL-15 repéré au niveau du noyau et du cytoplasme. Il en résulte que le LSP-IL-15 est faiblement traduit mais sécrété, alors que le SSP-IL-15 est bien traduit mais non sécrété (114, 188). Tout cela explique le très faible niveau de la protéine libérée. Également, la bioactivité CTLL du construit LSP-1L15-GFP a été significativement plus élevée que celle du LSP-IL-15 sans le 3’tag. Ceci suggère qu’un signal dans la portion carboxyle terminal de la protéine mature rende la sécrétion inefficace. Ce signal est probablement un signal de rétention (65).
Par l’élimination systématique de ces 3 points de contrôle, c’est-à-dire la suppression en amont des multiples AUGs, le remplacement du peptide leader endogène de l’IL 15 par celui de l’IL-2 et la fusion au C-terminal de la protéine IL-15 avec un « FLAG » épitope, la synthèse bioactive d’IL-15 augmenterait 250 fois (19). Cependant, un tel contrôle si complexe et si rigoureux du produit de gène de l’IL-15, peu commun parmi la plupart des cytokines caractérisées jusqu’à maintenant, est essentiel vu son potentiel proinflammatoire élevé. Ceci indique aussi, qu’une surproduction d’IL-15 pourrait être impliquée dans plusieurs désordres immunitaires. Des souris transgéniques qui sur-expriment l’IL-15 suite à l’élimination des points de contrôle
20
post-transcriptionel susmentionnés, ont fourni récemment la preuve in vivo soutenant cette hypothèse (60). Ces souris ont développé une leucémie lymphocytaire fatale après de premières expansions dans les cellules NK et T CD8 +.
Récemment, Musso et aI. (150) ont détecté l’expression constitutive de la protéine IL-15 active à la surface des lignées cellulaires de monocytes/macrophages et de
monocytes primaires. Cette expression membranaire est augmentée suite à la stimulation avec l’IFN-y, suggérant un mécanisme par lequel IL-15 pourrait manifester un effet biologique. Des études récentes ont démontré, par Western blot et par cytométrie en flux, l’expression constitutive de l’lL-15 dans les PBMCs humains. Cette expression est sur-régulée par Cryptococcus neoformans, le LPS ou l’IFN-y (Neely,
CG et al., communication au congrés de FASEB, 1999, numéro de la présentation
850.5). Au fait, plusieurs cellules expriment l’ARNm de l’IL-15 et le maintiennent inactif au niveau traductionnel. Ainsi ces cellules pourraient répondre rapidement à une attaque intracellulaire ou à un stimuli en transformant l’IL-15 inactif en IL-15 actif pouvant se traduire de façon efficace. La protéine IL-15 produite pourrait activer les cellules T (213) et les cellules NK (41) et fournit ainsi une réponse immunitaire forte et appropriée contre l’agent infectieux.
3-4) LIL-15 et les cellules immunitaires: 3-4-1) Les cellules NK:
Les cellules NK sont des grands lymphocytes granulaires humains issus de la moelle osseuse. Ils expriment les marqueurs CD2, CD16, 0056 ainsi que la chaîne du
récepteur des cellules T, mais n’expriment pas le marqueur CD3 spécifique des lymphocytes T. Les observations suggèrent que I’IL-15 soit importante dans la différentiation, la survie et la fonction de cellules NK. En effet l’lL-15 est essentielle pour leur développement (15, 41-43, 63, 117, 141, 147, 155, 156, 164). Des souris rendus déficientes dans la sous-unité 3 du récepteur de l’IL-2/IL-15 (lL-2/15R) par recombinaison homologue ou à l’aide d’un anticorps neutralisant, deviennent
21
déficientes en cellules NK (186). L’IL-2/15R13 est nécessaire pour les fonctions de I’IL
2 et de l’IL-15, mais il n’est pas utilisé par d’autres facteurs de croissance. En
revanche, les souris déficientes en IL-2 ou IL-2Ra (CD25) (la chaîne spécifique pour
le signal médié par IL-2) ont un nombre normal de cellules NK, suggérant que c’est
bien I’lL-15 et non l’IL-2, qui est nécessaire pour le développement des cellules NK (186). Fait remarquable, les cellules NK sont déficientes autant chez l’homme que chez la souris qui n’expriment pas la chaîne yc normalement utilisée par 2, 4,
IL-7, IL-9, IL-15 et IL-21. Alors que des souris déficientes en IL-2, IL-4 et IL-7 expriment
quand même des cellules NK (39, 50, 112). De même que, des souris déficientes en Jak3, protéine kinase indispensable pour le signal médié par d’IL-15, sont aussi déficientes en cellules NK (131, 172). En conclusion, l’IL-15 est indispensable dans le développement des cellules NK.
Les cellules NK expriment toutes les chaînes du récepteur de I’IL-15 (IL-l5Ra, IL
2I15R3 et yc), ce qui est suffisant pour une réponse à des concentrations picomolaire d’IL-15 (41). L’IL-15 facilite la survie de cellules NK
ex vivo
(41). L’lL-15 est efficacecomme chimioattractant et activateur des cellules NK. De plus, l’IL-15 en synergie avec l’IL-12, stimule la production d’IFN-y, TNF-a et GM-CSF par les cellules NK (43).
La cytotoxicité des cellules NK médiée par l’IL-15 est induite par une variété d’agents
infectieux comme le virus herpes 6 et le virus herpes 7, études effectuées dans notre laboratoire (15, 63). Dans ces études ci, l’augmentation de l’activité NK par ces agents infectieux a été significativement réduite suite à l’administration d’anticorps monoclonaux anti-IL-15, mais pas par des anticorps dirigés contre d’autres cytokines comme IFN-o, IFN-y, TNF-a, TNF-3, IL-12 ou IL-2. De plus, des patients déficients en cellules NK, sont sujets à plusieurs infections herpétiques (26). Ces résultats suggèrent que I’IL-15 sécrétée en réponse aux agents infectieux est responsable de
l’activation observée des cellules NK. Tout ceci, soutient le fait que l’IL-l 5 joue un rôle
-y,
3-4-2) Le rôle de I’IL-f 5 dans les fonctions des cellules T:
L’IL-15 et l’IL-2 ont quelques activités biologiques communes (13, 35, 47, 76, 105,
197, 207). Cependant, l’lL-15 a aussi ses propres fonctions, reflétant la grande distribution de son propre récepteur IL-l5Ra sur plusieurs tissus (72, 190). En outre, dans des cellules telles les mastocytes, ‘IL-15 utilise un deuxième récepteur IL-15RX, différent de celui qu’elle utilise pour les autres cellules et une voie de signalisation différente JAK-2/STAT-5, non partagée avec l’IL-2 (187). Finalement, les différences principales entre l’IL-2 et ‘IL-15 en termes de leurs sites de synthèse et de régulation de leur expression mènent aussi à des différentes fonctions. Par exemple, l’expression d’ARNm d’IL-15 au niveau des thymocytes et des cellules épithéliales ainsi que stromales de la moelle osseuse suggère que ‘IL-15 joue un rôle dans Je développement des lymphocytes T.
L’IL-15 stimule la prolifération des lignées CTLL-2; des cellules CD4-8-, CD4+8+,
CD4+ et CD$÷; et des cellules T épidermiques dendritiques (35, 40, 54, 66, 76, 96, 213). L’IL-15 produite entre autre par les cellules dendritiques, induit l’activation des cellules Thi et leur activité chimiotactique (30, 99). Comme I’IL-2 n’est pas produite par les cellules dendritiques, cette observation suggère que l’IL-15 est impliquée dans des réactions immunitaires fonctionnelles différentes de celles impliquant l’IL-2.
L’IL-15 stimule et augmente la prolifération de cellules T d’individus VIH positifs et de
cellules T dérivées de culture cellulaire de tumeur humaine primaire (118, 162). En outre, I’lL-lS coopère avec IL-12 pour induire la prolifération des clones Th1 murins (179). L’addition de I’lL-15 promeut aussi l’activation de cellules T cytotoxiques effectrices et l’induction de lymphokines activés par les cellules cytotoxiques tueuses.
L’ajout d’IL-15 aux cultures de cellules T induit l’expression d’IL-2Ra (CD25), lL-2R f3
(CD122) et Fas (CD95) tandis que cela sous-régule l’expression du CD27 (33, 195, 196, 211). L’IL-15 est un chimoaffractant pour les cellules T, mais pas pour les cellules B, ni les neutrophiles et monocytes (134, 207). En outre, l’IL-15 stimule les cellules TCD8 ÷ mémoires
in vivo
(213). Finalement, l’IL-15 inhibe l’apoptose induite par la privation d’un facteur de croissance ou une cytokine des cellules T activées.23 Également, l’lL-15 inhibe l’apoptose médiée par un anticorps anti-Fas, pat un anti CD3 ou par le dexamethasone des cellules T et B activées (34).
3-4-3) Le rôle de l’IL-l 5 dans les fonctions des cellules B:
Bien que l’lL-15 n’ait pas d’effet sur les cellules B en repos, elle induit la prolifération
et la synthèse d’immunoglobulines par les cellules B costimulées par la PMA ou pat
un anticorps anti-immunoglobine M (lgM) (13). En outre, l’IL-15, en combinaison avec le CD4O ligand (CD4OL), agit comme inducteur pour la production d’lgM, IgGi et IgA
polyclonaux, mais pas d’lgG4 ou d’IgE (13). L’effet de l’IL-15 sur la sécrétion des lgs peut être modulé, soit par l’IL-lO (sécrétion accrue) ou par l’IL-4 (sécrétion diminuée).
L’action de l’lL-15 sur les cellules T, B et les cellules NK pourrait être bloquée par des
anticorps anti-IL-2/-J 5R3 (76).
3-4-4) La régulation des monocyteslmacrophages et des granulocytes par l’IL 15
Les macrophages humains ont une grande affinité pour l’lL-15 et ils expriment toutes les chaînes du récepteur de l’IL-15, a3y. Il a été démontré que l’IL-15 régule de façon autocrine la production de cytokines pro-inflammatoires et ce en fonction de la concentration d’IL-15 disponible dans les macrophages (6). Les monocytes, quant à elles, expriment aussi toutes les sous-unités du récepteur de l’IL-15, IL-J 5 Ra3y (10, 57), ce qui fait que l’IL-l 5 pourrait agit de façon autocrine. Les monocytes ttaités avec
IL-15 (10-1000 ng/ml) produisent de l’IL-8 et la protéine chiomioattractante des
monocytes (MCP)-1, deux chimiokines qui attirent les neutrophiles et les monocytes, respectivement (150). L’lL-15 stimule la production de superoxydes par les monocytes et augmente leur activité anti-fongique contre Candida albicans (201). Les neutrophiles expriment également toutes les chaînes du récepteur de l’lL-15,
IL-15 Ra3y (51, 69, 70, 121, 149, IL-151). L’lL-IL-15 active les fonctions des neutrophiles,
incluant des changements morphologiques, l’augmentation de la phagocytose, de la bactéricidie et l’augmentation de la synthèse “de novo” de messagers et de protéines
24 (70). Egalement, l’IL-15 retarde I’entrée en apoptose des neutrophiles et inhibe la croissance de Candida albicans (149).
3-4-5) Le rôle de l’IL-15 dans le développement, l’homéostasie et l’activation des cellules T dendritiques épidermiques TCRy5, les cellules intraépithéliales intestinales et les cellules NK-T.
Comme les cellules NK, plusieurs populations de cellules T impliquées dans la réponse immunitaire innée, expriment les sous-unités 3 ou y du récepteur de I’IL-15 ou de l’lL-2. Celles-ci incluent les lymphocytes T dendritiques épidermiques TCRyÔ (DETCs), les lymphocytes intraépithéliaux intestinaux (i-IELs) et les lymphocytes T NK1+ (NK-T). Les DETCs sont des cellules spécifiques de la peau, membres des TCRyÔ, qui migrent au niveau de la peau durant la vie fetale chez la souris (7). Les cellules DETCs sont absentes chez les souris traîtées in-utero par de l’anti-IL-21-1 5R3
(191), mais présentes chez des souris IL-2’. Ceci démontre que fIL-15 est
essentielle pour la croissance et la survie des cellules DETCs.
Les lymphocytes i-lELs expriment à la fois le TCRar3 et le TCRyÔ. Elles sont localisées à la surface basolatérafe des cellules épithéliales intestinales et jouent vraisemblablement un rôle important dans l’immunité mucosale (64, 79). Les cellules i-IELs TCRyÔ expriment l’homodimère CD8aa, tandis que les TCRa3 expriment le CD8aa, le CDSc3 et le CD4÷ (163). Les cellules i-IELs Thy-1 CD8aa+ se développent extra-thymiquement, expriment l’lL-2/l’lL-15 R3y et sont capables de proliférer indépendamment de l’action de l’IL-2. Les i-tELs Thy1CDc43 et les CD4 dépendent du thymus pour leur développement (103, 170).
Les cellules i-lELs TCRyÔ expriment l’ARNm de l’lL-l5Ro et prolifèrent en réponse à I’lL-15. Cette dernière, les protègent également contre l’apoptose médiée par une privation en facteurs de croissance (96). Dans des travaux récents, l’équipe de Lai et aI. (115) a montré que l’IL-15 joue un rôle dans la survie des cellules i-lELs TCRo en
présence d’antigène. L’IL-15 stimule aussi la prolifération, la cytotoxicité ainsi que la production dINE-y par les cellules i-IELs 1CR yÔ (53). En conclusion, l’lL-15 joue
un rôle primordial dans l’expansion et les fonctions des cellules i-IEL et DETC,
contribuant ainsi à l’immunité mucosale.
Comme les cellules NK, les cellules NK-1 expriment le NK1.1, les NKR et le récepteur IL-2/1 5R (24, 132, 155). Les NK-T de souris prolifèrent en réponse à l’IL
15 et leur nombre est sévèrement réduit chez les souris IL-2/1 5R’, IRF-1’, IL-1 5Ra
‘ et IL-15’ (104, 124, 155, 156), mais normal chez les souris IL-2’ (32, 155).
Également, les NK-T dépendent du signal médié par le complexe IL-1 5/IL-15R pour leur expansion et leur homéostasie. Le tableau qui suit résume globalement le rôle joué par l’IL-15 dans les fonctions des différentes sous-populations des cellules du système immunitaire, comme mentionné ci-haut.
26
Tableau 1 Le rôle joué par l’IL-15 dans les fonctions des différentes sous-populations de cellules immunitaires
Les NK Développment, maturation, prolifération, maintenance,
fonction et intéraction cellules Nklmacrophages
Les NKT Expansion, homéostasie et fonction
Monocytes/Macrophages Maturation et libération de cytokines
Les cellules dendritiques Maturation et sur-régulation des molécules d costim u lation
Les neutrophiles Production d’IL-8, activation, maintenance et survie Les cellules yÔ T Développement, homéostasie, activation et survie
Les lymphocytes T Stimulation, chimiotaxie et prolifération des cellules 7
mémoires
Les lymphocytes B Différentiation et prolifération
3-5) L’IL-15 et les cellules non-immunitaires
L’expression de l’IL-15 a été détectée dans plusieurs tissus et cellules non impliquées
dans la réponse immunitaire, indiquant une activité biologique à large spectre de cette
cytokine (76). L’IL-15 joue un rôle anabolisant au niveau du muscle squelettique (167) et pourrait même supporter la différenciation de la cellule musculaire (166). Les cellules épithéliales intestinales prolifèrent en réponse à IL-15 in vitro (168). Les cellules endothéliales vasculaires expriment toutes les sous-unités du récepteur de l’IL-15 (a3y) et répondent à l’IL-15. L’IL-15 joue un rôle également dans l’angiogénèse