ﺔـــﻌﻣﺎﺟ ﻲـــﺟﺎﺑ رﺎــﺘﺨﻣ - ﺔـﺑﺎﻨﻋ Intitulé Membre de jury :
M BAIRI Abdel Madjid Professeur Président Université d’Annaba M TAHRAOUI Abdelkrim Professeur Directeur Université d’Annaba Mme TADJINE Aïcha Professeur Examinatrice Université d’El Tarf M BOUZEBDA Zoubir Professeur Examinateur
Université d’El Tarf
UNIVERSITE BADJI-MOKHTAR-ANNABA
DEPARTEMENT DE BIOLOGIE
FACULTE DES SCIENCES
T
HESEE
NVUEDE L’OBTENTION D’UND
IPLOMEDED
OCTORATSpécialité : BIOLOGIE ANIMALE
I
I
m
m
p
p
a
a
c
c
t
t
d
d
e
e
l
l
’
’
e
e
x
x
p
p
o
o
s
s
i
i
t
t
i
i
o
o
n
n
g
g
e
e
s
s
t
t
a
a
t
t
i
i
o
o
n
n
n
n
e
e
l
l
l
l
e
e
a
a
u
u
d
d
i
i
a
a
z
z
i
i
n
n
o
o
n
n
s
s
u
u
r
r
l
l
e
e
s
s
r
r
a
a
t
t
t
t
e
e
s
s
W
W
i
i
s
s
t
t
a
a
r
r
e
e
t
t
s
s
u
u
r
r
l
l
e
e
n
n
e
e
u
u
r
r
o
o
d
d
é
é
v
v
e
e
l
l
o
o
p
p
p
p
e
e
m
m
e
e
n
n
t
t
d
d
e
e
l
l
e
e
u
u
r
r
p
p
r
r
o
o
g
g
é
é
n
n
i
i
t
t
u
u
r
r
e
e
.
.
Présentée par : M
elleTAYAA Hakima
ﺔﯿﺒﻌﺸﻟا ﺔﯿطاﺮﻘﻤﯾﺪﻟا ﺔﯾﺮﺋاﺰﺠﻟا ﺔﯾرﻮﮭﻤﺠﻟا
REPUBLIQUE ALGERIENNE DEMOCRATIQUE ET POPULAIRE
ﻲﻤﻠﻌﻟا ﺚﺤﺒﻟا و ﻲﻟﺎﻌﻟا ﻢﯿﻠﻌﺘﻟا ةرازو
MINISTERE DE L'ENSEIGNEMENT SUPERIEUR ET DE LA RECHERCHE
SCIENTIFIQUE
Année universitaire 2013 / 2014
REMERCIEMENTS
Au terme de ce travail, je tiens à exprimer mes remerciements et ma profonde gratitude avant tout à Dieu qui m’a donné la force, le courage et la volonté d’élaborer ce travail scientifique.
Je remercie tout d’abord le Professeur AbdelMadjid Bairi d’avoir accepté de juger ce travail et d’en présider le jury. Je tiens particulièrement à lui exprimer ma grande reconnaissance pour sa disponibilité et sa grande sympathie.
Je tiens particulièrement à exprimer ma plus grande gratitude au Professeur AbdelKrim Tahraoui mon directeur de thèse. Je tiens à lui exprimer toute ma reconnaissance pour avoir été si patient, si compréhensif et si présent.
Je tiens à remercier le professeur Aïcha Tadjine pour sa sympathie. Je la remercie vivement d’avoir répondu favorablement pour juger ce travail.
Je remercie le Docteur Zoubir Bouzebda de m’avoir fait bénéficier, de sa disponibilité malgré ses lourdes tâches administratives et pédagogiques. Qu’il me soit permis de lui témoigner ma respectueuse reconnaissance pour avoir accepté de juger ce travail.
Je tiens à exprimer mes vifs remerciements aux : Pr Bouzerna N, Pr Ouakid M.L, Pr Ouali K, Dr Frih H et Dr Sifi K et Mr Metaii A pour leurs encouragements et leurs sympathies.
Je tiens à exprimer ma plus profonde gratitude au Professeur Lankar A, chef du service d’anatomie pathologique (CHU Ibn Rochd, Annaba), au Docteur Laouar O, Kaidi C ainsi qu’à tout le personnel et surtout Saida et Hassina pour m’avoir initié à la technique histologique et à l’interprétation des coupes et pour m’avoir soutenu, formé et encouragé. Malgré un stress permanent du au rythme de travail frénétique et à la gravité des cas observés, je garde pour cette équipe une profonde admiration et une immense tendresse.
Un merci infini à tous mes collègues du laboratoire neuroendocrinologie appliquée : Guedri K, Habbachi W ,Latreche A, Attoui N, Haloui M, Chouba I, Faci H , Fraia A,
Nessaïbia I et surtout Bouhali I et la poupée Zouiche S pour leurs encouragements et leurs sympathies.
Mes remerciements vont aussi à ma famille et mes amis qui, avec cette question récurrente, « quand est ce que tu va soutenir cette thèse ? », m’ont permis de ne jamais me dévier de mon objectif final. Merci à : Amel, Molka, Lylia, Nadia, Fatma, Moufida, Amira, Hiba,Rachid et tant d’autres…
Mes sentiments les plus affectueux vont vers mes parents. Leurs présences et leurs encouragements sont pour moi les piliers fondateurs de ce que je suis et de ce que je fais.
DEDICACES
Je dédie ce travail :
A mes chères parents, source d’amour et de tendresse qui se mettent toujours à mes cotés jusqu’à me voir réussir.
A mes chères frères : Hacène, Brahim, Rafik, Salim, Salah, Redah et Sami. A mes chères sœurs : Fatima, Loubna, Djahida, Biba et Noussa.
A Bouhali Imed Eddine A toute la famille Tayaa.
A mes amis et surtout Nounou et Hlima. A tous ceux que j’aime et qui m’aiment.
ﺺﺨﻠﻤﻟا ﻰﻟإ ﻞﻤﻌﻟا اﺬھ فﺪﮭﯾ ءﺎﻨﺑﻷا ﺪﻨﻋ ﻲﺒﺼﻌﻟا ﻮﻤﻨﻟا و رﺎﺘﺴﯾو ثﺎﻧﻹا ﺪﻨﻋ ﻞﻤﺤﻟا ةﺮﺘﻓ ءﺎﻨﺛأ نﻮﯾزﺎﯾﺪﻠﻟ ضﺮﻌﺘﻟا ﺮﺛأ ﺔﺳارد . ﺔﻋﺮﺠﺑ ناﺮﺌﻔﻟا ﻦﻘﺣ ﻢﺗ 10 ﻎﻣ / نﻮﻨﯾزﺎﯾﺪﻟا ﻦﻣ ﻎﻠﻛ ﻢﺗ ،ﻞﻤﺤﻟا ﻦﻣ ﺮﺸﻋ ﻊﺑاﺮﻟا مﻮﯿﻟا ﺔﯾﺎﻏ ﻰﻟإ ﻊﺑﺎﺴﻟا مﻮﯿﻟا ﻦﻣ ءاﺪﺘﺑا ﺪﻌﺑ و ﻞﻤﺤﻟا ةﺮﺘﻓ لﻼﺧ كﻮﻠﺴﻟا رﻮﻄﺗ ﻞﯿﺠﺴﺗ ﺔﻋﺎﺿﺮﻟا . ﺪﻌﺑ ،ﺔﻋﺎﺿﺮﻟا ﯿﺘﻟا،غﺎﻣﺪﻟا ﺪﺧأ ﻢﺗ ﻤ سﻮ ، ﻟا ﻐ ﺔﯿﺳﺎﯾﺮﻜﻨﺒﻟا ةﺬ ﺪﺒﻜﻟا، لﺎﺤﻄﻟا و ءﺎﻀﻋﻸﻟ ﻲﺒﺴﻨﻟا نزﻮﻟا سﺎﯿﻘﻟ ﺔﯿﺠﯿﺴﻨﻟا ﺔﺳارﺪﻟا و . ﺎﻨﻠﺻﻮﺗ ﻲﺘﻟا ﺞﺋﺎﺘﻨﻟا تﺮﮭظأ ﺎﮭﯿﻟإ : · ناﺮﺌﻔﻟا ﺪﻨﻋ ﺔﯿﮭﺸﻟا و ﻲﻛﺮﺤﻟا طﺎﺸﻨﻟا ﻒﻌﺿ و ﻖﻠﻘﻟا ةدﺎﯾز NGdzn · ﺔﯿﻧﺎﻜﻤﻟا ةﺮﻛاﺬﻟا رﺮﻀﺗ . · سﻮﻤﯿﺘﻟا نزو ﺺﻘﻧ لﺎﺤﻄﻟا،ﺪﺒﻜﻟا ، ﺦﻤﻟا نزو ةدﺎﯾز و سﺎﯾﺮﻜﻨﺒﻟا و ﺔﯾﺮﻈﻜﻟا ذﺬﻐﻟا و ناﺮﺌﻔﻟا ﺪﻨﻋ NGdzn . · ﺲﻧﺎھﺮﺠﻧﻻ ﺎﯾﻼﺧ ﻞﻛﺂﺗ و سﻮﻤﯿﺘﻟا ﻢﺠﺣ رﻮﻤﺿ ناﺮﺌﻔﻟا ﺪﻨﻋ NGdzn . · ناﺮﺌﻔﻟا ﺪﻨﻋ يﺪﺒﻜﻟا ﺪﯾرﻮﻟا ﻊﺳﻮﺗ و نﺎﻘﺘﺣا NGdzn · لﺎﺤﻄﻠﻟ ﺮﻤﺣﻷا ﺐﻠﻟا نﺎﻘﺘﺣا و ﻲﻨﯿﺑ ﻒﯾﺰﻧ . · مرو ﻞﯿﻜﺸﺗ هﺎﺠﺗا ﻲﻓ غﺎﻣﺪﻠﻟ ﺔﯿﺒﺼﻌﻟا ﺔﯿﻤﺠﻨﻟا ﺎﯾﻼﺨﻟا ﺮﺛﺎﻜﺗ . · ﺎﮭﺋﺎﺤﻟ ﺮﻐﺻ و ﺔﯾﺮﻈﻜﻟا ةﺬﻐﻟا ﺐﻟ ﻊﺳﻮﺗ . · ﺧا ﺪﻌﺑ ناﺮﺌﻔﻟا ﺪﻨﻋ راﺮﺿﻷا و تﺎﺑاﺮﻄﺿﻻا ءﺎﻔﺘ Gdzn ةدﻻﻮﻟا ﺪﻌﺑ . ﻞﻀﻔﺑ نﻮﻨﯾزﺎﯾﺪﻟا ﺎﮭﺒﺒﺴﯾ نأ ﻦﻜﻤﯾ ﻲﺘﻟا راﺮﺿﻸﻟ ﺢﻠﺼﻣ و موﺎﻘﻣ رود ﺐﻌﻠﯾ ﻞﻤﺤﻟا نﺄﺑ لﻮﻘﻟا ﻦﻜﻤﯾ زاﺮﻓإ ةدﺎﯾز ﺔﯾدوﺮﯿﺘﺴﻟا تﺎﻧﻮﻣﺮﮭﻟا ﺔﯿﺒﺼﻌﻟا تاﺪﯾوﺮﯿﺘﺴﻟا ﺔﺻﺎﺧو . ﺔﯿﺣﺎﺘﻔﻤﻟا تﺎﻤﻠﻜﻟا : ناﺮﺌﻔﻟا ،نﻮﻨﯾزﺎﯾﺪﻟا،ﻞﻤﺤﻟا ̨ءﺎﻨﺑﻷا ﺘﺴﻟا ﯿ ، ﺔﯿﺒﺼﻌﻟا تاﺪﯾوﺮ
ABSTRACT
The objective of this work is the study the impact of gestational exposure to diazinon on female wistar rat and neurodevelopment of their progeny.
The rats underwent an intra-peritoneal injection of diazinon at dose 10mg/kg, since the 7thday to 14thday of gestation. Sequences of behavior were recorded during gestation and after lactation. After lactation, Dams were decapitated. Brain, pancreas, liver, spleen and thymus were taken to measure relative weight and histological study.
Concerning progeny, ponderal developmental, physical and motor monitonring was made up to lactation. Furthermore, behavior tests were made up to lactation and adolescence to assess locomotor activity and spatial memory.
Our results showed:
· Increase of anxiety and decrease of locomotor activity and food intake in rats NGdzn · Deterioration of spatial memory in NGdzn rats
· Increase of depression associated with destruction of gabaergic receptors.
· Decrease in relative weight of spleen, pancreas, liver, thymus and increase in weight of brain and adrenal gland.
· Atrophy of thymus and necrosis in cell of Langerhans.
· Multiplication of astrocytes in brain that go in the direction to formation astrocytom. · Hyperplasia of adrenal medulla gland and thinning of the cortex.
· Congestion in red pulp in spleen and interstitial hemorrhage · Congestion and dilatation in hepatic central vein.
· Dysregulation of immune count cell.
· Disappearance of these neurobehavioral and histological changes in Gdzn rats after lactation.
· Neurodevelopment disturbances in the offspring, including physical and neuromotor impairments during lactation and behavioral and neurocognitive changes during adolescence.
We can say that the gestation has a protective and repair effect towards the disorders could be induced by diazinon by the increase secretion of steroids hormones particularly steroids neuroactive.
Key Words: Rats, gestation, diazinon, offspring, steroids neuroactive, behavior.
RESUME
L’objectif de notre travail est d’étudier l’impact de l’exposition gestationnelle au diazinon sur les rattes wistar et sur le neurodéveloppement de leur progéniture.
Les rattes ont subi une injection intra-péritonéale au diazinon à raison de 10mg/kg à partir du 7èmej jusqu’au 14èmej de la gestation. Des séquences comportementales ont été enregistrées au cours de la gestation et après la lactation. Après la lactation, un prélèvement rétro-orbitaire a été réalisé en vue d’examiner le profil leucocytaire, ensuite les rattes mères ont été décapitées. Le cerveau, le pancréas, le thymus, la rate, la surrénale, le foie ont été prélevés pour la mesure du poids relatif et l’étude histologique.
Concernant la progéniture, un suivi de développement pondéral et physico-moteur a été réalisé au cours de la lactation. De plus, des tests neurocomportementaux ont été réalisés au cours de l’adolescence afin d’évaluer l’activité locomotrice et la mémoire spatiale.
Nos résultats ont montré :
· Augmentation de l’anxiété et diminution de l’activité locomotrice et de la prise alimentaire chez les rattes non gestantes traitées au diazinon.
· Altération de la mémoire spatiale chez les rattes non gestantes traitées au diazinon. · Augmentation des signes de dépression associés à l’inefficacité du Clonazépam chez
les rattes non gestantes traitées au diazinon.
· Diminution du poids des organes (pancréas, foie, rate et thymus) et une augmentation du poids du cerveau et de la glande surrénale chez les rattes non gestantes traitées au diazinon.
· Au niveau du cerveau, une densification des foyers cellulaires gliaux avec multiplication des astrocytes qui va dans le sens d’une tumeur gliale.
· Un amincissement de la corticosurrénale au profil d’une hyperplasie de la médullo-surrénale.
· Au niveau de la rate, un parenchyme dont la pulpe rouge est fortement congestive avec des signes d’hémorragies interstitiels.
· Congestion et dilatation de la veine centrale hépatique. · Atrophie du thymus et une nécrose des ilôts de Langerhans. · une dysrégulation des cellules immunitaires.
· Disparition des altérations neurocomportementales et histologiques chez les rattes gestantes traitées au diazinon après la lactation.
· Perturbations neurodéveloppementales chez la progéniture incluant des altérations physiques et neuromotrices au cours de la lactation et des changements comportementaux et neurocognitifs au cours de l’adolescence.
Cela permet de conclure que la gestation pourrait jouer un rôle protecto-réparateur vis-à-vis les altérations qui peuvent être induites au diazinon via l’augmentation de la sécrétion des hormones stéroïdes notamment les stéroïdes neuroactifs.
Tableau Titre Pages
1 Identification des phases du cycle œstrien. 06
2 Principales étapes de la coloration par l’hématoxyline-éosine selon Martel (2005).
12
3
Variation du poids corporel (g) chez les rattes Wistar gestantes et non gestantes (témoins et traitées au diazinon 10mg/kg), du 1er jour de la gestation jusqu'à la mise bas. n= 08
20
4
Variation de la prise alimentaire chez les rattes Wistar gestantes et non gestantes (témoins et traitées au diazinon 10mg/kg), du 1er jour de la gestation jusqu'à la mise bas. n= 08
21
5
Effet du Clonazepam sur les paramètres de la nage forcée (temps de la nage, temps d’immobilité, temps d’escalades en secondes) chez les rattes gestantes et non gestantes (témoins et traitées au diazinon 10mg/kg). n= 08
23
6
Variation du temps de la nage pour le test de la nage forcée: Analyse de la variance à deux critères de classification (traitement 1, traitement 2). Traitement 1 (diazinon), traitement 2 (Clonazepam).
23
7
Variation du temps d’immobilité pour le test de la nage forcée: Analyse de la variance à deux critères de classification (traitement 1, traitement 2). Traitement 1 (diazinon), traitement 2 (Clonazepam).
24
8
Variation du temps d’escalades pour le test de la nage forcée: Analyse de la variance à deux critères de classification (traitement 1, traitement 2). Traitement 1 (diazinon), traitement 2 (Clonazepam).
24
9
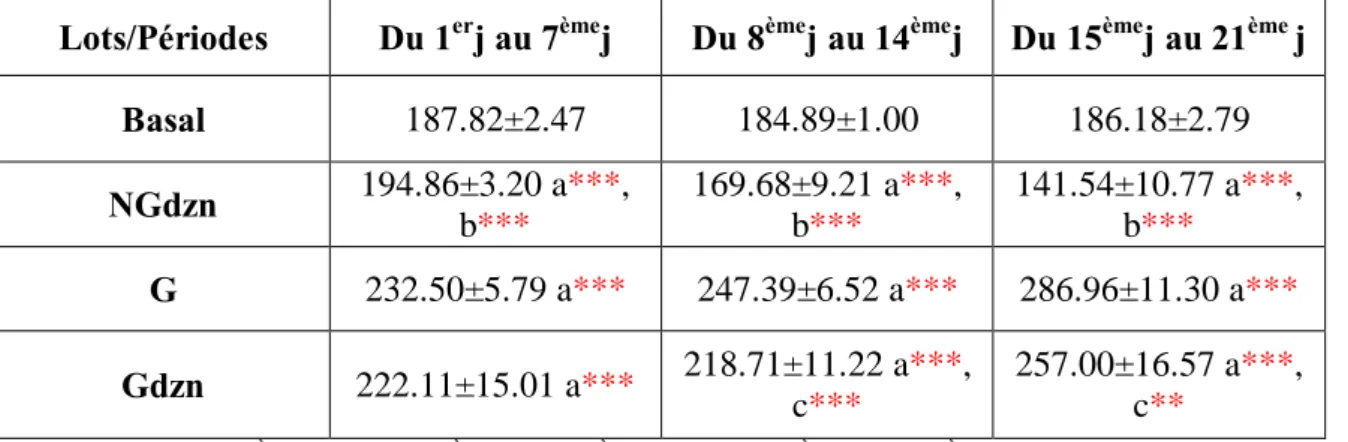
Variation des paramètres du test de champ ouvert [la distance parcourrue (cm) et le nombre d’escalades] chez les rattes Wistar gestantes et non gestantes (témoins et traitées au diazinon 10mg/kg). n=08
25
10
Variation de la distance parcourrue pour le test d’Open Field: Analyse de la variance à deux critères de classification (jours, traitement). Traitement (diazinon).
26
11
Variation du nombre d’escalades pour le test d’Open Field: Analyse de la variance à deux critères de classification (jours, traitement). Traitement (diazinon).
26
12
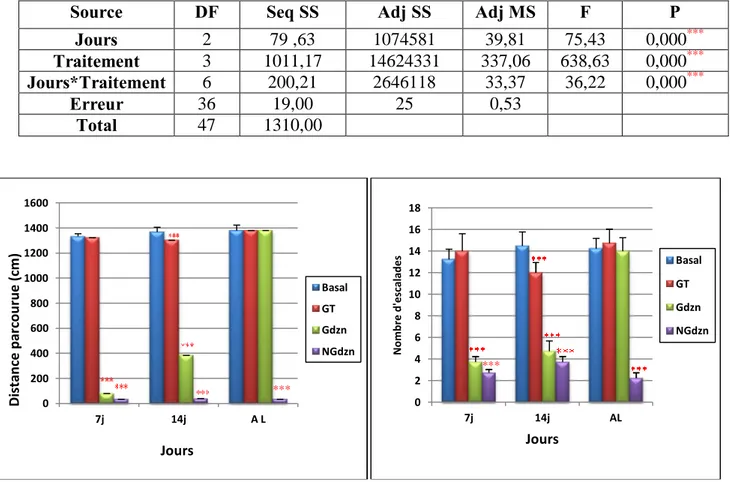
Variation des paramètres du test de labyrinthe en croix surélevée [nombre d’entrées dans les bras ouverts, nombre d’entrées dans les bras fermés, le temps passé dans les bras ouverts (sec) et le temps passé dans les bras fermés (sec)] chez les rattes Wistar gestantes et non gestantes (témoins et traitées au diazinon 10mg/kg). n=08
28
13
Variation du temps passé dans les bras ouverts pour le test de labyrinthe en croix surélevée: Analyse de la variance à deux critères de classification (jours, traitement). Traitement (diazinon).
29
14
Variation du temps passé dans les bras fermés pour le test de labyrinthe en croix surélevée: Analyse de la variance à deux critères de classification (jours, traitement). Traitement (diazinon).
29
15
Variation du nombre d’entrées dans les bras ouverts pour le test de labyrinthe en croix surélevée: Analyse de la variance à deux critères de classification (jours, traitement). Traitement (diazinon).
29
16
Variation du nombre d’entrées dans les bras fermés pour le test de labyrinthe en croix surélevée: Analyse de la variance à deux critères de classification (jours, traitement). Traitement (diazinon).
29
17
Variation du temps de la latence (sec) pour le test aquatique de Morris chez les rattes Wistar gestantes et non gestantes (témoins et traitées au diazinon 10mg/kg). n=08
18
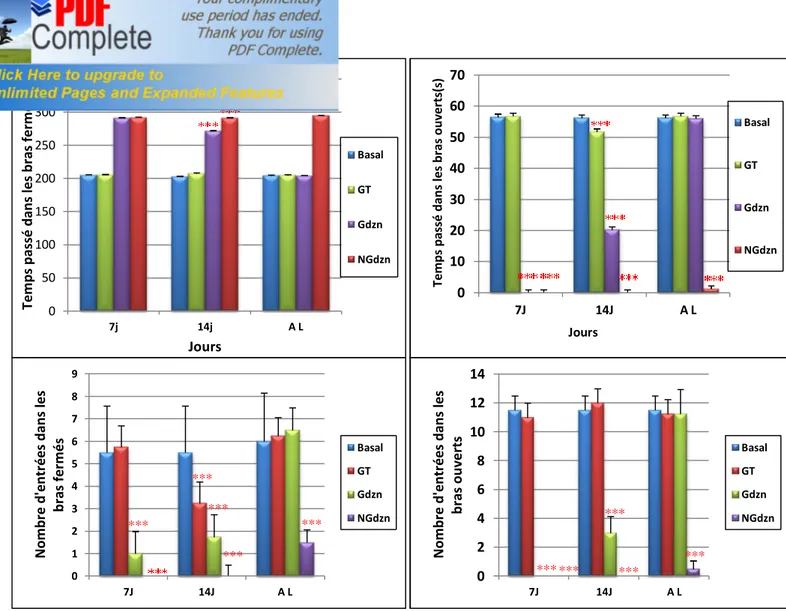
Variation des paramètres du test aquatique de Morris dans le cas de retirement du quadrant cible [nombre d'entrées dans le quadrant cible, le temps passé dans le quadrant cible (sec) et l'indice de rétention] chez les rattes Wistar gestantes et non gestantes (témoins et traitées au diazinon 10mg/kg). n=08
31
19
Variation du profil leucocytaire chez les rattes Wistar gestantes et non gestantes (témoins et traitées au diazinon 10mg/kg). n=08
33
20
Variation du poids relatif (g/100g du poids vifs) des organes (cerveau, surrénales, rate, pancréas, thymus et foie) chez les rattes Wistar gestantes et non gestantes (témoins et traitées au diazinon 10mg/kg). n=08
34
21 Variation des paramètres de la gestation chez les rattes Wistar gestantes (témoins et traitées) au diazinon (10mg/kg).n=08
47
22
Variation pondérale des ratons témoins et traités au diazinon (mâles et femelles) au cours des jours PN (j2, j5, j9, j12, j15, j18).n=20
48
23
Variation pondérale des ratons témoins et traités au diazinon (mâles et femelles) au cours des jours PN (j2, j5, j9, j12, j15, j18) : Analyse de la variance à trois critères de classification (jours, sexe, traitement).
48
24 Variation de l’âge de la percée des incisives chez la progéniture
des rattes Wistar (témoins et traitées au diazinon). n= 20 50
25
L’âge de la percée des incisives chez la progéniture des rattes Wistar (témoins et traitées au diazinon): Analyse de la variance à deux critères de classification (sexe, traitement).
50
26
Variation de l’âge de l’ouverture des yeux chez la progéniture
27
L’âge de l’ouverture des yeux chez la progéniture des rattes Wistar (témoins et traitées au diazinon): Analyse de la variance à deux critères de classification (sexe, traitement).
51
28 Variation de l’âge de la maturation sexuelle chez la progéniture des rattes Wistar (témoins et traitées au diazinon). n=20
53
29
L’âge de la maturation sexuelle chez la progéniture des rattes Wistar (témoins et traitées au diazinon): Analyse de la variance à deux critères de classification (sexe, traitement).
53
30
Variation du temps de la latence (sec) pour le test de retournement chez les ratons témoins et traités au diazinon (mâles et femelles) au cours du jour PN 03.n=20
55
31
Variation du temps de la latence pour le test de retournement chez les ratons témoins et traités au diazinon (mâles et femelles) au cours du jour PN 03 : Analyse de la variance à deux critères de classification (sexe, traitement).
55
32
Variation de l’angle de la chute (°) pour le test d’agrippement chez les ratons témoins et traités au diazinon (mâles et femelles) au cours du jour PN 04. n=20
57
33
Variation de l’angle de la chute pour le test d’agrippement chez les ratons témoins et traités au diazinon (mâles et femelles) au cours du jour PN 04 : Analyse de la variance à deux critères de classification (sexe, traitement).
57
34
Variation du temps de la réaction (sec) pour le test de réaction anti gravitaire chez les ratons témoins et traités au diazinon (mâles et femelles) au cours du jour PN 09. n=20
59
35
Variation du temps de la réaction pour le test de réaction anti gravitaire chez les ratons témoins et traités au diazinon (mâles et femelles) au cours du jour PN 09 : Analyse de la variance à deux critères de classification (sexe, traitement).
36
Variation du temps de la suspension (sec) pour le test de suspension chez les ratons témoins et traités au diazinon (mâles et femelles) au cours du jour PN 12.n=20
61
37
Variation du temps de la suspension pour le test de suspension chez les ratons témoins et traités au diazinon (mâles et femelles) au cours du jour PN 12: Analyse de la variance à deux critères de classification (sexe, traitement).
61
38
Variation des paramètres du test de champ ouvert (nombre de cases traversées, nombre de passées par la case centrale, nombre de redressement et nombre de crottes émises) chez les rats témoins et traités au diazinon (mâles et femelles) au cours du jour PN 45 .n=20
63
39
Variation du nombre de cases traversées pour le test de champ ouvert chez les rats témoins et traités au diazinon (mâles et femelles) au cours du jour PN 45: Analyse de la variance à deux critères de classification (sexe, traitement).
63
40
Variation du nombre de redressements pour le test de champ ouvert chez les rats témoins et traités au diazinon (mâles et femelles) au cours du jour PN 45: Analyse de la variance à deux critères de classification (sexe, traitement).
63
41
Variation du nombre de passées par la case centrale pour le test de champ ouvert chez les rats témoins et traités au diazinon (mâles et femelles) au cours du jour PN 45: Analyse de la variance à deux critères de classification (sexe, traitement).
64
42
Variation du nombre de crottes émises pour le test du champ ouvert chez les rats témoins et traités au diazinon (mâles et femelles) au cours du jour PN 45: Analyse de la variance à deux critères de classification (sexe, traitement).
65
43
Variation du temps de la latence (sec) pour le test aquatique de Morris chez les rats témoins et traités au diazinon (mâles et
44
Variation du temps de la latence pour le test de Morris chez les rats témoins et stressés (mâles et femelles) au cours des jours PN 50,51: Analyse de la variance à trois critères de classification (jours, sexe, traitement).
65
Figures Titre Pages
1 Structure chimique du diazinon (Bennett, 2001) 06
2 Structure chimique du Clonazepam (March et al., 1981) 07
3 Protocole expérimental (1) 13
4 Protocole expérimental (2) 17
5 Changement pondéral (g) chez les rattes Wistar gestantes et non gestantes (témoins et traitées au diazinon 10mg/kg), du 1er jour de la gestation jusqu'à la mise bas. n= 08.
21
6
Variation de la prise alimentaire (g) chez les rattes Wistar gestantes et non gestantes (témoins et traitées au diazinon 10mg/kg), du 1er jour de la gestation jusqu'à la mise bas. n = 08
22
7
Variation des paramètres de la nage forcée (temps de la nage, temps d’immobilité, temps d’escalades en secondes) chez les rattes Wistar gestantes et non gestantes (témoins et traitées au diazinon 10mg/kg). n=08
24
8
Variation des paramètres du test de champ ouvert [la distance parcourrue (cm) et le nombre d’escalades] chez les rattes Wistar gestantes et non gestantes (témoins et traitées au diazinon 10mg/kg).n=08
26
9
Variation des paramètres du test de labyrinthe en croix surélevée [nombre d’entrées dans les bras ouverts, nombre d’entrées dans les bras fermés, le temps passé dans les bras ouverts (sec) et le temps passé dans les bras fermés (sec)] chez les rattes gestantes et non gestantes (témoins et traitées au diazinon 10mg/kg). n=08
30
10
Variation du temps de la latence (sec) pour le test aquatique de Morris chez les rattes Wistar gestantes et non gestantes (témoins et traitées au diazinon 10mg/kg).n=08
32
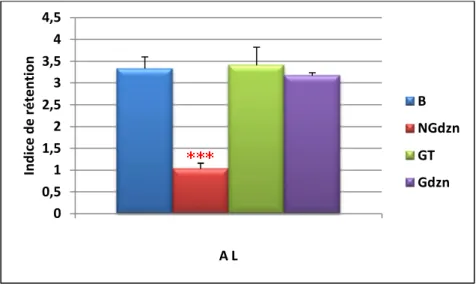
11 Variation de l’indice de rétention chez les rattes Wistar
10mg/kg).n=08
12
Variation du profil leucocytaire chez les rattes Wistar gestantes et non gestantes (témoins et traitées au diazinon 10mg/kg). n=08
33
13
Coupes histologiques du cerveau des rattes témoins et traitées (gestantes et non gestantes) au diazinon à raison d’une dose de 10 mg/kg du poids corporel, colorées à l’hématoxyline-éosine. (200x)
35
14
Coupes histologiques des glandes surrénales des rattes témoins et traitées (gestantes et non gestantes) au diazinon à raison d’une dose de 10 mg/kg du poids corporel, colorées à l’hématoxyline-éosine. (200x)
37
15
Coupes histologiques de la rate des rattes témoins et traitées (gestantes et non gestantes) au diazinon à raison d’une dose de 10 mg/kg du poids corporel, colorées à l’hématoxyline-éosine. (200x)
39
16
Coupes histologiques du pancréas des rattes témoins et traitées (gestantes et non gestantes) au diazinon à raison d’une dose de 10 mg/kg du poids corporel, colorées à l’hématoxyline-éosine. (200x)
41
17
Coupes histologiques du thymus des rattes témoins et traitées (gestantes et non gestantes) au diazinon à raison d’une dose de 10 mg/kg du poids corporel, colorées à l’hématoxyline-éosine. (100x)
43
18
Coupes histologiques du foie des rattes témoins et traitées (gestantes et non gestantes) au diazinon à raison d’une dose de 10 mg/kg du poids corporel, colorées à l’hématoxyline-éosine. (100x)
45
19 Variation pondérale des ratons témoins et traités au diazinon
La liste des abréviations AChE: acétylcholinestérase
j18)
20 Variation de l’âge de la percée des incisives chez la progéniture
des rattes (témoins et traitées au diazinon). 50
21 Variation de l’âge de l’ouverture des yeux chez la progéniture des rattes (témoins et traitées au diazinon).
52
22 Variation de l’âge de la maturation sexuelle chez la progéniture des rattes (témoins et traitées au diazinon).
54
23
Variation du temps de la latence (sec) pour le test de retournement chez les ratons témoins et traités au diazinon (mâles et femelles) au cours du jour PN 03.
56
24
Variation de l’angle de la chute (°) pour le test d’agrippement chez les ratons témoins et traités au diazinon (mâles et femelles) au cours du jour PN 04
58
25
Variation du temps de la réaction (sec) pour le test de réaction antigravitaire chez les ratons témoins et traités au diazinon (mâles et femelles) au cours du jour PN 09.
60
26
Variation du temps de la suspension (sec) pour le test de suspension chez les ratons témoins et traités au diazinon (mâles et femelles) au cours du jour PN 12.
62
27
Variation des paramètres du test de champs ouvert (nombre de cases traversées, nombre de passées par la case centrale, nombre de redressements et nombre de crottes émises) chez les ratons témoins et traités au diazinon (mâles et femelles) au cours du jour PN 45.
64
28
Variation du temps de la latence (sec) pour le test aquatique de Morris chez les ratons témoins et traités au diazinon (mâles et femelles) au cours des jours PN 50,51.
ACTH: adrénocorticotropine hormone CRH: corticolibérine
DHEA: dihydroepiandrostérone EPM: elevated plus maze
Fdzn: femelles issus des mères traitées au diazinon FST: forced swimming test
G: gestante
GA: gain du poids
Gdzn: gestante traitée au diazinon HPA: hypothalamo-pituitaire-adrenal 5-HT:5-hydroxytryptamine
Mdzn : mâles issus des mères traitées au diazinon NAS: stéroides neuroactifs
NGdzn: non gestante traitée au diazinon NPV: noyau paraventriculaire
NPY: neuropeptide Y OF: Open field
OPCs: composants organophosphorés OPs : organophosphorés PA : prise alimentaire PS : pregnénolone sulfate SE : système endocrinien SI : système immunitaire SN : système nerveux T : traitement TSH: thyroid-stimulating-hormone. 1. INTRODUCTION
Les évènements stressants, tels que la grossesse, l'accouchement et la lactation surviennent simultanément avec des fluctuations marquées des niveaux plasmatiques des hormones stéroïdes, connues pour être impliquées dans la vulnérabilité aux troubles émotionnels (Heinrichs M et al., 2002; Neumann I.D et al.,1998; Wigger A et al., 1999). Les premiers jours post-partum sont souvent associés à l'attaque de la majeure vulnérabilité émotionnelle. Cependant, la gestation et la lactation sont généralement décrites comme des périodes hyporéactives au stress. Ainsi, il reste incertain si la gestation constitue une période critique dans la vulnérabilité au stress. Chez l'homme et l'animal, le stress durant la gestation est associé à des changements physiologiques, des perturbations des fonctions émotionnelles et des aptitudes cognitives de la descendance. Cependant, les effets de tel stress sur les mères sont beaucoup moins connus (Stephanie B et al., 2008). Depuis quelques décennies, de nombreuses études se sont intéressées à l’effet à court terme du stress gestationnel sur le devenir de la grossesse et le développement du fœtus, tant chez des modèles animaux que chez l’humain (Da Costa J, 2000).
L'adaptation de l'organisme aux challenges environnementaux implique des mécanismes de réponse au stress en activant des circuits centraux et périphériques: L'axe hypothalamo-hypophyso-surrénalien (HPA), le système sympathique et le système limbique (De Kloet E.R et al., 1998) . L'axe hypothalamo-hypophyso-surrénalien est le principal mécanisme permettant à l'animal de répondre adéquatement aux conditions aversives et maintenir l'homéostasie (Munck A et al., 1984; Selye H, 1978). Les pesticides sont des puissants stimulants de l'axe HPA (Osicka-Koprowska A et al., 1984; Smallridge R.C et al., 1991) et l’exposition à ces substances peut résulter des altérations neurocomportementales persistantes dont l'anxiété, la dépression, déficits de mémoire à court terme, l'apprentissage, l'attention, le traitement d'information et le temps de réaction (Richardson R.J , 1995 ; Stephens R et al., 1995 ; Amr M.M et al.,1997 ; Singh S & Sharma N,2000; Salvi R.M et al., 2003). En plus de leur activation de l’axe HPA les pesticides peuvent induire un stress oxydatif qui est important dans sa toxicité (Amirkabirian N et al ., 2007; Shadnia S et al ., 2007) . Des études récentes indiquent que l’intoxication par les pesticides induit un stress oxydatif par la génération des radicaux libres qui causent la peroxydation lipidique des tissus chez les mammifères et d'autres organismes (Shadnia S et al ., 2005; Kovacic P , 2003) .
L’utilisation massive des pesticides synthétiques, et en particulier de ceux appartenant à la famille des organochlorés, constitua entre 1945 et 1960, un énorme progrès pour l’agriculture et a permis d’assurer une production alimentaire suffisante pour une population en grande croissance. Ceci, tant et si bien que l’utilisation massive des insecticides est
devenue une technique quasiment indispensable à la plupart des pratiques agricoles quel que soit le niveau de développement du pays. Leur utilisation a également contribué à l’amélioration de la santé publique en luttant contre certains insectes vecteurs de maladies (François R, 2005).
Cependant, avec l’utilisation massive des premiers insecticides synthétiques (particulièrement les insecticides organochlorés) sont apparus des signes évidents de toxicité et d’effets néfastes pour l’environnement et pour l’Homme (Eriksson P et al., 1990; Eriksson P et al., 1992; Snedeker S.M, 2001; Den Hond E & Schoeters G, 2006; Schoeters G & Hoogenboom R, 2006; Bonde J.P et al., 2008). Afin de faire face à ces problèmes, mais également à l’apparition de souches résistantes chez les insectes, les industries chimiques ont développé d’autres familles d’insecticides dont le principe actif est différent, quoiqu’il s’agisse toujours de neurotoxiques. Ces familles sont les carbamates, les pyréthroides, les nicoténoides et les organophosphorés.
Les pesticides organophosphorés sont largement utilisés dans l'agriculture pour améliorer la production alimentaire en contrôlant les insectes indésirables qui sont des vecteurs de maladies. Leur mécanisme d'action est basé sur l'inhibition de l’activité de l'acétylcholinestérase (Abu-Qare A.W & Abou-Donia M.B, 2001). L’inhibition de l’AChE par les pesticides organophosphorés provoque l’accumulation de l’acétylcholine dans les synapses cholinergiques, avec une sur-stimulation des récepteurs nicotiniques et muscariniques (Giordano G et al., 2007). En effet, Les organophosphorés sont très lipophiles, franchissent aisément toutes les barrières biologiques et se fixent de façon covalente aux cholinestérases que ce soient les acétylcholinestérases du système nerveux central, des muscles et des globules rouges ou les pseudo-cholinestérases du système nerveux central et plasmatique. Même si une faible quantité franchit la barrière hémato-encéphalique, elle suffit pour inhiber en quelques secondes pratiquement toute l'activité cholinestérasique (Bismuth C, 1993).
Le diazinon est un insecticide organophosphoré le plus utilisé dans le monde après le malathion (Ghafour K-Rashidi Z et al., 2007). Ce dernier s’accumule dans les tissus cibles et non cibles (Tomokuni K et al., 1958; Garcia-Repetto R et al., 1985) produisant des changements histologiques et biochimiques (Dikshith T.S.S et al., 1975). Les composants organophosphorés (OPCs) comme le diazinon sont des agents chimiques neurotoxiques qui inhibent l'activité de l'acétylcholinestérase (AChE) (Delfino R.T et al., 2009). Il peut être simplement postulé que l'acétylcholine dans les neurones cholinergiques à un seuil potentiel pour accomplir une partie cruciale dans la régulation des mécanismes neuroendocriniens des
complexes circuits. Dans le cas de la suraccumulation, d'autres neurotransmetteurs peuvent-être adéquatement recrutés pour moduler les mécanismes des circuits (Elmazoudi R.H & Attia A.A, 2012).
Cependant, les études de toxicité de ces insecticides se limitent souvent aux diverses formes de toxicité directe et aigue des insecticides. En effet, certains des effets nocifs produits par des insecticides neurotoxiques sont liés à une autre forme de toxicité sur l’organisme en développement se nomme neurotoxicité développementale et s’avère donc liée à une « exposition environnementale » dans laquelle certains insecticides, dont les organophosphorés jouent un rôle (Costa L.G et al., 2004; Colborn T, 2006; Grandjean P & Landrigan P.J, 2006; Bjorling-Poulsen M et al., 2008). Plusieurs travaux ont démontré que l’exposition gestationnelle ou néonatale aux organophosphorés provoque des altérations neurocomportementales chez la descendance dans différentes phases de développement (T.L Lassiter et al., 1998 ; Edward D et al., 2002 ; Laura M et al., 2004 ; Chanda S.M & pope C.N, 1996). Cependant, aucune étude n’a été élaborée dans le but d’explorer l’effet des organophosphorés sur le comportement des rattes au cours de la gestation. Frih H et al., (2012) ont suggéré que la gestation pourrait doter l’organisme d’une barrière protectrice vis-à-vis des attaques nerveuses (stress, inhalation des substances toxiques,…etc) et cette protection se ferait, à priori, via la production de stéroïdes dits neuroactifs (progestérone et ses métabolites, etc.) et des facteurs de croissance. La réponse de cette période a été positive vis à vis de la neurotoxicité du toluène, où elle a joué un rôle modérateur sur les changements comportementaux et le poids des organes (Frih H et al, 2012 ; Latreche A et al., 2012). Cet effet protecteur a été montré aussi chez les femmes souffrant de troubles bipolaires lithium-réactive typique de type I et il a été suggéré que les mécanismes naturels puissants peuvent prévenir la récurrence du trouble bipolaire lithium-réactive typique, de type I pendant la grossesse (Paul G et al., 2000). Beaucoup d'observations ont suggéré que la production de placenta, des hormones et des peptides peuvent être l'un des facteurs importants impliqués (Turnbull A.C et al., 1974 ; Field M, 1984). Les changements dans diverses neuro-hormones et neuropeptides pourraient également jouer un rôle protecteur pendant la grossesse. Il s'agit notamment de la CRH, l’ACTH, le cortisol, la progestérone et la progestérone métabolite, les œstrogènes, la TSH et la prolactine (Paul G et al., 2000).
Dans le but de clarifier cette hypothèse, nous avons procédé d’une part à l’évaluation de la toxicité cérébrale et immunitaire au diazinon et d’autre part les propriétés protectrices possibles aux neurostéroïdes actifs qui sont sécrétés pendant la gestation et aussi à
l’évaluation de l’effet de l’exposition gestationnelle au diazinon sur le neurodéveloppement de la progéniture.
La première partie consiste à évaluer l’effet du stress chez les rattes wistar sur plusieurs paramètres maternels, à savoir l’anxiété, la prise alimentaire, le profil leucocytaire et l’étude comportementale. Cette dernière a été réalisé à travers une batterie de tests comportementaux largement répandus (l’Elevated Plus Maze, l’Open Field, Morris Water Maze, le Forced Swiming Test) et leurs relations avec la capacité détoxifante des neurostéroïdes actifs et la réponse du système nerveux, immunitaire et endocrinien.
La deuxième partie a été effectué chez la progéniture prénatalement stressée. Nous avons procédé d’une part au suivi de l’évolution des paramètres physiques et neuromoteurs des ratons mâles et femelles issus des mères témoins et traitées au diazinon à travers une batterie de tests (test de retournement, test d’agrippement, test de réaction antigravitaire, test de suspension) et d’autre part au suivi du développement comportemental et cognitif des jeunes par deux tests (test du champs ouvert ,test du labyrinthe aquatique de Morris).
2. MATERIEL ET METHODES 2.1. Matériel biologique 2.1.1. Animaux d’élevage
Le matériel biologique de base que nous avons choisi est la ratte Rattus rattus de la souche Wistar provenant de l’institut Pasteur d’Alger. Les rattes sont des mammifères nocturnes de l’ordre des rongeurs. Leur puberté survient entre 50 et 60 jours après la naissance chez les deux sexes. Une ratte en bonne santé peut vivre entre 02 ans et demi à 03 ans en fonction de la souche, des conditions environnementales et autres variables (Baker H.J et al ., 1980). A leur arrivée, ces rattes pesaient en moyenne 180 grammes, et au moment de l’expérimentation, elles pesaient en moyenne 250±20 grammes. Ces rattes sont couplées et leurs progénitures sont gardées pour l’étude post natal.
2.1.2. Enceinte d’élevage
Les animaux sont élevés dans des cages translucides en polyéthylène. Celles-ci sont tapissées d’une litière composée de copeaux de bois. Les cages ont été nettoyées et la litière changée une fois tous les deux jours. Les 24 rattes sont acclimatées deux mois aux conditions de l’animalerie, à une température moyenne de 25 ±2°C, une hygrométrie de 50%. La nourriture apportée aux animaux est confectionnée sous forme de bâtonnets constitués de mais, son, remoulage, soja, CMV (Sarl la production locale aliment souris et rats Bouzaréah- Alger).Quand à l’eau de boisson, elle est présentée dans des biberons ad libitum.
2.2. Méthodes
2.2.1. Identification œstrale et accouplement
Les rattes des différents groupes ont été séparées, chacune dans une cage. L’identification œstrale s’effectue par des frottis vaginaux sur toutes les femelles afin d'identifier les phases du cycle œstrien tout en estimant leur réceptivité.
La technique du frottis vaginal consiste à prélever, au moyen d'une anse métallique, le liquide visqueux retrouvé au niveau des parois du vagin de la ratte .Une fois prélevé, le frottis est étalé sur une lame pour procéder à la coloration selon la méthode d’Issac J.P & Wurch T.A (1966) qui consiste à appliquer quelques gouttes du Bleu de Méthylène sur la lame (solution alcoolique de 1‰) puis rincer à l’eau distillée. La lecture se fait au microscope [B1 series system microscopes, Motic Inc, USA], où on observe les trois types cellulaires cités ci –dessous (Tableau 01) .L’identification des différentes phases du cycle œstrien s’effectue en fonction de l'abondance relative de ces types cellulaires au niveau du frottis.
Tableau 01 : Identification des phases du cycle œstrien.
Phase Cellules
épithéliales
Cellules
Proœstrus + ± +
œstrus + + -
Metoœstrus - + +
Diœstrus + - +
(+:abondance ± : présence - : absence ou présence rare)
Après avoir identifié les phases, des rats mâles ont été introduits le soir à 16 heures, indépendamment de leur poids, à raison d’un mâle par femelle pour réaliser l’accouplement. La fécondation est confirmée par la présence du bouchon muqueux dans le frottis vaginal qui correspond alors au premier jour de la gestation.
2.2.2. Application du traitement 2.2.2.1. Présentation du traitement
Diazinon
Le diazinon (C12H21N2O3PS) est un insecticide organophosphoré. Le diazinon (O,
O-diéthyl-O-(2-isopropyl-6-méthyl-pyrimidine-4-yl) phosphorothioate), est un liquide incolore huileux, d'odeur caractéristique. Le produit technique: jaune pâle à brun foncé, est un ester d'acide thiophosphorique.
Le diazinon est absorbé facilement par le tube digestif et il est métabolisé rapidement en quelques heures. Toutefois, la majorité du diazinon est excrétée dans les urines sous forme de produits de scission de l'ester phosphorique; ces produits de scission ne sont pas considérés comme actifs sur le plan toxicologique (Hansch C et al ., 1995). Chez le rat, 50 % d'une dose de diazinon administrée par voie orale est excrétée dans les premières heures, et de 95 à 98 % est éliminée dans les sept jours, surtout dans les urines (Robens J.F, 1969).
Figure 01. Structure chimique du diazinon (Bennett M, 2001) Clonazepam
Le Clonazepam est un antidépresseur appartient à un groupe de médicaments appelés benzodiazépines dont la formule chimique brute est de C15H10ClN3O3. Les benzodiazépines sont des médicaments sédatifs-hypnotiques et anticonvulsivants (March et al., 1981) qui aident à réduire la nervosité, la tension et les symptômes d'anxiété en ralentissant le système nerveux central.
Clonazepam
Figure 02. Structure chimique du Clonazepam (March et al., 1981)
2.2.2.2 Mode de traitement
Les 32 rattes ont été réparties en deux lots chacun comporte de 16 rattes. Le premier lot de 16 rattes gestantes comprend 08 rattes traitées au diazinon mélangé à l'huile d'olive et 08 rattes traitées à l’huile d’olive. Le deuxième lot de 16 rattes non gestantes comprend 08 rattes traitées au diazinon mélangé à l’huile d’olive et 08 rattes témoins (lot basal) traitées à l’huile d’olive.
Le traitement au diazinon de 08 rattes gestantes et 08 rattes non gestantes est préparé sous forme d’un mélange : huile d’olive et diazinon. Ce dernier est administré aux rattes par injection intra- péritonéale à raison de 10 mg/kg de poids corporel (1/6 de DL50)
chaque jour pendant 07 jours consécutifs à partir du 7émejour de la gestation entre 09 heures et 09 heures 30 minutes du matin.
Au cours de la nage forcée, les 32 rattes ont subi 2 sessions de tests espacées de 24 heures. Le pré-test est d'une durée de 15 minutes et le test est de 5 minutes. Le traitement des 24 rattes au Clonazepam est préparé sous forme d’un mélange : chlorure de sodium et de Clonazepam. Ce dernier est administré aux rattes par injection intra-péritonéale à raison de 0,2mg/kg (Porsolt R.D et al., 1977 a et b; Da Silva V.A et al., 1991). Les 24 rattes ont subi un test d’habituation de nage forcée pendant 15 minutes. Une première injection au Clonazepam a été effectuée une heure après. Une deuxième injection du traitement a été faite une heure avant le test de la nage forcée qui se déroulé en 5 minutes.
A partir du premier jour de la gestation jusqu'à la mise bas, les rattes ont été pesées quotidiennement et la quantité de la nourriture est mesurée à l’aide d’une balance GIBERTINI EU- C 1200.
2.2.4. Tests comportementaux
Le comportement anxieux inné est une composante fondamentale du comportement général des rongeurs. Il se manifeste par l'attitude de l'animal à avoir peur lorsqu'il est mis, sans expérience préalable, dans un environnement non protégé. Ce comportement peut être évalué à l'aide de dispositifs expérimentaux validés dont les plus utilisés sont le labyrinthe en croix surélevée (EPM, Elevated Plus Maze), le champ ouvert (OF, Open Field), le labyrinthe de Morris (Water Maze) et la nage forcée (FST,Forced Swiming Test). Les rattes ont subies une série de tests comportementaux Open Field et Plus Maze pendant le 7èmej, 14èmej de la gestation et après la lactation, ces mêmes rattes ont subis seulement la nage forcée et Morris après la lactation.
2.2.4.1. Test de la nage forcée (Forced Swiming Test, FST) (Porsolt R.D et
al., 1977)
La nage forcée ou test de Porsolt, est un test de désespoir comportemental (Porsolt R.D et al., 1977 b) utilisé pour étudier le mécanisme neurobiologique des antidépresseurs et leurs effets sur le comportement.
Le dispositif de ce test est un aquarium 54cm×30cm×36cm de diamètre rempli d’eau à 30cm d’hauteur dont le rat ne se sert pas de ses membres inférieurs pour se tenir à la surface ni s’échapper ce qui le soumet à une nage forcée. L’eau a été méticuleusement maintenue à (26° C). Ce test est composé de deux sessions espacées de 24 heures. Au cours de la première session les rats ont été placé individuellement dans l’aquarium pendant 15 minutes, cette phase sert à provoquer une dépression mentale (session dépressinogène). La deuxième session dure 5mn au cours de laquelle, le temps d’immobilité, de nage et d’escalade sont mesurés.
2.2.4.2. Test du champ ouvert (Open Field, OF) (Hall C.S, 1934)
Le test de l’Open Field, initialement décrit par Hall C.S (1934), a été développé dans le but de mesurer les différences de réactivité émotionnelle chez le rat.
Le dispositif se compose d’une base entourée par des parapets en plexiglas dont les mesures sont respectivement de 70cm×70cm×40cm. Le plancher est sous forme de carrés de
10cm×10cm de diamètre, il a été divisé en trois zones : zone centrale, zone périphérique et zone bordure, dont chacune est de 35cm.
Le test de champ ouvert est réalisé pendant 5mn et l'animal est placé au centre du champ, son déplacement permet de mesurer le nombre de carrés traversés ainsi que le temps passé dans chaque zone. De ce fait, ce test indique l'activité locomotrice et le comportement anxieux respectivement. Ce dernier est d’autant plus prononcé quand le rat passe plus de temps dans la zone périphérique. Quant à la zone centrale, son exploration représente un signe de moindre anxiété.
2.2.4.3. Test du labyrinthe en croix surélevée (Elevated Plus Maze, EPM) (Montgomery K.C, 1955)
Le labyrinthe en croix surélevée est utilisé pour mesurer le degré d’anxiété chez les rongeurs.
Le labyrinthe surélevé de 50cm du sol est composé de quatre bras en bois, deux bras ouverts (50×10cm) s’opposant perpendiculairement à deux bras fermés (50×10cm) avec 40cm de plexiglas haut bord. L'intersection des quatre bras (plate-forme centrale) mesurait 10cm. (Montgomery K.C, 1955 ; Roy V, 2002).
Le test du labyrinthe en croix surélevée est réalisé pendant 5 min en plaçant l'animal dans l'aire centrale face à un bras ouvert. Etant donné que le rat craint les espaces vides et hautes, son exploration des bras ouverts témoigne d'un comportement moins anxieux. A l'encontre, plus l'animal est localisé dans les bras fermés plus son comportement est désigné comme anxieux. (Pellow et al., 1985).
A l'issue de ce test, les paramètres suivants sont mesurés: le temps passé dans les bras ouverts, le temps passé dans les bras fermés, le nombre d'entrée dans les bras ouverts et le nombre d'entrée dans les bras fermés (Dawson I.A et al., 1995 ; Weiss A et al., 1998).
2.2.4.4. Test du labyrinthe de Morris (Morris Water Maze, MWM) (Richard Morris R.G.M , 1981)
Le Morris Water Maze est utilisé pour identifier et mesurer l’apprentissage spatial et la mémoire des rongeurs ( Morris R.G.M, 1981).
Le bassin de Morris est une piscine circulaire de 120 cm de diamètre et 60 cm de profondeur, il est réalisé en polypropylène et est monté sur un support. Celui-ci est divisé
en quatre quadrants ; l’un de ces derniers comporte une plate-forme légèrement immergée; 1 cm au-dessous de la surface de l'eau (le quadrant cible). Il est rempli d'eau à 30 centimètres de profondeur. La température de l’eau est maintenue entre 22 et 32°C.
Le test de Morris se déroule sur 4 jours consécutifs, dont l'essai quotidien comporte 05 passages. La ratte est déposée dans l'eau en périphérie à des endroits différents, elle nage jusqu'à trouver la plate-forme puis elle est retirée de l’eau. Si la ratte ne trouve pas la plate-forme au bout de soixante secondes, le passage est terminé et l’expérimentateur place l’animal sur la plate-forme pour dix secondes. La plate-forme est retirée au 4éme jour du test et l'essai dure 60s. Tous les essais sont filmés et les trois paramètres à enregistrer sont: le temps de latence, le nombre d'entrée dans le quadrant cible et le temps passé dans le quadrant cible. A partir du temps passé dans chaque quadrant de la piscine lors de l’essai sans plate-forme, nous avons calculé un indice de rétention qui consiste à diviser le temps passé dans le quadrant cible (celui qui contenait la plate-forme) par la moyenne du temps passé dans les trois autres quadrants. Ainsi, plus la ratte passe de temps dans le quadrant cible, plus l’indice est élevé, alors qu’un indice proche de 1 indique que l’absence de recherche privilégiée de la plate-forme dans le quadrant cible.
2.2.5. Prélèvements
2.2.5.1. Prélèvement sanguin
Le prélèvement se fait à partir de la veine rétro-orbitaire après la lactation (AL). Les échantillons sanguins sont recueillis dans des tubes EDTA pour l’étude hématologique.
2.2.5.2. Prélèvement des organes
Après la mise bas et la phase de la lactation, la progéniture est gardée et les mères sont sacrifiées. Suite à la décapitation et la dissection des animaux, les organes suivants ont été prélevés et pesés à l’aide d’une balance de précision (SCALTEC SBC 51) : cerveau, rate, surrénales, pancréas, thymus et foie puis conservés dans le formol (10 %) pour l’étude histologique.
2.2.6. Etude histologique :
Le protocole histologique est réalisé selon Martoja M & Martoja R (1967)
· Fixation: Le fragment du tissu est placé dans une cassette d’histologie, et conservé dans un fixateur d’histologie le formol (10 %) durant 48 heures.
· Pré inclusion: Les échantillons ont ensuite été déshydratés dans deux bains successifs d’éthanol et de trois bains de butanol, pour finalement être imprégnés dans la paraffine, quatre bains de 24h ont été effectués.
· Inclusion: Les tissus imprégnés de paraffine doivent ensuite être inclus dans un bloc de paraffine, que l’on moulera autour des tissus sur le banc d’inclusion. Le socle du moule est constitué par la cassette d’histologie afin de conserver la référence de l’individu. Une fois solidifié, le bloc de paraffine est débité en prisme autour du fragment de tissus.
· Réalisation des coupes: Les blocs de paraffine contenant les tissus sont coupés à l’aide d’un microtome. Ils sont d’abord dégrossis jusqu’à ce que la coupe passe par la totalité de la section de masse viscérale, puis coupés à 3 µm d’épaisseur, les coupes sont déposées sur une lame de microscope. Les coupes sont ensuite étalées à l’aide d’une plaque chauffante à 30°C et séchées à l’étuve de 60°C pendant 1heure.
· Coloration: Afin d’obtenir une coloration contrastée des tissus, on utilise une coloration à l’hématoxyline-éosine (Martel ,2005). Les tissus sont déparaffinés par des bains successifs de xylène, puis hydratés dans l’alcool avant d’être plongés dans les colorants, et rincés par des bains d’alcool, puis par le xylène (Tableau 2).
Tableau 02 : Principales étapes de la coloration par l’hématoxyline-éosine selon Martel-Pelletier (2005).
Xylène 5 minutes
Xylène 5 minutes
Ethanol 100° 5 minutes
Ethanol 100° 5 minutes
Ethanol 100° 5 minutes
Rincer à l’eau du robinet 3 minutes
Colorer avec l’hématéine de Harris 15 minutes Laver les coupes à l’eau du robinet 3 minutes
Bleuir dans l’eau ammoniacale 2 secondes
Laver à l’eau du robinet 15 minutes
Colorer dans une solution d’éosine 15 minutes
Ethanol 100° 5 minutes
Ethanol 100° 5 minutes
Acétone /xylène (v/v) 5 minutes
Xylène 5 minutes
Montage des lames avec le baume de canada
Les préparations histologiques ont été observées sous un microscope Leica avec trois grossissements selon la taille des cellules (10X, 20X et 40X). Le microscope est muni d’une caméra vidéo afin d’enregistrer les images.
Figure 03. Protocole expérimental (1)
32 rattes
16 rattes gestantes 16 rattes non gestantes
08 rattes traitées au diazinon + l'huile d'olive 08 rattes traitées à l'huile d'olive 08 rattes témoins traitées à l'huile d'olive 08 rattes traitées au diazinon + l'huile d'olive
Champ ouvert (OF)
Décapitation
Prélèvement des organes
Poids relatif (cerveau, rate, foie, surrénales, pancréas et thymus)
Etude histologique (cerveau, rate, foie, surrénales, pancréas et thymus 7èmej, 14èmej de la gestation
Après la lactation
Labyrinthe de
Morris (MWM) Nage forcée (FST)
Labyrinthe en croix
surélevée (EPM) Prélèvement sanguin Hématologie Traitement intra-péritonéale
au diazinon du 7èmej jusqu’au
14èmej de la gestation.
Récupération de la descendance pour l’étude post natal (protocole 2)
Labyrinthe en croix surélevée (EPM)
Champ ouvert (OF)
2.2.7. Mesure des paramètres du développement des ratons
Les mesures de ces paramètres ont concerné les ratons nouveau-nés depuis le jour de la naissance jusqu’au 18ème jour.
2.2.7.1. Mesure des paramètres de la gestation · Taille de la portée
Elle est estimée le jour de la mise bas et consiste par un comptage des petits nouveau- nés par femelle gestante.
· Le sex ratio
C’est le pourcentage de nouveau-nés mâles sur la taille totale de la portée, et calculé selon la formule suivante :
Sex ratio = nombre des mâles ×100 nombre total de la portée
· Test de construction du nid
Le test de construction du nid (structure du nid et quantité de matériaux utilisés pour sa construction) chez la femelle allaitante permet de repérer d’éventuelles perturbations du comportement maternel inhérentes à divers traitements toxiques (test réalisé entre J4 et J7 après la naissance).
Quatre niveaux ont été assignés à la qualité de la construction du nid (de 0 a 4) : Niveau 0 : absence totale de nid.
Niveau 1 : début de construction sans structure précise. Niveau 2 : début de structure en demi-cercle.
Niveau 3 : structure circulaire complète saris couverture du nid. Niveau 4 : structure circulaire complète avec couverture du nid.
2.2.7.2. Mesure du développement physique des ratons
Parmi les indicateurs du développement physique, nous avons réalisé la mesure des 3 paramètres les plus importants (Roberts L.G et al., 2007 ; Da-Silva V.A et al., 1991) :
· L’évolution pondérale des jeunes est réalisée pendant les jours : J2 ; J5 ; J9 ; J12 ; J15 et J18, à l’aide d’une balance de précision (BIO BLOCK Scientific).
· Les dates de percée des incisives : cette mesure s’effectue entre le 8éme
et le 11éme jour après la naissance par simple appréciation visuelle (Thiel R & Chahoud I, 1997). · La vérification de l’ouverture des yeux : elle s’effectue entre le 12éme
et le 16éme jour après la mise bas à partir de l’observation des ratons.
Ces trois paramètres constituent de bons indicateurs du développement physique de la descendance.
2.2.7.3. Mesure des paramètres neuromoteurs des ratons Test de retournement
Il est réalisé le 3éme jour du post natal (PN3) pour mesurer la maturation neuromusculaire (ETAP, 2001). Il consiste à déposer le raton sur le dos, et ce dernier tente de revenir à la position ventrale ; enfin, on mesure le temps nécessaire au raton pour atteindre son retournement.
Test d’agrippement
Il s’effectue au 4éme jour du post natal (PN 4) ; ce test sert à mesurer la force musculaire des membres antérieurs. Le système est composé d’un plateau grillagé, où le raton doit s’agripper pour ne pas tomber lorsque le plateau est mis en rotation. La variable mesurée est l’angle atteint par rapport à l’horizontale, quand le raton cesse de s’agripper et tombe. La mesure de l’angle est exprimée en degré (ETAP, 2001).
Test de réaction antigravitaire
Il s’effectue le jour 9 du post natal (PN 9) dans le but de mesurer l’équilibration et la maturation du cervelet et des canaux semi-circulaires de l’oreille interne. On place le raton « la tête vers le bas » sur un plan incliné à 20° ; l’animal doit pivoter pour se retrouver « la tête vers le haut » ; on mesure le temps nécessaire pour que l’animal effectue un demi-tour complet de 180° (ETAP, 2001).
Test de suspension
Ce test se fait le jour 12 du post natal (PN 12) pour la mesure de la force musculaire et de la fatigabilité du raton. Les pattes antérieures du raton sont amenées au contact d’un fil tendu à 40cm du sol. Cette stimulation déclenche une réaction d’agrippement, et l’animal se suspend au fil pendant un certain temps puis lâche prise à cause de la fatigue. La variable mesurée est la durée de suspension (temps en seconde) à l’aide d’un chronomètre (ETAP, 2001)
2.2.7.4. Mesure du développement comportemental et cognitif des jeunes rats Après le sevrage, les mâles et les femelles de chaque portée ont subis des tests comportementaux et cognitifs.
- Activité locomotrice, exploratoire et état émotionnel en Open- Field (Jour 45)
Le dispositif est constitué d’une base carrée (50 cm) divisée en neuf cases, une centrale et huit périphériques et entouré par des parapets de plexiglas.
Ce test permet d’évaluer, sur des sessions de test de 5 minutes, les troubles de l’activité locomotrice, du comportement exploratoire et de l’état émotionnel des animaux. Les variables étudiées sont le nombre de cases traversées et le nombre de redressements (activité locomotrice et exploratoire), le nombre de crottes émises ainsi que le nombre de passages dans la case centrale du dispositif (critère d’anxiété).
- Labyrinthe aquatique de Morris : mémoire spatiale (Jours 50 et 51)
Le rat, déposé dans un bassin circulaire (120 cm) rempli d’eau, nage et cherche à fuir du milieu aquatique aversif. La première session de test (Jour 50) comporte 5 essais, aux tours desquels I’animal apprend à localiser I’emplacement d’une plate-forme immergée à 2 mm sous la surface de I’eau et à s’y refugier. Pendant les deux premiers essais (essais de familiarisation au test), la plate-forme est placée contre la paroi du bassin. Pour les autres essais elle est placée à 10 cm de la paroi. La deuxième session de test (Jour 51) comporte deux essais, aux tours desquels la plateforme est placée d’emblée à 10 cm de la paroi du bassin. Un temps de repos de 30 secondes sur la plate-forme est nécessaire entre deux essais pour permettre au rat de prendre ses repères spatiaux, indispensables à son orientation dans le dispositif.
Ce test permet d’évaluer la qualité du comportement locomoteur pendant la nage, les perturbations éventuelles dans I’acquisition d’un apprentissage progressif et la mémorisation au plan spatial à court et à long terme. Les variables étudiées sont la qualité du comportement de la nage et le temps de la latence pour se refugier sur la plate-forme.
Figure 04. Protocole expérimental (2) 16 rattes gestantes 08 rattes traitées au diazinon + l'huile d'olive 08 rattes témoins traitées à l'huile d'olive
Après la mise bas Traitement intra-péritonéale du 7èmej jusqu’au 14èmej de la gestation. 40 ratons 40 ratons
20 ratons mâles 20 ratons femelles 20 ratons mâles 20 ratons femelles
Mesure des paramètres de la gestation
Mesure du développement
physique des ratons Mesure des paramètres
neuromoteurs des ratons
Mesure du développement comportemental et cognitif
des jeunes PN45 et PN 50 et 51