FACULTE DE MEDECINE
-y
,0 jT6 y
THESE PRESENTEE
A L'ECOLE DES GRADUES DE L'UNIVERSITE LAVAL
POUR L'OBTENTION
DU GRADE DE PHILOSOPHIAE DOCTOR (Ph.D.)
PAR
JACQUES BESANÇON, AGRONOME INGENIEUR
DE L'ECOLE SUPERIEURE D'AGRICULTURE D'ANGERS, FRANCE MAITRE ES SCIENCES EN ZOOTECHNIE
DE L'UNIVERSITE LAVAL
ETUDE PHYSIOLOGIQUE ET BIOCHIMIQUE DE L'a-GLUCOSIDASE DU PLASMA SEMINAL DE BELIER
RESUME
Le bélier a été choisi comme modèle animal en tant que reproduc teur saisonnier pour l'étude de 1'a-glucosidase dans le plasma séminal. Son activité spécifique est basse dans les cas d'immaturité du spermato zoïde suggérant ainsi qu'elle serait un marqueur de la fonction épididy- maire. L'étude de 1'enzyme dans les fluides du rete testis et de 10 zones de 1'épididyme démontre que cette glande contribue majoritairement au con tenu en a-glucosidase du plasma séminal. En vue d'élucider le rôle pos sible de cet enzyme dans le processus de maturation du spermatozoïde, 1'a-glucosidase a été purifiée 10,000 fois avec un rendement de 5%. C'est une glycoprotéine très mineure de 105 KDa et de structure monomérique.
RESUME
Les a-glucosidases sont les enzymes qui catalysent l'hydrolyse des polysaccharides directement en glucose. Ainsi, dans le plasma séminal des mammifères, leur activité pourrait représenter un potentiel d'énergie pour les spermatozoïdes. Le bélier a été choisi comme modèle animal en tant que reproducteur saisonnier pour étudier ces enzymes en relation avec la qualité de la semence.
L'activité spécifique de 1'a-glucosidase du plasma séminal est basse (< 1 mU/mg) chez 11 agneau immature, puis augmente simultanément à 11 acquisition de la maturité sexuelle jusqu'à un niveau adulte supérieur à 1 mU/mg. Un traitement à 1'a-chlorohydrine a été initié chez le bélier adulte en saison sexuelle afin d'inhiber la fonction épididymaire et ainsi la maturation des spermatozoïdes. L'activité enzymatique diminue signifi cativement dans le plasma séminal pendant le traitement, simultanément à 1'apparition de spermatozoïdes immatures dans la semence, et rejoint les niveaux témoins 2 mois après la fin du traitement. Ces résultats suggè rent que 1'activité spécifique de 1'a-glucosidase du plasma séminal de bélier peut être considérée comme un marqueur de la maturation des sperma
tozoïdes .
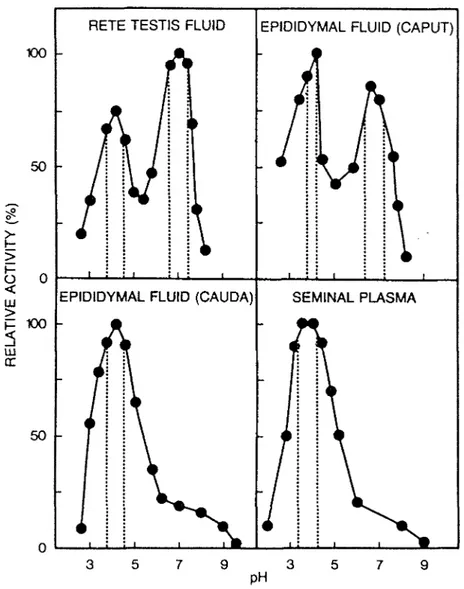
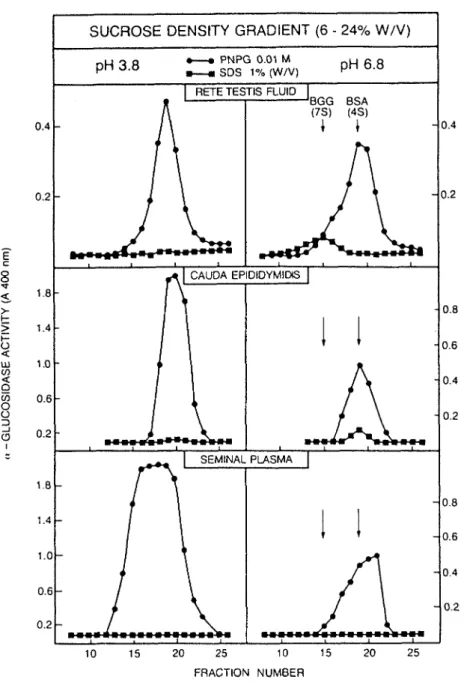
L'étude de 1'a-glucosidase s'est poursuivie dans les fluides du rete testis collectés par cathétérisme et ceux de 10 zones de 1'épididyme recueillis par microperfusion et microponction, afin de déterminer son origine dans les organes reproducteurs. Les résultats démontrent que l'activité enzymatique et la concentration en L-carnitine (un marqueur épididymaire connu) sont bas dans les fluides du rete testis et dans ceux de 1'épididyme jusque dans sa portion médiane puis augmentent à partir du corps distal pour atteindre dans le fluide épididymaire caudal des niveaux 2.5 fois supérieurs à ceux du plasma séminal. Une étude du pH optimum de 1' -glucosidase ainsi que de ses formes moléculaires dans ces différents fluides suggère que l'enzyme serait sécrété dans le fluide du rete testis sous deux formes (neutre 7S et acide 4S) mais que seulement la forme 4S
ill
serait accumulée (ou sécrétée) dans la queue de l'épididyme. Ces résul tats démontrent que l'épididyme contribue de façon majoritaire au contenu en a-glucosidase du plasma séminal et suggèrent que son activité pourrait être impliquée dans le processus de maturation épididymaire du spermato zoïde .
Afin d'élucider ce rôle éventuel, l'a-glucosidase du plasma séminal a été purifiée. Une méthode en 4 étapes (précipitation à 1'étha nol, hydroxylapatite, DEAE Sépharose CL-6B et focalisation isoélectrique à pH 6-4) est proposée, permettant de purifier 10,000 fois l'enzyme avec un rendement de 5%. L'a-glucosidase est une protéine très mineure du plasma séminal qui n'est pas adsorbée sur gel dextran; ainsi seulement quelques dizaines de microgrammes d'a-glucosidase ont été obtenus en fin de purifi cation. Les essais d'immunisation chez le lapin n'ont pas conduit au développement d'anticorps spécifiques contre la protéine. Cette étude a permis d'établir que 1'a-glucosidase du plasma séminal de bélier est une glycoprotéine de 105 KDa, ayant un point isoélectrique entre 4 et 5 et une structure monomérique. Cependant, son rôle vis-à-vis de la maturation épididymaire du spermatozoïde demeure à être démontré.
REMERCIEMENTS
Je désire en premier lieu exprimer ma profonde gratitude à l'égard de mon directeur de thèse, monsieur le docteur Roland R. Tremblay qui, par ses précieux conseils, son ardeur et sa ténacité, a su m'encoura ger tout au cours de ce travail. Je tiens aussi à le remercier pour toutes les facilités mises à ma disposition au laboratoire et pour avoir stimulé ma participation à différents congrès scientifiques.
J'adresse ma sincère reconnaissance à 1'intention de mes deux co-directeurs de thèse, les docteurs Jean-Paul Lemay et Jean Yvon Dubé pour les parties physiologiques et biochimiques respectivement. Leurs conseils judicieux, leur encouragement constant et leur grande disponibi lité ont été autant d'atouts pour mener à bien cette recherche.
Je tiens à remercier également les docteurs Michel Courot et Jean-Louis Dacheux de la Station de Physiologie de la Reproduction à l'I.N.R.A. de Nouzilly (France). Ils m'ont assuré chacun un encadrement adéquat pour les expériences effectuées dans leur laboratoire, et les ré sultats subséquents constituent une contribution substantielle à la partie physiologique de cette thèse.
Ce travail a été rendu possible grâce à la participation de nom breux assistants de recherche et techniciens du laboratoire d'Endocrinolo gie-Métabolisme . Je remercie particulièrement monsieur Pierre Chapdelaine qui, par sa compétence et son enthousiasme a su rendre ce travail plus agréable. Je tiens à souligner la contribution de monsieur Robert Faquin, mesdames Diane Dorval et Lise Lacouline. Leur expertise à chacun a été grandement appréciée.
J'exprime mes sincères remerciements à monsieur Alcide Cormier et à tout le personnel de la Station Agronomique de l'Université Laval pour la vigilance apportée dans le soin de tous les béliers impliqués dans cette recherche.
V
Je désire également remercier tout le personnel de l'illustra tion et de la photographie bio-médicale du C.H.U.L. pour leur excellent travail. Je suis particulièrement reconnaissant envers madame Marcelle Billion Hamel qui a dactylographié cette thèse avec application.
Finalement, je désire remercier de façon spéciale tous les cher cheurs et chercheuses étudiants avec qui j'ai collaboré tout au cours de ces études, ainsi que tous mes amis pour leur compréhension et le soutien moral qu'ils ont su me prodiguer dans les moments difficiles.
Ces travaux ont été effectués grâce à des subventions accordées au Laboratoire d'Endocrinologie-Métabolisme par le Conseil des Recherches Médicales du Canada, au département de Zootechnie par le Conseil des Recherches et Services Agricoles du Québec et par Approvisionnements et Services du Canada et grâce à des bourses d'études dont j'ai bénéficié de la part de la Fondation de l'Université Laval et des Fonds de la Formation de Chercheurs et Action Concertée. Je tiens à remercier tous ces organis mes pour leur appui financier.
AVANT-PROPOS
Cette thèse présentée à l'Ecole des Gradués de l'Université Laval pour 1'obtention du grade de Philosophiae Doctor (Ph.D.) a été rédi gée en partie sous forme d'articles acceptés pour publication (chapitres I et II). Ces articles ont été écrits en langue anglaise afin de satisfaire aux exigences des périodiques auxquels ils ont été soumis.
Cependant, le chapitre III a été rédigé de façon conventionnelle en français, de même que 1'introduction générale précédant 1'ensemble de ces chapitres. Celle-ci traite des notions nécessaires à la compréhension des différents sujets développés dans cet ouvrage. De plus, pour assurer la cohésion des différentes parties, chaque chapitre est précédé d'une courte introduction également écrite en français. Une conclusion générale résume, à la fin de la thèse, les points essentiels qui ont été soulevés dans les différentes parties.
Les références des ouvrages citées dans les chapitres ont été regroupées a la fin de chacun de ceux-ci alors que celles citées dans 1'introduction générale sont rassemblées dans la bibliographie à la fin de la thèse.
vi i
TABLE DES MATIERES
Page
RESUME... ii
REMERCIEMENTS ... iv
AVANT-PROPOS ... vi
TABLE DES MATIERES... vil ABREVIATIONS ... ix
INTRODUCTION ... 1
1. Les ot-glucosidases chez les organismes humains et animaux ... 1
1.1. Définitions: glycosidases et glucosidases .... 1
1.2. Spécificité et fonctions des ot-glucosidases .... 2
1.3. Rôles des ot-glucosidases... 3
1.4. Remarques sur la structure moléculaire des ot-glucosidases... 4
1.5. Mesure de l'activité de 1 'ot-glucosidase... 6
1.6. Origine cellulaire des ot-glucosidases... 6
1.7. Propriétés particulières aux ot-glucosidases acides ... 7
1.8. Purification des ot-glucosidases acides... 9
2. Physiologie épididymaire et maturation du spermatozoïde ... 13
2.1. Fonctions de 1 'épididyme... 15
2.1.1. Fonctions d'absorption ... 15
2.1.2. Fonctions de sécrétion ... 17
2.1.3. Fonctions d'accumulation ... 19
2.1.4. Définition d'une barrière sanguine épididymaire ... 20
2.2. Maturation des spermatozoïdes et influence de 1 ' épididyme... 20
2.2.1. Transformations intrinsèques aux spermatozoïdes épididymaires ... 20
viii
Page
2.2.2. Modifications physico-chimiques de la
membrane plasmatique ... 22
2.2.3. Interactions entre 11épididyme et la membrane du spermatozoïde ... 24
2.2.4. Intervention des glycosidases dans la maturation du spermatozoïde ... 25
CHAPITRE I: EFFET DE L'IMMATURITE PHYSIOLOGIQUE (CHEZ L'AGNEAU) OU INDUITE (CHEZ L'ADULTE) DES SPERMATOZOÏDES DE BELIER SUR L'ACTIVITE DE L'a-GLUCOSIDASE DU PLASMA SEMINAL... 28
Introduction ... 29
Article I... 31
CHAPITRE II: CONTRIBUTION MAJEURE DE L'EPIDIDYME AU CONTENU EN a-GLUCOSIDASE DU PLASMA SEMINAL DU BELIER .... 56
Introduction ... 57
Article II... 59
CHAPITRE III: PURIFICATION DE L'a-GLUCOSIDASE DU PLASMA SEMINAL DE BELIER... 77 Introduction ... 78 Matériel et méthodes ... 80 Résultats... 89 Discussion... 97 Références... 100
Légende des tableaux... 106
Légende des figures... 107
Liste des tableaux . ... 111
Liste des figures... 116
SOMMAIRE ET CONCLUSION ... 128
ABREVIATIONS Substrats BNG : 6-bromo-2-naphtyl-a-D-glycopyranoside MUG : 4-méthyl-umbelliféryl-a-D-glucopyranoside pNPG : p-nitrophényl-a-D-glucopyranoside Lectines ConA : Concanavaline A
RCA : Ricinus communis agglutinin
WGA : wheat germ agglutinin
Protéines et produits
ABP : androgen binding protein AMP cyclique : adenosine 35'-monophosphate BSA : albumine sérique bovine
B GG : gamma globuline bovine
DEAE : diéthylaminoéthyl
EDTA : acide éthylènediaminetétraacétique FMP : forward motility protein
GP G : glycérylphosphorylcholine
IgG
: immunoglobulineNP-40 : nonidet P-40
PBE SDS TCA TEMED Divers cm cpm h KDa pCi Ml mA mg ml mH min M p.s.i. V polybuffer exchanger sodium dodécyl sulfate acide trichloracétique tétraméthyléthylènediamine
degré celsius centimètre
coups par minute heure kilodalton microcurie microlitre milliampère milligramme millilitre millimolaire minute molaire
livre par pouce carré volt
INTRODUCTION
1. Les g-glucosidases chez les organismes humains et animaux.
1.1. Définitions: glycosidases et glucosidases.
Les glycosidases (EC 3.2) sont les enzymes agissant sur les composés glycosylés. On distingue les glycosides hydrolases (EC 3.2.1) et les glycosidases catalysant l'hydrolyse des composés N-glycosylés (EC
3.2.2)
ou S-glycosylés (EC3.2.3).
Les glycosidases agissent sur les substrats qui n'ont pas de groupes chargés positivement ni négativement ; de plus, les groupes déterminants sont des groupes hydroxyliques ou des atomes d'hydrogènes, de telle sorte que la spécificité est déterminée par 1'arrangement de ceux-ci incluant la configuration de chaque groupe -CHOH- (Discon et Webb, 1971). Les glycosidases (appelées aussi carbohydrolases) sont les enzymes qui catalysent l'hydrolyse des liens glycosidiques trou vés dans les simples glycosides, oligosaccharides et polysaccharides aussi bien que dans les complexes carbohydratés tels que les glycoprotéines et les glycolipides avec la libération de mono- ou oligosaccharides de poids moléculaires inférieurs à celui du substrat initial (Flowers et Sharon, 1979) . On distingue les exo- et les endoglycosidases suivant que le subs trat est hydrolysé à son extrémité ou à 1'intérieur de la molécule.Les a-glucosidases (a-D-glucosides glucohydrolases 3.2.1.20) sont des exoglycosidases catalysant la libération des résidus a-glucosylês des extrémités non réductrices de différents substrats ayant des liaisons a-glucosidiques (Matsui et Chiba, 1983a). La spécificité a leurs substrats diffère grandement avec la source d'enzyme. Le produit d'hydrolyse des a-glucosidases est 1'a-D-glucose (Florkin et Stotz, 1973; Chiba et coll., 1979; Chiba et coll., 1983) alors que celui des glucoamylases (a-l,4-D- glucan glucohydrolase 3.2.1.3) est le g-D-glucose (Hamauzu et coll., 1965 ; Ono et coll., 1965). Les a-glucosidases ont deux activités maltasique et glucoamylasique (Hers, 1963; Torres et Olavarria 1964; Auricchio et Bruni, 1967; Auricchio et coll., 1968). Cependant, en général, l'activité hy drolytique de l'a-glucosidase vers les a-glucanes est appelée activité
glucoamylasique, et celle vers le maltose, activité maltasique (Matsui et Chiba, 1983b). Par leur pH optimum, on distingue les a-glucosidases aci des (pH 3 à 5) et neutres (pH 6 à 7) (Rosenfeld, 1975) .
1.2. Spécificité et fonctions des a-glucosidases.
Les a-glucosidases acides dégradent tous les a-glucosyl disac- charides, le glycogène et les a-glucosides alors que les a-glucosidases neutres semblent plus spécifiques pour les liaisons a-1,4-(Torres et Olavarria, 1964 ; de Burlet et Sudaka, 1977 ; Reiss et Sacktor, 1981). Ainsi, la reconnaissance des liaisons a-l,4-(maltose), a-1,6-(isomaltose) et son activité glucoamylasique permet aux a-glucosidases acides de dégra der totalement le glycogène en a-D-glucose (Jeffrey et coll., 1970a; Palmer, 1971b) mais 1'a-glucosidase neutre du foie humain, par exemple, ne peut hydrolyser le glycogène (Brown et Brown, 1965) .
On attribue aussi aux a-glucosidases la fonction de catalyser plusieurs réactions de transglucosylation (Giri et coll., 1955 ; Hers, 1963; Torres et Olavarria, 1964; Gaffai, 1977) mesurés par la synthèse de polysaccharides à partir du maltose (donneur) et du glucose-^C (accep teur) ou du glycogène (donneur) et du maltose-"^C (accepteur). Cette activité peut être aussi évaluée par chromatographie sur papier (Yamasaki et Suzuki, 1979) . Puisque 11 augmentation de 1'activité transglucosidasique est parallèle à celle de 11 activité hydrolytique pendant la purification, Jeffrey et coll. (1970a) concluent que 1'activité transglucosidasique et hydrolytique est une propriété intrinsèque des a-glucosidases. L'inhibi tion de 1'activité hydrolytique des a-glucosidases en présence d'un excès de maltose peut être due a une concentration trop élevée en glucose (le glucose inhibe l'activité) ou à des réactions naissantes de transglucosy lation (Dahlqvist, 1961). Cette activité glucosyl transférasique est cependant plus prononcée dans le cas de 1'a-glucosidase neutre par rapport à l'acide (Torres et Olavarria, 1964).
En résumé, les a-glucosidases sont connues pour effectuer le transfert d'unités de carbohydrates à des macromolécules contenant des
sucres (glycoprotéines) , de servir comme des récepteurs de glucose et de scinder les glucosides et les polysaccharides (Palmer, 1971b ; Hansen, 1975 ; Gaffai, 1977; Michael et Kornfeld, 1980). Ainsi, les a-glucosidases peuvent être impliquées dans les modifications des chaînes oligosacchari diques des glycoprotéines (Elting et coll., 1980; Carrol et McCrorie, 1981; Peyrieras et coll., 1983).
1.3. Rôles des a-glucosidases.
En plus de la voie phosphorolytique, la glycogénolyse peut se produire dans les tissus animaux par le clivage hydrolytique des extrémi tés non réductrices des polysaccharides en glucose (Rosenfeld et Popova, 1962; Devos et Hers, 1980). Ainsi, 11 activité de l'a-glucosidase est supérieure à celle de la phosphorylase dans le foie du rat et de la carpe (Murat et coll., 1978).
Les a-glucosidases neutres ont un rôle dans la voie glucolytique du métabolisme cellulaire normal (Rutloff et coll., 1967; Castilla et coll., 1978) alors que les a-glucosidases acides, à faible activité dans les conditions physiologiques, ont un rôle dans le processus de digestion, d'autolyse et de nécrose intracellulaire (de Duve, 1963). Prësumêment, le rôle métabolique de ces enzymes, dont les activités sont plus prononcées sous des conditions acides, est de convertir leur substrat, le glycogène, qui pénètre dans les lysosomes par autophagie (Hers et de Barsy, 1973), en unités monomériques (Hers, 1963), de telle sorte que celles-ci puissent à nouveau devenir disponibles a la cellule pour des réactions biosynthéti ques et pour fournir de 1 ' énergie (de Duve, 1963; de Duve et Wattiaux, 1966 ; Coffey et de Duve, 1968 ; Aronson et de Duve, 1968) .
L'a-glucosidase acide a particulièrement été étudiée au regard de la maladie de Pompé (ou glycogénose, type II): C'est un désordre auto somal récessif caractérisé par 1'accumulation de glycogène dans tous les tissus (Hers, 1963), particulièrement dans les lysosomes (Baudhuin et coll., 1964). Chez l'enfant, la maladie se traduit par une hypertrophie du coeur et une faiblesse musculaire et la mort survient au cours de la
première année (di Sant'Agnese et coll., 1950); chez le patient adulte, on n'observe pas d'organomégalie et l'hypotonie est le trait clinique prédo minant (Hudgson et coll., 1968), il peut vivre au-delà de 50 ans (Koster et coll., 1976). L'accumulation de glycogène est due à une déficience en a-glucosidase (Hers, 1963), particulièrement en a-glucosidase acide (Palmer, 1971a), absente dans le foie et le muscle (de Barsy et coll., 1972; Murray et coll., 1978), le coeur (Smith et coll., 1966), le cerveau et le pancréas (Steinitz et Rutenberg, 1967), dans l'urine (Schram et coll., 1979) et dans les leucocytes (Dreyfus et Poenaru, 1978), alors que l'a-glucosidase neutre demeure active (Soyama et coll., 1977; Bertagnolio et coll., 1978; Dreyfus et Poenaru, 1978; Shanske et Dimauro, 1981). Des travaux récents réalisés sur le muscle (Ninomiya et coll., 1983) et dans les fibroblastes (Beratis et coll., 1978) prouvent cependant que 1'a-glu cosidase acide est présente chez les patients atteints de cette maladie, mais son activité est réduite. Walvoort et coll. (1984) démontrent, chez le chien Lapland atteint de la maladie, qu'une mutation génique et struc turale post-transcriptionnelle serait responsable de l'inactivité cataly tique de 1'a-glucosidase.
1.4. Remarques sur la structure moléculaire des a-glucosidases.
Les a-glucosidases sont des glycoprotéines (voir Callahan et Lowden, 1981). Elles sont synthétisées en une protéine monomérique modi fiée au niveau post-translationnel en poids moléculaire plus bas, prêsumé- ment par clivage protéolytique (Hasilik et Neufeld, 1980). Le précurseur de l'a-glucosidase acide a un poids moléculaire plus élevé que celui de la forme mature (Neufeld, 1981). Cette dernière a une demi-vie plus longue et une activité plus grande avec son substrat, probablement à cause d'un empêchement stérique chez le précurseur; il y aurait une conversion du précurseur lors de la maturation qui exposerait les déterminants stéri ques. Dans l'urine (Oude Elferink et coll., 1984), à la différence du précurseur, la forme mature ne contient pas de mannose-6-phosphate, lequel serait enlevé du précurseur pendant la maturation.
Palmer (1971b) et Jeffrey et coll. (1970b) proposent 2 sites actifs catalytiques dans l'a-glucosidase acide; l'enzyme neutre aurait 2
sites avec une partie commune (de Burlet et Sudaka, 1977). L'a-glucosidase acide du foie de boeuf aurait aussi 2 sites actifs puisque le tréhalose compétitionne avec l'amidon mais n'inhibe pas l'hydrolyse du maltose (Sica et coll., 1971); de plus, 1'activité glucoamylasique est plus thermolabile que 1'activité maltasique. Dans le cas de l'a-glucosidase acide du foie humain, le glycogène a un effet d'inhibition compétitive sur l'hydrolyse d'un substrat synthétique, alors que le maltose exerce une inhibition non compétitive; Koster et Slee (1977) concluent que cet enzyme aurait de même 2 sites catalytiques, 1 pour le glycogène et 1 pour le maltose, interagis sant sur l'autre. Matsui et Chiba (1983b) suggèrent au contraire que les molécules d'a-glucosidases acides du foie de porc n'auraient qu'un seul site actif. En effet, la vitesse initiale d'hydrolyse de 2 substrats (le maltose et le glycogène) est inférieure à la somme des vitesses initiales pour hydrolyser chacun d'entre eux, démontrant que l'enzyme hydrolyserait ces 2 substrats de façon compétitive; de plus, la vitesse maximale change constamment avec la proportion des 2 substrats sans maximum ni minimum.
Les sites actifs ont présumément la même structure chez diffé rentes espèces, il faut donc s'attendre à ce que les anticorps spécifiques ne soient pas dirigés contre les sites catalytiques (Cinader, 1968). De plus, les substrats de faibles poids moléculaires (maltose) peuvent être hydrolysés en présence d'anticorps (Schram et coll., 1979) alors que les grosses molécules (glycogène) ne peuvent atteindre le site a cause de 1'encombrement stérique (de Barsy et coll., 1972; Murray et coll., 1978).
Les anticorps monoclonaux de l'a-glucosidase acide du placenta humain ne réagissent pas contre la protéine native mais réagissent contre l'a-glucosidase pure dénaturée (2 isoformes et des produits de dégrada tion) (Hilkens et coll., 1982) suggérant que ces formes dénaturées expose raient les déterminants stériques.
Enfin, 1'acétylation de l'a-glucosidase acide de sarrasin permet à Kanaya et coll. (1978) de suggérer la présence de résidus tyrosyl logés près ou dans certains sous-sites de l'enzyme et que des groupes sulfhy- dryls seraient localisés très près du site catalytique.
1.5. Mesure de l'activité de 1'a-glucosidase.
L'activité de 1'a-glucosidase est évaluée par la mesure de la quantité de substrat hydrolysé ou celle des produits libérés par catalyse hydrolytique dans les conditions optimales (pH optimum, substrat à concen tration saturante, incubation chronométrée à 37°C). Les substrats les plus couramment utilisés sont naturels (maltose, glycogène) ou synthéti ques: le 4-méthyl-umbelliféryl-a-D-glucopyranoside (MUG), le 6-bromo-2- naphtyl-a-D-glucopyranoside (BNG) ou le p-nitrophényl-a-D-glucopyranoside (pNPG). Lorsque le maltose ou le glycogène est employé, le glucose libéré est mesuré avec 1'ortho-toluidine (Franzini et Bonini, 1967) ou enzymati- quement par la glucose-oxydase (Dahlqvist, 1974) ou 1 'hexokinase/glucose- 6-phosphate déshydrogénase (Bergmeyer et coll., 1974) . Le méthyl-umbelli- férone libéré du MUG est mesuré par fluorométrie alors que le p-nitrophé- nol libéré du pNPG ou le bromonaphtol libéré du BNG et précipité sont quantifiés par spectrophotométrie. L'affinité pour le substrat est va riable selon la source d'enzyme. Par exemple, 1'a-glucosidase acide de 1'intestin humain a plus d'affinité vers les substrats naturels à 1’inver se de l'enzyme neutre (Castilla et coll., 1980) alors que 1'a-glucosidase acide du foie de rat a plus d'affinité vers les substrats synthétiques a 1'inverse de 1'a-glucosidase neutre du même tissu (Murat et coll., 1978).
1.6. Origine cellulaire des a-glucosidases.
L'origine lysosomale des a-glucosidases acides a été prouvée par plusieurs auteurs: soit par centrifugation différentielle des particules subcellulaires (Lejeune et coll., 1963; Torres et Olavarria, 1964 ; Illingworth et Brown, 1965; Sorts et Dimond, 1981), soit par immunohisto chimie (Iwamasa et coll., 1982b; Ninomiya et coll., 1982). Les a-glucosi dases neutres ne sont pas localisées dans les lysosomes (Takano et coll., 1983). Elles sont d'origine microsomales (Lejeune et coll., 1963 ; Illingworth et Brown, 1965; Brown et Brown, 1965; Hamada, 1981; Borts et Dimond, 1981). Castilla et coll. (1978) démontrent que 1'a-glucosidase neutre du foie de rat est liée au réticulum et proche de la distribution du glycogène particulaire ; Siting et coll. (1980) localisent l'enzyme neu tre de 1'oviducte de poule sur le réticulum endoplasmique rugueux. Enfin
chez les organismes unicellulaires, 1'a-glucosidase neutre a été identi fiée comme un enzyme membranaire intracellulaire (Carrol et McCrorie, 1981; Opperdoes et Steiger, 1982).
1.7. Propriétés particulières aux a-glucosidases acides.
Effets propres aux dextrans.
Les a-glucosidases acides sont généralement adsorbées sur gel dextran facilitant leur séparation des autres protéines de même poids moléculaire (Auricchio et Bruni, 1967). Un phénomène d'adsorption se com bine a l'effet de charge du dextran (Flodin, 1962) et le "retard" s'expli que par la faible activité dextranasique de l'a-glucosidase (Rosenfeld,
1964).
Il y a une interaction spécifique avec les liaisons a-1,6- du gel servant de substrat pour l'enzyme (Bruni et coll., 1969). Avec 1'a-glucosidase acide de la rate de porc, Preobrazhenskaya et Rosenfeld (1972) démontrent que les liens a-1,6- et a-1,3- des dextrans sont scindés presque complètement, alors que les liens a-1,2- le sont avec beaucoup plus de difficultés.
Certains auteurs ont utilisé le dextran en chromatographie d'af finité en éluant avec 25 mM de maltose (de Barsy et coll., 1972; Beratis et coll., 1980; Chamber et William, 1983) ou de méthyl a-D-glucopyranoside (Belenky et Rosenfeld, 1975) qui agissent en compétition avec le dextran sur l'a-glucosidase. L'a-glucosidase neutre est peu active vers le dex tran (Lieberman et Eto, 1956), donc faiblement adsorbëe, laissant la possibilité de séparer l'enzyme neutre de l'acide dans le foie de rat (Auricchio et Bruni, 1967) ou chez l'humain, dans le coeur, le foie, le rein, l'urine et le muscle (Soyama et coll., 1977).
Activation par les métaux alcalins Na+, K+ et Mg++.
Les a-glucosidases acides sont généralement activées par les mé taux alcalins Na+, K+ et Mg++ jusqu'à 0.2M (Palmer, 1971a; Chamber et
Williams, 1983). Cette activation est plus marquée aux pH acides (Matsui et Chiba, 1983b). La présence de ces ions permet de stabiliser l'activité enzymatique (Auricchio et coll., 1963), phénomène pouvant être accentué par la présence d'une autre protéine agissant comme protection (de Barsy et coll., 1972). L'activation par le KC1 semble propre a l'ion potassium et non a l'ion chlore (Jeffrey et coll., 1970a) puisque 1'activité enzyma tique diminue dans les concentrations élevées d'histidine HCl et que 1'ac tivation en présence de KC1 est identique à celle mesurée en présence de KBr, Kl ou K^SO^. L'effet d'activation par l'ion K+ est si prononcé à pH acide que le catabolisme intralysosomal du glycogène in vivo pourrait être régularisé dans une certaine mesure par des changements de pH et/ou de concentration de sel à 1'intérieur de 1'organelle (Jeffrey et coll., 1970a).
L'activité de 1'a-glucosidase neutre n'est pas augmentée par le KC1 (Fluharty et coll., 1973), elle peut être même faiblement inhibée (de Burlet et Sudaka, 1977). Les ions Mn++ et Mg++ inhibent l'enzyme neutre chez bacillus cereus (Suzuki et coll., 1982). Ces propriétés différen tielles sont appliquées pour mesurer sélectivement les a-glucosidases acide ou neutre (Soyama et coll., 1977; Kochmann et coll., 1983) .
Inhibition par le turanose (3-fructose-a-D-glucoside).
Le turanose est connu comme un inhibiteur spécifique des a-glu cosidases lysosomales de mammifère (Hers, 1963; Lejeune et coll., 1963; Illingworth et Brown, 1965; Auricchio et Bruni, 1967; de Barsy et coll., 1972). L'inhibition de 1'a-glucosidase acide par le turanose a été rap portée dans le foie de boeuf (Bruni et coll., 1969), de rat (Jeffrey et coll., 1970b) et de porc (Matsui et Chiba, 1983b) et chez l'humain dans 1'intestin (Castilla et coll., 1980) et le coeur (Chamber et Williams,
1983).
L'a-glucosidase neutre est peu inhibée par le turanose (Fluharty et coll., 1973). Celui-ci semble 1'activer mais cette augmentation d'ac tivité peut être due à une suppression de compétition des 2 enzymes avec
le même substrat, laquelle survient à pH neutre sans turanose. L'effet opposé du turanose sur 1'a-glucosidase acide ou neutre est utilisé pour mesurer l'une ou l'autre avec plus de sélectivité (Kochmann et coll., 1983). Giudicelli et coll. (1980) utilisent le turanose pour prévenir 1 'inactivation de l'a-glucosidase neutre du rein de cheval lors de sa pu rification.
Autres propriétés.
L'a-glucosidase neutre est souvent plus thermolabile que l'en zyme acide (Auricchio et Bruni, 1968; Fluharty et coll., 1973; Chan et Li, 1981; Hamada, 1981; Poemaru et coll., 1981). Elle semble aussi moins sta ble à la congélation que 1'a-glucosidase acide (Shin-Buehring et coll., 1978). La stabilité de 1'activité en fonction du pH varie suivant la source d'enzyme: chez l'abeille, 1'a-glucosidase acide est stable entre pH 5 et pH 10 (Takewaki et coll., 1980) alors que celle de la semence de riz ne l’est qu'entre pH 4 et pH 5.5 (Yamasaki et Suzuki, 1979). L'enzyme neutre du fluide amniotique humain est détruite à pH 5 (Butteworth et Broadhead, 1977) alors que celui du rein humain est plus stable aux varia tions de pH (de Burlet et Sudaka, 1977) .
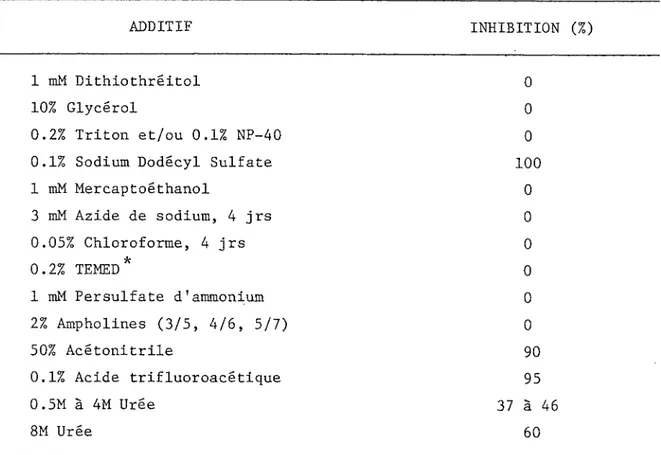
L'érythritol semble inhiber 1'a-glucosidase acide (Kelemen et Welan, 1966; Auricchio et Bruni, 1968). Par contre, 1'EDTA (acide ëthy- lènediaminetétraacétique) semble 1'activer (Chan et Li, 1981) mais inhiber 1'enzyme neutre (Suzuki et coll., 1982). Enfin, 1'a-glucosidase neutre n'est pas inhibée en présence de SDS (Sodium Dodecyl Sulfate) (Maestracci et coll., 1975) sauf à pH acide (Flanagan et Frostner, 1978). Le SDS a été utilisé par Faquin et coll. (1984) comme inhibiteur sélectif de 1'a-glucosidase acide des organes reproducteurs humains.
1.8. Purification des a-glucosidases acides.
Les méthodes classiques d'isolation de protéines, incluant les solubilités différentielles, la liaison à des adsorbents ou des échangeurs d'ions, et la cristallisation ont toutes été appliquées aux glycosidases,
mais seulement un nombre limité de ces enzymes a été purifié jusqu'à ré cemment. Ces méthodes sont habituellement laborieuses et demandent l'em ploi de grands volumes d'échantillon brut ne contenant que de faibles quantités d'enzyme désiré. La lyophilisation et la concentration répétées des solutions sont nécessaires alors que les enzymes ne sont pas toujours stables à de tels traitements surtout que, par exemple, la congélation et la décongélation conduisent souvent à une dénaturation considérable. De plus, le rendement obtenu avec ces procédures est bas (Ginsburg, 1972). Même si les préparations apparaissent pures, l'examination par gel d'électrophorèse ou focalisation isoélectrique les révèlent non homogènes.
Certaines glycosidases ont été davantage purifiées par gel d'électrophorèse et/ou focalisation isoélectrique préparative. Apparem ment les bandes multiples révélées souvent en utilisant ces techniques ne
sont pas toujours dues à des impuretés enzymatiquement inactives. En fait plusieurs glycosidases, particulièrement celles d'origine lysosomales, ont des isozymes avec de légères différences dans leur charge dues à des subs titutions d'acides aminés ou des différences dans la partie glycosylée pour les enzymes qui sont des glycoprotéines (Mikhailov et coll., 1978; Flowers et Sharon, 1979).
Au cours des 15 dernières années, des progrès significatifs ont été faits dans la purification de "matériel biologique" par l'emploi de chromatographie d'affinité et ceux-ci sont discutés en détail dans un grand nombre d'articles de revue (Cuatrecasas et Anfinsen, 1971; Tukova, 1974; Wilchek et Hexter, 1976). Le premier enzyme ainsi purifié fut la tyrosinase (Lerman, 1953) mais un nombre considérable de glycosidases a été maintenant isolé par cette technique. La connaissance de la spécifi cité d'une glycosidase, qui peut être déduite d'études à partir de préparations brutes, indique le genre de ligand qui convient pour sa puri fication. La chromatographie d'affinité est souvent simple et rapide, les conditions sont douces, le nombre d'étapes impliquées dans la purification est limité, et les rendements globaux sont élevés. En dehors des avan tages techniques de cette méthode, incluant la possibilité d'extraire des petites quantités d'enzyme de milieux contenant de grandes quantités de
contaminants ayant les mêmes propriétés, il y a aussi un effet stabilisant de la matrice sur l'enzyme. La liaison avec le site actif stabilise en effet la structure tertiaire de la protéine et la protège de la dénatura tion .
Les colonnes d'affinité ont été préparées en liant des subs trats, ou par préférence des inhibiteurs des enzymes désirés, de façon covalente, à des supports insolubles; le Sépharose 4B ou 6B et du poly acrylamide sont communément utilisés. A un pH approprié, l'enzyme est lié de façon non covalente au ligand spécifique alors que tout autre matériel est élue avec le tampon. Puis soit le pH est changé, soit un substrat ou un inhibiteur compétitif est ajouté sur la colonne et déplace l'enzyme lié. La présence d'enzyme résiduel adhérant a la colonne peut être détec tée par 1'addition d'un substrat chromophorique, comme le pNPG, qui développe une couleur jaune brillant en présence d'activité glycosidasique laissée sur la colonne. Dans certains cas cependant, une adsorption non- spécifique de 1'enzyme peut se produire sur la colonne d'affinité, augmen tant les difficultés de le séparer des autres protéines.
Puisque beaucoup de glycosidases sont des glycoprotéines, elles peuvent être partiellement purifiées en les liant à des colonnes de lec tines puis en éluant avec des sucres spécifiques. Ainsi les isoenzymes de la g-galactosidase du foie humain ont été purifiés plus de 40 fois (Miller et coll., 1976) sur des colonnes de Concanavaline A Sépharose.
Les a-glucosidases acides peuvent être purifiées par une procé dure simple en 2 ou 3 étapes résultant en un enzyme homogène en électro phorèse. En général, 1'extrait brut est d'abord précipité avec du sulfate d'ammonium. La deuxième étape est une filtration sur gel, utilisée comme chromatographie d'affinité. Tel que montré en premier par Auricchio et Bruni (1967), 1'a-glucosidase acide se lie au dextran qui contient les liaisons a-l,6-glucosidiques. Ainsi, l'enzyme est adsorbé quand il est chromatographié sur un matériel contenant du dextran comme le Sêphadex ou le Séphacryl. C'est une étape déterminante qui est souvent utilisée comme il est mentionné dans le tableau I. La troisième étape, lorsqu'elle est
nécessaire, consiste en une échangeuse d'ions ou une chromatographie d'af finité sur Concanavaline A Sépharose-4B puisque les a-glucosidases acides sont des glycoprotéines, comme d'autres enzymes lysosomales (voir Callahan et Lowden, 1981). Les rendements en fin de purification se situent autour de 15% variant de 2.4% (Oude Elferink et coll., 1984) à 40% (Murray et coll., 1978).
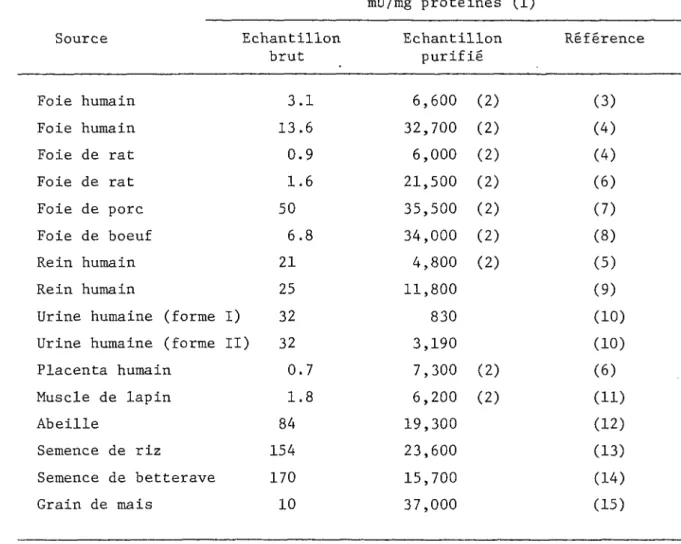
TABLEAU I: Exemples de purifications d'a-glucosidases acides.
mU/mg protéines (1)
Source Echantillon Echantillon Référence
brut purifié Foie humain 3.1
6,600
(2) (3) Foie humain 13.6 32,700 (2) (4) Foie de rat 0.96,000
(2) (4) Foie de rat 1.6 21,500 (2) (6) Foie de porc 50 35,500 (2) (7) Foie de boeuf6.8
34,000
(2) (8) Rein humain 214,800
(2) (5) Rein humain 25 11,800 (9)Urine humaine (forme I) 32
830
(10)Urine humaine (forme II)
32
3,190
(10)Placenta humain 0.7
7,300
(2) (6) Muscle de lapin 1.86,200
(2) (11) Abeille 8419,300
(12) Semence de riz 15423,600
(13) Semence de betterave 170 15,700 (14) Grain de mais 1037,000
(15)(1) Une milli-unité d'a-glucosidase est la quantité d'enzyme catalysant l'hydrolyse de 1 nmole de substrat par min à 37 C; (2) Enzyme adsorbé sur gel dextran; (3) Rester et coll. (1976); (4) Murray et coll. (1978); (5) Auricchio et coll. (1968) ; (6) de Barsy et coll. (1972); (7) Matsui et Chiba (1983a) ; (8) Bruni et coll. (1969) ; (9) Minamiura et coll. (1982); (10) Oude Elferink et coll. (1984); (11) Palmer (1971a); (12) Takewaki et aoll. (1980); (13) Yamasaki et Suzuki (1979); (14) Yamasaki et Suzuki (1980); (15) Matsui et coll. (1981).
Il ressort du tableau I que les oi-glucosidases acides purifiées ont une activité spécifique variant autour d'une moyenne de 10,000 mU/mg protéines. Par conséquent, dans le plasma séminal brut de bélier, l'acti vité étant de 1 mU/mg protéines en moyenne, il faudra purifier 10,000 à 15,000 fois pour obtenir 1'a-glucosidase acide pure. De plus, étant donné que le plasma séminal brut contient 40 mg/ml de protéines, il faudrait en utiliser 250 ml pour obtenir 1 mg d'enzyme pure sans perte (rendement de 100%) . L'étude de la purification de 1'a-glucosidase acide du plasma sémi nal de bélier sera l'objet du chapitre III de cette thèse.
2. Physiologie épididymaire et maturation du spermatozoïde.
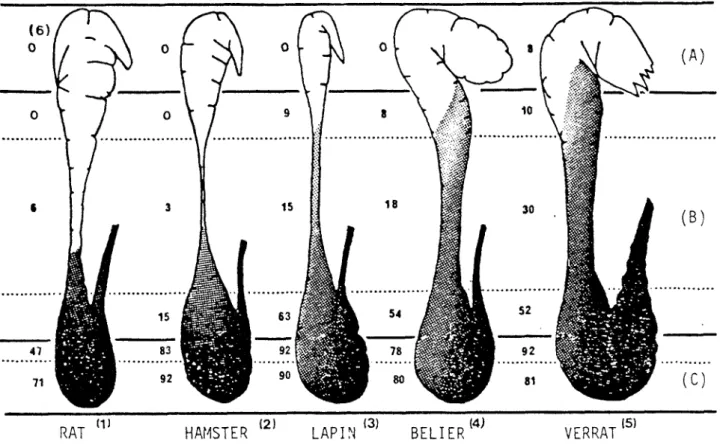
L'épididyme joue un rôle fondamental dans la physiologie de la reproduction des mammifères. Non seulement il véhicule les spermatozoïdes testiculaires mais il est indispensable à l'apparition du pouvoir fécon dant des gamètes. Une fois libérés des tubes séminifères, les spermato zoïdes sont rapidement transportés à travers le rete testis et le ou les canaux efférents dans l'épididyme, où ils subissent plusieurs changements biophysiques et biochimiques, acquérant une motilité progressive et la capacité de féconder un ovule. Ce phénomène, appelé maturation du sperma tozoïde, fut observé en premier par Young (1931) chez le cochon d'Inde puis confirmé chez d'autres espèces telles que le rat (Blandau et Rumery, 1964), le lapin (Bedford, 1966; Orgebin-Crist, 1967; Paufler et Foote, 1968), le taureau (Igloeli et Foote, 1968), le verrat (Hunter et coll., 1976) , le bélier (Fournier-Delpech et coll., 1977a, 1979) et l'homme (Hinrichsen et Blaquier, 1980). Le segment exact de l'épididyme où le spermatozoïde acquiert sa maturité fonctionnelle complète varie d'une es pèce à l'autre (Fig. 1, Dacheux, 1980). En général, pour que les sperma tozoïdes soient capables de fertiliser un ovule, il est nécessaire qu'ils aient atteint le corps distal. De plus, il peut être conclu que la matu ration épididymaire du spermatozoïde est un phénomène graduel où les gamè tes deviennent d'abord mobiles et développent subséquemment leur pouvoir de fécondation.
14
Fig. 1: Comparaison de la fécondance des spermatozoïdes de différentes régions épididymaires chez les mammifères. (A) région antérieu re de 1'ëpididyme; (B) région médiane; (C) région postérieure. Les spermatozoïdes fécondants sont présents dans les zones om bragées .
(1) Dyson et Orgebin-Crist, 1973; (2) Horan et Bedford, 1972; (3) Bedford, 1966 ; Orgebin-Crist, 1967; (4) Fournier-Delpech et coll., 1979; (5) Holtz et Smidt, 1976 ; les valeurs alignées sous le chiffre 6 correspondent au % de fécondation.
L'épithélium du tubule épididymaire présente de nombreuses fonctions variant selon les différentes zones de cet organe. Ces activi tés cellulaires se traduisent principalement par l'élaboration d'un milieu intra-tubulaire constituant le liquide environnant les spermatozoïdes lors de leur passage dans 1'épididyme. Le milieu épididymaire contient les facteurs nécessaires à la maturation des spermatozoïdes dans cet organe (Bedford, 1975 ; Orgebin-Crist et coll., 1975). Dans cette synthèse, se ront exposées les principales fonctions de 1'épididyme ainsi que la matu ration des spermatozoïdes et 1'influence de 1'épididyme.
2.1. Fonctions de l'épididyme.
L1 épithélium épididymaire possède principalement des fonctions d'absorption et de sécrétion. Ces fonctions ont pu être précisées récem ment par 1'utilisation de techniques de microponctions et de microanalyses du fluide épididymaire, techniques empruntées à la physiologie rénale.
2.1.1. Fonctions d'absorption.
La plus grande partie du fluide provenant du testicule est absorbée dans 1'épididyme. Chez de nombreuses espèces (verrat, taureau, cheval, hamster), 99% du liquide est absorbé dans la région antérieure de 1'organe (Grabo et Gustafson, 1964 ; lessee et Howard, 1976; Whelan et Brackett, 1979). Chez le rat, par contre, cette absorption se fait non seulement dans la région antérieure (55%) mais également dans la région postérieure de 1'épididyme (45%) (Levine et Marsh, 1971; Howards et coll., 1975 ; Turner et coll., 1977 ; Hinton et coll., 1979).
En considérant les différences de longueur du canal épididymaire mais aussi les différences de débit du fluide testiculaire, la capacité d'absorption de 1'épithélium épididymaire par unité de longueur est sensi blement identique chez les différentes espèces considérées (Tableau II) . La constance du temps de transit épididymaire, quelque soit la longueur du tube, suggère qu'un certain délai est nécessaire pour la maturation des gamètes. Des spermatozoïdes retenus dans la région antérieure de l'ëpidi- dyme ne deviennent cependant pas fertiles (Bedford, 1975; Orgebin-Crist et coll., 1975).
L'absorption hydrique est dépendante du transport transépithé lial des ions sodium (Wong et Yeung, 1978; Wong et coll. , 1979). Chez toutes les espèces étudiées, la concentration sodique dans le milieu tubu laire diminue le long de l'épididyme (White, 1973; lessee et Howard, 1976; Turner et coll., 1977; Jenkins et coll., 1980) . Cette variation sodique entraîne une diminution d'un facteur 10 du rapport Na/K entre la région antérieure et postérieure de 1'épididyme (White, 1973; lessee et Howard,
1976) . Le transfert sodique pourrait être couplé à une sécrétion potassi que (Au et coll., 1978) mais la quantité globale d'ions sodium-potassium dans le fluide diminue entre la région antérieure et postérieure de l'épi- didyme (Crabo et Gustafson, 1964). Les enzymes impliqués dans un tel transport ionique sont présents dans 1'épithélium (Martan, 1969 ; Cohen et coll., 1976; Goyal et Hrudka, 1980; Goyal et coll., 1980), mais la locali sation cellulaire du transport sodique et hydrique est imprécise. Chez le taureau, ce transport pourrait être attribué aux cellules non ciliées du vas efférent (Goyal et Hrudka, 1980; Goyal et coll. , 1980) et chez le rat, aux cellules apicales et claires de 1'ensemble de l'épithélium (Moore et Bedford, 1979a, b).
TABLEAU II: Caractéristiques épididymaires et testiculaires de quelques
Especes
mammifères (Amman, 1970 ; Vaissaire, 1977; Setchell,
1978).
Longueur de 1'épididyme (m) Durée de transit (J) Débit du fluide testiculaire entrant (ml/h) Absorption ( 1/h/m) Homme 6-7 12 - -Rat 2-3
9-10
0.01-0.06 20 Lapin 2-2.5 9-12 0.02-0.15 44 Verrat 55-60 9-14 2-3 36 Taureau35-50
9-13 1-248
Bélier 40-60 12-15 1-2 25Cette activité d'absorption est hormono-dépendante. Elle est réduite en cas de déficience androgénique (Jones et Glover, 1973; Wong et Yeung, 1977a), et maintenue en présence d'hormone surrénalienne (Au et coll., 1978). Elle est également diminuée en présence d'inhibiteurs méta boliques, en particulier avec 1'a-chlorohydrine (Wang et Yeung, 1976 ; 1977b) .
En plus de 1'absorption hydrique, des absorptions de particules par 1'épithélium ont été mises en évidence depuis quelques années. Cette
absorption se fait par pinocytose dans les cellules contenant des corps multivêsiculaires (Nicander, 1970; 1979). Cette activité épithéliale pourrait être à l'origine de la disparition de protéines du milieu épidi- dymaire, en particulier la protéine liante des androgènes (Androgen Bind ing Protein) d'origine testiculaire (Hansson et coll., 1975; Jegou et coll., 1979). Le nombre de protéines éliminées du fluide épididymaire va rie selon les espèces de 3 chez le lapin (Johnson et Hunter, 1979) à 20 chez le cheval (Whelan et Brackett, 1979). Toutefois, ces estimations sont liées aux techniques utilisées. L'élimination de ces protéines épi- didymaires peut être due à une absorption ou provoquée par une hydrolyse enzymatique, un masquage de sites antigéniques ou par adsorption sur les spermatozoïdes (Johnson et Hunter, 1979).
La diminution lors du transit épididymaire de quantités impor tantes d'inositol, d'origine testiculaire, pourrait être provoquée par une absorption de cette molécule par l'épithélium épididymaire, principalement dans la région caudale (Voglmayr et Amann, 1973; Hinton et coll., 1980). Le même phénomène est constaté pour des sécrétions ëpididymaires telles que la glycérylphosphorylcholine et la phosphorylcholine (Hinton et Setchell, 1980b). Enfin, concernant les stéroïdes entrant dans l'épidi- dyme par la voie du fluide testiculaire, ils sont éliminés presque totale ment dès la région antérieure de l'épididyme et moins de 1% est retrouvé dans le fluide sortant de cet organe (Ganjam et Amann, 1976; Jegou et coll., 1979).
L'absorption de spermatozoïdes au cours du transit épididymaire est peu importante et n'est observée histologiquement qu'après obstruction du canal épididymaire (Bedford, 1975) .
2.1.2. Fonctions de sécrétion.
L'activité sécrétoire de l'épididyme décrite chez toutes les espèces étudiées y compris l'homme (Brown-Woodman et coll., 1980) consiste dans la production de glycérylphosphorylcholine (GPC) (Dawson et Rowlands, 1959; Brooks et coll., 1974; Hinton et Setchell, 1980b). Cette sécrétion
de GPC est plus active dans la région antérieure de l'épididyme que dans la partie postérieure. Elle est attribuée aux cellules principales de l'épithélium (Killian et Chapman, 1980). La GPC provient de l'hydrolyse des lêcithines par la phospholipase A, androgéno-dépendante, présente dans les cellules (Beck, 1980). La concentration de GPC dans le fluide épididymaire est très élevée dans la région caudale: 60 mM chez le lapin (Jones et Glover, 1973) et 40 à 50 mM chez le rat (Brooks et coll., 1974; Hinton et Setchell, 1980b). L'épithélium épididymaire pourrait également synthétiser et sécréter de l'inositol (Robinson et Fritz, 1979); toutefois cette activité ne semble exister que chez le rat (Hinton et coll. , 1980) .
L'activité la plus étudiée ces dernières années est la biosyn thèse de protéines spécifiques par l'épithélium épididymaire. Plusieurs de ces protéines présentes dans le fluide épididymaire ont été décrites par de très nombreux auteurs (Schellpfeffer et coll., 1976; Whelan et Brackett, 1979; Moore, 1980; Jones et coll., 1982; Brooks, 1983; Flickinger, 1983). Leur nombre et leur lieu de synthèse dans l'épididyme varie selon les espèces mais aussi selon les techniques employées. Les synthèses ont été localisées par des méthodes immunohistochimiques (Lea et coll., 1978; Garberi et coll., 1979; Faye et coll., 1980; Goyal et coll., 1980; Kohane et coll., 1980a; Moore, 1980) ou par séparation cellulaire
(Killian et Chapman, 1980; Klinefelter et Amann, 1980).
La présence d'androgène (testostérone) dans le milieu sanguin est nécessaire à la synthèse de ces protéines spécifiques (Cameo et Blaquier, 1976; Brooks et Higgins, 1980; Jones et coll., 1980a; Fournier- Delpech et coll., 1981; Jones et coll., 1982; Kohane et coll., 1983; Iusem et coll., 1984). Cependant, l'activité sécrétoire du segment initial est dépendante de la présence de fluide testiculaire dans la lumière du tube (Fawcett et Hoffer, 1979; Jones et coll., 1980a,b) et probablement des stéroïdes qu'il contient (Waites, 1977).
Des acides sialiques sont également sécrétés dans le fluide épididymaire de beaucoup d'espèces (Fournier-Delpech, 1966; Peyre et Laporte, 1966). Il est probable qu'ils soient produits par l'appareil de
19
Golgi des cellules principales (Hambourg et coll., 1966) , sous l'influence des androgènes.
La formation de stéroides in vitro par 1'épithélium épididy- maire a été mise en évidence par certains auteurs (Hamilton, 1971) . Cepen dant, in vivo, 1'importance de cette sécrétion n'est pas connue. Seule la progestérone, trouvée chez le taureau, proviendrait d'une synthèse êpidi- dymaire (Ganjam et Amann, 1976) . Par contre, la présence dans l'épididyme de la A4-5a-rëductase et de la 3ct-stéroïde-déshydrogénase conduit à la formation dans le milieu de grandes quantités de 5ct-dihydro testostérone et de 3cx-diol (3a-5cc-androstanediol-178) , deux métabolites de la testostérone (Aafjes et Vreeburg, 1972 ; Vreeberg, 1975; Ganjam et Amann, 1976 ; Hinrichsen et De Larminat, 1980). L'activité de la 3ct-stëroïde-déshydro- génase est androgéno-dépendante (Robaire et coll., 1977) mais celle de la A4-5a-réductase est liée à la présence d'un facteur contenu dans le fluide testiculaire (Robaire et coll., 1977; De Larminat et coll., 1978). Le passage des stéroïdes sanguins à travers l'épithélium de l'épididyme est facilité par la présence des protéines du fluide épididymaire (Cooper et Waites, 1979b).
2.1.3. Fonction d'accumulation.
La carnitine présente dans le sang est concentrée spécifiquement dans la lumière de la région antérieure et médiane de l'épididyme (Marquis et Fritz, 1965 ; Brooks et coll., 1974 ; Bohmer et Hansson, 1975; Soufir et coll., 1981) et accumulée dans le fluide de la région caudale de l'organe (Johansen et Bohmer, 1979) où la concentration très élevée varie selon les espèces : 50 mM chez le rat (Brooks et coll., 1974; Hinton et Setchell, 1980a) et de 10 à 20 mM chez la plupart des autres espèces (Casillas et Chaipayungpan, 1979; Hinton et coll., 1979). Cette absorption de la carnitine sanguine par les cellules épididymaires serait réalisée par un double système de concentration, l'un au pôle basal des cellules épithéliales et l'autre à leur pôle apical, vers la lumière du tube épidi dymaire. La présence de GPC et de choline favorise le passage de la car nitine à travers 1'épithélium (Brooks, 1980 ; Yeung et coll., 1980).
L'accumulation de la carnitine est androgéno-dépendante (Marquis et Fritz, 1965; Bohmer et Hansson, 1975).
2.1.4. Définition d'une barrière sanguine ëpididymaire.
Les analyses du fluide ëpididymaire font apparaître que celui-ci a une composition très spécifique. La présence de composés organiques ou inorganiques en quantités différentes de celles du sang suppose qu'il existe, entre ces deux compartiments, une zone de perméabilité différentielle (barrière sanguine ëpididymaire). L'existence anatomique de cette barrière, analogue à celle décrite pour les tubes sêminifères (Setchell, 1967), semble être confirmée par l'existence de jonctions spé cialisées entre les cellules de l'épithélium ëpididymaire (gap-junction, desmosomes) (Suzuki et Nagano, 1968; Hoffer et Hinton, 1984). Cette bar rière laisse passer les petites molécules comme l'urée, l'eau (Howards et coll., 1976; Cooper et Waites, 1979a) ou le glycérol (Dacheux, 1980) mais réduit la perméabilité aux glucides comme le glucose ou le mêthylglucoside et est imperméable à l'inuline ou au dextran (Cooper et Waites, 1979).
2.2. Maturation des spermatozoïdes et influence de l'épididyme.
Le processus de maturation ëpididymaire du spermatozoïde impli que une série de modifications morphologiques et biochimiques des gamètes, particulièrement évidentes en ce qui concerne la membrane plasmatique. Le mécanisme moléculaire sous-jacent est peu compris, mais une revue du sujet indique que des agents sécrétés par les cellules épithéliales le long du tube ëpididymaire sont très probablement impliqués dans ce processus. Ainsi, après la description des changements intrinsèques aux spermato zoïdes et de ceux de leur membrane plasmatique, les interactions entre l'épididyme et la membrane du spermatozoïde seront exposées au regard du processus de maturation ëpididymaire des gamètes.
2.2.1. Transformations intrinsèques aux spermatozoïdes épididymaires.
Le passage des spermatozoïdes dans l'épididyme s'accompagne d'une perte en phospholipides (Voglmayr, 1975; Dacheux, 1977; Evans et
Setchell, 1979), d'une augmentation de leur contenu en AMP cyclique (Hoskins et Casillas, 1975, Voglmayr, 1975) et d'une profonde modification de leur métabolisme énergétique (Voglmayr et coll., 1969; Voglmayr, 1975; Dacheux et coll., 1979; Inskeep et Hammerstedt, 1982). Des modifications structurales portant sur le noyau ont été également décrites (Meistrich et coll., 1976). Des différences dans la taille, la forme et la structure interne de l'acrosome (Bedford, 1965; Fawcett et Phillips, 1969; Bedford et Nicander, 1971) et de la pièce intermédiaire (Oison et Hamilton, 1976) du spermatozoïde ont été révélées par microscopie électronique. De plus, des modifications dans la cohésion entre la membrane externe de l'acrosome et la membrane plasmique sous-jacente (Fawcett et Phillips, 1969; Bedford, 1975) ainsi que la migration de la gouttelette cytoplasmique (Branton et Salisbury, 1945; Nicander, 1957) ont été observées sur les spermatozoïdes de quelques espèces au cours de leur transit ëpididymaire.
Toutes ces transformations conduisent à rendre les spermato zoïdes mobiles et fertiles. Calvin et Bedford (1971) ont observé une aug mentation du nombre de ponts disulfures dans le flagelle du spermatozoïde au cours du transit dans l'épididyme, laquelle serait responsable du chan gement de type de motilité des gamètes simultanément à leur stade de maturation. In vitro, l'accroissement du taux d'AMP cyclique par la théo- phylline ou la caféine, associée à la présence de glycoprotéines (Forward Motility Protein: FMP) présentes dans le fluide ëpididymaire (Acott et Hoskins, 1978; Hoskins et coll., 1978) conduit à l'initiation de la moti lité progressive des spermatozoïdes immatures épididymaires (Ascott et coll., 1983) mais non pas des spermatozoïdes testiculaires (Dacheux et Paquignon, 1980b; Amann et coll., 1982). L'élévation in vivo de l'AMP cyclique des spermatozoïdes lors de leur transit ëpididymaire pourrait être le résultat d'une perte d'activité des nucléotides phosphodiestérases (Cascieri et coll., 1976; Stephens et coll., 1979). Dans l'ëjaculat, la modulation de la motilité progressive est indépendante de la concentration en AMP cyclique (Hammerstedt et Hay, 1980).
Les principaux changements du fluide ëpididymaire (ioniques, protéiques...) ne sont pas à eux seuls capables d'induire in vitro, sur
des spermatozoïdes immatures, des modifications de type maturation et en particulier, ils ne provoquent pas 1'apparition du pouvoir de fécondation (Dacheux et Paquignon, 1980a). Ainsi, les variations de pressions osmo tiques (Dacheux et coll., 1979), de concentration en ions sodium, potas sium (Pholpramool et Chaturapanich, 1979; Dacheux, 1980), calcium (Davis, 1978; Morton et coll., 1978; Nelson, 1978) ou en GPC (Turner et coll., 1978) modifient le métabolisme et la motilité des spermatozoïdes déjà actifs mais n'accroissent pas ceux des spermatozoïdes immatures. La pré sence de faibles concentrations en carnitine dans le milieu provoque une augmentation de 1'agitation des spermatozoïdes immatures épididymaires alors que des concentrations équivalentes à celles trouvées dans la région caudale inhibent leur motilité et leur métabolisme (Hinton et Setchell, 1980a) .
2.2.2. Modifications physico-chimiques de la membrane plasmatique.
Dès la sortie du testicule, la surface du spermatozoïde doit subir une série de transformations au cours du transit ëpididymaire mais aussi pendant la capacitation dans les voies génitales femelles, jusqu'à la fécondation (Oliphant et Singhas, 1979) . Ainsi, depuis une dizaine d'années, les modifications de la membrane plasmatique des spermatozoïdes ont été l'objet de nombreuses études en rapport avec la maturation épidi- dymaire (Fournier-Delpech et coll., 1977 ; Bacetti et coll., 1978; Hammerstedt et coll., 1979; Nicolson et Yanagimachi, 1979; Bostwick et coll., 1980).
Les variations de la quantité d'acides sialiques fixés sur les spermatozoïdes lors de leur transit ëpididymaire sont en partie responsa bles de 1'augmentation de la charge électronégative des gamètes (Courtens et Fournier-Delpech, 1979; Moore, 1979; Holt, 1980) . Ces composés stabi lisent probablement les membranes plasmatiques mais leur importance sur la maturation des spermatozoïdes est inconnue.
Plusieurs études ultrastructurales ont révélé des changements topographiques importants sur la membrane du spermatozoïde pendant le
transit ëpididymaire (Bedford, 1965 ; Bedford et Nicander, 1971). Une évi dence des changements de type maturation dans la composition chimique de la surface du spermatozoïde a été obtenue en utilisant des sondes molécu laires comme les lectines, qui se lient spécifiquement aux résidus glyco sylés disposés à l'extérieur de la membrane plasmatique et qui peuvent être observées au microscope électronique (voir Koehler, 1981). Les étu des ultrastructurales indiquent des changements dans le nombre et la dis tribution des sites liant la lectine sur le spermatozoïde de lapin (Gordon et coll., 1974; Nicolson et coll., 1977) et de bélier (Fournier-Delpech et Courot, 1980) pendant la maturation ëpididymaire. Les données ultrastruc turales sont renforcées par les analyses chimiques qui démontrent une légère augmentation du nombre de récepteurs de la ConA et une diminution apparente du nombre de récepteurs des WGA et des RCA sur la surface du spermatozoïde de rat au cours du transit ëpididymaire (Fournier-Delpech et coll., 1977b; Oison et Danzo, 1981). Ces variations pourraient être cau sées par divers changements de la surface cellulaire: 1- Une dégradation des glycoprotéines de la membrane du spermatozoïde par des protéases ou une altération de leur partie glycosylée par des glycosidases; 2- Une adsorption de substances de recouvrement qui masquent, à la surface, les récepteurs des lectines concernées; 3- L'achèvement des chaînes oligosac charidiques des glycoprotéines par des glycosyltransfërases résultant dans l'altération des sites liant les lectines. Par exemple, l'addition d'aci de sialique aux résidus galactoses terminaux via une sialotransférase pourrait être responsable du blocage de la liaison du RCA (Nicolson, 1973).
Ces études démontrent clairement des changements qualitatifs dans la composition de la membrane plasmatique du spermatozoïde pendant la maturation ëpididymaire. Les altérations de ces protéines de surface ont été suivies par des techniques de marquage récemment développées: les pro téines totales sont marquées par l'iodination des résidus tyrosyl avec le
125
chloroglycolulyl et l'iodure de sodium radioactif (Na I) ou par l'iodi nation catalysée par la lactoperoxydase; les glycoprotéines sont marquées sur les résidus galactosyl et galactosaminyl avec la galactose oxydase et
3
sialoprotéines sont marqués avec le métapériodate de sodium et le NaB H^. Ces techniques ont été employées chez le lapin (Nicolson et coll., 1979) , le rat (Oison et Hamilton, 1978; Oison et Danzo, 1981; Johns et coll., 1983; Zeheb et Orr, 1984) et le bélier (Voglmayr et coll., 1980, 1983; Dacheux et Voglmayr, 1983). Ainsi, en comparant le profil des protéines de surface des spermatozoïdes provenant de plusieurs segments de l'êpidi- dyme allant de la région antérieure à la région postérieure de l'organe, les auteurs rapportent que certaines apparaissent, d'autres disparaissent ou encore se maintiennent au cours du transit épididymaire. Les résultats varient suivant les espèces. Ces différences pourraient mieux refléter en partie les mécanismes de fertilisation spécifiques entre espèces.
2.2.3. Interactions entre l'épididyme et la membrane du spermatozoïde
Des études immunologiques ont démontré des changements dans les propriétés antigéniques de la . surface du spermatozoïde au cours du transit épididymaire (Hunter, 1969; Johnson et Hunter, 1972; Barker et Amann, 1971 ; Killian et Amann, 1973). Ces changements détectés immunolo giquement seraient attribués soit à la perte d'antigènes spécifiques du recouvrement des spermatozoïdes, soit à 1'acquisition de nouveaux anti gènes de recouvrement sécrétés par différentes régions de l'épididyme (Kohane et coll., 1979, 1980a,b; Lea et coll., 1978). Certains de ces ma tériels adsorbés sont liés fermement et ne sont pas enlevés facilement par lavage dans une solution saline physiologique (Kohane et coll., 1980b) ni par traitement avec des solvants organiques (Well, 1965) . Ces composants antigéniques ont été collectivement appelés antigènes de recouvrement des spermatozoïdes (sperm-coating antigens) (Edwards et coll., 1964; Well, 1965, 1967; Boettcher, 1969) . La signification fonctionnelle des subs tances liant les spermatozoïdes, ou leur liaison et leur relâchement pen dant la maturation épididymaire, ainsi que le rôle joué par ces substances dans la fertilisation demeurent à être déterminés.
La présence des protéines dans le milieu épididymaire modifie le revêtement cellulaire des spermatozoïdes testiculaires lors du transit épididymaire (Schellpfeffer et Hunter, 1976; Fournier-Delpech et coll.,
1977b; Oliphant et Singhas, 1979). Des évidences biochimiques indiquent que certains changements de surface résultent de 1'interaction de protéi nes spécifiques du fluide épididymaire avec la membrane du spermatozoïde
(Voglmayr et coll., 1980; Courtens et coll., 1982; Brooks et Tiver, 1983). Chez le rat, une glycoprotéine de surface (37 KDa) sécrétée par l'épidi dyme antérieur (Kohane et coll., 1980a,b) apparaît sur les spermatozoïdes lorsqu'ils traversent la région médiane épididymaire (Oison et Hamilton, 1978), protéine correspondant probablement à celle isolée par plusieurs auteurs (Lea et coll., 1978; Brooks et Higgins, 1980; Faye et coll., 1980; Jones et coll., 1980a; Oison et Danzo, 1981). Une évidence similaire a été obtenue avec la sécrétion d'une glycoprotéine acide épididymaire chez le lapin (Moore, 1980) et le hamster (Gonzalez-Echeverria et coll., 1982). L'examen de spermatozoïdes de différentes régions du tractus reproducteur de la souris mâle et du cochon d'Inde, utilisant des anticorps monoclonaux (Feuchter et coll., 1981 ; Myles et coll., 1981; Schmell et coll., 1982; Poirier et Nicholson, 1984), mène aussi à la conclusion que les spermato zoïdes acquièrent des antigènes pendant la maturation dans l'épididyme, lesquels sont très probablement d'origine épididymaire.
Le role de ces protéines n'est pas élucidé. Certaines ont des effets qui stabilisent les membranes et retardent la réaction acrosomique (Hunter et coll., 1976; Bavister et coll., 1978; Hunter et coll., 1978); d'autres, de faible poids moléculaire, maintiennent la motilité des sper matozoïdes déjà mobiles (Bavister et coll., 1978; Dott et coll., 1979) et favorisent la survie des spermatozoïdes après incubation in vitro (Morton et coll., 1979a,b). Actuellement, aucune de ces protéines n'est, à elle seule, directement associée au contrôle de la maturation des spermato zoïdes bien que 1'absence de leur synthèse dans l'épididyme abolisse l'apparition du pouvoir fécondant (Orgebin-Crist et Yahad, 1978).
2.2.4. Intervention des glycosidases dans la maturation du spermatozoïde.
Tel que mentionné plus haut, l'épididyme est connu pour syn thétiser et sécréter des protéines sous le contrôle des androgènes, cer taines d'entre elles s'associant à la membrane du spermatozoïde. Précisant
la nature de ces protéines, des études récentes ont démontré que plusieurs de ces protéines contenaient une partie glycosylée. Les lectines ont été utilisées pour identifier 1'abondance et la distribution des résidus gly cosylés spécifiques sur la surface de la membrane plasmatique des sperma tozoïdes . De ces études, il apparaît que la topographie de ces résidus est modifiée pendant la maturation épididymaire des gamètes. Alors que des évidences existent pour suggérer que certaines glycoprotéines sécrétées par l'épididyme peuvent être adsorbées à la surface des spermatozoïdes, il est aussi possible que des glycoprotéines membranaires préexistantes soient modifiées pendant le transit épididymaire.
Il est connu depuis longtemps que l'épididyme des mammifères est riche en glycosidases (Conchie et Mann, 1957; Rutenberg et coll., 1958; Conchie et Hay, 1959; Pugh et Walker, 1961; Hayaski, 1967; Moniem et Glover, 1972; Kemp et Killian, 1978; Rastogi et coll., 1981; Mayorga et Bertini, 1981, 1983) . Ces glycosidases pourraient être responsables des changements dans les glycoprotéines associées à la surface du spermato zoïde pendant le transit épididymaire. Ces changements peuvent inclure à la fois 1'apparition de nouvelles glycoprotéines et/ou la modification de glycoprotéines préexistantes sur la membrane du spermatozoïde (Oison et Hamilton, 1978; Bostwick et coll., 1980; Brooks, 1981). Les glycosidases peuvent agir avec les glycosyltransfërases (Hamilton, 1980) et les proté ases pour modifier à la fois les caractéristiques antigèniques et de liai son aux lectines des glycoprotéines de surface montrant des différences suivant les régions de l'épididyme (Jones et Brown, 1982).
Les glycosidases sécrétées par les cellules principales de l'épididyme (Chapman et Killian, 1984) pourraient être aussi adsorbées à la surface du spermatozoïde, ou incorporées dans la membrane plasmatique pour intervenir plus tard dans les événements conduisant à la fécondation (capacitation, dispersion du cumulus oophorus, attachement à la zone pel lucide ou pénétration) (Allison et Hartree, 1970; Farooqui et Srivostava, 1980; Rodger et Young, 1981; Shur et Hall, 1982).
Dans le plasma séminal humain, 1'activité de 1'a-glucosidase neutre (EC 3.2,1.20) est basse dans les cas de subfertilité ou après va sectomie (Tremblay et coll., 1979; Guérin et coll., 1981) et une variation de ses formes moléculaires a été démontrée chez des patients souffrant de varicocèle ou après vasectomie comparativement aux individus normaux (Tremblay et coll., 1982c) suggérant une relation possible entre l'a-glu- cosidase du plasma séminal et la fertilité. L’activité enzymatique varie en corrélation positive avec la concentration en L-carnitine dans le plas ma séminal (Tremblay et coll., 1982a), paramètre considéré comme un mar queur de la fonction épididymaire (Watterauer et Heite, 1978). L'activité de 1'a-glucosidase dans le plasma séminal humain est maintenant considérée comme un outil pour 1'andrologiste dans le diagnostic d'une pathologie obstructive du tractus reproducteur de l'homme infertile (Tremblay et coll., 1982b). Enfin, une étude comparative des formes moléculaires de cet enzyme dans plusieurs glandes sexuelles suggère que 1'a-glucosidase du plasma séminal humain originerait de l'épididyme (Faquin et coll., 1984).
Pour approfondir les connaissances au sujet des relations entre 1'a-glucosidase du plasma séminal des mammifères et la fertilité, le bélier a été choisi comme modèle animal en tant que reproducteur saison nier (Ortavant, 1959). Des travaux antérieurs portant sur les propriétés physico-chimiques de 1'a-glucosidase des plasmas séminal et sanguin avaient établi la spécificité de l'enzyme dans chacun de ces fluides (Besançon et coll., 1983). Le présent travail porte d'abord sur l'acti vité enzymatique du plasma séminal en relation avec le degré de maturité de la semence (Chapitre I). Une étude comparative de l'activité de 1 'a-glucosidase et de ses formes moléculaires dans les fluides du rete testis et de l'épididyme démontre que l'enzyme mesurée dans le plasma séminal provient de l'épididyme (Chapitre II) suggérant une implication potentielle de 1'a-glucosidase dans la maturation du spermatozoïde. Afin d'élucider un tel rôle, le recours à l'enzyme pur ou à des anticorps contre cette protéine devenait manifeste. Ainsi la dernière partie de cette étude (Chapitre III) est consacrée à la purification de 1'a-gluco sidase dans le plasma séminal de bélier.
CHAPITRE I
EFFET DE OU INDUITE
L'IMMATURITE PHYSIOLOGIQUE (CHEZ L'AGNEAU) (CHEZ L'ADULTE) DES SPERMATOZOÏDES DE BELIER SUR L'ACTIVITE DE
L'O-GLUCOSIDASE
DU PLASMA SEMINAL29
Une étude précédente portant sur les propriétés physico-chimi ques de 1'a-glucosidase des plasmas séminal et sanguin de bélier avait démontré la spécificité de 1'enzyme à chacun de ces fluides et déterminé les conditions optimales de mesure de son activité spécifique.
A partir d'une observation personnelle à l'effet qu'une faible motilité des spermatozoïdes chez le jeune agneau était associée à une basse activité de 1'a-glucosidase dans le plasma séminal, il fut postulé que 1'a-glucosidase pouvait jouer un rôle dans le processus de maturation du spermatozoïde impliquant en particulier 1'acquisition de la motilité progressive.
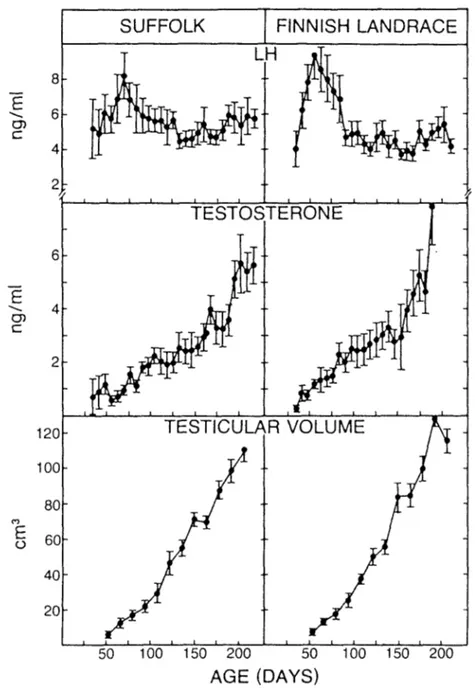
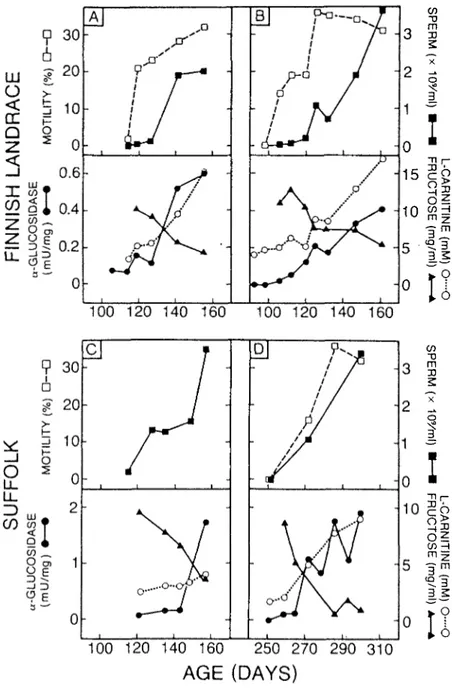
Ainsi la présente étude porte dans un premier temps sur la me sure de 1'activité de 1'a-glucosidase dans le plasma séminal d'agneaux prépubères suivis jusqu'à maturité sexuelle. Vingt (20) agneaux de race Finnish Landrace et Suffolk ont été entraînés à éjaculer dans un vagin artificiel peu après leur sevrage, vers l'âge de 3 mois, dans le but d'obtenir de la semence immature. La concentration et le pourcentage de motilité des spermatozoïdes ont été évalués jusqu'à maturité. La mesure du volume scrotal et celle des concentrations en LH et testostérone dans le plasma sanguin ont été effectuées à partir de l'âge de 1 mois, afin de déterminer le moment de la puberté. En plus de l'activité spécifique de 1'a-glucosidase dans le plasma séminal, la concentration en L-carnitine a été déterminée comme marqueur de la fonction épididymaire ainsi que celle en fructose en tant que témoin de 1'activité métabolique des spermato zoïdes .
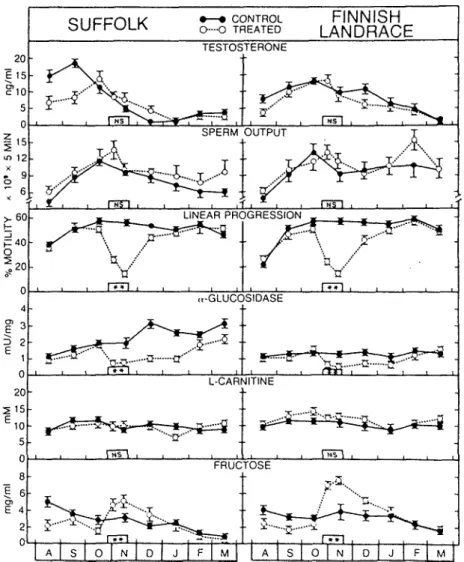
Dans un deuxième temps, un traitement à l'a-chlorohydrine a été initié pendant la saison de reproduction chez 14 béliers adultes des 2 races afin d'induire une immaturité de la semence. L'étude du spermo gramme, la mesure de 1'activité spécifique de 1'a-glucosidase et celle des concentrations en L-carnitine et fructose dans le plasma séminal ont été effectués avant, pendant et après le traitement ainsi que chez 14 béliers témoins des deux races n1 ayant subi aucun traitement. La concentration en testostérone dans le plasma sanguin a été mesurée dans le même temps chez
les 28 béliers afin d'évaluer l'effet du traitement sur la fonction endo crinienne du testicule.
Les résultats de ces expériences établissent que 1'activité spécifique de 11a-glucosidase est basse dans le plasma séminal d'animaux immatures ou à immaturité induite. Ce paramètre peut être considéré comme un marqueur de la fonction épididymaire chez le bélier, plus sensible que la L-carnitine, lors du traitement à 1'a-chlorohydrine.