HAL Id: hal-02792508
https://hal.inrae.fr/hal-02792508
Submitted on 5 Jun 2020HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Effet d’un stress hydrique de début et de fin de cycle
chez le pois
Jérémie Marolleau
To cite this version:
Jérémie Marolleau. Effet d’un stress hydrique de début et de fin de cycle chez le pois. [Stage] Autres régions du monde. Université de Bourgogne (UB), FRA. 2014, 23 p. �hal-02792508�
Jérémie Marolleau
M1 B2IPME 2013/2014
Effet d’un stress hydrique de début et de fin de cycle chez le pois
INRA UMR Agroécologie, pôle GEAPSI
Je remercie Marion Prudent ainsi que Vanessa Vernoud qui m’ont permis d’effectuer cette formation dans les meilleurs conditions possibles et m’ont offert une partie de leur temps et de leur connaissance. Je tiens aussi à remercier Christophe Salon, le directeur du pôle GEAPSI, qui m’a permis de travailler dans son bâtiment. Enfin, je tiens à remercier toute l’équipe présente lors de mon stage pour son professionnalisme et son amicalité.
TABLE DES MATIERES
I) LISTE DES ABREVIATIONS ... 4
II) INTRODUCTION ... 4
A) CONTEXTE SOCIO-ECONOMIQUE ... 4
B) DEVELOPPEMENT DE LA PLANTE DE POIS ... 5
C) ACQUISITION D’AZOTE AU SEIN DE LA PLANTE ... 7
D) LES EFFETS DU STRESS HYDRIQUE CHEZ LE POIS ... 9
E) CONTEXTE DU STAGE ... 11
III) MATERIELS ET METHODES ...11
A) DC,STRESS HYDRIQUE EN DEBUT DE CYCLE ... 12
B) FC, STRESS HYDRIQUE EN FIN DE CYCLE... 13
IV) RESULTATS ...14
A) RESULTATS PARTIE DC, STRESS HYDRIQUE EN DEBUT DE CYCLE ... 14
B) RESULTATS PARTIE FC, STRESS HYDRIQUE EN FIN DE CYCLE ... 16
V) INTERPRETATION ...17
A) INTERPRETATION PARTIE DC, STRESS HYDRIQUE EN DEBUT DE CYCLE ... 17
B) INTERPRETATION PARTIE FC, STRESS HYDRIQUE EN FIN DE CYCLE ... 18
VI) CONCLUSION ...19
I) Liste des abréviations - C : Carbone - N : Azote
- WW : Plantes bien arrosées, “Well Watered” - PPHD : Plateforme de Phénotypage à Haut Débit
- WS : Plantes stressées, “Water Stressed” - NS : Non significatif
- DC : Expérience stress hydrique en début de cycle - FC : Expérience stress hydrique en fin de cycle
II) Introduction
A) Contexte socio-économique
En France, les cultures de légumineuses représentaient 161 000 ha (avec 55 % de haricot, et 24 % de fèves et féverole) au début des années 1960, principalement cultivées comme source de protéine pour l'alimentation humaine. Entre 1950 et 1985 la consommation de légumineuses à graines a chuté de 7.3 à 1.4 kg par personne et par an avec l'évolution des régimes alimentaires. La quasi absence de soutien politique et économique a finalement rendu les surfaces cultivées inférieures à 15 000 ha (moyenne 2003-2007) en France pour la production destinée à l'alimentation humaine (Cavaillès, 2009).
Chez le pois, malgré trente années de sélection variétale ayant permis une amélioration de son rendement en graines, le niveau reste bien en dessous de celui des céréales. Nous pouvons aussi noter que depuis le début des années 2000, une très forte variabilité interannuelle se fait sentir sur les rendements agricoles. Souvent, la culture de pois disparaît des rotations ou se retrouve déplacée vers de moins bonnes terres (Voisin et al., 2013). Qui plus est, les rendements ont été beaucoup affectés ces dernières années par le changement climatique, en particulier par les fortes températures ou encore la fréquence et l’intensité des stress hydriques (Vadez et al., 2012).
Les légumineuses ont la capacité à fixer l’azote de l’air lors de la symbiose avec des bactéries du sol du genre Rhizobium. Ceci leur offre un grand potentiel d’insertion dans les systèmes de culture à faible niveau d’émission de gaz à effet de serre et à bas niveaux d’intrants. De plus, elles sont une source de protéines végétales possédant des caractères complémentaires à celles des céréales (Voisin et al., 2013). Dans les systèmes de culture actuels, les légumineuses ont un rôle de culture de diversification, ce qui permet une réduction des intrants pour l’ensemble de la culture et une rupture des cycles des bio-agresseurs. Les légumineuses pourraient jouer un rôle majeur dans la transition écologique d’une part -vers des systèmes plus durables via une réduction de la consommation d’énergie et d’autre part en participant à un régime alimentaire plus sain. En effet, la réponse de l’agriculture aux besoins des neuf milliards d’individus qui vivront sur la planète à l’horizon 2050, pourrait bien être une substitution partielle des protéines animales par des protéines végétales offrant ainsi aux légumineuses un intérêt renouvelé (Dorin et al., 2011).
B) Développement de la plante de pois
1) Le pois, généralitées
Le pois, Pisum sativum, est une plante grimpante herbacée annuelle, de la famille des Fabacées (couramment appelé légumineuses). Le cycle végétatif du pois est d'environ 140 jours pour les variétés de printemps, mais pouvant descendre jusqu’à 90 jours pour les variétés ultra-précoces et monter à 240 jours pour les variétés d'hiver. Le fruit par la suite se développe en 3 à 4 semaines suivant les espèces (Figure 1).
Le phytomère, initiée par le
méristème caulinaire, forme la tige de pois. Peu importe son âge et sa position, un phytomère est constitué :
D’un entre-nœud, c'est-à-dire la fraction de la tige entre l’insertion du phytomère considéré et de la feuille du phytomère précédent, et d’une feuille. Pour les variétés dites ‘’feuillues’’ la feuille se compose de une à trois paires de folioles et de vrilles ainsi que d’une paire de stipules. Chez les variétés dites ‘’afila’’, des vrilles remplacent les folioles. Il est intéressant de noter que les stipules ne sont pas des feuilles mais des organes mixtes folio-caulinaires (possédant une fonction de méristème) (Nougarèdes et Rondet, 1973b). Cependant, au niveau fonctionnel, on les considère comme faisant partie de la feuille car elles possèdent la partie principale des surfaces photosynthétiques et transpirantes.
2) Développement racinaire et nodulation
Le système racinaire du pois se compose d’une racine principale et de racines latérales primaires et secondaires, qui sont produites de manière acropète sur la racine mère. On distingue trois phases lors de sa mise en place (Mitchell and Russel, 1971) :
- Une phase d’élongation de la racine principale qui se déroule durant la période végétative des parties aériennes. Pour le pois, la vitesse d’élongation de la racine est maximale durant la germination/levée, puis elle diminue suite à l’épuisement des réserves de la semence (Tricot et al., 1997).
- Une phase d’augmentation rapide de la biomasse racinaire. On l’observe au cours de la floraison et de la formation des graines par un développement des racines latérales du second ordre. Chez le pois, la profondeur maximale est en général atteinte autour de la floraison et va de 50 à 80cm dans des conditions adéquates.
- Une phase de ralentissement, atteinte au cours du remplissage des graines.
Les légumineuses peuvent effectuer une symbiose avec des bactéries du sol du genre Rhizobium au sein d’organes spécifiques racinaires appelés nodules ou nodosités (Figure 2A). En quelques heures le microorganisme pénètre dans les racines de la plantule par les poils absorbants grâce à la formation d’une structure tubulaire appelée cordon d’infection. Cette structure progresse à travers l’épiderme puis le cortex racinaire où parallèlement les cellules se dédifférencient et se divisent activement. Les cellules issues de ces divisions s’organisent en un méristème dont le fonctionnement est à l’origine des nodosités. Chez le pois, le fonctionnement du méristème est permanent, les nodosités sont allongées (Figure 2A), de type indéterminées. Les nodosités matures comprennent une zone centrale où les bactéries sont libérées hors du cordon et envahissent les cellules végétales (Figure 2B et 2C) et qui correspond à la zone de fixation.
Figure 2 : Nodosité des
Fabaceae ; A : vue macroscopique, B : coupe transversale d'une nodosité, C : détail de la zone d’infection du nodule, les cellules infectées
sont hypertrophiées.
(http://www.plantes-botanique.org/)
3) Phase reproductrice et développement de la graine
Le début de floraison correspond au début de la phase reproductrice. Dans des conditions optimales, une à deux fleurs apparaîtront par nœud, pour une moyenne de 8 à 10 nœuds florifères par plante. C’est durant cette phase reproductrice que le nombre de graines est mis en place, déterminant ainsi le rendement dans une large mesure (Doré, 1992) (le rendement se décompose généralement comme le produit du nombre
de graines par m2 et du poids d’une graine). Il est important de noter que la culture est très sensible aux stress
hydriques durant cette période, et les effets sur le rendement seront plus forts que pendant d’autres périodes du cycle. En effet le nombre de graines mis en place sera déterminé à ce moment par l’état général de la plante, et par la suite l’avortement des graines sera rare (Lecoeur, 1994 ; Ney et al., 1994).
Chez le pois, comme chez les autres légumineuses, le développement de la graine peut se décomposer en trois phases :
- La première phase correspond à l’embryogénèse. Elle débute au moment de la fécondation, et
correspond à une phase de division cellulaire et de différenciation. Durant cette phase, l’accumulation de matière sèche est faible et le contenu en eau est élevé (>85%) (Ney et al., 1993 ; Schlitz et al., 2004).
- La seconde phase qui débute entre 10 et 12 jours après pollinisation (JAP) correspond à la phase de
remplissage caractérisée par l’accumulation massive de protéines de réserves dans les cotylédons de l’embryon. La graine de pois accumule environ 25% de contenu azoté, dont 23% de protéines (composé de 34% d’albumines, 27% de vicilines, 24% de légumines et 15% de protéines insolubles). Cette phase marque le stade limite d’avortement, à partir duquel les possibilités d’avortements de la graine deviennent faibles ou inexistantes, et pendant cette période, le contenu en eau de la graine diminue progressivement de 80 à 50% (Duthion et Pigeaire, 1991 ; Schlitz et al., 2004).
- Enfin la phase de dessiccation qui débute environ 24 JAP est caractérisée par une perte d’eau
massive et un arrêt d’accumulation de matière sèche : la graine a atteint son poids final, il y a rupture vasculaire entre la graine et la plante. La teneur en eau va diminuer de 55% à 15% vers 35 JAP (Dumoulin et al., 1994).
Une notion importante du développement du pois est la relation organe puits/organe source. Il existe une compétition trophique entres les organes puits pour les assimilats. En effet, l’aiguillage des assimilas est déterminé par l’appel trophique qu’exerce un tissu. Cet appel est fonction du niveau d’utilisation des molécules par les voies du métabolisme énergétique, leurs biosynthèses et leur stockage. La distribution des assimilats évolue au cours du temps : lors de la période de croissance végétative, ce sont les racines, les tiges et les bourgeons végétatifs qui sont prioritaires alors que lors de la floraison et du remplissage des graines, les assimilats sont préférentiellement réorientés vers ces organes puits de stockage au détriment des premiers.
C) Acquisition d’azote au sein de la plante
1) Prélèvement de l’azote
Chez les légumineuses, il existe deux voies d’acquisition de l’azote : l’absorption racinaire à partir de l’azote minéral du sol (principalement sous forme de nitrates et d’ammonium), ainsi que la fixation symbiotique du diazote atmosphérique, grâce à la symbiose avec les bactéries su sol du genre Rhizobium au sein des nodules (grâce à l’enzyme nitrogénase) selon l’équation :
N2 + 8 H +
+ 8e- + 16 ATP + 16H2O → 2 NH3+ H2 +16 ADP + 16 Pi.
L'ammoniac formé se combine avec un sucre : un aminoacide immédiatement assimilable est synthétisé.
La fixation du diazote dans les nodules se produit lors de situation de faible disponibilité en nitrate dans le sol. Par conséquent l’aptitude à fixer le diazote s’ajuste en fonction de la disponibilité en azote dans
le sol. Ainsi les deux voies de nutrition azotée sont complémentaires pour une alimentation azotée optimale, mais sont en revanche antagonistes pour l’utilisation du carbone au sein de la plante. En effet, l’énergie nécessaire pour le développement et le fonctionnement des nodules est apportée par les photoassimilats de la plante (Voisin et al., 2002b), et il y a donc compétition pour l’utilisation de ces composés entre les nodules d’une part, les racines et les parties végétatives d’autre part.
2) Flux C/N
L’azote, ainsi que les autres composés, sont transportés grâce à un système de sèves composé du xylème et du phloème.
Le xylème contient la sève brute (minérale) et transporte de grandes quantités d'eau et de nutriments depuis le sol jusqu'aux cellules photosynthétiques. La sève va contenir généralement des composés azotés comme des acides aminés, des amides, quelques acides organiques et éventuellement du nitrate. Dans le xylème, le rapport carbone sur azote (quantité de carbone total sur quantité d’azote total) des composés transportés varie de 1.5 à 6. L’asparagine est le composé azoté majeur transporté par la sève chez le pois (Layzell et al., 1981).
Le phloème est le canal qui contient les composés élaborés et qui les distribue dans la plante. Il va principalement transporter des sucres (surtout du saccharose), des sucres alcools (polyols) et des acides aminés (beaucoup d’aspartate et de glutamate, ainsi que leurs amides). Il possède un rapport carbone sur azote de 10 à 200. Sa composition peut être influencée par des facteurs abiotiques comme la température, la disponibilité en azote et en eau (Tilsner et al., 2005).
Les composés azotés sont exportés des racines vers les parties végétatives via le xylème et le transfert du xylème au phloème va ensuite dépendre de la charge électrique des composés. Ces transferts xylème vers phloème se produisent principalement dans la partie haute de la plante grâce au flux de transpiration, et permettent à l'azote d'être dirigé vers les organes de transpiration faible comme les jeunes feuilles ou les fruits (Pate et al., 1979a). Les sucres synthétisés dans les organes photosynthétiques attirent l'eau du xylème par osmolarité. La voie apoplastique est régulée par la quantité de sucres ou de phytohormone (provenant des racines via le flux de transpiration ou depuis l'eau recyclée du xylème et apportée par le phloème) afin de répondre au ratio source-puits (Minchin & Lacointe, 2005).
3) Remobilisation
Pour la croissance de la graine, deux sources d’azote existent : l’azote assimilé et intégré dans les organes végétatifs avant l’anthèse et l’azote acquis durant la période de remplissage et de maturation de la graine. Quand la plante arrive en phase reproductrice, les capacités d’absorption et de réduction du nitrate sont en baisses, l’activité de la nitrate réductase décroit et il se met en place un recyclage important de l’azote. Salon et al. (2001), ont montré que l’azote récemment absorbé par la plante ne pouvait pas répondre à la forte demande en azote de la graine lors de son remplissage. Chez le génotype Caméor, l’azote remobilisé des organes végétatifs représente 71% de l’azote total accumulé par les graines (Schiltz et al.,
2005). Cet azote provient principalement des feuilles (plus de 30%), des cosses pour 20% et des tiges et racines pour 11 et 10% respectivement (Schiltz et al., 2005). La rubisco, l'enzyme clé de la photosynthèse permettant la fixation du dioxyde de carbone, représente environ 50% des protéines totales dans les feuilles. Il semblerait qu’elle soit une source majeure d’azote lors de la remobilisation (Matile, 1992).
D) Les effets du stress hydrique chez le pois
Environs 90% des terres cultivables souffrent de stress environnementaux, et les prédictions semblent montrer le déficit hydrique comme un facteur abiotique majeur (Dita et al., 2006). Chez le pois, le stress hydrique est considéré comme le facteur limitant le plus important pour le rendement, en affectant chaque année à la fois la qualité et la quantité des récoltes.
1) Généralités
Il y a stress hydrique lorsque les tissus de la plante perdent de l’eau, affectant le métabolisme entier de la plante. Lorsque le stress hydrique apparait, la disponibilité en eau dans les cellules diminue. Ceci résulte en une diminution du potentiel hydrique (Verslues et al., 2006) et des processus vont se mettre en place dans les cellules afin de résister à ce changement.
La principale hormone répondant au stress hydrique est la phytohormone ABA , également engagée dans la réponse de stress environnementaux comme le froid ou encore le stress salin (Busk et Pagés, 1998). La principale fonction de l’ABA est la régulation de l’équilibre en eau dans la plante, ainsi que sa tolérance au stress osmotique. Elle est également essentielle pour activer des gènes codant pour des protéines de tolérance à la déshydratation (Zhu , 2002), pour contrôler la fermeture des stomates et pour réguler les changements métaboliques (Seki et al., 2007).
Lors du stress hydrique, la taille des plantes est diminuée, le transport et l’assimilation des minéraux sont perturbés, et l’activité photosynthétique baisse (Jewell et al., 2010). Des modifications physiologiques ont lieu en même temps diminuant ainsi l’évaporation des feuilles. Le stress va s’accompagner de dommages oxydatifs notamment de l’accumulation de formes actives d’oxygène, résultant en changements de fluorescence de la chlorophylle, dans la stabilité de la membrane, et des niveaux de péroxidase (Anjum et al., 2011).
Nous pouvons noter que lors d'un stress hydrique, la capacité d'absorption de l'azote est réduit due à (1) la moindre disponibilité des ions dans le sol, (2) à la réduction du débit d'eau dans la plante (à cause de la réduction de la transpiration) et (3) un effet sur les mécanismes de transports actifs et la perméabilité de la membrane (Hsiao, 1973).
2) Ajustement osmotique
Lors du stress hydrique, les cellules vont accumuler des ions inorganiques et synthétiser des osmolytes (protéines, prolines, mannitol, sorbitol …) afin que l’eau ne s’échappe pas en dehors des cellules. La réduction de la pression hydrique va inhiber significativement l’élongation cellulaire. D’après Anjum et
al., (2011) la croissance cellulaire est de ce fait, un des processus physiologiques les plus sensible au stress
hydrique. Souvent le stress hydrique va entrainer une augmentation de la quantité de transporteur de polyols (sucre alcool), qui sont la forme réduite d’aldose et de sucres comme le mannitol et le sorbitol. Leurs groupes hydroxyles peuvent remplacer l’eau dans une certaine mesure, en établissant des ponds hydrogènes. Qui plus est, ces molécules jouent un rôle dans la protection de l’activité des enzymes et des membranes (Noiraud et
al., 2001). L’accumulation de sucres dans les épicotyles du pois semble être le facteur majeur de l’ajustement
osmotique (34 à 46%).
3) Au niveau racinaire
Lors d’un stress hydrique, Benjamin et Nielsen (2006) ont montré que les racines se développaient plus profondément dans le sol que pour des pois dans des conditions optimales d’irrigation. Cependant, il semblerait qu’un stress osmotique (induit par du polyéthylène glycol) aurait pour résultat un raccourcissement de la racine primaire et une augmentation du nombre de racines latérales (Kolbert et al., 2008). Après un stress hydrique, la durée de vie du système racinaire est réduite ce qui conduit à une augmentation de la matière organique dans le sol (Huang et Gao, 2000). Lorsqu’une réhumectation suit le stress, la minéralisation est réactivée et amplifiée par la grande quantité de matière organique (Austin et al., 2004).
4) Au niveau symbiotique
Lors du stress hydrique, la fixation de diazote va diminuer, associée à une diminution de la formation de nodules et une diminution de leurs activités spécifiques et de leurs tailles (Streeter, 2003). Dans tous les cas, la dépendance de la plante par rapport à la fixation de diazote va décroitre avec le prolongement de la durée du stress hydrique (Kirda et al., 1989). En outre, la cessation irréversible de la fixation symbiotique de diazote a été observée dans le cas de sévère stress hydriques (Guerin et al., 1991). Nous pouvons aussi noter que la réponse symbiotique au stress hydrique va aussi dépendre des souches de bactérie, qui peuvent être plus ou moins sensibles à la sécheresse (Djedidi et al., 2011).
Plusieurs mécanismes ont été proposés pour expliquer la diminution de la fixation biologique de diazote. Une première possibilité concerne une diminution de la perméabilité corticale des nodules, limitant la disponibilité en oxygène pour les bactéries, réduisant ainsi leur respiration. En conséquence, l'activité de la nitrogénase est fortement réduite (Hungria et Vargas, 2000) causant des dommages oxydatifs. En outre, il a été montré que dans des conditions de sécheresse sévère, la leghémoglobine nodulaire (hémoprotéine fixatrice de dioxygène) est affectée négativement (Manavalan et al., 2009) et a un impact sur la disponibilité en oxygène pour les bactéries (Marino et al., 2006).
5) Au niveau des graines
L’effet d’un stress hydrique sur le rendement dépend de son intensité, de sa durée et du moment où il est appliqué. Un stress débutant une semaine après la formation des premières gousses entraine une
diminution du nombre de graines de 79% (De Sousa-Majer et al., 2004). La distribution des graines est aussi affectée par un stress hydrique puisque plus de graines sont développées sur les phytomères du bas du couvert (Guilioni et al., 2003). Le stress hydrique va induire une diminution de la période de remplissage, conduisant à des graines plus petites. Il est intéressant de noter que les contenus en protéines ne sont pas modifiés chez le soja (Crozat et al., 1992). L'origine de l'azote remobilisé pour le remplissage des graines est significativement réduite dans des conditions de stress hydrique, ainsi que la quantité d'azote remobilisé à partir des racines (Mahieu et al., 2009).
E) Contexte du stage
Il existe encore de nombreuses zones d’ombre sur l’effet d’un stress hydrique pendant la période de mise en place des structures racinaires (début de cycle) et lors du remplissage des graines (fin de cycle).
Deux expériences ont été menées.
- La première expérience que nous nommerons DC, pour stress hydrique en Début de Cycle, a pour but d’évaluer l’effet d’un stress hydrique en phase végétative ainsi que l’effet d’une ré-humectation sur le compartiment racinaire (racine et nodules). Cette expérience a été réalisé avant mon arrivée au laboratoire et mon stage a porté sur l’analyse d’image de feuilles et de racines stressées et non stressées ainsi que sur la quantification en éléments carbone et azote des différents compartiments.
- La seconde expérience nommée FC pour stress hydrique en Fin de Cycle, a pour but d'évaluer l’effet d’un stress hydrique sur le remplissage de la graine et sur la remobilisation des assimilats des parties végétatives. J’ai lors de mon stage suivi la mise en place de l’expérience FC et réalisé les prélèvements qui m’ont permis d’évaluer la biomasse des différents compartiments de la plante (en condition stressées et non stressées) et qui permettront également d’extraire les ARN et les métabolites des tissus. En effet, lors de ces deux expériences (FC et DC), une approche intégrative de type écophysiologique transcriptomique et métabolomique est menée afin de mieux comprendre l’effet du stress.
III) Matériels et méthodes
La PPHD, Plateforme de Phénotypage Haut Débit, est composée de serres modulables et climatisées, équipées de convoyeurs, permettant d’étudier le développement des plantes et leurs fonctionnements dans des conditions très contrôlées (température, humidité, arrosage).
Durant les deux expériences, l’arrosage automatisé de la plateforme a été utilisé, permettant ainsi de mettre en place un stress hydrique précis en contrôlant et réajustant la teneur en eau du substrat trois fois par jour.
A) DC, Stress hydrique en début de cycle
1) Conditions de croissance
L’expérimentation s’est déroulée en à l’automne 2013 sur la PPHD. Cette plateforme est composée de serres modulables et climatisées, équipées de convoyeurs, permettant d’étudier le développement des plantes et leurs fonctionnements dans des conditions très contrôlées (température, humidité). Dans notre cas, les conditions de croissances ont été les suivantes : température de nuit de 15°C, température de jour de 18°C et humidité de 50%.
Le 17 septembre, 418 graines de pois génotype Caméor ont étés semées, et inoculées avec
Rhizobium. La solution nutritive ne possédait pas d’azote, permettant d'avoir une acquisition d'azote
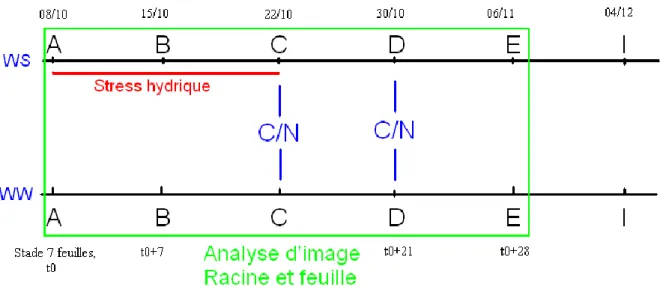
exclusivement par la fixation symbiotique. Le 8 octobre (A), un stress hydrique est effectué durant deux semaines (jusqu’au 22 octobre : C) sur les plantes WS (water stress pour « stress hydrique ») (Figure 3). Le stress hydrique sera de 40%, c'est à dire que le substrat ne retiendra que 40% de l'eau par rapport à sa capacité maximum de rétention en eau. La fin de période de stress correspondait au début de la floraison, le stress hydrique était donc en phase végétative. Suite à la période de stress, les plantes sont réarrosées jusqu’à la récolte des plantes à maturité physiologique. Les WW (well watered pour « bien arrosés ») servent de témoin et seront arrosés de manière à maintenir une rétention en eau dans le substrat de 100%.
Des prélèvements sont effectués sur les plantes WS et WW à chacune des dates A, B, C, D, E et I. Pour chaque plante, une analyse d'image est réalisée sur les feuilles et les racines, la biomasse des différents organes est mesurée, après séchage pendant 48 heures à 80°C. Les échantillons sont ensuite broyés avant leur analyse ultérieure en analyseur d’éléments.
Figure 3 : Stress hydrique en début de cycle, récapitulatif. Le stress (en rouge) va de A à C pour WS. Les analyses d’images effectuées sont encadrées en vert. En bleu, les analyses C/N sont effectuées à la fin du stress et une semaine après réhumectation.
2) Dosage C/N des différents organes
L’analyse élémentaire consiste en une analyse de l’azote et du carbone d’une matrice organique par combustion totale sous oxygène.
Les échantillons de végétaux séchés et broyés sont pesés sur une balance de précision Mettler (5mg) dans une capsule en étain tarée. La capsule est scellée puis placée dans l’analyseur. L’échantillon est injecté avec de l’oxygène par un flux d’hélium dans un tube à combustion à 1021°C. La combustion de la nacelle porte temporairement la température à 1800°C, les éléments C et N sont oxydés en présence d’oxygène et de
catalyseurs (Co3O4 et NiO) suivant les réactions suivantes :
C+O2 => CO2 2N+O2 => 2NO N+O2 => NO2
Les oxydes d’azote sont réduit en N2, et l’excès d’oxygène est piégé par du cuivre à 650°C.
2NO+2Cu => N2+2CuO 2NO2+4Cu => N2+4CuO O2+2Cu => 2CuO
Le mélange azote, dioxyde de carbone et gaz vecteur (hélium) sont entraînés à 50°C dans une colonne remplie de porapak (support poreux sur lequel est imprégnée la phase stationnaire). Les composés de la phase mobile sont plus ou moins retenus par la phase stationnaire et sortent donc de la colonne à des temps différents. Les différents temps de sortie sont collectés et les données sont ensuite comparées à partir d'une courbe de calibration, déterminée par des échantillons au poids connu.
3) Analyse de l'architecture racinaire et de la surface foliaire
Un scan des feuilles et des racines à été effectué au moment des prélèvements. Les données ont été collectées et une analyse d’image à été effectuée par le logiciel WinRHIZO 2012b. La surface projetée des feuilles à été déterminée. Les valeurs de la surface racinaire, de la surface projetée, du diamètre moyen, du nombre de pointes racinaires et de la longueur totale des parties racinaires ont été récoltées.
4) Analyses statistiques des données
Le test de Mann-Whitney (test bilatéral) à été utilisé pour analyser les données. Le seuil de significativité est
de 5% (alpha = 0.05). Les pourcentages relatifs sont calculé selon la formule : % relatif =
(WW-WS)*100/WW.
B) FC, stress hydrique en fin de cycle
L’expérience se déroule sur 170 plants de pois Caméor. Les conditions de croissances des plantes sont identiques à l’expérience DC (température de nuit de 15°C, température de jour de 18°C et humidité de 50%). La solution nutritive est dépourvue d’azote, permettant ainsi une acquisition d'azote exclusivement par fixation symbiotique. Les plantes sont placées en PPHD jusqu’aux prélèvements. Des relevés de floraison journaliers sont réalisés afin de déterminer le début de remplissage des graines (qui débute environ à 12
jours après floraison) (Figure 4). Un stress hydrique de 50% (c'est à dire que le substrat ne retiendra que 50% de l'eau par rapport à sa capacité maximum de rétention en eau) est appliqué pour les plantes WS au moment du début de remplissage des graines (T=0). A T=0, un prélèvement est effectué pour vérifier que le début de remplissage a commencé (étude du Water Content). Le stress hydrique dure une semaine, il se fini à T=+8. Pour chaque stade et traitement, quatre répétitions de trois plantes sont réalisés. Pour chaque plante les biomasses des différents organes (feuilles, tiges, graines et gousses, racines) est pesée : le poids frais est pesé dans un premier temps, puis les organes sont disposés dans une étuve à 80°C durant 48-72h, éliminant ainsi l’eau dans les cellules afin de ne calculer ensuite que le poids sec. Les graines de chaque nœud sont récoltées séparément. Pour les analyses transcriptome et métabolomique le premier ou second nœud florifère est récolté car la floraison n’est pas synchrone entre plantes. De ce fait, selon les plantes, le début du stress pour le nœud choisi à commencé entre 11 et 14 jours après le début de floraison.
IV) Résultats
A) Résultats partie DC, stress hydrique en début de cycle
1) Analyse d’images
La surface foliaire (figure 5)
présente des différences
significatives entre les échantillons stressés et non stressés : les WS ont des surfaces foliaires plus faibles. La différence entre les plantes WW et WS est de 19% ; 30,2% ; 32.3% et 30.5% pour B, C, D et E respectivement (exprimée en % relatif). Les écarts commencent dès Les étoiles correspondent à une différence significative entre la
surface foliaire de WW et WS.
la première semaine du stress (B), s’accroissent à la fin de la seconde semaine (C) pour finir à un maximum de différence au niveau de D malgré la réhydratation. La croissance atteint un plateau entre D et E pour WW et WS, la différence de surface foliaire reste stable.
La longueur racinaire totale a été analysée. Elle présente une différence significative uniquement pour B, avec une longueur plus faible pour WS que pour WW. La surface projetée (Figure 6) montre des écarts significatifs pour B, C, D et E. La différence entre les plantes WW et WS est de 16.7% ; 15.8% ; 26.9% et 17.3% pour B, C, D
et E, respectivement. A chaque fois, WS présente les valeurs les plus faibles. La surface racinaire présente des écarts significatifs entre WW et WS pour B, D et E, WS ayant à chaque fois les valeurs les plus faibles. Le diamètre moyen racinaire ainsi que le nombre de pointes racinaires ne présentent aucune différence significative entre WW et WS au cours du temps. Le nombre de nodules ne représente pas de différences significatives entre WW et WS aux stades C et D.
2) Analyses élémentaires
Le pourcentage et la quantité d’azote et de carbone a été analysé pour les différents organes (figure 7 et 8). Le pourcentage d'azote dans les racines, les gousses et fleurs et les tiges ne présente aucune différences
Les étoiles correspondent à une différence significative entre les surfaces projetée de WW et WS.
significatives entre WW et WS pour C, contrairement aux feuilles et aux nodules dans lesquelles WS aura les valeurs les plus basses. Pour D, seules les racines ne présentent pas d'écarts de pourcentage d'azote entre les deux échantillons : WS a les valeurs les plus basses pour les tiges, feuilles, gousses et fleurs et nodules. Le pourcentage de carbone présent dans les tiges, racines et nodules ne présente pas de différence significative entre WW et WS pour D et pour C. En revanche, le pourcentage de carbone présent dans les feuilles présente des écarts pour C et D, WS ayant une valeur plus basse dans les deux cas. Pour les gousses et fleurs, aucune différence significative n'est présente pour D, en revanche pour C le pourcentage de carbone est plus élevé chez WS.
La quantité d'azote présente dans les tiges, feuilles, racines ainsi que sur la plante dans son ensemble (figure 9 et 10) présente des différences significatives entre WW et WS pour C, WS a systématiquement les valeurs les plus faibles. Il n'y a aucune différence de quantité dans les gousses et graine pour C et D, et les nodules présentent une différence de quantité de carbone uniquement pour C (WS ayant les valeurs les plus faibles).
B) Résultats partie FC, stress hydrique en fin de cycle
Afin de déterminer l’effet du stress hydrique sur la biomasse, des prélèvements ont été effectués à T=+8, c'est-à-dire 8 jours après le début du stress pour 6 plantes WW et 6 plantes WS (Figure 4). Aucune différence significative n’a été observée entre les échantillons stressés et non stressés. La biomasse des différents organes ne
présente pas de variations
significatives (Figure 11).
La différence de taille entre les graines des WW et WS a aussi été étudiée pour notre expérience. Le développement des graines a été évalué visuellement et les graines ont été classées en trois groupes : « avortées » (petites et sèches), « petites » ou « normales ». Aucune différence significative entre le nombre de graines réparties dans chaque groupe n’a été observée.
La quantité d’eau présente dans les graines est directement en lien avec le début de remplissage. En effet, le début du remplissage est caractérisé par une teneur en eau de la graine descendant en dessous de 85% d’eau. La figure 12 nous montre la quantité d’eau et le poids sec des graines prélevées à la fin du stress à T=+8. L’axe des abscisses représente le nombre de jours après floraison au moment de la fin du stress (T=+8). Les carrés de couleur grise représentent les graines des nœuds 1 et 2 qui étaient au début de
remplissage au moment de l’application du stress. Les carrés de couleur bleu représentent les graines des nœuds supérieurs qui étaient encore en phase d’embryogenèse à T=0. On remarque que ceux-ci ont débuté le remplissage (mis en évidence par une teneur en eau relative inférieure à 85%) de manière identique, qu’elles soient stressées ou non. La quantité d’eau ne présente aucune différence significative au niveau des graines lors du prélèvement (Figure 12). Directement relié à la présence en eau, l’augmentation du poids sec en fonction du moment du stress
V) Interprétation
A) Interprétation partie DC, stress hydrique en début de cycle
Kolbert et al. (2008) ont montré qu’un stress osmotique chez le pois avait pour résultat un raccourcissement de la racine primaire, et une augmentation du nombre de racines latérales. Après un stress hydrique, la longévité du système racinaire est réduite, ce qui conduit à une augmentation de la quantité de matière organique dans le sol (Huang et Gao, 2000).
Il est intéressant de noter que la surface projetée racinaire montre des résultats significativement différents entre WW et WS, et ce même après la fin du stress hydrique, nous montrant une persistance de l’écart racinaire généré par le stress. Cependant, bien que l’écart de la surface foliaire entre WW et WS s’agrandisse entre C et D (et donc après la fin du stress), celui-ci ne croît plus entre D et E. Au niveau de la quantité et du pourcentage d’azote et de carbone dans les feuilles, WS est toujours en dessous de WW, ce qui conforte les résultats de la surface foliaire. Il aurait été intéressant de continuer les analyses C/N pour E et I, afin de voir si la différence de l’écart entre WW et WS s’amenuise comme pour la surface foliaire.
La quantité d’azote et de carbone présent dans les cosses et graines pour C et D ne présentent aucunes différences significatives. Nous ne pouvons cependant conclure si le stress hydrique à entrainé ou non une modification au niveau du remplissage des graines car nous ne savons pas s’il y a eu, ou non, un
décalage de la durée de remplissage. Pour conclure sur ce point, il faudrait procéder à une étude lors de la maturité physiologique. La fin de période de stress (C) correspondait au début de floraison. La fécondation a donc eu lieu durant la période de stress. Le poids sec total des graines de WW est supérieur au poids sec total des graines WS, on peut donc poser l’hypothèse que la plante a avorté certaines graines dans le cas de WS, afin de garder un remplissage des graines existantes toujours optimal.
On remarque que la quantité d’azote et de carbone pour les feuilles, les tiges et les racines est moins élevée pour WS pour C et D. En effet, le stress hydrique ne permet pas à la plante de synthétiser des molécules nécessaires à sa croissance, par le biais de la photosynthèse. En revanche, on remarque que pour D, la quantité C/N dans les nodules ne présente plus de différences significatives, montrant un certain retour à l’équilibre. L’effet du stress hydrique sur le pourcentage de carbone dans les nodules n’est pas significatif pour C et D, alors que le pourcentage d’azote présente des valeurs plus basses pour WS pour les deux périodes. Les feuilles WS ont une quantité et un pourcentage de C/N en dessous de WW pour C et D. Ceci peut s’expliquer par le fait qu’elles ont un rôle d’organe source, produisant plus de sucres et acides aminés en condition d’irrigation normale. Le pourcentage d’azote moins élevé dans les tiges pour D pourrait s’expliquer par l’accumulation de sucres solubles en réponse à un ajustement osmotique (Sorensen et al., 2003) cependant la différence n’est pas significative pour C.
B) Interprétation partie FC, stress hydrique en fin de cycle
Lors de longues périodes de stress hydrique, la croissance des plantes est inhibé et l'activité photosynthétique décroit (Jewell et al., 2010). Les résultats de la figure 1 montrent que le stress n’était pas suffisamment long ou fort pour avoir un résultat significatif observable au niveau morphologique. Cela ne signifie pas qu’il n’y a pas de réaction du pois. En effet, les processus métaboliques se mettant en place dès la perception du stress ne sont simplement pas encore visibles à notre niveau d’analyse.
Le stress ne semble pas assez long pour avoir réduit significativement la durée entre la floraison et le début du remplissage des graines entre WW et WS. Crozat et al., (1992) ont montré que les contenus en protéines dans les graines de soja n’étaient pas modifiés à la suite d’un stress après l’anthèse. Nous pourrons conclure plus en profondeur pour le pois lors de l’obtention des valeurs à maturité physiologique.
L’absence de différence significative entre la morphologie des plantes stressées et non stressées peut s’expliquer par la période choisie par le stress. En effet, l’expérience DC présente des différences significatives entre plantes stressées et non stressées, dès la première semaine de stress (au niveau de la surface projetée des racines, des feuilles notamment). L’une des explications de ce phénomène est la relation organe source/puits qui diffère selon les expériences. Dans l’expérience DC la plante est en phase végétative. Les organes puits sont les racines, les tiges et les bourgeons. Dans l’expérience FC, la phase végétative est finie, la phase reproductrice est amorcée et l’organe puits majeur est l’organe reproducteur. Il est donc normal d’observer une diminution de la masse sèche pour l’expérience en phase végétative car la réduction de la pression hydrique va inhiber significativement l’élongation cellulaire (Anjum et al., 2011).
VI) Conclusion
Lors d’un stress hydrique avant floraison, l’impact au niveau des taux C/N semble continuer durant la première et seconde semaine après la fin du stress. La différence de répartition semble moindre au niveau des racines et la plus élevée chez les feuilles et les nodules. Etonnamment, le pourcentage d’azote chez les tiges ne semble pas affecté après deux semaines de stress, mais son niveau descend après la première semaine qui suit la réhydratation. Cela met sans doute en avant un mécanisme lié à la modification du contenu des sèves lors du retour à la normale. Au niveau physiologique, on constate de manière générale une continuité de l’impact du stress après son arrêt. La surface foliaire semble revenir à une croissance normale dès le début de la deuxième semaine après arrêt du stress. Ce retard entre la perception de la fin du stress et la mise en place d’un retour à la normale au niveau C/N et enfin au niveau physiologique peut s’expliquer par la latence entre la réaction moléculaire, cellulaire de la plante, et sa mise en place à l’échelle de l’organisme. Par analyse des mécanismes cellulaires, et plus particulièrement au niveau de l’expression des gènes, les observations pourront être affinées afin de dégager de nouvelles hypothèses quant aux mécanismes sous-jacents.
Il semblerait qu’un stress modéré appliqué au début de remplissage pendant une semaine n’a pas d’effet sur l’accumulation de la biomasse dans les différents compartiments. Il parait évident que ces analyses physiologiques ne suffisent pas. Les plantes à maturité doivent êtres étudiées. Avec les prélèvements des différents organes de l’expérience FC, une analyse transcriptomique et métabolomique sera effectuée. L’analyse transcriptomique sera effectuée par hybridation d'un microarray (qui permet d'analyser le niveau d'expression des gènes transcrits) alors que les changements métaboliques seront analysés par spectroscopie RMN 1H.
VII) Références bibliographiques
Anjum S.A., Xie X., Wang L., Saleem M.F., Man C. and Lei W., (2011) Morphological, physiological and biochemical responses of plants to drought stress. African Journal of Agricultural Research, Vol 6(9), pp. 2026-2032.
Austin, A.T.; Yahdjian, L.; Stark, J.M.; Belnap, J.; Porporato, A.; Norton, U.; Ravetta, D.A. & Schaffer, S.M. (2004). Water pulses and biogeochemical cycles in arid and semiarid ecosystems. Oecologia, Vol. 141, pp. 221-335
Benjamin J.G. et Nielsen D.C. (2006). Water deficit effects on root distribution of soybean, field pea and chickpea. Field Crops Res 97, 248-253.
Busk P.K. and Pagès M., (1998). Regulation of abscisic acid-induced transcription. Plant Molecular Biology, 37:425-435.
Cavaillès E. (2009) Commissariat Général au Développement Rural, (2009). La relance des légumineuses dans le cadre d'un plan protéines: quels bénéfices environnementaux ? Etudes et Documents, n°15,
Crawford T.W., Rendig V.V. and Broadbent F.E., (1982) Sources, Fluxes, and Sinks of Nitrogen during Early Reproductive Growth of Maize (Zea mays L.). Plant Physiology, 70 1654-1660.
Crozat, Y.; Gillet, J.P.; Tricot, F. & Domenach, A.M. (1992). Nodulation, N2 fixation and incorporation of combined N from soil into the pea crop: effects of soil compaction and water regime. In: AEP, First
European Conference on Grain Legumes, ed, pp 141-142, Plancquaert, Angers
De Sousa-Majer M.J., Turner N.C., Hardie D.C., Morton R.L., Lamont B. et Higgins T.J.V. (2004). Response to water deficit and high temperature of transgenic peas (Pisum sativum L.) containing a seed-specific alpha-amylase inhibitor and the subsequent effects on pea weevil survival. Exp Botany 55, 497-505. Dita M.A., Rispail N., Prats E., Rubiales D., Singh K.B., (2006). Biotechnology approaches to overcome biotic and abiotic stress constraints in legumes. Euphytica, vol 147, Issue 1-2, pp 1-24.
Djedidi, S.; Yokoyama, T.; Ohkama-Ohtsu, N.; Risal, C.P.; Abdelly, C. & Sekimoto, H. (2011). Stress Tolerance and Symbiotic and Phylogenic Features of Root Nodule Bacteria Associated with Medicago Species in Different Bioclimatic Regions of Tunisia. Microbes and Environments, Vol. 26, pp. 36-45
Dumoulin V., Ney B., Gérard E., (1994). Variability of Seed and Plant Development in Pea. Crop Science, Vol. 34 No. 4, p. 992-998.
Duthion C. and Pigeaire A., (1991). Seed Lengths Corresponding to the Final Stage in Seed Abortion of Three Grain Legumes. Crop Science Vol. 31 No. 6, p. 1579-1583.
Dorin B, Treyer S., Paillard S., (2011). AgrimondeScenarios and Challenges for Feeding the World in 2050.
(Eds) Editions Quae, Paris. http://www.foresight-platform.eu/brief/efp-brief-no-196-agrimonde/
Guerin, V.; Pladys, D.; Trinchant, C. & Rigaud, J.M. (1991). Proteolysis and nitrogen fixation in faba-bean (Vicia faba) nodules under water stress. Physiologia Plantarum, Vol. 82, pp. 360-366
Hardy R.W.F., E.Jr. Knight. 1968. The biochenistry and postulated mechanisms of N2 fixation. "Progress in
Phytochemistry" (L. Reinhold, ed.), 387-469.
Hsiao, T.C. (1973). Plant responses to water stress. Annual Review of Plant Physiology, Vol. 24, pp. 519-570 Huang, B. & Gao, H. (2000). Root physiological characteristics associated with drought resistance in tall fescue cultivars. Crop Science, Vol. 40, pp. 196-203
Hungria, M. & Vargas, M.A.T. (2000). Environmental factors affecting N2 fixation in grain legumes in the tropics, with an emphasis on Brazil. Field Crops Research, Vol. 65, pp. 151-164
Jewell M.C., Campbell B.C. and Godwin I.D., (2010). Transgenic Plants for Abiotic Stress Resistance.
Transgenic Crop Plants, pp 67-132
Kolbert Z., Bartha B., and Erdei L., (2008). Osmotic stressand indole-3-butyric acid-induced NO generation are partially distinct processes in root growth and development in Pisum sativum. Physiologia Plantarum, Vol 133 Issue 2.
Layzell D.B., Pate J.S, Atkins C.A., Canvin D.T., (1981). Partitioning of Carbon and Nitrogen and the Nutrition of Root and Shoot Apex in a Nodulated Legume. Plant Physiology, vol. 67 no 1 30-36.
Lecoeur J. (1994) Phenological and morphological responses of pea (Psum sativum L.) to water deficit: consequences on number of reproductive nodes. INIST-CNRS, Cote INIST : T 104252
Magyar-Tábori K., Mendler-Drienyovszki N., and Dobránszki J. (2011) Models and Tolls for Studying Drought Stress Responses in Peas. OMICS Volume 15, Number 12.
Mahieu, S.; Germon, F.; Aveline, A.; Hauggaard-Nielsen, H.; Ambus, P. & Jensen, E.S. (2009). The influence of water stress on biomass and N accumulation, N partitioning between above and below ground parts and on N rhizodeposition during reproductive growth of pea (Pisum sativum L.). Soil Biology and
Biochemistry, Vol. 41, pp. 380-387
Manavalan, L.P.; Guttikonda, S.K.; Tran, L.S.P. & Nguyen, H.T. (2009). Physiological and Molecular Approaches to Improve Drought Resistance in Soybean. Plant and Cell Physiology, Vol. 50, pp. 1260-1276 Marino, D.; Gonzalez, E.M. & Arrese-Igor, C. (2006). Drought effects on carbon and nitrogen metabolism of pea nodules can be mimicked by paraquat: evidence for the occurrence of two regulation pathways under oxidative stresses. Journal of Experimental Botany, Vol. 57, pp. 665-673
Matile P., (1992) Chloroplast senescence. In crop Photosynthesis : Spatial and Temporal Determinants.
Amsterdam : Elsevier, pp. 413-440.
Minchin, P.E.H. & Lacointe, A. (2005). New understanding on phloem physiology and possible consequences for modelling long-distance carbon transport. New Phytologist, Vol. 166, pp. 771–779
Mitchell R.L. and Russell W.J., (1971). Root Development and Rooting Patterns of Soybean (Glycine max (L.) Merrill) Evaluated Under Field Conditions. Crop Science, Vol. 63 No. 2, p. 313-316.
Ney B., Duthion C. and Fontaine E., (1993) Timing of reproductive abortions in relation to cell division, water content and growth of the seeds of pea seeds. Crop Sci., 33, 267-270.
Ney B., Duthion C. and Turc O., (1994). Phenological response of pea to water stress during reproductive development. Crop Sci., 34, 141-146.
Noiraud N., Maurousset L., Lemoine R., (2001). Identification of a Mannitol Transporter, AgMaT1, in Celery Phloem. The Plant Cell, vol. 13 no. 3695-705.
Nougarède A., Rondet P., (1973b) Un modèle original d’organisation de la tige : étude du fonctionnement plastochronique chez le Pisum sativum L. var. ‘nain hâtif d’Annonay’. C.R. Acad. Sci. Fr., série D., 277, 997-1000.
Pate, J.S.; Atkins, C.A.; Hamel, K.; McNeil, D.L.; Layzell, D.B. (1979a). Transport of organic solutes in phloem and xylem of a nodulated legume. Plant Physiology, Vol. 63, pp.1082-1088
Salon C., Munier-Jolain N.G., Duc G., Voisin A.S., Grandgirard D., Larmure A., Emery R.J.N. and Ney B. (2001). Grain legume seed filling in relation to nitrogen acquisition : a review and prospect with particular reference to pea. Agronomie. 21, 539-552.
Sánchez F.J., Andrés E.F., Tenorio J.L. and Ayerbe L., (2004). Growth of epicotyls, turgor maintenance and osmotic adjustment in pea plants (Pisum sativum L.) subjected to water stress. Field Crops Research, vol 86, Issue 1, pages 81-90.
Schiltz S., Gallardo K., Huart M., Negroni L., Sommerer N., and Burstin J. (2004) Proteome Reference Maps of Vegetative Tissues in Pea. An Investigation of Nitrogen Mobilization from Leaves during Seed Filling.
Plant Physiology Vol. 135 pp. 2241-2260.
Schiltz S., Munier-Jolain N., Jeudy C., Burstin J. et Salon C. (2005) : Dynamics of Exogenous Nitrogen
Partitioning and Nitrogen Remobilization from Vegetative Organs in Pea Revealed by 15N in Vivo Labeling
throughout Seed Filling. Plant Physiology April 2005 vol. 137 no. 4 1463-1473.
Streeter, J.G. (2003). Effects of drought on nitrogen fixation in soybean root nodules. Plant Cell and
Environment, Vol. 26, pp. 1199-1204
Tilsner, J.; Kassner, N.; Struck, C. & Lohaus, G. (2005). Amino acid contents and transport in oilseed rape (Brassica napus L.) under different nitrogen conditions. Planta, Vol. 221, pp. 328-338
Tricot F., Crozat Y. and Pellerin S., (1997). Root growth and nodule establishment on pea (Pisum sativum L.). J. Exp. Bot., 48, 316, 1935-1941.
Vadez V., Berger J.D., Warkentin T, Asseng S., Ratnakumar P.C., Rao K.P., Gaur P.M., Munier-Jolain N.G., Larmure A., Voisin A.S., Sharma H.C., Pande S., Sharma M., Krishnamurthy L., Zaman M.A., (2012). Adaptation of grain legumes to climatic changes: A review. Agronomy for Sustainable Development 32, 31-44.
Verslues P.E., Agarwal M., Katiyar-Agarwal S., Zhu J. and Zhu J.K., (2006). Methods and concepts in quantifying resistance to drought, salt and freezing, abiotic stresses that affect plant water status. The Plant
Journal, Vol 45; issue 4, p 523-539.
Voisin A.S., Guéguen J., Huyghe C., Jeuffroy M.H., Magrini M.B., Meynard J.M., Mougel C., Pellerin S., and Pelzer E. (2013) Les légumineuses dans l’Europe du XXIè siècle : Quelle place dans les systèmes agricoles et alimentaires actuels et futurs ? Quels nouveaux défis pour la recherche ? Innovations
Agronomiques 30, 283-312
Voisin, A.S.; Salon, C.; Munier-Jolain, N.G. & Ney, B. (2002b). Quantitative effect of soil nitrate, growth potential and phenology on symbiotic nitrogen fixation of pea (Pisum sativum L.). Plant and Soil, Vol. 243, pp. 31-42.
Effet d’un stress hydrique de début et de fin de cycle chez le pois
Mots clefs : pois, stress hydrique, remplissage de la graine, taux carbone azote, remobilisation.
La sécheresse est un des facteurs limitant le plus important pour les cultures de pois et affecte chaque année la qualité et la quantité des récoltes. Dans le but de mieux comprendre les réactions du pois au stress hydrique, deux expériences ont été menées. Une première expérience qui a pour but d’évaluer l’effet d’un stress hydrique en phase végétative ainsi que l’effet d’une ré-humectation sur le compartiment racinaire (racine et nodules). Le stage a porté sur l’analyse d’image de feuilles et de racines stressées et non stressées ainsi que sur la quantification en éléments carbone et azote des différents compartiments. Une seconde expérience qui a pour but d'évaluer l’effet d’un stress hydrique sur le remplissage de la graine et sur la remobilisation des assimilats des parties végétatives. Le stage était porté sur la mise en place de l’expérience et la réalisation des prélèvements pour évaluer la biomasse des différents compartiments de la plante et qui permettront également d’extraire les ARN et les métabolites des tissus. Lors d’un stress hydrique avant floraison, l’impact au niveau des taux C/N semble continuer durant la première et seconde semaine après la fin du stress. Il semblerait qu’un stress modéré appliqué au début de remplissage pendant une semaine n’a pas d’effet sur l’accumulation de la biomasse dans les différents compartiments.
Effect of water stress at the beginning and at the end of cycle in pea
Key-words : pea, water stress, remobilization, seed filling, C/N rate.
Drought is the most important limiting factor for pea in the world, affecting every year the quality and quantity of crops. However, there are still many gray areas on water stress and its effect on pea. Two experiments were performed on pea : - Water stress on peas at the beginning of cycle, which aims to evaluate, in vegetative phase, the effect (i) of water stress and (ii) re-wetting, on the acquisition of carbon and nitrogen and their distribution in pea. The mission of the training focused on image analysis in leaves and roots, as well as the quantification of carbon and nitrogen elements in each organ.
- Water stress on peas at the end of cycle, which aims to (i) assess the development and characterization of seed filling (ii) analyze the morphology of the stressed peas. The mission of the training was focused on the follow of growth, flowering and physiological characterization. During water stress before flowering, the impact for the rate C/N seems to continue during the first and second week after the end of stress. It appears that a moderate stress applied at the beginning of filling for one week had no effect on the accumulation of biomass in the different compartments.