Rôles des récepteurs nucléaires Nur77 et Nor-1 et des
neuropeptides enképhaline et dynorphine dans les
comportements médiés par la dopamine et induits par
les psychostimulants
Thèse
Céline Hodler
Programme de doctorat en Neurobiologie
Philosophiae doctor (Ph.D.)
Faculté de médecine
Québec, Canada
© Céline Hodler, 2012
I
RÉSUMÉ
Cette thèse démontre que les récepteurs nucléaires Nur77 et Nor-1 ainsi que les neuropeptides dynorphine (DYN) et enképhaline (ENK) sont des facteurs déterminants de la régulation du système dopaminergique. Notre premier manuscrit démontre d’une part que Nur77 et Nor-1 sont très clairement impliqués dans la régulation de l’homéostasie du système dopaminergique et qu’ils y jouent des rôles distincts, voire opposés, dans les conditions basales et dans les réponses comportementales et biochimiques aux psychostimulants. La délétion génétique de Nur77 augmente la proportion des récepteurs D2 en haute affinité (D2high), supprime les stéréotypies et perturbe la persistance de la préférence de place induites par l’administration répétée de psychostimulants. À l’inverse, la délétion de Nor-1 diminue la proportion des récepteurs D2high, atténue les comportements moteurs en réponse à l’amphétamine et supprime la sensibilisation comportementale. La délétion de Nor-1 module également l’expression de la DYN et de l’ENK favorisant ainsi une diminution de la réponse comportementale alors que celle de Nur77 induit l’effet inverse. Ainsi, Nor-1 et Nur77 jouent des rôles opposés, la délétion de Nor-1 tempère les comportements moteurs, celle de Nur77 les exacerbe. Notre second manuscrit démontre d’autre part que la DYN et l’ENK sont toutes deux nécessaires et ont des rôles opposés dans la manifestation des comportements de base médiés par la dopamine. Par contre, dans les conditions d’une exposition répétée aux psychostimulants, la DYN et l’ENK agissent de concert en potentialisant l’exacerbation de l’activité locomotrice et sont donc toutes deux indispensables à la sensibilisation comportementale. Nos travaux révèlent également l’existence d’interactions entre les neurotransmissions enképhalinergique et dynorphinergique et donc entre les deux voies de sortie indirecte et directe des ganglions de la base. Aussi, les neuropeptides DYN et ENK sont modulés différentiellement par la délétion de Nur77 et de Nor-1 et inversement leur délétion régule de manière différente l’expression de ces facteurs de transcription. Ceci suggère l’existence d’une relation de régulation réciproque entre les récepteurs nucléaires et ces neuropeptides. Nur77 et Nor-1 sont donc des régulateurs clés de la transmission dopaminergique et des réponses comportementales aux psychostimulants et ce, principalement via la modulation des récepteurs dopaminergiques et des neuropeptides striataux.
II
ABSTRACT
This present study demonstrates that the nuclear receptors Nur77 and Nor-1 and the neuropeptides dynorphin (DYN) and enkephalin (ENK) are crucial in dopaminergic system regulation. On one hand, our first manuscript shows that Nur77 and Nor-1 are deeply involved in the homeostatic regulation of the dopaminergic system and play distinct, mostly opposite roles, in basal dopaminergic neurotransmission and in psychostimulants-induced behavioral and biochemical effects. In particular, Nur77 deletion exacerbates the behavioral effects of both acute and chronic amphetamine (AMPH) administrations while Nor-1 deletion has the opposite effect. In fact, Nur77 deletion favors the upregulation of the proportion of D2 receptors in high affinity state (D2high) and suppress AMPH-induced stereotyped behavior. On the contrary, Nor-1 deletion downregulates the D2high receptors proportion, attenuates locomotor activity in response to chronic AMPH administration and consequently suppresses the development of behavioral sensitization. Nor-1 deletion modulates DYN and ENK expression in a way that promotes decreased behavioral responses to psychostimulants and that is opposite to the effects of Nur77 deletion on these very same neuropeptides. Also, Nur77 deletion suppresses the persistance of cocaine-induced place preference wherese Nor-1 deletion has no effect. Thus, Nor-1 and Nur77 mostly play opposite roles, Nor-1 deletion dampens ambulatory activity whereas Nur77 deletion exacerbates it. On the other hand, our second manuscript shows that DYN and ENK are both necessary and play opposite roles in dopamine-mediated basal behaviors. However, during chronic psychostimulants exposure, DYN and ENK both contribute to the exacerbation of locomotor activity and they are consequently both essential for the expression of behavioral sensitization. Besides, our results highlight a cross-talk between ENK and DYN neurotransmissions and thus between the indirect and direct output pathways of the basal ganglia. Interestingly, we also show that the striatal DYN and ENK deletions could differentially modulate Nur77 et Nor-1 expression. This suggests that the nuclear receptors and the neuropeptides ENK and DYN share an intimate reciprocal regulation relationship. Collectively, our results strongly establish that Nur77 and Nor-1 are key regulators of the dopaminergic neurotransmission and of behavioral responses to psychostimulants and this, mostly via the modulation of dopaminergic receptors and striatal neuropeptides.
III
AVANT-PROPOS
Je tiens à remercier, en premier lieu, mon directeur et mon co-directeur de recherche, les Drs Claude Rouillard et Daniel Lévesque. Ce fut un privilège d'avoir pu travailler avec ces chercheurs compétents, passionnés et généreux. Merci pour votre soutien, vos encouragements, votre confiance, votre précieuse expérience et votre disponibilité.
Avant tout, Claude, merci de m’avoir accordé ta confiance et de m'avoir donné la chance de travailler à tes côtés à la maîtrise puis au doctorat. Merci aussi pour ton soutien financier qui m'a permis de m'investir pleinement dans mes études. Merci pour ton encadrement bienveillant. J'ai tiré un grand plaisir de nos discussions au laboratoire, et je tiens en particulier à t’exprimer ma gratitude pour tes conseils avisés, tes encouragements, ton réconfort et ta compréhension lors de mes moments de fragilité et d’incertitude. Tu as contribué à rendre plus lumineuses et prometteuses mes années au Québec grâce à ton écoute et à ton soutien dans mes projets professionnels.
Un immense merci à Brigitte Paquet, premièrement pour m'avoir assistée et formée pendant toutes ces années. Deuxièmement, et de façon encore plus significative à mes yeux, merci pour toutes ces petites attentions qui ont su égailler mes journées. Merci à tous mes amis et collaborateurs, je pense à, Joanie Baillargeon, Aurore Voisin, Emmanuelle Bourhis, Cécile Vue, Jérôme Maheux, Michel st-Hilaire, François Gilbert, Marc Cloutier. Un merci tout spécial à Emmanuelle Berret et Antoine Hone-Blanchet, vos personnalités joyeuses et votre esprit plaisantin ont su me motiver dans les moments de découragement. Merci pour votre aide précieuse et votre amitié. Vous avez tous été d’une aide essentielle pour l’élaboration et l’aboutissement de mon projet de recherche.
J'aimerais aussi remercier mes parents, Marie-Claire et Jürg, pour m’avoir soutenu financièrement pendant mes études. Merci surtout à mes frères, David et Manuel, pour leur présence réconfortante, leur complicité, leur humour imparable et leur amour inconditionnel qui m’ont été indispensables et salutaires dans les moments difficiles.
IV
Bien que je sois première auteure des deux articles composant les chapitres 2 et 3 de cette thèse, j'ai bénéficié de la collaboration de plusieurs de mes collègues et, bien évidemment, des Drs Claude Rouillard et Daniel Lévesque.
Le chapitre 2 de ma thèse, « Distinct roles for the nuclear receptors Nur77 and Nor-1 in dopamine-mediated and psychostimulant-induced behaviors », est un article en voie de soumission dans un journal international de haut calibre. J'ai été directement impliqué dans toutes les étapes qui ont menées à la réalisation de cette étude. J'ai effectué tous les traitements et quantifications des comportements chez les souris. J'ai également réalisé les perfusions et prélèvements des cerveaux. J’ai aussi effectué toutes les hybridations in situ. J'ai également procédé à la quantification et l'analyse statistique des résultats. La rédaction de l'article a été réalisée par moi-même et révisée par le Dr. Claude Rouillard. Antoine Hone-blanchet, est présenté comme second auteur car il m’a fourni les données biochimiques concernant l’expression de la DYN suite à l’administration aigüe d’amphétamine chez les souris Nur77 (-/-). Joanie Baillargeon et Brirgitte Paquet, nos deux assistantes de recherche, ont aidé à la quantification de certains protocoles et m’ont assistée lors des chirurgies. Le Dr. Philip Seeman m’a fourni les données concernant le pourcentage d’expression des récepteurs D2 en haute affinité. Le Dr. Daniel Lévesque a, avec le Dr. Claude Rouillard, participé à l'élaboration des hypothèses de recherche, à la mise sur pied des protocoles expérimentaux, ainsi qu’à la correction de l'article.
Le chapitre 3, «Implication of the endogenous striatal neuropeptides Enkephalin and Dynorphin in dopamine-mediated and psychostimulant-induced behaviors.», est un article en voie de soumission dans un journal international. Dans cette étude, Brigitte Paquet m’a assistée pour la réalisation des expériences comportementales, et notamment lors de l'administration des traitements. J’ai réalisé les techniques d'hybridation in situ, la quantification, l'analyse et l'interprétation des résultats. Joanie Baillargeon m’a prêté son assistance pour une partie des quantifications ainsi que pour la perfusion des animaux. Emmanuelle Bourhis a réalisé le protocole de colocalisation de Nur77 avec la substance P et l’enképhaline (figure 3.4). J'ai aussi rédigé la totalité de l'article qui a été, par la suite, révisé par le Dr. Rouillard. Le Dr. Claude Rouillard et le Dr. Daniel Lévesque ont participé à l'élaboration des hypothèses de recherche, à la mise sur pied des protocoles expérimentaux, ainsi qu’à la correction de l'article.
V
TABLE DES MATIÈRES
RÉSUMÉ ... I ABSTRACT ... II AVANT-PROPOS ... III TABLE DES MATIÈRES ... V LISTE DES FIGURES ... X LISTE DES ABRÉVIATIONS ... XIV
CHAPITRE 1. INTRODUCTION GENERALE ... 1
1.1 Introduction ... 1
1.2 La transmission dopaminergique ... 4
1.2.1 Métabolisme de la dopamine ... 4
1.2.2 Les récepteurs de la dopamine ... 6
1.2.2.1 Localisation tissulaire et cellulaire ... 6
1.2.2.2 Voies de signalisation ... 7
1.2.2.3 Propriétés des récepteurs dopaminergiques ... 12
1.2.3 Les circuits dopaminergiques ... 14
1.2.3.1 Le circuit mésocorticolimbique ... 15
1.2.3.2 Le circuit nigro-strié ... 22
1.3 Modulation de la transmission dopaminergique ... 28
1.3.1 Les neuropeptides striataux endogènes ... 28
1.3.1.1 Définition et caractéristiques de la dynorphine striatale... 29
1.3.1.2 Définition et caractéristiques de l’enképhaline striatale ... 31
1.3.1.3 Sélectivité relative des récepteurs opioïdes ... 32
1.3.2 Les psychostimulants ... 33
1.3.2.1 Caractéristiques et mode d’action des psychostimulants ... 33
1.3.2.2 Comportements induits par les psychostimulants ... 35
1.3.2.3 Effets des psychostimulants sur les neuropeptides endogènes ... 41
1.3.2.4 Neuroadaptations induites par les psychostimulants ... 48
1.4 Les récepteurs nucléaires ... 59
1.4.1 Caractéristiques générales des récepteurs nucléaires... 61
1.4.1.1 Définition... 61
1.4.1.2 Structure ... 62
1.4.1.3 Modulation de l’activité des récepteurs nucléaires ... 64
1.4.2 Les récepteurs nucléaires de la sous-famille NR4A ... 65
1.4.2.1 Définition... 65
1.4.2.2 Structure ... 66
1.4.2.3 Liaison à l’ADN ... 68
VI
1.4.3 Rôles périphériques et centraux de la sous-famille NR4A ... 70
1.4.3.1 Rôles en périphérie ... 70
1.4.3.2 Rôles au niveau du système nerveux central ... 76
1.5 Phénotypes des souris déficientes pour les gènes préproenképhaline, prodynorphine, Nur77 ou Nor-1. ... 95
1.5.1 Phénotypes connus des souris Nur77 (-/-) et Nor-1 (-/-) ... 96
1.5.2 Phénotypes connus des souris ENK (-/-) et DYN (-/-) ... 97
1.5.2.1 Phénotypes connus des souris ENK (-/-) ... 97
1.5.2.2 Phénotypes connus des souris DYN (-/-) ... 99
1.6 Les objectifs de la thèse ... 101
CHAPITRE 2 ... 106
Distinct roles for the nuclear receptors Nur77 and Nor-1 in dopamine-mediated and psychostimulant-induced behaviors ... 106
2.1 RÉSUMÉ ... 107
2.2 ABSTRACT ... 109
2.3 INTRODUCTION ... 110
2.4 MATERIALS AND METHODS ... 112
2.4.1 Animals ... 112
2.4.2 Basal activity and AMPH-induced behaviors ... 112
2.4.2.1 Basal locomotor activity ... 112
2.4.2.2 Acute AMPH and chronic AMPH-induced behaviors ... 113
2.4.3 Conditioned place preference... 114
2.4.3.1 Place preference conditioning apparatus ... 114
2.4.3.2 Behavioral conditioning procedure ... 115
2.4.4 In situ hybridizations ... 116
2.4.5 D2high States ... 117
2.4.6 Quantification analysis ... 118
2.4.7 Statistical analysis ... 119
2.5 RESULTS ... 119
2.5.1 Basal locomotor activity in Nur77 and Nor-1knockout mice: ... 119
2.5.1.1 Locomotor activity measured in the home cage ... 119
2.5.1.2 Spontaneous locomotor activity measured in a new environment ... 120
2.5.2 Striatal D2 receptors in Nur77 and Nor-1 knockout mice: ... 121
2.5.3 Acute AMPH-induced activity in Nur77 and Nor-1 knockout mice: ... 121
2.5.4 Effect of acute AMPH administration on ENK and DYN mRNA expression in Nur77 and Nor-1 knockout mice: ... 122
VII
2.5.4.1 ENK mRNA expression after acute AMPH administration ... 122
2.5.4.2 DYN mRNA expression after acute AMPH administration ... 123
2.5.5 Chronic AMPH-induced activity in Nur77 and Nor-1 knockout mice: ... 124
2.5.5.1 Repeated injection of a 5 mg/kg AMPH dose in Nur77 knockout mice ... 124
2.5.5.2 Repeated injection of a 2.5 mg/kg AMPH dose in Nur77 knockout mice ... 125
2.5.5.3 Repeated injection of a 2.5 mg/kg AMPH dose in Nor-1 knockout mice ... 126
2.5.6 Effect of chronic AMPH administration on ENK and DYN mRNAs in Nur77 and Nor-1 knockout mice: ... Nor-127
2.5.6.1 ENK mRNA expression after repeated AMPH administration ... 127
2.5.6.2 DYN mRNA expression after repeated AMPH administration ... 128
2.5.7 Effect of chronic AMPH administration on Nor-1 and Nur77 mRNAs in respectively Nur77 and Nor-1 knockout mice: ... 129
2.5.7.1 Nor-1 mRNA expression after chronic AMPH administration ... 129
2.5.7.2 Nur77 mRNA expression after chronic AMPH administration ... 129
2.5.8 Cocaine-induced conditioned place preference in Nur77 and Nor-1 knockout mice: ... 130
2.5.9 Expression of Nur77 mRNA, after acute or chronic cocaine administration in the hippocampus of wild-type mice: ... 131
2.6 DISCUSSION ... 131
2.6.1 Opposing roles of Nur77 and Nor-1 in basal and spontaneous activity: ... 131
2.6.2 Distinct roles of Nur77 and Nor-1 in acute AMPH-induced activity: ... 132
2.6.3 Distinct roles of Nur77 and Nor-1 in chronic AMPH-induced activity: ... 133
2.6.4 Distinct roles of Nur77 and Nor-1 in conditioned preference place: ... 137
2.7 CONCLUSION ... 139
2.8 FIGURES AND LEGENDS ... 140
2.9 SUPPLEMENTAL MATERIALS ... 168
CHAPITRE 3 ... 178
Implication of the endogenous striatal neuropeptides Enkephalin and Dynorphin in dopamine-mediated and psychostimulant-induced behaviors ... 178
3.1 RÉSUMÉ ... 179
3.2 ABSTRACT ... 181
3.3 INTRODUCTION ... 183
3.4 MATERIALS AND METHODS ... 187
3.4.1 Animals ... 187
3.4.2 Basal locomotor activity and AMPH-induced behaviors ... 188
3.4.2.1 Basal locomotor activity ... 188
VIII
3.4.3 Conditioned place preference... 190
3.4.3.1 Place preference conditioning apparatus ... 190
3.4.3.2 Behavioral conditioning procedure ... 190
3.4.4 In situ hybridizations ... 191
3.4.5 Double labeling of Nur77 with SP or ENK mRNA transcripts after acute AMPH administration ... 192
3.4.6 Quantification analysis ... 194
3.4.7 Statistical analysis ... 195
3.5 RESULTS ... 196
3.5.1 Basal locomotor activity in ENK and DYN knockout mice: ... 196
3.5.2 Acute AMPH-induced activity in ENK and DYN knockout mice: ... 196
3.5.3 Effect of acute AMPH administration on Nur77 and DYN mRNAs in ENK and DYN knockout mice: ... 198
3.5.3.1 Nur77 mRNA expression after acute AMPH administration ... 198
3.5.3.2 DYN mRNA expression after acute AMPH administration ... 198
3.5.4 Chronic AMPH-induced activity in ENK and DYN knockout mice: ... 199
3.5.4.1 Effect of repeated AMPH administration in ENK knockout mice ... 199
3.5.4.2 Effect of repeated AMPH administration in DYN knockout mice ... 200
3.5.5 Effect of chronic AMPH administration on Nur77 and Nor-1 mRNAs in ENK and DYN knockout mice: ... 202
3.5.5.1 Nur77 mRNA expression after chronic AMPH administration ... 202
3.5.5.2 Nor-1 mRNA expression after chronic AMPH administration ... 202
3.5.6 Effect of chronic AMPH administration on DYN and ENK mRNAs in respectively ENK and DYN knockout mice: ... 203
3.5.6.1 DYN mRNA expression after chronic AMPH administration ... 203
3.5.6.2 ENK mRNA expression after chronic AMPH administration ... 203
3.5.7 Cocaine-induced conditioned place preference induced in ENK and DYN knockout mice: ... 204
3.6 DISCUSSION ... 205
3.6.1 Effect of DYN and ENK deletion on basal motor activity ... 205
3.6.2 Effect of acute AMPH in DYN and ENK knockout mice ... 206
3.6.3 Effect of chronic AMPH in ENK and DYN knockout mice ... 209
3.6.3.1 Behavioral consequences ... 209
3.6.3.2 Biochemical consequences and implications ... 212
3.6.4 Cocaine-induced conditioned place preference in ENK and DYN knockout mice: ... 217
3.7 CONCLUSION ... 219
3.8 FIGURES AND LEGENDS ... 220
IX
CHAPITRE 4. DISCUSSION GÉNÉRALE ET CONCLUSIONS ... 250
4.1 Activité basale médiée par la dopamine ... 251
4.1.1 Rôles opposés de Nur77 et Nor-1 ... 251
4.1.2 Effets de la délétion de l’ENK ou de la DYN sur l’activité locomotrice de base ... 255
4.2 Effets aigus des psychostimulants ... 258
4.2.1 Rôles de Nur77 et Nor-1 dans les effets aigus des psychostimulants ... 258
4.2.2 Rôles de l’ENK et de la DYN dans les effets aigus des psychostimulants ... 262
4.3 Effets chroniques des psychostimulants ... 267
4.3.1 Rôles de Nur77, Nor-1, DYN et ENK dans la sensibilisation comportementale ... 267
4.3.1.1 Rôles opposés de Nur77 et Nor-1 dans la sensibilisation comportementale ... 267
4.3.1.2 Rôles de l’ENK et de la DYN dans la sensibilisation comportementale ... 281
4.3.2 Rôles de Nur77, Nor-1, DYN et ENK dans la préférence de place ... 289
4.3.2.1 Rôles de Nur77 et Nor-1 dans la préférence de place ... 289
4.3.2.1 Rôles de l’ENK et de la DYN dans la préférence de place ... 294
CONCLUSION GÉNÉRALE ... 298
X
LISTE DES FIGURES
CHAPITRE 1
Figure 1.1: Le ciblage pharmaceutique de la transmission dopaminergique. 2 Figure 1.2: Les étapes de la biosynthèse de la dopamine. 4 Figure 1.3: Les récepteurs de la dopamine et leurs effets sur une de leur principale voie de
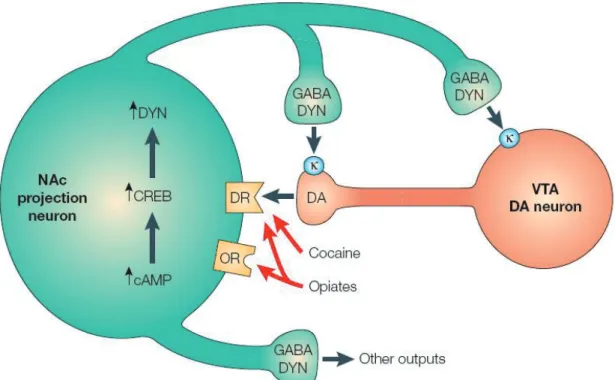
signalisation, celle de l’adénylate cyclase. 11 Figure 1.4: Schéma du circuit de la « récompense » ou circuit mésocorticolimbique. 18 Figure 1.5: Schéma des ganglions de la base. 24 Figure 1.6: Circuits neuronaux impliqués dans les comportements planifiés et automatisés. 27 Figure 1.7: Mécanismes d’action des psychostimulants. 34 Figure 1.8: Accumulation graduelle de ∆FosB versus l’induction rapide et transitoire des
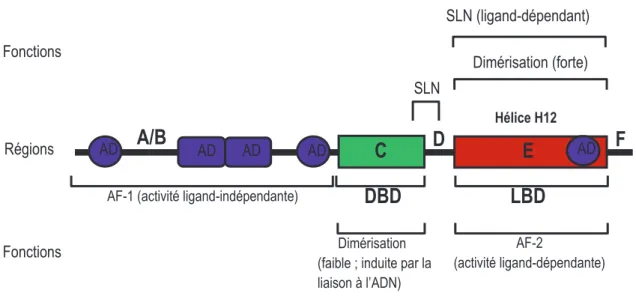
autres protéines de la famille Fos dans le cerveau. 51 Figure 1.9: La dynorphine est une cible potentielle de ∆FosB. 53 Figure 1.10: Régulation de CREB par les drogues d’abus. 56 Figure 1.11: Distribution des récepteurs nucléaires dans le SNC de souris adultes. 60 Figure 1.12: Schéma de la structure des récepteurs nucléaires. 63 Figure 1.13: A. Structure d’un récepteur nucléaire et représentation schématique des séquences
qui correspondent aux gènes des membres de la sous-famille NR4A. 67 B. Illustration de la structure tertiaire du domaine de LBD de Nurr1. 67 Figure 1.14: Mécanismes de l’activité transcriptionnelle des membres de la
sous-famille NR4A. 69
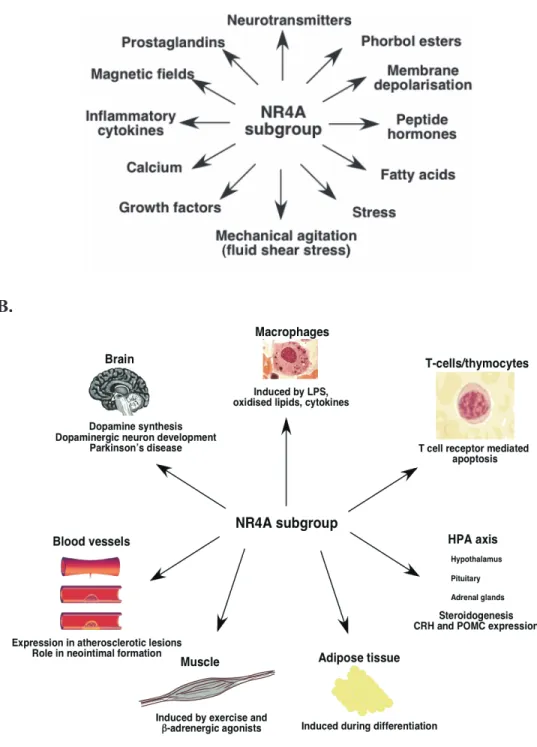
Figure 1.15: A. Divers stimuli peuvent induire l’expression des membres de la
sous-famille NR4A. 71
B. Effets spécifiques de la sous-famille des Nurs (NR4A) sur certains organes
XI Figure 1.16: (a) Relation entre l’isoforme RXRγ1 du récepteur rétinoïde RXR,
les récepteurs Nurs et la neurotransmission DAergique. 77 (b) Voies dopaminergiques et maladies neurologiques et psychiatriques
possiblement influencées par l’expression des Nurs. 77 (c) Induction de Nur77 dans le complexe SN/VTA par des antagonistes des
récepteurs D2. 77
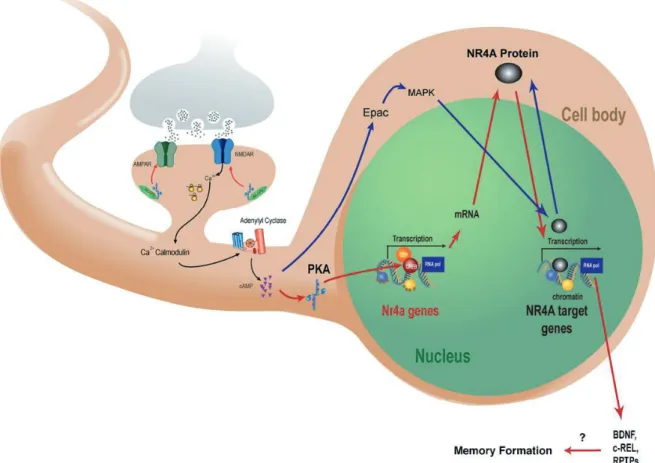
Figure 1.17: La cascade de signalisation AMPc–PKA CREB, qui est cruciale pour la formation de la mémoire, induit l’expression des gènes codant pour les
récepteurs nucléaires NR4A. 88
CHAPITRE 2
Figure 2.1: Basal locomotor activity measured in Nur77 and Nor-1 knockout mice. 140 Figure 2.2: Comparison of “flex field” spontaneous activities and adaptation in Nur77
knockout mice versus Nor-1 knockout mice. 142 Figure 2.3: Proportion of striatal high affinity D2 receptors expression in Nur77 and
Nor-1 knockout mice. 144
Figure 2.4: Comparison of activities after acute AMPH administration (2.5 mg/kg) in
Nur77 and Nor-1 knockout mice. 146 Figure 2.5: ENK mRNA expression after acute AMPH administration in Nur77
knockout mice and in Nor-1 knockout mice. 148
Figure 2.6: DYN mRNA expression after acute AMPH administration in A: Nur77
knockout mice and in B: Nor-1 knockout mice. 150 Figure 2.7: Chronic AMPH (5 mg/kg/day) administration-induced activities in Nur77
knockout mice. 152 Figure 2.8: Chronic AMPH (2.5 mg/kg/day) administration-induced activities in Nur77
knockout mice. 154
Figure 2.9: Chronic AMPH (2.5 mg/kg/day) administration-induced activities in Nor-1
knockout mice. 156
Figure 2.10: ENK mRNA expression after repeated AMPH (2.5 mg/kg) administration in
Nur77 and Nor-1 knockout mice. 158
Figure 2.11: DYN mRNA expression after repeated AMPH (2.5 mg/kg) administration in
Nur77 and Nor-1 knockout mice. 160
Figure 2.12: Nor-1 and Nur77 mRNA expression after repeated AMPH (2.5 mg/kg)
XII
Figure 2.13: Cocaine-induced conditioned place preference in Nur77 and in
Nor-1 knockout mice. 164
Figure 2.14: Nur77 mRNA expression after repeated cocaine (15 mg/kg/day) administration
in the hippocampus of wild-type mice. 166
Figure S2.1: The three components of activity during the 120 minutes-recording period
of the 5 mg/kg AMPH dose challenge in Nur77 knockout mice. 168 Figure S2.2: The three components of activity during the 120 minutes-recording period
of the 2.5 mg/kg AMPH dose challenge in Nur77 knockout mice. 170 Figure S2.3: The three components of activity during the 120 minutes-recording period
of the 2.5 mg/kg AMPH dose challenge in Nor-1 knockout mice. 172 Figure S2.4: Nor-1 mRNA expression after repeated AMPH (2.5 mg/kg) administration
in the ventral striatum of Nur77 knockout mice. 174
CHAPITRE 3
Figure 3.1: Basal locomotor activity measured in ENK and DYN knockout mice. 220 Figure 3.2: Comparison of acute AMPH induced activities in ENK and DYN knockout mice. 222 Figure 3.3: Nur77 mRNA expression after acute AMPH administration in A: ENK
knockout mice and in B: DYN knockout mice. 224 Figure 3.4: Nur77 mRNA colocalization with SP or ENK after acute AMPH administration
in wild-type mice. 226
Figure 3.5: DYN mRNA expression after acute AMPH administration in ENK knockout mice. 228 Figure 3.6: Chronic AMPH administration-induced activities in ENK knockout mice. 230 Figure 3.7: Chronic AMPH administration-induced activities in DYN knockout mice. 232 Figure 3.8: Nur77 mRNA expression after chronic AMPH administration in ENK and
in DYN knockout mice. 234
Figure 3.9: Nor-1 mRNA expression after chronic AMPH administration in ENK and
XIII Figure 3.10: DYN and ENK mRNA expression after chronic AMPH administration in
ENK and in DYN knockout mice. 238
Figure 3.11: Cocaine-induced conditioned place preference in ENK and in DYN
knockout mice. 240
Figure S3.1: Spontaneous activities and adaptation in ENK and DYN knockout mice. 242 Figure S3.2: The three components of activity during the 120 minutes-recording period that
followed AMPH challenge in ENK knockout mice. 244 Figure S3.3: The three components of activity during the 120 minutes-recording period that
followed AMPH challenge in DYN knockout mice. 246
CHAPITRE 4
Figure 4.1: Schéma de l’effet de la délétion de Nur77 et de Nor-1 sur l’affinité des
récepteurs D2 et sur l’activité locomotrice de base. 254 Figure 4.2: Schéma de l’effet de l’administration chronique d’AMPH chez les
souris sauvages. 271
Figure 4.3: Hypothèse explicative de l’effet de Nur77 sur la synthèse de l’ENK dans
différentes conditions (aigüe, chronique, chronique avancée) 275 Figure 4.4: Administration chronique d’AMPH chez les souris Nur77 knockout et
XIV
LISTE DES ABRÉVIATIONS
AADC : Décarboxylase des acides amines aromatiques(L-aromatic amino acid decarboxylase) AC : Adénylate cyclase
ACTH : Corticotropine (Adrenocorticotropic hormone) ADN : Acide désoxyribonucléique
AF-1 : Domaine d’activation de la transcription 1 AF-2 : Domaine d’activation de la transcription 2 AMPc : Adénosine monophosphate cyclique AMPH : Amphétamine
ANOVA : Analysis of variance
AP-1 : Complexe d’activation de la transcription 1(Activating Protein 1) ARNm : Acide ribonucléique messager
ATV : Aire tegmentale ventrale Bcl-2: B-cell lymphoma 2
BDNF: Brain-derived neurotrophic factor BG : Basal ganglia
CA1: Corne d’Ammon 1 CA2: Corne d’Ammon 2 CA3: Corne d’Ammon 3
CAMK : Ca2+/Calmoduline-dependent kinase CAMKII : Ca2+/Calmoduline-dependent kinase II
COMT : Catéchol-o-méthyltransférase
CMH : Complexe majeur d’histocompatibilité CNS : Central nervous system
CPP : Conditionned place preference CRE : Cyclic AMP response element
CREB : Facteur de transcription CREB (Cyclic AMP response element-binding protein) CRH : Hormone de libération de la corticotropine (Corticotropin –Releasing Hormone) CRM : Complexe de remodelage de la chromatine
Csn-B : Cytosporone B
CTAP : D-Phe-Cys-Tyr-D-Trp-Arg-Thr-Pen-Thr-NH2 CTOP : D-Phe-Cys-Tyr-D-Trp-Orn-Thr-Pen-Thr-NH2 DA : Dopamine
DAergique : Dopaminergique
DAT : Transporteur de la dopamine (Dopamine transporter) DBD : Domaine de liaison à l’ADN (DNA-binding domain) DHA : Acide docosahexaénoïque
DMI: Désipramine
DNA: Acide désoxyribonucléique (Desoxyribo nucleic acid) DOR : Récepteur opioïde δ (δ opioid receptor)
XV DYN: Dynorphine
END: Endorphine ENK: Enképhaline
ER: Élément de réponse
ERK: Extracellular signal-regulated kinases GABA : Acide γ-amino-butyrique
GPe : Segment externe du globus pallidus GPi : Segment interne du globus pallidus GRK 6 : G protein-coupled receptor kinase 6 HAT : Histone acétyltransferase
HDAC : Histone déacétylasee
HHS : Hypothalamo-hypophyso-surrénalien
HRE : Élément de réponse aux hormones (Hormone Response Element) i. c. v. : Intracérébroventriculaire
IEGs: Gènes à induction précoce (Immediate Early Genes) IL-1β : Interleukine 1β
INF-γ : Interféron gamma i. p. : Intrapéritonéal KO : Knock out
KOR : Récepteur opioïde κ (κ opioid receptor)
LBD : Domaine de liaison du ligand (Ligand-binding domain) L-DOPA : L-3,4-dihydroxy-phénylalanine
LTD : Dépression à long terme (Long Term Depression) LTP : Potentialisation à long terme (Long Term Potentiation) MAO : Monoamine oxydase
MAPK : Protéine kinase associée aux mitogènes (Mitogen Activated Protein Kinase) MARCKS : Myristoylated alanine-rich C-kinase substrate
MEF2 : Myocyte enhancer factor 2
MOR : Récepteur opioïde μ (μ opioid receptor) MP : Maladie de Parkinson
MPTP : 1-méthyl-4-phényl-1,2,3,6-tétrahydropyridine MSNs : Neurones moyens épineux (Medium Spiny Neurons) NAc : Noyau Accumbens
NBRE : NGFI-B response element NF-κB : nuclear factor-kappa B NMDA : N-methyl-D-aspartate NR : Nuclear hormone receptor NR4A : Nuclear receptors 4A subgroup NST : Noyau sous-thalamique
NT : Neurotensine
NurRE : Nur-responsive element PFA : Paraformaldéhyde
PI3K : Phosphatidylinositol-3-kinase PKA : Protéine kinase A
XVI
PKB : Protéine kinase B PKC : Protéine kinase C POMC : Pro-opiomélanocortine
PPC : Préférence de place conditionnée RCPGs : Récepteurs couplés aux protéines G RGS9 : Regulator of G-protein-signaling 9 RM : Repeated mesures
RNA : Acide ribonucleique (Ribonucleic acid) RPTPs : Receptor protein tyrosine phosphatases RXR : Récepteur X de l’acide rétinoïque SD : Sprague –Dawley rat strain SLN : Signal de localisation nucléaire SN : Substance noire
SNC : Système nerveux central SNc : Substance noire pars compacta SNr : Substance noire pars réticula SP : Substance P
STDL : Striatum dorsolatéral STDM : Striatum dorsomédial STVL: Striatum ventrolatéral STVM : Striatum ventromédial TCR: T-cell antigen receptor
TDAH: Troubles de deficit de l’attention/hyperactivité TH: Tyrosine hydroxylase
TNF-α: Tumor necrosis factor alpha UFAs : Unsaturated fatty acids VEH: Vehicle (solution saline 0.9%)
VMAT : Transporteur vésiculaire des monoamines (Vesicular Monoamine Transporter)
VMAT2 : Transporteur vésiculaire de type 2 des monoamines (Vesicular Monoamine Transporter 2)
VTA: Ventral Tegmental area WKY: Wistar-Kyoto rat strain 6-OHDA: 6-hydroxy-dopamine
Chapitre 1
1
CHAPITRE 1. INTRODUCTION GENERALE
1.1 Introduction
La neurotransmission dopaminergique (DAergique) revêt une importance capitale au sein du système nerveux central (SNC). Elle est en effet, impliquée dans de nombreux mécanismes physiologiques tels que la mémoire, la cognition, l’apprentissage, la prise alimentaire, la production hormonale, le contrôle des fonctions motrices et les comportements motivationnels. Lorsque défectueuse, elle est aussi impliquée, plus ou moins directement, dans diverses maladies neurologiques et psychiatriques comme : la maladie de Parkinson (MP), la schizophrénie, les troubles de la consommation alimentaire (anorexie, boulimie, obésité) ainsi que la dépendance aux drogues d’abus (pour revue : Bjorklund et Dunnett, 2007b).
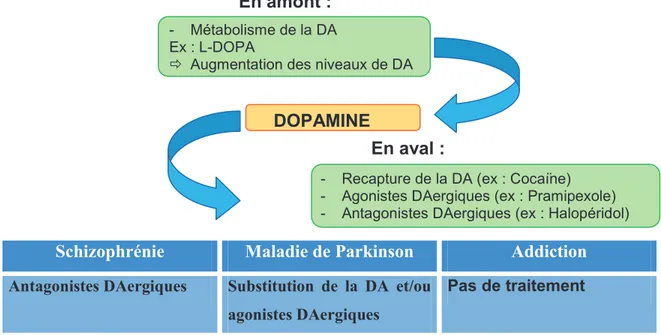
De nos jours, il existe différentes manières de cibler pharmacologiquement la transmission DAergique : soit en amont en augmentant ou en diminuant le métabolisme de la dopamine (DA), soit en aval en bloquant la recapture de la DA ou en utilisant des agonistes ou des antagonistes DAergiques (pour revue : Lévesque et Rouillard, 2009). Cependant, si l’on a réussi, jusqu’à présent, à développer des thérapies ciblant la neurotransmission DAergique pour le traitement de la MP (agonistes DAergiques, L-3,4-dihydroxyphenylalanine (L-DOPA) ou de la schizophrénie (antipsychotiques : antagonistes DAergiques), on peine à trouver un moyen d’intervention pour contrer les addictions (fig. 1.1A). En effet, l’instauration d’une dépendance implique des neuroadaptations de la neurotransmission DAergique qui rendent inefficaces les traitements classiques basés sur la reconnaissance d’un ligand agoniste/antagoniste DAergique par les récepteurs DAergiques situés à la surface des cellules (fig. 1.1B). Or, ces neuroadaptations semblent faire intervenir les cascades signalétiques déclenchées par la stimulation des récepteurs DAergiques et la modification de la transcription des gènes et ce, via l’activité d’une diversité de facteurs de transcription dont certains appartiennent à la grande famille des récepteurs nucléaires.
2
En amont :
En aval :
Schizophrénie Maladie de Parkinson Addiction
Antagonistes DAergiques Substitution de la DA et/ou agonistes DAergiques
Pas de traitement
Figure 1.1 : A. Ciblage pharmacologique actuel pour le traitement des pathologies associées à la transmission dopaminergique. B. Les récepteurs nucléaires : une nouvelle cible potentielle ?
Jusqu’à présent les cibles pharmacologiques utilisées pour contrer les pathologies liées au système DAergique sont limitées aux récepteurs situés à la surface de la cellule, les récepteurs nucléaires pourraient constituer une nouvelle alternative et procurer de nouvelles cibles, cette fois, intranucléaires, pour le traitement des pathologies associées à la transmission DAergique (Adapté de la revue : Lévesque et Rouillard, 2009).
Cibles actuelles : - les récepteurs situés à la surface de la cellule. Cibles futures :
- les récepteurs nucléaires.
DOPAMINE
- Métabolisme de la DA Ex : L-DOPA
Ö Augmentation des niveaux de DA
A. Le ciblage pharmacologique de la neurotransmission DAergique jusqu’à présent
B. Avons-nous besoin de nouvelles cibles pharmacologiques pour le système DAergique?
- Recapture de la DA (ex : Cocaïne) - Agonistes DAergiques (ex : Pramipexole) - Antagonistes DAergiques (ex : Halopéridol)
3 pathologies associées à la transmission DAergique sont limitées aux récepteurs situés à la surface de la cellule. On considère désormais que les récepteurs nucléaires exprimés au sein du système DAergique pourraient constituer une nouvelle alternative et procurer de nouvelles cibles, cette fois, intranucléaires, pour le traitement des ces pathologies (fig. 1.1B).Nous nous sommes intéressés en particulier à la sous-famille de récepteurs nucléaires Nurs (NR4A) qui sont étroitement associés à la transmission DAergique (pour revue : Lévesque et Rouillard, 2007). Effectivement, parmi les membres de cette sous-famille, il a été démontré que Nurr1 était impliqué dans le développement des neurones DAergiques et que Nur77 et Nor1 étaient exprimés dans les structures cibles du système DAergique. Ces récepteurs nucléaires ont d’ailleurs fait l’objet d’un intérêt croissant dans la communauté scientifique au cours des dix dernières années (pour revue : Maxwell et Muscat, 2006). En effet, leur rôle physiologique et leur potentiel thérapeutique a été bien défini en périphérie mais il reste à en faire de même au niveau du SNC (pour revue : Gofflot et coll., 2007; Pearen et Muscat, 2010). Selon les dernières découvertes, au niveau central, ces récepteurs nucléaires/facteurs de transcription pourraient être impliqués dans l’adaptation du système DAergique et dans le maintien de son homéostasie. Ils représenteraient dès lors une nouvelle cible pharmacologique de choix pour le traitement des pathologies associées à la transmission DAergique. En outre, l’un des intérêts majeurs de ces récepteurs nucléaires réside dans le fait qu’ils entretiennent une relation de régulation réciproque avec le système DAergique. Ils sont non seulement capables de moduler, en amont, la transmission DAergique mais ils font également partie, en aval, de la cascade moléculaire induite par les systèmes DAergiques (pour revue : Lévesque et Rouillard, 2009).
Cette introduction a donc pour objectif de poser les bases pour la compréhension des rôles particuliers de deux de ces récepteurs nucléaires dans les comportements médiés par la DA et induits par les psychostimulants. Dans un premier temps, on présentera le système DAergique. Puis, une section sera consacrée à la présentation des effets comportementaux, de la plasticité et des neuroadaptations induits par les psychostimulants par leur action sur le système DAergique. Enfin, nous présenterons les récepteurs nucléaires de la sous-famille Nurs et leur possible implication dans la régulation et la plasticité de la transmission DAergique. Pour finir, un court exposé des objectifs de la thèse sera réalisé.
4
1.2 La transmission dopaminergique
La DA est un neurotransmetteur de la famille des catécholamines, agissant sur une grande partie de l’encéphale. La transmission DAergique est, en effet, impliquée dans une grande diversité de fonctions centrales notamment dans la cognition, la mémoire et l’apprentissage, les comportements motivés, le contrôle moteur ainsi que dans la production neuroendocrine (pour revue : Bjorklund et Dunnett, 2007a).
1.2.1 Métabolisme de la dopamine
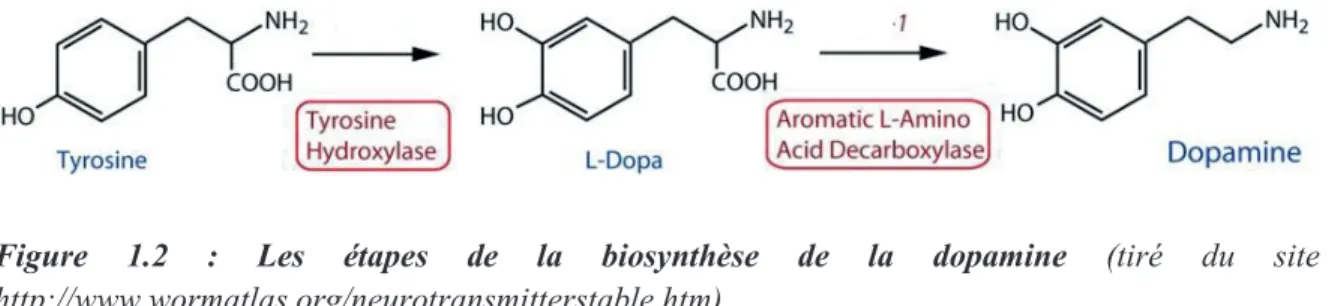
L’essentiel de la synthèse de la DA se déroule au niveau des terminaisons axonales. La tyrosine hydroxylase (TH) est l’enzyme clé de cette synthèse, elle transforme la tyrosine circulante en L-DOPA, laquelle sera ensuite décarboxylée en DA par l’enzyme DOPA-décarboxylase des acides aminés (AADC ; fig. 1.2). À la différence des enzymes décarboxylases, la TH est spécifiquement assignée à la synthèse des catécholamines (DA, adrénaline et noradrénaline). Dès lors, la TH constitue un excellent marqueur des populations neuronales DAergiques. Il faut toutefois signaler qu’elle n’est pas un marqueur exclusif des neurones DAergiques, puisque la DA sert de précurseur à la noradrénaline et à l’adrénaline. Fonctionnant d’emblée au maximum de son potentiel catalytique, l’action de la TH définit une étape limitante dans la production de DA (Zigmond et coll., 1989; pour revue : Constentin, 1990).
Figure 1.2 : Les étapes de la biosynthèse de la dopamine (tiré du site
5 Suite à sa synthèse, la DA est stockée dans des vésicules au niveau des terminaisons présynaptiques par le biais d’une unité de transport vésiculaire des monoamines (VMAT2). Ce transporteur permet donc de diminuer la concentration intracellulaire de DA sans avoir recours à son inactivation enzymatique (Peter et coll., 1995). La libération de la DA dans le milieu extracellulaire se fera par exocytose en réponse à l’arrivée d’un potentiel d’action. Au niveau de la fente synaptique, la DA interagit avec ses récepteurs situés sur les membranes post- et présynaptiques (Zucker et coll., 1999).
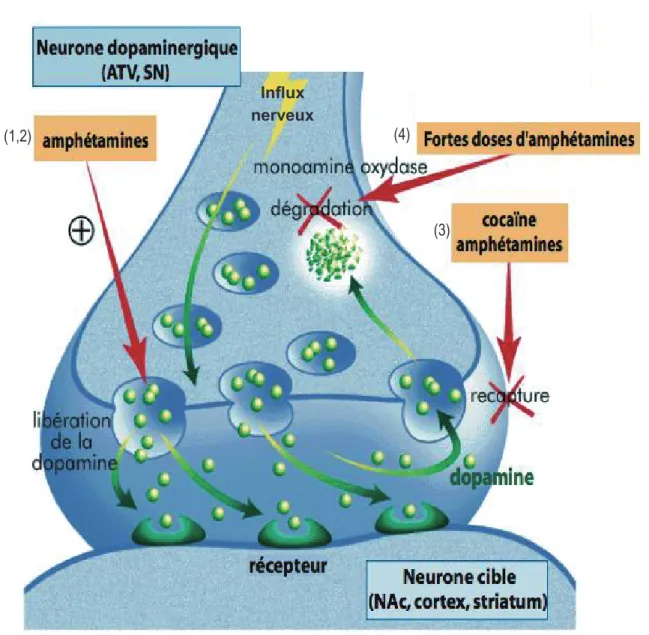
Pour permettre la succession rapide des informations, il est nécessaire qu’un neurotransmetteur agisse brièvement dans la fente synaptique. L’action transitoire de la DA est assurée par trois mécanismes qui contribuent à l’élimination de la DA de l’espace synaptique (pour revue : Samadi et coll., 2007): 1) la DA peut être recaptée par les terminaisons présynaptiques et pourra ainsi être réutilisée. Cette recapture constitue le mécanisme le plus important car il concerne 80 % de la DA libérée. Elle est réalisée via un système très efficace de transporteurs membranaires. Et ce, en particulier par le transporteur à haute affinité pour la dopamine (DAT) qui assure une fonction régulatrice en réduisant la durée et l’amplitude du signal DAergique dans la synapse (Mortensen et Amara, 2003); 2) Les cellules gliales avoisinantes capturent elles aussi une partie de la DA ; 3) enfin, l’inactivation de la DA peut être effectuée par diverses enzymes dont la Catéchol-o-méthyltransferase (COMT) qui transforme la DA en acide homovanillique mais aussi par des monoamines oxydases (MAO) et en particulier la MAO-B. La MAO est principalement exprimée dans les astrocytes alors que la COMT est située majoritairement sur les neurones postsynaptiques (pour revue : Constentin, 1995; Samadi et coll., 2007).
Au niveau du striatum et du noyau accumbens (NAc), c’est le transporteur DAT qui effectue la plus grande partie du travail de recapture (Sacchetti et coll., 2001). Dans le cortex préfrontal, le DAT n’est présent qu’en faible densité dans la synapse (pour revue : Bannon et coll., 2001), c’est donc la COMT qui devient le protagoniste le plus efficace pour l’élimination de la DA (pour revue : Tunbridge et coll., 2006).
6
1.2.2 Les récepteurs de la dopamine
La DA exerce son action dans le cerveau par le biais de différents sous-types de récepteurs (pour revue : Jaber et coll., 1996). Ces récepteurs DAergiques sont tous des récepteurs métabotropiques couplés à des protéines G (RCPGs) qui vont transmettre le message à l’intérieur de la cellule. La dopamine est définie comme un neurotransmetteur à action lente. En effet, contrairement aux neurotransmetteurs à action rapide, comme le glutamate, qui peuvent influencer directement l’excitabilité électrique des neurones en activant des récepteurs ionotropiques, la dopamine se fixant aux RCPGs fait intervenir des cascades de signalisations intracellulaires via des seconds messagers qui ralentissent la transmission du signal. Ces récepteurs sont au nombre de cinq, classés en deux grandes familles selon leurs caractéristiques structurales et leurs propriétés pharmacologiques: la famille de récepteurs D1 (comprenant les sous-types D1 et D5) et la famille D2 (incluant les sous-types D2, D3, D4). Afin de simplifier le présent ouvrage, les termes « récepteurs D1 » et « récepteurs D2 » seront utilisés pour faire référence aux deux familles de récepteurs (pour revue : Vallone et coll., 2000).
1.2.2.1 Localisation tissulaire et cellulaire
En ce qui a trait à l’expression des différents sous-types des récepteurs DAergiques dans le noyau accumbens et le striatum (les deux structures plus particulièrement étudiées dans cette thèse), les plus nombreux restent les sous-types D1 et D2. En effet, l’expression des récepteurs D3 est un peu moins abondante et serait restreinte au noyau accumbens (pour revue : Beaulieu et Gainetdinov, 2011). Celle des récepteurs D5 est très faible et répartie à travers le striatum (Rivera et coll., 2002). Enfin, celle des récepteurs D4 n’est pas détectée dans ces structures (Noain et coll., 2006). Aussi, les sous-types majoritaires D1 et D2 présentent la caractéristique d’être fortement ségrégés dans les deux principales populations neuronales GABAergiques (GABA pour acide γ-aminobutyrique) de ces structures qui expriment sélectivement la dynorphine ou l’enképhaline (voir parties 1.2.3). En effet, les récepteurs D1 sont localisés en majorité sur les neurones GABAergiques qui co-expriment
7 la dynorphine alors que les D2 sont situés plus spécifiquement sur les neurones GABAergiques qui co-expriment l’enképhaline (Gerfen et coll., 1990 ; Bertran-Gonzalez et coll., 2008 ; Surmeier et coll., 2010). Cependant, il semblerait que cette ségrégation, bien que très marquée, ne soit pas aussi nette car une population neuronale co-exprimant les deux récepteurs a été mis en évidence par certaines études au niveau notamment du striatum (≈5%) et de la coquille du noyau accumbens (≈20%) (Bertran-Gonzalez et coll., 2008; Perreault et coll., 2010).
Concernant leur distribution au niveau synaptique, les récepteurs DAergiques peuvent être exprimés soit sur l’élément présynaptique, soit sur l’élément postsynaptique. Les récepteurs de la famille D1 sont uniquement présents au niveau postsynaptique. Les récepteurs de la famille D2, sont, quant à eux, localisés aussi bien au niveau postsynaptique dans les structures cibles des différentes voies DAergiques qu’au niveau présynaptique sur les neurones DAergiques et sur les afférences glutamatergiques des structures cibles du système DAergique (pour revue : Vallone et coll., 2000; Dani et Zhou, 2004; Samadi et coll., 2007). En effet, il existe, par exemple deux isoformes pour le sous-type D2: le récepteur D2 court(D2s) et une version plus longue, le récepteur D2 long(D2L), qui possède 29 acides aminés en plus. Cette extension dans le D2L pourrait servir à déterminer la localisation cellulaire du récepteur car des études ont montré que son expression était confinée au niveau postsynaptique alors que le D2S est situé au niveau présynaptique sur les terminaisons dopaminergiques et glutamatergiques (Usiello et coll., 2000; De Mei et coll., 2009).
1.2.2.2 Voies de signalisation
1.2.2.2.1 Signalisation induite par les récepteurs postsynaptiques
Au niveau postsynaptique, les deux grandes familles de récepteurs peuvent activer diverses voies signalétiques intracellulaires. Parmi, celles-ci, nous décrirons la plus connue pour illustrer la fonction globale de chacune des deux familles. Au niveau postsynaptique, l’une des principales différences entre les deux familles tient au fait qu’elles sont couplées à
8
des protéines G différentes, qui ont des effets opposés sur les voies signalétiques intracellulaires (fig. 1.3; pour revue : Vallone et coll., 2000).
En effet, les récepteurs DAergiques de la famille D1 sont couplés positivement à l'adénylate cyclase (AC) via la protéine Gs et permettent la production d'adénosine monophosphate cyclique (AMPc) qui déclenche de nombreuses réponses métaboliques dépendantes de la protéine kinase A (PKA) et facilite notamment la dépolarisation du neurone cible (pour revue : Vallone et coll., 2000; Surmeier et coll., 2010). De fait, l’activation de la PKA conduit à la phosphorylation de diverses protéines dans la cellule (Huff et coll., 1997). Au niveau du striatum, les principales cibles de la PKA sont DARP-32 (pour dopamine and cyclic AMP-regulated phosphoprotein, DARP-32 KDa), CREB (pour Cyclic AMP Response Element Binding protein) et certains canaux ioniques voltage ou chimio-dépendants impliqués dans la modulation de l’excitabilité neuronale (Neve et coll., 2004). Ainsi, l’activation par le récepteur D1 de cette cascade d'événements intracellulaires mène à la phosphorylation de facteurs de transcription nucléaires tels que CREB. Or, la phosphorylation de ce dernier conduit à l'augmentation de l’expression de gènes d’induction précoces comme c-fos et zif268 mais aussi à celle des ARNm de neuropeptides endogènes tels que la prodynorphine et la substance P (Svenningsson et coll., 2000b; Nestler, 2001b; pour revue : Waltereit et Weller, 2003). Cette cascade de signalisation interviendrait dans la consolidation de l'information au niveau du SNC (pour revue : Bozon et coll., 2003). Aussi, cette voie active la protéine DARP-32 qui ultimement active MEK et la voie des ERK (pour Extracellular signal-regulated kinases).
En outre, l’activation des récepteurs D1 induit également la voie des kinases associées aux mitogènes (MAPK, mitogen-activated protein kinases). De fait, l’administration de psychostimulants favorise la phosphorylation de cette voie de signalisation par le récepteur D1 (Beaulieu et coll., 2006; Valjent et coll., 2005). Cependant, selon certaines études, l’activation de cette voie D1-dépendante nécessiterait également l’activation concomitante des récepteurs N-méthyl-d-aspartate (NMDA) par le glutamate ainsi que de certaines voies de signalisation par les phosphatases, elles-mêmes capables de solliciter l’activation de la voie AMPc/PKA (Valjent et coll., 2005). Ainsi,
9 suite à l’activation du récepteur D1 plusieurs voies convergent vers la phosphorylation des ERK.
À l’inverse, les récepteurs de la famille D2 sont couplés à une protéine G inhibitrice (la protéine Gi/o) qui bloque la synthèse d'AMPc et par conséquent inhibe la PKA (Strange, 1993; Beaulieu et Gainetdinov, 2011). Son activation aura donc l’effet inverse par rapport à celui des récepteurs D1. En effet, cette inhibition aura un effet globalement hyperpolarisant sur la cellule cible car elle facilite l’inhibition des courants calciques et l'ouverture des canaux K+ hyperpolarisants. La stimulation des récepteurs D2 active également des cascades de signalisation menant à une induction de l’expression de neuropeptides endogènes mais cette fois : l’enképhaline (ENK) et la neurotensine (Engber et coll., 1992; pour revue : Constentin, 1995; Steiner et Gerfen, 1998).
En outre, les récepteurs D2 médient des voies signalisation comme celle des MAPK, les transporteurs Na+/H+ ainsi que des canaux ioniques calciques et potassiques via la sous-unité Gβγ de la protéine G inhibitrice. En effet, la sous-unité Gβγ semble tout particulièrement impliquée dans la modulation de la concentration cytoplasmique de calcium. Elle peut, d’une part, activer la phospholipase C (PLC) et provoquer une libération de calcium dans le cytoplasme à partir des réserves endoplasmiques intracellulaires augmentant ainsi la concentration cytoplasmique de calcium. Curieusement, elle peut, d’autre part, agir à l’inverse en régulant à la baisse l’entrée de calcium extracellulaire en bloquant les canaux calciques voltage-dépendant (Yan et coll., 1997 ; Hernandez-lopez et coll., 2000).
Enfin, selon de récentes études, les RCPGs pourraient également induire des voies de signalisations indépendantes des protéines G. Par exemple, il a été démontré que les récepteurs D2 pouvaient activer des cascades de signalisation par l’entremise d’une protéine d’ancrage, la β-arrestine qui induirait l’intervention d’effecteurs tels que Akt et GSK-3 (pour Glycogen synthase kinase 3) (Beaulieu et coll., 2009, 2011; pour revue : Beaulieu, 2012). Ces données sont intéressantes puisque Akt a récemment été identifié
10
comme un potentiel intervenant dans la plasticité des systèmes DAergiques (Tian et coll., 2010).
Ainsi, la liaison de la DA à ses deux familles de récepteurs provoque la transduction du signal via des cascades de réactions intracellulaires différentes dont les effets sont globalement opposés. En somme, la stimulation des récepteurs D1 a un effet excitateur et celle des récepteurs D2 a un effet inhibiteur (pour revue : Surmeier et coll., 2007; Surmeier et coll., 2010).
1.2.2.2.2 Signalisation induite par les récepteurs D2 présynaptiques
Au niveau présynaptique, les récepteurs D2 présynaptiques, sont exprimés sur les corps cellulaires, les dendrites et les terminaisons des neurones DAergiques; cette particularité leur confère le statut d’autorécepteurs (Usiello et coll., 2000). Au niveau des corps cellulaires et des dendrites, les autorécepteurs ont pour fonction de réguler négativement le taux de décharge des cellules DAergiques. Ils peuvent, en effet, moduler l’amplitude et la durée du signal DAergique via la régulation de canaux calciques (pour revue : Schmitz et coll., 2003). Au niveau des terminaisons DAergiques, les récepteurs D2 régulent négativement la synthèse de la DA (Jackson et Westlind-Danielsson, 1994). Ainsi, les autorécepteurs permettent d’assurer l’autorégulation du système DAergique via une boucle de rétroaction qui va contrôler la libération et la synthèse de la DA (pour revue : Schmitz et coll., 2003).
D’autre part, certaines structures cibles des voies DAergiques comme le striatum et le NAc reçoivent également des afférences glutamatergiques en provenance du cortex. Or, on a aussi relevé la présence de récepteurs D2 au niveau présynaptique sur les terminaisons axonales de ces afférences glutamatergiques. Ces récepteurs permettraient donc de moduler l’influx glutamatergique issu du cortex (Bamford et coll., 2004; pour revue : Dani et Zhou, 2004). Ainsi, ces divers mécanismes de rétroaction permettent aux voies DAergiques de maintenir leur homéostasie via des mécanismes d’adaptation rapides (pour revue : Grace, 2000; Grace et coll., 2007). Dans le registre adaptatif, une autre intervention des récepteurs DAergiques peut être soulevée. En effet, il a été proposé que la libération répétée de DA
11 Figure 1.3 : Les récepteurs de la dopamine et leurs effets sur une de leur principale voie de signalisation, celle de l’adénylate cyclase.
La DA agit sur deux grandes familles de récepteurs "D1-like" et "D2-like". Elles sont toutes deux métabotropiques, mais provoquent des effets parfois opposés : les récepteurs de
la famille D1 (D1 et D5) sont couplés via la protéine Gs à l'adénylate cyclase (AC) activant
ainsi la production d'AMPc qui déclenche de nombreuses réponses métaboliques dépendantes de la protéine kinase A (PKA) ; citons en particulier la phosphorylation des canaux ioniques qui active les conductances Na+ et inhibe les courants K+, ce qui résulte
en une augmentation de l’excitabilité neuronale. Les récepteurs de la famille D2 (D2, D3,
D4) sont couplés à la protéine Gi/o et inhibent la synthèse d'AMPc ; ce qui en particulier
facilite l'ouverture de canaux K+ hyperpolarisant et donc inhibe les neurones. Ainsi, selon la nature de son récepteur, la DA stimule ou inhibe les neurones ; on ne peut donc pas lui attribuer un rôle global de neurotransmetteur inhibiteur ou excitateur.
Pas de phosphorylation des canaux K+ et Na+ Ext.
Int..
Phosphorylation des canaux K+ et Na+
(et autres protéines) Dépolarisation Excitation du neurone Membrane
AMPc
AMPc
AC
D1-like D2-like DA DAGs
Gi
PKA
PKA
Hyperpolarisation Inhibition du neurone+
+
-
-
Facilitation des courants Na+
12
menait à des adaptations qui correspondraient à une réponse physiologique compensatoire à la surstimulation du système (pour revue : Robinson et Berridge, 2003). Or, un des exemples d’adaptations est justement la modification de la concentration des récepteurs DAergiques à la surface des membranes cellulaires.
1.2.2.3 Propriétés des récepteurs dopaminergiques
Les récepteurs D1 et D2, peuvent exister soit dans un état de faible affinité pour la DA (D1low et D2low) soit dans un état de haute affinité pour la DA (D1high et D2high). La proportion des récepteurs en haute et basse affinité est liée au couplage du récepteur avec les protéines G. Par exemple, le récepteur D2high représente celui qui est couplé alors que le D2low est la portion non couplée du récepteur. Les récepteurs à haute affinité ont une affinité environ 1000 fois plus grande que celle des récepteurs à basse affinité. L’état fonctionnel des récepteurs DAergiques est considéré comme correspondant aux récepteurs sous leur forme D1high et D2high(McDonald et coll., 1984; George et coll., 1985; Shuto et coll., 2008). En effet, lors d’une faible libération, la DA se fixe préférentiellement sur les récepteurs à haute affinité, ce n’est que lors d’une libération massive de DA, comme sous l’action de psychostimulants, que les récepteurs à basse affinité sont éventuellement recrutés. De base, les récepteurs D1high et D2high à haute affinité sont présents au niveau du striatum dans une proportion d’environ 20% par rapport au nombre total de récepteurs D1 et D2 (Seeman, 2008). De manière intéressante, il a été démontré que l’hypersensibilité comportementale à la DA était toujours associée avec une augmentation majeure de la concentration des récepteurs D2high dans le striatum (Seeman et coll., 2002; Seeman et coll., 2005; Sacchetti et coll., 2006; Seeman et coll., 2006; Seeman, 2009).
Selon le modèle tonique/phasique de la libération de DA (pour revue : Grace, 2000), les deux familles de récepteurs possèdent des modes d’actions distincts et antagonistes. La comparaison de l’affinité relative des deux familles D1 et D2, montre que les récepteurs D2 présentent une affinité pour la DA beaucoup plus grande que les récepteurs D1 (pour revue : Hikida et coll., 2010). Il a par conséquent été suggéré que ce sont les récepteurs D2,
13 qui assurent la régulation du taux de base de la DA (i.e. le niveau tonique) reflétant ainsi l’activité basale des neurones DAergiques. Quant aux récepteurs de type D1, ils ne peuvent être stimulés que par une concentration relativement haute de DA et seraient plutôt impliqués dans la médiation de la libération phasique de DA. Cette libération phasique dépend de la fluctuation de l’activité des neurones DAergiques en réponse à une stimulation particulière (Schultz, 2007a, 2007b). Plus que le taux absolu de DA, c’est l’équilibre entre ces deux niveaux, tonique et phasique, qui assure le bon fonctionnement du système. Un dysfonctionnement de cette balance serait la cause des phénomènes de dépendance (Bertran-Gonzalez et coll., 2008; Perez et coll., 2011; Grieder et coll., 2012; pour revue : Grace et coll., 2007).
En outre, parmi les récepteurs de la famille D2, le sous-type D3 aurait un rôle particulier à jouer dans la réponse aux drogues d’abus, et en particulier aux psychostimulants. Il est en effet, comme on l’a décrit plus haut, exprimé sélectivement et en forte densité dans le noyau accumbens; structure cible du système DAergique méso-limbique impliquée dans la modulation des comportements motivés. De base, l’activité locomotrice chez les rongeurs serait régulée principalement par les influences opposées des différents sous-types de récepteurs DAergiques D1, D2 et D3 (Sibley et coll., 1999; pour revue : Beaulieu et Gainetdinov, 2011). Dans ce contexte, la stimulation du récepteur D3 aurait pour effet de s’opposer à l’activation concurrente des récepteurs D1 et D2. Les récepteurs D3 exerceraient une action inhibitrice modérée sur l’activité locomotrice et ce, en faisant intervenir soit ses populations pré- ou postsynaptiques (Joseph et coll., 2002). Bien qu’il ne soit présent qu’à une échelle d’un récepteur D3 pour deux récepteurs D2 dans le noyau accumbens et le striatum, il a été démontré que ce sous-type D3 (pour revue : Cho et coll., 2010) avait une affinité pour la DA 200 fois plus importante que le récepteur D2 et 70 fois plus élevée que les récepteurs D2 et D1 combinés (Richtand et coll., 2001a, 2001b). Ce déséquilibre dans l’affinité pour la DA implique par conséquent une plus forte probabilité de liaison aux récepteurs D3 lors d’une stimulation de la libération de la DA induite par les psychostimulants. Selon certaines études, cela résulterait en une désensibilisation sélective des récepteurs D3 comparativement aux récepteurs D2 et D1. Par conséquent la sensibilisation comportementale observée suite à l’administration répétée de
14
psychostimulants pourrait être due à l’essoufflement du système de freinage qu’exerce normalement le récepteur D3 sur la transmission DAergique (Cho et coll., 2001). Le rôle inhibiteur du récepteur D3 sur l’activité locomotrice est supporté par une étude montrant que les souris déficiente pour le gène de ce récepteur présentent une vulnérabilité accrue à la cocaïne. Le ciblage sélectif du récepteur D3 est actuellement considérer comme une avenue intéressante pour traiter les addictions aux psychostimulants (pour revue : Newman et coll., 2012).
1.2.3 Les circuits dopaminergiques
Les corps cellulaires des neurones DAergiques sont principalement situés dans le mésencéphale et le diencéphale. Ils peuvent être regroupés en quatre noyaux principaux, un noyau diencéphalique à savoir le noyau arqué (A12 ; selon la terminologie de Dahlstroem et Fuxe, 1964) et trois noyaux mésencéphaliques : l’aire rétrorubrale (A8), la substance noire (A9) et l’aire tegmentale ventrale (A10).
Les circuits qui prennent leur origine des noyaux mésencéphaliques A10 et A9 feront l’objet d’une description plus détaillée dans les parties subséquentes. Il s’agit respectivement du circuit mésocorticolimbique qui est constitué des projections DAergiques de l’aire tegmentale ventrale (ATV) ainsi que le circuit nigro-strié qui est constitué des projections de la substance noire (SN) et appartient au réseau des ganglions de la base (Wise, 2004). En effet, ce sont les deux principaux circuits étudiés dans cette thèse de par leur implication centrale dans les comportements médiés par la DA et induits par les psychostimulants. Le troisième noyau mésencéphalique, l’aire rétrorubrale (A8), favoriserait simplement la coordination des deux systèmes en permettant la communication entre la SN pars compacta et l’ATV (Arts et coll., 1996). Pour finir, la voie DAergique tubéro-infundibulaire a pour origine le noyau arqué de l’hypothalamus (A12) et projette vers l’hypophyse. Cette voie est davantage impliquée dans la régulation hormonale caractéristique de l’hypothalamus et en particulier dans la régulation de la libération de la prolactine par l’hypophyse antérieure (pour revue: Samadi et coll., 2007; Bolam et coll., 2008).
15 1.2.3.1 Le circuit mésocorticolimbique
Le circuit mésocorticolimbique est un circuit correspondant au système neuronal de récompense (pour revue : Volkow et coll., 2012). En effet, les structures appartenant au circuit de la récompense sont spécifiquement impliquées dans le renforcement des comportements indispensables à la survie de l’individu et de l’espèce (manger, boire, se reproduire). Ces régions cérébrales, interconnectées entre elles, sont chargées de récompenser l’exécution de ces comportementaux vitaux par l’apparition d’une sensation agréable ou d’empêcher la reproduction de comportements néfastes en produisant une réaction aversive (pour revue : Bromberg-Martin et coll., 2010; fig. 1.4).
1.2.3.1.1 Structure
Les projections DAergiques de l’ATV innervent le cortex (surtout la partie antérieure) et le système limbique (NAc, septum, hippocampe et amygdale). Ces projections constituent le circuit mésocorticolimbique impliqué dans le traitement d'informations d'ordre cognitivo-affectif et notamment dans la régulation de l’attention, de la mémoire, des émotions, de la motivation et de la récompense (Schultz et coll., 1997; Wise, 2004; pour revue : Volkow et coll., 2012). Il est lui-même constitué de deux voies distinctes : la voie mésocorticale et la voie mésolimbique (Wise, 2009).
La voie mésocorticale est composée des projections DAergiques de l’ATV vers les régions corticales : préfrontale (principalement), cingulaire et entorhinale. Elle est impliquée dans le contrôle inhibiteur, dans la prise de décisions, la motivation, la régulation des émotions, dans l’attribution d’une valeur motivationnelle (salience) et dans l’intégration et l’évaluation des situations potentiellement stressantes (pour revue : Volkow et coll., 2012). Elle serait d’autre part impliquée dans les conséquences cognitives de l’imprégnation émotionnelle de la prise de drogues, le « craving » ainsi que la recherche compulsive de drogues (Goldstein et coll., 2001; Maldonado, 2003).
16
La voie mésolimbique est quant à elle constituée des projections de l’ATV vers plusieurs noyaux sous-corticaux qui font partie du système limbique. Cette voie projette donc principalement vers le NAc, mais aussi vers l’amygdale, l’hippocampe, le septum, le tubercule olfactif ainsi que vers les régions ventrales du striatum (caudé putamen) (pour revue : Maldonado, 2003). Les afférences de l’ATV sont ces mêmes aires, en plus du thalamus. La voie mésolimbique, encore appelée système de récompense, est impliquée dans la motivation, le désir et la récompense. Elle serait le siège des processus de renforcement et de dépendance associés à la prise de drogues d’abus. Sachant que la DA est le substrat commun impliqué dans l’abus et les propriétés addictives des drogues (pour revue : Maldonado, 2003; Kalivas et Volkow, 2005; Nestler, 2005; Bromberg-Martin et coll., 2010; Volkow et coll., 2012), on peut en déduire que l’ATV possèderait un impact fonctionnel unique sur le système de récompense. En effet, elle est la seule, parmi les structures du système de récompense, à produire de la DA. L’ATV contient environ 80% de neurones DAergiques et se situe en continuité de la SN pars compacta.
La principale cible du circuit mésolimbique est le NAc. Cette voie de signalisation ATV-NAc est le substrat le plus important expliquant l’effet de récompense de la majorité des drogues d’abus (fig. 1.4) aussi elle s’intègre dans le réseau des ganglions de la base et constitue le point d’entrée de la partie ventrale de ce réseau. Le NAc présente des caractéristiques structurales communes à celles du striatum (voir section 1.2.3.2.2). Il est constitué, essentiellement, à 90% de neurones de projections GABAergiques. Du fait de leur morphologie caractéristique, ces neurones sont encore appelés neurones épineux moyens (MSNs pour medium spiny neurons) et envoient des projections vers le thalamus, le striatum et le mésencéphale, mais également vers l’ATV assurant ainsi un rétrocontrôle des influx reçus de l’ATV (Wilson, 2004).
Le NAc peut être subdivisé en deux parties distinctes ayant chacune des propriétés neurochimiques et des connexions différentes. Ainsi, on distingue deux composantes fonctionnelles différentes (pour revue : Kalivas et Volkow, 2005) : une partie ventromédiale ou « coquille » du NAc strictement relié aux structures limbiques désignées sous le vocable l’amygdale étendue « extended amygdala » et une partie dorsolatérale ou
17 « corps » du NAc considérée comme partie intégrante du complexe striatopallidal. De fait, la coquille jouerait un rôle dans les fonctions motivationnelles et émotionnelles alors que le corps serait plutôt impliqué dans les fonctions somatomotrices (Cadoni et coll., 2000; Ito et Hayen, 2011). De même que le striatum, les MSNs du NAc peuvent être ségrégés en deux populations différentes exprimant des récepteurs DAergiques et des neuropeptides distincts (voir section 1.2.3.2.1). Alors que les récepteurs D2, la neurotensine (NT) et le neuropeptide ENK sont fortement exprimés dans les neurones de la partie corps du NAc, les neurones exprimant les récepteurs D1, la substance P (SP) et la dynorphine (DYN) sont distribués de façon égale dans les deux parties du NAc (Lu et coll., 1998). L’innervation DAergique émise par l’ATV est régulée par des neuropeptides endogènes (DYN, ENK) qui peuvent agir soit au niveau du NAc sur les terminaisons présynaptiques pour contrôler le taux de libération de la DA, soit sur les corps cellulaires au niveau de l’ATV (pour revue : Steiner et Gerfen, 1998; Samadi et coll., 2007).
1.2.3.1.2 Fonction
Le circuit de la récompense définit à chaque instant l’état de satisfaction physique et psychique dans lequel se trouve le sujet. L’activité des neurones DAergiques augmente à l’occasion de récompenses telles que la prise de nourriture (pour revue : Volkow et coll., 2012). L’apprentissage conduit à ce que ce ne soit plus la récompense qui active les neurones DAergiques mais les signaux annonçant l’arrivée de cette récompense (pour revue : Kalivas et Volkow, 2005).
La libération de DA signale au circuit mésolimbique d’initier les réponses comportementales adaptées aux stimuli motivationnels perçus. Ce faisant, elle facilite les changements cellulaires qui établissent les associations apprises liées à ces stimuli (pour revue : Ikemoto, 2010). L’organisme peut ainsi émettre une réponse comportementale adaptative plus efficace face à l’événement motivationnel au cas où ce dernier viendrait à se reproduire. Toutefois, tout comme dans le cas d’une administration répétée de drogues, quand un événement naturellement motivationnel devient familier, la libération de la DA n’est plus induite par cet événement particulier (pour revue : Volkow et coll., 2012). Dans
18
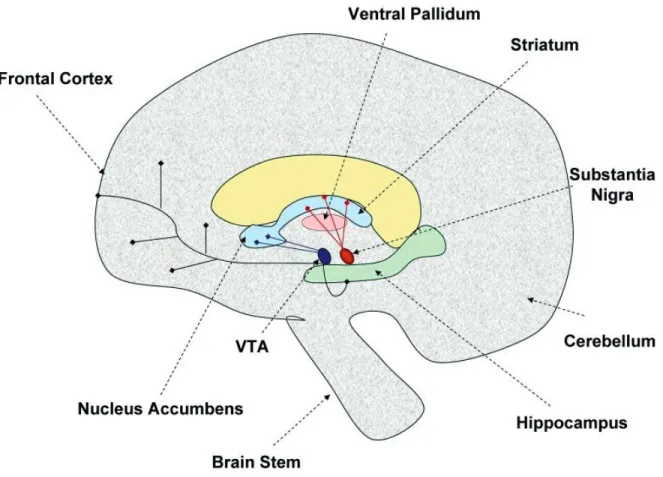
Figure 1.4: Schéma du circuit de la « récompense » ou circuit mésocorticolimbique (bleu).
Cette figure illustre les voies dopaminergiques abordées dans cette thèse. La voie nigro-striée (en rouge) est constituée de la projection des neurones dopaminergiques de la substance noire vers le striatum. Elle est impliquée dans le contrôle de la motricité. La voie mésolimbique ou circuit de la récompense (en bleu) correspond aux projections des neurones dopaminergiques de l’aire tegmentale ventrale vers le noyau accumbens, le cortex préfrontal et l’hippocampe. Cette voie est impliquée dans les comportements motivés, la récompense et l’apprentissage. Le pallidum ventral sert d’interface entre les territoires limbiques et sensori-moteurs. Ainsi, le striatum et le noyau accumbens pourraient jouer des rôles importants dans la régulation des comportements moteurs et des comportements motivés. Les flèches pointillées indiquent des régions cérébrales spécifiques alors que les flèches tracées de manière continue indiquent les principales voies dopaminergiques (Adapté de Knab et Lightfoot, Int J Biol Sci. 2010).