HAL Id: dumas-01671604
https://dumas.ccsd.cnrs.fr/dumas-01671604
Submitted on 22 Dec 2017HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Comparaison des modèles in vivo utilisés pour l’étude de
la régénération pulpaire au travers d’une revue de la
littérature
Aurélien Naveilhan
To cite this version:
Aurélien Naveilhan. Comparaison des modèles in vivo utilisés pour l’étude de la régénération pulpaire au travers d’une revue de la littérature. Chirurgie. 2017. �dumas-01671604�
Université de Bordeaux
Collège des Sciences de la Santé
UFR des Sciences Odontologiques
Année 2017 N°83
Thèse pour l’obtention du
DIPLOME d’ETAT de DOCTEUR EN CHIRURGIE DENTAIRE
Présentée et soutenue publiquement
Par Aurélien NAVEILHAN
Né le 19/07/1990 à Biarritz Le 21 Novembre 2017
Directeur de thèse Olivia KEROUREDAN
Membres du jury
Président M. S. CATROS Professeur des Universités Directeur Mme O. KEROUREDAN Assistant Hospitalo-Universitaire Rapporteur M. R. DEVILLARD Maître de Conférences des Universités Assesseur M. J-F. PELI Maître de Conférences des Universités
Comparaison des modèles in vivo utilisés pour l’étude
de la régénération pulpaire au travers d’une revue de la
REMERCIEMENTS
A notre Président de thèse,
Monsieur le Professeur Sylvain CATROS
- Professeur des Universités – Praticien Hospitalier (sous-section Chirurgie buccale – Pathologie et Thérapeutique)
UFR des Sciences Odontologiques de Bordeaux
Vous me faites un très grand honneur en ayant accepté de présider ce jury. Je vous remercie pour l’ensemble des enseignements que vous m’avez transmis durant la totalité de mon cursus universitaire. Je vous remercie aussi pour les vacations de stage réalisés à vos côtés durant votre pratique hospitalière, qui ont été une réelle mise en pratique clinique de l’implantologie mais aussi de la prise en charge des pathologies à risque en chirurgie dentaire.
A notre juge et directeur de thèse,
Madame le Docteur Olivia KEROUREDAN
- Assistante Hospitalo-Universitaire (sous-section Odontologie Conservatrice – Endodontie)
UFR des Sciences Odontologiques de Bordeaux
Tout d’abord, je tenais à vous remercier pour l’ensemble de votre encadrement au cours de mon enseignement clinique à l’Hôpital Xavier Arnozan, tant sur le plan de l’enseignement que sur le plan humain. Je vous remercie donc pour votre sympathie, votre écoute et vos conseils avisés. Je vous suis aussi particulièrement reconnaissant pour votre patience, votre disponibilité et votre motivation dans la réalisation de cette thèse, sans lesquelles elle n’aurait pas pu aboutir.
A notre juge et rapporteur de thèse,
Monsieur le Docteur Raphaël DEVILLARD
- Maître des Conférences des Universités – Praticien Hospitalier (sous-section Odontologie Conservatrice – Endodontie)
UFR des Sciences Odontologiques de Bordeaux
Je tiens à vous remercier d’avoir accepté d’être le rapporteur de ce travail. Je vous remercie aussi pour l’ensemble de votre enseignement théorique et clinique, et notamment de la rigueur scientifique que vous m’avez inculquée tout au long de ma formation.
A notre juge et assesseur de thèse,
Monsieur Jean-François PELI
- Maître des Conférences des Universités – Praticien Hospitalier (sous-section Odontologie Conservatrice – Endodontie)
UFR des Sciences Odontologiques de Bordeaux
Je vous remercie de me faire l’honneur de faire partie des membres du jury en tant qu’assesseur. Je vous remercie aussi pour l’ensemble des enseignements que vous m’avez transmis durant mon cursus universitaire, ainsi que pour votre rôle dans ma formation clinique dans le domaine de l’endodontie.
À mes parents,
Je vous remercie pour votre éducation, qui a fait de moi l’homme que je suis maintenant, je vous remercie pour votre soutien et pour la motivation que vous m’avez apportés tout au long de mon cursus universitaire, mais aussi de ma vie.
À mon frère Nicolas,
Même si les grands discours n’ont jamais été notre force, je ne te remercierai jamais assez pour tout ce que tu as fait pour moi, pour m’avoir protégé, soutenu, aidé, éduqué et cela à travers toutes les épreuves que nous avons traversées. Je tiens fort à toi mon frère. Et je n’aurai jamais les mots pour t’exprimer la gratitude, le respect et l’amour fraternel que je te porte.
À mon frère Yannick,
Je sais que tu ne liras jamais ces lignes, même si on se voit très peu à cause de ton handicap, tu as participé à ma construction, et sache que je tiens à toi. Je te remercie pour tes sentiments débordants et pour ta propre vision du monde qui t’entoure, qui est bien plus positive celle de la plupart des gens.
À mes amis
Que dire à mes amis, à part qu’ils ont toujours été là pour moi dans les moments les plus difficiles comme dans les moments les plus heureux. Et je ne saurai jamais assez les remercier pour cela. Je ne vais pas les citer et les remercier un par un, car ce serait trop long. Mais vous qui vous reconnaîtrez, vous êtes des personnes formidables, et je suis très fier et très heureux de faire partie de votre vie et que vous fassiez partie de la mienne.
Abréviations
BMP1 = Bone Morphogenic Protein 1 BMSSC = Bone Marrow Stromal Stem Cell BSP = Bone Sialoprotein (osteogenic protein) DPP = Dentin Phosphoprotein
DPSC = Dental Pulp Stem Cell DSP = Dentin Sialoprotein
DSPP = Dentin Sialophosphoprotein MEC = Matrice Extra-Cellulaire
MMP20 = enamelysin/Matrix Metalloproteinase 20 FGF = Fibroblast Growth factor
NGF = Nerve Growth Factor
PDGF = Platelet Derived Growth Factor PDL = Periodontal Ligament
PDLSC= Periodontal Ligament Stem Cells PLLA = poly-L-lactic acid
PLG = Poly-D,L-lactide Glycolide PRF = Platelet-rich fibrin
SCAP = Stem Cells from Apical Papilla VEGF = Vascular Endothelial Growth Factor SDF1 = Stromal-derived factor-1a
SHED= Stem cells from Human Exfoliated Decidious teeth SP = side-population
TABLE DES MATIERES
I.
INTRODUCTION ... 10
A.
LES
LIMITES
DU
TRAITEMENT
ENDODONTIQUE ... 10
B.
RÔLE
ET
COMPOSITION
DU
COMPLEXE
PULPO-DENTINAIRE . 13
1. Le rôle du complexe dentino-pulpaire ... 132. Les composants de la pulpe dentaire ... 14
a) Les cellules de la pulpe ... 14
(1) Les odontoblastes ... 14
(2) Les fibroblastes ... 15
(3) Cellules de l’immunité ... 15
(4) Les cellules souches ... 16
(a) Les DPSC ... 16
(b) Les SHED ... 17
(c) Les autres cellules souches d’origine dentaire ... 17
b) La matrice extra-cellulaire (MEC) ... 18
c) La vascularisation pulpaire ... 18
d) L’innervation pulpaire ... 19
C.
PRINCIPES
GENERAUX
DE
LA
REGENERATION
PULPAIRE ... 20
1. Définition de l’ingénierie tissulaire ... 20
2. La régénération pulpaire ... 20
a) Définition ... 20
b) Enjeux de la régénération pulpaire ... 21
(1) Formation d’un pont dentinaire ... 22
(2) Régénération partielle du tissu pulpaire ... 23
(3) Régénération « de novo » ou totale de la pulpe ... 23
c) Les outils de l’ingénierie tissulaire pulpaire ... 24
(1) Les cellules souches ... 24
(2) Les matrices (« scaffold ») ... 25
(3) Les facteurs de croissance ... 26
D.
MODELES
D’ETUDE
EN
ODONTOLOGIE ... 27
II.
MATERIEL ET METHODES ... 29
A.
S
CHEMA D’
ETUDE... 29
B.
S
TRATEGIE DE RECHERCHE... 29
C.
C
RITERES D’
INCLUSION/
EXCLUSION... 30
D.
S
ELECTION DES ETUDES... 30
E.
A
CCES AUX ARTICLES... 31
III.
RESULTATS ... 32
A.
A
RTICLES SELECTIONNES POUR LA REVUE DE LITTERATURE... 32
B.
L
ES MODELES D’
ETUDE IN VIVO UTILISES POUR LA REGENERATION PULPAIRE... 34
1. Les modèles ectopiques ... 34
a) Etudes expérimentales du choix cellulaire pour la régénération pulpaire 35 b) Etude des différents composants de la régénération pulpaire ... 40
2. Les modèles orthotopiques ... 45
a) Etude du potentiel cellulaire de régénération pulpaire ... 46
b) Du modèle in vitro au modèle orthotopique ... 50
c) Développement de protocoles applicables cliniquement ... 55
3. Autre modèle d’étude in vivo ... 59
4. Les études de modèles animaux ... 60
IV.
DISCUSSION ... 67
V.
CONCLUSION ... 73
VI.
BIBLIOGRAPHIE ... 74
I.
INTRODUCTION
A. LES LIMITES DU TRAITEMENT ENDODONTIQUE
Le traitement endodontique a pour objectif de traiter les maladies de la pulpe et du périapex et ainsi de transformer une dent pathologique en une entité saine, asymptomatique et fonctionnelle sur l’arcade. Il est indiqué quand l’atteinte du tissu pulpaire est trop importante, comme par exemple les cas de pulpite irréversible et de nécrose pulpaire. Le traitement endodontique peut aussi être indiqué, dans de plus rares cas, quand le tissu pulpaire est vivant et sain. Suite à l’éviction d’une lésion carieuse étendue ou une fracture coronaire, le traitement canalaire de référence avec obturation à la gutta-percha, s’avère parfois être la seule thérapeutique envisageable permettant de maintenir la dent asymptomatique (1).
Le traitement endodontique est un acte très courant en cabinet dentaire. En France, en 2004, le ministère de la santé en collaboration avec la CNAMTS (Caisse nationale de l'assurance maladie des travailleurs salariés) a réalisé une étude statistique sur les actes de la CCAM effectués au sein des cabinets dentaires. Cette étude a recensé 7,6 millions d’actes de traitement endodontique, dont 1,6 millions de retraitements, soit 15,9% des soins conservateurs représentant eux-mêmes 55,6% du total des soins effectués dans un cabinet dentaire en moyenne. La gravité des pathologies pulpaires, allant de la simple pulpite à l’infection périapicale, et leur fréquence, posent un réel problème en termes de santé publique (2).
Malgré les avancées considérables faites dans le domaine de l’endodontie, le succès des traitements endodontiques n’est jamais assuré, et dépend d’une multiplicité de facteurs. Parmi eux, le rôle du praticien est essentiel puisque ce dernier, selon sa rigueur, ses connaissances et sa manière de travailler, va grandement influencer la réussite ou non du traitement (3). Plusieurs critères doivent être respectés : la préparation d’une cavité d’accès correcte, sans interférences, qui doit assurer un réservoir pour la solution d’irrigation, sans être trop délabrante ; la détermination de la longueur de travail, qui est un facteur influençant grandement le pronostic du
traitement (4) ; la technique mise en forme canalaire, qui a évolué ces dernières décennies avec l’instrumentation mécanisée, qui possède des avantages non négligeables par rapport à l’instrumentation classique, mais qui a aussi ses limites comme le risque de fracture instrumentale si les recommandations d’usage ne sont pas respectées (5–7) ; l’irrigation, qui est un facteur prépondérant dans la réussite du traitement canalaire, car c’est cette dernière qui permet l’élimination de la majorité des bactéries présentes dans un canal infecté ; et enfin le dernier facteur important est l’obturation canalaire, qui finalise le traitement endodontique et permet de prévenir toute contamination canalaire ultérieure en scellant l’espace canalaire de manière tridimensionnelle, traditionnellement avec de la gutta-percha associée à un ciment de scellement canalaire.
En plus de ces critères, il faut aussi prendre en compte la nature de la pathologie et sa gravité qui influencent de manière importante le taux de succès du traitement endodontique. Les chances de succès du traitement d’une pulpite seront ainsi plus importantes que celles d’une nécrose pulpaire. De la même manière, une lésion périapicale de petit volume aura un meilleur pronostic qu’une lésion de volume plus important (4,8).
La restauration coronaire réalisée sur la dent dépulpée joue aussi un rôle critique dans la réussite de ces traitements canalaires. En effet, de nombreuses études ont montré l’incidence de la qualité du continuum endo-restaurateur sur la pérennité du traitement (9,10).
Du fait de la rigueur nécessaire à la réussite de ces traitements, les thérapeutiques endodontiques sont perçues par les praticiens comme des actes difficiles, chronophages, peu rémunérateurs, et dont le succès reste malgré tout incertain. Les échecs sont frustrants pour les patients comme pour les praticiens, entraînant des heures supplémentaires de travail et peuvent être à l’origine de discordes troublant la relation patient/praticien (11).
Différents types de complications peuvent survenir suite à un traitement endodontique, telles que les lésions péri-apicales ou les fractures. Ces dernières peuvent être liées à l’acte endodontique lui-même, mais aussi à l’absence-même de tissu pulpaire induite par le traitement. En effet, si une dent immature doit être traitée endodontiquement, celle-ci aura une épaisseur de dentine plus faible car elle ne sera pas arrivée à maturation. La pulpectomie engendrée par le traitement aura pour
conséquence l’arrêt de la synthèse dentinaire. Par conséquent, la structure de la dent en sera fragilisée, par un manque d’épaisseur dentinaire et sa susceptibilité à la fracture sera accrue (12,13). La susceptibilité à la fracture, d’une dent traitée par la méthode recommandée de traitement endodontique, est aussi due au fait que durant le traitement, une partie non négligeable de la structure dentaire est éliminée. De plus, une préparation prothétique supplémentaire est souvent nécessaire, avec pour conséquence un affaiblissement de la résistance de la dent aux contraintes mécaniques (14–16).
Ainsi, même si des progrès majeurs ont été faits dans le domaine de l’endodontie ces dernières années, il est important de souligner que, malgré son efficacité, l’acte endodontique présente des limites, en particulier des risques de complications pouvant aboutir à la perte prématurée de la dent traitée. A l’ère de la dentisterie a minima, l’objectif principal de notre pratique clinique est désormais la préservation maximale des tissus dentaires et pulpaires. Aussi, de nombreuses recherches sont menées afin de développer de nouvelles thérapeutiques endodontiques basées sur la régénération de la pulpe.
B. RÔLE ET COMPOSITION DU COMPLEXE PULPO-DENTINAIRE
1. Le rôle du complexe dentino-pulpaire
Le complexe dentino-pulpaire est un tissu d’origine ectomésenchymateux. Il est formé par une continuité physiologique entre un tissu dur composé principalement d’odontoblastes et d’une matrice extra-cellulaire dense (la dentine) et un tissu conjonctif mou hétérogène et central, qui est lui vascularisé et innervé, composé de différentes cellules et d’une matrice extra-cellulaire riche en collagène (la pulpe). Ces deux tissus fonctionnent de façon synchrone et équilibrée.
La pulpe a plusieurs rôles. Elle est l’apport nutritif des odontoblastes et permet l’élimination des déchets métaboliques et cellulaires du fait de sa vascularisation conséquente. Elle participe donc à la minéralisation de la dentine en apportant un soutien aux odontoblastes. La pulpe a aussi pour rôle de défendre la dent contre les agressions, qu’elles soient chimiques, biologiques ou mécaniques. En effet, ses mécanismes de défense sont complexes et basés sur la communication cellulaire principalement. Les cellules immunitaires, les médiateurs de l’inflammation, la vascularisation et l’innervation de ce tissu, forment une réelle défense immunitaire pour les odontoblastes qui eux ont pour rôle de former de la dentine tout au long de la vie de la dent (17,18).
Réciproquement, la dentine joue un rôle majeur dans la protection de la pulpe sous-jacente, elle agit comme une barrière afin d’inhiber la diffusion des éléments nuisibles vers la pulpe. Ceci est démontré par le fait que, bien que les résines composites, les adhésifs et les composants de ces produits soient cytotoxiques en culture cellulaire, des tests d'utilisation précliniques indiquent que les mêmes classes de matériau peuvent avoir peu d'effet sur la pulpe lorsque nous les appliquons au niveau de la dentine (19). Ce processus de protection de la diffusion de la dentine contre des éléments nocifs pour la pulpe est directement en lien avec l’épaisseur de dentine résiduelle après une agression, et cela a été démontré in vitro en étudiant la diffusion des monomères HEMA et TEGDMA des résines composites photopolymérisables, dans des cavités de caries préparées. Les résultats de cette
expérience ont démontré que plus l’épaisseur de la dentine résiduelle est élevée, moins la réponse pulpaire est grande, et inversement. Cela démontre le rôle de protection important que joue la dentine vis-à-vis de la pulpe (20).
2. Les composants de la pulpe dentaire
a) Les cellules de la pulpe
(1) Les odontoblastes
Les cellules odontoblastiques sont de petites cellules ovoïdes avec un rapport noyau/cytoplasme élevé et dont le réticulum endoplasmique granuleux (REG) est très développé. Ces cellules sont se réorganisent sans cesse en fonction de leur activité sécrétoire. En effet, ces cellules ont notamment pour rôle la sécrétion de la dentine primaire, qui participe à la formation de la dent avant éruption, de la dentine secondaire tout au long de la vie de la dent, et enfin de la dentine tertiaire, dite de réparation, en cas d’agression de la dent (21,22).
Ces cellules possèdent un complexe de jonction distale important, puisqu’elles sont alignées le long de la pulpe, et forment une barrière cytologique et histologique entre le compartiment pulpaire et dentinaire. Elles possèdent aussi un prolongement cytoplasmique qui s’immisce dans les tubulis dentinaires où se déroule la sécrétion dentinaire (23,24).
Enfin, ces cellules, en plus de leur activité sécrétoire et leur rôle de barrière cellulaire, jouent un rôle dans la proprioception et le nociception dentaires. L'idée que les odontoblastes puissent détecter des stimuli externes et traduire le signal vers les cellules neurales voisines est soutenue par la proximité des odontoblastes avec les terminaisons nerveuses dentaires. Ils transmettent les signaux, notamment les stimuli extérieurs vers le système nerveux contenu dans la pulpe, et sont donc responsables des douleurs que nous rencontrons quand nous avons une carie profonde avec une atteinte dentinaire par exemple (25,26).
Les odontoblastes, qui constituent la couche cellulaire la plus externe de la pulpe dentaire, assurent à la fois une communication et une barrière d'isolement entre la dentine et la pulpe sous-jacente.
(2) Les fibroblastes
Les fibroblastes pulpaires sont des cellules allongées avec un large noyau et un REG bien développé. Ils représentent la principale population de cellules de la zone centrale du parenchyme pulpaire. Ils sont présents dans les tissus conjonctifs, et appelés parfois « cellules de soutien ».
La présence de l’appareil de Golgi, développé et localisé proche du noyau, et de vésicules de sécrétion, montre une activité de synthèse et donc de sécrétion importante. Leur rôle est de former et de renouveler la matrice extra-cellulaire (MEC) en synthétisant des fibres de collagène de type I et III, des protéoglycanes et des glycoprotéines. Ces cellules, en plus de leur activité sécrétoire, ont une activité de communication et de stimulation.
Cette communication inter-fibroblastes est essentielle, et elle est traduite par la présence de jonctions de type GAP et desmosomales qui sont le siège d’une activité de communication importante. Ensuite, leur activité sécrétoire leur permet de sécréter, en plus des constituants de la MEC, des cytokines et des facteurs de croissance en cas de traumatismes pulpaires, notamment des facteurs angiogéniques (23,27).
(3) Cellules de l’immunité
La pulpe dentaire contient plusieurs types de cellules immunitaires : des macrophages, des cellules dendritiques, des lymphocytes, des mastocytes et des plasmocytes (28).
Le rôle des macrophages dans la pulpe physiologique, c’est-à-dire sans pathologie, est la phagocytose des éléments morts ou étrangers de la pulpe. Ils ont aussi pour rôle d’activer la réponse immunitaire au cours de la pathologie pulpaire d’origine bactérienne (29).
Le rôle des cellules dendritiques est similaire à celui des macrophages, ils ne possèdent pas d’activité de phagocytose, en revanche, ils déclenchent la réponse immunitaire en cas d’agression bactérienne en présentant les antigènes aux lymphocytes. Ces cellules dendritiques ont aussi une forte activité de communication
grâce à leurs dendrites et à leur proximité avec les vaisseaux sanguins et les fibres nerveuses de la pulpe.
Les lymphocytes, quant à eux, sont responsables de l’immunité spécifique et sont la mémoire de la réponse immunitaire en cas d’agression pulpaire par un antigène qui leur a déjà été présenté (18).
(4) Les cellules souches (a) Les DPSC
Les cellules souches de la pulpe dentaire sont des cellules indifférenciées d’origine mésenchymateuse. Elles ont été découvertes en 2000 et ont été le point de départ des recherches sur l’endodontie régénératrice. Ces cellules souches ainsi découvertes sont appelées DPSC pour « Dental Pulp Stem Cells » (30).
Les études récentes concernant l’ingénierie tissulaire dentaire portent donc principalement sur ces cellules, car elles ont montré in vitro, un fort potentiel de différenciation et de prolifération, supérieur à celui des cellules souches issues de différents tissus (moelle épinière ou tissu adipeux par exemple). Ces cellules ont donc la capacité de se différencier en odontoblastes ou bien en fibroblastes selon les besoins du milieu (31).
L’étude immunohistochimique réalisée par Gronthos et son équipe lors de la découverte des DPSC, a permis de caractériser cette population cellulaire (30). Cette étude a permis la comparaison entre les DPSC et les BMSSC (Bone Marrow Stromal Stem Cell) qui sont les cellules souches de la moelle épinière, dans le but de mettre en évidence les marqueurs communs et divergents des deux types cellulaires.
En particulier, il a été montré que les DPSC et les BMSSC exprimaient des marqueurs similaires, qui sont associés à :
- l'endothélium (MUC-18 (CD146), et VCAM1) ;
- l’os (phosphatase alcaline, collagène de type I, ostéonectine, ostéopontine et ostéocalcine) ;
- aux fibroblastes (collagène de type III et facteur de croissance des fibroblastes 2).
(b) Les SHED
D’autres cellules souches d’origine dentaire, présentant un fort potentiel thérapeutique dans le domaine de l’ingénierie tissulaire, ont été découvertes peu de temps après. Ce sont les cellules souches de la pulpe des dents temporaires appelées SHED pour « Stem cells from Human Exfoliated Deciduous Teeth » (32).
L’intérêt de ces cellules est double. Non seulement elles présentent des propriétés cytologiques et biologiques intéressantes dans le cadre de l’ingénierie tissulaire dentaire et médicale, du fait de leurs capacités de différenciation et de prolifération, mais elles sont aussi plus facilement disponibles et peuvent être recueillies de façon simple.
(c) Les autres cellules souches d’origine dentaire
D’autres cellules souches provenant de l’environnement dentaire ont été découvertes par la suite.
Parmi elles, les PDLSC (Periodontal Ligament Stem Cell) dérivent du ligament parodontal et ont la spécificité de se différencier en cémentoblastes et en cellules produisant du collagène de type I. Elles sont surtout étudiées dans le cadre de la régénération tissulaire parodontale (33).
Les SCAP (Stem Cells from the Apical Papilla) sont les cellules souches dites de la papille apicale, on les retrouve au niveau de l’apex des dents lorsque ce dernier est ouvert, donc sur des dents immatures, donc principalement chez l’enfant et l’adolescent. On peut les retrouver chez l’adulte au niveau des troisièmes molaires immatures (34,35). Ces cellules possèdent des caractéristiques cytologiques proches des DPSC, puisqu’elles possèdent la capacité de se différencier en odontoblastes capables de générer un tissu dentinaire et ont un potentiel de prolifération égal, voire supérieur, à ces dernières (36,37).
Enfin, les dernières cellules souches d’origine dentaire découvertes sont les DFPC (Dental Follicle Precursor Cells), qui sont les cellules souches issues du follicule dentaire. Ce dernier contient les cellules progénitrices qui formeront le tissu parodontal (os alvéolaire, cément et ligament parodontal) (38). Ces cellules ont des capacités
cytologiques différentes des DPSC puisqu’elles peuvent se différencier en ostéoblastes, adipocytes, chondrocytes et cémentoblastes selon leur milieu de culture. Cette capacité fait de ces cellules une source potentielle dans la régénération tissulaire parodontale (39,40).
b) La matrice extra-cellulaire (MEC)
La MEC pulpaire est synthétisée par les fibroblastes et constitue une grande partie de la pulpe, car les espaces interstitiels sont plutôt larges et sont occupés majoritairement par des fibres de collagène, des glycosaminoglycanes, des glycoprotéines, de l’élastine, des métalloprotéases matricielles (MMP) et des lipides. Le collagène contenu dans la pulpe est de type I et III (respectivement 56 et 41%). Cette quantité de collagène représente 34% des protéines pulpaires, et elle augmente avec l’âge conduisant à une fibrose progressive de la pulpe (23).
La MEC contient aussi des composants non collagéniques : - fibronectine, prédominante dans la pulpe
- chondroïtine 4 et 6 sulfate (60%) (CS4 et CS6) - dermatane sulfate (34%) (DS)
- kératane sulfate (2%) (KS) - glycosaminoglycanes (GAGs) - protéoglycanes (PGs)
La MEC de la pulpe joue un rôle important, car elle permet le soutien physique des cellules dans le canal dentaire, mais elle permet aussi la mobilité cellulaire au sein de l’espace et la transmission des facteurs de croissance et autres protéines d’information. Elle a donc aussi un rôle important dans la communication cellulaire et dans les processus de réparation et de régénération de la pulpe. C’est donc un élément important à prendre en compte dans l’optique d’une thérapeutique basée sur l’ingénierie tissulaire.
c) La vascularisation pulpaire
La pulpe est un tissu très vascularisé, les capillaires issus des artérioles, elles-mêmes issues des artères alvéolaires supérieures ou inférieures, se ramifient et forment un réseau vasculaire sous-odontoblastique.
Les artérioles pénètrent par le foramen apical principal et par les foramens secondaires. Le retour veineux s’effectue de la même manière par l’organisation en veinules post-capillaires qui se rassemble en veinules collectrices qui ressortent par le foramen apical (29).
Il existe d’autre part un réseau lymphatique pulpaire qui se draine dans les ganglions sous-maxillaires et sous-mentaux, puis cervicaux. Ce réseau joue un rôle important dans l’initiation de la réponse immunitaire en cas d’agression bactérienne de la pulpe (41).
d) L’innervation pulpaire
De la même manière que pour sa vascularisation pulpaire, l’innervation de la pulpe est riche. Elle est assurée par le foramen apical après lequel elle se ramifie et forme aux côtés de la vascularisation pulpaire, un réseau nerveux sous-odontoblastique : c’est le plexus de Rashkow (29).
Ces fibres nerveuses sont issues des branches sensitives maxillaires et mandibulaires du nerf trijumeau (respectivement V2 et V3) et des branches sympathiques du ganglion cervical supérieur.
Il existe des fibres sensitives, responsables de la douleur, qui sont activées lors de l’inflammation pulpaire principalement, mais aussi lors des stimuli thermiques, électriques et mécaniques. Les fibres vaso-motrices sympathiques, elles, ont pour rôle le contrôle vaso-constricteur des éléments vasculaires pulpaires (29,42).
A ce jour, un certain nombre de connaissances ont ainsi été acquises autour de la composition complexe du tissu pulpaire et la physiopathologie de la pulpe. Ces connaissances ont permis le développement de nouvelles recherches visant à élaborer un tissu « pulp-like », dans le but de régénérer le tissu pulpaire d’une dent, quelle que soit son atteinte.
C. PRINCIPES GENERAUX DE LA REGENERATION PULPAIRE
1. Définition de l’ingénierie tissulaire
La régénération pulpaire fait partie d’un domaine plus large appelé ingénierie tissulaire. Ce domaine a été défini en 1993 comme « un domaine interdisciplinaire qui applique les principes de l'ingénierie et des sciences de la vie au développement de substituts biologiques qui rétablissent, maintiennent ou améliorent la fonction des tissus biologiques ou un organe entier » (43). L’ingénierie tissulaire utilise les connaissances accumulées sur les biopolymères, la culture cellulaire et les facteurs de croissance et repose en grande partie sur l’utilisation des cellules souches, qui ont été découvertes et isolées en 1981 chez la souris pour la première fois (44). Cette découverte a créé un renouveau dans le domaine de la recherche et de la médecine notamment, car elle ouvre sur de nouvelles perspectives thérapeutiques (45).
Cet élargissement des compétences thérapeutiques, permise par l’ingénierie tissulaire, n’épargne pas le domaine de l’odontologie. En effet, la découverte de cellules souches pluripotentes d’origine dentaire, et plus précisément d’origine pulpaire comme nous l’avons vu plus tôt, par l’équipe de Gronthos en 2000, a permise aux chercheurs de travailler sur de nouvelles solutions thérapeutiques afin faire évoluer les techniques de soin, notamment dans le domaine de la parodontologie, mais surtout dans celui de l’endodontie. La découverte des DPSC est donc le point de départ de l’endodontie régénératrice (30).
2. La régénération pulpaire
a) Définition
Le processus de régénération pulpaire est assez complexe, et doit être différencié de celui de la revitalisation pulpaire. En effet, la régénération de la pulpe consiste en la restauration du complexe pulpe-dentine, et ne peut avoir lieu sans revascularisation (ou angiogenèse) (46). A contrario, la « revascularisation de la
le repeuplement des odontoblastes, qui s'alignent sur les surfaces de la dentine. Bien que les vaisseaux sanguins soient des constituants indispensables de la pulpe dentaire, la régénération de la pulpe est considérée comme incomplète sans une couche odontoblastique recouvrant la surface de la dentine. Et même avec ces deux éléments (activité vasculaire et activité odontoblastique), la régénération pulpaire peut, également, être considérée comme incomplète sans les fibres nerveuses nociceptives, sympathiques et parasympathiques, sans les fibroblastes interstitiels et sans le plus important, les cellules souches progénitrices qui servent à reconstituer toutes les cellules pulpaires de la « pulpe régénérée ».
La régénération pulpaire peut donc être définie comme étant la régénération d’une partie ou bien de la totalité du tissu pulpaire accompagné d’une angiogenèse, d’une neurogénèse et d’une minéralisation périphérique, permise grâce au recrutement ou à l’apposition de cellules souches d’origine, principalement, dentaire et à leur différenciation et leur prolifération (47–50). C’est un domaine qui se situe à la croisé de l’ingénierie tissulaire et de la biofabrication, qui est définit au sens large, par la fabrication de matériaux par des organismes vivants (51).
b) Enjeux de la régénération pulpaire
Les cellules souches ont ouvert de nouvelles perspectives thérapeutiques, mais à ce jour ces dernières présentent des limites et ne peuvent être envisageables en pratique clinique à court terme. En effet, les principaux risques lors de la manipulation de cellules souches dans le domaine médical sont : le risque de rejet immunologique des greffons ; le risque cancérigène qu’apportent les cellules souches à haut potentiel de prolifération ; et enfin, le risque de contamination potentiel lors des manipulations
ex vivo et des cultures cellulaires.
Actuellement, les études concernant la régénération pulpaire portent principalement sur la caractérisation de ces cellules souches pluripotentes d’origine dentaire et sur les moyens de les recruter et de les faire se différencier et proliférer. Et cela dans le but de parvenir à la régénération totale d’une pulpe pathologique, la régénération partielle d’une pulpe lésée, ou bien à la formation d’un pont dentinaire pour une lésion carieuse étendue avec effraction pulpaire (52,53).
(1) Formation d’un pont dentinaire
La population cellulaire pulpaire permet d’intervenir en cas d’agressions, notamment bactérienne. En effet, un mécanisme immunologique se met en place grâce aux cellules immunitaires présentes (17). En parallèle de ce mécanisme de défense, il existe un mécanisme de différenciation, de régénération, et de réparation, faisant intervenir les cellules souches de la pulpe dentaire, les DPSC citées précédemment.
Le principe de ce processus de réparation est le remplacement des odontoblastes endommagés par le traumatisme carieux. Il peut être initié grâce à l’apposition d’un coiffage pulpaire bioactif qui a pour but de stimuler le processus de différenciation des cellules souches mésenchymateuses pulpaires en odontoblastes de remplacement. Cela a pour effet de faire « cicatriser » la dentine par synthèse d’une dentine tertiaire dite de réparation formée par ces nouveaux odontoblastes appelés « odontoblaste-like » car ils sont issus de la différenciation des cellules souches présentes dans la pulpe dentaire. Cette régénération tissulaire endogène et induite par le matériau de comblement bioactif est appelé « pont dentinaire » (54).
Cette thérapeutique est basée sur la technique dite de « cell homing », c’est-à-dire qu’il n’y a pas d’utilisation de cellules souches exogènes ou bien endogènes modifiées ou cultivées ex vivo, mais seulement de facteurs de croissance qui permettront d’enclencher la cascade signalétique du processus de différenciation des cellules souches endogènes déjà présentes localement, dans la pulpe.
Ce processus permet le maintien de la vitalité pulpaire, mais le pronostic d’une telle thérapeutique est incertain car de nombreux facteurs rentrent en jeu, notamment la taille du défaut dentinaire. En effet, le « critical-size defect » ou taille de défaut critique, est un concept de l’ingénierie tissulaire qui se définit par le fait qu’à partir d’un défaut trop important, le temps de vie restant de l’animal ou de l’humain ayant ce défaut ne suffira pas pour permettre la régénération entière du tissu lésé (55).
Cette notion de « critical-size defect » montre aussi la limite de la régénération basée sur le recrutement des cellules endogènes tant dans le domaine de la régénération tissulaire en général, que dans celui de la régénération pulpaire (46).
(2) Régénération partielle du tissu pulpaire
Le traitement actuel inscrit dans les recommandations, en cas d’atteinte pulpaire partielle, est la pulpectomie totale (1). Or, lors de l’inflammation de la pulpe, la totalité du tissu n’est pas touchée. Le reste de la pulpe demeure sain pendant un temps et peut permettre la régénération du tissu lésé avant que l’inflammation ne s’étende à l’ensemble de la pulpe (56). Néanmoins, ce mécanisme physiologique de régénération a ses limites, et l’agression constante qu’engendre une carie aboutit bien souvent à l’inflammation de la totalité de la pulpe voire une nécrose pulpaire.
C’est à ce moment que l’ingénierie tissulaire dentaire et donc la régénération pulpaire intervient. Dans un cas comme celui-ci, la procédure consiste à utiliser la pulpe saine restante comme une aide à la régénération de la pulpe. L’équipe de Koichiro Iohara est parvenue par, le biais d’expérimentations, à régénérer le tissu pulpaire entièrement in vivo chez le chien, après pulpotomie et de façon orthotopique (57,58).
Le traitement de régénération partielle de la pulpe est donc une étape importante dans l’endodontie régénératrice, mais cette discipline vise la régénération totale de la pulpe. Néanmoins, cette approche permet de mieux cerner les mécanismes mis en jeu durant le processus de régénération.
(3) Régénération « de novo » ou totale de la pulpe Lorsque nous parlons de régénération pulpaire, nous visons à mettre en lumière une thérapeutique nouvelle permettant la synthétisation de la totalité du parenchyme pulpaire.
Afin de permettre le développement, la prolifération et la différenciation des cellules souches dans des conditions cliniques chez l’Homme, il y a trois éléments qui doivent être étudiés : le type de cellules souches utilisé, les matrices et les facteurs de croissance (59).
Comme vu précédemment, les cellules souches utilisées dans la régénération pulpaire doivent préférentiellement être d’origine dentaire (DPSC ; SHED). Les
recherches portent donc sur ces cellules du fait de leurs propriétés biologiques et cytologiques, mais elles doivent aussi être facilement accessibles, collectables, cultivables et caractérisables, afin de pouvoir être exploitées plus facilement dans le cadre d’une application clinique.
Les études et expériences faites dans le cadre de la régénération pulpaire totale visent à établir un protocole reproductible qui permettrait d’obtenir, systématiquement ou bien le plus souvent possible, des résultats probants de synthétisation de tissu pulpaire en quantité suffisante et fonctionnel.
Pour cela, deux types de recherches sont menés :
- Les traitements de régénération dits de « cell-homing », c’est-à-dire portés sur le recrutement des cellules souches endogènes, et donc déjà présentes dans le corps. Ceci permet de passer outre certaines difficultés, comme le risque cancérigène lié à la manipulation génique des cellules souches, ou bien le risque de contamination, ou le risque de rejet de greffons (60,61) ;
- Les traitements de régénération dit « cell-based », qui sont plus complexes à réaliser, surtout du point de vue d’une application clinique potentielle, avec les inconvénients cités juste avant, mais qui seraient plus enclins à pouvoir régénérer un tissu pulpaire de façon totale (46).
La régénération totale est donc le but à atteindre pour la recherche dans ce domaine. Néanmoins, il y a encore beaucoup de difficultés à surmonter avant de pouvoir envisager une translation clinique.
c) Les outils de l’ingénierie tissulaire pulpaire
(1) Les cellules souches
Les cellules souches exploitées dans les expérimentations et les études actuelles sur l’endodontie régénératrice sont principalement d’origine dentaire. Certaines études portent sur les cellules souches de la moelle épinière (BMSSC), ou sur les cellules souches du tissu adipeux, mais leur intérêt dans la régénération tissulaire de la pulpe est moindre (31).
Comme vu précédemment, les cellules souches les plus fréquemment utilisées dans ce contexte sont les cellules issues : de la pulpe des dents définitives matures (les DPSC), de la pulpe des dents déciduales (SHED), de l’apex des dents immatures (SCAP) et enfin du ligament parodontal (PDLSC).
Les cellules les plus étudiées, du fait de leur potentiel de différenciation et de prolifération supérieurs aux autres, sont les DPSC et les SHED. Il s’agit des cellules les plus prometteuses dans le cadre de la mise en place d’une thérapeutique régénératrice viable (33,37,62,63).
(2) Les matrices (« scaffold »)
Les matrices doivent posséder certaines propriétés, comme la biocompatibilité et une architecture tridimensionnelle favorable à la prolifération cellulaire.
Ces matrices sont par ailleurs appelées « scaffold » dans les différents articles anglophones, se traduisant littéralement par échafaudage. Cela souligne l’importance de ces matrices dans la régénération pulpaire, mais il y a encore de nombreuses études en cours afin de déterminer le meilleur environnement matriciel à développer dans le cadre d’une telle régénération, nécessitant l’intervention d’une multitude de facteurs (64).
Les principaux montages matriciels réalisés lors des expérimentations retrouvées dans la littérature font intervenir du collagène de type I et III, car ce sont les protéines de soutien présentes dans la pulpe physiologique, et ces deux types de collagène semblent avoir des propriétés de guidage de la prolifération supérieures à d’autres matériaux comme la gélatine ou le chitosan (65).
Néanmoins les chercheurs se penchent sur de nouveaux matériaux afin de déterminer le milieu, protéique ou à base de biomatériaux, idéal pour la prolifération des cellules souches au sein de l’environnement particulièrement hostile que constitue la dent (66–68).
Par exemple, récemment, une expérience a été récemment réalisée dans le but de mettre au point une matrice de type « gutta-percha-like » à base de collagène et d’alginate, dans le but de la cellulariser pour une application clinique future (69).
(3) Les facteurs de croissance
Les facteurs de croissance sont aussi très importants en ingénierie tissulaire. Ils sont des éléments clés car ils permettent d’orienter les cellules souches, cellules indifférenciées, vers des stades de différenciation supérieurs. Ils vont ainsi permettre la différentiation cellulaire vers le type cellulaire que nous voulons obtenir, c’est-à-dire des cellules de la pulpe dentaire (odontoblastes et fibroblastes, qui sont les plus importantes). De plus, ces facteurs de croissance vont aussi avoir pour rôle l’accroissement de la prolifération cellulaire dans le but d’obtenir la génération d’un tissu plus conséquent (70,71).
Dans le cadre de la régénération pulpaire, nous cherchons entre autres à obtenir une différenciation des cellules souches d’origine dentaire en cellules « odontoblast-like », c’est-à-dire en cellules nouvellement générées qui expriment les marqueurs spécifiques des odontoblastes, notamment les DSPP, et qui sont capables de minéralisation. Pour cela, les propriétés de différenciation des DPSC en « odontoblast-like » ont été étudiées in vitro afin de déterminer le milieu de culture le plus favorable, c’est le cas de Yamashita et coll. (2003) qui ont démontré par la mise en culture in vitro dans un milieu contenant de l’acide ascorbique, le potentiel de différenciation odontoblastique de ces cellules. Ils ont démontré que l’ajout de dexaméthasone accroît l’activité de la phosphatase alcaline et de la DSPP, qui sont spécifiques des odontoblastes (72).
Cette activité de minéralisation prouvée par la présence de la DSPP dans le milieu de culture avait déjà été mise en évidence par Gronthos et coll. (2000). Ils ont montré que BMP-4 (Bone Morphogenic Protein), ajouté au milieu de culture favorisait la différenciation et la prolifération des DPSC en cellules « odontoblast-like » secrétant de la DSPP (30).
L’ingénierie tissulaire pulpaire est un domaine visant à développer des thérapeutiques régénératrices de la pulpe dentaire, lorsqu’elle a été lésée de manière partielle ou totale. Les propriétés régénératrices de certains types cellulaires ont été mises en évidence grâce à différentes études in vitro. Actuellement, les recherches s’orientent de plus en plus vers l’in vivo, permettant la mise en situation biologique des résultats démontrés par les études antérieures.
D. MODELES D’ETUDE EN ODONTOLOGIE
Afin de démontrer le potentiel de ces cellules souches, et de pouvoir les imaginer un jour devenir le matériel d’obturation des dents de nos patients, il est indispensable de recueillir des données précises in vitro, dans un premier temps, puis
in vivo dans un second temps. Ces études préliminaires sont indispensables avant
une potentielle application clinique.
Il est naturel que nous ne puissions pas évaluer leur potentiel directement chez l’Homme, d’un point de vue déontologique et éthique, il est donc nécessaire de développer un modèle animal sur lequel les études et les expériences menées puissent être reproductibles et prédictibles à l’application clinique chez l’Homme.
La régénération de la pulpe doit donc être évaluée tant de façon qualitative que quantitative en utilisant des modèles animaux. Les modèles utilisés actuellement dans le cadre des expérimentations sont majoritairement des modèles d’études ectopiques faits avec des greffons de dents humaines implantés en sous-cutané sur des souris modifiées génétiquement. D’autres modèles animaux sont utilisés pour des études orthotopiques dont nous parlerons plus en détails dans la suite de ce travail. Dans tous les cas, il est difficile de trouver un modèle présentant toutes les caractéristiques et subtilités de la dentinogénèse humaine (73–75).
La régénération pulpaire impose donc des recherches qui sont biologiques, in
vitro, avec l’étude de la biologie cellulaire notamment, mais aussi plus spécifiquement
odontologiques, en tenant compte de l’environnement biologique bien particulier que constitue l’organe dentaire. Cela signifie que le modèle animal qui fera l’objet d’expérimentations doit être assez proche de l’Homme sur le plan biologique, mais aussi sur le plan odontologique. C’est en cela que le choix de ce modèle est complexe, pas uniquement dans le domaine de la régénération pulpaire, mais dans le domaine de l’ingénierie tissulaire en général (76).
E. OBJECTIFS DE L’ETUDE
Ce travail consistait, par le biais d’une revue de la littérature scientifique, à recenser les différents modèles d’étude in vivo utilisés actuellement dans le domaine de la régénération pulpaire, comparer les résultats expérimentaux obtenus, et évaluer la pertinence de ces modèles en vue d’une potentielle application clinique des thérapeutiques proposées chez l’Homme.
II.
MATERIEL ET METHODES
A. Schéma d’étude
Ce travail a consisté en une revue de la littérature scientifique biologique et odontologique.
B. Stratégie de recherche
Des recherches informatiques exhaustives utilisant plusieurs combinaisons de mots-clés ont été réalisées sur la base de données électronique PubMed, afin de balayer la littérature biologique et odontologique. Les combinaisons de mots-clés « Keywords » et leur équivalents « MeSH Terms » suivants ont été utilisés :
- (endodontics) AND (tissue engineering) AND (regeneration) AND (stem cell) = MeSH Terms
- (endodontics) AND (tissue engineering) AND (regeneration) AND (models) = MeSH Terms
- (endodontics) AND (tissue engineering) AND (regeneration) AND (animal) = MeSH Terms
- (endodontics) AND (dental pulp) AND (regeneration) AND (stem cells) = MeSH Terms
- (endodontics) AND (tissue engineering) AND (regeneration) AND (in vivo) = Keywords
Cette recherche a été complétée par l’ajout d’articles extraits des références bibliographiques des articles identifiés lors de la recherche informatique.
C. Critères d’inclusion / exclusion
Les critères retenus pour la sélection d’articles se sont focalisés sur :
o Les études expérimentales in vivo concernant la régénération tissulaire de la pulpe dentaire
o Les études concernant les modèles animaux utilisés dans le domaine de l’ingénierie tissulaire dentaire
o Les revues de littérature préexistantes relatives au sujet de ce travail Ont été exclues, toutes les publications concernant :
o La revascularisation pulpaire des dents immatures
o Les études biologiques in vitro concernant la régénération du tissu pulpaire
La recherche électronique a ainsi été focalisée exclusivement sur les modèles d’étude in vivo utilisés dans le domaine de la régénération tissulaire pulpaire.
D. Sélection des études
Les titres et les résumés des articles identifiés lors des recherches électroniques ont été étudiés, les doublons ont été éliminés et si l’incorporation d’un article semblait probable, le texte intégral était lu. De plus, les références bibliographiques des articles sélectionnés ont été passées en revue pour identifier de nouvelles possibilités d’inclusion.
E. Accès aux articles
L’accès à la totalité des articles choisis a été possible grâce à l’Environnement Numérique de Travail de l’Université de Bordeaux.
Le logiciel de gestion des références bibliographiques Zotero a été utilisé afin d’archiver les articles sélectionnés et pouvoir les consulter ultérieurement.
III. RESULTATS
A. Articles sélectionnés pour la revue de littérature
Les recherches électroniques décrites précédemment ont permis de regrouper initialement 285 articles issus de la base de données PubMed.
Après avoir éliminé les doublons, lu les titres et résumés résultant des recherches, seules 24 publications ont été retenues. L’analyse bibliographique des articles sélectionnés nous a permis d’inclure 8 nouvelles publications que la recherche par mots-clés n’avait pas fait ressortir.
Une lecture complète du texte et une analyse de la pertinence des articles, basé sur les critères d’inclusion, a conduit à une sélection finale regroupant 15 articles internationaux, avec des dates de publication comprises entre 2008 et 2016.
Parmi ceux-ci, 13 articles concernaient des études expérimentales in vivo sur des animaux. 7 articles sélectionnés portaient sur des modèles d’études ectopiques (en sous-cutané sur des rongeurs immunodéprimés), et 6 articles sur des modèles orthotopiques (sur des modèles animaux plus imposant comme le chien ou bien les cochons nains).
Puis 2 articles supplémentaires ont été sélectionnés, et concernaient l’étude d’un modèle animal précis. Ces études avaient pour objectif de rechercher un modèle expérimental animal nouveau (le furet et le mouton) dont les résultats expérimentaux pourraient être pertinents dans le cadre d’une application clinique future.
Un arbre de sélection des articles a été réalisé afin de résumer le processus de sélection des 15 articles inclus dans l’étude (37,58,74,75,77–88) (Figure 1).
Chaque étude a fait l’objet d’une synthèse, compilée dans un tableau récapitulatif global (Annexes).
Figure 1 : Arbre de sélection des articles pour la revue de littérature
Publications potentiellement pertinentes issues des recherches électroniques par mots-clés et des sources bibliographiques supplémentaires
n = 286 (PubMed)
Publications exclues pour cause de doublons = 108
Résumés potentiellement pertinents récupérés pour évaluation n = 24 (PubMed)
Sources bibliographiques supplémentaires = 8
Publications exclues sur la base du résumé = 12
Textes intégraux potentiellement pertinents récupérés pour évaluation détaillée n = 20 (PubMed + sources bibliographiques)
Publications exclues sur la base d’une évaluation du texte = 5
Etudes inclues dans la revue de littérature n = 15 (Pubmed + sources bibliographiques)
B. Les modèles d’étude in vivo utilisés pour la régénération pulpaire
Les modèles animaux utilisés pour l’évaluation de produits d’ingénierie tissulaire pour la régénération pulpaire peuvent être divisés en deux grandes catégories : les modèles ectopiques et les modèles orthotopiques. Ces modèles sont utilisés dans le cadre de l’étude des mécanismes biologiques et cytologiques intervenant dans la régénération pulpaire, et plus généralement dans l’évaluation de la biofonctionnalité des produits d’ingénierie tissulaire dans un cadre in vivo.
1. Les modèles ectopiques
Les modèles d’étude appelés « ectopiques » consistent en l’implantation de produits d’ingénierie tissulaire en sites sous-cutanés ou intramusculaires. Ces modèles sont utilisés afin d’étudier le potentiel régénérateur des protocoles utilisés, et ils permettent, dans un même temps, d’étudier la reproductibilité de ces protocoles. De plus, d’un point de vue technique, ils sont facilement réalisables.
Les modèles animaux utilisés pour les études à implantations ectopiques dans le cadre de la régénération pulpaire sont de petits animaux, souvent des rongeurs (souris, rats), ce qui permet de s’amender des problèmes éthiques que posent souvent les animaux de plus grande taille comme les chiens, ou bien les chats, souvent considérés comme des animaux de compagnie dans la société actuelle. Le coût des études dépend aussi du choix du modèle animal, et dans des modèles ectopiques sur les rongeurs, il est grandement diminué, par rapport aux études faites sur des animaux de grande taille. Plusieurs sites d’implantation ectopique peuvent être réalisés sur un seul animal, ce qui permet d’éviter la variabilité des résultats en fonction de l’individu.
Pour résumer, ces modèles sont simples, peu coûteux et reproductibles. Ce sont donc des modèles très utiles et largement exploités dans le développement de protocoles expérimentaux en rapport avec la régénération pulpaire.
a) Etudes expérimentales du choix cellulaire pour la régénération pulpaire
L’équipe de Huang (2009) a réalisé une étude expérimentale sur un modèle ectopique dans le but de démontrer et comparer le potentiel de régénération de cellules souches issues de différents tissus pouvant produire de la nouvelle dentine. Le modèle choisi pour cette étude était une souris immunodéprimée, sur laquelle l’implantation de greffons de dentine a été réalisée en sous-cutané (78).
Plus précisément, l’étude consistait en l’implantation de DPSC, de SCAP et de BMMSC afin de comparer leurs potentiels respectifs de différenciation et de prolifération. Ces cellules étaient ensemencées dans une matrice de poly-D,L-lactide/glycolide (PLG) après leur collecte, leur isolation et leur caractérisation cytologique, et étaient implantées dans des fragments radiculaires de troisième molaire humaine. Chaque souris a reçu deux greffons, un de chaque côté, en sous-cutané. Après une période de quatre mois, les souris étaient euthanasiées puis les greffons étaient retirés et analysés histologiquement.
Les résultats ont montré que les potentiels de différenciation et de prolifération des DPSC et des SCAP étaient supérieurs à celui des BMMSC. De plus, le fragment témoin (n’ayant pas reçu la matrice de PLG), était rempli d’un tissu conjonctif qui était semblable au tissu sous-cutané de la souris présent autour du fragment. En revanche, dans les autres fragments, ayant reçu une matrice ensemencée de DPSC et de SCAP, il y a eu formation d’un tissu similaire à celui observé dans la pulpe saine, et de même densité cellulaire, présentant des marqueurs odontoblastiques et angiogéniques positifs. De plus, certaines structures du tissu nouvellement formé présentaient un aspect tubulaire, avec des prolongements cytoplasmiques cellulaires, et se rapprochaient fortement de l’histologie du tissu dentinaire originel (81).
Cette étude, par le biais d’un modèle ectopique, a permis de démontrer le potentiel de cellules souches issues de différentes sources à promouvoir la formation de tissus ressemblant à la dentine et la pulpe.
En 2013, l’équipe de Rosa, a mis en en évidence le potentiel que représentent les dents déciduales en tant que source de cellules souches pour la régénération pulpaire. Cette expérience avait pour but de démontrer la capacité de régénération des SHED (cellules souches des dents déciduales extraites). Pour cela, ils ont mis en culture in vitro des SHED, ensemencées dans une matrice de collagène injectable recombinée (rhCollagen) ou dans un hydrogel peptidique (PuramatrixTM). Ces matrices ont permis une expansion du nombre de SHED in vitro sur une période de 7 jours, puis elles ont été placées dans des racines de prémolaires humaines qui ont été implantées de façon ectopique en sous-cutané dans le dos de souris immunodéprimées (Figure 2) (78).
Figure 2 : Morphologie et prolifération des SHED dans deux matrices injectables différentes. (A) les SHED sont dispersées et présentent une morphologie ronde lorsqu'elles sont cultivées dans PuramatrixTM ou rhCollagen type I pendant 1 jour. Les cellules prolifèrent, s’allongent et forment des grappes après 7 jours. Le vert représente la coloration d'Actin-F, et le bleu représente la coloration DAPI (noyaux). (B) Graphique représentant la prolifération de SHED au fil du temps lorsqu'il est mélangé avec PuramatrixTM ou RhCollagen type I. Le nombre de cellules pendant l'expérience n'était pas statistiquement différent lorsque les cellules ont été cultivées dans PuramatrixTM ou RhCollagen type I, comme déterminé par test t (p> 0,05), Reproduit avec permission de Rosa et al. 2013 (83).
Après 7 jours, l’analyse histologique du tissu nouvellement formé retrouvé dans les canaux contenant la PuramatrixTM, a permis de mettre en évidence l’apparition de marqueurs odontoblastiques comme la DSPP. Cette activité n’est retrouvée, en revanche qu’à partir du 14ème jour pour les canaux contenant les SHED ensemencées dans le rhCollagen (Figure 3).
Figure 3 : Expression des marqueurs putatifs de la différenciation odontoblastique par SHED in vitro. Analyse RT-PCR (DMP-1, DSPP, MEPE) des SHED ensemencées dans des matrices (PuramatrixTM, rhCollagen type I) et injectées dans des canaux radiculaires humains. En tant que témoins, des SHED cultivées dans des plaques de culture tissulaire standard (Control) ou des SHED cultivées dans les échafaudages injectables (PuramatrixTM ou rhCollagen type I) mais en l'absence de matrice pendant 28 jour. Reproduit avec permission de Rosa et al. 2013 (83)
L’expérience de Rosa et de son équipe a donc permis de démontrer le potentiel que représentent les SHED dans le domaine de la régénération pulpaire, et cela grâce à un modèle in vivo ectopique chez la souris immunodéprimée.
En 2014, Lei et son équipe ont réalisé une expérience in vivo ayant pour but de démontrer les propriétés des cellules souches de la pulpe dentaire (DPSC) et des cellules souches provenant du ligament parodontal (PDL) (appelées PDLSC), après implantation in vivo. Les cellules souches ont été isolées à partir de troisièmes molaires humaines extraites, puis cultivées in vitro. Les DPSC et les PDLSC ont ensuite été implantées respectivement à l’intérieur et autour de morceaux de dentine humaine.
Après 60 jours, les souris ont été euthanasiées et un tissu « pulp-like » a été nouvellement généré par les DPSC et un tissu « PDL-like » a été formé par les PDLSC. Les cellules souches ont été ré-isolées après l’expérience in vivo ectopique, puis analysées immunologiquement afin de mesurer leur potentiel (Figure 3).
Figure 3 : Schéma de la procédure de ré-isolement cellulaire à partir de tissus dentaires régénérés in vivo. Reproduit avec permission de Lei et al. 2014 (37).
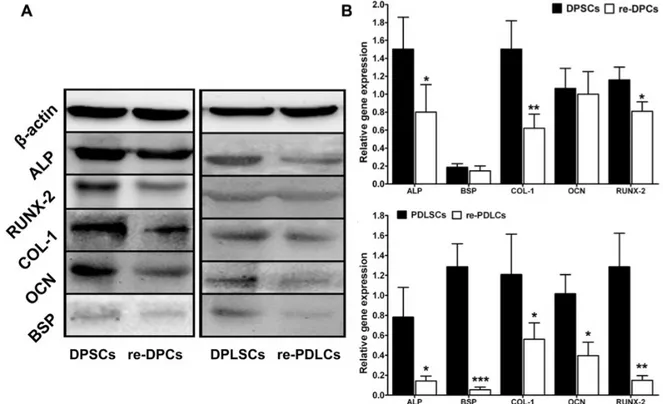
Les caractéristiques cellulaires ont donc été évaluées avant et après l'implantation. L’analyse immunologique a montré que les re-DPC et les re-PDLC étaient d'origine humaine et mésenchymateuse, et positifs pour les marqueurs mésenchymateux tels que STRO-1, CD146, CD29, CD90 et CD105. Les deux types cellulaires ont pu former des dépôts minéraux et se différencier en adipocytes et chondrocytes (Figure 4). Les résultats quantitatifs montrent des capacités de prolifération plus faibles pour les cellules ré-isolées par rapport à celles d’origine.
Figure 4 : Analyse comparatives des marqueurs ostéogéniques entre les cellules d’origine (DPSC et PDLSC) et les cellules ré-isolées après 60 jours in vivo. (A) Analyse par Western blot et image densitométrique. (B) Analyse utilisant la RT-PCR (real-time polymerase chain reaction). Reproduit avec permission de Lei et al. 2014 (37).
L’expérience a donc montré que les DPSC et les PDLSC peuvent maintenir leurs caractéristiques mésenchymateuses après l'implantation in vivo. De plus, les résultats suggèrent que les DPSC semblent beaucoup plus stables dans des conditions in vivo par rapport aux PDLSC. Ces résultats fournissent des preuves cellulaires et moléculaires supplémentaires qui soutiennent l'utilisation de cellules souches dérivées de tissus dentaires pour la régénération pulpaire et cela par l’utilisation d’un modèle animal ectopique de souris (37).
Ces trois expériences avaient pour but d’étudier le potentiel régénérateur de différentes cellules souches d’origine dentaire (DPSC, SCAP, SHED et PDLSC). Elles ont démontré qu’il existait plusieurs sources cellulaires potentielles pour la mise en place d’une thérapeutique visant la régénération pulpaire (Tableau 1).
Etude Modèle animal Site
d’implantation Résultats Huang et al. 2009 (78) Souris immunodéprimées Dorsal ectopique en sous-cutané Formation tissu « pulp-like » avec utilisation de DPSC et de SCAP Rosa et al. 2013
(83) immunodéprimées Souris Dorsal ectopique en sous-cutané tissu exprimant Formation d’un des marqueurs odontoblastiques avec l’utilisation de SHED, de Puramatrix et de RhCollagen type 1 Lei et al. 2014 (37) Souris immunodéprimées Dorsal ectopique en sous-cutané Formation d’un tissu « pulp-like » et « PDL-like » avec utilisation de DPSC et de PDLSC. Démonstration du maintien de leurs potentiels après réimplantation
Tableau 1 : Comparaison des études expérimentales ectopiques orientées sur l’étude des cellules souches d’origine dentaire
b) Etude des différents composants de la régénération pulpaire
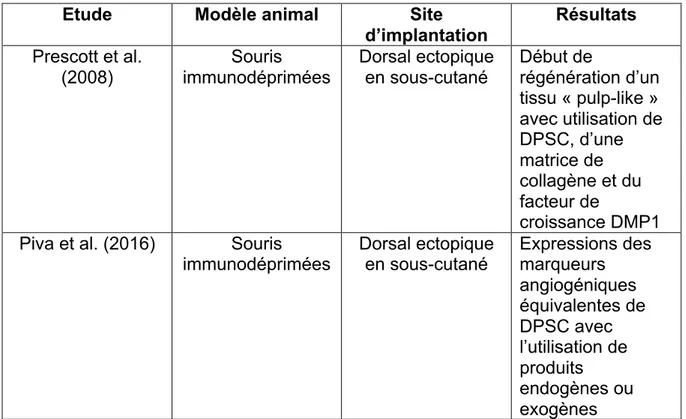
Dans l’étude expérimentale in vivo de l’équipe de Rebecca S. Prescott (2008), l’objectif était de rechercher la pertinence de chaque composant de la triade de l’ingénierie tissulaire dans la différenciation des DPSC, implantées dans un morceau de dentine, au niveau d’une perforation réalisée pour simuler une lésion de furcation,
elle-même implantée sur un modèle ectopique de souris. Cette triade était composée de collagène (servant de matrice), de facteurs de croissance (la « dentin matrix protein » (DMP1)) et des DPSC.
Cinq groupes ont été faits : dans le groupe 1, le morceau de dentine perforé était seulement comblé à l’aide de MTA ; dans le groupe 2, la dentine était comblée uniquement avec du collagène de type I ; dans le groupe 3, le comblement était réalisé avec une matrice de collagène imprégnée de DMP1 ; dans le groupe 4, le collagène était imprégné de DPSC et de DMP1 ; et dans le groupe 5, la dentine était comblée avec du collagène imprégné de DPSC uniquement. Chaque groupe était composé de 4 souris, avec chacune un seul site d’implantation ectopique en sous-cutané, au niveau dorsal.
Après 6 semaines, les souris étaient euthanasiées, puis une analyse histologique du comblement était réalisée. Les résultats ont montré que seul le groupe 4 présentait un début de régénération tissulaire. Ce groupe étant composé des tranches de dentine dont le comblement a été fait avec les trois éléments : la matrice de collagène, le facteur de croissance DMP1 et les DPSC.
Figure 5 : Souris avec un greffon sous-cutanée (ectopique) placé controlatéralement au site d’incision. Reproduit avec permission de S. Prescott and al., 2008 (77).
Ces résultats suggèrent que chaque élément de la triade de l’ingénierie tissulaire joue un rôle dans la régénération de la pulpe dentaire. Cette étude expérimentale a permis de montrer le potentiel que présentent les DPSC en présence
d’une matrice et de facteurs de croissance dans l’induction d’un mécanisme de régénération. Elle a mis en évidence les mécanismes de régénération pulpaire dans un contexte in vivo sur une modèle ectopique de souris (77).
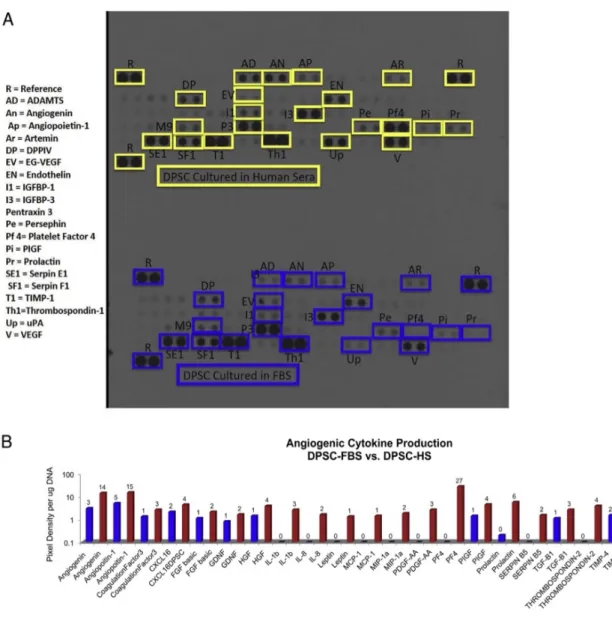
Plus récemment, dans l’étude de Piva et de son équipe (2016), l’objectif était d’utiliser un modèle animal ectopique afin d’établir un protocole réalisable en clinique, en mettant en culture les DPSC sans utilisation de moyens xénogéniques (comme le sérum animal) ou bien de facteurs de croissance exogènes. Leur but est donc de démontrer que l’on peut cultiver des DPSC avec des produits endogènes.
Pour cela, des cellules souches de troisièmes molaires humaines ont été isolées et mises en culture dans des conditions standards avec du sérum d’origine bovin fœtal (DPSCs-FBS) ou avec du sérum d’origine humain (DPSCs-HS). Après mise en culture, les cellules ont été ensemencées dans une matrice de poly(L-lactide), puis placé dans un morceau de dentine. Pour chaque groupe, deux souris sur trois ont eu des doses de tétracycline chlorhydrate (à 15, 20 et 25 jours d’expérience), qui a permis d’identifier la présence d’une minéralisation active. Les souris ont été euthanasiées après 30 jours afin de procéder à l’analyse histologique des tissus nouvellement formés.
L’analyse histologique a permis de mettre en évidence qu’après une implantation in vivo, les deux types cellulaires (DPSCs-HS et DPSCs-FBS) présentaient des marqueurs angiogéniques comparables, avec un nombre de marqueurs retrouvés plus important pour les DPSCs-HS (Figure 6).