HAL Id: dumas-01813331
Résistance et consommation des antibiotiques en ville
Henri Voillot
To cite this version:
Henri Voillot. Résistance et consommation des antibiotiques en ville. Sciences pharmaceutiques. 2018. �dumas-01813331�
UNIVERSITE DE ROUEN
UFR DE MEDECINE ET PHARMACIE
Année 2018THESE
Pour l’obtention du Diplôme d’Etat deDOCTEUR EN PHARMACIE
Présentée et soutenue publiquement Le 9 avril 2018 Henri VOILLOT Né le 22 juin 1987, à BOIS-GUILLAUMERésistance et consommation
des antibiotiques en ville.
JURY
ANNEE UNIVERSITAIRE 2017 - 2018
U.F.R. SANTÉ DE ROUEN
---
DOYEN : Professeur Pierre FREGER ASSESSEURS : Professeur Michel GUERBET Professeur Benoit VEBER Professeur Pascal JOLY Professeur Stéphane MARRET I - MEDECINE PROFESSEURS DES UNIVERSITES – PRATICIENS HOSPITALIERS
Mr Frédéric ANSELME HCN Cardiologie
Mme Gisèle APTER Havre Pédopsychiatrie
Mme Isabelle AUQUIT AUCKBUR HCN Chirurgie plastique
Mr Fabrice BAUER HCN Cardiologie
Mme Soumeya BEKRI HCN Biochimie et biologie moléculaire
Mr Ygal BENHAMOU HCN Médecine interne
Mr Jacques BENICHOU HCN Bio statistiques et informatique médicale
Mr Olivier BOYER UFR Immunologie
Mr Frédéric DI FIORE CB Cancérologie
Mr Fabien DOGUET HCN Chirurgie Cardio Vasculaire
Mr Jean DOUCET SJ Thérapeutique - Médecine interne et gériatrie
Mr Bernard DUBRAY CB Radiothérapie
Mr Philippe DUCROTTE HCN Hépato-gastro-entérologie
Mr Frank DUJARDIN HCN Chirurgie orthopédique - Traumatologique
Mr Fabrice DUPARC HCN Anatomie - Chirurgie orthopédique et traumatologique
Mr Eric DURAND HCN Cardiologie
Mr Bertrand DUREUIL HCN Anesthésiologie et réanimation chirurgicale
Mme Hélène ELTCHANINOFF HCN Cardiologie
Mr Manuel ETIENNE HCN Maladies infectieuses et tropicales
Mr Thierry FREBOURG UFR Génétique
Mr Pierre FREGER HCN Anatomie - Neurochirurgie
Mr Jean François GEHANNO HCN Médecine et santé au travail
Mr Emmanuel GERARDIN HCN Imagerie médicale
Mme Priscille GERARDIN HCN Pédopsychiatrie
M. Guillaume GOURCEROL HCN Physiologie
Mr Dominique GUERROT HCN Néphrologie
Mr Olivier GUILLIN HCN Psychiatrie Adultes
Mr Didier HANNEQUIN HCN Neurologie
Mr Fabrice JARDIN CB Hématologie
Mr Luc-Marie JOLY HCN Médecine d’urgence
Mr Pascal JOLY HCN Dermato – Vénéréologie
Mme Bouchra LAMIA Havre Pneumologie
Mme Annie LAQUERRIERE HCN Anatomie et cytologie pathologiques
Mr Vincent LAUDENBACH HCN Anesthésie et réanimation chirurgicale
Mr Joël LECHEVALLIER HCN Chirurgie infantile
Mr Hervé LEFEBVRE HB Endocrinologie et maladies métaboliques
Mr Thierry LEQUERRE HB Rhumatologie
Mme Anne-Marie LEROI HCN Physiologie
Mr Hervé LEVESQUE HB Médecine interne
Mme Agnès LIARD-ZMUDA HCN Chirurgie Infantile
Mr Pierre Yves LITZLER HCN Chirurgie cardiaque
Mr Bertrand MACE HCN Histologie, embryologie, cytogénétique
Mme Véronique MERLE HCN Epidémiologie
Mr Pierre MICHEL HCN Hépato-gastro-entérologie
M. Benoit MISSET HCN Réanimation Médicale
Mr Jean-François MUIR (surnombre) HB Pneumologie
Mr Marc MURAINE HCN Ophtalmologie
Mr Philippe MUSETTE HCN Dermatologie - Vénéréologie
Mr Christophe PEILLON HCN Chirurgie générale
Mr Christian PFISTER HCN Urologie
Mr Jean-Christophe PLANTIER HCN Bactériologie - Virologie
Mr Didier PLISSONNIER HCN Chirurgie vasculaire
Mr Gaëtan PREVOST HCN Endocrinologie
Mr Jean-Christophe RICHARD (détachement) HCN Réanimation médicale - Médecine d’urgence
Mr Vincent RICHARD UFR Pharmacologie
Mme Nathalie RIVES HCN Biologie du développement et de la reproduction
Mr Horace ROMAN HCN Gynécologie - Obstétrique
Mr Jean-Christophe SABOURIN HCN Anatomie - Pathologie
Mr Guillaume SAVOYE HCN Hépato-gastrologie
Mme Céline SAVOYE–COLLET HCN Imagerie médicale
Mme Pascale SCHNEIDER HCN Pédiatrie
Mr Michel SCOTTE HCN Chirurgie digestive
Mme Fabienne TAMION HCN Thérapeutique
Mr Luc THIBERVILLE HCN Pneumologie
Mr Christian THUILLEZ (surnombre) HB Pharmacologie
Mr Hervé TILLY CB Hématologie et transfusion
M. Gilles TOURNEL HCN Médecine Légale
Mr Olivier TROST HCN Chirurgie Maxillo-Faciale
Mr Jean-Jacques TUECH HCN Chirurgie digestive
Mr Jean-Pierre VANNIER (surnombre) HCN Pédiatrie génétique
Mr Benoît VEBER HCN Anesthésiologie - Réanimation chirurgicale
MAITRES DE CONFERENCES DES UNIVERSITES – PRATICIENS HOSPITALIERS
Mme Noëlle BARBIER-FREBOURG HCN Bactériologie – Virologie
Mme Carole BRASSE LAGNEL HCN Biochimie
Mme Valérie BRIDOUX HUYBRECHTS HCN Chirurgie Vasculaire
Mr Gérard BUCHONNET HCN Hématologie
Mme Mireille CASTANET HCN Pédiatrie
Mme Nathalie CHASTAN HCN Neurophysiologie
Mme Sophie CLAEYSSENS HCN Biochimie et biologie moléculaire
Mr Moïse COEFFIER HCN Nutrition
Mr Serge JACQUOT UFR Immunologie
Mr Joël LADNER HCN Epidémiologie, économie de la santé
Mr Jean-Baptiste LATOUCHE UFR Biologie cellulaire
Mr Thomas MOUREZ HCN Virologie
Mr Gaël NICOLAS HCN Génétique
Mme Muriel QUILLARD HCN Biochimie et biologie moléculaire
Mme Laëtitia ROLLIN HCN Médecine du Travail
Mr Mathieu SALAUN HCN Pneumologie
Mme Pascale SAUGIER-VEBER HCN Génétique
Mme Anne-Claire TOBENAS-DUJARDIN HCN Anatomie
Mr David WALLON HCN Neurologie
PROFESSEUR AGREGE OU CERTIFIE
Mr Thierry WABLE UFR Communication
II - PHARMACIE
PROFESSEURS
Mr Thierry BESSON Chimie Thérapeutique
Mr Roland CAPRON (PU-PH) Biophysique
Mr Jean COSTENTIN (Professeur émérite) Pharmacologie
Mme Isabelle DUBUS Biochimie
Mr Loïc FAVENNEC (PU-PH) Parasitologie
Mr Jean Pierre GOULLE (Professeur émérite) Toxicologie
Mr Michel GUERBET Toxicologie
Mme Isabelle LEROUX - NICOLLET Physiologie
Mme Christelle MONTEIL Toxicologie
Mme Martine PESTEL-CARON (PU-PH) Microbiologie
Mr Rémi VARIN (PU-PH) Pharmacie clinique
Mr Jean-Marie VAUGEOIS Pharmacologie
Mr Philippe VERITE Chimie analytique
MAITRES DE CONFERENCES
Mme Cécile BARBOT Chimie Générale et Minérale
Mr Jérémy BELLIEN (MCU-PH) Pharmacologie
Mr Frédéric BOUNOURE Pharmacie Galénique
Mr Abdeslam CHAGRAOUI Physiologie
Mme Camille CHARBONNIER (LE CLEZIO) Statistiques
Mme Marie-Laure GROULT Botanique
Mr Hervé HUE Biophysique et mathématiques
Mme Laetitia LE GOFF Parasitologie – Immunologie
Mme Hong LU Biologie
M. Jérémie MARTINET (MCU-PH) Immunologie
Mme Marine MALLETER Toxicologie
Mme Sabine MENAGER Chimie organique
Mme Tiphaine ROGEZ-FLORENT Chimie analytique
Mr Mohamed SKIBA Pharmacie galénique
Mme Malika SKIBA Pharmacie galénique
Mme Christine THARASSE Chimie thérapeutique
Mr Frédéric ZIEGLER Biochimie
PROFESSEURS ASSOCIES
Mme Cécile GUERARD-DETUNCQ Pharmacie officinale
Mr Jean-François HOUIVET Pharmacie officinale
PROFESSEUR CERTIFIE
Mme Mathilde GUERIN Anglais
ASSISTANT HOSPITALO-UNIVERSITAIRE
Mme Anaïs SOARES Bactériologie
ATTACHES TEMPORAIRES D’ENSEIGNEMENT ET DE RECHERCHE
Mme Anne-Sophie CHAMPY Pharmacognosie
LISTE DES RESPONSABLES DES DISCIPLINES PHARMACEUTIQUES
Mme Cécile BARBOT Chimie Générale et minérale
Mr Thierry BESSON Chimie thérapeutique
Mr Roland CAPRON Biophysique
Mme Marie-Catherine CONCE-CHEMTOB Législation et économie de la santé
Mme Elisabeth CHOSSON Botanique
Mme Isabelle DUBUS Biochimie
Mr Abdelhakim ELOMRI Pharmacognosie
Mr Loïc FAVENNEC Parasitologie
Mr Michel GUERBET Toxicologie
Mr François ESTOUR Chimie organique
Mme Isabelle LEROUX-NICOLLET Physiologie
Mme Martine PESTEL-CARON Microbiologie
Mr Mohamed SKIBA Pharmacie galénique
Mr Rémi VARIN Pharmacie clinique
M. Jean-Marie VAUGEOIS Pharmacologie
III – MEDECINE GENERALE
PROFESSEUR
Mr Jean-Loup HERMIL (PH-PH) UFR Médecine générale
MAITRE DE CONFERENCE
Mr Matthieu SCHUERS (MCU-PH) UFR Médecine générale
PROFESSEURS ASSOCIES A MI-TEMPS – MEDECINS GENERALISTE
Mr Emmanuel LEFEBVRE UFR Médecine Générale
Mme Elisabeth MAUVIARD UFR Médecine générale
Mr Philippe NGUYEN THANH UFR Médecine générale
Mme Marie Thérèse THUEUX UFR Médecine générale
MAITRE DE CONFERENCES ASSOCIE A MI-TEMPS – MEDECINS GENERALISTES
Mr Pascal BOULET UFR Médecine générale
Mr Emmanuel HAZARD UFR Médecine Générale
Mme Marianne LAINE UFR Médecine Générale
Mme Lucile PELLERIN UFR Médecine générale
ENSEIGNANTS MONO-APPARTENANTS
PROFESSEURS
Mr Serguei FETISSOV (med) Physiologie (ADEN)
Mr Paul MULDER (phar) Sciences du Médicament
Mme Su RUAN (med) Génie Informatique
MAITRES DE CONFERENCES
Mr Sahil ADRIOUCH (med) Biochimie et biologie moléculaire (Unité Inserm 905)
Mme Gaëlle BOUGEARD-DENOYELLE (med) Biochimie et biologie moléculaire (UMR 1079)
Mme Carine CLEREN (med) Neurosciences (Néovasc)
M. Sylvain FRAINEAU (med) Physiologie (Inserm U 1096)
Mme Pascaline GAILDRAT (med) Génétique moléculaire humaine (UMR 1079)
Mr Nicolas GUEROUT (med) Chirurgie Expérimentale
Mme Rachel LETELLIER (med) Physiologie
Mme Christine RONDANINO (med) Physiologie de la reproduction
Mr Antoine OUVRARD-PASCAUD (med) Physiologie (Unité Inserm 1076)
Mr Frédéric PASQUET Sciences du langage, orthophonie
Mme Isabelle TOURNIER (med) Biochimie (UMR 1079)
« L’université de Rouen et l’UFR de Médecine et de Pharmacie de Rouen n’entendent donner aucune approbation ni improbation aux opinions émises dans cette thèse. Ces opinions sont propres à leurs auteurs. »
Remerciements
A Madame Martine PESTEL-CARON, pour m’avoir fait l’honneur de m’accompagner tout au long de ce travail et de présider cette thèse. Soyez assurée de ma profonde reconnaissance.
A Madame Marie-Laure Groult, pour avoir accepté d’être membre du jury de cette thèse. Soyez assurée de ma respectueuse considération.
A Madame Marie-Jeanne LAINE, pour votre bienveillance durant mes études et pour avoir accepté que je puisse réaliser l’étude au sein de votre officine. Soyez assurée de mon affection. A mes parents, pour leur patience (comme quoi tout arrive à temps) et pour leur soutien indéfectible. On n’aurait pas pu rêver mieux comme parents. A ma sœur, Hortense, pour ne m’avoir jamais laissé tomber dès mon plus jeune âge et pour m’avoir guidé vers cette voie.
A mon autre sœur, Joséphine, pour sa motivation et son esprit pragmatique pendant toutes ces année de révisions.
A Aude, ma future femme, qui a su me remobiliser pour terminer enfin ce travail.
Table des matières :
Table des matières : ... 13
Table des figures : ... 16
Table des tableaux : ... 18
Liste des abréviations : ... 19
INTRODUCTION : ... 21
A. Rappels bibliographiques. ... 22
1. Antibiotiques et antibiorésistances. ... 22
1.1. Principales familles d’antibiotiques : . ... 22
1.2. Principaux mécanismes de résistances aux antibiotiques : ... 25
1.2.1. La résistance naturelle : [6] ... 26
1.2.2. La résistance acquise : [7] ... 27
1.3. Les bactéries multirésistantes : [12] ... 33
1.4. Epidémiologie de la résistance bactérienne : ... 36
1.4.1. Epidémiologie de la résistance de Staphylococcus aureus : ... 38
1.4.2. Epidémiologie de la résistance de Streptococcus pneumoniae : 39
1.4.3. Epidémiologie de la résistance d’Eschericia coli : ... 40
1.5. Stratégie de lutte contre la résistance des bactéries face aux
antibiotiques : ... 41
2. Etat des lieux de la consommation d’antibiotique dans le secteur
ambulatoire. ... 51
B. Travail personnel : Analyse de prescriptions d’antibiotiques par voie
orale dans une pharmacie d’officine. ... 71
1. Mise en place de l’étude. ... 71
2. Résultats. ... 73
2.1. Familles d’antibiotiques prescrites pendant l’étude : ... 73
2.1.1. Les pénicillines : ... 74
2.1.2. Les céphalosporines : ... 74
2.1.3. La fosfomycines (sel de trométamol) : ... 75
2.1.4. Les macrolides : ... 75
2.1.5. L’association macrolide et nitro-imidazolé : ... 75
2.1.6. Les streptogramines : ... 76
2.1.7. Les tétracyclines : ... 76
2.1.8. L’acide fusidique : ... 76
2.1.9. Les fluoroquinolones : ... 76
2.1.10. Le cotrimoxazole : ... 77
2.1.11. Les nitro-imidazolés : ... 77
2.2. Consommation d’antibiotiques selon le sexe des patients : ... 78
2.3. Consommation d’antibiotiques selon l’âge des patients : ... 80
2.3.1. De 0 à 2 ans : ... 81
2.3.2. De 3 à 15 ans : ... 82
2.3.3. De 16 à 30 ans : ... 84
2.4.2. Prescription d’antibiotiques en fonction de l’âge et du sexe des
prescripteurs : ... 94
2.5. Familles d’antibiotiques prescrites sur un an à la Nouvelle
Pharmacie de Longpaon: ... 97
3. Discussion . ... 99
C. Rôles du pharmacien d’officine dans la lutte contre la résistance
bactérienne. ... 103
1. Précautions lors de la délivrance d’antibiotiques. ... 104
2. Conseils associés en fonction de l’antibiotique prescrit. ... 105
2.1. Les pénicillines : ... 106
2.2. Les céphalosporines : ... 107
2.3. Les macrolides : ... 108
2.4. Les streptogramines : ... 109
2.5. L’acide fusique : ... 109
2.6. La fosfomycine trométamol : ... 110
2.7. Les tétracyclines : ... 111
2.8. Le cotrimoxazole : ... 112
2.9. Les quinolones : ... 112
2.10. Le métronidazole : ... 113
Conclusion : ... 114
Références bibliographiques : ... 115
Table des figures :
Figure 1 : Mécanismes d'action des familles d'antibiotiques (à gauche) et mécanismes de résistance aux antibiotiques (à droite).[4] ... 23 Figure 2 : Mécanismes de résistance acquise des bactéries aux antibiotiques. (source : Janssen-Cilag) ... 29 Figure 3 : Prévalence mondiale en milieu hospitalier des SARM en 2013. ... 38 Figure 4 : Incidence des pneumocoques de sensibilité diminuée à l'amoxicilline (CMI>0,5mg/L) isolés de batériémies, selon le groupe d'âge, 2001-2015 (sources : données Epibac et CNR des Pneumocoques). ... 39 Figure 5 : Prévalence européenne des E. coli résistantes aux Céphalosporines de 3ème génération. [14] ... 40 Figure 6 : Première campagne sur le bon usage des antibiotiques. ... 42 Figure 7 : Axes stratégiques et mesures du Plan national d'alerte sur les antibiotiques 2011-2016.[32] ... 43 Figure 8 : Campagne de la CNAM de 2010 sur le mésusage des antibiotiques.[34] ... 44 Figure 9 : Projets du programme ND4BB.[39] ... 45 Figure 10 : Stratégie et les cibles bactériennes utilisées pour lutter contre la résistance aux antibiotiques.[50] ... 49 Figure 11 : Consommation d’antibiotiques en 2010 exprimée en DDD (A) et son taux de croissance annuelle entre 2000 et 2010 (B).[52] ... 52 Figure 12 : Consommation par famille d’antibiotiques entre 2000 et 2010 par pays. [52] ... 54 Figure 13 : Pic de consommation d’antibiotiques en fonction du mois (A) et variation de la consommation d’antibiotiques sur 12 mois (B) [52] ... 56Figure 19 : Répartition des prescriptions d'antibiotiques par sexe dans les différentes classes d'âge en 2015.[15] ... 69 Figure 20 : Motif en pourcentage de prescription des antibiotiques en ville en 2016.[15] ... 70 Figure 21 : Familles d'antibiotiques délivrées en nombre de boites en fonction des mois. ... 73 Figure 22 : Prescription des familles d’antibiotiques en fonction du sexe. ... 78 Figure 23 : Proportion homme/femme par rapport aux tranches d'âges. ... 80 Figure 24 : Prescription d'antibiotiques en fonction de la spécialité du prescripteur. ... 93 Figure 25 : Nombre de prescriptions d'antibiotiques en fonction de l'âge et du sexe du prescripteur. ... 94 Figure 26 : Nombre de prescriptions en fonction de l'âge et de la spécialité du prescripteur. ... 96 Figure 27 : Délivrance totale de Juillet 2014 à Juin 2015 des familles d'antibiotiques à la pharmacie en nombre de boites. ... 97
Table des tableaux :
Tableau 1 : Année d'apparition de bactéries résistantes à certains antibiotiques.[19] .... 36 Tableau 2 : Les deux catégories d'antibiotiques critiques établis par l'ANSM en 2015. [51] ... 50 Tableau 3 : Consommation en antibiotique exprimée en nombre de DDJ pour 1000 habitants par jour. Sources: ECDC [15] ... 59 Tableau 4 : Evolution de la consommation des principales classes d’antibiotiques (classification ATC) en Dose Définie Journalière/1 000 habitants/jour des principales classes d’antibiotiques. [15] ... 65 Tableau 5 : Evolution de la consommation des antibiotiques "critiques" 2000-2016 (1) ... 66 Tableau 6 : Evolution de la consommation des antibiotiques "critiques" 2000-2016 (2) ... 67 Tableau 7 : Antibiotiques prescrits chez les enfants de 0 à 2 ans. ... 81 Tableau 8 : Antibiotiques prescrits chez les enfants de 3 à 15 ans. ... 82 Tableau 9 : Antibiotiques prescrits chez les patients de 16 à 30 ans. ... 84 Tableau 10 : Antibiotiques prescrits chez les patients de 31 à 45 ans. ... 86 Tableau 11 : Antibiotiques prescrits chez les patients de 46 à 65 ans. ... 88 Tableau 12 : Antibiotiques prescrits chez les patients de plus de 66 ans. ... 90 Tableau 13 : Place des familles d'antibiotiques prescrites en fonction de l'âge du prescripteur. ... 95 Tableau 14 : Principales contre-indications des familles d'antibiotiques. ... 105Liste des abréviations :
ANSM : Agence Nationale de Sécurité du Médicament et des produits de santé ATB-RAISIN : Antibiotique- Réseau d’Alerte, d’Investigation et de Surveillance des Infections Nosocomiales ARS : Agence Régionale de Santé ATC : Anatomique Thérapeutique Chimique AVK : Anti Vitamine K BHRe : Bactéries Hautement Résistantes aux antibiotiques émergentes BLSE : Bêta-Lactamases à Spectre Elargi BMR : Bactéries Multi-Résistantes aux antibiotiques CDC : Centers for Disease Control and Prevention CMI : Concentration Minimale Inhibitrice CMB : Concentration Minimale Bactéricide CNAM : Caisse Nationale d’Assurance Maladie CRE : Carbapenem-Resistant Enterobacteriaceae C1G : Céphalosporine de 1ère GénérationC2G : Céphalosporine de 2ème Génération C3G : Céphalosporine de 3ème Génération DCI : Dénomination Commune Internationnale DDD : Defined Daily Dose DDJ : Dose Définie Journalière DID : DDD pour 1000 habitants par jour EBLSE : Entérobactéries productrices de Bêta-Lactamases à Spectre Elargi ECDC : European Centre for Disease Prevention and Control EPC : Entérobactéries Productrices de Carbapénèmases ERG : Entérocoques Résistants aux Glycopeptides ESAC : European Surveillance of Antimicrobial Consumption IABC : Inhaled Antibiotics in Bronchiectasis and Cystic fibrosis
OMS : Organisation Mondiale de la Santé OXA : OXanilic Acid
PLP : Protéines Liant la Pénicilline
SARM : Staphylococcus aureus Résistant à la Méticilline
INTRODUCTION :
Depuis leur découverte au début du XXème siècle, les antibiotiques prennent une place prépondérante dans la délivrance de médicaments au sein des officines françaises.
En effet, les enquêtes sur la consommation totale en France des antibiotiques maintiennent que c’est en officine qu’ils sont le plus délivrés.[1] Ce qui fait du pharmacien d’officine un acteur de premier ordre pour pouvoir juger de leur bon usage par le patient, de l’observance du traitement ainsi que des interactions médicamenteuses ou des allergies.
L’augmentation de la consommation d’antibiotiques est une préoccupation mondiale. En effet, des situations d’impasses thérapeutiques sont rapportées devant l’augmentation de bactéries multi-résistantes et l’absence de disponibilité de nouveaux antibiotiques sur le marché. La diminution de la consommation d’antibiotiques devient une des armes clé pour diminuer la pression de sélection sur les bactéries.
Grâce aux campagnes de sensibilisation sur la consommation des antibiotiques (« les antibiotiques c’est pas automatique ») et aux nouveaux tests de diagnostic rapide permettant de différencier les pathologies virales des pathologies bactériennes, a été observée une diminution de 16% de la consommation antibiotique entre 2000 et 2009. Cependant ce n’est pas suffisant car depuis 2009, la consommation est repartie à la hausse.[1]
Dans ce manuscrit, nous ferons le point dans un premier temps sur l’antibiorésistance et l’état des lieux de la consommation des antibiotiques en ville, dans le monde et en France puis nous présenterons notre travail personnel qui a porté sur l’analyse de la prescription d’antibiotiques sur une année au sein d’une officine avant de conclure sur le rôle des pharmaciens d’officine lors de leur délivrance.
A. Rappels bibliographiques.
1. Antibiotiques et antibiorésistances.
1.1.
Principales familles d’antibiotiques :
Le mot antibiotique vient du grec anti qui signifie contre et bios qui signifie la vie. On peut ainsi traduire celui-ci comme contre la vie.[2] Un antibiotique se définit comme étant : « Un composé chimique, élaboré par un micro-organisme ou produit par hémi-synthèse ou par synthèse, dont l’activité thérapeutique se manifeste à très faible dose d’une manière spécifique, par l’inhibition de certains processus vitaux à l’égard des micro-organismes sensibles.» [2]Ainsi, deux types d’antibiotiques peuvent être différenciés en fonction de leur mode de production :
• Les antibiotiques naturels qui sont produits par des bactéries ou des champignons que l’on cultive.
• Les antibiotiques synthétiques (les plus récents) qui sont des analogues ou des dérivés d’antibiotiques naturels.
Ainsi, les antibiotiques pourront être classés selon leur nature chimique.
Cependant la façon de produire un antibiotique n’est pas le seul axe de la classification. En effet, Jacques Berthet dans son dictionnaire de biologie écrit : « Substance ayant la capacité de tuer les bactéries (effet bactéricide) ou d’inhiber leur multiplication (effet bactériostatique) »[3].
Ces notions sont utiles pour soigner en fonction de la gravité de l’infection. Pour les infections sévères, on optera pour la qualité bactéricide de l’antibiotique ; en revanche,
Figure 1 : Mécanismes d'action des familles d'antibiotiques (à gauche) et mécanismes de résistance aux antibiotiques (à droite).[4] Les antibiotiques vont agir sur la bactérie à deux lieux différents, soit sur la paroi bactérienne, soit sur des cibles cytoplasmiques.[4] Une première classe d’antibiotique rassemble ceux dont l’action a pour but d’inhiber la synthèse du peptidoglycane. C’est le cas par exemple des béta-lactamines (pénicillines, céphalosporines, monobactames et carbapénèmes), des glycopeptides et de la fosfomycine. Les bétalactamines vont se fixer aux PLP (Protéines liant la pénicilline) qui sont des enzymes (transpeptidases) de la membrane cytoplasmique impliquées dans la phase terminale de l’assemblage du peptidoglycane. Suite à la liaison aux PLP, il y aura
streptogramines, des tétracyclines, des phénicolés, de l’acide fusidique et des oxazolidinones.(Figure 1) D’autres antibiotiques agiront en inhibant la synthèse des acides nucléiques, comme les quinolones et les rifamycines. Certains antibiotiques subiront une réaction d’oxydo-réduction au sein des bactéries. Le produit endommagera l’ADN de ces bactéries comme les nitro-imidazolés et les nitrofuranes. Les sulfamides seront des inhibiteurs de la synthèse des folates qui sont indispensables à la synthèse des acides nucléiques. Enfin, les polypeptides agiront en inhibant la synthèse ou en désorganisant la membrane de la paroi bactérienne.
1.2.
Principaux mécanismes de résistances aux
antibiotiques :
Il existe un grand nombre de définitions pour l’expression « résistance bactérienne aux antibiotiques», basées sur différents critères (génétiques, biochimiques, microbiologiques et cliniques) et qui ne se recoupent pas forcément. Les définitions les plus fréquemment employées se fondent sur les critères microbiologiques (résistance in vitro) et sur les critères cliniques (résistance in vivo). Selon la définition clinique, une souche est qualifiée de résistante lorsqu’elle survit à la thérapie antibiotique mise en place. En outre, il est important de signaler, qu’in vivo, la capacité de résistance ou de sensibilité de la souche à la thérapie antimicrobienne mise en place sera dépendante de différents paramètres, tels que la localisation de l’infection, la posologie, le mode d’administration de l’antibiotique, et l’état du système immunitaire de l’individu traité.[5]
Sur le plan microbiologique, un micro-organisme est résistant lorsque la CMI est supérieure aux concentrations critiques définies par cet antibiotique, qui sont des concentrations qui tiennent compte des caractéristiques pharmacocinétiques et pharmacodynamiques de l’antibiotique.
En cas de résistance à un antibiotique, il existe une probabilité d’échec thérapeutique quels que soient les traitements et la dose d’antibiotique.
On parle de résistance croisée quand une bactérie est résistante à deux antibiotiques ou plus d’une même famille ou d’un même sous-groupe par le même mécanisme de résistance. Une bactérie multi-résistante est une bactérie qui a accumulé des résistances naturelles et acquises qui ne la rendent sensible qu’à un petit nombre d’antibiotiques. (cf infra).
1.2.1. La résistance naturelle : [6]
La résistance naturelle d’une bactérie aux antibiotiques est liée à des caractéristiques génétiques et phénotypiques constitutionnelles. Cette résistance est stable avec une transmission verticale. Elle est connue et donc on connait les antibiotiques qui seront efficaces ou non. Elle contribue à définir le spectre clinique d’un antibiotique.
Par exemple, les bacilles à Gram négatif sont naturellement résistants aux antibiotiques hydrophobes ou ayant une masse moléculaire élevée comme la pénicilline G car l’antibiotique ne franchit pas la membrane externe de la paroi.
Les mycobactéries sont résistantes aux antibiotiques qui n’ont pas la capacité de traverser leur paroi riche en lipides. Klebsiella spp. produit naturellement une bêta-lactamase qui est une enzyme présente dans l’espace périplasmatique de la bactérie et conduit à la destruction de l’antibiotique (pénicilline A) avant qu’il ne puisse atteindre sa cible bactérienne. Les bactéries anaérobies sont naturellement résistantes aux aminosides car le passage des aminosides à travers la membrane cytoplasmique nécessite un système de transport actif absent chez elles.
1.2.2. La résistance acquise : [7]
Il s’agit d’un caractère qui ne concerne que quelques (ou parfois de nombreuses) souches d’une espèce donnée. Si son support est plasmidique, cette résistante peut être perdue mais elle se propage souvent de façon importante, épidémique. La résistance acquise résulte d’une modification du capital génétique de la bactérie, lui permettant de tolérer une concentration d’antibiotique plus élevée que celle qui inhibe les souches sensibles de la même espèce. La résistance acquise a été observée dès le début de l’antibiothérapie mais sa fréquence était initialement faible. La généralisation de l’utilisation des antibiotiques a conduit à une sélection des souches résistantes. Ce phénomène a atteint une telle ampleur que la seule identification bactérienne ne permet parfois plus de prédire le comportement d’une souche isolée vis-à-vis des antibiotiques, d’où l’intérêt et la nécessité de réaliser des antibiogrammes.
Le potentiel génétique d’une bactérie est constitué d’un chromosome et éventuellement de plasmides. Des gènes sont également portés par des éléments génétiques transposables et par des intégrons. Une bactérie peut ainsi acquérir une résistance aux antibiotiques par deux grands mécanismes génétiques, une modification de son chromosome (résistance chromosomique) ou l’acquisition de plasmides ou d’éléments transposables ou d’intégrons ; ceux-ci définissent une résistance extra-chromosomique.
La résistance chromosomique résulte d’une ou plusieurs mutations. C’est un phénomène rare, dû au hasard. Il n’est pas provoqué par la présence de l’antibiotique mais l’antibiotique révèle la mutation de résistance en sélectionnant les bactéries mutantes résistantes (ou plus exactement, en détruisant les autres bactéries de l’espèce, celles restées sensibles à l’action de l’antibiotique).
Les mutations peuvent avoir pour conséquence la perte ou la modification d’une protéine structurale ou enzymatique. Ainsi, une bactérie mutée disparait en l’absence d’antibiotique.
Deux faits expliquent l'importance de la résistance plasmidique :
• Si la résistance plasmidique est liée à la synthèse de protéines additionnelles et non à une modification des constituants normaux de la bactérie. Les bactéries porteuses de plasmides sont « normales » alors que les bactéries résistantes par mutation sont souvent fragilisées. Aussi, le plasmide peut être perdu en l’absence d’antibiotique. • Si de nombreux plasmides de résistance sont conjugatifs ou mobilisables, ce qui permet un transfert horizontal entre cellules bactériennes.
Ces transferts sont à l’origine d’une dissémination très importante de la résistance au sein des populations bactériennes, ce qui fait qualifier la résistance plasmidique de "contagieuse ou d’infectieuse". Les plasmides de résistance sont susceptibles d’évoluer par acquisition ou pertes successives de déterminants de résistance portés par des éléments génétiques transposables. Les éléments génétiques transposables permettent la dissémination de gènes entre des bactéries phylogéniquement éloignées en permettant l’implantation d’un gène là où celle d’un plasmide échoue.
La résistance chromosomique, comme la résistance extra-chromosomique, ne sont pas induites par l’utilisation des antibiotiques qui se contentent de sélectionner les bactéries
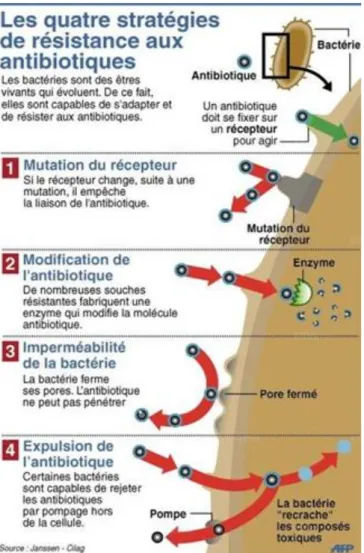
Figure 2 : Mécanismes de résistance acquise des bactéries aux antibiotiques. (source : Janssen-Cilag) Les mécanismes biochimiques de la résistance acquise peuvent être regroupés en quatre grands types: (Figure 2)
• La diminution de la perméabilité : elle repose sur des mutations affectant la structure des porines ou diminuant la synthèse des porines par lesquelles l’antibiotique peut pénétrer dans la bactérie.
• L’efflux actif : il repose sur une pompe insérée dans la membrane qui est capable d'éjecter l'antibiotique hors de la bactérie grâce un canal. Cet efflux conduit à une diminution de la concentration intracellulaire de l'antibiotique.
• La modification de la cible des antibiotiques :
Par exemple, la modification des PLP : les PLP ou "protéines liant les pénicillines" sont des enzymes qui catalysent l’étape finale de la biosynthèse du peptidoglycane (paroi bactérienne) et qui sont la cible des bêta-lactamines. En se fixant aux PLP, les béta-lactamines les empêchent de jouer leur rôle et ainsi la synthèse du peptidoglycane est entravée.
Trois mécanismes peuvent alors intervenir :
§ soit il y a diminution de l’affinité des PLP pour les bêta-lactamines. On retrouve ce type de résistance chez Streptococcus pneumoniae; les béta-lactamines ont du mal à se fixer aux PLP qui restent disponibles pour la synthèse du peptidoglycane.
§ Soit il y a une augmentation de la synthèse des PLP existantes avec hyper-expression de PLP possédant naturellement une faible affinité pour les bêta-lactamines. Ce type de résistance est décrit chez Enterococcus spp où l’augmentation du nombre de PLP disponibles pour la synthèse du peptidoglycane conduit à une impossibilité pour une même dose de béta-lactamines de toutes les bloquer.
§ Soit il y la synthèse d’une ou de plusieurs nouvelles PLP insensibles aux bêta-lactamines. Ce type de résistance explique la résistance à la méticilline de Staphylococcus aureus: l’acquisition et l’intégration dans le chromosome d’un gène (mecA), induit la synthèse d’une nouvelle PLP, la PLP 2a, qui est capable d’assurer à elle seule l’assemblage du peptidoglycane. Elle confère ainsi une résistance à toutes les bêta-lactamines sauf deux molécules nouvellement commercialisées (Ceftaroline et Ceftobiprole).[9]
• Production d'enzymes inactivant les antibiotiques :
C’est le mécanisme de résistance aux bêta-lactamines le plus varié et le plus fréquent. Les bactéries résistent à l’antibiotique par production de bêta-lactamases codées par des plasmides ou des éléments génétiques transposables. Le nombre des bêta-lactamases plasmidiques est très élevé. Elles sont classées selon leur vitesse d’hydrolyse, leurs constantes d’affinité pour les bêta-lactamines, leur faculté à être inhibée par les inhibiteurs tel que l’acide clavulanique, ...[10]
Sur un plan pratique, les bêta-lactamases peuvent être regroupées en 4 catégories : o Les pénicillinases : chez Staphylococcus aureus, elles inactivent la pénicilline G,
les pénicillines A ... Elles sont par contre sans action sur la pénicilline M (oxacilline ou méticilline) ainsi que sur les céphalosporines. Ces pénicillinases sont inductibles et codées par des plasmides ou des transposons.
o Les céphalosporinases : observées chez certaines entérobactéries, elles confèrent une résistance à toutes les pénicillines seules ou en association avec des inhibiteurs ainsi qu’à toutes les C2G. Cette résistance peut s’étendre aux C 3G en cas d’hyperproduction.[11]
o Les bêta-lactamases à spectre étendu (BLSE) : le profil de résistance conféré est étendu aux céphalosporines de 3ème génération et à l’aztréonam.
Les bêta-lactamases à spectre étendu peuvent rester sensibles aux associations avec des inhibiteurs de bêta-lactamase (acide clavulanique, sulbactam, tazobactam). Les bêta-lactamases résistantes aux inhibiteurs dérivent de certaines bêta-lactamases à spectre élargi par mutations ponctuelles.
o Les carbapénèmases : en France, on observe plus fréquemment celles de type OXA. Elles diminuent la sensibilité des bactéries aux carbapénèmes (principalement l’ertapénème).[11]
Les antibiotiques n’induisent pas la résistance mais, grâce à leur pression de sélection, ils permettent l’émergence des souches résistantes qui, au sein d’un biotope, seront favorisées par rapport aux souches sensibles.
Si la résistance a pour origine une mutation, le biotope sera colonisé par une souche, le plus souvent monorésistante et généralement plus fragile que les souches sauvages. Lorsque la pression de sélection diminue, par arrêt d’utilisation de l’antibiotique, la souche mutée disparaitra et le biotope sera à nouveau colonisé par des souches sauvages sensibles. Ceci n’est généralement pas le cas lorsque la résistance est liée à un mécanisme extra-chromosomique.
Plus l’utilisation des antibiotiques est importante (ou anarchique), plus la fréquence d’apparition des bactéries résistantes est grande.
1.3.
Les bactéries multirésistantes : [12]
Il est d’usage de parler de multirésistance face à « une bactérie qui, du fait de l'accumulation de résistances naturelles ou acquises, n'est plus sensible qu’à un petit nombre d'antibiotiques habituellement actifs en thérapeutique » ou face à « une bactérie sensible à moins de 3 familles d'antibiotiques ».
La multirésistance peut donc être acquise, mais aussi naturelle, comme par exemple pour Burkholderia cepacia, ou à un moindre degré pour Acinetobacter spp. Ce terme s’emploie généralement pour une bactérie qui pose en général un problème de ressource thérapeutique. Actuellement on surveille l’épidémiologie de certaines BMR : • Les SARM : Staphylococcus aureus résistants à la méticilline. • Les E-BLSE : Entérobactéries productrices de béta-lactamase à spectre étendu. • Les ABRI : Acinetobacter baumannii résistants à l’imipénème. Le rôle de l’exposition aux antibiotiques dans l’émergence de la multirésistance des bactéries est largement rapporté dans la littérature. Si durant la seconde moitié du vingtième siècle, la découverte et l’utilisation de nombreux antibiotiques ont été à l’origine de quelques uns des plus grands succès de la médecine, aujourd’hui, l’émergence et la diffusion, dans les populations humaines, de bactéries ayant peu à peu acquis des résistances aux antibiotiques, sont devenues des problèmes de santé publique préoccupants. Les antibiotiques administrés à des individus dans un souci de bénéfice individuel ont un impact sur la collectivité par l’activité antibactérienne qu’ils exercent sur les écosystèmes.[13]
Ainsi, l’évolution de la résistance bactérienne acquise aux antibiotiques se concrétise aujourd’hui par des taux élevés de multirésistance de certaines espèces bactériennes qui étaient sensibles "à l’origine", espèces plutôt impliquées dans les infections acquises à l’hôpital comme Staphylococcus aureus mais aussi des espèces bactériennes plutôt
De ce fait, la maîtrise de la résistance bactérienne aux antibiotiques apparaît bien comme un enjeu majeur de santé.
Les deux déterminants de l’émergence et de la diffusion de la résistance bactérienne aux antibiotiques sont l’exposition de la population aux antibiotiques et la transmission inter-individuelle des souches résistantes.
Il convient donc d’agir sur ces 2 aspects : bon usage des antibiotiques et lutter contre les transmissions croisées.
Des efforts majeurs ont été consentis dans ces deux domaines au cours des 10 dernières années. Ils ont été couronnés d’un succès relatif en ce qui concerne certaines bactéries pathogènes multirésistantes comme les Staphylococcus aureus ou les pneumocoques. Ainsi, alors qu’on redoutait de gravir un nouvel échelon de la résistance chez
Staphylococcus aureus en voyant apparaître, après la méticillino-résistance, la résistance
aux aminosides, la résistance aux fluoroquinolones ou une résistance aux glycopeptides, on a vu la tendance s’inverser et le taux de méticillino-résistance des staphylocoques dorés isolés de prélèvements à visée diagnostique en milieu hospitalier est passé de 40 à 25%.[15] Une évolution favorable est aussi observée en ville où la résistance du pneumocoque à la pénicilline et aux macrolides tend à diminuer. Mais pour d’autres espèces ou familles d’antibiotiques, les constats restent très préoccupants.[16]
Aujourd’hui, les phénomènes qui semblent désormais les plus préoccupants concernent les bacilles à Gram négatif : augmentation des résistances chez Pseudomonas
aeruginosa de réanimation, épidémies d’infections à Acinetobacter en milieu hospitalier,
importation de Klebsiella spp productrices de carbapénémases et surtout, émergence sur notre territoire, en milieu communautaire, de multirésistance de type "béta-lactamases à spectre étendu de type CTX-M" chez E coli.[14]
Un groupe de bactéries résistantes est de plus en plus suivi, les bactéries hautement résistantes aux antibiotiques émergentes (les BHRe) qui sont des bactéries commensales du tube digestif et résistantes à de nombreux antibiotiques. Cette résistance est plasmidique et transférable. Deux BHRe sont surveillées :
• Les ERG : Enterococcus faecium résistants aux glycopeptides. Plusieurs épidémies de colonisations digestives à entérocoques résistants aux glycopeptides au sein des établissements de santé français ont été rapportées ces 5 dernières années ; heureusement ces souches sont rarement responsables de réelles infections.[17] • Les EPC : entérobactéries productrices de carbapénémase.
1.4.
Epidémiologie de la résistance bactérienne :
La résistance aux antibiotiques est un phénomène d’évolution constante. En effet, depuis l’introduction des premiers antibiotiques, on est passé d’une révolution dans le traitement des infections bactériennes à une augmentation des résistances aux antibiotiques qui menace le contrôle de ces infections.
En 2013, un rapport du CDC américain estimait à environ 2 000 000 le nombre annuel d’infections à bactéries résistantes et à 23 000 le nombre de décès qui leur seraient directement attribuables.[18]
Nous avons décidé de regarder l’évolution de l’épidémiologie de la résistance de trois espèces bactériennes responsables d’infections en ville :
• Staphylococcus aureus responsable d’infections de la peau et des tissus mous.
• Streptococcus pneumoniae responsable d’infections respiratoires. • Eschericia coli responsable d’infections urinaires.
1.4.1. Epidémiologie de la résistance de Staphylococcus
aureus :
La résistance la plus préoccupante chez S. aureus est la résistance aux béta-lactamines, en particulier la résistance à la méticilline (SARM). A l’échelle mondiale au sein du milieu hospitalier, la proportion de SARM atteint plus de 50% en Amérique du nord, en Amérique du sud et en Asie en 2013. En Chine, en Australie ou en Afrique la proportion varie de 25 à 50%. Au niveau européen, le taux de SARM au Portugal s’élève à 49%, en Grèce à 40%, et à 37% en Italie. En revanche, pour la Suède ou la Finlande, ce taux est inférieur à 5%.(figure 3)[20]
1.4.2. Epidémiologie de la résistance de Streptococcus
pneumoniae :
S. pneumoniae, responsable d’infections respiratoires a présenté un taux
important de résistance aux pénicillines et aux macrolides jusqu’aux années 2000.[23] Des résistances aux fluoroquinolones et aux tétracyclines ont été décrites à cause de mutations du génome bactérien.[24]
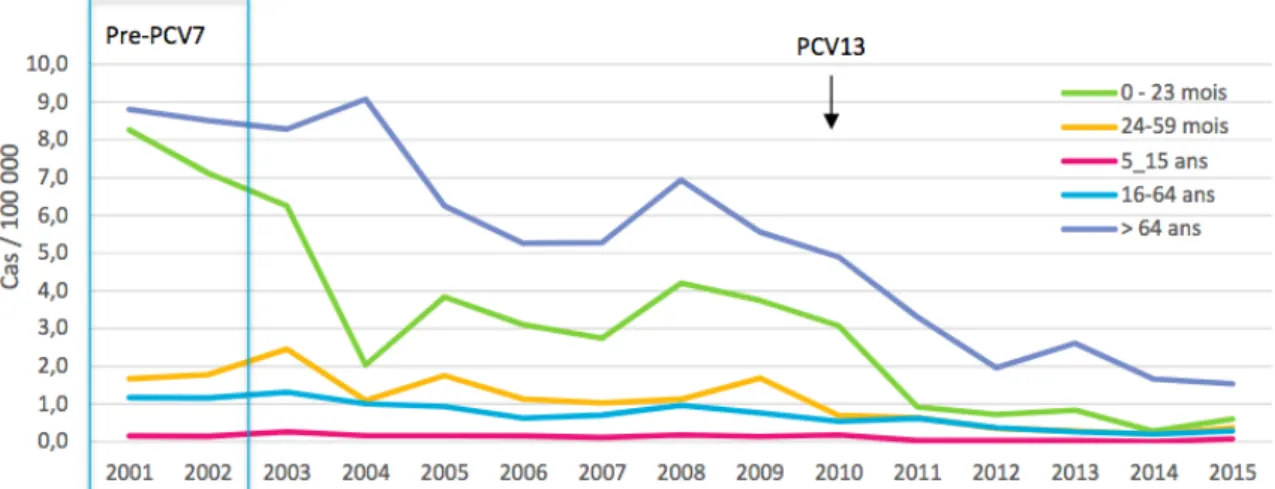
Cependant, en France la proportion de souches de sensibilité diminuée aux Béta-lactamines est passée de 41% en 2005 à 23% en 2015 et la proportion de souches résistantes aux macrolides est passée de 39% en 2005 à 22% en 2015. Cette diminution peut être expliquée par la mise à disposition en 2003 du vaccin conjugué 7 valent (PCV7) et en 2010 du vaccin conjugué 13 valent (PREVENAR 13®) comme le montre la figure 4 [25], en parallèle du plan de lutte contre le mésusage des antibiotiques ( « Les antibiotiques, ce n’est pas automatique »).
Figure 4 : Incidence des pneumocoques de sensibilité diminuée à l'amoxicilline (CMI>0,5mg/L) isolés de batériémies, selon le groupe d'âge, 2001-2015 (sources : données Epibac et CNR des Pneumocoques).
1.4.3. Epidémiologie de la résistance d’Eschericia coli :
E. coli est la principale espèce responsable d’infections urinaires en ville.
Depuis une dizaine d’années, on constate pour cette espèce, une augmentation constante des souches résistantes aux céphalosporines de 3ème génération, avec en parallèle l’émergence de souches d’entérobactéries productrices de bêta-lactamase à spectre élargi (EBLSE).[26] Le portage digestif d’EBLSE varie en fonction des pays, 70% en Asie, 35% dans l’est du bassin méditerranéen ou 15% en Afrique. [27] Ces taux de portage d’E. coli sont liés à une hygiène médiocre et à une consommation trop importante et anarchique d’antibiotiques.[27] De plus, un tourisme en pleine expansion permet une diffusion importante et rapide de ces souches au niveau mondial. En Europe, le taux de portage est de l’ordre de 10% avec une différence entre les pays du nord et du sud de ce continent. [27] En France, en 10 ans, le taux d’E. coli résistant aux C3G est passé de 2% en 2004 à 10% en 2014.[14] (Figure 5)
1.5.
Stratégie de lutte contre la résistance des
bactéries face aux antibiotiques :
En France, depuis les années 2000 nous nous préoccupons de l’impact de l’efficacité des antibiotiques sur les bactéries.[28] Ainsi, il y a eu la mise en place de plans d’action pluriannuels ayant pour but de sensibiliser à la fois les professionnels de santé et les consommateurs sur une utilisation non systématique des antibiotiques.
Le premier plan « antibiotique » fut mis en place de 2001-2005 et s’articule autour de sept axes :[29]
• l’information aux prescripteurs et aux consommateurs pour un usage raisonnable des antibiotiques. • Diffuser des outils pour aider les professionnels de santé. • Améliorer le bon usage des antibiotiques à l’hôpital. • Améliorer les échanges d’information entre la ville et l’hôpital. • Renforcer les actions de formation. • Améliorer la surveillance des consommations et des résistances. • Améliorer la coordination nationale des actions. Ce plan avait pour but de maitriser et de rationnaliser la prescription des antibiotiques et il a inscrit dans les mémoires le fameux slogan « les antibiotiques, c’est pas automatique. »(Figure 6)
Figure 6 : Première campagne sur le bon usage des antibiotiques.
Même si cette campagne a permis de diminuer de 26,5 % les prescriptions d’antibiotiques entre 2001 et 2005, la France reste malgré tout une grande consommatrice en matière d’antibiotiques. [30][15]
C’est pour continuer cet effort qu’un second plan, sur la période 2007-2010, a été élaboré. De nouveaux thèmes y ont été ajoutés comme :[31]
• La qualité des pratiques médicales en matière d’antibiothérapie.
• Des actions en direction du grand public et des professionnels de la petite enfance.
• Etablir un lien entre la politique antibiotique et le risque infectieux. • L’utilisation des antibiotiques dans les établissements de santé.
• Mise en place d’un système d’information spécifique au plan national pour préserver l’efficacité des antibiotiques. Malgré une baisse significative de la consommation des antibiotiques en France sur cette période, le secteur ambulatoire reste un des plus gros prescripteur d’antibiotiques. C’est pour tenter d’enrailler cette dynamique qu’un nouveau Plan national d’alerte sur les antibiotiques 2011-2016 a vu le jour.[32] (figure 7)
Bien qu’il soit dans la continuité des deux précédents, il est placé sous la responsabilité de l’Agence Régionale de Santé afin d’avoir un interlocuteur local. Un nouveau slogan a vu le jour en 2010 « Les antibiotiques, utilisés à tort, ils deviendront moins forts ».[33](figure 8) Figure 8 : Campagne de la CNAM de 2010 sur le mésusage des antibiotiques.[34]
Depuis 2009, il y a une volonté d’échange d’information avec les différents acteurs mondiaux notamment en participant aux échanges dans le cadre de la Transatlantic Task Force on Antimicrobial Resistance, qui est une collaboration entre les Etats Unis et l’Europe pour la prévention de la résistance aux antibiotiques.[35]
2011. Un autre réseau a été mis en place, l’EARS-Net [38], qui lui, collecte des informations sur la résistance de sept principaux agents pathogènes bactériens causant souvent des infections chez l’homme (Enterococcus faecalis, Enterococcus faecium,
Escherichia coli, Klebsiella pneumoniae, Pseudomonas aeruginosa, Staphylococcus aureus, et Streptococcus pneumoniae) dans 30 pays de l’Union Européenne.
Le contrôle de la consommation des antibiotiques ainsi que la surveillance de l’apparition de résistance des bactéries a ses limites, si en parallèle aucune mesure n’est mise en place pour trouver de nouvelles armes. C’est dans cette dynamique qu’un programme européen « New drugs for bad bugs » a été lancé par l’IMI (Innovative Medicines Initiative), en mai 2012, ayant pour objectif le développement de nouveaux antibiotiques. Ce programme s’articule autour de sept projets de recherche. (Figure 9) En mars 2015, une collaboration a été mise en place aux Etats-Unis entre les industries pharmaceutiques et les universités. Figure 9 : Projets du programme ND4BB.[39]
Sont décrits ci-dessous succinctement les différents projets de ce programme :
• Le projet COMBACTE (Combatting Bacterial Resistance in Europe) est une association entre les recherches publiques et privées ayant pour objectif la découverte de nouveaux antibiotiques et la mise en place d’essais cliniques performants.[40]
• TRANSLOCATION est un axe de recherche pour faciliter l’entrée de l’antibiotique au sein de la bactérie afin d’augmenter son efficacité.[41]
• ENABLE (European Gram Negative Antibacterial Engine) est un plan de recherche sur les antibiotiques agissant contre les bactéries Gram négatif telles que Escherichia coli.[42]
• DRIVE-AB, est un partenariat privé/public ayant pour but de mettre en place un système économique afin de stimuler la recherche et le développement de nouveaux antibiotiques.[43]
• COMBACTE-CARE, est un projet qui a pour but de comprendre et de mieux traiter les infections liées aux bactéries GRAM négatif résistantes aux carbapénèmes.[44]
• COMBACTE-MAGNET, est un projet axé sur la prévention et le traitement des infections potentiellement mortelles causées par des bactéries Gram-négatif. Il s’appuie sur un réseau épidémiologique pan-européen (EPI-Net) qui surveille la résistance bactérienne aux antibiotiques et les infections associées aux soins en Europe.[45]
Grace à ces travaux de recherche, ont été ouvertes de nouvelles voies pour lutter contre les bactéries multirésistantes.
Ainsi de nouvelles molécules viennent étoffer l’arsenal antibiotique :
• la Ceftaroline (ZINFORO®), nouvelle céphalosporine active sur les SARM, utilisé dans le traitement des infections compliquées de la peau et des tissus mous (ICPTM) et les pneumonies communautaires. [46]
• la Ceftobiprole (MABELIO®), céphalosporine active sur les SARM, les bactéries à GRAM Négatif et les entérobactéries sauf les BLSE, utilisée pour la prise en charge de pneumopathies. [47]
• L’association Ceftolozane/Tazobactam (ZERBAXA®) active sur les entérobactéries productrices de carbapénèmase et les BLSE, indiquée pour le traitement d’infections intra-abdominales compliquées, les pyélonéphrites aiguës et les infections urinaires compliquées.[48]
• L’association Ceftazidime/Avibactam (ZAVICEFTA®) active sur certaines bactéries Gram négatif (EBLSE). Elle est indiquée pour le traitement des infections intra-abdominales compliquées, des infections urinaires compliquées, des pneumonies nosocomiales ou le traitement des infections dues à des bactéries Gram négatif chez des patients adultes pour lesquels les options thérapeutiques sont limitées.[49]
De nouvelles stratégies apparaissent pour lutter contre la résistance bactérienne comme : (figure 10) [50]
• L’amélioration de la structure des anciens antibiotiques comme par exemple la Ceftaroline qui est une amélioration de la structure du Céfozoprane (ancien antibiotique de la famille des C2G).
• L’association avec des inhibiteurs de bêta-lactamase afin de diminuer la résistance de la bactérie à l’antibiotique, comme c’est le cas pour le ZERBAXA®.
• Le sous citrate de sel de bismuth agit en provoquant une toxicité directe sur la fonction membranaire. Son utilisation est intéressante en association avec des antibiotiques (PYLERA®), comme pour le traitement des infections à H.
pylori.
• L’inhibition du transfert des plasmides pour éviter aux bactéries de se transmettre la résistance aux antibiotiques.
• Les peptides antimicrobiens ont un effet bactéricide soit par insertion dans la membrane des bactéries entrainant une perméabilisation puis la lyse cellulaire, soit en traversant la membrane pour cibler des molécules interférant avec le processus biologique de la bactérie.
• Le contrôle de l’activité du riborégulateur, le but étant de contrôler l’activité des ribosomes impliqués dans la synthèse des protéines de résistance afin de la diminuer.
• L’inhibition de l’ATP synthase mycobactérienne en utilisant une molécule (Bédaquiline) résistante à l’ATP synthase. Une fois fixée à sa cible, elle inhibe ce mécanisme.
Figure 10 : Stratégie et les cibles bactériennes utilisées pour lutter contre la résistance aux antibiotiques.[50] Le chemin pour la découverte de nouveaux antibiotiques est encore long. C’est dans ce contexte que l’ANSM a établi une liste d’antibiotiques critiques. Cette dénomination repose à la fois sur la notion de pression de sélection et sur l’intérêt de l’utilisation des antibiotiques en dernier recours. Il y a deux catégories :[51] (Tableau 2)
• Les antibiotiques particulièrement générateurs de résistances bactériennes.
Sont prises en compte leur action sur les flores commensales ainsi que leur action anti-anaérobie.
Tableau 2 : Les deux catégories d'antibiotiques critiques établis par l'ANSM en 2015. [51]
Cette liste a pour but de préserver les antibiotiques actifs en les utilisant de façon rationnelle et au maximum de leur efficacité. En effet, on constate qu’une surconsommation des antibiotiques provoque bien souvent une baisse de leur efficacité.
La prise de conscience de l’utilisation abusive des antibiotiques est là, de nouveaux projets voient le jour, la recherche avance, mais qu’en est-il réellement de cette consommation à l’échelle mondiale, européenne et française ?
2. Etat des lieux de la consommation
d’antibiotique dans le secteur ambulatoire.
2.1.
Consommation d’antibiotiques au niveau
mondial :
Ce volet a été en partie rédigé grâce aux informations recueillies par l’article Global antibiotic consumption 2000 to 2010: an analysis of national pharmaceutical sales data. [52], qui a recueilli les informations au sein des officines et des hôpitaux dans 71 pays entre 2000 et 2010.Sur cette période, il y a une augmentation de 36% de la consommation en antibiotiques, avec cependant trois familles qui se démarquent, les céphalosporines, les pénicillines à large spectre et les fluoroquinolones.
Dès 2010, la consommation en unité de prise des monobactames a augmenté de 2031%, les glycopeptides de 233%, les céphalosporines de 93% et les fluoroquinolones de 64% ainsi que pour deux familles d’antibiotiques dits de dernier recours les carbapénèmes (45%) et les polymyxines (13%).
Toujours en 2010, les trois des plus gros consommateurs en antibiotiques en unité de prise étaient l’Inde (12,9 ∗ 10! unités soit 10,7 unités par personne), la Chine (10 ∗ 10!
unités soit 7,5 unités par personne) et l’Union Européenne (6,8 ∗ 10! unités soit 22
unités par personne).(Figure 11) [52]
Figure 11 : Consommation d’antibiotiques en 2010 exprimée en DDD (A) et son taux de croissance annuelle entre 2000 et 2010 (B).[52] La Figure 11 A montre que Hong Kong, la Malaisie, Singapour et la Corée du Sud sont parmi les 8 premiers consommateurs d’antibiotiques (en unités par personne).
population qui s’élève à 33%. Il est bon de remarquer qu’en Inde, l’augmentation concerne le volume de vente au détail alors que pour la Chine, cela concerne uniquement le secteur hospitalier.
Cela montre combien il est important d’analyser les chiffres mondiaux avec précaution car les systèmes de délivrance des antibiotiques sont très variables selon les pays (délivrance hors officine fréquente dans de nombreux pays) et les systèmes d’informations ne sont pas très fiables.
Comme nous le montre la figure 12, nous pouvons observer une consommation différente des familles d’antibiotiques en fonction des pays. En effet les glycopeptides, les carbapénèmes ou les monobactames voient leur prescription progresser indépendamment du développement économique des pays comme en Chine, en France, en Allemagne, au Royaume Uni, en Inde et aux Etats Unis. Les céphalosporines et les fluoroquinolones sont plus utilisées en Inde, en Chine et en Allemagne. La délivrance des polymixines est en augmentation partout sauf en Chine, ceci s’explique par l’apparition des entérobactéries résistantes aux Carbapénèmes (CRE)[53] et de bactéries résistantes telles que Acinetobacter baumannii et Pseudomonas aeruginosa.
Figure 12 : Consommation par famille d’antibiotiques entre 2000 et 2010 par pays. [52]
Ainsi, la consommation des glycopeptides, des carbapénèmes, des polymyxines et des monobactames est indépendante des revenus du pays ; a contrario, l’utilisation des céphalosporines et des fluoroquinolones est plus importante dans les pays à revenus
La consommation d’antibiotiques est affectée par les variations de climat. On constate sur la Figure 13 des pics de consommation entre janvier et mars dans l’hémisphère nord et entre juillet et novembre dans l’hémisphère sud. [52]
Cependant, en Inde, le pic se situe entre juillet et septembre, ce qui correspond à la période des moussons. Or depuis 2003, il y a 33 millions de nouveaux cas de dengue chaque année avec une forte transmission en post mousson et 51 à 69% des patients sont pris en charge en milieu hospitalier pour des maladies infectieuses secondaires à la dengue. Les recommandations de traitements sont alors les céphalosporines de troisième génération (C3G) ou les fluoroquinolones. [52]
Il est bon de remarquer que plus un pays est loin de l’équateur, plus sa consommation d’antibiotiques aura une tendance saisonnière.
Les glycopeptides et les carbapénèmes voient leur utilisation augmenter sur cette période du fait d’une fréquence importante de Staphylococcus aureus résistant à la méticilline (SARM) et de bactéries Gram négatif productrices de bétalactamases respectivement.
Enfin, l’utilisation des monobactames s’explique par leur bonne tolérance et leur indication en seconde intention en cas d’échec ou d’allergie d’un traitement avec les pénicillines dans le cadre d’infections sévères à bacilles aérobies Gram négatif.[55]
Figure 13 : Pic de consommation d’antibiotiques en fonction du mois (A) et variation de la consommation d’antibiotiques sur 12 mois (B) [52]
Au total, il faut remarquer qu’au niveau mondial, il existe une grande disparité au niveau des recommandations, des traitements, de la législation pour la publicité, de stratégies marketing ainsi que sur la structure du système de soins (antibiotiques à large spectre vendus sans ordonnance).
Articles
www.thelancet.com/infection Published online July 10, 2014 http://dx.doi.org/10.1016/S1473-3099(14)70780-7 5
con sumption was stable or had moderately decreased in high-income countries between 2000 and 2010 (fi gure 2), with two exceptions: consumption increased substantially in Australia (from 25 in 2000 to 87 units per person in 2010) and New Zealand (from 26 in 2000 to 70 units per person in 2010) and we noted a continuous increase of antibiotic consumption. We observed very diff erent levels of consumption per person in 2010 in other high-income countries with apparently similar rates of economic development (eg, 7·89 units per person in the Netherlands vs 23·13 units per person in France). In 2010, the high-income Asian countries and regions (Hong Kong, Malaysia, Singapore, and South Korea) all ranked within the top eight consumers of antibiotics per person. Antibiotic consumption increased substantially in developing countries, with the highest rates shown in BRICS countries (Brazil, Russia, India, China, and South Africa) and French West Africa. 76% of the overall increase in global antibiotic consumption between 2000
and 2010 was attributable to BRICS countries. Meanwhile, only 33% of the overall increase in global population occurred in BRICS countries between these years. In BRICS countries, 23% of the increase in the retail sales volume was attributable to India and up to 57% of the increase in the hospital sector was attributable to China.
Between 2000 and 2010, consumption of glycopeptides, carbapenems, and monobactams increased in all six selected countries (China, France, Germany, the UK, India, and the USA), irrespective of their income (fi gure 3). By contrast, we show a large increase in cephalosporin and fl uoroquinolone consumption, mainly in middle-income countries (India and China), plus one high-income country (Germany). Consumption of polymixins increased in each country apart from China.
The consumption rates for antibiotics had seasonal patterns in some countries (fi gure 4). In the northern
A
B
Peak month consumption
No data 0·097–0·194 0·194–0·290 0·290–0·388 0·388–0·485 0·485–0·582 0·582–0·679 0·679–0·776 0·776–0·873
Correlation between consumption and 12 month harmonic
January February March April May June July August September October November December
Figure 4: Peak month for antibiotic consumption (A) and correlation between consumption and its 12 month harmonic (B); darker shades show greater
![Figure 1 : Mécanismes d'action des familles d'antibiotiques (à gauche) et mécanismes de résistance aux antibiotiques (à droite).[4]](https://thumb-eu.123doks.com/thumbv2/123doknet/6390641.169105/24.892.109.788.117.630/figure-mécanismes-action-familles-antibiotiques-mécanismes-résistance-antibiotiques.webp)

![Figure 8 : Campagne de la CNAM de 2010 sur le mésusage des antibiotiques.[34]](https://thumb-eu.123doks.com/thumbv2/123doknet/6390641.169105/45.892.219.646.242.663/figure-campagne-la-cnam-sur-mésusage-des-antibiotiques.webp)
![Figure 9 : Projets du programme ND4BB.[39]](https://thumb-eu.123doks.com/thumbv2/123doknet/6390641.169105/46.892.110.717.538.989/figure-projets-du-programme-nd-bb.webp)
![Figure 10 : Stratégie et les cibles bactériennes utilisées pour lutter contre la résistance aux antibiotiques.[50]](https://thumb-eu.123doks.com/thumbv2/123doknet/6390641.169105/50.892.108.810.115.578/figure-stratégie-cibles-bactériennes-utilisées-lutter-résistance-antibiotiques.webp)
![Figure 11 : Consommation d’antibiotiques en 2010 exprimée en DDD (A) et son taux de croissance annuelle entre 2000 et 2010 (B).[52]](https://thumb-eu.123doks.com/thumbv2/123doknet/6390641.169105/53.892.106.791.86.714/figure-consommation-antibiotiques-exprimée-ddd-taux-croissance-annuelle.webp)
![Figure 12 : Consommation par famille d’antibiotiques entre 2000 et 2010 par pays. [52]](https://thumb-eu.123doks.com/thumbv2/123doknet/6390641.169105/55.892.110.782.79.718/figure-consommation-famille-antibiotiques-pays.webp)
![Figure 13 : Pic de consommation d’antibiotiques en fonction du mois (A) et variation de la consommation d’antibiotiques sur 12 mois (B) [52]](https://thumb-eu.123doks.com/thumbv2/123doknet/6390641.169105/57.892.108.770.87.663/figure-pic-consommation-antibiotiques-fonction-variation-consommation-antibiotiques.webp)