FACULTE DE MEDECINE
w
<UL
HÏ-5
SSU
THESE PRESENTEEA L'ECOLE DES GRADUES DE L'UNIVERSITE LAVAL
POUR L'OBTENTION
DU GRADE DE MAITRE ES SCIENCES (M. SC.) PAR
PIERRE SIMARD BACHELIER ES SCIENCES DE L'UNIVERSITE LAVAL
FACTEURS POUVANT INFLUENCER LA SENSIBILITE IN VITRO ET IN VIVO DES HAEMOPHILUS INFLUENZAE
A DIFFERENTS ANTIBIOTIQUES
TABLE DES MATIERES 1
REMERCIEMENTS V
RESUME VI
LISTE DES TABLEAUX X
LISTE DES FIGURES XII
INTRODUCTION , 1
CHAPITRE I: L1HAEMOPHILUS INFLUENZAE 4
1.1 Historique 5
1.2 Bactériologie 8
1.2.1 Identification 8
1.2.2 Sérotypage 9
1.2.3 Biotypage 9
1.3 Sensibilité aux antibiotiques 11
1.3.1 Pénicilline 11 1.3.2 Céphalosporines 11 1.3.3 Autres 12 1.3.4 Phénomène de résistance 13 1.4 Antibiotiques étudiés 14 1.4.1 Erythromycine 14 1.4.2 Tétracyline 14 1.4.3 Moxalactame 14 1.4.4 Chloramphénicol 16
CHAPITRE II: MATERIELS ET METHODES 17
2.1 Techniques in.vitro' 18
Z
2.1.1 Concentration minimale inhibitrice 18 2.1.2 Concentration minimale bactéricide , 18
II
2.1.3 L'effet inoculum 19
2.1.4 Les milieux de culture 20
2.2 Techniques in vivo 23
2.2.1 Modèle expérimental de caillot de fibrine 23
2.2.1.1 Méthodologie 25
2.2.1.2 Expérience in vivo 26
2.2.1.3 Dosage des antibiotiques 27 2.2.1.4 Mesure de l'activité antimicrobienne 27 2.2.2 Mode d'administration des antibiotiques 28
2.2.3 Pharmacologie 30
2.2.4 Liaison aux protéines 30
CHAPITRE III: RESULTATS: ETUDE IN VITRO 32
3.0 L'Effet inoculum 33
3.1 Inoculum size effect on the MIC of cefoperazone, 33 moxalactam, cefotaxime, cefoxitin and cephalothin for
118 strains of Haemophilus influenzae including "Tolerant" micro-organisms. Journal of Antimicrobial Chemotherapy (1982) 10, 397-402.
3.1.1 Introduction 34
3.1.2 Material and methods 35
3.1.3 Results 36
3.1.4 Discussion 38
3.1.5 References 39
3.2 Sensibilité de Haemophilus influenzae 40 3.2.0 Limited in vitro activity of cefamandole againgt 41
100 beta-lactamase and non-beta-lactamase producing Haemophilus influenzae strains: comparison of moxalactam, chloramphenicol and
Chemotherapy (1981) 19, 101-105
3.2.1 Introduction 41
3.2.2 Materials and methods 41
3.2.3 Results 42
3.2.4 Discussion 42
3.2.5 Literature cited 44
3.3 Influence des milieux de cultures et des enrichissements 46 3.3.0 Influence of growth media and added supplement on 47
the growth of H. influenzae and on the antibacte rial activity of several antibiotic.
3.3.1 Abstract 48
3.3.2 Introduction 49
3.3.3 Material and methods 50
3.3.4 Results 52
3.3.5 Discussion 54
3.3.6 Literature cited 59
CHAPITRE IV: RESULTS: ETUDES IN VIVO 80
4.0 Modes d1 administration des antibiotiques 81 4.1 Influence of three modes of administration on the 82
penetration of latamoxef into insterstitial fluid and fibrin clots and its in-vivo activity against Haemophilus influenzae.
4.1.1 Introduction 82
4.1.2 Material and methods 83
4.1.3 Results 85
IV
4.1.5 References 89
4.2 Efficacité in vivo de 11 érythromycine et de la 92 tétracycline 4.2.1 Introduction 93 4.2.2 Matériels et méthodes 93 4.2.3 Résultats 95 4.2.4 Discussion 97 CONCLUSION J 06 BIBLIOGRAPHIE 109
REMERCIEMENTS
Avant tout, je me dois de souligner de façon particulière le rôle primordial que certaines personnes ont tenu pour que je réalise ce travail.
Je voudrais d'abord remercier le Docteur Michel G. Bergeron qui a su m'accueillir dans son laboratoire. Par son exemple et sa détermination, il a su m'inculquer une bonne méthode de travail et une discipline qui sont maintenant miennes.
Je tiens également à remercier le Docteur Robert Letarte pour sa grande disponibilité, son soutien et ses conseils judicieux.
Je voudrais souligner la grande collaboration des membres du personnel du
laboratoire d'infectiologie, du laboratoire de Microbiologie du CHUL et de ceux du laboratoire de Microbiologie de la Faculté de Médecine qui, par leur aide souvent inaperçue, ont grandement contribué à mon développement.
VI
RESUME
Identifié depuis près d'un siècle, 11 Haemophilus influenzae est encore
aujourd'hui responsable d'infections sévères. Nécessitant deux facteurs (X et V) pour sa croissance, ce microorganisme est peut sensible à 1'activité de la
majorité des pénicillines, sauf l'ampicilline et l'amoxicilline. Nos études in vitro ont démontré que les concentrations minimales inhibitriçes des
céphalosporines étaient peu affectées par une augmentation du nombre de microor ganismes mais également que le céfamandole s'avérait inefficace contre certaines souches. Notre travail sur différents milieux de culture nous a fait constater que certains enrichissements affectaient la croissance des Haemophilus influenzae et la CMI de divers antibiotiques. Les étude in vivo de quelques agents
antibactériens nous ont permis d'analyser, grâce au modèle expérimental du caillot de fibrine, 1'influence de différents modes d'administration et ont démontré 1'excellente activité du moxalactam contre ce microorganisme.
Isolé depuis bientôt un siècle, 1'Haemophilus influenzae est toujours actuelle ment la cause de plusieurs infections sévères, telles otite, méningite et pneumonie. Des souches résistantes à l'ampicilline productrices de bêta- lactamase sont apparues en 1974. Depuis, nous sommes à la recherche d'alterna tives qui pourraient remplacer les thérapies actuelles qui impliquent souvent 1'utilisation de médicaments toxiques tels le chloramphénicol.
L'Haemophilus influenzae est un microorganisme Gram-négatif qui nécessite pour sa croissance deux principaux facteurs : X et V. Ces bactéries sont typées, selon les constituants chimiques du lipopolysaccharide formant leur capsule en six (6) sérotypes. De plus il existe six (6) biotypes caractérisés par des réactions biochimiques particulières.
Peu sensible à l'activité de la majorité des pénicillines, sauf l'ampicilline et 1'amoxicilline, 1'Haemophilus influenzae semble cependant inhibé par certaines céphalosporines telles céfamandole, céfuroxime, céfotaxime et moxalactame. Ce microorganisme est également sensible au chloramphénicol, au rifampin, à 1'érythromycine, à la rosaramicine et à la combinaison triméthoprim-sulfaméthoxazole.
L'étude in vitro traitant de 1'influence de 1'inoculum sur les concentrations minimales inhibitrices de diverses céphalosporines a révélé que celles-ci étaient peu affectées par une augmentation de 1'inoculum des souches
d'Haemophilus influenzae non-productrices de bêta-lactamases. Nous avons également décelé ici les souches tolérantes à certaines céphalosporines, la
VÏIJ tolérance étant un concept nouveau chez 1'Haemophilus influenzae.
L'étude comparée du céfamandole, du moxalactame, du chloramphénicol et de l'ampicilline a fait ressortir certaines lacunes in vitro du céfamandole contre quelques souches d'Haemophilus influenzae, productrices ou non de bêta-lactamases. L'étude portant sur les différents milieux de culture de ce microorganisme a démontré le faible rendement des enrichissements 10% Fildes et 2% sang de mouton pour la croissance des Haemophilus influenzae. Nous
avons de plus constaté que les concentrations minimales inhibitrices de certains antibiotiques étaient affectés soit par le milieu de base utilisé, soit par 11 enrichissement employé. Ainsi, les CMI des antibiotiques étaient plus élevées lors de 1'utilisation de 5% Fildes et plus faibles avec 1% de supplément B. Les études in vivo ont été effectuées à l'aide du modèle expé rimental du caillot de fibrine. Celui-ci nous permet d'étudier l'action des antibiotiques diffusant passivement dans les tissus sur les Haemophilus influenzae infectant le caillot de fibrine synthétique placé sous la peau d'un animal. Grâce à ce modèle nous avons évalué 1'efficacité de trois différents modes d1 administration des antibiotiques : le bolus, 1'infusion continue et les injections intermittentes. /
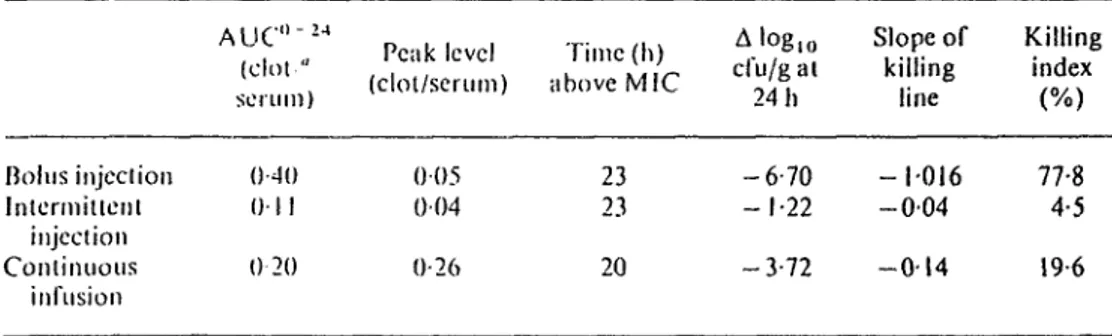
Le moxalactame, une céphalosporines de 3ième génération, fut étudié selon ces trois modes d'administration. Le bolus utilisé s'est avéré le plus effi cace régime pour 1'inhibition des microorganismes présents dans le caillot de fibrine.
L'infusion continue s'est également avérée un mode d'administration efficace mais moins rapidement que le bolus.
Ce modèle expérimental nous a de plus permis d'évaluer in vivo l'efficacité de 1'érythromycine et de la tétracycline vis-à-vis des Haemophilus influenzae. L'injection de ces antibiotiques s'est faite par^un simple bolusj Aucun de ces deux agents antibactériens n'a pu éliminer les microorganismes présents dans le caillot de fibrine infecté. La tétracycline s'est cependant avérée plus efficace que 1'érythromycine, les Haemophilus influenzae subissant une diminution importante de leur nombre.
X
LISTE DES TABLEAUX
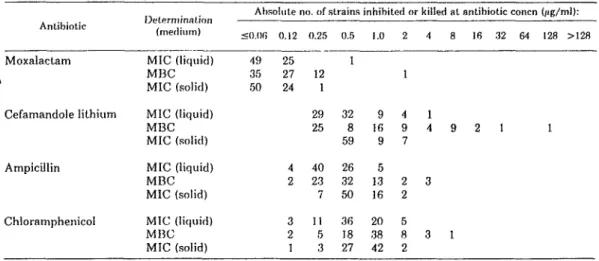
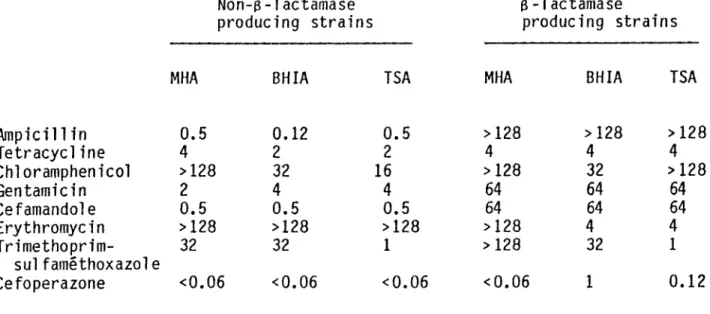
3.1.1: MIC's in solid media of five antibiotics against 87 non-B-lactamase producing strains of Haemophilus influenzae.
3.1.2: MIC 's in solid media of five antibotics against 31 Beta-lactamase- producing strains of Haemophilus influenzae.
3.1.3: MIC and MBC of cephalosporins in Mueller Hinton broth and brain heart infusion broth against four tolerant strains of Haemophilus influenzae. 3.2.1: MIC's in liquid and solid media and MBC's of four antibiotics against
75 non-beta-lactamase-producing strains of Haemophilus influenzae. 3.2.2: Sources and biotypes of 11 ampicillin susceptible strains of
Haemophilus influenzae relatively resistant to the bacterial activity of cefamandole.
3.2.3: MIC 's in liquid and solid media and MBC's of four antibiotics against 25 beta-lactamase-producing strains of Haemophilus influenzae.
3.2.4: Sources and biotypes of 25 ampicillin resistant strains of Haemophilus influenzae of wich 20 were resistant to the bactericidal activity of cefamandole.
3.3.1 Liquid media for the growth of Haemophilus influenzae. 3.3.2: Solid media for the growth of Haemophilus influenzae.
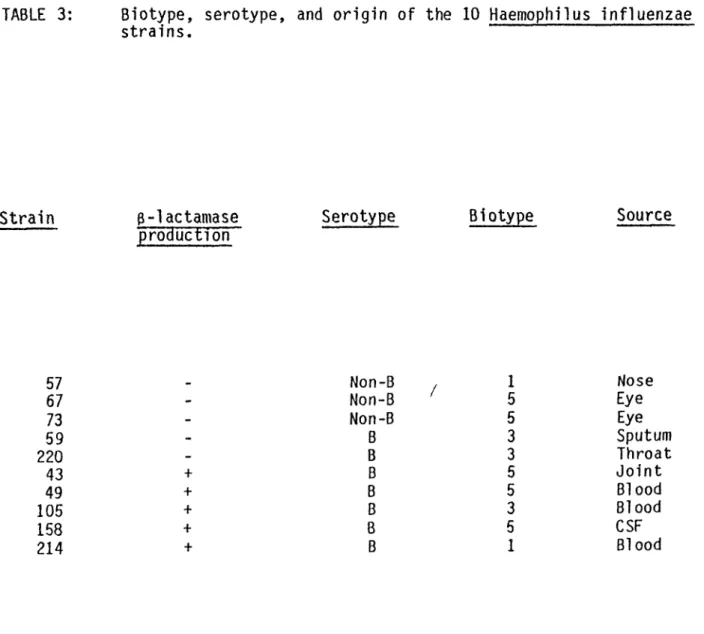
3.3.3: Biotype, serotype and origin of the 10 Haemophilus influenzae. 3.3.4: Influence of different media on the growth (log No CFU/ml) of 10
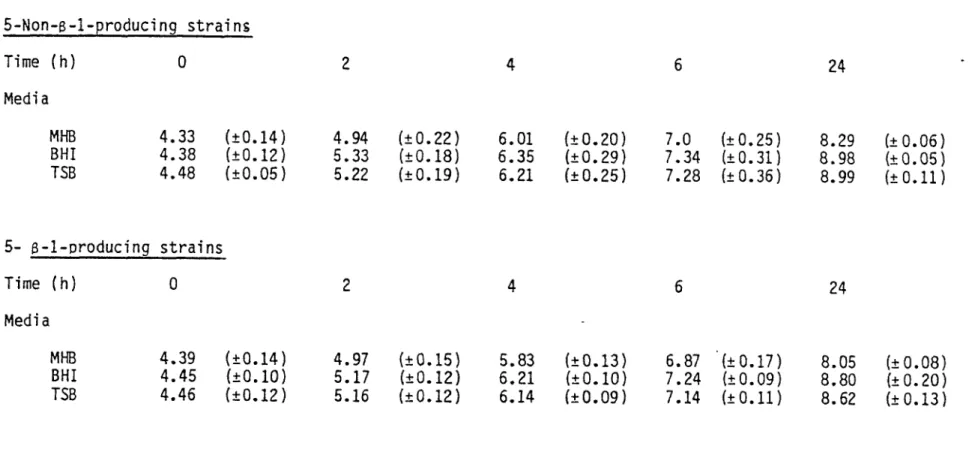
Haemophilus influenzae over a period of 24 hours.
3.3.5: Influence of several enrichment factors added to MHB on the growth (log No CFU/ml) of 5 non-Beta-lactamase-producing strains of
Haemophilus influenzae over a period of 24 hours.
3.3.6: Influence of several enrichment factors added to MHB on the growth (log No CFU/ml) of 5 Beta-lactamase-producing strains of Haemophilus influenzae over a period of 24 hours.
3.3.7: Influence of different media enriched with 5% Fildes on the MIC (pg/ml) of eight antibiotics against Haemophilus influenzae strains. 3.3.8: Influence of different enrichments on the MIC (pg/ml) of,eight anti
biotics against non-Beta-lactamase-producing strains of Haemophilus influenzae.
3.3.9: Influence of different enrichments on the MIC (ug/ml) of eight anti biotics against Beta-lactamase-producing strains of Haemophilus influenzae.
4.1.1: Parameters for the evaluation of penetration and efficacy of moxalac- tam in fibrin clots infected with Haemophilus influenzae.
4.2.1: Tétracycline 4.2.2: Erythromycine.
4.2.3: Pourcentage de pénétration des antibiotiques dans le liquide intersti tiel et dans le caillot.
4.2.4: Courbe de croisance in vivo.
4.2.5: Aire sous la courbe dans le sérum (pg/ml/h/) le liquide interstitiel (pg/ml/h) et le caillot (pg/g/h).
XII
LISTE DES FIGURES
4.1.1: Concentration of moxalactam in serum from 151 to 24 h following a single 100 mg/kg BOLUS of moxalactam, 4 INTERMITTENT injections of 25 mg/kg given every 6 h for 24 h, and a CONTINUOUS infusion of 100 mg/kg 24 h. Mean of 4 to 6 rabbits.
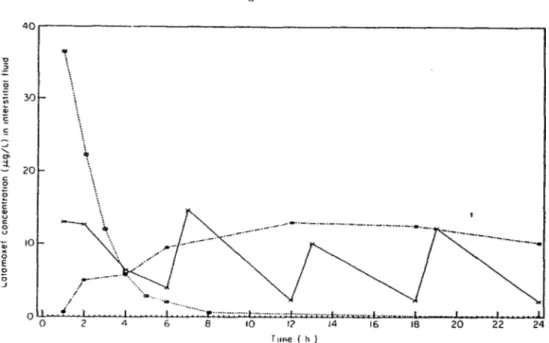
4.1.2: Concentration of moxalactam in interstitial fluid from 3Ô1 to 24 h following a single 100 mg/kg BOLUS of moxalactam, 4 INTERMITTENT injections of 25 mg/kg given every 6 h for 24 h, and a CONTINUOUS infusion of 100 mg/kg infused over 24 h. Mean of 4 to 6 rabbits.
4.1.3 Concentration of- moxalactam in fibrin clotsifrom 1 h to 24 h following a single 100 mg/kg BOLUS of moxalactam, 4 INTERMITTENT injections of 25 mg/kg given every 6 h for 24 h, and a CONTINUOUS infusion of 100 mg/kg infused over 24 h. Mean of 4 to 6 rabbits.
4.1.4: Log no of colony forming units of Haemophilus influenzae in infected fibrin clots from 0 h to 24 h following a single 100 mg/kg BOLUS of moxalactam, 4 INTERMITTENT injections of/25 mg/kg given every 6 h for
24 h, and a CONTINUOUS infusion of 100 mg/kg infused over. 24 hours. Mean of 4 to 6 rabbits.
2
INTRODUCTION
Depuis plusieurs années, des souches bactériennes d'Haemophilus influenzae sont rencontrées en pathologie humaine. Responsable de plusieurs infections telles otite, méningite et pneumonie, ce microorganisme a développé des résistances et la thérapeutique est difficile (19). En 1942, la pénicilline fut le premier antibiotique utilisé dans le traitement des infections à Haemophilus influenzae
(2). Une décennie plus tard, le chloramphenicol s'avéra un médicament des plus efficaces mais toxique (66, 81). En 1966, 1'ampicilline, un antibiotique peu toxique fit son apparition (102). Ce médicament, qui pénétrait facilement le liquide céphalo-rachidien, pouvait éliminer les Haemophilus influenzae
responsables d'infections mineures ou même très sévères telles les méningites.
Les premières souches d'Haemophilus influenzae , résistantes à l'ampicilline furent isolées en 1974,(84, 160). Il fallait ainsi ré-évaluer tout le trai tement des infections causées par ces bactéries. Ces microorganismes résistants à l'ampicilline produisent un enzyme de type bêta-lactamase qui inhibe l'effet de l'antibiotique. Il devient alors important de différencier les souches d'Haemophilus influenzae, productrices de bêta-lactamase de celles non productrices et d'étudier l'efficacité d'autres antibiotiques contre ces pathogènes résistants,.
La littérature en ce sens est abondante. Les tests in vitro sont cependant difficiles à interpréter puisqu'il n'existe auéune standardisation des tests de sensibilité vis-à-vis les Haemophilus influenzae (19). Plusieurs facteurs peuvent influencer les résultats de ces tests. Par exemple, certains enrichissements nécessaires pour la croissance de ce microorganisme peuvent
modifier l'activité in vitro des antibiotiques. L1 inoculum est également un facteur qui rend difficile 11 interprétation des concentrations minimales inhibitrices. Nous avons donc tenté, dans ce travail, d'évaluer 1'importance de 11 inoculum et de déterminer l'influence des différents milieux de culture utilisés sur la croissance des microorganismes et sur leur sensibilité aux antibiotiques.
Nous avons de plus vérifié les caractéristiques pharmacologiques de certains antibiotiques in vivo et analysé leur activité contre 1'Haemophilus influenzae. Pour ce faire, nous avons utilisé le modèle expérimental du caillot de fibrine. Par le fait même, nous avons étudié 1'influencp de différents modes d'adminis tration des antibiotiques sur la pénétration de ces derniers dans la fibrine et sur leur efficacité vis à vis une souche d'Haemophilus influenzae résistante à l'ampicilline.
Cette thèse se veut d'un caractère particuliér. Elle est composée d'abord d'une revue de la littérature sur 1‘Haemophilus influenzae et d'une description des matériels et méthodes utilisés in vitro et in vivo. Les études in vitro se présentent grâce à deux articles publiés dans des revues scientifiques et à un autre article soumis pour approbation. Les études in vivo regroupent un article publié dans un journal spécialisé et un résumé des résultats obtenus non publiés. Pour faciliter la lecture de la thèse, les articles publiés ou soumis ont été directement intégrés a la thèse, même s'ils sont écrits en anglais.
CHAPITRE I
1.1 HISTORIQUE
Entre 1889 et 1892, Richard Pfeiffer isolat pendant une pandémie de grippe un bacille qu'il considéra à tort l'agent étiologique de 1'influenzaei (127). Quelques années plus tard, entre 1918 et 1920, Levinthal et Fildes développèrent de nouveaux milieux de culture à base de sang digéré, ce qui permit d'identifier plus facilement 1'Haemophilus influenzae (55, 94).
Dès 1921, Thjotta et Avery découvrirent que la croissance de 1'Haemophilus influenzae dépendait de deux facteurs qu'il nommèrent X et V (155). Un an plus tard, Rivers le différenciait de 1'Haemophilus parainfluenzae (134). Margaret Pittman démontra en 1931 la différence immunologique entre les souches capsulées découvrant ainsi 6 sérotpypes (126). Il devint alors évident que 1'Haemophilus influenzae était une cause importante de méningite bactérienne chez l'enfant ainsi que de plusieurs autres maladies.
En 1943, Alexander et Leidy démontrèrent que les pénicillines étaient efficaces dans le traitement des infections à Haemophilus influenzae de type B (2, 61). Quelques années plus tard, en 1952, GrOnos (66)
utilisant comme antibiotique le chloramphenicol, parvint à traiter
efficacement les infections à Haemophilus influenzae. A la même époque, Wilson alerta le milieu médical de la toxicité relative du chloramphenicol qui pouvait même s'avérer fatal pour certains patients (181).
Un an plus tard, 1'érythromycine apparut. Love et Finland, tout en étudiant onze antibiotiques différents, démontrèrent que 1'érythromycine
6
était efficace contre les Haemophilus influenzae (97).
Vers i960, la tétracycline démontrait une certaine activité in vitro mais demeurait cependant inefficace en clinique. En 1966, l'ampicilline devenait l'antibiotique de choix pour le traitement de ce genre d'infection
(102). Ne démontrant aucun problème de toxicité, cet antibiotique pénétrait facilement le liquide céphalo-rachidien.
En 1974, les premières souches bactériennes d'Haemophilus influenzae résistantes à l'ampicilline apparurent (3, 84, 518, 160). Le
traitement des infections à ces microorganismes producteurs de beta- lactamase devenait donc inefficace (169). Il fallait trouver une alternative à ce traitement. L'association de chloramphénicol et
d'ampicilline devait s'avérer bénéfique. Cependant, l'utilisation d'une combinaison d'antibiotiques possiblement antagonistes et du chloramphénicol potentiellement toxique inquiétait toujours les cliniciens qui utilisaient cette combinaison (1, 15). Par la suite, de nouvelles céphalosporines apparurent. Cependant, ces dernières, telle le céfamandole, pénètrent difficilement le liquide céphalo-rachidien et des faillites de traitement furent enregistrées (38, 104, 148).
En 1978, certaines infections furent causées par des Haemophilus influenzae résistants à l'ampiciline qui ne produisaient pas d'enzyme de type bêta- lactamase (99). la seule détection de la présence de l'enzyme ne
Il faut attendre au début des années 1980 pour découvrir des médicaments tels les céphalosporines de 3e génération qui pénètrent dans le liquide céphalo-rachidien et ainsi avoir des alternatives au traitement classique. Ces antibiotiques, tels moxalactam, céfotaxime et céfopérazone, sont très efficaces contre les Haemophilus influenzae sensibles ou résistants à l'ampicilline. (7, 10, 13, 21, 34, 39, 41, 49, 52, 69, 70, 79, 92, 101, 111, 112, 121, 142, 185).
De nos jours, 11Haemophilus influenzae, spécialement celui de type B, est souvent responsable d'infections sévères comme la méningite, l'épiglottite, l'arthrite, la pneumonie et 1'ostéomyélite. (19, 37). Les autres types antigéniques induisent particulièrement des sinusites et des otites. La plupart de ces infections surviennent en général chez les enfants âgés de 6 à 36 mois mais 1'Haemophilus influenzae peut infecter les patients de tout âge (73, 152, 174) car la présence d'anticorps opsonisant dirigés contre la capsule de la bactérie n'induit aucune protection valable.
8
1.2 BACTERIOLOGIE
1.2.1 IDENTIFICATION
L'Haemophilus influenzae est un microorganisme pléomorphique Gram-négatif. Son métabolisme respiratoire est aérobie ou anaérobie facultatif. Sa température optimale de croissance est de 37° C mais il peut se développer entre 25° C et 43° C. Tl transforme les nitrates en nitrates et donne une réaction positive pour le test de catalase. De plus, il n'est ni mobile, ni hémolytique.
Sa croissance nécessite la présence de deux facteurs de croissance: X et V. Le facteur X est une substance complexe retrouvée chez plusieurs pigments qui fournissent les composés tétrapyrroles nécessaires pour la synthèse des enzymes respiratoires suivants: cytochrome, oxydase, catalase et peroxydase. La nécessité du facteur X pour la croissance de 1'Haemophilus influenzae provient de son incapacité à former une protoporphyrine à partir de l'acide -aminolevulinique. Ce facteur diffuse des globules rouges et est disponible dans les milieux où du sang est ajouté.
Le facteur V, identifié comme étant de la nicotinamide dinucléotide (NAD), est produit par certaines bactéries, notamment les staphylocoques, et par certains champignons. Lorsque ces organismes se retrouvent dans une gélose au sang, ils fournissent assez de NAD pour permettre la croissance de
1'Haemophilus influenzae, ce qui se caractérise par la croissance dite "satellite" de 1'Haemophilus autour des colonies de Staphylcoccus aureus. (
98
).Il faut noter que depuis l'utilisation dans les différents laboratoires de la gélose chocolatée contenant les deux facteurs de croissance, la fréquence d'isolement des Haemophilus influenzae au augmenté.
1.2.2 SEROTYPAGE
Certaines souches d'Haemophilus influenzae peuvent former ,une capsule et contiennent alors une substance hydrosoluble analogue au polyoside
capsulaire de Streptococcus pneumoniae. Les antisérums de lapins préparés avec ces bactéries précipitent la substance capsulaire et nous permettent de distinguer 6 types antigéniques : a, b, c, d, e et f.
Le typage des souches bactériennes peut se faire selon différentes
techniques : agglutination, fluorescence et immunoélectrophorèse. Seules les souches encapsulées peuvent être ainsi groupées. Les souches non capsulées sont dites non typables.
Selon le type, les constituants chimique du lipopolysaccharide varient. La différentiation se fait particulièrement sur les constituants suivants: hydrate de carbone total, heptose et 2 - céto - 3 - désoxyoctonate.
1.2.3 BIOTYPAGE
En 1976, Kilian subdivisa les Haemophilus influenzae en 6 biotypes, Chaque souche d'un biotype donné produisait des réactions biochimiques caractéristiques (86).
10
Ainsi, le biotype I se caractérise par une réaction positive aux tests suivants : indole, uréase et ornithine décarboxylase. Les biotypes II et III donnent des réactions négatives au test de 1'ornithine
décarboxylase; le test de 1'uréase est négatif pour le biotype V et le test de 1'indole est négatif pour les biotypes III et IV. (86, 120).
Le biotype VI, quant à lui, n'est positif que pour le test de lysine
décarboxylase. ^
Il faut noter que les biotypes III et V ne contiennent pas de souches capsulées et demeurent non typables par des antisérums.
1.3 SENSIBILITE AUX ANTIBIOTIQUES 1.3.1 PENICILLINE
Les pénicillines offrent peu d1 intérêt dans le traitement des infections à Haemophilus influenzae puisqu'elles n'ont que peu d'activité intrisèque contre ce microorganisme qui produit ou non une bêta-lactamase.
En effet, la carbénici11ine, la cloxacilline, la cyclacilline, l'épicilline, la méthicilline, la pénicilline G, la pipéracilline et la ticarcilline
demeurent peu efficaces contre les Haemophilus influenzae (7, 19, 47, 160, 172, 176, 188) Les CHI de ces différentes pénicillines varient de 0,25 p g/ml à 50 p g/ml pour les souches non productrices de B- lactamases et de 1 p g/ml à 128 p g/ml pour les souches résistantes à l'ampicilline.
Parmi toutes les pénicillines, seules l'amoxicilline et l'ampicilline s'avèrent efficaces contre les souches non-productrices de bêta-lactamase, les CMI variant de 0.01 p g/ml a 2.0 p g/ml. Pour les microorganismes producteurs de bêta-lactamases, les CMI varient de 2 p g/ml a 128 p g/ml.
1.3.2 CEPHALOSPORINES
Certaines céphalosporines, telles que la céphaloridine, la céphacétrile, la céphalexine, la céphradine, la céfazoline et la céfatrizine s'avèrent peu efficaces in vitro vis-à-vis les Haemophilus influenzae producteurs de bêta-lactamase ou non. Les CMI variant de 0.2 p g/ml à 128 p g/ml
12
Cependant, le céfamandole, la céfuroxime, la cefotaxime et le moxalactam démontrent une bonne activité antibactérienne in vitro (19, 41, 70, 77, 101, 184), les CMI pouvant atteindre des niveaux aussi bas que 0.015 p g/ml.
Il est important de noter que les CMI des céphalosporines contre 1'Haemophilus influenzae peuvent être influencées par 1'inoculum. Ainsi, une variation de 10^ bactéries par millilitre à 10^ peut affecter de façon significative les CMI. (19, 153). Ce phénomène semble plus prononcé chez les souches d'Haemophilus influenzae produc trices de bêta-lactamases.
1.3.3 AUTRES
Parmi les autres familles d1 antibiotiques, le rifampin, 1'érythromycine, la rosaramicine et la combinaison triméthcfcrim-sulfaméthoxazole présentent des concentrations minimales inhibitrices peu élevées contre 1'Haemophilus influenzaev (19, 35, 47, 82, 125, 144, 145).
Les aminosides ont des CMI faibles mais ces antibiotiques présentent des problèmes d'oto- et néphro-toxicité et pénètrent difficilement le liquide céphalo-rachidien (47). La tétracycline semble également démontrer une bonne efficacité contre les Haemophilus influenzae. Cependant, 11 émer gence de souches résistantes et les effets secondaires chez l'enfant rendent son utilisation problématique (37, 73, 176).
(54, 66, 101, 130) mais son utilisation est parfois associée aux dépressions hématopoîtétiques (181). Certaines souches d'Haemophilus influenzae sont maintenant résistantes (28, 32, 168) et d'autres alternatives de traitement doivent être envisagées.
1.3.4 PHENOMENE DE RESISTANCE
La majorité des souches d'Haemophilus influenzae sont sensibles aux pénicillines: pénicilline G., ampicilline, amoxicilline, carbénicilline et ticarcilline. L'ampicilline demeure 1'antibiotique de choix pour le traitement des infections à Haemophilus influenzae. Depuis 1974, des souches résistantes à l'ampicilline ont été rapportées dans plusieurs échantillons. (3, 84, 158, 160). Le mécanisme de cette résistance est une production de bêta-lactamase par 1'intermédiaire d'un plasrnide, enzyme qui brise 1'anneau bêta-lactame de la molécule de pénicilline. Les pénicillines semi-synthétiques résistantes aux bêta-lactamases (telles nafcilline, cloxaoillihe, oxacilline, méthicilline) demeurent peu efficaces contre 1'Haemophilus influenzae.
Certains chercheurs on déjà’ noté la présence de souches d'Haemophilus influenzae non-productrices de bêta-lactamase, et pourtant résistantes à l'ampicilline (99). Le mécanisme de cette résistance n'est pas le transfert d'un plasrnide mais 1'hypothèse retenue explique ce phénomène par une modification de la membrane cellulaire, affectant ainsi la per méabilité et l'efficacité de l'ampicilline.
Certains antibiotiques démontrent une efficacité contre les souches résistantes à l'ampicilline. Il en est ainsi pour le chloramphénicol
qui se veut une alternative intéressante à l'ampicilline. Cependant, certaines souches d'Haemophilus influenzae sont résistantes au
chloramphenicol.
Cette résistance est acquise par un plasmide extrachromosomique échangé d'une cellule à une autre par la conjugaison (28, 32, 168).
1.4 ANTIBIOTIQUES ETUDIES 1.4.1 ERYTHROMYCINE
L'érythromycine souvent combinée à un sulfamidé demeure efficace dans le traitement des infections à Haemophilus influenzae. (46, 60). Sa toxicité est limitée et son utilisation pour le traitement de ces infections est, depuis plusieurs années, répandue dans le monde médical (114). Les concentrations minimales inhibitrices de 1'érythromycine contre 1'Haemophilus influenzae sont faibles et cet antibiotique, doit être considéré pour lutter contre ces microorganismes.
1.4.2 TETRACYCLINE
La tétracycline est efficace in vitro contre les Haemophilus influenzae. (96, 124). Les concentrations minimales inhibitrices (CMI) et les concentrations minimales bactéricides (CMB) sont faibles, même contre les microorganismes résistants à 11ampic/lline. En clinique, surtout dans les bronchites chroniques, cet antibiotique s'est avéré efficace.
1.4.3 MOXALACTAME
Le moxalactame, une nouvelle céphalosporine, semble doté d'une efficacité
Il est différent des autres céphalosporines car un atome de souffre est remplacé par un atome d1oxygène dans l'anneau a six membres dihydrothiazine pour former un noyau dihydro-oxazine. La présence ou 11 absence de plasmide ou de bêta-lactamase chromosomale n'affecte pas l'activité bactéricide in vitro de cet antibiotique. Les CMI et les CMB du moxalactame vis-à-vis 1'Haemophilus influenzae, résistants à l'ampicilline ou non, demeurent très faibles.
Z
Mason (101) conclut que cet antibiotique doit être une alternative inté ressante dans le traitement des maladies systémiques causées par des Haemophilus influenzae résistants à d1 autres agents antimicrobiens ou par d'autres bâtonnets Gram-négatif. Il conclut également que le
moxalactame n'a pas d'action antagoniste en combinaison avec l'ampicilline ou le chloramphénicol.
Son taux de pénétration dans le liquide céphalo-rachidien de lapins infectés est de 23%, ce qui donne des titres élevés contre les bactéries pouvant causer des méningites. De plus cet antibiotique pénètre bien le LCR chez l'humain. Associé à son efficacité contre les Haemophilus
influenzae résistants à l'ampicilline ou au chloramphénicol, sa bonne pénétration dans le liquide céphalo-rachidien lui confère donc de belles perspectives d'utilisation. Sa toxicité récente fait que son utilisation est maintenant diminuée au Canada et aux Etats-Unis mais demeure l'anti biotique le plus utilisé au Japon.
16
1.4.4 CHLORAMPHENICOL
Habituellament, les souches d'Haemophilus influenzae demeurent sensibles au chloramphenicol. Les concentrations minimales inhibitrices variant de 8 p g/ml à 0,032 p g/ml (54, 66, 101. 130).
le chloramphenicol est un antibiotique de choix dans les infections méningées car il pénètre bien dans le liquide céphalo-rachidien. Cependant, il demeure potentiellement toxique, spécialement chez le nouveau-né et son utilisation présente un certain risque car il est associé avec les dépressions hématopoïétiques (181).
Largement employé en clinique, le choramphénicol demeure difficile a doser dans les liquides ou les tissus vivants. Quelques méthodes sont décrites pour le dosage mais ces techniques sont peu répandues car, soit qu'elles nécessitent un appareillage sophistiqué, soit que le degré de précision laisse à désirer. (9, 45, 93, 95, 96, 115, 154).
18
2.1 TECHNIQUES IN VITRO
2.] .1 CONCENTRATION MINIMALE INI III ilTR ICE ( CMI )
La concentration minimale inhibitrice d'un antibiotique se définit comme la concentration plus faible d'un antibiotique qui inhibe la croissance bactérienne.
Afin d'évaluer avec précision cette quantité minimum, nous ajoutons aux milieux de culture des quantités connues d'antibiotiques dans lesquelles nous faisons croître un nombre connu d'Haemophilus influenzae. Après une période d'incubation de 24 heures à 37°C, la concentration minimale inhibitrice des antibiotiques est déterminée par une absence de croissance visible du microorganisme. La CMI d'un antibiotique vis-à-vis les bactéries est exprimée en milligrammes d'antibiotique par litre.
Il faut noter que plusieurs facteurs, incluant la nature des différents milieux de culture et 1'inoculum utilisé (153), peuvent affecter la CMI des antibiotiques contre 1'Haemophilus influenzae.
La CMI s'avère un critère important dans le choix d'un antibiotique pour le traitement d'un infection.
2.1.2 CONCENTRATION MINIMALE BACTERICIDE (CMB)
se rapproche de la mesure de la CMI. Alors que la CMI d'un antibiotique permet à quelques microorganismes de survivre et de croître à nouveau sur un milieu de culture, la CMB d'un antibiotique, quant à elle, est une concentration d'antibiotique qui inactive complètement les bactéries et les empêche de se reproduire à nouveau.
Avec les antibiotiques bactéricides, la CMI est en général semblable à la CMB. Lorsqu'un antibiotique bactéricide ne peut pas tuer une bactérie et que le rapport CMB/CMI est supérieur à 32, l'on parle de tolérance. Cette tolérance a très bien été définie chez le Staphylococcus aureus
(119, 131). La CMB d'un antibiotique est également un critère important pour déterminer l'efficacité d'un traitement.
2.1.3 L'EFFET INOCULUM
Le milieu de culture utilisé lors de ces expériences fut le Mueller Hinton Agar (BBL), supplémenté avec 1% d'Isovitalex (BEL) et 0,01% d'hémine
(Eastman Kodak Co.) pour toute les études en milieu solide.
Les antibiotiques dilués furent ajoutés à l'agar liquide à 50° C dans les plats de Pétri. Lorsqu'ils furent solidifiés, ils purent être entreprosés à 40 c pour un maximum de 24 heures. La concentration finale des antibio tiques varia de 0,06 a 128 mg/l. Le jour fle 1'expérience, une culture de 18 h des souches d1Haemophilus influenzae étudiées fut diluée pour obtenir trois inoculum différents de 107,
10
3 et 103 unités formatrices de colonie/ml, évalués par un compte total bactérien. Les suspensions obtenues furent ensemencées à l'aide d'un réplicateur Steers (147). Les plats de Pétri furent incubés à 37° C pour 18 heures. La CMI20
est définie à la section 2.1.1.
Pour les études en milieu liquide, la CMI fut déterminée sur deux milieux différents: Mueller Hinton Broth et le bouillon Brain Heart Infusion. Ils furent tous deux supplémentés avec 0,01% d’hémine et 1% d'Isovitalex. Les concentrations finales d'antibiotiques varièrent de 0,06 à 128 mg/1. Un inoculum de 10^ bactéries par ml fut utilisé. Pour la concentration minimale bactéricide, (CMB), les bouillons des tubes où il n'y a pas de croissance apparente fut ensemencée a l'aide d'un fil à boucle de 4mm sur gélose chocolatée et incubée à 37° C pendant 18 heures. La plus faible concentration d'antibiotique inhibant totalement la croissance bactérienne fut définie comme étant la CMB.
La tolérance des microorganismes se définit comme un rapport de la con centration minimale bactéricide d'un antibiotique sur la concentration minimale inhibitrice supérieur à 32.
2.1.4 LES MILIEUX DE CULTURE
Pour cette étude, 1'inoculum des souches fut standardisé sur 1'échelle McFarland pour nous donner un inoculum de départ de 1C)5 bactéries/ml pour les CMI et de 10^ bactéries/ml pour les courbes de croissance. Tous les tubes et milieux solides furent incubés à l'air en absence de Cq2 souvent employé lors de la croissance de 1'Haemophilus influenzae mais pouvant modifier 1'action des antibiotiques.
complète de la souche.
Ce genre de travail, jamais réalisé auparavant avec les Haemophilus influenzae, était important et nous a renseigné sur des points cruciaux de la croissance et de la CMI de plusieurs antibiotiques contre ces bactéries.
Trois milieux différents, fréquemment employés Le Mueller Hinton Broth, le Brain Heart Infusion, le Tryptic Soy Broth furent utilisés pour étudier l'influence du milieu de culture sur la croissance des microor ganisme. Nous y avons fait croître plusieurs souches bactériennes et avons déterminé le nombre de bactéries présentes à différents temps.
Les souches bactériennes utilisées, sensibles ou non à l'ampicilline, furent les suivantes:
- 5 souches Haemophilus influenzae résistantes - 5 souches Haemophilus influenzae sensibles
- 2 souches Haemophilus influenzae de l'ATCC résistantes - 1 souche Haemophilus parainfluenzae de l'ATTC sensible - 1 Staphylococcus aureus de l'ATTC 25923 sensible
Pour déterminer l'influence des différents enrichissements utilisés pour permettre la croissance d'Haemophilus influenzae, nous avons choisi un milieu de base constant: le Mueller-Hinton Broth. Une fois ensemencés, les milieux furent incubés à 37° C à différents temps et une numération bactérienne fut effectuée.
Voici la liste des facteur de croissance que nous avons utilisés. 1° 10% enrichissement Fildes 2° 5% enrichissement Fildes 3° 1.0% Isovitalex + 0.01% Hémine 4° 0.1% Isovitalex + 0.2% Hémine 5° 2% Hémoglobine + 1% Isovitalex 6° 1% supplément B (Difco)
7° 5% d1 érythrocytes de sang de cheval 8° 2% de sang de mouton défibriné
Pour évaluer l'influence du milieu de culture sur la CMI de différents antibiotiques, nous avons utilisés les milieux suivants :
- Mueller-Hinton agar
- Brain-Heart infusion agar - Tryptic Soy Agar
Les antibiotiques étudiés furent ceux-ci: - Ampicilline - Tétracycline - Chloramphénicol - Gentamicine - Cefamandole - Erythromycine - Trimethoprim-sulfaméthoxazole (TMP-SMX) - Cefoperazone
Les souches utilisées furent les mêmes que précédemment sauf que nous ajoutons une souche Escherichia coli de l'ATCC 25922.
Pour évaluer 11 influence des facteurs de croissance sur la OMI de différents antibiotiques, les souches bactériennes, les antibiotiques ainsi que les facteurs de croissance étudiées furent les mêmes que précédemment.
Cependant, l'étude s'est effectuée en milieu solide, (Mueller-Hinton agar) enrichi avec 5% de FiIdes.
2.2 TECHNIQUES IN VIVO
2.2.2 MODELE EXPERIMENTAL DU CAILLOT DE FIBRINE
Les modèles expérimentaux demeurent le meilleur moyen pour évaluer la relation entre le niveau d'antibiotique dans le sérum et les tissus.
Le taux de diffusion des antibiotiques dans les liquides tissulaires est grandement influencé par le genre de modèle expérimental. Ainsi, certains modèles permettront d'atteindre rapidement dans le tissu des concentrations d'antibiotiques se rapprochant de celles du sérum tandis que d'autres modèles expérimentaux permettent une pénétration et une élimination lente des antibiotiques. (14, 18, 75, 81, 116, 159).
Les modèles expérimentaux qui s'équilibrent rapidement sont associés à des surfaces sous la courbe de liquide tissulaire/sérum (AUC) plus
faibles que l'autre catégorie de modèles. Ce rapport (surface sous la courbe liquide tissulaire/sérum) demeure actuellement le meilleur
indicateur de la pénétration tissulaire. Dans notre étude, il est plus intéressant d1 étudier la pharmacologie des antibiotiques en optant pour un modèle expérimental ou la pénétration et 11 élimination des antibio tiques sont lentes afin d'en étudier l'effet sur les microorganismes.
Il est admis que les concentrations d'antibiotiques dans les tissus sont inversement proportionnelles à leur liaison avec les protéines du sérum même si cette corrélation n'est pas ^toujours évidente (12). Certains modèles expérimentaux démontrent clairement cette relation
(12, 14, 18).
Certains modèles ou la surface de contact des antibiotiques est grande et le volume du liquide faible s'équilibrent plus rapidement que ceux où cette surface est faible, par rapport au volume du liquide. (14, 18, 75, 91, 116, 159). D'autres modèles permettent d'étudier les interactions dynamiques entre les antibiotiques et les bactéries dans un environnement où les défenses de l'hôte, tels les anticorps, jouent un rôle infime (14, 18).
Considérant que la fibrine est toujours présente dans tout processus infectieux , que notre modèle doit permettre une pénétration et une élimination lente des antibiotiques, que nous désirons 1'absence de moyens de défense de l'organisme, il nous semble que le modèle du caillot de fibrine soit celui qui corresponde le mieux à nos
attentes, cette technique implique 1'implantation de caillots de fibrine préparés in vitro à 11 intérieur,des tissus sous-cutanés de lapins afin d'analyser la pharmacocinétique des antibiotiques dans les tissus et d'évaluer leur efficacité in vivo seuls ou en combinaison.
Dans ce modèle, les antibiotiques diffusent passivement dans les caillots de fibrine (16, 17, 18).
2.2.1.1 METHODOLOGIE
Pour la préparation de caillots de fibrine non infectés, deux millilitres d'une solution à 2% de fibrinogène humain (Merk, Sharp and Dome) ou d'une solution à 3% de fibrinogène bovin sont distribués dans les tubes stériles. Un dixième de millilitre de thrombine bovine (250m/m) (Parke, Davis and Co.) est ajouté à chaque tube, incubé par la suite 0.5 heure à 37° C. Les caillots ainsi fabriqués peuvent être réfrigérés à 4° C jusqu'à 47 heures avant leur utilisation ou peuvent être enlevés avec précaution et placés dans les plats de Pétri stériles à 20° C pour une période maximale de 15 minutes.
Pour préparer les caillots de fibrine infectés, plusieurs microorganismes peuvent être ajoutés à la solution de fibrinogène. L'insertion de
microorganismes anaérobies doit s'effectuer dans une chambre anaérobie. Pour la majorité des microorganismes, le bouillon Mueller Hinton, dans un volume de 0,1 ml est ajouté à la solution de fibrine. Pour les microorganismes nécessitant des milieux enrichis, un milieu spécifique peut être utilisé. Ainsi, pour 1'Haemophilus influenzae, les caillots de fibrine sont constitués d'une solution de fibrinogène à 3%, de 1%
26
d'Isovitalex (BEL), 20% de sérum, 5% d'un bouillon coeur cervelle conte nant une dilution 1/10 d'une culture de 18 heurs d'Haemophilus inlfuenzae et de 0,1 ml de thrombine. Après leur préparation, les caillots de fibrine infectés sont lavés trois fois avec de l'eau phsysiologique stérile pour enlever les bactéries à la surface des caillots. Chaque caillot est préalablement pesé avant son insertion chez 3,'animal.
2.2.1.2 EXPERIENCE IN VIVO
Des lapins New Zealand, pesant de 2 à 3 kg reçoivent une injection
intramusculaire de 20 mg de chlorpromazine par kg. Toutes les étapes de chirurgie doivent respecter des normes sévères d'asepsie. Les francs de 1'animal sont rasés et désinfectés avec de l'iode et de l'alcool. Une anesthésie locale avec de la lidocaine à 2% est faite sur la peau pour permettre une incision de 4 cm. Après une dissection délicate des tissus sous-cutanés, un maximum de 4 caillots infectés ou non sont placés dans chaque poche sous-cutanée. Des agrafes (18 mm) sont appliquées pour
/
fermer l'incision. Les animaux sont habituellement utilisés une seule fois. Dans chaque oreille des animaux nous insérons des aiguilles (#23): une pour 1'infusion des antibiotiques, l'autre pour prélever des
échantillons de sang. Celle-ci est régulièrement nettoyée à l'aide d'une solution d'héparine (20 u /ml).
Le sang, le liquide extravasculaire et les caillots de fibrine sont, prélevés avant 1'administration des antibiotiques ainsi qu'à différents temps après 1'implantation des caillots.
disques en papier dans les poches sous-cutanées. Ils sont par la suite placés sur gélose pour analyser leur contenu en antibiotique. Les caillot de fibrine sont prélevés de façon aseptique et 11ouverture est renfermée par des agrafes.
Les caillots sont pesés, coupés et dissous avec une solution de trypsine à 2.5% (Sigma Chemical Co., St-Louis, Moc.) ajoutée dans un volume égal au poids final du caillot. Une incubation d'une heure à 37° C est nécessaire pour obtenir une dissolution complète des cailots.
2.2.1.3 DOSAGE DES ANTIBIOTIQUES
Le niveau d1 antibiotique est habituellement déterminé par une méthode biologique. Des solutions standards sont préparés en diluant des
quantités connues d1antibiotique dans le sérum de lapins pour le sérum, dans une solution saline physiologique pour le liquide interstitiel et dans des caillots de fibrine dissouts pour les caillots. Les échantillons de plasma, de liquide extravasculaires, de cailots et leurs standards respectifs sont prélevés en triplicata et incubés 24 heures à 37° C. La zone d'inhibition de la croissance bactérienne est mesurée et reportée sur une échelle semilcgarithmique.
2.2.1.4 MESURE DE L'ACTIVITE ANTIMICROBIENNE
Pour évaluer l'efficacité des antibiotiques contre les microorganismes, il est important que les concentrations d'agents antimicrobiens dans le sérum dépassent les concentrations minimales inhibitriçes (CMI) contre les
bactéries en présence. Un gradient de diffusion élevé entre le sérum et les tissus est nécessaire pour permettre à l'antibiotique de pénétrer dans le caillot de fibrine et ainsi éliminer les bactéries qui l'infectent.
L'activité antimicrobienne des antibiotiques contre les Haemophilus influenzae présents dans les caillots est évaluée en déterminant le nombre de microorganismes viables présents dans les caillots dissouts ensemencés en triplicata sur une gélose chocolatée, incubée à 37°C pendant 24 heures.
2.2.2 MODE D'ADMINISTRATION DES ANTIBIOTIQUES
La meilleur façon d'administrer les agents antimicrobiens, infusion
continue ou injection intermittente, demeure toujours un sujet controversé. Les études cliniques et expérimentales traitant ce sujet sont limitées et n'ont pu convenir, à ce jour, de la supériorité d'un des deux modes
d'administration.
Pour être efficaces, les antibiotiques doivent être actifs in vitro contre l'agent infectieux et atteindre les sites d'infection en concentrations suffisantes. Les chercheurs ont découvert très tôt que les antibio
tiques pouvaient soit diffuser passivement dans les liquides intestitiels et les tissus, soit être transportés activement dans les humeurs ou
les sites visés (14). Ces variations dans la distribution tissulaire ont encouragé les investigateurs à chercher des nouveaux modes de thérapie.
28
de l'administration des antibiotiques par injection intermittente ou par infusion continue, il demeure toujours extrêmement difficile d'opter pour un ou l'autre de ces modes. La plupart des chercheurs ont limité leurs investigations à l'aspect pharmacocinétique des agents antimicrobiens (30) ou ont évalué l'effet clinique de la thérapie sans étudier d'une façon systématique la distribution de 1'antibiotique au site d'infection (53). Ces deux approches ont rarement été analysés d'une façon simultanée.
De fait, en plus des qualités physio-chimiques intrisèques des
antibiotiques, de la liaison au protéines du sérum et du liquide inters titiel, de la perméabilité des membranes et du transport actif pouvant
/
tous influencer la distribution tissulaire, le processus inflammatoire qui peut modifier la circulation locale et la présence d'enzymes bactériens peuvent également être considérés comme des facteurs influençant d'une certaine façon la concentration d'agents antimicrobiens dans les tissus et pouvant modifier l'efficacité d'une thérapie.
De plus, le modèle expérimental utilisée, les espèces animales employés, le genre de microorganisme et les transformations métaboliques des
antibiotiques restent également des facteurs pouvant affecter la distribution tissulaire et la thérapie.
Dans notre étude, nous avons choisi trois différents modes d'administra tion des antibiotiques: le bolus, 1'infusion continue et les injections intermittentes.
30
Le terme bolus est utilisé lorsque l'antibiotique est injecté en 30 minutes. Habituellement, une dose de 50 à 100 milligrammes d'antibio tique par kilogramme était administrée au lapin.
L'infusion continue contenait la même quantité d'antibiotique mais l'injection se faisait pendant 24 heures.
Les injections intermittentes étaient une fraction, soit le quart, de la dose du bolus, et chaque injection, espacée de 6 heures, était administrée en 30 minutes.
2.2.3 PHARMACOLOGIE
Le modèle expérimental du caillot de fibrine a souvent été employé pour étudier la diffusion passive des antibiotiques du sérum vers les liquides tissulaires. Nous utilisons le rapport suface sous la courbe caillot/ sérum car il demeure un meilleur indicateur de la pénétration tissulaire que le rapport concentration maximale tissulaire/concentration maximale sérum. L'aire sous la courbe de la concentration d'antibiotique versus le temps a été obtenue par la méthode d'approximation mathématique des trapèzes successifs, à partir du temps 0 jusqu'à 24 heures. Les
résultats sont présentés comme la moyenne t la déviation standard de quatre expériences.
2.2.4 LIAISONS AUX PROTEINES
La liaison aux protéines de sérum de l'antibiotique a été évaluée in vitro à l'aide de chambres à dialyse dans lesquelles du sérum de lapins et une
solution Krebs-Ringer étaient séparés par une seule membrane (12).
L'antibiotique était présent initialement dans le sérum à des concentra tions de 50, 25 et 10 pg/ml dans 50% des chambres à dialyse et dans l'autre 50% l'antibiotique était dans la solution de Krebs-Ringer. Les chambres étaient fermées et agitées lentement à 37° C pour un minimum de 18 heures, période adéquate pour atteindre l'équilibre. Chaque compartiment était par la suite échantilloné en triplicata et chaque solution était
analysée par une méthode de diffusion en gélose. Des courbes standards dans le sérum de lapins et dans du Krebs-Ringer étaient utilisées au
même moment. Le degré de liaison aux protéines était calculé en exprimant la différence finale entre la concentration dans les deux compartiments comme un pourcentage de la concentration finale dans le sérum.
CHAPITRE III
Dans cette section, nous désirons évaluer l'influence de 1'inoculum sur les CMI de plusieurs céphalosporines contre 1'Haemophilus
influenzae.
Nous discutons également pour la première fois dans la littérature spécialisée de souches d'Haemophilus influenzae "tolérantes" à certains agents anti-microbiens.
34
Jpunml of Antimicrobial Chemotherapy ( 1982) 10, 397^)02
3.1 L'effet inoculum
Inoculum size effect on the MIC of cefoperazone, moxalactam, cefotaxime, cefoxitin and cephalothin for 118 strains of Haemophilus influenzae including
‘tolerant’ micro-organisms
Pierre Simard and Michel G. Bergeron
Infectious Disease Service, Le Centre Hospitalier de l'Université Laval, Québec, Canada
In this study, 118 strains of Haemophilus influenzae (H.I.), 31 ^-lactamase producers, and 87 non-/?-lactamase producers were tested on Mueller Hinton Agar enriched with Isovitalex (1%) and Hemin (0 01%) for susceptibility to cefo perazone, moxalactam, cefotaxime, cefoxitin, and cephalothin. The inocula used were 10', 10' and 10' colony forming units (efu) per ml. With the exception of moxalactam, an inoculum effect could not be detected against the non-/?-lacta- mase producers. Against the /Mactamase producers, the MIC*, of cefotaxime and moxalactam was equal to or less than 0-06 mg/I. The MIC*, of cefoperazone ranged from <0 06 mg/I for an inoculum of 10' bacteria/ml to 0-5 mg/1 for inocula of 10' and 10' bacteria/ml. Four /7. influenzae strains (all Kilian biotype I ) were observed to be tolerant (MBC/MIC ^32) to either cefoperazone, moxalac tam, cefotaxime or cephalothin.
3.1.1 Introduction
The widening spectrum of Haemophilus influenzae infections affecting both young children and healthy adults, and the emergence of strains resistant to ampicillin (Bergeron, Claveau & Simard, 1980) have stimulated investigators to study the in-
vilro efficacy of other antimicrobial agents against this micro-organism. Cefopera
zone, a new semisynthetic cephalosporin with a comparable spectrum of activity (Jones el a!., 1980) to cefotaxime and moxalactam could become, if proved to be effective in vivo, a potentially useful alternative to other agents in the treatment of infections other than meningitis caused by IL influenzae. Moreover, moxalactam already appears as a promising alternative in the treatment of Gram-negative bacil lary meningitis (Olson et ai, 1981).
In the present investigation, we have examined the effect of inoculum size on the
in-vitro activity of cefoperazone, moxalactam, cefotaxime, cefoxitin and cephalothin
against 118 strains of H, influenzae, and have looked at the tolerance of selected strains of /7. influenzae to these five antibiotics.
Reprint requests to: Dr Michel G. Bergeron, Chief, Infectious Disease Service, Centre Hospitalier de l’Université Laval, 2705, Laurier Blvd.. Ste-Foy, Quebec GIV 4G2.
397
5
-1.2
398 P. Simard and M. G. Bergeron
Material and methods
Organisms. One hundred and eighteen clinical isolates of //. influenzae (87 ampi-
cillin susceptible, 31 ampicillin resistant) were collected at the Centre Hospitalier de l’Université Laval, Québec, Canada, and at the Hospital for Sick Children, Toronto, Canada. The isolates originated from blood (55 strains), cerebrospinal fluid (39), ocular specimens (13), expectorations (5), synovial fluid (4), and ears (2). As previously described (Bergeron et ai, 1981), they were characterized as H. influenzae by demonstrating requirements for both X and V factors. Xylose fermentation, indole production, 5% human erythrocyte hemagglutination, gas production, horse blood haemolysis, H2S production, and the porphyrin test allowed us to differentiate //. influenzae from H. haemolyticus, //. aegypticus, and H. parainfluenzae. 106 strains were of type B, 1 of type A, 1 of type C, and 10 were non-typable. All the strains of //. influenzae were biotyped by the method of Kilian. The 3 I /?-lactamase producing strains included 15 biotype I, 7 biotype II, 4 biotype III, 1 biotype IV, and 4 biotype V. Of 87 ^-lactamase-negative strains, 43 were biotype I, 8 biotype II, 7 biotype III, 5 biotype IV, and 24 biotype V. The presence of /1-lactamase was assessed by the phenol red test. All strains were stored and frozen at — 70°C in glycerol broth before testing.
Antibiotics. The antibiotic powders were kindly provided by the following phar
maceutical companies: cefoperazone by Pfizer Pharmaceuticals, New York, N.Y., cefotaxime by Hoechst-Roussel Pharmaceuticals, Somerville, N.J.; moxalactam and cephalothin by Eli Lilly Co., Indianapolis, Ind. cefoxitin by Merck Frosst Laboratories, Montreal, Canada.
In vitro testing. Susceptibility testing was determined in Mueller Hinton Agar (BBL Microbiology Systems, Cockeysville, Md.). This medium was supplemented with 1% Isovitalex (BBL) and 0 01% Hemin extract (Eastman Kodak Co., Rochester, N.Y.).
Agar studies. The diluted antibiotics were added to the liquid agar at 50°C in petri
dishes, allowed to solidify, and stored at 4°C for no more than 24 h. The final concen trations of antibiotics in the plates ranged from 0 06 to 128 mg/1. On the day of the experiment, an 18-h culture of each //. influenzae strain, grown in Mueller Hinton broth (BBL) supplemented with 1% Isovitalex, and 0 01% Hemin, was diluted to obtain three different inocula of 107, 105, 103 cfu/ml, as evaluated by colony counts. These suspensions were inoculated on Mueller Hinton supplemented agar with the use of a Steers’ replicator. The plates were then incubated for 18 h at 37°C in air. The MIC was defined as the lowest concentrations of antibiotic at which there was no growth detectable with the naked eye.
Broth studies. Minimal inhibitory concentrations were determined in both Mueller
Hinton broth and Brain Heart Infusion broth on four selected strains which were previously found to be tolerant to cefamandole (Bergeron el al., 1981) or to have a high MIC against one or many of the antibiotics tested. Broth media were enriched with 0 01% Hemin and 1% Isovitalex. The final antibiotic concentration ranged from 0 06 to 128 mg/I. A final inoculum of 10s bacteria per ml was used. The MIC was defined as the tube where there was no visible growth. For the minimal bactericidal
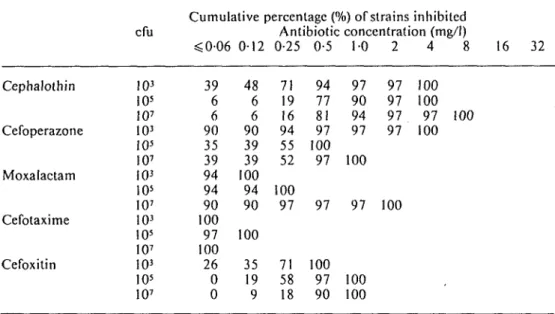
Activity of cephalosporins against H. influenzae 399 Table I. MICs in solid media of five antibiotics against 87 non-/?-lactamase producing strains
of //. influenzae
cfu
Cumulative percentage (%) of strains inhibited Antibiotic concentration (mg/I) <0 06 0-12 0 25 0-5 1-0 2 4 Cephalothin 103 10 15 30 75 94 100 I05 1 1 18 39 86 98 98 107 1 1 20 40 82 94 94 Cefoperazone I03 52 61 90 92 97 98 100 7 10' 77 83 90 95 98 99 100 I07 70 75 93 97 99 99 100 Moxalactam I03 100 10' 90 99 99 100 107 85 92 99 99 99 100 Cefotaxime I03 100 10' 98 98 99 100 107 95 97 100 Cefoxitin I03 9 13 33 90 98 100 10' 0 5 18 72 98 100 107 0 2 31 75 100 8 16 32 94 99 100
concentrations (MBCs), broth from the tubes, where no visible growth was observed, was sampled with a 4-ratn loop, plated on chocolate agar and incubated at 37°C for 18 h in air. The lowest concentration of antibiotic yielding no colony was defined as the MBC. Tolerance was defined as a ratio MBC/MIC of more than 16 (Rajashekaraiah el al., 1980; Norden & Keleti, 1981).
3
.I.3
ResultsTable I shows the cumulative percentage of 87 ^-lactamase-negative strains inhibited by the five antimicrobial agents. Most strains were inhibited by concentrations equal to or less than 2 mg of either antibiotic per litre. The activity of all the cephalosporins studied against these non-/?-lactamase producing strains of H. influenzae were not a Heeled by an increase in inoculum from 103 to 107 micro-organisms per ml. The MICjo for an inoculum of 107 cfu/ml was <0 06 mg/I for cefotaxime, 0-12 mg/1 for moxalactam, 0 25 mg/I for cefoperazone, 1 mg/1 for cefoxitin and 2 mg/1 for ‘ cephalothin.
As shown in Table II, the in-vitro activity of both cefotaxime and moxalactam were not affected by the inoculum, and the MIC90 was equal to or less than 0-06 mg/1. Cefoperazone was the third most effective drug but its inhibitory activity was affected by the increase in inoculum. The MIC90 of cefoperazone ranged from <0 06 mg/I for an inoculum of 103 bacteria/ml to 0-5 mg/1 for inocula of 105 and 107 bacteria/ml. Cefoxitin and cephalothin were minimally affected by the inoculum but were less active than the other agents.
The MIC and MBC of cephalothin, cefoperazone, moxalactam, cefotaxime and cefoxitin determined against four selected strains of //. influenzae is presented on
Table II. MICs in solid media of five antibiotics against 31 /Maclamase-producing strains of
H. influenzae
Cumulative percentage (%) of strains inhibited efu Antibiotic concentration (mg/1)
<006 012 0 25 05 10 2 4 Cephalothin 103 39 48 71 94 97 97 100 I05 6 6 19 77 90 97 100 107 6 6 16 81 94 97 97 Cefoperazone 103 90 90 94 97 97 97 100 10s 35 39 55 100 I07 39 39 52 97 100 Moxalactam I03 94 100 10s 94 94 100 107 90 90 97 97 97 100 Cefotaxime 103 100 105 97 100 107 100 Cefoxitin 103 26 35 71 100 10
*
0 19 58 97 100 107 0 9 18 90 100 16 32Table III. MIC and MBC of cephalosporins in Mueller Hinton broth and brain heart infusion broth against four tolerant strains of H. influenzae
Strain Medium Antibiotic MIC MBC MBC/MIC
169 MHB Cefoxitin <006 2 >32 214 MHB Cefoperazone 0 25 4 16 214 BHI Moxalactam <006 1 >16 224 BHI Cefotaxime <006 2 >32 251 MHB Cefoperazone <006 2 >32 251 BHI Cefotaxime
<
0-06 2 >32 251 BHI Cephalothin 025 4 16 251 BHI Cefoxitin 2 >128 >64Strain 169: H. influenzae, type B, biotype I, /Mactamase-negative Strain 214: H. influenzae, type B, biotype I, /Mactamase-positive Strain 224: //. influenzae, type B, biotype I, /Mactamase-negative Strain 251: Z/. influenzae, non B, biotype I,/(-lactamase-positive
Table Hi. One /Mactamase-negative strain of H. influenzae (No. 169) was found to be relatively resistant to cefoperazone (8 mg/1), cefotaxime (1 mg/1), and moxalactam (1 mg/1) in MHB.
Although very susceptible to the inhibitory activity of cefoxitin (MIC <0-06 mg/1), this strain appeared to be tolerant to its bactericidal activity with an MBC of 2 mg/1
38
. Activity of cephalosporins against //. influenzae 401
(at least 32 times the MIC) (Table III). Another non ^-lactamase-producing strain No. 224 was tolerant exclusively to cefotaxime in BHI but not in MHB, nor to any of the other cephalosporins. The /?-lactamase producing strains nos. 214 and 251 were tolerant to cefoperazone in MHB. Strain no. 214 was also tolerant to moxalactam in BHI. Strain no. 251 was tolerant in BHI to cefotaxime, cephalothin and cefoxitin.
3.1.4 Discussion
In the present investigation, it appears that the inoculum size which minimally affec ted moxalactam did not affect the activity of the five cephalosporins studied against non-/?-Iactamase-producing strains of H. influenzae. In contrast with moxalactam and cefotaxime, the activity of cefoperazone against /Mactamase-producing strains of H. influenzae was affected by an increase in the inoculum used. However, these results must be interpreted with care, since an inoculum effect might have been detected if a wider range of concentrations (that is one going lower than 0 06 mg/I) had been used. These results are in accordance with those of other investigators who have demonstrated a similar inoculum effect with cefoperazone (Bulger & Washington, 1980). Of all the cephalosporins studied, cefotaxime and moxalactam were the most active antibiotics against all isolates (Jorgensen, Crawford & Alexander, 1980; Mason el ai, 1980; Baker, Thornsberry & Jones, 1980). The dif fusion of these latter two drugs into cerebrospinal fluid and the recent observations that moxalactam appears to be effective in the treatment of Gram-negative men ingitis suggest that they may, after proper clinical trials, appear as interesting alterna tives to the combination of ampicillin with chloramphenicol, as initial treatment of meningitis in children (Olson, 1981).
In general, no correlation could be made between the susceptibility of II. influen
zae to the antimicrobial agents used and their serotypes or biotypes, but all tolerant
strains were biotype I. With respect to the limited bactericidal activity of several cephalosporins against a few selected strains of II. influenzae, we have previously observed that cefamandole had a limited bactericidal activity against both /?- lactamase and non-/Mactamase producing strains of H. influenzae (Bergeron et ai, 1980). We believe that these strains were tolerant to cefamandole. It appears from our present experiments that this phenomenon may be observed with the newer cephalosporins. We have also observed, as did other investigators with Staphylococ
cus aureus, that the tolerance of certain strains of H. influenzae may be medium
dependent (Kaye, 1980; Bradley, Wetmur & Hodes, 1980; Norden & Keleti, 1981), thus suggesting that the medium used, or the different enrichment added in the medium may modify the sensitivity of /7. influenzae to antibiotics. In a recent review of the literature, we have observed that more than 25 different media or enrich ments have been used to evaluate the in-vitro activity of antimicrobial agents against
H. influenzae (Bergeron et ai, 1980). The inoculum-dependent formation of
spheroplasts (Bulger & Washington, 1980), although not evaluated here, may also be a partial explanation for the phenomenon of tolerance (Bottone, Brandman & Schneierson, 1976). The mechanism and the clinical significance of tolerance is not known (Rajashckaroiah et ai, 1980), and, at this stage of investigation, whether or not we should call these strains ‘tolerant’ is highly controversial.
, 402 P. Simard and M. G. Bergeron
of tolerance is far from being established, one should be cautious in the interpretation of sensitivity testing using low inoculum which might not necessarily reflect the number of bacteria at the site of infection. A better standardization of sensitivity testing against H. influenzae is needed.
Acknowledgements
This study was supported by a grant from Pfizer Pharmaceuticals, Pfizer Canada Inc. Many thanks to Dr Charles Prober from The Toronto General Hospital for furnishing some of the //. influenzae strains and to Mrs Lise Villeneuve for her assistance.
3
.I.5
ReferencesBaker, C. N., Thornsberry, C. & Jones, R. N. (1980). In Vitro Antimicrobial Activity of Cefoperazone, Cefotaxime, Moxalactam (LY 127935), azlocillin, mezlocillin, and other /Mactam antibiotics against Neisseria gonorrhoeae and Haemophilus influenzae includ
ing /7-lactamase producing strains. Antimicrobial Agents and Chemotherapy 17, 757-61.
Bergeron, M. G., Claveau, S. & Simard, P. (1981). Limited in-vitro Activity of cefamandole against 100 beta-lactamase producing Haemophilus Influenzae strains; comparison of moxalactam, chloramphenicol, and ampicillin. Antimicrobial Agents and Chemotherapy
19, 101-5.
Bergeron, M. G., Gagne, J. M., Dery, P. & Gauvreau, L. (1980). L'Haemophilus influenzae en 1980: aspect clinique, microbiologie et thérapeutique. Une revue, Union Médicale du
Canada 109, 499-506.
Bottone, E. J., Brandman, Z. & Schneierson, S. S. (1976). Spheroplasts of Haemophilus
influenzae induced by cell-wall active antibiotics and their effect upon the interpretation
of susceptibility tests. Antimicrobial Agents and Chemotherapy 9, 327-33.
Bradley, H. E., Wetmur, J. G. & D. S. Modes (1980). Tolerance in Staphylococcus aureus: Evidence for bacteriophage role. Journal of Infectious Diseases 141, 233-7.
Bulger, R. R. & Washington II, J. A. (1980). Effect of inoculum size and /7-lactamase pro duction on in vitro activity of new cephalosporins against Haemophilus species. Anti
microbial Agents and Chemotherapy 17, 393-6.
Jones, R. N., Fuchs, P. C., Barry, A. L., Gavan, T. L., Sommers, H. M. & Gerlack, E. H. (1980). Cefoperazone (T-1551), a new semisynthetic cephalosporin: comparison with cephalothin and gentamicin. Antimicrobial Agents and Chemotherapy 17, 743-9. Jorgensen, J. H„ Crawford, S. A. & Alexander, G. A. (1980). In vitro activities of Cefotaxime
and Moxalactam (LY 127935) against Haemophilus influenzae. Antimicrobial Agents and
Chemotherapy 17, 516-17.
Kaye, D. (1980). The clinical significance of tolerance of Staphylococcus aureus. Annals of
Internal Medicine 93, 424-6.
Mason, E. O., Kaplan, S. L., Anderson, D. C., Hinds, D. B. & Feigin, R. D. (1980). In vitro susceptibility of 104 clinical isolates of Haemophilus influenzae to moxalactam
1 (LY 127935); ampicillin, chloramphenicol, and ticarcillin. Antimicrobial Agents and
Chemotherapy 17, 470-3.
Norden, C. W. & Kclcti, E. (1981). Antibiotic tolerance in strains of Staphylococcus aureus.
Journal of Antimicrobial Chemotherapy 7, 599-605.
Olson, D. A., Hoeprick, P. D., Nolan, S. M. & Goldstein, E. (1981). Successful treatment of Gram-negative bacillary meningitis with moxalactam. Annals ofInterna! Medicine 95,
302-5.
Rajashekaraiah, K. R., Rice, T., Rao, V. S., Marsh, D., Ramakrishna, B. & Kallick, C. A. (1980). Clinical significance of tolerant strains of Staphylococcus aureus in patients with endocarditis. Annals of Internal Medicine 93, 796-801.
40
3.2 SENSIBILITE DE HAEMOPHILUS INFLUENZAE
Dans cette section, nous évaluons 1'activité de plusieurs antibiotiques contre 1'Haemophilus influenzae. Nous utilisons 75 souches bactériennes non productrices de bêta-lactamase et 25 souches productrices.