Étude de l’expression de la sous-unité alpha 5 des récepteurs
GABA
Adans les interneurones de l’hippocampe et de sa
diminution dans l’épilepsie du lobe temporal
Mémoire
Elise Magnin
Maîtrise en neurobiologie
Maître ès sciences (M.Sc.)
Québec, Canada
© Elise Magnin, 2014
iii
Résumé
L’expression synaptique de la sous-unité α5 des récepteurs GABAA (α5-RGABAA)a été montrée
dans les interneurones (INs) inhibiteurs de la zone CA1 de l’hippocampe. Cependant, les types de synapses qui expriment cette α5-RGABAA et son rôle fonctionnel n’ont pas encore été déterminés.
En utilisant une association d’enregistrements de « patch-clamp » en configuration cellule entière, d’optogénétique et de la technique d’immunohistochimie, nous avons étudié l’expression synaptique de la α5-RGABAA et ses modifications dans un modèle animal d’épilepsie du lobe temporal (ELT).
Nos données montrent que la α5-RGABAA est exprimée aux synapses inhibitrices formées par le
réseau de cellules qui expriment la calrétinine (CR+) sur différents types d’INs du stratum
oriens-alveus (O/A) de l’hippocampe. De plus, nous avons observé un déclin précoce de la α5-RGABAA
dans les INs de l’O/A pendant l’ELT ce qui pourrait contribuer à la désinhibition et à l’hyperexcitabilité de ces INs et aurait donc des conséquences sur l’activité du réseau entier.
v
Table des matières
Résumé ... iii
Table des matières ... v
Liste des figures ... vii
Liste des tableaux ... ix
Liste des abréviations... xi
Remerciements ... xiii
Introduction ... 1
1. L’hippocampe ... 1
1.1 Présentation générale de la structure ... 1
1.2 Organisation de l’hippocampe ... 2
1.2.1 Subdivisons des aires de l’hippocampe ... 2
1.2.2 Organisation neuronale ... 4
1.3 Les interneurones de type O-LM ... 4
1.4 Transmission synaptique inhibitrice ionotropique de type GABAergique : mécanisme et régulation . 7 1.4.1 Le récepteur GABAA ... 7
1.4.2. Combinaisons des sous-unités et cinétiques de courants associées. ... 10
1.5 La sous-unité alpha 5 ... 11
1.5.1 Présence et rôle dans l’hippocampe ... 11
1.5.2 Radixine, protéine d’ancrage de la sous-unité α5 ... 13
2. L’épilepsie du lobe temporal ... 15
2.1 Généralité et structures cérébrales impliquées dans la maladie ... 15
2.2 L’hippocampe dans l’épilepsie ... 15
2.2.1 Modification du réseau inhibiteur GABAergique ... 16
Hypothèse ... 17
Objectifs spécifiques ... 17
Matériel et méthodes ... 19
1. Génotypage ... 19
2. Modèle expérimental de l’épilepsie du lobe temporal : le modèle pilocarpine ... 19
3. Préparation des tranches ... 20
4. Enregistrement électrophysiologiques : technique du « patch-clamp » ... 20
5. Injection stéréotaxique : ciblage optogénétique et pharmacogénétique des interneurones ... 22
6. Analyse des données ... 23
vi
8. Immunohistochimie ... 25
9. Microscopie confocale ... 25
Résultats ... 27
1. Identification des IS-3 dans le modèle de souris transgénique VIP-eGFP ... 27
2. Identification des IS-3 dans le modèle de souris transgénique CR-Cre. ... 29
3. Caractérisation des réponses inhibitrices dans les interneurones de l’O/A de la zone CA1 ... 30
4. Expression synaptique de la sous-unité α5 des RGABAA dans les interneurones O/A de la zone CA1 ... 34
5. Expression de la sous-unité α5 des RGABAA dans les interneurones positifs à la somatostatine ... 38
6. Diminution de l’expression de la sous-unité α5 et de radixine en conditions expérimentales d’ELT ... 41
Discussion ... 45
1. Différents modèles de souris transgéniques pour cibler les interneurones ... 45
2. Les cibles des IS-3 dans l’O/A ... 46
3. La sous-unité alpha 5 du récepteur GABAA est exprimée aux synapses de toutes les cibles postsynaptiques des cellules CR+ ... 47
4. Conséquences de la perte de la sous-unité α5 en cas d’ELT ... 50
Conclusion ... 53
Bibliographie ... 55
vii
Liste des figures
Figure 1 : Coupe transversale de l’hippocampe ... 3
Figure 2 : Contrôle inhibiteur des O-LM, innervation et identification des cellules IS-3 ... 6
Figure 3 : Neurones de la région CA1 du str. oriens de l’hippocampe ... 8
Figure 4 : Représentation de la structure des récepteurs GABAA ... 9
Figure 5 : Diversité des sous-unités alpha des récepteurs GABAA ... 12
Figure 6 : Localisation synaptique de radixine, de la α5-RGABAA et de « clusters » de radixine/ α5-RGABAA 14 Figure 7 : Identifications des cellules IS-3 dans le modèle de souris VIP-eGFP ... 28
Figure 8 : Anatomie des interneurones spécifique aux interneurones de type 3, de types 1 et des interneurones de projection à longue portée CR+ ... 31-32 Figure 9 : Caractérisation des réponses inhibitrices évoquées par la lumière dans les interneurones de la zone CA1 de l’hippocampe ... 33
Figure 10 : Les IPSCs évoqués par la lumière sont sensibles aux agonistes inverses de α5-RGABAA ... 36
Figure 11 : Expression synaptique de la α5-RGABAA dans différents types cellulaires de l’O/A ... 37
Figure 12 : Colocalisation de α5-RGABAA , radixine et VGAT dans les interneurones SOM+ ... 40
ix
Liste des tableaux
xi
Liste des abréviations
A : alveus
BC : de l’anglais « basket cell », pour désigner les cellules en panier BIS : cellules bistratifiées
CNO : clozapine-N-oxide
CR/CR+ : calrétinine/positif (ou exprimant la) à la calrétinine
DSI : suppression de l’inhibition induite par la dépolarisation, de l’anglais « depolarization-induced supporession of inhibiton »
ELT : épilepsie du lobe temporal
GABA : acide gamma-aminobutyrique, de l’anglais « gamma-aminobutyric acid » In(s) : interneurones(s)
IS(s) : interneurone(s) spécifique(s) aux interneurones
IS-1/IS-3 : interneurone spécifique aux interneurones de type 1/de type 3 LM : lacunosum moleculare
LTP : potentialisation à long terme, de l’anglais « long term potentiation » mGluR1α : récepteurs glutamatergiques métabotropiques de type 1
M2R : récepteur muscarinique de type 2 O/A : oriens/alveus
O-LM : oriens-lacunosum moleculare O-O : oriens-oriens
PFA : parafornaldéhyde PR : cellule de projection
PV/PV+ : parvalbumine/ positif (ou exprimant la) à la parvalbumine PYR : pyramidale
RAD : radiatum
Rser : résistance en série
SOM/SOM+ : somatostatine/ positif (ou exprimant la) à la somatostatine str. : stratum
TRI : cellule trilaminaire
VGAT : transporteur vésiculaire du GABA, de l’anglais « vesicular GABA transporter » VIP/VIP+: peptide vasoactif intestinal/ positif (ou exprimant le) au peptide vasoactif intestinal
xiii
Remerciements
Je tiens à remercier en premier lieu Lisa Topolnik, ma directrice de recherche, avec qui nous avons partagé trois années de travail mais aussi trois années de vie. Nous arrivons au terme de l’aventure mais ce fut une chance d’être dans son laboratoire. Elle a pris le temps de me guider et de m’orienter afin que je puisse trouver l’inspiration. Toujours très disponible tout au long de mon parcours, la réalisation de ce mémoire n’aurait pas pu se faire sans son temps et son aide précieuse. Lisa, sincèrement, merci pour tout.
Je tiens également à remercier chaleureusement tous les membres de mon équipe, actuels et anciens. Merci pour toute l’aide et le soutien qu’ils ont su m’apporter au cours de mon évolution, et surtout, merci pour toute cette sympathie et cette amitié. Olivier, Marie-Andrée, Lynda, Ruggiero, Xiao, Dimitry… nous avons partagé de beaux moments de vie.
Je n'oublie pas mes plus proches amis (ils se reconnaîtront!) qui ont été présents depuis le début, qui ont toujours su me soutenir et m’encourager. Dans les bons comme dans les mauvais moments, ce sont eux qui m’ont fait avancer et qui m’ont fait croire en ma réussite. Merci également à mes sœurs chéries adorées, mes modèles! Et évidemment merci à mes parents, sans qui tout cela n’aurait pas lieu finalement!
Mes remerciements s’adressent également aux deux autres membres de mon comité aviseur, Armen Saghatelyan et Mohamed Chahine, pour leur encadrement et leur sympathie.
1
Introduction
1. L’hippocampe
1.1 Présentation générale de la structure
Localisé dans les profondeurs du lobe temporal médian du cerveau humain, l’hippocampe est composé d’une multitude de neurones organisés en un réseau original ne trouvant son égal dans aucune autre structure du système nerveux. Il est présent de manière paire et symétrique dans chaque hémisphère et suscite l’intérêt des scientifiques issus de nombreux domaines. Que vous soyez un psychologue intéressé par la mémoire ou un chercheur travaillant sur la plasticité neuronale et synaptique, l’hippocampe et les structures qui lui sont associées font l’objet d’une étude intense depuis des années.
En plus de son rôle central dans les mécanismes liés à la mémoire, à l’apprentissage et à la navigation spatiale, l’hippocampe est doté d’une architecture extrêmement bien organisée. Composé de strates cellulaires distinctes faites de différentes populations neuronales facilement identifiables, il se présente comme le système modèle par excellence pour l’étude de la neurophysiologie. De plus, il est pourvu d’une bonne capacité de survie in vitro permettant ainsi de longues expériences électrophysiologiques.
Les travaux de recherche menés sur l’hippocampe ont donc permis d’établir de nombreux principes de neurosciences. Une des formes de la plasticité synaptique, connue sous le nom de LTP ou potentialisation à long terme, a été découverte et est très bien caractérisée dans cette structure. La LTP est notamment reconnue pour être un des mécanismes principaux utilisés par le cerveau pour stocker les souvenirs. La compréhension des mécanismes de différentes classes de récepteurs pour des acides aminés excitateurs et inhibiteurs ainsi que les mécanismes de recapture de plusieurs neurotransmetteurs et les conséquences délétères de l’excitotoxicité sur les cellules du cerveau ont aussi pu être mis en lumière.
L’hippocampe est également une structure de choix pour d’autres types de recherche de par son implication dans plusieurs désordres neurologiques telles que l’épilepsie ou la maladie d’Alzheimer. Observer les processus pathologiques sous-jacents à ces maladies offre la perspective de nouvelles thérapeutiques. Pour comprendre la fonction de l’hippocampe, considérons maintenant son organisation anatomique.
2
1.2 Organisation de l’hippocampe
1.2.1 Subdivisons des aires de l’hippocampe
En coupe transversale, on peut observer que l'hippocampe est formé de deux structures en forme de « V » inversé, le gyrus denté et la corne d'Ammon (Cajal, 1911; Lorente de Nó, 1934). Sur la base de différences morphologiques et de ses connexions synaptiques, la corne d'Ammon est encore subdivisée en trois parties : CA3, CA2 et CA1. L’hippocampe contient cinq couches cellulaires principales au lieu des six couches classiques du néocortex : l'alveus (A), contenant les axones des cellules pyramidales, le stratum oriens (str.O), situé entre l'alveus et les cellules pyramidales et contenant les dendrites basales de ces dernières. Le stratum pyramidale (str.PYR), contient les corps cellulaires des cellules pyramidales de la corne d'Ammon et les stratum radiatum (str.RAD) et
stratum lacunosum-moleculare (str.LM) contiennent les segments respectivement proximaux et
distaux de l'arbre dendritique apical des cellules pyramidales (Fig. 1).
La zone CA1 de l’hippocampe présente différentes caractéristiques qui en font une zone très populaire pour étudier le réseau cortical. En effet, la ségrégation laminaire des cellules pyramidales ainsi que les différentes entrées d’informations atteignant le CA1 fournit la meilleure opportunité pour définir le lien entre les divers types cellulaires de cette région. De plus, le CA1 renferme seulement deux types de populations neuronales, à savoir glutamatergique et GABAergique; elle reçoit également le plus petit nombre d’entrées extrinsèques excitatrices – au nombre de trois, très peu par rapport au reste du cerveau – en provenance de la voie temporo-ammonique, du thalamus par le noyau reuniens et de l’amygdale (Somogyi et Klausberger, 2005). La zone CA1 se présente comme la zone la plus simple du cortex cérébral. Cependant, elle abrite une population particulièrement hétérogène de cellules GABAergiques. La simplicité de son architecture et sa diversité neuronale font donc la popularité de la zone CA1.
3 Figure 1 : Coupe transversale de l'hippocampe
A : alveus; O : str. oriens; PYR : str. pyramidale; RAD : str. radiatum ; LM : str. lacunosum moleculare; GD :
gyrus denté; CA1-CA2-CA3 : subdivisions de la corne d’Ammon. [Tiré et modifié de Ariel Ruiz i Altaba
4
1.2.2 Organisation neuronale
Différents types de cellules sont présents dans l'hippocampe, comme dans la majorité du système nerveux central. Les cellules les plus nombreuses sont les neurones pyramidaux qui doivent leur nom à leur forme évidente de pyramide. Ce sont des neurones excitateurs glutamatergiques. Ils constituent la majeure partie des cellules du str. PYR de la corne d'Ammon et sont également majoritaires dans diverses régions corticales. Ces cellules peuvent avoir un diamètre variable. En effet, les neurones pyramidaux du CA3-CA2 sont nettement plus larges et moins condensés que dans le CA1. Dans le gyrus denté, les neurones principaux sont les cellules granulaires. C’est d’ailleurs dans cette région que siège une population de précurseurs neuraux donnant lieu à une neurogénèse adulte.
L’inhibition synaptique est portée par les interneurones qui libèrent le neurotransmetteur inhibiteur GABA (acide gamma-aminobutyrique). Groupe neuronal hétérogène, les interneurones sont dispersés à travers toutes les couches de l’hippocampe. Il en existe plusieurs types qui sont répertoriés selon leur morphologie, leur patron de décharge, leur profile neurochimique et leur innervation des différents domaines subcellulaires des cellules pyramidales (Klausberger et Somogyi, 2008). Leur mécanisme d’action est commun : en relâchant le GABA sur leurs neurones cibles, ils induisent des courants inhibiteurs postsynpatiques par hyperpolarisation de la membrane de la cellule cible. La majorité des interneurones forme des synapses inhibitrices principalement sur les cellules pyramidales ce qui permet donc de moduler la sortie d’informations en régulant l’activité neuronale et la coordination des réseaux locaux (Freund et Buzsaki, 1996).
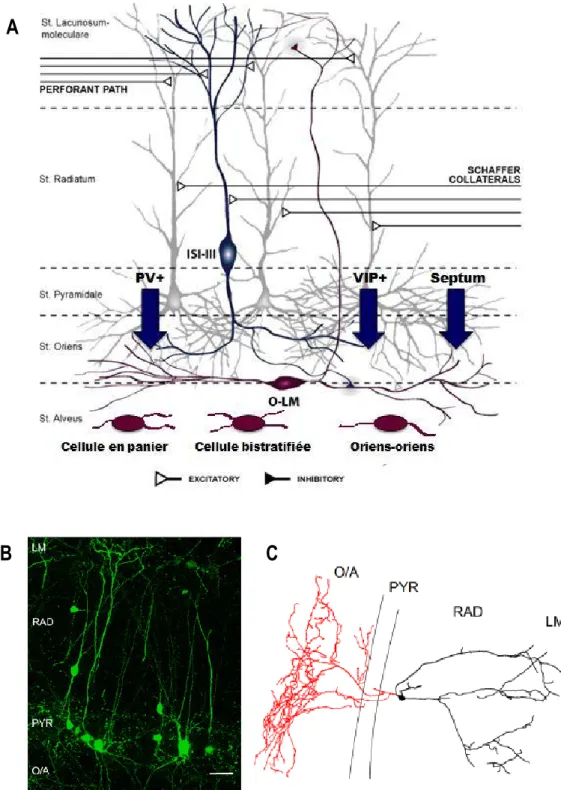
Dans cette étude, nous nous sommes intéressés en particulier aux interneurones de type oriens-lacunosum moleculare – O-LM – qui sont impliqués dans le circuit de rétroaction de l’inhibition de l’hippocampe. Nous allons donc aborder en détail leur organisation anatomique et fonctionnelle.
1.3 Les interneurones de type O-LM
Les interneurones de type O-LM doivent leur nom à leur structure anatomique : leur corps cellulaire et leurs dendrites horizontales sont présents dans le str. O de la zone CA1 et leur axone projette dans le str. LM du CA1 (Somogyi et Klausberger, 2005). C’est dans cette couche que l’axone se ramifie pour former un plexus dense créant des synapses inhibitrices sur les dendrites distales des
5
cellules pyramidales (Klausberger et Somogyi, 2008) au niveau de sites des afférences de la voie perforante, qui est une voie d’entrées excitatrices impliquée dans le mémoire spatiale et non spatiale. Former ces contacts confère aux O-LM le rôle d’élément majeur du circuit de rétroaction inhibitrice de l’hippocampe (Somogyi et Klausberger, 2005 ; Klausberger et Somogyi, 2008). Ce mécanisme de contrôle participe ainsi à la bonne intégration de l’information en provenance de la voie perforante contribuant ainsi à l’activité rythmique normale de l’hippocampe.
Les O-LM expriment un faible niveau de parvalbumine (PV) mais sont caractérisés par un fort taux de récepteurs glutamatergiques métabotropiques de type 1 (mGluR1α) dans leur membrane présynaptique; ils sont aussi connus pour exprimer la somatostatine (SOM; Somogyi et Klausberger, 2005).
À ce jour, il a été montré que l’activité des O-LM est régulée par quatre types de voies inhibitrices (Fig. 2A) : une projection inhibitrice en provenance des interneurones de l’hippocampe exprimant la PV (Lovett-Barron et al., 2012), une en provenance de ceux exprimant le peptide vasoactif intestinal localisés dans l’O/A (VIP; données préliminaires de notre laboratoire), une autre à partir de projections du septum (Chamberland et al., 2010) et une dernière provenant directement d’un sous-ensemble d’interneurones de l’hippocampe, les interneurones spécifiques aux interneurones (IS) de type III (IS-3; Acsády et al., 1996a,b; Gulyás et al., 1996; Chamberland et al., 2010).
Les IS-3, comme leur nom l’indique, sont spécialisés dans l’innervation exclusive d’autres cellules GABAergiques (Chamberland et Topolnik, 2012). Il existe trois types d’IS se distinguant par leur anatomie et l’expression de différents marqueurs neurochimiques. Les propriétés physiologiques de ces surprenantes cellules et leur intérêt fonctionnel pour le réseau sont encore inconnus. Les IS-3 co-expriment le VIP (Fig. 2B) et la calrétinine (CR). Ils sont localisés dans le str. PYR ou RAD et leur axone projette au str. O/A afin d’y contacter d’autres interneurones (Fig. 2C). Il a été montré que les IS-3 contactent de manière préférentielle les O-LM (Acsády et al., 1996b; Chamberland et al., 2010), mais également d’autres interneurones du str. O/A de la région CA1 tels que les cellules bistratifiées, les cellules en panier et les interneurones oriens-oriens (Fig. 2A; Tyan et al., 2014).
6
Figure 2 : Contrôle inhibiteur des O-LM, innervation et identification des cellules IS-3.
A : Projections inhibitrices convergeant sur les O-LM (flèches bleues) et cibles neuronales des IS-3 (cellules violettes). B : Image deux-photons (projection maximale d'un z-stack) de la région CA1 de l'hippocampe d'une souris VIP-eGFP montrant les caractéristiques morphologiques des interneurones positifs au VIP. C : Reconstruction anatomique (l'axone est rouge, les dendrites noires) d’une cellule IS-3 [Tiré de Tyan et al., 2014]
A
7
Finalement, il a été montré que les interneurones O-LM sont impliqués dans certaines maladies : ils sont perdus dans le str. O/A en conditions expérimentales d’épilepsie du lobe temporal (ELT) au bout de deux semaines (Houser and Esclapez, 1996; Morin et al., 1998; Cossart et al., 2001; Fig. 3). Les mécanismes à l’origine de cette perte sont inconnus mais des données récentes montrent des perturbations au niveau de la transmission excitatrice dans les O-LM qui pourraient jouer un rôle important dans leur vulnérabilité pendant l’ELT : des changements surviendraient sur les récepteurs glutamatergiques ionotropiques de type NMDA (Perez et al., 2006) et sur les métabotropiques (Sanon et al., 2010) contribuant ainsi à l’activité épileptiforme dans l’hippocampe. Mais la contribution de changements au niveau des mécanismes inhibiteurs restent encore à prouver. Dans la section suivante, nous traiterons alors des mécanismes inhibiteurs pouvant contrôler l’activité des interneurones.
1.4 Transmission synaptique inhibitrice ionotropique de
type GABAergique : mécanisme et régulation
1.4.1 Le récepteur GABAA
La transmission synaptique inhibitrice GABAergique se fait via deux types de récepteurs au GABA : les récepteurs ionotropiques GABAA (RGABAA) et les métabotropiques GABAB. Nous aborderons ici
seulement les RGABAA.
Le RGABAA est le principal récepteur présent au niveau des synapses de l’hippocampe. C’est une
glycoprotéine transmembranaire formant un canal ionique et dont l’ouverture dépend de la liaison sur son site de fixation du ligand GABA, permettant ainsi le passage des ions chlore et, en moindre proportion, des ions bicarbonate (Fig. 4A). Ce récepteur transmet donc des courants inhibiteurs postsynpatiques (IPSCs pour « inhibitory postsynaptic currents » ; pour la suite du mémoire, je fais le choix de garder le terme anglais qui est universellement utilisé) qui hyperpolarisent la membrane de la cellule postsynaptique. Hétéropentamérique, il est fait de l’assemblage de cinq sous-unités : 2 alphas (α1-6), 2 betas (β1-3) et une gamma (γ1-3) (Baumann et al., 2001; Klausberger et al., 2001; Sieghart et al., 2002).
8
Figure 3 : Neurones de la région CA1 du str. oriens de l'hippocampe.
Neurones contenant la somatostatine en conditions contrôles (A) et chez les rats traités à la pilocarpine (B) [Tiré et modifié de Cossart et al., 2001]
B A
9 Figure 4 : Représentation de la structure des récepteurs GABAA.
A : Le récepteur consiste en l’assemblage de cinq sous-unités formant un canal ionique perméable aux ions chlore. B : Localisation des sites de liaison pour le GABA et pour les benzodiazépines qui ont pour effet d’augmenter l’effet inhibiteur du GABA. [Tiré et modifié de Vinkers et Olivier, 2011].
A
10
Les sous-unités α jouent un rôle important dans l’affinité au GABA et dans la sensibilité à des agents modulateurs tels que les benzodiazépines, qui augmentent l’affinité du RGABAA pour les agonistes
(Fig. 4B). Leur action a pour effet de prolonger le courant postsynaptique inhibiteur et d’augmenter l’amplitude du pic ainsi que la conductance du canal ionique.
Les sous-unités α1, α2, α5, β1, β2, β3 et γ2 des RGABAA sont principalement présentes dans la
région CA1 de l’hippocampe (Sperk et al., 1997; Andersen et al., 2007; Patenaude et al., 2001). Ceci résulte en une importante hétérogénéité structurelle et donc fonctionnelle de ces récepteurs.
1.4.2. Combinaisons des sous-unités et cinétiques de courants associées.
Les synapses inhibitrices formées sur des interneurones par des interneurones présentent des propriétés spécifiques selon le type cellulaire. Un des mécanismes impliqués dans ces différences réside dans la composition en sous-unités du RGABAA, ce qui déterminera la cinétique des IPSCs
(Barberis et al., 2007). En effet, selon les combinaisons de ces sous-unités, les cinétiques de courants inhibiteurs associées avec l’ouverture du canal du RGABAA sont différentes. Par exemple,
la présence de la sous-unité α1 et α6 dans le récepteur est associée avec un courant rapide (Tia et al., 1996; Dunning et al., 1999; Okada et al., 2000; Bosman et al., 2005). Alors, qu’à l’inverse, la présence de la sous-unité α5 est responsable de la génération d’un courant plus lent (Caraiscos et al., 2004; Ali et Thomson, 2008; Salesse et al., 2011).
Les interneurones de l’hippocampe expriment un large éventail de sous-unités des RGABAA
conférant ainsi des propriétés différentes à leurs synapses inhibitrices (Nusser et al., 1995; Patenaude et al., 2001). L’expression préférentielle de certaines sous-unités par les interneurones est donc une conséquence de cette hétérogénéité. Par exemple, les interneurones O-LM vont exprimés au niveau de leur RGABAA la sous-unité α5 tardivement dans le développement (Yu et al.,
2006) ce qui résultera donc en un ralentissement des courants avec l’âge (Salesse et al., 2011). Dans cette étude, nous nous sommes concentrés sur la sous-unité α5, nous allons donc faire un récapitulatif des connaissances actuelles.
11
1.5 La sous-unité alpha 5
1.5.1 Présence et rôle dans l’hippocampe
La sous-unité α5 est une des sous-unités α les plus exprimées dans l’hippocampe (Sperk et al., 1997; Fig. 5), se retrouvant à hauteur de 25% dans les RGABAA (Wisden et al., 1992; Sur et al.,
1998; Pirker et al., 2000). Son expression est augmentée entre le dixième et le trentième jour après la naissance (Yu et al., 2006).
La localisation de cette sous-unité dans l’hippocampe suggère qu’elle peut être impliquée dans les processus physiologiques sous-jacents à l’apprentissage et à la mémoire. En effet, il a été montré que la sous-unité α5 jouerait un rôle clé dans la modulation de la cognition : des études menées sur des souris ne possédant pas la sous-unité α5 (souris Gabra 5-/- KO, de l’anglais «knock-out ») ont
montré de meilleures performances à des tests d’apprentissage spatial tel que le labyrinthe de Morris (Collinson et al., 2002). Diminuer l’activité GABAergique en utilisant des agonistes inverses de cette sous-unité ont également permis d’observer des résultats similaires (Dawson et al., 2006). De plus, l’utilisation de ce type d’agonistes a pu inverser les déficits fonctionnels et neuromorphologiques induits par le syndrome de Down (Martίnez-Cué et al., 2013).
La sous-unité α5 est principalement exprimée à des sites extrasynaptiques (Fritschy et al., 1998; Bruning et al., 2002; Christie et al., 2002; Crestani et al., 2002) dans les cellules pyramidales, où elle est donc impliquée dans l’inhibition tonique (Pirker et al., 2000; Caraiscos et al., 2004; Glykys et Mody, 2006; Serwanski et al., 2006). L’inhibition tonique est un signal lent dont la transmission se produit à l’extérieur des synapses. Le neurotransmetteur GABA diffuse dans l’espace extracellulaire et va se lier au niveau des RGABAA dispersés sur toute la membrane de la cellule. Ce phénomène
engendre une diminution de l’excitabilité de la cellule qui se traduit par une baisse de la probabilité de la génération d’un potentiel d’action. Cependant, il est intéressant de souligner que cette sous-unité est également présente à un moindre degré au niveau de synapses où elle contribue cette fois-ci à une inhibition phasique des interneurones (Ali et Thomson, 2008; Zarnowska et al., 2009; Salesse et al., 2011). L’inhibition phasique est un signal de transmission synaptique rapide et transitoire. Le neurotransmetteur GABA est relâché dans la fente synaptique et va se lier aux RGABAA postsynaptiques ce qui fournira une hyperpolarisation de quelques millisecondes au
12
Figure 5 : Diversité des sous-unités alpha des récepteurs GABAA.
A. Distribution comparée des sous-unités α du RGABAA dans l’hippocampe du rat. B. Distribution de la sous-unité α5 dans l’hippocampe. [Tiré et modifié de Sperk et al., 1997].
13
En terme de combinaison avec les autres sous-unités dans les RGABAA, α5 s’associe
préférentiellement avec la sous-unité β3 (Sur et al., 1998) mais peut aussi s’associer à une α1 (Fritschy et Mohler, 1995).
Récemment, il a été montré que l’incorporation spécifique de la sous-unité α5 des RGABAA au
niveau des synapses faites sur les dendrites des interneurones O-LM pourrait contrôler leur activité. Présente dans l’hippocampe mature, son incorporation résulterait en un ralentissement des courants avec l’âge (Salesse et al., 2011) : en effet, les cinétiques de courant chez la souris adulte (P26-40) sont ralentis, ce qui engendre donc une augmentation de l’inhibition (Salesse et al., 2011). Cependant, les mécanismes cellulaires et moléculaires du trafic de la sous-unité α5 restent largement inconnus.
1.5.2 Radixine, protéine d’ancrage de la sous-unité α5
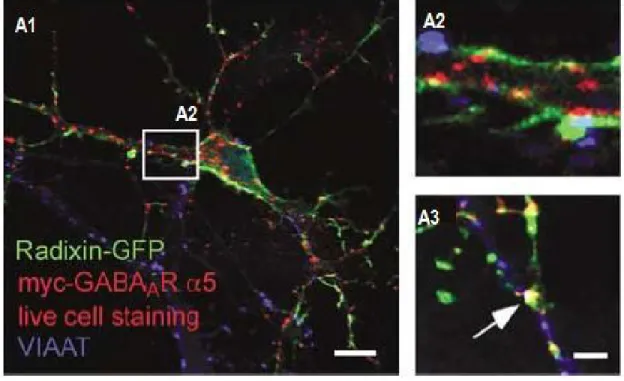
La protéine radixine est un membre de la famille des protéines du cytosquelette ERM (Ezrin/Radixin/Moesin). Elle présente différents rôles, dont celui notamment d’être impliquée dans la liaison des filaments d’actine, la rendant alors essentielle dans l’organisation du cytosquelette cortical du neurone. Elle joue également un rôle dans la motilité, l’adhésion et la prolifération cellulaire (Tsukita et al., 1997; Hoeflich et Ikura, 2003). De plus, des études ont montré que radixine est aussi impliquée dans l’insertion membranaire de la sous-unité α5 des RGABAA (Neisch et Fehon, 2011).
Localisées toutes deux dans les neurones (Fig.6), radixine et la sous-unité entrent en interaction suite à l’activation préalable de la protéine par phosphorylation (Loebrich et al., 2006). Une fois activée sous forme de phosphoradixine, elle est impliquée dans l’insertion membranaire des RGABAA en étant essentielle pour l’ancrage de la sous-unité α5 au cytosquelette (Loebrich et al.,
2006).
Des études ont également associé la protéine radixine à des maladies humaines tels que le cancer ou l’épilepsie. La croissance de protrusions neuronales, la formation de nouveaux contacts et de nouveaux récepteurs sont des caractéristiques bien établies de cette maladie auxquels ont été associées différentes protéines; en sa qualité de protéine du cytosquelette, radixine a été identifiée comme en étant un des acteurs (Majores et al., 2005).
14
Figure 6: Localisation synaptique de radixine, α5-RGABAA et de « clusters » de radixine/α5-RGABAA.
A : Expression neuronale de radixine-GFP et de α5-RGABAA-myc (A1; échelle : 20µm). Des groupes de radixine/α5-RGABAA se trouvent à des synapses inhibitrices exprimant le VIAAT (A2,A3; échelle : 3µm). [Tiré et modifié de Loebrich et al., 2006].
15
2.
L’épilepsie du lobe temporal
2.1 Généralité et structures cérébrales impliquées dans la
maladie
L’épilepsie est une maladie neurologique mal connue, qui touche près de 50 millions de personnes à travers le monde. Elle se caractérise par la répétition de crises imprévisibles, soudaines et souvent très brèves, qui prennent des formes très diverses. Ces crises ont une origine cérébrale, elles sont la traduction physique d’une hyperactivité de réseaux de neurones excitateurs liée à des décharges électriques inhabituelles. Un déséquilibre excitation-inhibition se créé, aboutissant alors à une activité électrique anormale qualifiée de paroxystique. Cette hyperactivité trouve de multiples origines : génétique, malformations congénitales, traumatismes ou, comme dans la majorité des cas, de causes inconnues. Les nombreuses étiologies et les différentes zones cérébrales pouvant être atteintes donnent lieu à divers syndromes épileptiques, différant par leur physiopathologie et leur mécanisme.
L'une des régions cérébrales la plus souvent atteinte par un foyer épileptique est le lobe temporal. L’épilepsie du lobe temporal est donc la forme d’épilepsie la plus fréquente chez l’adulte et reste difficilement contrôlable par des traitements antiépileptiques (Wiebe et al., 2001). Le cerveau des patients ELT présente un modèle typique de dommages : la sclérose temporale qui résulterait du
status epilepticus (Avoli et al., 2005). Les structures du lobe temporal les plus impliquées et affectées
dans l’ELT sont les structures limbiques tels que l'hippocampe, le cortex entorhinal et le complexe amygdalien. L’hippocampe étant un des sites d’origine des décharges épileptiques, il est par conséquent touché par cette sclérose et subit de nombreux changements.
2.2 L’hippocampe dans l’épilepsie
Une des théories classiques de l’épileptogenèse est basée sur l’hypothèse que la réduction de l’inhibition dans les réseaux neuronaux est la cause de leur hyperexcitabilité, conduisant donc à l’apparition de crises (Olsen et Avoli, 1997; Avoli, 2000). À l’appui de ce point de vue, des études ont montré que la majorité des anomalies observées lors de l’ELT dans l’hippocampe conduisent à une réorganisation structurelle et fonctionnelle de son réseau neuronal (Avoli et al., 2005; Andersen et al., 2007), impliquant, entre autres, une perte sélective de certains types d’interneurones GABAergiques (Sloviter, 1987; Houser et Esclapez, 1996; Morin et al., 1998a-b; Cossart et al., 2001) et des
16
changements dans plusieurs sous-unités du RGABAA (Olsen et al., 1992; Houser et Esclapez, 2003;
Avoli et al., 2005).
2.2.1 Modification du réseau inhibiteur GABAergique 2.2.1.1 Perte sélective d’interneurones
Dans l’ELT, la perte sélective de cellules de l’hippocampe est un phénomène bien connu et déjà bien décrit (Dam, 1980; Babb et al., 1989). Dans les différents modèles animaux de l’ELT (Sloviter, 1987; Houser et Esclapez, 1996; Morin et al., 1998b), des études immunohistochimiques ont montré que les interneurones de la zone CA1 positifs à la glutamate décarboxylase étaient préférentiellement vulnérables (Houser et Esclapez, 1996 ; Morin et al., 1998, Cossart et al., 2001), et plus spécialement les interneurones positifs à la PV et à la SOM localisés dans le str. O/A (Sanon et al., 2005). Plus précisément encore, Cossart et al. (2001), ont montré que ces interneurones du str. O contenant la SOM étaient les interneurones O-LM et dégénéraient au bout de deux semaines de la maladie (Morin et al., 1998).
2.2.1.2 Changements dans la composition des sous-unités du RGABAA
Les sous-unités spécifiques des RGABAA peuvent être régulées de manière différente chez les
animaux modèles de l’ELT pendant le stade chronique de la maladie. Les altérations dans ces sous-unités sont complexes et inclues à la fois une augmentation ou une diminution de leur expression. Une surexpression de certaines sous-unités des RGABAA dans le gyrus denté à été décrite dans
plusieurs modèles animaux de l’ELT. Cette augmentation de l’expression de ces sous-unités a été généralement considérée comme étant un phénomène compensatoire des les modèles épileptiques (Fritschy et al., 1999).
Une diminution de l’expression de certaines sous-unités des RGABAA a également été observée
chez des animaux présentant des crises d’épilepsies récurrentes. La plupart des exemples de ces diminutions d’expression a été trouvée dans la zone CA1 et concerne entre autres la sous-unité α2 et α5 (Rice et al., 1996 ; Fritschy et al., 1999). Considérant α5, Houser et Esclapez (2003) ont montré que l’expression de cette sous-unité chez des rats épileptiques chroniques était diminuée dans la zone CA1. Ces données montrent que l’expression de la sous-unité α5 peut être diminuée de manière prolongée dans l’ELT. De telles baisses de l’expression des sous-unités des RGABAA sont
17
importantes à considérer puisqu’elles pourraient contribuer à la diminution de l'inhibition fonctionnelle et donc à l'activité des crises d’épilepsie.
Ensemble, toutes ces données de la littérature scientifique nous montrent que les mécanismes de l’inhibition des interneurones sont mal connus et que, dans les interneurones de type O-LM, ces mécanismes peuvent impliquer la sous-unité α5 des RGABAA. Cependant, les mécanismes de
l’expression et la fonction de cette sous-unité dans des conditions normales et pathologiques restent à déterminer.
Hypothèse
Puisque les synapses formées par les cellules IS-3 sur les interneurones O-LM montrent une cinétique lente, et que l’expression de la sous-unité α5 des RGABAA au niveau synaptique est
associée avec une cinétique lente des courants inhibiteurs, nous allons, dans la première partie de cette étude, tester l’hypothèse selon laquelle la sous-unité α5 des RGABAA est présente dans les
synapses IS3-O-LM.
Dans la deuxième partie de cette étude, nous allons tester l’hypothèse selon laquelle la sous-unité α5 est importante dans le fonctionnement des interneurones LM et que la perte sélective des O-LM pourrait être initiée par leur désinhibition qui pourrait, elle-même, être causée par une perte de α5 pendant l’ELT.
Objectifs spécifiques
Le premier objectif de cette étude était de tester l’expression de la sous-unité α5 sur les synapses formées par les IS-3.
Le deuxième objectif était de comparer l’expression de la sous-unité α5 et de sa protéine d’ancrage, radixine, dans les conditions normales et expérimentales de l’ELT. Etude de l’expression de α5 et de radixine dans le stade aigu de l’ELT (ce qui peut initier l’hyperexcitabilité des O-LM et leur perte plus tard).
19
Matériel et méthodes
1. Génotypage
Toutes les expériences impliquant des animaux ont été menées en conformation avec les directives de protection des animaux du Comité de Protection des Animaux de l'Université Laval (CPAUL). Des souris transgéniques VIP-eGFP (University of California) et des souris B6(Cg)-Calb2tm1(cre)Zjh/J (The Jackson Labs) mâles et femelles ont été utilisées pour toutes les expériences réalisées. Afin de génotyper ces animaux, il a fallu dans un premier temps extraire leur ADN. Pour ce faire, des « punchs » d’oreille ont été prélevés sur chacun des animaux. Les échantillons de peau ont été mis dans un tampon de lyse pour être digérés sous l’action de la protéinase K à 55 °C pendant la nuit. Le lendemain, après précipitation et extraction, l’ADN a été amplifié et utilisé pour la technique de réactions de polymérisation en chaîne (PCR). Dans ce but, deux couples d’amorces ont été utilisés : le type sauvage « forward » ACC TGG AGA TTG TGC TCT GC/type sauvage « reverse » GGG AAG CCA AAG AGA AAA GG et type mutant « forward » GCG GTC TGG CAG TAA AAA CTA TC/type mutant « reverse » GTG AAA CAG CAT TGC TGT CAC TT. Ces amorces ont été utilisées dans le but de déterminer le génotype des souris afin d’isoler celles étant homozygotes pour l’allèle du gène codant pour l’enzyme (Cre+/+). Les animaux homozygotes ont ensuite été utilisés pour les injections
stéréotaxiques de constructions virales.
2. Modèle expérimental de l’épilepsie du lobe
temporal : le modèle pilocarpine
Les crises d’épilepsie ont été induites chez les souris B6(Cg)-Calb2tm1(cre)Zjh/J (18,5-22,5g) par
l’injection de pilocarpine, un agoniste cholinergique muscarinique. Le protocole d’injection a été similaire à ceux décrits précédemment (Turski et al., 1983; Curia et al., 2008). Une faible dose de méthyle scopolamine nitrate (1mg/kg, i.p., Sigma, St. Louis, MO), un antagoniste cholinergique, a été administré 30 minutes avant l’injection de pilocarpine afin de réduire les effets cholinergiques en périphérie. Les animaux du groupe expérimental ont reçu une unique injection de pilocarpine (330mg/kg, i.p., Sigma) dissout préalablement dans de la saline stérile à 0,9%. Les souris contrôles ont reçu une injection similaire de scopolamine et, après 30 minutes, une injection de saline stérile. Après l’injection de pilocarpine, les souris ont été replacées dans leur cage et observées pendant
20
deux heures pour déterminer la sévérité et la durée des crises aigues d’épilepsie en se référant à l’échelle de Racine (Racine, 1972). Dans cette étude, les crises aigues comportementales induites chez les animaux traités à la pilocarpine ont été arrêtées par injection de diazepam (5mg/kg, i.p., Sandoz). Les animaux ont ensuite été utilisés pour les études immunohistochimiques 3 à 5 jours et 30 à 45 jours après l’injection de pilocarpine, ce qui correspond ici respectivement au stade aigu et chronique de la maladie.
3. Préparation des tranches
Les tranches transversales d’hippocampe ont été préparées à partir de cerveau de souris transgéniques B6(Cg)-Calb2tm1(cre)Zjh/J (The Jackson Labs) mâles et femelles (P42-P66). Avant de
retirer le cerveau de la souris, il a été pratiqué des perfusions intracardiaques au sucrose glacé dans le but d’améliorer la qualité des tranches des animaux âgés. Dans un premier temps, la souris a été endormie par kétamine-xylazine (0,1mL/10g, i.p.); après s’être assuré de la profondeur de l’anesthésie indiquée par une non réponse de la souris à un petit pincement de la patte, il faut ouvrir la cage thoracique pour accéder au cœur. Puis, très rapidement il faut faire une petite incision dans l’atrium droit suivie par l’introduction d’une seringue de 20mL dans le ventricule gauche afin de perfuser une solution de sucrose glacé. Les organes sont supposés pâlir au passage du sucrose, le foie devenant « blanc » est un bon indicateur. Puis, il faut décapiter la souris, disséquer délicatement le cerveau et le transférer dans une solution de sucrose glacé (0 à +4°; en mM : 2KCl, 1.25 NaH2PO4, 7 MgSO4, 26 NaHCO3, 10 glucose, 250 sucrose, 0.5 CaCl2) et oxygénée (95% O2 et 5%
de CO2). Les tranches sont coupées en utilisant un vibratome puis elles sont transférées dans une solution chauffée et oxygénée dite de récupération (en mM : 124 NaCl, 2.5 KCl, 1.25 NaH2PO4, 26
NaHCO3, 3 MgSO4, 2CaCl2 et 10 de glucose) dans laquelle les tranches seront laissées pour une
heure.
4. Enregistrement électrophysiologiques :
technique du « patch-clamp »
Pour les enregistrements électrophysiologiques, les tranches d’hippocampe ont été transférées dans une chambre d’enregistrement et perfusées continuellement (2 mL/min) avec une solution de liquide
21
cérébrospinal artificiel contenant (ACSF; en mM) : 124 NaCl, 2.5 KCl, 1.25 NaH2PO4, 26 NaHCO3, 2
MgSO4, 2CaCl2 et 10 de glucose (pH 7.3, oxygéné) et proche de la température physiologique (32 ± 1°C). Les interneurones d’intérêt de la zone CA1 du str. O/A de l’hippocampe ont été identifiés visuellement avec une caméra infrarouge montée sur un microscope droit à fluorescence (Zeiss Axioscope) équipé d’un objectif 40X à immersion dans l’eau (NA, 0.8) et d’une caméra infrarouge. Les interneurones exprimant mCherry ont été identifiés grâce à la lumière verte (filtre : 515-560 nm). Les pipettes pour les enregistrements cellulaires (3.5-6MΩ) ont été réalisées à partir de capillaires de verre en borosilicate avec un « Flaming/Brown micropipette puller » (Sutter Instrument Co.). Les enregistrements de « patch-clamp » en configuration cellule-entière ont été obtenues à partir de cellules seules et effectués en mode « voltage-clamp » à 0 mV durant lesquels la solution intracellulaire, dite solution de patch, contenait (en mM) : 130 CsMeSO4, 5CsCl, 2MgCl2, 10
phosphocréatine, 10 HEPES, 0.5 EGTA, 2 ATP-Tris, 0.2 GTP-Tris, 0.3% de biocytine (pH 7.2-7.3; 280-290 mOsm/L). L’acquisition des données (filtrées à 2-3 kHz et numérisées à 10kHz) a été faite par un amplificateur de type Multiclamp 700B et le logiciel Clampex 10.2 (Molecular Devices, Union City, CA, USA).
Les propriétés membranaires passives, incluant le potentiel de repos membranaire, la résistance membranaire et la capacitance de la membrane, ont été relevées immédiatement après l’ouverture de la cellule par rupture de sa membrane. La résistance en série (Rser; 5-25 MΩ) a été surveillée continuellement pendant les expériences en appliquant une petite hyperpolarisation de -5 mV à la fin de chaque tracé enregistré. Un changement dans la Rser de plus de 20% provoquait l’arrêt des enregistrements.
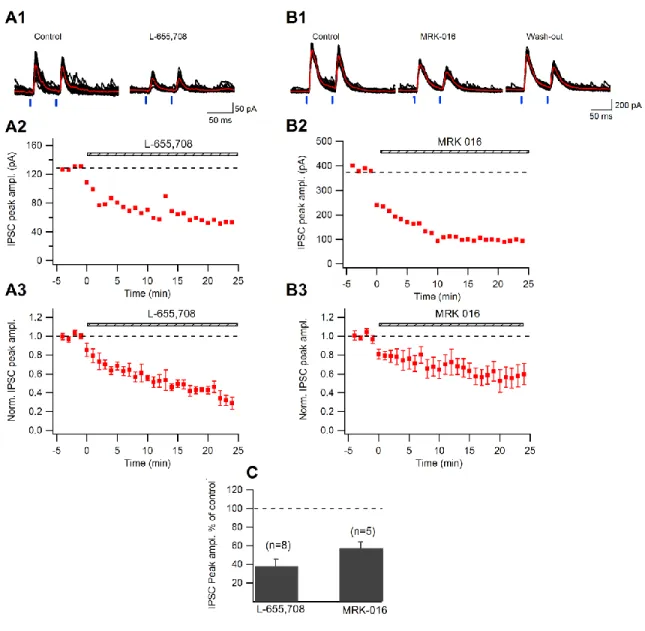
Puisque nous travaillons à 0 mV, qui est le potentiel d’inversion glutamatergique, il a été important de tester que la dépolarisation des interneurones seule n’affectait pas les propriétés des IPSCs; ce phénomène est appelé DSI (de l’anglais « depolarization-induced supporession of inhibiton ») et a déjà été montré dans l’hippocampe (Patenaude et al., 2001). Pour ces expériences, l’antagoniste des récepteurs glutamatergiques L-AP5 (100µM, Abcam) et NBQX (10µM, Abcam) ont été utilisés. Pour le contrôle des expériences d’optogénétique, le bloqueur des canaux sodiques – la tétrodotoxine (TTX; 1µM; Alomome Laboratories) – a été appliqué afin de tester l’origine physiologique des IPSCs émis par la lumière. Deux agonistes inverses de la sous-unité α5 du RGABAA, le L-655,708 (50mM,
Tocris) ou le MRK 016 (100µM, Tocris), ont été utilisés dans les expériences pour attester de la présence ou non cette sous-unité à différentes synapses.
22
5. Injection stéréotaxique : ciblage optogénétique
et pharmacogénétique des interneurones
L’expression de la channelrhodopsin 2 (ChR2) a été induite dans les interneurones positifs à la CR (CR+) en utilisant l’approche Cre-loxP. Les animaux B6(Cg)Calb2tm1(cre)Zjh/J homozygotes (P21-P42)
ont été utilisés. Il a été montré précédemment par mes collègues (Tyan et al., 2014) que ces souris homozygotes ne montrent pas le phénomème de « Cre leakage ». En effet, après analyse des immunohistochimies faites contre la CR et le mCherry, aucun Cre leakage n’a été observé dans les animaux homozygotes ou hétérozygotes. Les souris ont été anesthésiés par une injection de kétamine/xylazine (0,1mL/10g, i.p.). L’analgésqiue (Anafen, 0,04 à 0,1mL/10g, s.c.) était administré en pré-opératoire selon les nouvelles directives du CPAUL de l’Université Laval. Ensuite, les animaux étaient installés dans un appareil stéréotaxique (Kopf Instruments, CA, USA) et une craniotomie bilatérale était effectuée selon les coordonnés calculées à partir du bregma : Antéro-Postérieur=± 2,25, Médio-Latéral=+2,2, Dorso-Ventral= - 1,4. Attachée à son support (Nanoliter 2000, World Precision Instruments), la pipette d’injection était abaissée lentement afin de s’insérer dans l’hippocampe à une vitesse d’environ 1mm/min. Puis, le virus adéno-associé rAAV5-EF1a-DIO-hChR2(H134R)-mCherry-WPRE-pA (4 x 1012 molecules virales /mL; Vector Core Facility, University
of North Carolina, USA) contenu dans la pipette était injecté dans l’hippocampe de chacun des hémisphères. Un volume total de 500nL était injecté en une fois à une vitesse de 3nL/s. Une minute après l’injection, la pipette était remontée très lentement, le scalp hydraté avec de la saline et suturé; l’animal était ensuite replacé dans sa cage, laquelle était posée sur un tapis chauffant afin de permettre à l’animal de se réveiller et de récupérer dans des conditions optimales.
L’activation des interneurones CR+ (et leur axone) qui expriment la ChR2 a été faite par une stimulation avec la lumière bleue (deux stimulations de 5 ms chacune séparées d’un intervalle de 50 ms) contrôlée par un obturateur ultrarapide (Uniblitz, Electronic) via l’objectif 40X à immersion dans l’eau (NA, 0.8). Les courants postsynaptiques inhibiteurs évoqués par la lumière (IPSCLs) enregistrés
dans la cellule postsynaptique (interneurones horizontaux du stratum O/A du CA1) ont été enregistrés à 0 mV. Ces IPSCLs ont été enregistrés en condition contrôle avec une perfusion d’ACSF
23
Nous avons également utilisé l’approche pharmacogénétique par l’injection d’un virus DREADDs (de l’anglais « Designer Receptors Exclusively Activated by Designer Drugs »), le rAAV8/hSvn-DIO-hm4D(Gi)-mcherry, dans des animaux B6(Cg)Calb2tm1(cre)Zjh/J homozygotes. Le but ici était d’induire
l’expression d’un récepteur couplé à une protéine G dans les interneurones CR+ en utilisant l’approche Cre-loxP et de moduler leur activité par l’activation du récepteur via une petite molécule inerte exogène, la clozapine-N-oxide (CNO). Le but était de rendre silencieux ces interneurones afin d’étudier leur contribution dans l’inhibition des O-LM. Nous avons fait des expériences contrôles en enregistrant, dans un premier temps, l’activité spontanée dans les interneurones CR+. Puis, dans un deuxième temps, nous avons fait le même type d’enregistrements en présence de CNO. Mais les effets induits par le CNO étaient très variables; en effet, dans certaines expériences son action était visible et dans d’autres expériences beaucoup plus incertaine. Notons que ces résultats ne sont pas analysés dans cette étude. Cependant, les cellules remplies avec de la biocytine pendant les enregistrements électrophysiologiques ont été utilisées pour une étude anatomique qui sera traitée dans les résultats.
6. Analyse des données
L’analyse des donnés des enregistrements électrophysiologiques a été réalisée en utilisant les logiciels Clampfit 10.2 (Molecular Devices) et Igor Pro 6.2 (Wave Metrics Inc.). Pour analyser les propriétés des IPSCLs, 30 tracés ont été enregistrés. Les tracés contaminés par une activité
spontanée ayant lieu juste avant ou pendant l’acquisition ont été supprimés. Les échecs ont été conservés. L’amplitude des IPSCLs correspond à la valeur mesurée entre le début de la réponse
inhibitrice et le sommet. Pour la cinétique des ces courants, le temps de montée de la réponse a été calculée à 20-80% et le taux d’affaiblissement τ été calculé à l’aide d’une courbe exponentielle à 100-37%. La conductance synaptique a été déterminée à partir de l’équation suivante : I=Gx(Vhold-Vrev) où I : pic d’amplitude du courant (pA), G : la conductance synaptique (nS), Vhold : le potentiel de maintien et Vrev : le potentiel de réversion des IPSC déterminé expérimentalement dans les O-LM (-71.9 ± 1.2 mV; Salesse et al., 2011). Les données de groupe (les graphiques temporels et les graphiques en barres) ont été normalisées en fonction de l’amplitude moyenne calculée pendant la période contrôle des enregistrements (période de 5 minutes).Toutes les données sont présentées
24
sous la forme de moyenne ± SEM. La signification statistique a été évaluée soit avec test de Student apparié ou non apparié ou avec un test de Mann-Whitney (*p<0.05, **p<0.01, ***p<0.001).
7. Analyse morphologique et neurochimique
Pour les reconstructions anatomiques post hoc, tous les neurones enregistrés pendant les expériences de « patch-clamp » ont été remplis avec de la biocytine (Sigma). Les tranches avec les cellules enregistrées ont été fixées durant la nuit avec du paraformaldéhyde (PFA) 4% à 4°C et puis conservées dans du PB (tampon phosphate; 0,1mM) et sodium azide (0,03%). Pour révéler la biocytine, les tranches de 300 µm d’épaisseur ont été perméabilisées avec 0.3% de Triton X-100 dans du TBS (tampon tris-sodium) pendant 30 min et ensuite bloquées pendant 1h dans du NHS (sérum normal de cheval) à 20% et du Triton à 0.3% dans du TBS. Finalement, les tranches ont été incubées en présence d’Alexa Fluor 488 conjugué à la streptavidine (1 :1000, Life technologies) durant deux nuits à 4°C. Le jour suivant, les tranches ont été rincées et montées sur des lames de microscope avec un médium de montage fluorescent, le Dako (Dako North America Inc.). Les images confocales avec les interneurones remplis de la biocytine ont été obtenues en utilisant un système d’imagerie Leica TCS SP5 couplé à un laser Argon à 488nm. Les « Z-stacks » ont été acquis en utilisant un objectif 20x (NA, 0.8) à immersion dans l’huile. Les reconstructions anatomiques ont été réalisées grâce au logiciel Neurolucida 8.26.2 (MBF Bioscience, Williston, VT, USA).
Pour les analyses immunohistochimiques des marqueurs moléculaires exprimés par les interneurones, les tranches contenant les cellules enregistrées et précédemment traités pour révéler la biocytine, ont été testées pour l’expression de différents marqueurs. Les sections ont été rincées en PBS (tampon phosphate salin) puis bloquées pendant 1h dans du NHS à 10% et du Triton X-100 à 0.25% dans du PBS. Puis, les anticorps primaires suivants ont été utilisés : un anticorps du lapin dirigé contre le récepteur muscarinique de type 2 (M2R ; 1:2000; Abcam; AB2805), un anticorps de rat contre la SOM (1 :500, Millipore, MAB354) et un anticorps de souris contre la PV (1 :1000 ; Sigma ; P3088). Les « Z-stacks » ont été obtenus en utilisant le système d’imagerie Leica TCS SP5 couplé aux lasers Argon 488 nm, HeNe 543 nm et HeNe 633 nm.
25
8. Immunohistochimie
Les animaux contrôle et ceux traités avec la pilocarpine ont subi une perfusion intracardiaque avec du chlorure de sodium à 0,9% (NaCl) suivi de PFA à 4%. Les cerveaux ont ensuite été post-fixés pendant la nuit dans le PFA. Puis ils ont été coupés au vibratome en sections de 50 µm d’épaisseur. Les tranches ont été rincées en PBS, traitées avec du peroxyde d’hydrogène (H2O2) à 0,3% et
perméabilisées dans une solution de Triton à 0.2%-PBS à température pièce. Puis, les tranches ont été incubées à 4°C durant toute une nuit avec les anticorps primaires dans une solution contenant du BSA à 4%, du Triton à 0.2% et du PBS (anticorps de lapin dirigé contre radixine, 1 :300, Abcam, ab52495; anticorps de lapin dirigé contre la sous-unité α5 des RGABAA, 1 :200, Abcam, ab10098;
anticorps de souris anti-transporteur vésiculaire du GABA (VGAT), 1 :500, Synaptic Systems, 131-011; et un anticorps de rat contre la SOM, 1 :200, Abcam, ab128717). Après trois rinçages consécutifs en PBS pendant 30 minutes, les tranches ont été incubées avec les anticorps secondaires (Cy 3 dirigé contre les anticoprs de lapin, 1 :200, Dylight 633 contre l’anticorps de souris, 1 :200 et Dylight 488, 1 :200, contre l’antociprs du rat, Jackson ImmunoResearch).
Différents types de contrôles ont été utilisés. Les contrôles par omission des anticorps primaires et contrôles en présence d’anticorps secondaires. Un contrôle supplémentaire a été utilisé pour la sous-unité α5 en faisant une immonohistochimie sur des tranches de cerveau de souris ne possédant pas le gène codant pour la sous-unité α5, Gabra5-/- KO.
9. Microscopie confocale
Les images ont été acquises à l'aide d'un microscope confocal Leica SP5 à balayage séquentiel couplé avec des lasers Argon 488, 543 et HeNe 633. L’intensité du marquage immunohistochimique et la colocalisation de radixine, de la sous-unité α5, du VGAT et de la SOM ont été analysées en utilisant le logiciel Leica LAS AS. Le degré de colocalisation a été déterminé en utilisant le coefficient de Pearson.
27
Résultats
1. Identification des IS-3 dans le modèle de souris
transgénique VIP-eGFP
Pour cibler les IS-3 de manière spécifique, nous avons combiné la technique d’enregistrements électrophysiologiques avec les outils optogénétiques dans des de tranches d’hippocampe de deux types de souris transgéniques : le modèle VIP-eGFP et CR-Cre. Puisque les IS-3 expriment le VIP, nous avons travaillé initialement avec le modèle de souris VIP-eGFP pour cibler les interneurones du CA1 de l’hippocampe qui expriment le VIP (VIP+). En premier lieu, le but a été de valider l’utilité de ce modèle de souris transgénique.
Dans un premier temps, un marquage pour le GFP et le VIP a montré une parfaite colocalisation entre ces deux marqueurs. Après comptage des cellules dans les différentes couches de la zone CA1 de l’hippocampe, toutes les cellules exprimant le GFP étaient VIP+ (n=398/398 cellules, trois animaux ; Fig. 7A, 7B). Ce résultat indique que le modèle de souris VIP-eGFP serait un modèle approprié pour étudier les cellules exprimant le VIP et plus particulièrement pour cibler les IS-3. Dans un deuxième temps, un marquage pour le GFP et la CR a été réalisé puisque des études précédentes ont montré que les IS-3 représentaient une sous-population d’interneurones exprimant le VIP et la CR (Acsády et al., 1996a, 1996b ; Gulyás et al., 1996). Ces cellules sont généralement situées dans le str. PYR et RAD (Acsády et al., 1996a, 1996b ; Chamberland et al., 2010). L’analyse des résultats des immunhistochimies par comptage du nombre de cellules par couches cellulaires ont montré que la majorité des cellules positives au GFP co-exprimant la CR étaient localisées dans le str. PYR et RAD (respectivement 42.3 ± 5.8% et 22.9 ± 4.1 ; n=10 tranches, 2 animaux ; Fig. 7C,7D). Ces cellules semblent bien correspondre aux IS-3.
Donc, le modèle de souris VIP-eGFP sera utile pour enregistrer l’activité des cellules VIP+, incluant les IS-3, et étudier leurs propriétés. Cependant, pour ce qui est de manipuler les cellules IS-3, il faut avoir un modèle de souris Cre, qui exprime la recombinase Cre dans les interneurones spécifiques aux interneurones (ISs).
28
Figure 7 : Identification des cellules IS-3 dans le modèle de souris VIP-eGFP.
A. Images confocales montrant le marquage par immunohistochimie pour le GFP (gauche), le VIP (milieu) et la superposition des deux marqueurs (droite). B. Graphique en barres montrant le pourcentage de colocalisation entre le GFP et le VIP dans les différentes couches de la zone CA1 de l’hippocampe. C. Images confocales montrant le marquage par immunohistochimie pour le GFP (gauche), la CR (milieu) et la superposition des deux marqueurs (droite).D. Graphique en barres montrant le pourcentage de colocalisation entre le GFP et la CR dans les différentes couches de la zone CA1 de l’hippocampe.
29
2. Identification des IS-3 dans le modèle de souris
transgénique CR-Cre.
Puisque les IS-3 sont connus pour exprimer la CR (Acsády et al., 1996a, 1996b ; Gulyás et al., 1996), il serait donc intéressant d’avoir un modèle de souris valide qui nous permettrait de manipuler les cellules CR+.
Tout d’abord, nous avons injecté le virus adéno-associé appartenant à la famille des DREAADs – le rAAV8/hSvn-DIO-hm4D(Gi)-mCherry – dans l’hippocampe de souris CR-Cre afin d’exprimer uniquement le récepteur hm4D et le mCherry dans les cellules qui expriment la CR.
En cohérence avec des études précédentes, nous avons identifié deux sous-types différents de cellules CR+ dans l’hippocampe de ces souris.Le premier type identifié a été les cellules IS-3 (Fig. 8A, 8B). Leur corps cellulaire était localisé dans le RAD ou dans le PYR avec des dendrites orientées verticalement, traversant le RAD et se ramifiant largement dans le LM. La moitié de ces cellules présente des dendrites orientées de manière bipolaire susceptibles de recevoir les entrées de toutes les couches du CA1 (Fig. 8A). L’autre moitié révèle un arbre dendritique monopolaire avec des ramifications dans le LM, montrant leur excitation majeure à travers les projections temporoammoniques et thalamiques (Fig. 8B). Dans tous les cas, l’axone de ce type cellulaire projette localement pour innerver quasi exclusivement l’O/A.
Le corps cellulaire du deuxième type identifié peut-être trouvé dans le RAD avec des dendrites s’étalant à travers toutes les couches mais se ramifiant principalement dans le RAD et l’O/A (Fig. 8C, 8D). Leur axone occupe le RAD mais aussi l’O/A (Fig. 8C, 8D). Anatomiquement parlant, ces cellules ressemblent grandement à celles précédemment décrites dans la zone CA1 de l’hippocampe de rat et ayant été identifiées comme étant les interneurones spécifiques aux interneurones de type I (IS-1). En termes de propriétés électrophysiologiques, ces cellules ont montré une forte résistance (582 ± 98 MΩ) et une petite amplitude de courant activé par l’hyperpolarisation (4.6 ± 1.2 mV ; Fig. 8A, 8B). Elles ont également montré un patron de décharge à adaptation ou à « spiking » irrégulier. (Fig. 8C, 8D).
De plus, nous avons identifié un nouveau sous-ensemble d’interneurones CR+ dans le CA1 de l’hippocampe de souris (Fig. 8E, 8F). Ces cellules avaient leurs corps cellulaires dans le RAD à la frontière du LM et leurs dendrites se ramifiaient dans toutes les couches du CA1. Leur axone s’étalait
30
localement dans le RAD ou projettetait au subiculum (Fig. 8E, 8F). Les propriétés physiologiques de ces cellules sont similaires à celles décrites pour les IS-3 et les IS-1. Toutefois, il est intéressant de noter qu’une des cellules enregistrées a montré un « burst » de rebond après injection de courant hyperpolarisant (Fig. 8E); ceci est une caractéristique des cellules exprimant les canaux calciques de type T et est souvent observable dans les cellules de projection de l’aire thalamocorticale. Nous avons donc nommé ces cellules comme étant des cellules de projection à longue portée.
En résumé, les trois types précédemment décrits – les IS-3, IS-1 et les interneurones de projection à longue portée – ont donc été identifiés dans les CA1 d’hippocampe de souris CR-Cre. Ces résultats confirment que ce modèle de souris est un bon modèle pour manipuler de manière spécifique les cellules CR+, incluant les IS-3, pour la suite des expériences.
3. Caractérisation des réponses inhibitrices dans
les interneurones de l’O/A de la zone CA1
Pour étudier les courants inhibiteurs évoqués par les INs CR+, dont les IS-3, nous avons décidé de travailler à 0 mV pendant les expériences de « patch-clamp ». Ce potentiel est connu pour être le potentiel de réversion des courants glutamatergiques; ainsi, il est possible d’enregistrer seulement les courants inhibiteurs.
Dans un premier temps, il faut s’assurer que la dépolarisation à 0 mV n’a pas d’effet sur les courants inhibiteurs. En effet, ce phénomène connu sous le nom de DSI, « depolarization-induced suppresion of inhibition », a été identifié et démontré par un certain nombre d’études récentes, notamment dans les cellules pyramidales de l’hippocampe (Patenaude et al., 2001). Cette forme bien connue de la plasticité à court terme au niveau des synapses GABAergiques de l'hippocampe est en fait transmise par les actions rétrogrades d'endocannabinoïdes endogènes libérés en réponse à la dépolarisation des cellules postsynaptiques (Hampson et al., 2014). La DSI se caractérise donc par une suppression transitoire de réponses synaptiques inhibitrices. Pour vérifier la présence de ce phénomène dans les interneurones du str. O/A du CA1 de l’hippocampe, nous avons dépolarisé les cellules « patchées » (n=5) par injection de courant (de -70mV à 0mV, 5ms). Nous n’avons observé aucun changement dans l’amplitude des IPSCs avant la dépolarisation et 5 secondes après (-28 ± 4.79 mV avant la dépolarisation et -28.3 ± 4.33 mV après la dépolarisation; Fig. 9A, 9B) .
31 Figure 8 : Anatomie des interneurones spécifiques aux interneurones de type 3, de type 1 et des interneurones de projection à longue portée CR+.
A-B. Reconstructions anatomiques de différents interneurones CR+ dont l’axone cible préférentiellement l’O/A. L’arborisation dendritique de ces cellules est soit bipolaire (A) ou monopolaire et dirigée dans le L/M (B).
32
C-D. Reconstructions anatomiques de différents interneurones CR+ dont l’axone est dirigé dans plusieurs couches du CA1. E-F. Reconstructions anatomiques d’interneurones CR+ et dont l’axone se ramifie localement et projette dans le subiculum. Dans toutes les reconstructions, l’axone apparait en rouge et les dendrites en noir.
33 Figure 9 : Caractérisation des réponses inhibitrices évoquées par la lumière dans les interneurones de la zone CA1 de l’hippocampe.
A. Exemples de tracés enregistrés avant la dépolarisation (-70mV, Ctl) et 5 secondes après la dépolarisation (0mV, Post-Depol.) B. Graphique en barres montrant l’amplitude des IPSC avant la dépolarisation (-28 ± 4.79 mV) et 5 secondes après (-28.3 ± 4.33 mV). Notons qu’il n’y a aucun changement dans l’amplitude donc le phénomène de DSI n’est pas observé. C. Exemples de tracés et un graphique montrant l’effet de la TTX au cours du temps sur les IPSPLs. Notons que ces IPSPLs sont bloqués par la TTX.
34
La DSI n’est donc pas un phénomène qui risque d’affecter les enregistrements des courants inhibiteurs dans nos interneurones d’intérêt du str. O/A du CA1 de l’hippocampe.
Dans un deuxième temps, nous avons étudié les propriétés des réponses postsynaptiques évoquées par la lumière dans les interneurones du str. O/A du CA1 par les cellules CR+. Il est important de s’assurer que ces réponses soient physiologiques. De fait, un effet collatéral bien connu de la stimulation par la lumière de la ChR2 est de provoquer un apport additionnel de calcium qui induit alors une libération de GABA au niveau de la terminaison axonale présynaptique (Schoenenberger et al., 2011). Ce qui crée donc une réponse dans la cellule postsynaptique non déclenchée par un potentiel d’action sodique. Lors de nos expériences, nous avons travaillé sur des souris CR-Cre exprimant la ChR2 dans les interneurones CR+ en combinant des enregistrements en mode « current-clamp » des interneurones de l’O/A avec la stimulation lumineuse des cellules CR+. Nous avons étudié les propriétés des potentiels d’action évoqués par la lumière bleue (450-490nm; 5 ms) en utilisant la stimulation lumineuse « wide-field » dans la zone CA1 (environ 0.2mm2, centré sur le
str. oriens). Les réponses évoquées par la lumière à - 40 mV dans les O-LM ont été bloquées par le
TTX (Fig. 9C) ce qui suggère qu’elles étaient générées par des potentiels d’action sodiques initiés dans les cellules CR+ après l’activation de ChR2.
4. Expression synaptique de la sous-unité α5 des
RGABA
Adans les interneurones O/A de la zone
CA1
Salesse et al. (2011) ont montré l’expression synaptique de la sous-unité α5 dans les synapses faites sur les O-LM (Salesse et al., 2011). De plus, des expériences précédentes ont montré que les IS-3 formaient des synapses sur les dendrites des O-LM (Chamberland et al., 2010; Tyan et al., 2014). Nous avons donc voulu étudié si cette sous-unité était exprimée au niveau des synapses formées par les IS-3 sur les dendrites des O-LM. Pour étudier la potentielle présence de la sous-unité α5 au niveau des synapses faites par les IS-3 sur les O-LM, nous avons associé l’activation sélective par la lumière des interneurones CR+ dans les souris CR-Cre avec l’enregistrement des courants inhibiteurs, induits par la lumière, en mode « voltage-clamp » dans les O-LM. Afin de cibler les O-LM lors des expériences, le but était de « patcher » les interneurones orientés horizontalement dans le