THESE
Pour l’obtention du Grade de
DOCTEUR DE L’UNIVERSITE DE POITIERS
(Faculté des Sciences Fondamentales et Appliquées)
(Diplôme National - Arrêté du 7 août 2006)
Ecole Doctorale : Sciences pour l’Environnement Gay Lussac
Secteur de Recherche
:
Biologie des organismes ;
Biotechnologies animales, végétales et microbiennes
Présentée par :
Yves Yacouba SERE
************************
Effet de la biosynthèse des lipides sur la
toxicité de l’!-synucléine, protéine
impliquée dans la maladie de Parkinson,
chez Saccharomyces cerevisiae
************************Directeur de Thèse : Thierry BERGES ************************
Soutenue le 03 décembre 2010 devant la Commission d’Examen ************************
JURY
Président :
M. JABER Mohamed, Professeur, Université de Poitiers Rapporteurs
M. BLONDEL Marc, Professeur, Université de Brest
M. SCHNEITER Roger, Professeur, Université de Fribourg, Suisse Examinateurs
M. LABARRE Jean, Directeur de Recherches, CEA SACLAY, Gif-sur-Yvette
M. REGNACQ Matthieu, Maître de Conférences, Université de Poitiers
Sommaire
!"#$%&'%(&)*+,-%(&%!&'%(&!"#$%",. /////////////////////////////////////////////////////////////////////////////////////////////////0! $*(!%&'%(&"#-12*"!*34( //////////////////////////////////////////////////////////////////////////////////////////////////////////////////////// 56! -%2,%&'%&$"&$*!!1-"!,-%//////////////////////////////////////////////////////////////////////////////////////////////////////////////////// 57! 89":*!-%&5&;&-"::%$(&(,-&$%(&"8*'%(&+-"(<&$%(&(!1-3$(&%!&$%(&+3,!!%$%!!%(& $*:*'*=,%( //////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////// 5>! */&$%(&"8*'%(&+-"(////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////// 5>! *?5/&(!-,8!,-%&%!&8$"((*)*8"!*34&'%(&"8*'%(&+-"(////////////////////////////////////////////////////////////////////////////////// 5>! *?7/&#*3(@4!9A(%&'%(&"8*'%(&+-"(/////////////////////////////////////////////////////////////////////////////////////////////////////////////// 5B! "#$#%&!'(!)"*+,-./0+1!21+!(3"21+!45(+!+(.657+&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&& %8! "#$#%#%&!'1+!7.(91+!21!'(!)"*+,-./0+1!21+!(3"21+!45(+!+(.657+&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&& %8! "#$#%#$&!'1+!1-:,;1+!21!'(!9/(+1!"-"."('1!21!)"*+,-./0+1!21+!(3"21+!45(+&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&& %<! !"#$%!&'()$*&+!#&!,-+.)$!/0&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&& %<! -"#$%!&120#3,!/#/)4(5!/0&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&& %<! "#$#$&!"-+(.65(."*-!21+!(3"21+!45(+&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&& %=! **/&$%(&(!1-3$(///////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////// 5C! **?5/&23*%&',&D12"$34"!%///////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////// 76! **?7/&#*3(@4!9A(%&'%&$E%-+3(!1-3$//////////////////////////////////////////////////////////////////////////////////////////////////////////// 77! ***/&$%(&+3,!!%$%!!%(&$*:*'*=,%( ///////////////////////////////////////////////////////////////////////////////////////////////////// 7B! ***?5/&83D:3(*!*34&#*389*D*=,%&'%(&+3,!!%$%!!%(&$*:*'*=,%(//////////////////////////////////////////////////////////// 7F! """#%#%&!3*-.1-6!1-!'"9"21+&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&& $>! """#%#$&!3*-.1-6!1-!95*.7"-1+&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&& $<! ***?7/&#*3+%4A(%&'%(&+3,!!%$%!!%(&$*:*'*=,%(//////////////////////////////////////////////////////////////////////////////////////// 7C! """#$#%&!)"*+,-./0+1!21+!.(4 &&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&& ?@! 11*6*7*78#/)4(59/0#20/#2!3 &&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&& ?@! 111*6*7*68#!&)$!(1+4#2:#2!3 &&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&& ?%! """#$#$&!)"*+,-./0+1!21+!+1&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&& ?$! ***?>/&D3#*$*("!*34&'%(&$*:*'%(&4%,!-%(/////////////////////////////////////////////////////////////////////////////////////////////////// >>! ***?B/&-G$%&:9@(*3$3+*=,%&'%(&+3,!!%$%!!%(&$*:*'*=,%(////////////////////////////////////////////////////////////////////// >B! 89":*!-%&7&;&-"::%$(&(,-&$"&D"$"'*%&'%&:"-H*4(34&%!&$E!
?(@4,8$1*4% ////////////////// >0! */&$"&D"$"'*%&'%&:"-H*4(34 //////////////////////////////////////////////////////////////////////////////////////////////////////////////// >0! *?5/&$%(&(@D:!GD%(///////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////// >I! *?7/&$%(&3-*+*4%(///////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////// >J! **/&$E!?(@4,8$1*4%////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////// B6!**?5/&:-3:-*1!1(<&(!-,8!,-%<&D,!"!*34(&%!&834)3-D"!*34(/////////////////////////////////////////////////////////////// B6!
**?7/&"+-1+"!*34&%!&D3'*)*8"!*34(&:3(!&!-"',8!*344%$$%(/////////////////////////////////////////////////////////////// B5!
**?>/&)348!*34(&4"!*2%(&%!&*D:$*8"!*34(&:"!93$3+*=,%(///////////////////////////////////////////////////////////////////// B7!
*/&$%(&%(:A8%(&-1"8!*2%(&'%&$E3.@+A4%&K-3(L ///////////////////////////////////////////////////////////////////////////// BF! **/&$%(&"4!*3.@'"4!(/////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////// BI!
**?5/&$%(&D1!"#3$*!%(&"4!*3.@'"4!(&89%M&!"#$%&%'(!()%///////////////////////////////////////////////////////////////////////// BI!
""#%#%&!'1!4'6.(./"*-!A4+/B&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&& 8<! ""#%#$&!(6.51+!;7.()*'".1+!C!95*95"7.7!(-."*D,2(-.1&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&& 8=! **?7/&$%(&"4!*3.@'"4!(&%4M@D"!*=,%(/////////////////////////////////////////////////////////////////////////////////////////////////////// BC! ""#$#%&#'(!3(.('(+1&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&& >@! ""#$#$&#'(!+6915*D,21!2"+;6.(+1!A+*2B&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&& >%! ""#$#?&#'1+!915*D,2(+1+&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&& >%! ""#$#8&#'1!+,+.0;1!./"*572*D"-1&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&& >$! ""#$#>&#'1!+,+.0;1!4'6.(572*D"-1&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&& >?! ""#$#E&#'(!4'6.(./"*-!57263.(+1&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&& >8! ""#$#<&#'1+!4'6.(./"*-!+#.5(-+F75(+1+&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&& >8! ""#$#G&#'1+!1-:,;1+!21!'(!H*"1!21+!91-.*+1+!9/*+9/(.1+&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&& >>! ***/&3.@'"!*34&'%(&D"8-3D3$18,$%( //////////////////////////////////////////////////////////////////////////////////////////// FF! ***?5/&:%-3.@'"!*34&'%(&$*:*'%(////////////////////////////////////////////////////////////////////////////////////////////////////////////////// FF! """#$#%&!'I*D,2(."*-!26!+J61'1..1!3(5)*-7!21+!9*',919."21+&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&& ><! """#$#$&!'1!3'"H(41!21+!'"("+*-+!919."2"J61+&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&& >G! """#$#?&!'(!3(5)*-,'(."*-!21+!95*.7"-1+&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&& >G! """#$#8&!'(!F*5;(."*-!21!3*;9'1D1+!95*.7"J61+!(++*3"7+&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&& >=!
***?>/&3.@'"!*34&'%&$E"'4 /////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////// 0>!
*2/&$"&(*+4"$*("!*34&-%'3.////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////// 0B!
"H#%&!5746'(."*-!512*D!21!)!;7 &&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&& E8!
"H#$&!H*"1!21!+"4-('"+(."*-!H"(!'(!;(9K!+'.$9&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&& E>!
2/&-3(<&:"!93$3+*%(&9,D"*4%(&%!&2*%*$$*((%D%4!&8%$$,$"*-%//////////////////////////////////////// 0F!
89":*!-%&B&; !"#$%&%'(!()%#;&D3'A$%&'E1!,'%&'%&$"&#*3$3+*%&'%&$E
!
?(@4,8$1*4%/// 00!89":*!-%&F&;&3#N%8!*)(&'%&$E1!,'%/////////////////////////////////////////////////////////////////////////////////////////////////// I6! D"!1-*%$&%!&D1!93'%(///////////////////////////////////////////////////////////////////////////////////////////////////////////////////////// I>! */&D"!1-*%$&#*3$3+*=,%///////////////////////////////////////////////////////////////////////////////////////////////////////////////////////// IB! *?5/&(3,89%&#"8!1-*%44%////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////// IB! *?7/&(3,89%(&'%&$%2,-%////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////// IB!
*?>/&:$"(D*'%(///////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////// IB!
*?B/&"4!*83-:(///////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////// IF! **/&D1!93'%(&'%&D*8-3#*3$3+*%&%!&'%&#*3$3+*%&8%$$,$"*-%///////////////////////////////////////////// IF!
**?5/&834'*!*34(&'%&8,$!,-%//////////////////////////////////////////////////////////////////////////////////////////////////////////////////////// IF!
""#%#%&!)(3.75"1+&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&& <>!
""#%#$&!'1H651+&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&& <E!
**?7/&%(!*D"!*34&'%&$"&D,$!*:$*8"!*34&'%(&8%$$,$%(///////////////////////////////////////////////////////////////////////////// I0!
**?>/&%(!*D"!*34&'%&$"&2*"#*$*!1&8%$$,$"*-%&:"-&$%&'143D#-%D%4!&'%(&,)8 /////////////////////////////////// I0!
**?B/&%(!*D"!*34&'%&$"&2*"#*$*!1&8%$$,$"*-%&:"-&$"&D1!93'%&'%&!%(!&%4&+3,!!%(////////////////////////// II!
**?F/&"8=,*(*!*34&'%(&*D"+%(&:"-&D*8-3(83:*%&834)38"$%//////////////////////////////////////////////////////////////////// II!
**?0/&'1!%-D*4"!*34&',&23$,D%&8%$$,$"*-%//////////////////////////////////////////////////////////////////////////////////////////// II!
***/&D1!93'%(&'%&+141!*=,%&%!&'%&#*3$3+*%&D3$18,$"*-%///////////////////////////////////////////////// IJ!
***?5/&%.!-"8!*34&%!&:,-*)*8"!*34&'E"'4&:$"(D*'*=,%&#"8!1-*%4///////////////////////////////////////////////////// IJ!
***?7/&!-"4()3-D"!*34&'%&#"8!1-*%(///////////////////////////////////////////////////////////////////////////////////////////////////////// IC!
***?>/&!-"4()3-D"!*34&'%(&$%2,-%(/////////////////////////////////////////////////////////////////////////////////////////////////////////// IC!
*2/&D1!93'%(&#*389*D*=,%( /////////////////////////////////////////////////////////////////////////////////////////////////////////////// J6! *2?5/&"4"$@(%&'%(&:-3!1*4%(/////////////////////////////////////////////////////////////////////////////////////////////////////////////////////// J6! "H#%#%&!1D.5(3."*-!21+!95*.7"-1+!21!'1H651!9*65!'(!;1+651!21!'I(3."H".7!F(+ &&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&& G@! "H#%#$&!1D.5(3."*-!21+!95*.7"-1+!21!'1H651!9*65!'I(-(',+1!1-!7'13.5*9/*50+1!+2+#9(41&&&&&&&&&&&&& G@! "H#%#?&!2*+(41!21+!95*.7"-1+!9(5!'(!;7./*21!21!)1(521-&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&& G@! "H#%#8&!+79(5(."*-!21+!95*.7"-1+!9(5!7'13.5*9/*50+1!+2+#9(41&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&& G%! "H#%#>&!7'13.5*!.5(-+F15.!21+!95*.7"-1+&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&& G%! "H#%#>&!";;6-*#57H7'(."*-!21+!95*.7"-1+!.5(-+F7571+!+65!;1;)5(-1!21!-".5*31''6'*+1!9(5!'(! ;7./*21!13'.;&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&& G%!
*2?7/&D%(,-%&'%&$E"8!*2*!1&"8*'%&+-"(&(@4!9"(%&K)"(L///////////////////////////////////////////////////////////////////////// J7!
*2?>/&"4"$@(%&'%&$"&83D:3(*!*34&$*:*'*=,%&8%$$,$"*-%///////////////////////////////////////////////////////////////////////// J7! "H#?#%&!1D.5(3."*-!21+!'"9"21+!.*.(6D&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&& G$! "H#?#$&!+79(5(."*-!21+!'"9"21+!-16.51+!9(5!3/5*;(.*45(9/"1!+65!3*63/1!;"-31!A33;B&&&&&&&&&&&&&&&&&&&& G?! "H#?#?&!.5(-+1+.75"F"3(."*-!21+!(3"21+!45(+!C!9(5."5!21+!31''6'1+!1-."051+&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&& G?! "H#?#8&!1D.5(3."*-!1.!+(9*-"F"3(."*-!21+!+.75*'+!.*.(6D&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&& G8! "H#?#>&!(-(',+1!21+!'"9"21+!1-!3/5*;(.*45(9/"1!1-!9/(+1!4(:16+1&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&& G8!
*2?B/&'3("+%&'%(&-3(&*4!-"8%$$,$"*-%(////////////////////////////////////////////////////////////////////////////////////////////////// JF!
"H#8#%&!2*+(41!21+!5*+!9(5!'(!2/5%$?&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&& G>!
"H#8#$&!2*+(41!21+!5*+!9(5!'(!>#A(-2#EB#3/'*5*;1./,'#$L<L!2"3/'*5*2"/,25*F'6*51+31"-!
2"(31.(.1!(31.,'!1+.15!A3;#/$23F2(B &&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&& G>!
*2?F/&'3("+%&',&+$,!"!9*34&*4!-"8%$$,$"*-%//////////////////////////////////////////////////////////////////////////////////////// J0!
"H#>#%!1D.5(3."*-!26!4'6.(./"*-!.*.('!"-.5(31''6'("51&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&& GE!
"H#>#$&!2*+(41!+913.5*9/*.*;7.5"J61!26!4+/!1.!26!4++4 &&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&& GE!
"H#>#$#%&!27.15;"-(."*-!21!'(!J6(-.".7!21!4'6.(./"*-!.*.('!A4+/!1.!4++4B&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&& G<!
"H#>#$#%&!27.15;"-(."*-!21!'(!J6(-.".7!21!4'6.(./"*-!2"+6'F651!A4++4B&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&& G<!
*2?0/&'1!%-D*4"!*34&',&:3!%4!*%$&-%'3.&8%$$,$"*-%////////////////////////////////////////////////////////////////////////// JJ!
-1(,$!"!( //////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////// JC! */&%))%!&'%&$"&(@4!9A(%&'%(&"8*'%(&+-"(&(,-&$"&!3.*8*!1&'%&$E!?(@4,8$1*4% ////////// C6! *?5/&!3.*8*!1&'%&$E!?(@4,8$1*4%&:3,-&$"&(3,89%&+5IF////////////////////////////////////////////////////////////////////////// C5!
"#%#%&!'I!#+,-63'7"-1!1-.5("-1!6-1!(336;6'(."*-!21!5*+!2(-+!'(!+*63/1!4%<>&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&& =%!
"#%#$&!'I!#+,-63'7"-1!"-/")1!'(!35*"++(-31!1.!(FF13.1!'(!H"()"'".7!21!'(!+*63/1!4%<>&&&&&&&&&&&&&&&&&&&&&&&& =$! *?7/&%))%!&'%&$"&(,-%.:-%((*34&'%&$E!?(@4,8$1*4%&(,-&$"&(@4!9A(%&$*:*'*=,%///////////////////////////////// CB!
*?>/&$"&(@4!9A(%&'E"8*'%(&+-"(&D3',$%&$"&!3.*8*!1&'%&$E!?(@4,8$1*4%////////////////////////////////////////////// CC!
"#?#%&!'I!#+,-63'7"-1!"-26".#1''1!6-1!'"9*.*D"3".7!M&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&& %@@!
"#?#$&!'I(3."H".7!(3"21!45(+!+,-./(+1!;*26'1!'(!.*D"3".7!21!'I!#+,-63'7"-1&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&& %@%!
1*<*6*78#$%!:3=04(!(1+4#20#$%!&(1>1('#?!/#21=14:0#$%0??0(#(+.1@:0#20#$%!*/)4:&$'140&&&&&&&&&&&&&&&&&&&&&&&& %@%!
1*<*6*68#$%1451-1(1+4#;!,(10$$0#20#$%!&(1>1('#?!/#0.!&0,-0#$!#(+.1&1('#20#$%!*/)4:&$'140&&&&&&&&&&&&&&&&&&& %@8! *?B/&-%$"!*34&%4!-%&$E"8!*2*!1&"8*'%&+-"(&(@4!9"(%&%!&$E"88,D,$"!*34&8%$$,$"*-%&'%&-3(//// 560! **/&%))%!&'%&$E*49*#*!*34&'%&$"&#*3(@4!9A(%&'%(&$*:*'%(&4%,!-%(&(,-&$"&!3.*8*!1& '%&$E!?(@4,8$1*4% ///////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////// 56J!
**?5/&:9143!@:%&"((38*1&P&$E*48":"8*!1&'%&(@4!91!*(%-&$%(&$*:*'%(&4%,!-%(///////////////////////////////// 56J!
""#%#%&!35*"++(-31!3*;9(571!21+!+*63/1+!4%<>!1.!/%$8E &&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&& %@G!
""#%#$&!H75"F"3(."*-!21!'I()+1-31!21!'"9"21+!-16.51+!1.!21!4*6..1'1..1+!'"9"2"J61+!2(-+!'(!+*63/1!
/%$8E &&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&& %%@!
""#$#%&!35*"++(-31!1.!H"()"'".7!3*;9(571!21!4%<>!1.!/%$8E!1-!957+1-31!21!'I!#+,-63'7"-1&&&&&&&&& %%$!
""#$#$&!1.621!3*;9(571!21!'I(336;6'(."*-!21!5*+!2(-+!'1+!+*63/1+!4%<>!1.!/%$8E!1-!957+1-31!21! 'I!#+,-63'7"-1&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&& %%>!
**?>/&%))%!&'%&$"&:-1(%48%&'%&$E!?(@4,8$1*4%&(,-&$"&(@4!9A(%&'E"8*'%(&+-"(&89%M&$"&(3,89%&
957B0 /////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////// 55I! ***/&%!,'%&'%&$"&83--1$"!*34&%4!-%&$%&(!"!,!&-%'3.&%!&$"&!3.*8*!1&'%&$E!?
(@4,8$1*4%//////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////// 55J!
***?5/&'3("+%&',&+$,!"!9*34&%!&',&+$,!"!9*34&'*(,$),-%&8%$$,$"*-%////////////////////////////////////////// 55J!
"""#%#%&!3*65)1!7.('*-!21!2*+(41!26!4'6.(./"*-!.*.('!31''6'("51&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&& %%=!
"""#%#$&!3*65)1!7.('*-!21!2*+(41!26!4'6.(./"*-!2"+6'F651!A4++4B &&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&& %$%!
***?7/&%!,'%&83D:"-1%&'%&$"&=,"4!*!1&'%&+$,!"!9*34&'"4(&$%(&(3,89%(&+5IF&%!&957B0 //////// 577!
***?>/&%!"!&'E3.@'"!*34&*4!-"8%$$,$"*-%&'%(&(3,89%(&+5IF&%!&957B0 //////////////////////////////////////// 57>!
***?B&%!,'%&'%&$E%42*-344%D%4!&-%'3.&8%$$,$"*-%//////////////////////////////////////////////////////////////////////////// 57F!
"""#8#%&!27.15;"-(."*-!26!H*'6;1!31''6'("51&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&& %$>!
"""#8#$&!27.15;"-(."*-!26!9*.1-."1'!512*D!31''6'("51&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&& %$E!
***?F/&%))%!&'%&$"&D3',$"!*34&'%&$E%42*-344%D%4!&-%'3.&(,-&$"&!3.*8*!1&'%&$E!?(@4,8$1*4% 57I!
"""#>#%&!1FF1.!21!'(!+699'7;1-.(."*-!1-!4+/!+65!'(!.*D"3".7!21!'I!#+,-63'7"-1&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&& %$G!
"""#>#$&!1FF1.!21!'(!2";"-6."*-!26!9**'!"-.5(31''6'("51!21!4+/!+65!'(!.*D"3".7!21!'I!#+,-63'7"-1
&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&& %$=! *2/&%))%!&'%&$"&#*3(@4!9A(%&'%(&(!1-3$(&(,-&$"&!3.*8*!1&'%&$E!?(@4,8$1*4% ///// 5>6!
*2?5/&%))%!&'%&$"&(@4!9A(%&'%(&(!1-3$(&(,-&$"&!3.*8*!1&'%&$E!?(@4,8$1*4%////////////////////////////////// 5>6!
*2?7/&%!,'%&'%&$"&83--1$"!*34&%4!-%&$%&(=,"$A4%&%!&$"&!3.*8*!1&'%&$E!?(@4,8$1*4%///////////////// 5>7!
'*(8,((*34///////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////// 5>F! 8348$,(*34&%!&:%-(:%8!*2%( ////////////////////////////////////////////////////////////////////////////////////////////////////////// 5B7! #*#$*3+-":9*% //////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////// 5BJ! "44%.% //////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////// 5JF! Q&"&!)$$*)&+,-$%!#$%&%'(!()%&(!-"*4&,4"#$%&!3&(!3-%&4%,!-"$&$*:*'(&*(& !3$%-"4!&!3&3.*'"!*2%&(!-%((&*4',8%'&#@&R?(@4,8$%*4&S/ /////////////////////////////////////////// 5JF!
Table des figures et des tableaux
Table des figures
Figure 1: Initiation de la biosynthèse des acides gras à partir du malonyl-CoA et de l’acétyl-malonyl-CoA.
5
Figure 2: Structure moléculaire de la cérulénine, un inhibiteur de l’acide gras synthase.
17
Figure 3: La voie du mévalonate chez Saccharomyces cerevisiae. 19 Figure 4: Structure moléculaire de la lovastatine, un inhibiteur de la
HMG-CoA réductase.
20
Figure 5: La synthèse de l’ergostérol à partir du farnésyl pyrophosphate. 23 Figure 6: Représentation schématique d’une gouttelette lipidique. 24 Figure 7: Les différentes théories de la biogenèse des gouttelettes
lipidiques cytoplasmiques.
29
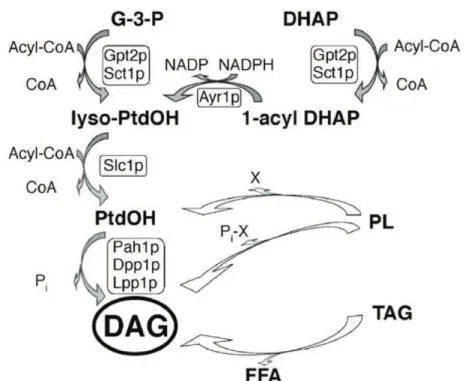
Figure 8: Voies métaboliques conduisant à la formation du DAG. 30 Figure 9: Biosynthèse et dégradation des lipides neuters. 32 Figure 10: La voie nigro-striatale en condition normale et en condition
pathologique
36
Figure 11: Représentation schématique de la structure primaire de l’!-synucléine.
40
Figure 12: Fibrillogenèse de l’!-synucléine. 42
Figure 13: Schéma de la chaine respiratoire de S. cerevisiae montrant les sites principaux de production de ROS ainsi que les antioxydants mobilisés contre ces ROS.
46
Figure 14: Structure moléculaire du (A) glutathion GSH; (B) glutathion
disulfure GSSG. 48
Figure 15: Systèmes enzymatiques impliqués dans la détoxification des ROS et dans le contrôle de l'état redox des protéines contenant le groupe sulfhydrile chez S. cerevisiae.
50
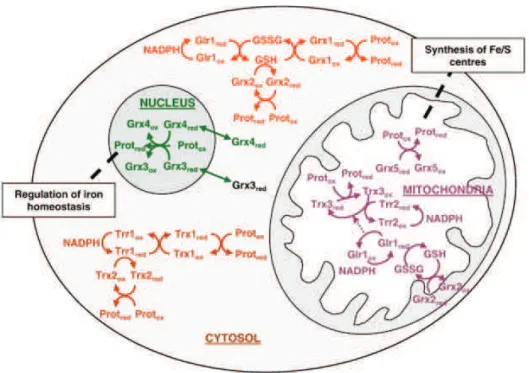
Figure 16: Composants cytosoliques mitochondriaux et nucléaires du système thiorédoxine et glutarédoxine de S. cerevisiae.
53
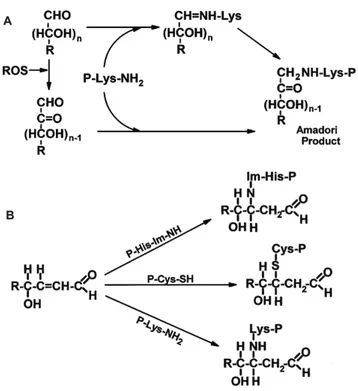
Figure 18: Oxydation du squelette carboné des proteins. 58 Figure 19: Clivage de la chaine polypeptidique par la voie de l’! amidation
et du diamide.
59
Figure 20: Génération des dérivés carbonylés des proteins. 60
Figure 21: Oxydation des proteins. 61
Figure 22: Oxydation des acides aminés aromatiques. 62 Figure 23: Fonctions biologiques conservées entre S. cerevisiae et les
eucaryotes supérieurs.
68
Figure 24: Les voies cellulaires de la lipotoxicité. 70 Figure 25: Effet de l’!-synucléine sur l’accumulation de ROS. 92 Figure 26: Effet de la surexpression de l’!-synucléine sur la croissance
cellulaire.
93
Figure 27: Coloration des gouttelettes lipidiques. 95 Figure 28: Séparation des lipides neutres par chromatographie sur couche
mince (CCM). 96
Figure 29: Effet de l’induction de l’!-synucléine sur l’accumulation d’acides gras.
97
Figure 30: Effet de l’induction de l’!-synucléine sur l’activité acide gras synthase (FAS).
98
Figure 31: L’activité FAS module la toxicité de l’!-synucléine. 101 Figure 32: Niveau d’expression cellulaire de l’!-synucléine. 102 Figure 33: Croissance comparée des souches Y10000 (contrôle sauvage)
et Y15313 (fld1!, isogénique de Y10000), en présence de l’!-synucléine.
103
Figure 34: L’activité FAS module la toxicité de l’!-synucléine. 105 Figure 35: Rôle du NADPH dans la synthèse des acides gras du GSH et
des ROS.
106 Figure 36: Croissance comparée des souches G175 et H1246 (quadruple
mutant dga1", lro1", are1", are2"). 108
Figure 37: Séparation des lipides neutres. 110
Figure 38: Coloration des gouttelettes lipidiques. 110 Figure 39: Croissance comparée des souches G175 et H1246 (quadruple 112
mutant dga1", lro1", are1", are2") en présence ou non de l’!-synucléine.
Figure 40: Croissance comparée des souches G175 et H1246, exprimant ou non l’!-synucléine, sur les milieux solides YP glucose et YP galactose.
113
Figure 41: Croissance comparée des souches Y10000 (contrôle sauvage) et RSY3077 (quadruple mutant dga1", lro1", are1", are2") en présence de l’!-synucléine.
114
Figure 42: Analyse comparative des quantités cellulaires de ROS dans les souches G175 et H1246, en présence ou absence
d’!-synucléine.
116
Figure 43: Effet de l’induction de l’!-synucléine sur l’accumulation d’acides gras.
117
Figure 44: Recyclage enzymatique du GSH à partir du GSSG en présence du NADPH et de la glutathion réductase (GR).
119
Figure 45: Courbe étalon de dosage du glutathion (GSH). 120 Figure 46: Courbe étalon de dosage du glutathion (GSSG). 121 Figure 47: Effet de l’!-synucléine sur le statut redox cellulaire GSH/GSSG. 124 Figure 48: Analyse comparative du potentiel redox cellulaire. 126 Figure 49: Le glutathion module la toxicité de l’!-synucléine. 128 Figure 50: Effet de l’!-synucléine sur le contenu cellulaire en sterols. 130 Figure 51: Effet de l’!-synucléine sur le contenu cellulaire en squalène. 132 Figure 52: Effet de l’inhibition de la synthèse du squalène et des stérols sur
la toxicité de l’!-synucléine.
133
Figure 53: Mécanisme hypothétique de l’augmentation de l’activité FAS en
présence de l’!-synucléine. 145
Figure 54: Mécanisme hypothétique de la réduction de la toxicité de l’!-synucléine par la protéine Sfh2p.
146
Table des Tableaux
Tableau 1: Composants des gouttelettes lipidiques de Saccharomyces cerevisiae
Tableau 2: Protéines des gouttelettes lipidiques de S. cerevisiae 27 Tableau 3: Loci et gènes liés à la maladie de Parkinson 38
Tableau 4: souches de levure utilisées 73
Tableau 5: plasmides utilisés. 74
Tableau 6: anticorps utilisés. 74
Tableau 7: Tableau comparatif de l’activité acide gras synthase 100 Tableau 8: Comparaison de l ‘activité FAS chez les souches Y10000
(contrôle sauvage, origine EUROSCARF) et Y15313 (fld1!, isogénique de Y10000).
103
Tableau 9: Tableau comparatif de l’activité acide gras synthase. 117 Tableau 10: Concentration cellulaire en glutathion total (GSH et GSSG). 122
Liste des abréviations
ACP Acyl carrier protein
ADN Acide désoxyribonucléique
BSA Albumine bovine sérique
CDNB 1-chloro-2,4-dinitrobenzene
CoA Coenzyme A
DAG Diacylglycérol
DGAT Diacylglycérol acyl transférase
DHR123 Dihydrorhodamine 123
CM-H2DCFDA
5-(and-6)-chloromethyl-2,7-dichlorodihydrofluorescein diacetate acetyl ester
CPG Chromatographie en phase gazeuse
EDTA Acide éthylène-diamine-tétra-acétique
Eh Potentiel redox
FAB Fatty acid binding domain
FAS Acide gras synthase
GSH Glutathion (forme réduite)
GST Glutathion S-transférase
IgG Immunoglobuline de type G
IUPAC Union internationale de chimie pure et appliquée
LB Luria Bertani
NADPH Nicotinamide adénine dinucléotide phosphate
NOX NADPH Oxydase
PMSF Phénylmethanesulphonylfluoride
RE Réticulum endoplasmique
ROS Espèces réactives de l’oxygène
SDS Dodecyl Sulfate de sodium
SDS-PAGE Sodium Dodecyl Sulfate Polyacrylamide Gel Electrophoresis
SE Ester de stérol
SOD Superoxyde dismutase
TAG Triacylglycérol
TEMED Tetraméthyléthylenediamine
Chapitre 1 : Rappels sur les acides gras, les stérols
et les gouttelettes lipidiques
I. Les acides gras
D’un point de vue biochimique, les lipides sont de petites molécules hydrophobes ou amphipathiques provenant, en totalité ou en partie, de la condensation de thioesters à base de carbanions (acides gras, polykétides, etc.) et/ou de la condensation d'unités d'isoprène à base de carbocations (prénols, stérols, etc.) (Fahy, et al., 2009). En fonction de la composition, les lipides peuvent être regroupés en deux catégories. D’une part les lipides isoprénoïdes ou stérols ; d’autres part les lipides contenant un ou plusieurs acides gras (cérides, sphingolipides, phospholipides et glycérolipides).
I-1. Structure et classification des acides gras
Le terme « acides gras » regroupe l’ensemble des acides carboxyliques contenant une chaine carbonée hydrophobe (IUPAC, 1976). Les acides gras sont des constituants essentiels des membranes cellulaires. De plus, les acides gras sont utilisés comme source d’énergie pour produire de l’ATP et comme second messager pour la transduction de signaux cellulaires (Graber, et al., 1994; Sumida, et al., 1993). Les propriétés physico-chimiques des acides gras dépendent de la structure de leurs chaines carbonées. Ainsi la longueur de la chaine carbonée et le nombre de liaisons éthyléniques sont des paramètres couramment utilisés pour classer les acides gras.
En fonction de la longueur de la chaine carbonée, on distingue 5 groupes d’acides gras. Les acides gras volatiles, qui sont constitués de 2, 3 ou 4 atomes de carbone. Les acides gras à chaine courte qui contiennent entre 6 et 10 atomes de carbone. Les acides gras à chaine moyenne ont un nombre d’atome de carbone compris entre 12 à 14. Les acides gras à chaine longue sont constitués de 16 à 18 atomes de carbones. Enfin, les acides gras à très longue chaine qui contiennent plus de 18 atomes de carbone. Selon la nomenclature proposée par l’IUPCA, l’atome de
carbone portant le groupement carboxylique doit être considéré comme le carbone numéro 1 (IUPAC, 1976). En fonction du nombre de liaisons éthyléniques (degré d’insaturation), les acides gras sont regroupés en acides gras saturés et en acides gras insaturés. Les acides gras insaturés, par opposition aux acides gras saturés, possèdent une ou plusieurs doubles liaisons éthyléniques. L’identification de la position de la ou des liaisons éthyléniques permet de différencier les acides gras ayant le même degré d’insaturation.
Chez la levure de boulangerie Saccharomyces cerevisiae, les acides gras les plus abondants sont en C16 (C16 :0, C16 :1) et C18 (C18 :0, C18 :1) (Cottrell, et al., 1986; Welch and Burlingame, 1973). Cependant on retrouve des acides gras à très longue chaine (C26 :0) dans des proportions très faibles (1 à 2%) (Welch and Burlingame, 1973).
I-2. Biosynthèse des acides gras
Il existe plusieurs sources d’acides gras pour les cellules. En effet, les cellules peuvent transporter les acides gras du milieu extracellulaire vers le cytoplasme au moyen des protéines de type FATP (protéines de transport des acides gras) (Bonen, et al., 1999; Zou, et al., 2002). Une étude récente chez S. cerevisiae a identifié la protéine kinase Ypk1p, orthologue de la kinase humaine Sgk1 (serum- and glucocorticoid-induced kinase), comme étant un composant essentiel pour la régulation de l’entrée des acides gras exogènes et impliquant les étapes précoces de l’endocytose (Jacquier and Schneiter, 2010). En outre les acides gras cellulaires peuvent être mobilisés suite à l’hydrolyse des lipides neutres et des phospholipides. Enfin les cellules eucaryotes et procaryotes sont capables d’effectuer la synthèse de
novo des acides gras.
I-2-1. La biosynthèse des acides gras saturés
Le mécanisme général de la biosynthèse des acides gras demeure identique chez toutes les cellules. Cependant les enzymes impliquées dans la biosynthèse des acides gras varient en fonction des organismes vivants.
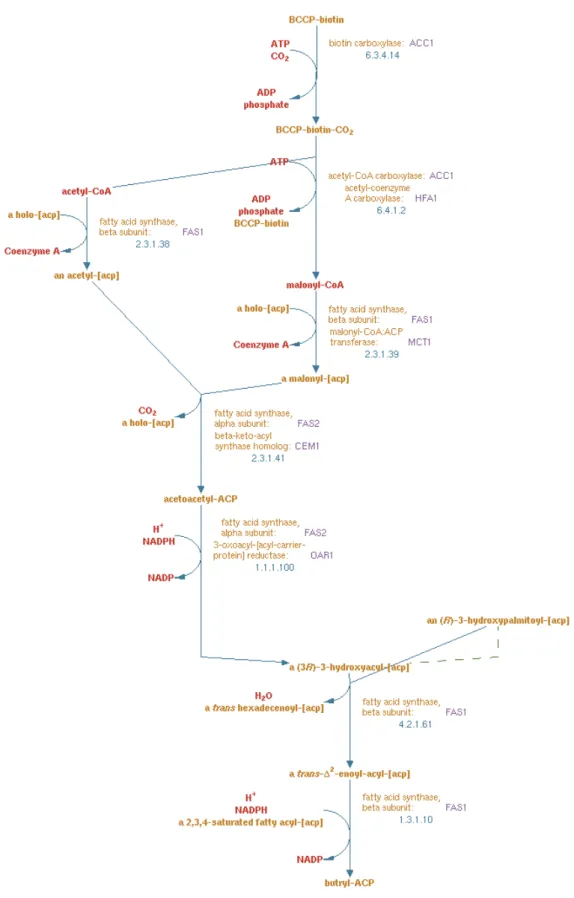
La formation du malonyl-CoA représente la première étape de la biosynthèse des acides gras (Figure 1). Le malonyl-CoA est synthétisé à partir de l’acétyl-CoA en présence de la biotine. Après la synthèse du malonyl-CoA, la biosynthèse des acides gras se poursuit par le transfert du malonyl-CoA et de l’acétyl-CoA vers une même protéine nommée ACP (Acyl Carrier Protein). Ces deux molécules sont condensées, par une ACP synthase, pour former la ß ACP. Cette ß cétoacyl-ACP est réduite en présence de NADPH pour former un 3-hydroxyacyl-cétoacyl-ACP qui, par la suite, subit une déshydratation enzymatique pour former l’énoyl-ACP. En présence de NADPH, l’énoyl réductase catalyse la formation du butyryl-ACP à partir de l’énoyl-ACP (pour revue (Smith, 1994)). Le processus d’élongation de la chaine acyl gras est réalisé par des cycles successifs utilisant les mêmes étapes de condensation du malonyl-CoA et de l’acyl-ACP suivies des étapes de décarboxylation, de réduction et de déshydratation (Smith, 1994).
D’après « Saccharomyces Genome Database »
Figure 1 : Initiation de la biosynthèse des acides gras à partir du malonyl-CoA et de l’acétyl-CoA.
I-2-1-2. Les enzymes de la phase initiale de biosynthèse des acides gras
a) L’acétyl-CoA carboxylase
La synthèse du malonyl-CoA, à partir de CoA, est catalysée par l’acétyl-CoA carboxylase. Cette enzyme est présente dans le cytoplasme et dans les mitochondries. Chez S. cerevisiae, l’acétyl-CoA carboxylase cytoplasmique est codée par le gène ACC1. En présence de choline et d’inositol, ce gène est réprimé (Hasslacher, et al., 1993). De plus ACC1 est régulé par les facteurs de transcription Ino2p, Ino4p et Opi1p (Chirala, et al., 1994). La protéine Acc1p est une enzyme essentielle (Hasslacher, et al., 1993) qui utilise la biotine comme cofacteur. Dans les mitochondries de S. cerevisiae, la décarboxylation de l’acétyl-CoA en malonyl-CoA est catalysée par le produit du gène HFA1. La protéine Hfa1p possède 72% d’homologie structurale avec la protéine Acc1p (Hoja, et al., 2004; Kearsey, 1993). Cependant Hfa1p ne peut catalyser la production de malonyl-CoA cytoplasmique en absence de Acc1p (Hasslacher, et al., 1993). Chez les mammifères, la synthèse du malonyl-CoA est la cible de nombreux médicaments contre l’obésité (CP-640186, ESP-55016, Soraphen A).
b) L’acide gras synthase
Chez les procaryotes comme chez les eucaryotes, la synthèse des acides gras saturés est catalysée par l’acide gras synthase (FAS pour Fatty Acid Synthase, appelée également FASN chez les animaux). Il existe deux types d’acide gras synthase. L’acide gras synthase de type I que l’on retrouve dans le cytosol et l’acide gras synthase de type II qui est localisée dans les mitochondries et les plastes. Chez les animaux, La FAS fonctionnelle de type I est un homodimère dont chacune des sous unités catalyse les différentes réactions de la synthèse des acides gras à partir du malonyl-CoA (Alberts, et al., 1975; Stoops, et al., 1975). Dans les plastes et les mitochondries, la formation du butyryl-ACP à partir du malonyl-CoA est catalysée par un complexe protéique représenté par la FAS de type II.
Chez S. cerevisiae, la FAS cytoplasmique est un complexe enzymatique constitué des deux protéines (Fas1p, Fas2p) dont chacune est représentée en 6 exemplaires (Schweizer and Hofmann, 2004). Ce complexe possède 6 centres indépendants. Chaque centre indépendant, constitué par Fas1p et Fas2p, catalyse les différentes étapes de la synthèse des acyl-ACP à partir du malonyl-CoA et de l’acétyl-CoA. La Fas1p possède les activités acétyl transférase, énoyl réductase,
déshydratase, malonyl /palmitoyl transférase (Schweizer, et al., 1986; Stoops and Wakil, 1978). Quant à la Fas2p, elle contient l’acyl carrier protein (ACP) et possède les activités 3-cétoreductase, 3-cétosynthase et phosphopantéthéine transférase (Mohamed, et al., 1988; Stoops and Wakil, 1978). La FAS mitochondriale de la levure S. cerevisiae est une FAS de type II constituée de plusieurs monomères ayant chacun une fonction spécifique (Hiltunen, et al., 2005).
Les gènes FAS1 et FAS2 peuvent être activés par les facteurs de transcription Rap1p, Abf1p, and Reb1p ainsi que par la présence de choline et d’inositol. De plus, la stœchiométrie du complexe protéique FAS (Fas1p Fas2p) semble être maintenue par un mécanisme mal défini au sein duquel Fas1p contrôlerait le niveau de transcription du gène FAS2 (Wenz, et al., 2001).
La synthèse d’acides gras est utilisée comme cible thérapeutique au cours de nombreuses infections et pathologies (Campbell and Cronan, 2001; Kuhajda, et al., 2000; Loftus, et al., 2000; Paul, et al., 2004). Ainsi le triclosan, la cérulénine et le C75 sont utilisés comme des inhibiteurs de l’acide gras synthase. La cérulénine (Figure 2) en se fixant à la FAS, bloque la synthèse de la ß cétoacyl-ACP et par conséquent inhibe l’acide gras synthase (Funabashi, et al., 1989; Kawaguchi, et al., 1982). Certains de ces inhibiteurs comme C75 présentent cependant l’inconvénient majeur de stimuler l’oxydation des acides gras, en activant CPT1, gène de la carnitine palmitoyl-transférase 1. En conséquence, des traitements au long cours avec cette molécule induisent l’anorexie et l’amaigrissement (Thupari, et al., 2002).
Figure 2 : structure moléculaire de la cérulénine, un inhibiteur de l’acide gras synthase.
I-2-2. Insaturation des acides gras
Les acides gras insaturés sont des composés essentiels des membranes biologiques en participant à la modulation de leur fluidité. Dans les cellules, on distingue des acides gras mono-insaturés et des acides gras poly-insaturés. Toutefois, seules les plantes et quelques rares animaux (Peyou-Ndi, et al., 2000) sont capables de synthétiser de novo les acides gras poly-insaturés. En revanche, tous les eucaryotes peuvent synthétiser les acides gras mono-insaturés. Chez S. cerevisiae, l’insaturation des acides gras est catalysée par la delta-9 désaturase codée par le gène essentiel OLE1. La protéine Ole1p catalyse spécifiquement la désaturation du palmitoyl-CoA (16:0) et du stéaroyl-CoA (18:0) respectivement en palmitoléate (16:1) et en oléate (18:1) (Stewart and Yaffe, 1991; Stukey, et al., 1989). La transcription du gène OLE1 est activée par les protéines Mga2p et Spt23p (Chellappa, et al., 2001; Zhang, et al., 1999). En réponse à des niveaux élevés d’acides gras, la transcription de OLE1 diminue (McDonough, et al., 1992). Cependant, l’hypoxie stimule l’augmentation de la transcription de ce gène (Kwast, et
al., 1999). De plus, le niveau cellulaire d’acides gras insaturés contrôle la stabilité de
l’ARNm d’OLE1 (Gonzalez and Martin, 1996).
II. Les stérols
Les stérols sont des molécules essentielles qui interviennent dans le maintien de l’intégrité structurale et fonctionnelle des membranes cellulaires (Bagnat, et al., 2000; Bloch, 1983). Les stérols participent à la modulation de la fluidité membranaire. Associés aux sphingolipides, ils constituent des microdomaines lipidiques rigides et ordonnés qui jouent un rôle dans la localisation, la diffusion et la fonction de certaines protéines (Guan, et al., 2009). Ils constituent également des précurseurs pour la biosynthèse de certaines hormones. Dans les cellules animales, le stérol majeur est le cholestérol. Les levures ne synthétisent pas le cholestérol ; l’analogue du cholestérol chez les levures, est l’ergostérol.
II-1. Voie du mévalonate
La biosynthèse des stérols commence par la conversion de l’acétyl-CoA en farnésyl pyrophosphate au terme d’une série de réactions dont l’ensemble constitue la voie de biosynthèse du mévalonate ou voie des isoprénoïdes (Figure 3). Cette voie métabolique est conservée chez tous les eucaryotes.
Daum G et al., Yeast (1998) 14, 1471–1510
La synthèse du mévalonate commence par le transfert du groupe acétyle d’une molécule d’acétyl-CoA à une autre molécule d’acétyl-CoA avec formation d’un acéto-acétyl-CoA. Cette étape est catalysée par l’acéto-acétyl-CoA thiolase codée par le gène ERG10. Chez S. cerevisiae, il existe deux isoformes de l’acéto-acétyl-CoA thiolase dont une cytosolique et l’autre mitochondriale (Kornblatt and Rudney, 1971). Contrairement aux cellules animales, l’activité de l’acéto-acétyl-CoA thiolase de la levure est régulée par la concentration cellulaire en stérols (Servouse and Karst, 1986; Trocha and Sprinson, 1976). L’acéto-acétyl-CoA formé est ensuite converti en hydroxy-méthyl-glutaryl-CoA (HMG-CoA) par l’hydroxy-méthyl-glutaryl-CoA synthase (HMG-CoA synthase). Chez S. cerevisiae, cette enzyme Erg13p est régulée par la concentration cellulaire en ergostérol (Servouse and Karst, 1986; Trocha and Sprinson, 1976). Cependant, le mécanisme moléculaire de cette régulation n’est pas encore élucidé.
L’étape suivante de la voie du mévalonate consiste en la formation de l’acide mévalonique à partir de l’HMG-CoA. Cette étape est catalysée par une enzyme clé, l’hydroxy-méthyl-glutaryl-CoA réductase (HMG-CoA réductase).
La modulation de l’activité de cette réductase permet de réguler la synthèse du cholestérol et de l’ergostérol (BARD and DOWNING, 1981; Goldstein and Brown, 1990). Pour cette raison, l’HMG-CoA réductase est une cible thérapeutique pour de nombreux médicaments hypocholestérolémiants de la famille des statines tels que la lovastatine (Figure 4) et la compactine (Alberts, et al., 1980; Downs, et al., 1998; Endo, 1985).
Figure 4 : structure moléculaire de la lovastatine, un inhibiteur de la HMG-CoA réductase.
Contrairement aux cellules humaines, la levure S. cerevisiae possède deux gènes (HMG1 et HMG2) codant chacun l’HMG-CoA réductase. Les mutations