T
T
H
H
È
È
S
S
E
E
En vue de l'obtention du
D
D
O
O
C
C
T
T
O
O
R
R
A
A
T
T
D
D
E
E
L
L
’
’
U
U
N
N
I
I
V
V
E
E
R
R
S
S
I
I
T
T
É
É
D
D
E
E
T
T
O
O
U
U
L
L
O
O
U
U
S
S
E
E
Délivré par l'Université Toulouse III - Paul SabatierDiscipline ou spécialité : Chimie Supramoléculaire et Macromoléculaire
Présentée et soutenue par Florence GAYET Le 19 Décembre 2008
Agrégats moléculaires en liquides ioniques et réactivité dans ces milieux
JURY
Mme Monique MAUZAC, Directeur de recherches CNRS, Toulouse Présidente M Bernard PUCCI, Professeur Faculté des Sciences, Avignon Rapporteur M Michel VAULTIER, Directeur de recherches CNRS, Rennes Rapporteur Mme Annie BRÛLET, Ingénieur de Recherches CEA, Saclay Examinateur M André VIOUX, Professeur Université de Montpellier 2, Montpellier Examinateur M Jean-Christophe PLAQUEVENT, Directeur de recherches CNRS, Toulouse Examinateur Mme Nancy LAUTH-de VIGUERIE, Professeur Université Paul Sabatier Directrice thèse
Ecole doctorale : Sciences de la matière
Unité de recherche : Laboratoire des Intéractions Moléculaires Réactivité Chimique et Photochimique – UMR 5623
Directeur(s) de Thèse : Professeur Nancy Lauth-de Viguerie Rapporteurs : M Bernard Pucci et M Michel Vaultier
T
T
H
H
È
È
S
S
E
E
En vue de l'obtention du
D
D
O
O
C
C
T
T
O
O
R
R
A
A
T
T
D
D
E
E
L
L
’
’
U
U
N
N
I
I
V
V
E
E
R
R
S
S
I
I
T
T
É
É
D
D
E
E
T
T
O
O
U
U
L
L
O
O
U
U
S
S
E
E
Délivré par l'Université Toulouse III - Paul SabatierDiscipline ou spécialité : Chimie Supramoléculaire et Macromoléculaire
Présentée et soutenue par Florence GAYET Le 19 Décembre 2008
Agrégats moléculaires en liquides ioniques et réactivité dans ces milieux
JURY
Mme Monique MAUZAC, Directeur de recherches CNRS, Toulouse Présidente M Bernard PUCCI, Professeur Faculté des Sciences, Avignon Rapporteur M Michel VAULTIER, Directeur de recherches CNRS, Rennes Rapporteur Mme Annie BRÛLET, Ingénieur de Recherches CEA, Saclay Examinateur M André VIOUX, Professeur Université de Montpellier 2, Montpellier Examinateur M Jean-Christophe PLAQUEVENT, Directeur de recherches CNRS, Toulouse Examinateur Mme Nancy LAUTH-de VIGUERIE, Professeur Université Paul Sabatier Directrice thèse
Ecole doctorale : Sciences de la matière
Unité de recherche : Laboratoire des Intéractions Moléculaires Réactivité Chimique et Photochimique – UMR 5623
Directeur(s) de Thèse : Professeur Nancy Lauth-de Viguerie Rapporteurs : M Bernard Pucci et M Michel Vaultier
Que toutes les personnes qui ont permis la réalisation de ce travail trouvent ici l’expression de toute ma reconnaissance.
Mesdames Isabelle Rico-Lattes et Monique Mauzac ont successivement dirigé le laboratoire des Interactions Moléculaires Réactivité Chimique et Photochimique de l’Université Paul Sabatier à Toulouse dans lequel j’ai accompli ce travail de thèse. Merci à toutes deux pour leur présence et la qualité de leur accueil.
Messieurs Bernard Pucci, Professeur à la Faculté des Sciences d’Avignon et Michel Vaultier, Directeur de Recherches CNRS à l’Université de Rennes m’ont tous deux fait l’honneur d’accepter de lire ce mémoire et d’apprécier la valeur de mon travail en tant que rapporteurs. Je les assure de ma profonde gratitude et de mes sincères remerciements.
Madame Annie Brûlet, Ingénieur de Recherches au laboratoire Léon Brillouin du CEA de Saclay, m’a initiée à la technique de diffusion des Neutrons aux petits angles et accompagnée dans la compréhension des données obtenues. Je la remercie d’avoir su stimuler et guider ma curiosité dans la découverte d’un domaine utile pour les sciences physiques et chimiques mais relativement éloigné de ma chimie de tous les jours. Je lui suis reconnaissante de m’avoir accordé beaucoup de son temps et en particulier pendant le long week-end de Pâques 2008 et d’avoir distillé rapidement et toujours avec bienveillance ses conseils lors la rédaction de la partie des neutrons. Merci pour ta venue à Toulouse et ta présence au sein du jury.
Monsieur Jean-Christophe Plaquevent, Directeur de Recherches CNRS à l’Université Paul Sabatier de Toulouse, a accepté avec plaisir de participer au jury et de formuler des remarques constructives lors de la discussion. Je le remercie pour l’intérêt porté à ce travail.
Monsieur André Vioux, Professeur à l'Université de Montpellier 2, dont j’ai la chance d’apprécier au quotidien la qualité de l’écoute, la pertinence de ses conseils a facilité la dernière phase de préparation de ces travaux en me permettant de concilier l’achèvement de ma thèse et l’exercice des fonctions inhérentes au poste ATER obtenu au sein de son laboratoire. J’ai été honorée par votre présence au jury et je vous exprime remerciements et gratitude pour votre accueil à Montpellier et votre aide.
La présidence du jury a été assurée par Madame Monique Mauzac, Directeur de Recherches CNRS à l’Université Paul Sabatier de Toulouse. Je vous prie d’accepter mes remerciements pour votre participation mais aussi pour tout ce que vous m’avez apporté lors de mes débuts en Master 2, au laboratoire, au sein de votre équipe.
prodiguer. Merci, Nancy, pour ta gentillesse, ta pédagogie et ton accompagnement. Nous avons, côte à côte et grâce à l’informatique, accompli dans les dernières semaines de ce travail un fructueux marathon.
Je tiens ici à exprimer des remerciements particuliers à Jean-Daniel Marty, Maître de Conférence, pour sa disponibilité, son écoute, ses encouragements, sa grande réactivité ainsi que son efficacité lors de nos échanges scientifiques de vive voix ou par informatique.
Je vous remercie très chaleureusement tous les deux pour le partage de votre bureau pendant ces années ; notre cohabitation fut très conviviale et j’en garderai un excellent souvenir.
Un grand Merci à l’ensemble des personnels de l’Université Paul Sabatier et du bâtiment de chimie : le service commun de spectroscopie de masse dirigé par Cathy Claparols, le service d’analyse centésimale du LCC, le service de spectroscopie RMN avec Pierre Lavedan, Marc Vedrenne, Yannick Chollet, Corine Routaboul pour le service commun d’Infrarouge et le service de diffraction aux rayons X avec notamment Heinz Goritzka.
J’ai beaucoup appris au cours de cette thèse…
Par définition, une thèse de recherche est un exercice codifié et toutes les thèses de ce genre sont soumises aux mêmes procédures. Singularité cependant de chacune par le sujet, les « acteurs » qu’elle agrège !
C’est une « aventure » scientifique et humaine de trois ans, soumise à des contingences infinies et diverses (matérielles, techniques, psychologiques …etc), constituée d’attentes stimulantes, de doutes utiles et féconds, de résultats parfois décevants dont il faut comprendre le pourquoi, mais aussi de réussites bienvenues et rassurantes qui réactivent l’enthousiasme jamais perdu ; ces trois années de partenariat entre le thésard, le directeur de thèse et la chaîne d’intervenants impliqués dans les manipulations ont pour espace principal le « labo », ses paillasses et appareils, ses équipes, ses personnels, unité qui constitue la cellule matricielle … … … d’une « ODYSSEE », d’une « école » de soi, des autres, des « choses » !
Dans la fin de l’été 2005, avec envie, confiance et détermination, j’ai pris la mer… J’embarquais pour une course hauturière sans escale… … … mon Vendée Globe Challenge en terre toulousaine !
En larguant les amarres, je me savais en liaison avec mon P.C. course, moralement, mentalement et physiquement préparée à affronter péripéties et imprévus, à éprouver inquiétudes et satisfactions, à faire mienne la morale du laboureur de la fable, à résister aux coups de fatigue, à bannir le renoncement, à maintenir la vigilance pour éviter le naufrage (fût il « au pays du lotos » !), à goûter avec délices à la joie indicible de retrouver sans avarie le port!
Il y eut les jours de jubilation, quand, les alizés gonflant les voiles emportaient sereinement et vivement l’esquif qui tenait bon le cap ; vinrent les épreuves incontournables et redoutées de la traversée du « pot au noir » à essuyer grains et orages, sur le pont, pour
il a fallu franchir « la porte des glaces », naviguer à la limite d’hiberner dans le monde des icebergs, filer sans casse mais avec rage dans les latitudes rugissantes et hurlantes pour mieux relancer le bateau et rester dans les temps! La remontée s’accomplit à très vive allure en exploitant tous les vents porteurs ; l’automne languedocien avait, le jour, la couleur et la douceur du miel… … la nuit, la blancheur des soleils de minuit ! Et j’accostais à mon « ITHAQUE » par un des jours les plus courts de l’année, pluvieux, venteux, hivernal ! J’étais l’impétrante prête à faire le point sur ce parcours.
Enfin, heureuse comme Ulysse… … …! Mission accomplie!!!
Vous m’avez aussi accompagnée …
Mes remerciements s’adressent également à l’ensemble des personnes que j’ai eu le plaisir de rencontrer et qui ont ainsi contribué directement ou indirectement à l’accomplissement de ce travail au plan scientifique, administratif et relationnel. Je savais l’importance des bonnes relations humaines ; ce parcours m’a renforcé dans ces convictions. Un sourire, un bonjour, une parole aimable ont agrémenté les journées au laboratoire.
Je pense tout particulièrement à Juliette Fitremann, Chargée de Recherches au CNRS, qui m’a initiée à la recherche. Durant mon stage de master 2, elle a su me faire bénéficier de son expérience, de sa disponibilité, de ses rigoureuses exigences scientifiques. Je l’assure à jamais de toute ma gratitude. J’ai pratiqué avec elle l’autonomie accompagnée. Je n’oublie pas non plus dans mes pensées Anne-Françoise Mingotaud.
Je souhaite exprimer mes remerciements respectueux au Professeur Armand Lattes dont j’ai apprécié la qualité de l’enseignement, les échanges dans le cadre de la Société Française de Chimie et qui a toujours été attentif à mes interrogations.
Je suis consciente du rôle de tout le personnel administratif du laboratoire dont la présence, la gentillesse et l’action sont vitales à son bon fonctionnement. Merci à Florence, Josiane et Fabienne toujours promptes à régler les tracasseries paperassières ! Merci aussi à Arielle pour sa disponibilité lors de la demande tardive d’un solvant et si vite résolue ! Merci également à Fernanda, pour ses conseils avisés sur la sécurité au laboratoire, et surtout pour ses recommandations de ce qu’il ne faut pas faire ! Yann, merci pour ton aide en informatique : sans ta mise en place des serveurs, j’aurai eu beaucoup de mal à pouvoir travailler ! Merci encore à Sandrine, Christian et Jean-Christophe pour vos interventions rapides et fiables lors de la livraison de produits, pour l’approvisionnement en « petit matériel » (si grandement important !), et pour les analyses en HPLC et Masse. Enfin, un grand merci à Richard : sans toi pas de produits commandés, donc pas de manips…, pas de billets d’avion ou de train réservés ; et surtout merci pour ton efficacité à régler les dossiers en cours et les dépenses engagées !
stagiaires se sont succédés dans le groupe : Christiane (partie à Dijon pour la thèse), Marta (retournée à Saragosse), Mathieu (ou comment parler un anglais parfait en France et vivre maintenant aux states), Raphaëlle, Aurélie et Clara, quels fous rires ! Vous êtes dans mon souvenir. Dr Kamil, mon collègue de Master 2, nous nous sommes suivis dans cette aventure de thèse et avons franchi la ligne d’arrivée à peu d’intervalle de temps. Merci pour ta gentillesse et ton amitié…. et à bientôt en Irlande !
Nelly, merci pour ton amitié constante, les pauses thé ou café d’après midi au laboratoire. Depuis le monde austral, tes emails m’ont fait tant sourire quand j’étais plongée dans la rédaction… votre périple : un vrai plaisir des yeux, un puissant stimulant mental et je m’évadais avec toi et Yoann !
Je n’oublie pas tous mes collègues du troisième étage grâce à qui ces années sont passées de façon très agréable, vous étiez le plus nécessaire, toujours présents. Guillaume, Corine, votre gentillesse et vos conseils dès mes débuts en Master 2 ont permis d’ouvrir une belle histoire d’amitié dans le groupe polymères des IMRCP.
Merci à Ménana, Roland, Cristina, Hugo, Roberto, Ariane, Marta, Maria-Jose, Alex, Plamen, Jose, Rawad, Elisabeth, Sheila, Lacra, Wael, Katrin la douce allemande, pour toutes les pauses-café et discussions impromptues de fin d’après-midi, de début de soirée au laboratoire. Egalement un merci particulier pour mes amis du bâtiment de chimie : en particulier bravo à Périne et Mona qui ont fini un peu avant moi et courage à celle qui suit. Tu verras Céline, ce n’est que du bonheur …. après !!!! ;)
Les réunions du monitorat, au CIES, ont été plus qu’utiles … … et agréables grâce à ta présence Périne ! Nos fous rires et nos bons moments pendant les stages resteront d’excellents souvenirs de la team toulousaine. Bonne chance sur Paris !
Plus que merci à Maité, Esther pour votre amitié, vos sourires et vos regards pleins d’encouragements et de réconforts lors des journées longues et des débuts de soirée au laboratoire…, le chemin vers la porte 3010 est gravé dans ma mémoire. J’ai découvert une autre équipe avec vous deux, Jean-Pierre et Patricia (café, petits gâteaux, causettes diverses … etc … ) qui a crée une estime réciproque et une confiance rassurante.
Il y a aussi Hafida Gaspard, Maitre de Conférence : nous nous sommes rencontrées, moi étudiante en Deug et toi enseignante de TP de chimie organique. Depuis, nous avons gardé ce lien, enseigné la même matière ce qui a permis de forger une solide et amitié vraie. Vraiment merci pour tout !
Les échanges ERASMUS ont quelque chose de magique, ils vous permettent de rencontrer une multitude de personnes venues d’ailleurs …
Par delà les pyrénées et du sud de l’Ibérie, Montse, Gemma, Architectes d’Etat espagnoles, le programme Erasmus a permis notre rencontre à Toulouse, un partage au quotidien et tant d’échanges sur nos cultures respectives. J’ai passé avec vous et vos familles, un moment plus
entre la Garonne et le Guadalquivir, que de promenades sur leurs rives, ici et là-bas.
Lali, Jordi, Vanessa, Carol, Veronica, Clara, Carolina, la chaîne pyrénéenne catalane amène une atmosphère particulière à Toulouse… Toutes ces années remplies de repas, de fêtes, d’anniversaires, de week-ends et également de voyages, sont à jamais fixées dans ma mémoire, gracias, y hasta pronto ! C’est de tout mon cœur que je vous remercie.
En regardant maintenant par delà les océans, il y a aussi le Japon, terre si lointaine et qui a envoyé Shuko, l’amie formidable. Tes paquets remplis de tout ce que tu pouvais trouver à m’envoyer m’ont tant donné le sourire et tant intrigué les postiers ;) Merci pour ta constance dans nos écrits et nos échanges. Félicitations pour ta maitrise de la langue de Molière que tu enseignes. Je sais que tu attends ma venue au japon : prochainement c’est promis !
Camille et François (bientôt trois), Chris (nous sommes de nouveau dans la même ville !), Arnaud avec Jeanne et la petite Lara, Auré, Nico, Gégé, Guill, Laure, Charly, Julien, Audrey, Ben, Cécile : nous avons tous « grandis » mais pas foncièrement beaucoup changé. Avec vous tous un moment privilégié, une tranche de vie et cette amitié toujours plus forte continue, cela me fait extrêmement plaisir.
Mes remerciement se portent maintenant vers mon entourage…
Je vous remercie tous vivement : ceux qui de près ou de plus loin ont participé à l’édifice de ce chapitre de vie, apportant chacun leur pierre, leurs conseils et leur affection.
Ma famille toute entière m’a toujours accompagnée et encouragée : leur présence et attention ont été décisives.
Je tiens à remercier mes parents pour leur soutien permanent, constant et surtout sans aucune faille ; avec la patience et la confiance que vous avez toujours placée en moi, vous m’avez permis d’avancer en toute quiétude.
Merci grands parents trop tôt disparus, amis (Jacques et Lili, Claire et Amine depuis Paris et Philadelphie) pour tous les moments partagés et votre présence rassurante.
Merci à mon oncle d’avoir ouvert la voie : tu as toujours été soucieux de mon parcours et tu m’as encouragée dans ces longues études … J’ai tant apprécié ta présence avec Hélène le jour du grand oral.
Je terminerai en pensant, sans les nommer à tous ceux que j’ai croisé sur mon chemin et qui ont contribué à rendre possible mon parcours.
« La science est d’un goût amer à ses débuts,
mais à la fin elle est aussi douce que le miel »
Inscription sur un plat, Nishapur (Iran) Xème siècle
«Era el cielo de un azul límpido y puro, glorioso de luz y de calor. Entre las copas de las palmeras, más allá de las azoteas y
galeriás blancas que coronaban el jardín,
una torre gris y ocre se erguía esbelta como el calíz de una flor»
Ocnos – «Jardín antiguo» Alcazar – Sevilla
à mes parents
Sommaire
Introduction
1
CHAPITRE 1 Mise au point bibliographique
5
I. Les liquides ioniques 9
I-1. Structure des liquides ioniques 9
I-1.1. Introduction 9
I-1.2. Liquides ioniques chiraux 10
I-1.2.a) Structures 10
I-1.2.b) Applications 12
I-2. Propriétés des liquides ioniques 16
II. Utilisation des liquides ioniques 19
II-1. La réaction de Heck 20
II-1.1. Généralités 20
II-1.2. Les ligands utilisés 22
II-1.3. Les ligands carbènes 23
II-1.4. Les réactions en transferts de phases 23
II-2. La réaction de Heck en liquides ioniques 24
II-2.1. Introduction 24
II-2.2. Mécanisme mis en jeu 25
II-2.2.a) Les carbènes 25
II-2.2.b) Les nanoparticules 26
II-2.3. Les liquides ioniques fonctionnalisés 27
II-2.4. Les sels de diazonium 29
III. Les milieux organisés 31
III-1. Les molécules amphiphiles 31
III-2. Organisation des tensioactifs en solution dans l’eau 32
III-2.1. Les micelles 32
III-2.2. Les phases lyotropes 34
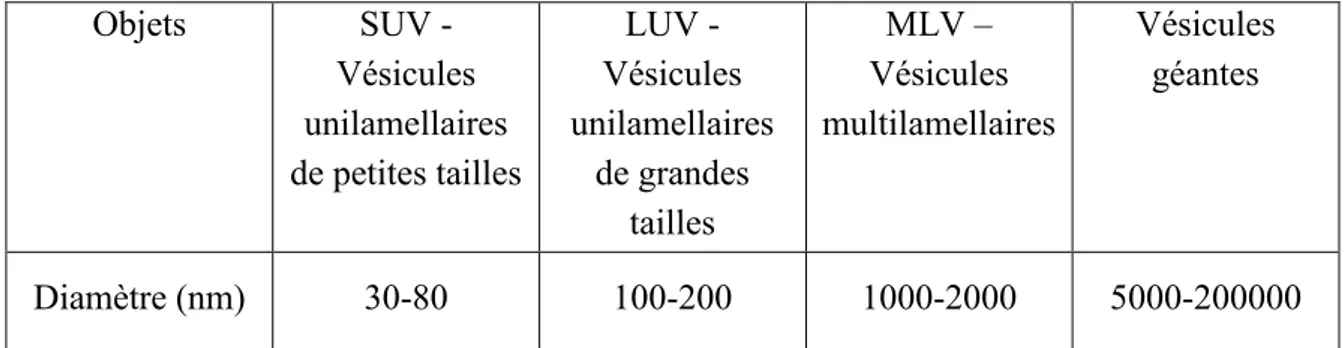
III-2.3. Les vésicules 35
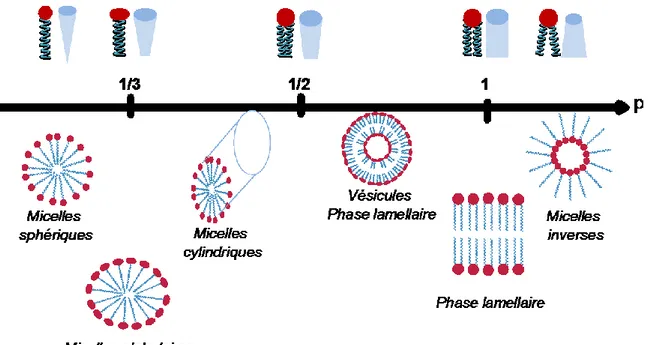
III-2.4. Relation structure – morphologie des phases formées 36
III-3. Emulsions et microémulsions : généralités 38
III-3.1. Les émulsions 38
III-3.2. Les microémulsions 39
III-4. Organisation des tensioactifs dans d’autres solvants que l’eau 42
III-4.1. Introduction 42
III-4.2. Micelles en liquides ioniques 43
III-4.3. Phases lyotropes en liquides ioniques 46
III-4.5. Densité d’énergie de cohésion et paramètre de Gordon 47 III-4.5.a) Densité d’énergie de cohésion 47
III-4.5.b) Le paramètre de Gordon 48
III-5. Microémulsions en liquides ioniques 49
III-5.1. Microémulsions LI / TA / Huile 49
III-5.2. Microémulsions Eau/ TA / LI 51
III-5.3. Microémulsions LI / TA / LI 51
IV. Réactivité en phases organisées 52
V. Conclusion et objectifs de la thèse 55
Bibliographie 56
CHAPITRE 2 Liquides ioniques solvants et contre-ions de catalyseurs
palladés
67
Introduction 70
I. Choix du système étudié 71
I-1. Catalyseurs de palladium utilisés 72
I-1.1. Synthèse du catalyseur bis (1-butyl-3-méthylimidazolium) tétrachloro
Palladium II [Bmim]2[PdCl4] 73
I-1.2. Synthèse du catalyseur bis ((R)1-phényléthylpyridinium) tétrachloro
Palladium II [Pyr*]2[PdCl4] 73
I-2. Choix des conditions de réaction 75
I-3. Méthode de séparation et procédure d’analyse 76
II. Réaction de Heck en liquide ionique catalysée par des sels de palladium 77
II-1. Choix du temps de réaction 77
II-2. Recyclabilité des solutions catalytiques 78
II-2.1. Etude de l’évolution des rendements 78
II-2.2. Les nanoparticules inhérentes au système 79
II-2. Influence de la quantité de catalyseur 82
III. Nature des catalyseurs utilisés 84
III-1. Présence de carbènes ? 84
III-2. Les nanoparticules préformées et leur utilisation 86
III-3. Phénomène de « leaching » 88
IV. Phénomène d’échange 89
IV-1. Analyse RMN 89
IV-2. Analyse Infrarouge 92
V. Conclusion 94
CHAPITRE 3 Organisations moléculaires en liquide ionique
97
Introduction 101
I. Vésicules en liquides ioniques 102
I-1. Choix du tensioactif 102
I-2. Choix des liquides ioniques 102
I-3. Détermination de la concentration d’agrégation critique (CAC) 103
I-4. Préparation de vésicules en solvants ioniques 106
I-4.1. Caractérisation par Analyse Enthalpique Différentielle 108
I-4.2. Caractérisation par Microscopie Optique 112
I-4.3. Caractérisation par Microscopie Electronique à Transmission 113
I-4.4. Caractérisation par Diffusion Dynamique de la Lumière 115
I-4.5. Essai de caractérisation par Diffusion de Neutrons aux Petits Angles 116
I-5. Conclusion 116
II. Microémulsions en liquide ionique 117
II-1. Choix des Composants 117
II-1.1. Liquides ioniques 117
II-1.1.a) Synthèse du bis(trifluorométhylsulfonyl) amidure de (R)-1 ou (S)-1-phényléthyl pyridinium. 118
II-1.1.b) Synthèse du bis(trifluorométhylsulfonyl) amidure de benzylpyridinium (BnPyrNTf2) 119
II-1.1.c) Température de transition vitreuse de BnPyrNTf2 120
II-1.1.d) Densité de BnPyrNTf2 120
II-1.2. Tensioactif 121
II-1.3. Huile 121
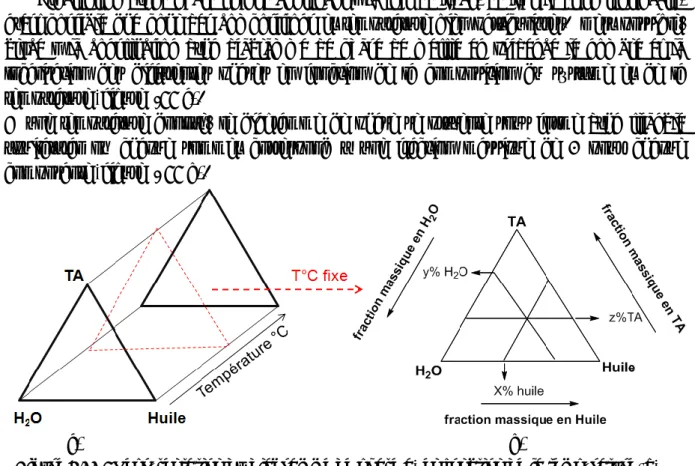
II-2. Construction du diagramme ternaire 122
II-2.1. Recherche du domaine monophasique 122
II-2.1.a) Détermination des solubilités des mélanges binaires à 27°C 122
II-2.1.b) Recherche de la ligne de démixtion 123
II-2.2. Recherche des phases organisées dans le domaine monophasique 123
III. Identification et caractérisation des microémulsions 128
III-1. Synthèse du liquide ionique deutéré 128
III-2. Analyse par Diffusion Dynamique de la Lumière 130
III-3. Analyse par Diffusion de Neutrons aux Petits Angles 133
III-3.1. Principe 133
III-3.1.a) Fonctionnement : source et détection 133
III-3.1.b) Notion de contraste 134
III-3.1.c) Gammes de vecteurs de diffusion 136
III-3.2. Analyses des microémulsions 136
III-3.2.c) Détermination des rayons de giration 139
III-3.2.d) Microémulsions 140
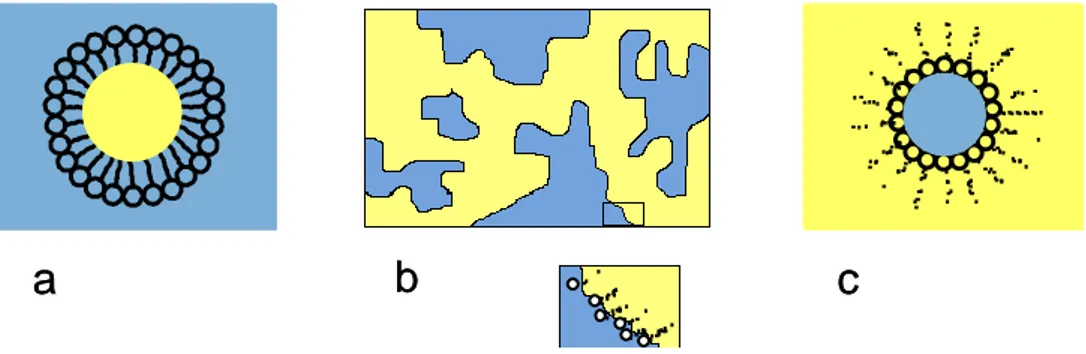
III-3.3. Autres phases 144
III-3.3.a) Zone bicontinue 145
III-3.3.b) Zone riche en liquide ionique 146
III-3.3.c) Micelles de triton en liquide ionique BnPyrNTf2 ? 147
IV. Conclusion 148
Bibliographie 149
CHAPITRE 4 Réactivité en microémulsions
151
Introduction 154
I. Choix de la réaction 154
II. Réactions avec le catalyseur Pd2(dba)3 157
II-1. Phase continue 157
II-2. Microémulsions BnPyrNTf2 / Triton / Toluène 158
II-3. Réactivité en microémulsion chirale Pyr*NTf2 / Triton TX-100 / Toluène 159
III. Réaction avec un catalyseur chiral : [Pyr*]2[PdCl4] 162
III-1. Phase continue 162
III-2. Microémulsions BnPyrNTf2 / Triton / Toluène 162
IV. Conclusion 163
Bibliographie 164
Conclusion
165
Partie Expérimentale
169
I. Appareillages 174
II. Produits et Solvants 177
III. Synthèse de Heck en liquide ionique 180
III-1. Synthèses des catalyseurs de palladium 180
III-1.1. Synthèse de [Bmim]2[PdCl4] 180
III-1.2. Synthèse de [Pyr]2*[PdCl4] 180
III-2. Synthèse du bis [(R)1-phényléthylpyridinium] tétrachloropalladium 182 III-3. Protocole général de la réaction de Heck en liquide ionique 184
III-3.1. 1er cycle 184
III-3.2.a) Analyse HPLC 184 III-3.2.b) Rendement d’extraction en trans-stilbene 185
III-3.2.c) Courbe de calibration 185
III-3.2.d) Cycles suivants 186
III-3.3. Microscopie Electronique à Transmission 186
III-4. Protocole général de la réaction de Heck en liquide ionique utilisant les
nanoparticules préformées 187
III-4.1. Préparation des nanoparticules de Palladium à partir des précurseurs
[Bmim]2[PdCl4] et [Pyr*]2[PdCl4] 187
III-4.2. MET 187
III-4.3. Réaction 187
IV. Synthèses des Liquides Ioniques 188
IV-1. Synthèse du bis(trifluorométhylsulfonyl) amidure de (R)-1- ou (S)-1-phényléthyl
pyridinium 188
IV-2. Synthèse du Chlorure de Benzylpyridinium (BnPyrCl) 189 IV-3. Synthèse du bis(trifluorométhylsulfonyl) amidure de benzylpyridinium
(BnPyrNTf2) 192
IV-4. Synthèse du Chlorure de Benzylpyridinium Deutéré 193
IV-5. Synthèse du bis(trifluorométhylsulfonyl) amidure de benzylpyridinium
(BnPyrNTf2) Deutéré 193
V. Vésicules de DPPC en liquides ioniques 194
V-1. Tensiométrie : détermination de la CAC du DPPC dans BmimBF4, EmimNTf2 et
BmimPF6 194
V-2. Vésicules : Préparation et Analyses 196
V-2.1. Protocole général pour la formation des vésicules multilamellaires 196 V-2.2. Analyse Enthalpique Différentielle de vésicules de DPPC dans l’eau, dans BmimBF4 et EmimNTf2 ainsi que dans des mélanges H2O/BmimBF4 196
V-2.3. Observation par Microscopie optique de vésicules de DPPC dans BmimBF4
et EmimNTf2 197
V-2.4. Microscopie électronique à transmission et diffusion dynamique de la lumière 197
V-2.4.a) Préparation des échantillons à analyser 198
V-2.4.b) Préparation des grilles de MET 198
V-2.4.c) Diffusion dynamique de la lumière 199
VI. Microémulsions Liquide ionique / Tensioactif / Toluène 199
VI-1.1. Construction du diagramme ternaire BnPyrNTF2 / Triton TX-100 / Toluène
199
VI-1.1.a) Détermination des solubilités des mélanges binaires à 27°C 199
VI-1.1.c) Conductimétrie 200
VI-1.1.d) Densité 201
VI-2. Etude par diffusion de neutrons aux petits angles (DPNA) 202
VI-2.1. Densité de longueur de diffusion des atomes 202
VI-2.2. Densités de longueur de diffusion des composés organiques utilisés 202 VI-2.3. Préparation des solutions étalons toluène H / toluène D 203
VI-2.4. Préparation de vésicules de DPPC deutéré 204
VI-2.5. Préparation des microémulsions BnPyrNTF2 / Triton TX-100 / Toluène 204
VI-3. Etude des microémulsions par diffusion dynamique de la lumière 206
VII. Synthèse de Matsuda-Heck 207
VII-1.Synthèse des sels d’aryl diazonium 207
VII-1.1.Synthèse du tétrafluoroborate de phényldiazonium 207 VII-1.2.Synthèse du tétrafluoroborate de para-méthoxyphényldiazonium 208 VII-2.Couplage de Matsuda-Heck en solvant acétonitrile 208 VII-3.Couplage de Matsuda-Heck en Liquides Ioniques BmimPF6 et BnPyrNTf2 209
VII-3.1.Réaction avec les catalyseurs [Bmim]2[PdCl4] et [Pyr*]2[PdCl4] 209
VII-3.2.Réaction avec les nanoparticules (nP) préformées 209
VII-3.3.Analyse CPG chirale 210
VII-4.Couplage de Matsuda-Heck en microémulsions LI/ Huile 211
VII-4.1.Microémulsions utilisées 211
VII-4.2.Réaction de Matsuda-Heck en nanoréacteurs 212
Annexes 215
Depuis quelques années, les liquides ioniques sont utilisés pour le remplacement des solvants organiques volatils (SOV) dans le cadre du développement durable. Ils constituent donc une nouvelle classe de solvants aux propriétés physico-chimiques remarquables parmi lesquelles leurs très faibles tensions de vapeur, leur grande stabilité thermique, leur non-inflammabilité et leur haut pouvoir solvatant. Ces caractéristiques sont modifiables à souhait en faisant varier la structure de l’anion et du cation. Récemment, ces solvants particuliers ont montré qu’ils sont capables d’induire la formation d’agrégats moléculaires tels que des micelles. Cette aptitude permet l’ouverture de tout un domaine de recherche sur l’utilisation de ces objets en réactivité, bio-réactivité et en conception de matériaux contrôlés.
Dans ce travail nous nous sommes intéressés aux liquides ioniques comme solvant de réactions, de contre-ions de catalyseurs et de solvant d’agrégation.
Nous présenterons tout d’abord dans le chapitre 1, une mise au point bibliographique sur les liquides ioniques, ainsi que leur utilisation dans le processus catalytique de Heck en s’attachant à la description des différents mécanismes mis en jeu. Ensuite, l’aptitude des liquides ioniques à former des associations de molécules amphiphiles sera évaluée. L’état de l’art sur les microémulsions utilisant des liquides ioniques sera présenté.
Dans le chapitre 2, nous décrirons la synthèse de catalyseurs de palladium avec des contre-ions de motif liquide ionique (imidazolium et pyridinium), ainsi que leur utilisation dans une réaction de couplage de Heck réalisée en liquide ionique. Leur activité catalytique sera évaluée et comparée avec celle de catalyseurs commerciaux.
Dans le troisième chapitre, la formation d’agrégats moléculaires par auto-association d’amphiphiles dans ces solvants ioniques sera présentée. Ainsi seront décrits d’une part, l’établissement de vésicules de phopholipides et d’autre part, un autre type d’organisation que sont les microémulsions. Le diagramme de phase de ces systèmes tripartites (liquide ionique, tensioactif et huile) sera présenté. Les différentes phases seront caractérisées par des études en diffusion de la lumière et diffusion de neutrons aux petits angles. Une attention plus prononcée sera portée sur les microémulsions inverses.
La réactivité en microémulsions inverses sera évaluée dans le dernier chapitre sur une réaction de Matsuda-Heck régiospécifique et stéréospécifique entre une oléfine prochirale et un sel d’aryl diazonium. Un catalyseur palladé chiral, et un liquide ionique chiral seront utilisés dans le but d’évaluer un éventuel transfert de chiralité en milieu confiné.
Chapitre 1
I. Les liquides ioniques 9
I-1.Structure des liquides ioniques 9
I-1.1. Introduction 9
I-1.2. Liquides ioniques chiraux 10
I-1.2.a) Structures 10
I-1.2.b) Applications 12
I-2.Propriétés des liquides ioniques 16
II. Utilisation des liquides ioniques 19
II-1. La réaction de Mizoroki - Heck 20
II-1.1. Généralités 20
II-1.2. Les ligands utilisés 22
II-1.3. Les ligands carbènes 23
II-1.4. Les réactions en transferts de phases 23
II-2. La réaction de Heck en liquides ioniques 24
II-2.1. Introduction 24
II-2.2. Mécanisme mis en jeu 25
II-2.2.a) Les carbènes 25
II-2.2.b) Les nanoparticules 26
II-2.3. Les liquides ioniques fonctionnalisés 27
II-2.4. Les sels de diazonium 29
III. Les milieux organisés 31
III-1.Les molécules amphiphiles 31
III-2.Organisation des tensioactifs en solution dans l’eau 32
III-2.1. Les micelles 32
III-2.2. Les phases lyotropes 34
III-2.3. Les vésicules 35
III-2.4. Relation structure – morphologie des phases formées 36
III-3.Emulsions et microémulsions : généralités 38
III-3.1. Les émulsions 38
III-3.2. Les microémulsions 39
III-4.Organisation des tensioactifs dans d’autres solvants que l’eau 42
III-4.1. Introduction 42
III-4.2. Micelles en liquides ioniques 43
III-4.3. Phases lyotropes en liquides ioniques 46
III-4.4. Vésicules en liquides ioniques 46
III-4.5. Densité d’énergie de cohésion et paramètre de Gordon 47
III-4.5.b) Le paramètre de Gordon 48
III-5.Microémulsions en liquides ioniques 49
III-5.1. Microémulsions LI/ TA / Huile 49
III-5.2. Microémulsions Eau/ TA / LI 51
III-5.3. Microémulsions LI / TA / LI 51
IV. Réactivité en phases organisées 52
Conclusion et objectifs de la thèse 55
I. Les liquides ioniques
Les méthodes classiques utilisant des solvants organiques sont une source significative de pollution et depuis quelques années, les liquides ioniques sont apparus comme une nouvelle classe de solvants alternative aux SOV (solvants organiques volatils) dans le contexte de la « chimie verte » et du développement durable.
Les liquides ioniques sont depuis déjà plus d’une vingtaine d’années convoités et utilisés, aussi bien en synthèse organique,1 en électrochimie2 que lors des processus de biocatalyse.3, 4
Cette classe de solvants a été découverte dans le début du 20ème siècle par Paul Waden qui a mis en évidence le premier sel fondu, le nitrate d’éthylammonium ([EtNH3] [NO3]), dont la
température de fusion est de 12°C.5 Le terme liquide ionique ne sera employé que plus tard. Ce n’est qu’à la fin des années 1970 que des liquides ioniques composés d’anions comme les chloroaluminates ou de cations tels que les alkylphosphoniums furent synthétisés. Ils représentent la « première génération » de liquides ioniques, basés sur le contre-ion AlCl3-
ou Al2Cl72- mais comportent un inconvénient majeur, celui de ne pas être stables à l’air.
Bien que la plupart des sels ne fondent qu’à de hautes températures, il existe une classe particulière de liquides ioniques qui sera utilisée dans cette étude, appelée RTIL’s («room temperature ionic liquids»), ceux liquides à température ambiante (< 100°C).
I-1. Structure des liquides ioniques
I-1.1. Introduction
Ces solvants sont formés par l’association d’un cation organique et d’un anion. Compte tenu des variations possibles de structure presque infinies aussi bien au niveau des anions que des cations, la multiplicité de ces associations laisse entrevoir la formation d’un très grand nombre de structures,6 ayant des propriétés physiques et chimiques très variées. On peut également envisager la préparation ciblée d’un liquide ionique à façon en vue d’une application.
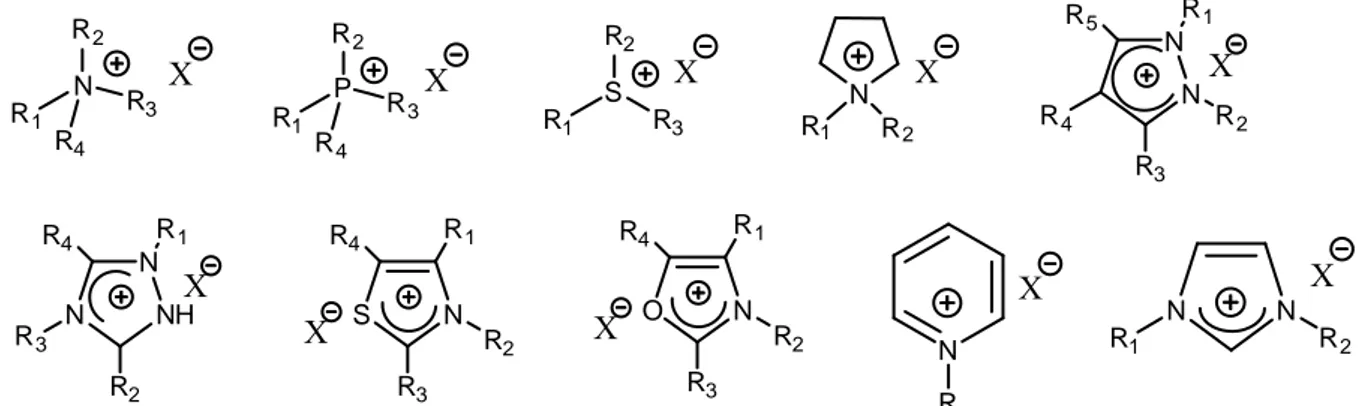
Généralement, les liquides ioniques les plus répandus présentent des cations de type sulfonium,7-9 phosphonium,10, 11 ammonium,12-14 pyrrolidinium,15-18 pyrazolinium,19 triazolium,20-22 oxazolium,23 , 24 thiazolium,25 pyridinium26-29 et imidazolium.30-34 Ils sont présentés dans la figure I-1.
N R2 R1 R4 R3 S R2 R1 P R2 R1 R4 R3 R 3 N R X X X X N N R1 R2 X N R1 R2 N N R4 R2 X R1 R5 R3 X N N NH R3 X R1 R4 R2 S N X R1 R4 R3 R2 O N X R1 R4 R3 R2
figure I-1 : Structure des cations des liquides ioniques les plus courants
On retrouve majoritairement l’utilisation des liquides ioniques à cations imidazolium (Im) et pyridinium (Pyr). Les contre-ions les plus couramment utilisés sont soit des anions inorganiques tels que BF4-, PF6-, Cl-, AlCl4-, SbF6- etc… soit des anions organiques (CF3SO3
-, (CF3SO2)2N-, CF3CO2- et CH3CO2- etc …)
Il existe également des structures de liquides ioniques sur lesquelles on introduit des groupes fonctionnels particuliers. Ce ne sont plus des liquides ioniques « innocents », mais sont à ce titre appelés liquides ioniques à tâche spécifique. 35, 36 Ce concept a été premièrement décrit par Davis et Wierbicki en 200037 et les définis comme des liquides ioniques possédant un groupe fonctionnel attaché de manière covalente soit à l’anion, soit au cation.
I-1.2. Liquides ioniques chiraux
I-1.2.a) Structures
Parmi toutes ces structures, il existe également des liquides ioniques chiraux.38 Le centre chiral peut être introduit soit au niveau de l’anion, soit du cation,39 soit des deux.
Le premier exemple de liquide ionique chiral a été décrit par l’équipe de Sheddon.40 Il s’agit du ([bmim] [(-)-lactate]) où la structure acquiert sa chiralité par l’anion. Ce liquide ionique est préparé par réaction entre le BmimCl et le (S)-2-hydroxypropionate de sodium.
N N C C HO H H3C O O
figure I-2 : Structure du [Bmim] [(-)-Lactate]
De nouvelles structures ont été obtenues dans lesquelles l’anion est également chiral tels que le (S)-10-camphrosulfonate,41 le (R)-1,1’- binaphthylphosphate41 qui possèdent tous deux des cations à motif imidazolium.
La chiralité peut être également apportée par le cation, avec par exemple des séries imidazolium ou imidazolinium (figure I-3) comme les liquides ioniques synthétisés par Génisson et coll.42 N N * Me Ph C5H11 N N * Me Ph C5H11 X X X = BF4ou NTf2
figure I-3 : Liquides ioniques à motif imidazolium et imidazolinium
Un liquide ionique à motif pyridinium chiral, a été développé au laboratoire par Patrascu et coll28 et la voie de synthèse (figure I-4) permet l’obtention des deux énantiomères purs. Seul celui possédant l’anion amidure de trifluorométhylsulfonyle (NTf2-) est un liquide à
température ambiante et sera utilisé comme solvant dans le quatrième chapitre.
HBF4 NaPF6 LiNTf2 N Me Ph NTf2 N Me Ph BF4 N Me Ph PF6 N Me Ph Cl N Ph NH2 Me R ou S 65 110 - 30 Point de fusion (°C)
figure I-4 : Voies de synthèse, structures et points de fusion des sels de (R) et (S)-1-phényléthyl pyridinium
Il existe des entités qui dérivent du “chiral pool”.24, 39, 43, 44 Ces liquides ioniques chiraux sont obtenus à partir de précurseurs tels que des aminoalcools, des sucres, des acides aminés45 etc …
A titre d’exemple, quelques structures de liquides ioniques chiraux sont données dans la figure I-5.
N HO OH N N N Me O CH3 CH3 CH3 O H3N H H3C [(CF3SO2)2N] O MeO MeO OMe N Tf O N Br N N [(CF3SO2)2N] S N R BF4/ PF6 [(CF3SO2)2N] Me SO3 O N N Bu SO3 O N N [(CF3SO2)2N] [(CF3SO2)2N]
figure I-5: Exemples de structures de liquides ioniques chiraux 39 , 46, 47 , 48, 49
I-1.2.b) Applications
Ces structures chirales sont très attractives pour les chimistes et permettent des applications potentielles en discrimination chirale,49 en incluant les synthèses asymétriques et les résolutions optiques de racémates. Elles sont aussi utilisées pour des applications spectroscopiques et pour des applications chromatographiques.50
Nous allons nous intéresser principalement aux liquides ioniques utilisés en tant que solvant, comme milieu de réaction et pouvant par la même induire des stéréo- et des énantiosélectivités.
La première induction asymétrique significative a été réalisée pour la réaction de Baylis-Hillman,51 entre le benzaldéhyde et l’acrylate de méthyle, en présence d’une base (DABCO) et de 0,5 à 3 équivalents de liquide ionique chiral (figure I-6).
O
OMe O
DABCO LI chiral Temp. amb. 3 jours
OH OMe O N R Z X R: C 4H9, C8H17, C10H21, C16H33 X: OTf, PF6 Z: OH, OAc Rdmt : 60 %
figure I-6 : La réaction asymétrique de Baylis-Hillman en présence de LI chiraux.
Le meilleur excès énantiomérique (44% pour l’énantiomère R) a été obtenu pour R = C8H17,
X = OTf et Z = OH.
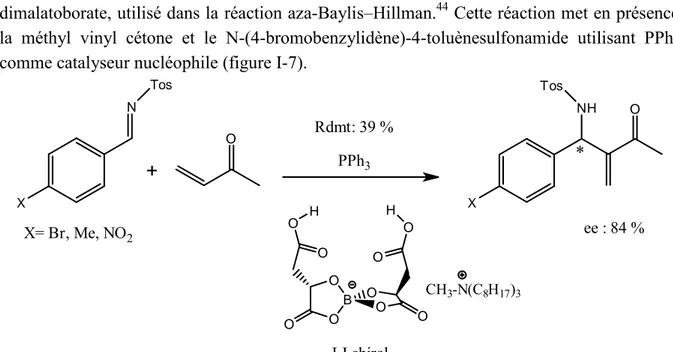
Jusqu’à présent, les meilleurs résultats (ee 84%) sont attribués au groupe de Leitner qui ont mis au point un liquide ionique possédant un anion chiral, le méthyltrioctylammonium dimalatoborate, utilisé dans la réaction aza-Baylis–Hillman.44 Cette réaction met en présence la méthyl vinyl cétone et le N-(4-bromobenzylidène)-4-toluènesulfonamide utilisant PPh3
comme catalyseur nucléophile (figure I-7).
O B O O O O O O H O H O O X N Tos O X NH O Tos X= Br, Me, NO2 LI chiral CH3-N(C8H17)3 Rdmt: 39 % ee : 84 % PPh3
figure I-7: Réaction asymétrique de Aza-Baylis-Hillman réalisée dans le liquide ionique chiral dimalatoborate de méthyltrioctylammonium
La haute énantiosélectivité obtenue est attribuée à la stabilisation, par l’anion chiral du liquide ionique, de l’intermédiaire zwittérionique formé au cours de la réaction (figure I-8).
O P R R R H O R' squelette chiral
figure I-8 : Représentation de l’interaction bifonctionnelle possible entre l’intermédiaire zwittérionique et l’anion chiral du liquide ionique
D’excellents excès énantiomériques ont été mis en évidence en utilisant un liquide ionique jouant à la fois le rôle de catalyseur chiral et de solvant. Il s’agit de réactions organocatalysées comme les réactions de Michael, entre les aldéhydes ou les cétones avec les nitroalcènes. La L-proline est utilisée généralement comme catalyseur dans ce type de réaction (figure I-9).
N H N BF4 N H COOH
figure I-9 : Structure de la L-proline
Le remplacement de celle-ci par un liquide ionique portant un noyau pyrrolidine52 permet d’obtenir d’excellentes diastéréosélectivité (syn/anti supérieure à 99/1) et énantiosélectivité (ee = 99%) (figure I-10).
O Ph NO2 O NO2 Ph TFA, 5 % 4°C, 30h N H N BF4
figure I-10 : Réaction de Michael entre la cyclohexanone et le nitrostyrène en présence d’un liquide ionique pyridinium chiral à noyau pyrrolidine
Les auteurs ont également testé la recyclabilité du système, montrant la possibilité de réaliser trois cycles sans trop de pertes de rendement ni de stéréosélectivité.
Un exemple d’utilisation de liquide ionique avec un anion chiral a été décrit par Branco et coll. Ce liquide ionique possède un cation guanidinium avec un anion (acide quinique) qui dérive directement du pool chiral.53 Il sert de solvant dans une dihydroxylation asymétrique de Sharpless du styrène pour obtenir des diols vicinaux (figure I-11).
De très bons rendements (92 et 95%), ainsi que des excès énantiomériques importants (72 et 85%) sont obtenus, à température ambiante et en présence du système catalytique K2OsO2(OH)4/ N-Méthylmorpholine-N-Oxyde (NMO)
HO HO OH CO2 OH N R2N NR2 R = C6H13 Temp. Amb. 24h K2OsO2(OH)4, NMO
Rdmt = 95 %
OH OH
ee : 85 %
figure I-11 : Réaction de dihydroxylation de Sharpless en présence d’un liquide ionique à anion chiral
Les liquides ioniques chiraux trouvent également des applications dans les réactions de biotransformation telles que les hydrolyses enzymatiques. Le groupe de Zhao a réalisé l’hydrolyse de l’ester méthylique de la phénylalanine en solution aqueuse de liquides ioniques possédant des anions chiraux d’alpha-aminoacides.54 De meilleures énantiosélectivités ont été observées pour la L-phénylalanine en utilisant le liquide ionique avec l’aminoacide D.
O N N N H O O 30 °C, 40 min
Bacillus lichenif ormis protéase O
OH
O
ee : 93 %
figure I-12 : Réaction d’hydrolyse enzymatique en présence d’un liquide ionique à cation chiral
Cependant, l’exemple le plus surprenant de transfert de chiralité a été publié par l’équipe de Wasserscheid.55 Le liquide ionique chiral R-camphorsulfonate de N-méthylimidazolium sert à la fois de solvant mais également de réactif dans une réaction de Michael avec la méthyl vinyl cétone pour former le R-camphorsulfonate de N-(3’-oxobutyl)-N-méthylimidazolium. Ce produit ainsi formé, une réaction d’hydrogénation est réalisée, sous
60 bars d’hydrogène à température de 80°C, en utilisant comme catalyseur du ruthénium sur
charbon pour donner, après un temps de 8h, le R-camphorsulfonate de
N-(3’-hydroxybutyl)-N-méthylimidazolium avec un rendement quantitatif et des énantiosélectivités allant jusqu’à 80% en conservant l’anion camphrosulfonate R.
O3S O NH N N N O A = O 95 % 60 bar H2 80°C Ru/C, EtOH > 99 % N N OH A
figure I-13 : Réaction d’hydrogénation énantiosélective
Cependant, pour la réaction d’hydrogénation, l’utilisation d’un co-solvant est nécessaire, car la phase liquide ionique est trop visqueuse pour réaliser la réaction. A ce titre, les auteurs ont remarqué un fort lien entre l’augmentation de la concentration en liquide ionique chiral dans le milieu et l’augmentation de l’énantiosélectivité. Ceci indiquerait un effet important de la paire d’ions.
I-2. Propriétés des liquides ioniques
Les liquides ioniques présentent un certain nombre de propriétés physicochimiques qui font d’eux une classe de solvants très convoitée telles que leur facilité de préparation, leur haute stabilité thermique56 (qui les placent avantageusement en solvant de choix pour les réactions à haute température) ainsi qu’une pression de vapeur négligeable57 qui les rend non inflammables et facilement recyclables.
Ils possèdent également un grand pouvoir solvatant, qui leur permet de solubiliser une large gamme de composés organiques, inorganiques et également organométalliques, et sont liquides dans une large gamme de température. Ces deux dernières propriétés permettent de les envisager facilement comme solvants de réaction.
Les propriétés des LI sont principalement liées à leur possibilité d’agir en tant que donneur ou accepteur de liaison d’hydrogène.58 Les interactions de Van Der Walls sont un des paramètres important qui dépendent fortement du type d’anion mis en jeu. On peut ainsi noter que les liquides ioniques ayant un anion tétrafluoroborate (BF4) ont une viscosité plus
faible que ceux possédant un contre-ion hexafluorophophate (PF6).
Pour les liquides ioniques à motif dialkylimidazolium, la solubilité dans l’eau dépend de la nature des anions, de la température et de la longueur de la chaîne alkyle.
Les sels dont le cation est un motif 1,3-dialkylimidazolium sont les plus utilisés de part leur stabilité thermique et aussi leur faible interaction avec les anions.
N N
R1 R2
X
N N
X
figure I-14 : Motifs 1,3-dialkylimidazolium et 1-butyl-3-méthylimidazolium (Bmim)
Il est très difficile de prévoir les propriétés des liquides ioniques, car elles différent énormément en fonction du couple cation/anion choisi.
Ils sont généralement miscibles avec les solvants halogénés tel que le dichlorométhane et le chloroforme et peu miscibles avec l’éther éthylique, le toluène, le cyclohexane ou les alcanes. Par exemple, les liquides ioniques ayant le même cation 1-butyl-3-méthylimidazolium (Bmim) diffèrent par leurs anions; ceux contenant des anions BF4−, CF3SO3−, CF3CO2−, NO3−,
sont parfaitement miscibles à l’eau, alors que ceux ayant des anions PF6−, SbF6−, NTf2−,
montrent une très faible miscibilité à l’eau.
Pour une même série de cations 1-alkyl-3-méthylimidazolium (figure I-15), lorsqu’on augmente la longueur de la chaîne alkyle, l’hydrophobicité et la viscosité augmentent, alors que les densités et les tensions de surface diminuent.59
N N
X
CnH2n+1
figure I-15 : Structure des liquides ioniques à motif 1-alkyl-3-méthylimidazolium
Les liquides ioniques, les plus communément utilisés et disponibles facilement, de part leur synthèse sont les BmimPF6 et le BmimBF4 dont les principales propriétés ont été
présentées dans le tableau I-1. Anion Point de fusion (°C) Densité (g.cm-3) à 20°C Viscosité (cP) Indice de réfraction Température de décomposition (°C) BF4− − 81 1,17 154 1,42 403 PF6− − 61 1,37 397 1,43 349 CF3SO3− 16 1,29 90 1,44 nd NTf2− − 4 1,43 69 1,42 439
tableau I-1: Caractéristiques de quelques liquides ioniques à motif 1-butyl-3-méthylimidazolium60 ; nd : non déterminée
Les variations des températures, de changement d’état en fonction de la longueur de chaîne sont le résultat de la compétition entre deux phénomènes majeurs. D’une part, la température de fusion augmentant avec la masse molaire, augmente avec la longueur de chaîne. D’autre part, la dissymétrie des chaînes alkyles limite les interactions coulombiennes
entre les ions et réduit ainsi la cristallisation. Ainsi, un abaissement de la température de fusion apparaît lorsque la longueur d’une chaîne augmente. De plus, en fonction de la longueur de chaîne, les effets ne sont pas pondérés de la même manière et ne s’expriment donc pas avec la même intensité. Il existe donc un minimum. Ce phénomène est particulièrement net en ce qui concerne les 1-alkyl-3-méthylimidazoliums,61 et ce, quel que soit le contre-ion, comme le montre la figure I-16.
Cl -Br -BF4 -PF6 -(CF3SO2)2N -AlCl4 -CF3SO3 -Anions X N N Me R + R = CnH2n+1 n T e m p é ra tu re d e fu s io n
figure I-16 : Variation de la température de fusion en fonction de la longueur de chaîne alkyle pour les 1-alkyl-3-méthylimidazoliums
Les propriétés physiques et chimiques des liquides ioniques peuvent être altérées par la présence d’impuretés. Ainsi, la présence de traces d’halogénures peut avoir des effets néfastes sur certaines réactions dans lesquelles le liquide ionique est utilisé en tant que solvant. Quelques traces d’anions halides peuvent aller jusqu’à désactiver le catalyseur dans certaines réactions catalysées par les métaux de transitions, comme les hydrogénations.62 Les liquides ioniques qui possèdent un contre-ion hexafluorophosphate, peuvent, en présence d’eau, générer in situ du fluorure d’hydrogène HF.
La multiplicité des structures « cation + anion » (ou paire cation/anion) permet de créer judicieusement des liquides ioniques pratiquement adaptés à l’utilisation que l’on prévoit d’en faire. Ils sont donc devenus très attractifs et sont utilisés dans de diverses applications.
Il a été montré que les liquides ioniques imidazolium purs sont des solvants très structurés,63 dont l’organisation est liée à des liaisons ion-ion et des interactions faibles (forces de Van Der Walls et/ou liaisons hydrogène).
Les recherches de Watanabe et coll ont évalué l’influence de la longueur de chaine latérale du cation imidazolium.64 En augmentant le nombre d’atomes de carbone, les forces de Van Der Walls prennent au fur et à mesure le pas sur les interactions électrostatiques entre les parties chargées de la molécule (entre cation et anion). On estime qu’à partir d’une longueur de chaîne de quatre atomes de carbones (groupement butyle) se forment des microdomaines.
Très récemment, le groupe de Padua65 a réalisé une étude structurale en modélisation moléculaire de plusieurs liquides ioniques imidazolium où seule la longueur de la chaîne latérale alkyle est modifiée. Toujours à partir de cette même longueur limite (butyle), il apparaît une ségrégation des chaînes latérales par rapport à la partie chargée du sel fondu.
figure I-17 : Représentation du liquide ionique 1-hexyl-3-méthylimidazolium hexafluorophosphate. Les zones en rouge représentent les zones chargées (cation
imidazolium et anion PF6-) et celle en vert la chaîne latérale hexyle apolaire.
250 espèces LI ont été représentées dans cette structure.
Les auteurs ont réalisé la même étude avec un anion NTf2- (amidure de
trifluorométhylsulfonyle) et les simulations mènent à des résultats similaires, ce qui montre l’existence d’une structure hétérogène de ces liquides ioniques.
II. Utilisation des liquides ioniques
Les applications des liquides ioniques sont nombreuses, et on retrouve leur utilisation dans divers domaines, allant des applications analytiques66, 67 aux processus de stockage d’énergie,2 à l’électrochimie,68 jusqu’aux sciences des polymères69 en passant par les processus photochimiques.70 Ils sont également utilisés dans les procédés sol-gel, permettant de former des composés hybrides appelés ionogels, dans lesquels ceux-ci sont confinés dans des matrices de silices poreuses.71, 72
Ne possédant pratiquement pas de pression de vapeur, ils sont ainsi attractifs pour des processus gazeux. Par exemple, des sels d’imidazolium fonctionnalisés avec des amines primaires73 peuvent capturer le CO2 en formant des carbamates d’ammonium.
La synthèse organique dans les liquides ioniques est un domaine très dynamique et un très grand nombre de réactions ont été transposées dans ces milieux. Leur utilisation réussie en tant que solvant a été démontrée pour une large classe de réactions, incluant les réactions catalysées par des métaux de transition.
En utilisant la réaction d’acylation de Friedel et Craft,74 de nombreuses molécules, telles que des parfums ou des médicaments ont été synthétisés. La Pravadoline est un exemple de synthèse totale d’une molécule pharmaceutique menée en liquides ioniques75 ainsi que celle de la Paroxétine76.
Les réactions de cycloadditions de type Diels et Alder40 et les additions organocatalysées de Michael77 ont également été réalisées en liquides ioniques.
Il en est de même de la catalyse organométallique.78, 79 Le principal apport des liquides ioniques est lié à la possibilité d’immobiliser des catalyseurs dans ces milieux et de pouvoir ainsi travailler en milieu biphasique sans perte de catalyseur (leaching) avec la possibilité de recyclage.
Un des premiers travaux publié sur ce thème réside en l’utilisation de liquides ioniques en catalyse homogène décrite par Chauvin et coll en 1990,80 pour la dimérisation du propène. Ensuite, des sels de N, N-dialkylimidazolium ont été utilisés en catalyse biphasique dans l’hydroformylation des oléfines catalysées par le rhodium (processus chimique catalytique industriel), l’isomérisation et l’hydrogénation asymétrique, démontrant la possibilité de récupération du catalyseur. Par la suite d’autres réactions comme le couplage de Heck,81 la métathèse des oléfines ainsi que la télomérisation du butadiène avec le méthanol82 ont également été développées en milieu liquide ionique.
Depuis, de nombreux groupes83-85 ont développé des recherches sur l’étude de systèmes catalytiques dans les liquides ioniques.
Dans ce contexte, l’utilisation des liquides ioniques pour immobiliser les catalyseurs a été une des plus productives dans les recherches mises en œuvre.
Par exemple, le liquide ionique BmimPF6, insoluble dans l’eau et dans les alcanes a la
particularité de dissoudre facilement de nombreux catalyseurs de métaux de transition.86 Une des approches les plus prometteuses dans l’utilisation des systèmes biphasiques est la préférence du catalyseur qui diffère de celle du réactif, ce qui permet la récupération du catalyseur par simple séparation de phase.
En dépit de leur grande potentialité en tant que vecteurs pour l’immobilisation des catalyseurs, ces systèmes ont toujours une tendance à la perte de catalyseur (leaching). En effet, lors de la récupération du produit formé, une infime partie de catalyseur se retrouve dans la phase extraite, car dissout dans le solvant d’extraction. Pour surmonter ou du moins réduire cette perte de catalyseur, des motifs imidazolium ont été incorporés au ligand ou au précurseur de catalyseur résultant à la mise en valeur de la recyclabilité de celui-ci et par la même la réactivité en liquide ionique.87
II-1. La réaction de Mizoroki - Heck II-1.1. Généralités
Les propriétés catalytiques du palladium sont utilisées pour la formation de liaisons C-C, et étudiées très largement dans de nombreux processus parmi lesquels, les réactions de Miyaura et de Suzuki,88 celle de Sonogashira89 et le couplage de Stille.90
Parmi les réactions les plus utilisées en synthèse organique existe la réaction de Heck qui permet de créer une liaison C-C entre une oléfine et un composé halogéné insaturé ou un triflate aromatique. Le terme de Heck est associé en tout premier lieu à l’arylation catalytique
des oléfines, originellement découverte par Mizoroki91 et Heck.92 Cette réaction peut être soit intramoléculaire, soit intermoléculaire. Elle est parfaitement adaptée à une éventuelle automatisation car elle ne nécessite pas d’être réalisée sous une atmosphère inerte. Elle consiste en plusieurs étapes qui se suivent lors de l’établissement d’un cycle catalytique (figure I-18).93 Pd L Pd Base Base / HX PdII Pd0 élimination réductrice addition oxydante insertion migratoire béta-H-élimination PdII PdII PdII PdII PdII R1-X Pd X L R1 X L Pd R1 X L R2 L R2 Pd L X L R2 Pd H L X L Pd H L X L R1 R2 R1 R2 R1 L L X
figure I-18 : Cycle catalytique de Heck
- La première étape est l’activation qui consiste au passage du palladium (II) au palladium (0). Cette réduction est généralement réalisée grâce à l’addition dans le milieu réactionnel d’une phosphine.94 Cette réduction peut être également réalisée avec des amines telle que la triéthylamine.86, 95
- L’étape d’addition oxydante est un processus concerté dans lequel la rupture de la liaison C-halogène est pratiquement simultanée avec la formation des liaisons métal-C et métal-halogène. L'ordre de réactivité des halogénures vis-à-vis de l'addition oxydante est I >OTf > Br >> Cl.96 Un substituant électroattracteur (COCH3, NO2 …) sur le cycle aromatique
active le substrat pour cette étape et un substituant électrodonneur (OMe …) le désactive. - L’insertion migratoire est l’étape de réalisation du produit, lors de la formation de la
- La dernière étape du cycle de Heck correspond à la libération du produit, suite à une -élimination, menant au produit majoritaire (isomère E), montrant une réaction hautement régiospécifique. Le catalyseur palladé est quant à lui régénéré pour reconduire un cycle, grâce à l’action d’une base.
II-1.2. Les ligands utilisés
Le processus de Heck assisté par les phosphines97 est conduit dans des solvants polaires aprotiques, tels que le N,N-diméthylformamide (DMF), la N-méthylpyrrolidinone (NMP), l’acétonitrile (CH3CN), en présence d’une base, généralement l’acétate de sodium (NaOAc,
NBu3) et avec des phosphines classiques telles que PPh3 ou P(O-Tol)3.
Des types variés de catalyseurs de palladium sont utilisés, soit au degré d’oxydation (+II), soit (0), parmi lesquels Pd(OAc)2, PdCl2, Pd2(dba)3, Pd(acac)2….
Cette réaction peut également se réaliser avec divers systèmes catalytiques, tels que le palladium sur charbon, ou avec l’aide d’ultrasons.
La réaction de Heck peut également être une réaction asymétrique ; c’est là même une des raisons de l’utilisation de ligands tels que des phosphines chirales (comme par exemple le BINAP) qui ont montré une efficacité remarquable. D’autres types de ligands chiraux phosphines présentés ci-dessous trouvent leur utilisation lors de réactions asymétriques de Heck. PPh2 PPh2 PPh2 MeO MeO PPh2 P P R R R R N O PPh2 R Fe N N R PPh2
figure I-19 : Représentation de quelques ligands chiraux phosphines
La synthèse de produits naturels tels que la cis-décaline a été mise au point par le groupe de Sato98 avec 74 % de rendement et une bonne énantiosélectivité (46% ee), en utilisant le (R)-BINAP.
Le premier exemple d’un couplage de Heck asymétrique intermoléculaire a été décrit par Hayashi et coll,99 entre le 2,3-dihydrofurane et un triflate. L’utilisation des triflates avec le système catalytique Pd(OAc)2/BINAP mène à la formation majoritaire du
2-aryl-2,3-dihydrofurane et de l’obtention minoritaire de son isomère le 2-aryl-2,5-2-aryl-2,3-dihydrofurane.
O
PhOTf
Pd(OAc)2 / (R)-BINAP
benzene, 40°C O Ph O Ph
i-Pr2NEt
II-1.3. Les ligands carbènes
Les carbènes N-hétérocycliques nucléophiles, les imidazol-2-ylidènes, aussi communément appelées « mimes » de phosphine ont attiré l’attention d’un grand nombre de recherches en tant qu’alternatives possibles aux ligands phosphines en catalyse homogène.100,
101 Un de leur avantage est de ne pas se dissocier du centre métallique permettant ainsi de ne
pas devoir rajouter des ligands pour éviter la formation de métal massif.
Ainsi, des composés comme les palladacycles de Herrmann102 ont fait leur apparition, également les palladacycles pinces décrits par Dupont103 ainsi que des bis-carbènes.
Un des premiers exemples d’utilisation de complexes de palladium bis-carbène (figure I-21) a été présenté dans la littérature pour son utilisation comme catalyseur de la réaction de couplage entre la 4-bromoacétophénone et l’acrylate de n-butyle.
Pd
I I
N
N N
N
figure I-21 :Représentation du complexe de palladium bis-carbène iodé 104
Ces catalyseurs bis-carbènes sont formés par réaction entre les complexes de palladium avec des sels de chlorure d’imidazolium, qui appartiennent à la famille des liquides ioniques.105 En plus de ces catalyseurs carbènes, ou de ces précatalyseurs chiraux, les chimistes se sont tournés vers des sels de palladium simples, comme Pd(OAc)2, en absence de
phosphine, dans les réactions de Heck et Suzuki. Dans cette optique, une revue récente d’Haneda106 décrit l’utilisation de systèmes catalytiques simples, tels que des catalyseurs au palladium à motif imidazole et imidazoline.
Par suite, ces systèmes sans phosphine ont été utilisés dans des solvants polaires (comme le DMF) et également dans l’eau.
II-1.4. Les réactions en transferts de phases
De nombreux exemples de réactions par transferts de phases ont également été décrits. L’effet des sels d’ammonium quaternaires a été étudié en détail et démontré par Jeffery107, 108 puis d’autres études ont suivi appliquant les conditions décrites par cet auteur.109, 110
Jeffery décrit l’influence de sels de tétrabutylammonium sur une réaction modèle entre l’iodobenzène et l’acrylate de méthyle, en présence de Pd(OAc)2 avec ou sans phosphine et
démontre que l’utilisation de phosphine dans ces réactions n’est pas utile.111
Cependant, la séparation des produits du milieu réactionnel et la récupération du catalyseur sont les inconvénients majeurs des processus catalytiques homogènes et c’est pour cela qu’ils ne sont pas utilisés à l’échelle industrielle.
Parmi les diverses approches pour surmonter ces inconvénients, la catalyse biphasique liquide-liquide a émergé comme une des alternatives les plus intéressantes. Ces systèmes