UNIVERSITE MOHAMMED V - AGDAL
FACULTE DES SCIENCES - RABAT
THESE
No d’ordre : 2613POUR OBTENIR LE GRADE DE
DOCTEUR D’ETAT ES SCIENCES BIOLOGIE
SPECIALITE : NEUROSCIENCES PRESENTEE PAR
MERYEM ALAMY
DOCTEUR DE L’UNIVERSITE D’AIX-MARSEILLE II
Effets de la Sous Nutrition chez le Rat : Etude
Comportementale et Neurochimique.
Soutenue le 19 Décembre 2012 devant la commission d’examen
N. LAKHDAR-GHAZAL, Professeur à la Faculté des Sciences, Rabat Président
M. ERRAMI, Professeur à la Faculté des Sciences, Tétouan Rapporteur
A. BENAZZOUZ, Professeur, Directeur de Recherche, INSERM, Bordeaux Rapporteur
S. EL OUEZZANI, Professeur à la Faculté des Sciences Dhar El Mehraz, Fès Examinateur W. BENJELLOUN, Professeur à la Faculté des Sciences, Rabat Directeur de thèse
A la mémoire de mes parents Ahmed et Touria, cet aboutissement est pour eux et grâce à eux, A la mémoire de mon beau père Seddik, A mon oncle Boubker, merci pour ton éternel appui, A mon époux Jawad, A mes enfants chéris, Ismail, Youssef et Ahmed Yassine, merci de m’avoir supportée (dans tous les sens du terme), A mes sœurs Nabaouia et HibatouAllah, aucune phrase ne saurait exprimer mes remerciements pour vos encouragements incessants et votre dévouement. A mes beaux frères Ali et Salahdine, A mes neveux Ilyas, Rayan et Yasmine, merci d’être là, A ma belle mère Fanida, A ma belle sœur Sanaa et son mari Imad, A Meissane et Sirine, A mon oncle Abdelkrim, A mes amis.
AVANT PROPOS
Ce travail a été réalisé au sein du Laboratoire de Physiologie Animale à la Faculté des Sciences de Rabat dans l’équipe Neurosciences et Cognition sous la direction du Professeur WAIL BENJELLOUN, Président de l’Université Mohammed V-Agdal. Je tiens à lui exprimer ma reconnaissance pour m’avoir permis d’effectuer cette thèse. Je le remercie très chaleureusement d’avoir assuré ma formation en Neurosciences et de m’avoir accordée sa confiance en m’intégrant dans son groupe de Recherche. Ses conseils avisés et ses compétences scientifiques ont été des éléments essentiels dans l’aboutissement de ce travail.
Je voudrais remercier mon Professeur NOURIA LAKHDAR-GHAZAL, Professeur à la Faculté des Sciences de Rabat, pour m’avoir fait l’honneur d’accepter de présider mon jury de thèse. J’ai particulièrement apprécié sa lecture critique de mon manuscrit et ses interminables discussions scientifiques qui m’ont beaucoup aidée à améliorer ce mémoire. L’étude de l’effet de la sous nutrition sur le rythme circadien constitue le début d’une collaboration qui s’annonce très fructueuse. Par son expérience, ses compétences scientifiques et son enthousiasme, elle m’a ouvert de nouvelles perspectives exaltantes. Je souhaite vivement que cette collaboration se prolonge et s’accentue dans les années à venir.
Je remercie Monsieur MOHAMMED ERRAMI, Professeur et Doyen de la Faculté des Sciences, Université Abdelmalek Essaâdi, Tétouan, de l’honneur qu’il me fait en jugeant ce mémoire. Je ne saurais passer sous silence sa valeureuse contribution à la partie neurochimique de mon travail expérimental, contribution qui s’est avérée très efficace et très précieuse.
C’est avec plaisir que je remercie Monsieur le Professeur ABDELHAMID BENAZZOUZ, Directeur de Recherche INSERM à l’Université Victor Segalen à Bordeaux, pour m’avoir fait l’honneur d’accepter de juger ce travail. La haute estime que j’ai pour ses travaux de recherche me fait d’autant plus apprécier l’effort qu’il a consenti en se penchant sur ma modeste contribution à l’étude de la sous nutrition.
Je voudrais exprimer mes remerciements et ma gratitude envers Madame SELOUA EL OUAZZANI, Professeur, à la Faculté des Sciences Dhar El Mehraz-Fès, qui m’a fait l’honneur d’accepter de faire partie du Jury et de bien vouloir apporter ses critiques à ce mémoire.
Je tiens à remercier mon époux JAWAD LAHJOMRI, Professeur à la Faculté des Sciences Ain Chock, Casablanca, pour m’avoir aidé et soutenu durant toutes ces années de thèse. Il m’a souvent épaulé dans les moments difficiles. Sans lui, rien n’aurait pu être réalisé.
Je voudrais remercier Monsieur SALAHDINE EL BAZI pour ses encouragements et pour la qualité de toutes les photos des dispositifs expérimentaux.
Mes remerciements vont aussi à tous mes collègues de la Faculté des Sciences de Rabat pour leur soutien et leurs encouragements.
Enfin, je tiens à remercier Monsieur ABDERRAHMANE EL MOUSTIR, technicien du laboratoire, pour ses précieux soins à nos petits rats.
Table des Matières
TABLE DES MATIERES ... 4
INTRODUCTION GENERALE ... 7
I-GENERALITES ... 7
II-OBJECTIFS DE LA THESE ... 11
CHAPITRE 1 : REVUE BIBLIOGRAPHIQUE SYNTHETIQUE SUR LES EFFETS DE LA MALNUTRITION ET DE LA SOUS NUTRITION CHEZ LE RAT ... 14
I- EFFET DE LA MALNUTRITION ET DE LA SOUS NUTRITION SUR LE POIDS CORPOREL ... 14
A. Malnutrition et Sous nutrition prénatale ... 14
a. Malnutrition ... 14
b. Sous nutrition ... 16
B. Malnutrition et Sous nutrition postnatale ... 16
a. Malnutrition ... 16
b. Sous nutrition ... 17
II- EFFETS NEURO-ANATOMIQUES DE LA MALNUTRITION ET DE LA SOUS NUTRITION ... 18
A. Malnutrition et Sous nutrition prénatale ... 18
a.Malnutrition ... 18
b.Sous nutrition ... 20
B. Malnutrition et Sous nutrition postnatale ... 20
a. Malnutrition ... 20
b. Sous nutrition ... 22
III- EFFETS COMPORTEMENTAUX DE LA MALNUTRITION ET DE LA SOUS NUTRITION ... 23
A. Malnutrition et Sous nutrition prénatale ... 24
a.Malnutrition ... 24
b.Sous nutrition ... 25
B. Malnutrition et Sous nutrition postnatale ... 27
a. Malnutrition ... 27
b. Sous nutrition ... 29
IV.EFFETS NEUROCHIMIQUES DE LA MALNUTRITION ET DE LA SOUS NUTRITION ... 31
A. Effets de la malnutrition et de la sous nutrition sur le système dopaminergique ... 31
a.Malnutrition et Sous nutrition prénatale ... 31
b.Malnutrition et Sous nutrition postnatale ... 35
B. Effets de la malnutrition et sous nutrition sur le système sérotoninergique ... 38
a. Malnutrition et Sous nutrition prénatale ... 38
b. Malnutrition et Sous nutrition postnatale ... 39
V-EFFETS DE LA MALNUTRITION ET DE LA SOUS NUTRITION SUR LES RYTHMES CIRCADIENS ... 40
CHAPITRE II : MATERIEL ET METHODES ... 48
I- MODELE DE SOUS NUTRITION ... 48
II- GROUPES EXPERIMENTAUX ... 49
A. Mesure de l’activité dans un champ ouvert « Open field » ... 52
a- Activité de « crossing » ... 52
b- Exploration verticale : Activité du « rearing » ... 53
c- Défécation ... 53
B. Mesure de la sensibilité à la chaleur ... 54
a- Test du « Tail flick » ... 54
b- Test de la plaque chauffante « Hot plate » ... 54
C. Mesure de l’activité dans un labyrinthe radial à huit bras « radial maze » ... 56
a- Habituation ... 56
b- Apprentissage ... 57
c- Critère ... 58
d- Rétention avec injection d’une solution saline ou avec injection d’halopéridol ... 58
IV- NEUROCHIMIE DES MONOAMINES ... 58
A- Dosage par HPLC pour la dopamine, le DOPAC, HVA, la sérotonine et le 5HIAA. ... 58
B- Approche pharmacologique ... 59
V- ETUDE DES EFFETS DE LA SOUS NUTRITION SUR LE RYTHME CIRCADIEN DE L’ACTIVITE LOCOMOTRICE ... 60
VI-ANALYSE STATISTIQUE ... 62
CHAPITRE III : RESULTATS DES EFFETS DE LA SOUS NUTRITION ... 64
I- EFFET DE LA SOUS NUTRITION SUR LE POIDS CORPOREL ... 64
II- EFFETS DE LA SOUS NUTRITION AU MOMENT DU SEVRAGE SUR LE COMPORTEMENT ... 66
A- Effets de la Sous nutrition sur l’activité dans un champ ouvert « open-field » ... 66
a-Effets de la sous nutrition sur l’activité d’exploration horizontale ... 66
b-Effets de la sous nutrition sur l’activité d’exploration verticale ... 66
c-Effets de la sous nutrition sur la défécation ... 68
B- Effet de la sous nutrition sur la sensibilité à la chaleur ... 69
a-Test du « Tail flick » ... 69
b-Test de « Hot plate » ... 71
C- Effet de la sous nutrition sur l’activité dans un labyrinthe radial à huit bras « radial maze » ... 72
a-Acquisition ... 72
b-Rétention avec injection d’une solution saline ou injection d’halopéridol ... 73
III- EFFETS NEUROCHIMIQUES DE LA SOUS NUTRITION :DOSAGE DES MONOAMINES ET DE LEURS METABOLITES ... 75
A- Effet sur le système dopaminergique ... 75
B- Effet sur le système sérotoninergique ... 75
IV-EFFETS NEUROCHIMIQUES : TESTS PHARMACOLOGIQUES ... 78
A- Effet de la sous nutrition imposée au moment du sevrage ... 78
a-Effet d’une injection saline sur le « crossing » ... 78
b-Effet d’une injection saline sur le « rearing » ... 78
c-Effet d’une injection d’amphétamine sur le « crossing » ... 78
d-Effet d’une injection d’amphétamine sur le « rearing » ... 80
e-Effet d’une injection d’halopéridol sur le « crossing » ... 80
f-Effet d’une injection d’halopéridol sur le « rearing» ... 80
B- Effet de la sous nutrition imposée chez l’adulte ... 82
a-Effet de la sous nutrition sur le « crossing » ... 82
b-Effet de la sous nutrition sur le « rearing » ... 82
c-Effet de l’injection d’amphétamine sur le « crossing » ... 82
d-Effet d’une injection d’amphétamine sur le « rearing » ... 83
e-Effet d’une injection d’halopéridol sur le « crossing » ... 83
e-Effet d’une injection d’halopéridol sur le « crossing » ... 85
f-Effet d’une injection d’halopéridol sur le « rearing » ... 85
C- Conclusion ... 85
VI-EFFETS DE LA SOUS NUTRITION SUR LE RYTHME CIRCADIEN DE L’ACTIVITE LOCOMOTRICE CHEZ LE RAT ADULTE. ... 87
CHAPITRE 4 : DISCUSSION ... 98
I- SOUS NUTRITION :EFFETS COMPORTEMENTAUX ET NEUROCHIMIQUES ... 98
II- SOUS NUTRITION ET RYTHME CIRCADIEN DE L’ACTIVITE LOCOMOTRICE CHEZ LE RAT ADULTE ... 105
III- DISCUSSION GENERALE ... 108
IV-PERSPECTIVES ... 114
REFERENCES ... 116
RÉSUMÉ ... 139
Introduction Générale
I- Généralités
Au cours du XXème siècle, la lutte contre la malnutrition et son éradication ont été un
défi majeur pour la communauté internationale et les organisations mondiales. La malnutrition est, en effet, la principale cause de mortalité infantile dans les pays du sud, son traitement et sa prévention devraient être une priorité pour tout ces pays. En 2008, selon les estimations de l’UNICEF, sur les 8.8 millions d’enfants décédés à un âge en dessous de 5 ans, 93% sont originaires des pays d’Afrique et d’Asie. L’organisation mondiale de la santé a d’ailleurs souligné la situation alarmante existante dans certains pays associant pauvreté, malnutrition et crise humanitaire.
La nutrition joue un rôle crucial dans la maturation et le développement du système nerveux central (Morgane et al. 1992). Différents types de malnutrition ou de sous-nutrition pourraient affecter la maturation du système nerveux central ce qui aurait des conséquences sur le comportement et engendrerait des dysfonctionnements dans les fonctions mnésiques et dans l’apprentissage.
Le terme «Malnutrition» signifie qu’un ou plusieurs composants essentiels de l’apport journalier est manquant ou bien qu’ils sont présents mais en quantités insuffisantes. Une carence en vitamines, en sels minéraux pourrait affecter la maturation du cerveau de manière conséquente. Un déficit en protéines semblerait, cependant, être plus critique et avoir des effets plus importants (Morgane et al., 2002). De ce fait, de nombreuses études se sont intéressées aux conséquences de la restriction en acides aminés essentiels sur le comportement et la mémoire. Ainsi, le terme « Malnutrition » a été utilisé dans la plupart des études pour désigner une restriction protéique.
Le terme «Sous-nutrition» est une forme de « Malnutrition » dans laquelle tous les nutriments essentiels sont disponibles dans l’alimentation mais avec des proportions inadéquates. La famine actuelle en Somalie est un exemple type d’une sous nutrition qui pourrait avoir des effets à court et à long terme sur plusieurs générations.
La malnutrition est une des causes principales de morbidité et de mortalité chez l’enfant dans le monde et reste le facteur principal du retard de croissance. Une malnutrition sévère a pour conséquence un marasme (apport calorique insuffisant), un kwashiorkor (apport protéique déficient) ou la combinaison des deux syndromes (malnutrition protéino-calorique). Le marasme consiste en un dépérissement du corps dû à une privation calorique prolongée (Winnik, 1969, Benjelloun, 1990, Kumar et al., 2002).
Pour le marasme comme pour le kwashiorkor, un déficit en protéines s’accompagne souvent par une déficience en micronutriments, en vitamines et en sels minéraux. L’apathie, la fatigue et l’irritabilité sont présentes dans les deux syndromes (Kumar et al., 2002). Parfois, l’enfant présente les deux symptomatologies, les œdèmes du kwashiorkor et une importante fonte de la masse musculaire caractéristique du marasme (Prakash, 2003). Ces conditions sont associées à une mortalité importante (Kumar et al., 2002). La raison la plus commune de la mortalité chez l’enfant en dessous de 5 ans d’âge associée à la malnutrition est liée à la diarrhée qui sévit dans certains pays d’Afrique et d’Asie du sud (Rosenberg, 2007, Walton and Allen, 2011).
Malgré d’importants efforts dans la lutte contre la malnutrition pour réduire la mortalité infantile, une différence énorme persiste entre les pays industrialisés et les pays en voie de développement (Rosenberg, 2007).
Dans la littérature, plusieurs études ont été réalisées chez l’homme afin d’étudier les effets de la malnutrition sur les performances intellectuelles et les capacités d’apprentissage. Les effets les plus frappants de la malnutrition sont comportementaux et cognitifs avec une perturbation des processus attentionnels et un quotient intellectuel plus bas (Galler et al., 1987; 1990; 1997). Les effets de la malnutrition ont été également étudiés chez l’animal, elles ont été développées plus tôt et sont les plus nombreuses dans la littérature pour des raisons éthiques et économiques (Laus et al, 2011). Ces études expérimentales permettent de mieux comprendre comment la malnutrition pourrait affecter le développement du cerveau.
Les premiers travaux se sont surtout intéressés aux effets de la malnutrition sur le déficit pondéral au niveau du corps ou du cerveau (Winnick, 1969). Cet auteur a dosé la quantité d’acide désoxyribonucléique (ADN) comme étant un indice représentatif du nombre de cellules et de la quantité de protéines contenues dans un organe (Winnick, 1969). Plus tard, différentes études ont décrit des troubles cognitifs (Bengelloun, 1990; Tonkiss et al., 1990; 1994), des déficits dans divers systèmes de neurotransmetteurs (Almeida et al., 1996a ; Chen et al., 1997) ainsi que des troubles de la phosphorylation oxidative au niveau du cerveau (Bonnatto et al., 2005 ; Feoli et al., 2006).
L’inadéquation du régime alimentaire reste un des facteurs non génétique qui pourrait influencer la croissance du cerveau au cours de la période de gestation comme après la naissance. Les effets de la malnutrition seraient importants et seraient à long terme à l’origine de nombreux déficits dans l’apprentissage et le comportement (Morgane et al. 2002). Une malnutrition protéique pourrait induire des déficits au niveau des structures cérébrales chez le rat (King et al., 2002, Soto-Moyano et al. 1999) qui seraient à l’origine de la diminution du poids du cerveau chez les nouveaux nés et au cours des premiers stades de la vie (Joshi et al. 2003, Souza et al., 2008, 2011). Bien plus, des études expérimentales montrent après malnutrition et réhabilitation nutritionnelle, une persistance de déficits comportementaux et un maintient de ces déficits sur deux générations (Galler et Propert, 1981).
L’âge et la durée de la malnutrition semblent être des facteurs déterminants pour l’expression des effets de la malnutrition sur le cerveau (Morgane et al., 2002). Il est évident que les effets les plus importants pourraient résulter des privations les plus précoces et pourraient être à l’origine de déficits permanents (Morgane et al., 1997). Il est évident que la période de gestation comprend la plupart des processus de la neurogénèse, alors que la myelinisation, la prolifération dendritique et la synaptogénèse ont lieu au cours de la période postnatale.
Cependant, il existe des différences entre les espèces dans le moment d’occurrence de la neurogénèse, de la migration cellulaire, de la formation des synapses ainsi que l’élaboration des circuits neuronaux (voir Figure 1). Toutes ces phases semblent critiques pour arriver au stade « cerveau mature », elles se chevauchent entre elles et pourraient former des périodes critiques successives (Morgane et al., 2002). Chez l’Homme, la genèse de la glie et des cellules pyramidales a pour résultat l’acquisition d’environ 27 % du poids du cerveau au moment de la naissance, alors que pour le rat ce pourcentage est de 12 %. La courbe de croissance du cerveau chez le rat est de ce fait décalée vers la droite par rapport à celle de l’Homme (Figure 1).
Selon Morgane et al. (2002), dans sa dernière revue de question, une bonne compréhension des effets de la malnutrition devrait tenir compte de l’étape d’occurrence de la malnutrition en relation avec la phase de développement du cerveau. Le développement postnatal étant intimement lié au statut nutritif gestationnel de la mère.
En général, la malnutrition a des effets différents selon la période pendant laquelle elle est imposée. Par exemple, la malnutrition prénatale provoque une réduction des cellules granulaires du gyrus dentelé (Debassio et al., 1994,1996). Chez le rat adulte, elle induit une
diminution du nombre total des cellules granulaires du gyrus denté et des cellules pyramidales de l’hippocampe (CA3 et CA1) (Lukoyanov and Andrade, 2000). Cette réduction du nombre de cellules est accompagnée d’une diminution du nombre de synapses entre les fibres moussues et les dendrites des cellules pyramidales (CA3). La réhabilitation (2 mois) permet de récupérer le nombre de synapses mais pas le nombre de cellules (Lukoyanov and Andrade, 2000). Ces déficits neuro-anatomiques seraient à l’origine des troubles cognitifs observés dans l’apprentissage et la rétention dans des tests spatiaux chez les sujets mal nourris.
L’hippocampe est une des rares régions du cerveau où le processus de neurogénèse continue même chez l’adulte. Ces processus semblent avoir une importance fonctionnelle dans l’apprentissage et la rétention (Mohapel et al., 2010).
Figure 1: Courbes de vitesse de croissance cérébrale montrant le degré, la durée et le timing des processus développementaux chez le Rat et chez l’Homme. Les courbes de croissance sont surimposées afin de comparer la genèse de la glie et des cellules pyramidales et granulaires (Morgane et al., 2002).
Au cours du développement du cerveau, la malnutrition ou la sous nutrition affectent des séries d’événements comme la neurogénèse, la gliogénèse et la migration cellulaire et tous les aspects liés à la différentiation incluant la myelinisation et la synaptogénèse. Une diète inadéquate pourrait avoir des effets délétères sur chacune de ces étapes. Au cours du développement embryonnaire et fœtal, les neurones et la glie sont générées à des périodes spécifiques à partir des cellules embryonnaires. Après la naissance, les neurones migrent le long de voies spécifiques. Si la prolifération et la migration cellulaires sont retardées, les neurones ne peuvent recevoir les afférences appropriées, ce qui aurait pour résultat une altération de l’organisation fonctionnelle des aires cérébrales impliquées. Le développement de la fonction de neurotransmission pourrait avoir lieu au cours de la phase de différentiation à travers la synthèse d’enzymes de régulation et de récepteurs spécifiques (Galler et al., 1997). Les effets de la malnutrition et de la sous nutrition s’exerceraient plus tard au cours de la vie de l’individu en agissant sur la régulation de la neurotransmission à travers la synthèse des neurotransmetteurs et la modulation du nombre et de l’affinité des récepteurs.
II-Objectifs de la thèse
Dans ce mémoire, nous exposerons dans une première partie une revue bibliographique détaillée concernant les travaux antérieurs sur la malnutrition et la sous nutrition (voir chapitre 1). Au regard de l’analyse des résultats de ces travaux, des études supplémentaires s’avèrent clairement nécessaires pour caractériser les effets comportementaux de la sous nutrition au moment du sevrage. En effet, à notre connaissance aucune étude ne s’est intéressée à ces effets au moment du sevrage. Pourtant, le passage de l’allaitement maternel à une nutrition individuelle, nous semble être une période cruciale pendant laquelle une sous nutrition pourrait facilement s’installer et avoir des conséquences néfastes qui se répercuteraient sur le développement du cerveau.
Par ailleurs, il est bien établi que la malnutrition au cours de la période prénatale et postnatale provoque une perturbation du système monoaminergique avec une diminution de la dopamine dans le cortex frontal, dans l’hippocampe et l’hypothalamus, une réduction de la catalepsie induite par l’halopéridol ainsi que de la stéréotypie provoquée par l’amphétamine. Les résultats des travaux antérieurs concernant les effets de la malnutrition protéique sur la sérotonine restent contradictoires. A notre connaissance, les effets neurochimiques de la sous nutrition n’ont été étudiés qu’au cours de l’allaitement et montrent une diminution de la dopamine dans le striatum, avec une réduction de l’activité de la tyrosine hydroxylase et du
nombre de récepteurs dopaminergiques. Ces études décrivent par ailleurs, une réduction de la catalepsie induite par l’halopéridol. Il apparait là encore l’intérêt de l’étude des effets de la sous nutrition au cours de la période du sevrage sur le système dopaminergique.
La malnutrition pendant la période prénatale et postnatale ainsi que la sous nutrition au cours de l’allaitement et chez l’adulte provoquent une hyperactivité, des troubles de l’apprentissage avec une perturbation du système dopaminergique. Sur la base de toutes ces données expérimentales, nous avons émis l’hypothèse qu’une sous nutrition au cours de la période de sevrage, période non étudiée dans la littérature, pourrait donner lieu à des troubles comportementaux importants ainsi qu’à des altérations neurochimiques touchant plus particulièrement le système dopaminergique. Afin de vérifier ces hypothèses nous avons examiné les effets de la sous nutrition imposée au moment du sevrage sur le comportement dans un open field, sur la sensibilité thermique, sur l’apprentissage et la capacité à stocker les informations ainsi que sur les taux de monoamines et de leurs métabolites au niveau du striatum. Nous montrons tout particulièrement que la sous nutrition provoque une perturbation du métabolisme dopaminergique striatal. Ceci nous a mené à étudier les effets comportementaux sous deux conditions expérimentales. La première, dans le cas d’une augmentation de la transmission dopaminergique induite par l’amphétamine qui agit en augmentant la concentration de la dopamine au niveau de la fente synaptique en augmentant sa libération vésiculaire et en inhibant sa recapture. La seconde, après blocage des récepteurs dopaminergiques par l’halopéridol. Nous avons testé ainsi les effets d’injections de l’amphétamine ou de l’halopéridol sur le comportement dans un open field après une sous nutrition de 3 semaines chez le rat au moment du sevrage. Nous avons étendu notre étude pharmacologique au rat adulte âgé de 2 mois afin de comparer les effets de la sous nutrition imposée à ces deux âges de la période post natale et de déterminer si les effets comportementaux observés après une sous nutrition de 3 semaines au moment du sevrage sont reproduits dans le cas d’une sous nutrition de 3 semaines chez le rat adulte. Nous avons de plus testé la sensibilité thermique chez le rat adulte sous nourri.
Enfin, étant donné que certaines études ont mis en évidence l’existence de troubles du rythme du sommeil dans le cas d’une malnutrition protéique prénatale ainsi qu’une perturbation du rythme circadien après sous nutrition prénatale combinée à un stress postnatal ; il nous a paru intéressant de tester, dans une étude préliminaire, les effets de la sous nutrition sur le rythme circadien d’activité locomotrice chez le rat adulte.
Dans le présent mémoire, nous exposerons dans le chapitre 1 une revue bibliographique détaillée constituant une synthèse des travaux antérieurs sur les effets de la malnutrition et de la sous nutrition sur le développement du cerveau. Cette revue nous a permis d’aborder les aspects les plus importants, à savoir les aspects neuro-anatomiques, neurochimiques et comportementaux sous jacents à une inadéquation alimentaire chez le rat.
Dans le chapitre 2, nous décrirons les protocoles expérimentaux et les méthodes que nous avons utilisés pour approcher les conséquences de la sous nutrition.
Dans le chapitre 3, nous exposerons les résultats obtenus après sous nutrition chez le rat au moment du sevrage et chez le rat adulte.
Dans le chapitre 4, nous discuterons et nous interpréterons ces résultats afin de pouvoir répondre aux questions suivantes :
La sous nutrition au moment du sevrage a-t-elle un impact sur le comportement et la neurochimie des monoamines au niveau du striatum?
Quels sont les effets comportementaux après manipulation pharmacologique de la
transmission dopaminergique ?, Ces effets sont-ils reproduits dans le cas d’une sous nutrition chez le rat adulte âgé de 2 mois?
La sous nutrition chez le rat adulte a-t-elle une répercussion sur le rythme circadien de
l’activité locomotrice ?
Dans ce chapitre, nous présenterons également une discussion générale dans laquelle nous intégrerons nos résultats dans le cadre actuel des investigations sur la malnutrition et le développement du cerveau. En conclusion, nous aborderons les perspectives que nous ouvre l’étude que nous avons réalisée.
Chapitre 1 : Revue Bibliographique synthétique sur les effets
de la Malnutrition et de la Sous nutrition chez le rat
I- Effet de la Malnutrition et de la Sous nutrition sur le poids corporel
Plusieurs modes de malnutrition ont été utilisés dans le but d’étudier les effets de différentes restrictions alimentaires telles que la malnutrition protéique dans laquelle le régime alimentaire est pauvre en protéines. La sous nutrition où tous les nutriments sont présents mais en quantité insuffisante a été induite en augmentant le nombre de rats allaités par lignée, en les privant de leur mère pendant quelques heures ou tout simplement en réduisant la ration journalière attribuée aux rats sous nourris. Ces différents protocoles de restriction alimentaire ont été adaptés afin d’étudier la malnutrition à différents stades de la vie et du développement du cerveau, pendant la période prénatale, périnatale ou chez l’adulte. Indépendamment du mode de privation utilisé, malnutrition ou sous nutrition, les différentes études mettent en évidence, dans la plupart des cas, un déficit du poids dont la sévérité est dépendante du type, du moment et de la durée de la malnutrition. Les tableaux 1 et 2 résument respectivement les effets de la malnutrition et de la sous nutrition sur le poids en fonction du type, du moment de la restriction alimentaire et de l’âge du rat au moment du test.A. Malnutrition et Sous nutrition prénatale
a. Malnutrition
Différentes études ont décrit les effets de la malnutrition protéique prénatale dans le cas d’un régime alimentaire contenant un faible taux de protéines (6 ou 8 % de caséine). Des rates femelles sont soumises à ce régime alimentaire cinq semaines avant l’accouplement et pendant toute la période de gestation jusqu’au moment de la parturition. Au contraire, des rates témoins reçoivent une nourriture contenant une teneur adéquate en protéine qui est de 25 % caséine. Les deux régimes alimentaires sont iso caloriques (Debassio et al., 1994, Galler et al., 1991, Tonkiss et al., 1991, 1994). Après naissance, tous les rats sont allaités par des mères nourrices ayant un régime alimentaire à 25 % de caséine.
Tableau 1: Malnutrition chez le rat: Effets sur le poids corporel
0 : naissance, E: période embryonnaire; P: Période postnatale. La diminution de poids est représentée relativement par rapport au poids des sujets témoins (100%).
Manipulation Age du test
(jours) Résultats Références Malnutrition Type Moment Protéique, 6% caséine Prénatal P0 P45 P70 -15% -5% Pas de différence Almeida et al. (1996b) Protéique, 6% caséine Prénatal P0 P21 Après P21 -21% -11% Pas de différence Chen et al. (1997) Protéique, 6% caséine
Prénatal P9 -9%, Kehoe et al. (2001)
Protéique 6% caséine Lactation (P0-P21) P21 P70 -60% -20% Santucci et al. (1994)
Protéique P0-P50 P70 -40% Fukuda et al.
(2002) Protéique P25-P60 P60 -50% Benjelloun (1990) Protéique, 6% caséine P0-P21 P70 -20% Hernandes et al. (2005) Protéique, 8% caséine Adulte P60- P240 P320 -4% Lukoyanov and Andrade (2000)
La malnutrition protéique prénatale induit une diminution du poids des rats mal nourris à la naissance allant de 6 à 20 % (Almeida et al. 1996b,c ; Chen et al. 1997, Kehoe et al. 2001, Tonkiss et al., 1994) et malgré un allaitement normal, cette différence de poids reste
évidente jusqu’au 27e
jour. Vers le 70e jour la différence n’est plus significative (Tonkiss et al. 1994).
L’étude des effets de la malnutrition prénatale initiée au moment de la conception et maintenue au cours des deux semaines de gestation (Gressens et al.1997) montre un poids
fœtal qui est inférieur à celui des rats témoins mesuré au 15e
jour embryonnaire à la fin de la période de malnutrition. Cependant, un retour à une nutrition normale au cours de la dernière
semaine de gestation conduit à un retour aux normes des paramètres de croissance des
nouveaux nés.
b. Sous nutrition
La sous nutrition prénatale est réalisée par restriction alimentaire des quantités attribuées aux mères à 50% de la prise alimentaire normale. Ce régime a pour résultat une baisse du poids chez les rats nouveaux nés qui atteint 73 % par rapport au poids des rats provenant de mères ayant reçu une alimentation normale (Jahnke et Bedi, 2007). Par ailleurs, il a été démontré qu’une ligature de l’artère utérine à partir du 17e
jour embryonnaire implique une diminution du poids du cerveau et du corps pesés à la naissance (Oliver et Gressens, 2007).
B. Malnutrition et Sous nutrition postnatale a. Malnutrition
La malnutrition postnatale imposée à la naissance a été décrite par Fukuda et al. (2002), au cours de la période de lactation et après sevrage jusqu’au 49e jour, les rats et leurs petits sont soumis à un régime alimentaire déficient en protéines à 6% de caséine alors que les
sujets normaux ont une diète contenant 16 % de protéines. Au 70e jour ces rats ont présenté
une perte d’environ 73% de leur poids par rapport au poids de leurs témoins.
Une malnutrition protéique (8 % de caséine) au moment du sevrage a pour résultat une diminution de 50 % du poids des rats mal nourris (Bengelloun, 1990).
Chez les rats adultes âgés de 2 mois, soumis à un régime alimentaire hypo protéique (8 % caséine) complété avec de la méthionine, une malnutrition au cours de 6 ou 8 mois induit une diminution du poids d’environ 5 % par rapport au témoin.
b. Sous nutrition
La sous nutrition à la naissance par augmentation du nombre de rats dans une portée nombreuse contenant plus de 16 nouveaux nés, provoque une diminution du poids d’environ 16% par rapport au témoin (Hernandes et al., 2005). La sous nutrition par séparation des petits de leur mère est réalisée en les mettant la moitié du temps dans un incubateur ou avec des femelles non allaitantes (Castro et Rudy,1987 ; Hernandes et al. 2005). Celle-ci induit une réduction du poids de 22 %.
Tableau 2: Sous nutrition chez le rat: Effets sur le poids corporel.
0: naissance, E: période embryonnaire; P: période postnatale. La diminution de poids est représentée relativement par rapport au poids des sujets témoins (100%)
Manipulation Age du test
(jours)
Résultats Références
Sous nutrition
Type Temps
Sous nutrition P2-P18 P22 -40% Castro and
Rudy (1987) 25% restriction Pré-conception, E, P. P70 -18% Levay et al. (2010) Ligature de l’artère utérine E17 P0 P14 P21 -8% -10% -13% Oliver et al. (2007) 50% restriction P0-P21 P70 -25% Hernandes et al. (2005) Large taille de portée P0-P21 P70 -16% Hernandes et al. (2005) Sous nutrition par
séparation
P0-P21 P70 -18% Hernandes et
al. (2005)
50% restriction E0-P21 P21 -73% Jahnke and
Bedi (2007) 50% restriction E0-P21 P21 P62 -66% -33% Partadiredja et al. (2008)
A notre connaissance, aucune étude n’a traité les effets de la sous nutrition chez l’adulte, cet aspect serait de ce fait intéressant à étudier. Cependant, Levay et al. (2010) a montré qu’une restriction de 25 % de la prise alimentaire au cours de la conception, de la gestation et après sevrage a pour résultat une baisse de 18 % du poids des rats par rapport à leurs témoins.
En conclusion, toutes ces études ainsi que l’analyse des résultats des tableaux 1 et 2 montrent que la malnutrition aussi bien que la sous nutrition induit une diminution du poids qui est plus importante quand elle est imposée à la naissance, au cours de l’allaitement et 1 mois après la naissance. Par ailleurs, dans la plupart de ces études une récupération a été décrite après renutrition.
II- Effets Neuro-anatomiques de la Malnutrition et de la Sous nutrition
La malnutrition semble affecter le développement du cerveau notamment la croissance cellulaire, la migration et la différentiation incluant les phénomènes de myélinisation et de synaptogénèse. La malnutrition prénatale et postnatale affecte le cerveau en cours de développement en modifiant le nombre de cellules, de synapses ainsi que la myelinisation des axones. Récemment, Feoli et al. (2008) ont mis en évidence une astrogliose suite à une malnutrition protéique. La réhabilitation nutritive peut rétablir certains effets mais pas toutes les altérations structurales et morphologiques (Benjelloun, 1990 ; Lukoyanov and Andrade, 2000 ; Winnick, 1969). Les tableaux 3 et 4 résument les résultats des principaux travaux traitant les effets neuro-anatomiques de la malnutrition et de la sous nutrition en fonction du type, du moment de la restriction alimentaire et de l’âge du rat au moment du test.A. Malnutrition et Sous nutrition prénatale
a.Malnutrition
La restriction protéique prénatale initiée au moment de la conception et maintenue au cours des deux premières semaines de gestation chez le rat provoque une différenciation cellulaire anormale dans le néocortex et le cervelet et une synaptogenèse anormale au sein des ganglions de la base trois semaines après la naissance (Gressens et al., 1997). Cette malnutrition induit un retard de l’astrogliogénèse et un retard de la production d’acide hyaluronique dans la matrice extracellulaire. L’analyse de ces critères chez le cerveau adulte ne révèle pas d’altérations architecturales ni dans la différentiation neuronale mettant ainsi en
évidence un haut niveau de plasticité du cerveau au cours de son développement (Gressens et al., 1997).
Figure 2 : Schéma résumant l’histologie de la formation hippocampique avec la circuiterie de base (modifié d’après Isaacson, 1974). EC : Cortex enthorinal (couche 2 et 3), DG: Gyrus Denté, CA3, CA1 : Corne d’Ammon 1 et 3, Sub : Subiculum, 1 : Cellule granulaire du gyrus denté, 2 : Cellule pyramidale du CA3, 3 : Fibre moussue, 4 : Collatérale de Schaffer.
Une malnutrition prénatale réalisée suite à une restriction protéique chronique de 5 semaines avant l’accouplement et maintenue au cours de la gestation n’a pas d’effet sur la genèse des cellules pyramidales mais induit une diminution de la neurogénèse des cellules granulaires du gyrus denté au 20e jour embryonnaire (Debassio et al., 1994) et au 8e jour postnatal (Debassio et al., 1996) et provoque une altération de la morphologie des cellules de l’hippocampe (Diaz-cintra et al., 1991). En effet, l’étude par la technique de Golgi des cellules granulaires montre une réduction de la taille des cellules granulaires et une diminution de la complexité dendritique et de la densité des synapses mesurées à différents
âges du 15e jour au 220e jour postnatal avec des déficits plus marqués à P220 (Diaz-Cintra et
al., 1991). La malnutrition réduit le nombre de fibres et le nombre de synapses entre les fibres moussues issues des cellules granulaires et les cellules pyramidales du CA3 de l’hippocampe (Andrade et al., 1991; Cintra et al., 1990; Diaz –Cintra et al., 1991 ; Garcia –Ruiz et al., 1993 ; Granados-Rojas et al., 2002) ainsi que le nombre de dendrites et d’épines dendritiques
1
2 3
au niveau des cellules granulaires (Diaz-cintra et al., 1991; 1994). Feoli et al. (2008) ont évalué les effets d’une malnutrition protéique prénatale sur les cellules gliales, cette étude montre une multiplication des astrocytes au niveau du cortex cérébral et de l’hippocampe. Un retard de la genèse des astrocytes avec une différentiation et une synaptogénèse anormales ont aussi été observées (Granados-Rojas et al., 2002 ; Gressens et al., 1997). De plus, la malnutrition prénatale induit une augmentation du nombre d’interneurones GABAergiques dans le gyrus denté et dans l’hippocampe (CA1-3) à P30 (Diaz-cintra et al., 2007).
b.Sous nutrition
La sous nutrition au cours de la gestation et de la lactation provoque une réduction de l’épaisseur de l’hippocampe (Katz et al., 1982) et de son volume chez des rats nouveaux nés (Ranade et al., 2008) avec une altération du nombre de cellules pyramidales des aires hippocampales CA3 et CA4 (Jordan et Clark, 1983) ainsi qu’au niveau des cellules granulaires du gyrus denté (Bedi , 1991 ; Jordan et Clark, 1983). Par ailleurs, Jahnke et Bedi
(2007) ont noté, au 21e jour postnatal, que la sous nutrition précoce au cours de cette période
de gestation et de lactation augmente le nombre de cellules apoptotiques dans le gyrus dentelé mais non dans la formation hippocampique. Selon ces auteurs, la sous nutrition pourrait induire une mort cellulaire en relation avec la disponibilité des facteurs trophiques. L’apoptose est sensible au statut nutritionnel et les cellules granulaires immatures du gyrus denté seraient plus vulnérables à une sous nutrition que les cellules pyramidales matures de l’hippocampe.
B. Malnutrition et Sous nutrition postnatale
a. Malnutrition
La restriction en tryptophane chez des rats à partir du 30e jour jusqu’au 60e jour postnatal implique une altération des épines dendritiques des cellules pyramidales dans le CA1 ainsi qu’au niveau des cellules granulaires (Zhang et al. 2006) avec une activation astrocytaire mise en évidence par une hypertrophie de leur cytosquelette, ce qui serait en faveur d’un rôle modulateur de la sérotonine dans la modulation de la morphologie gliale (Zhang et al.2009). La malnutrition protéique chez l’adulte provoque une réduction de l’épaisseur de la couche pyramidale CA3 chez des rats mal nourris pendant 6, 12 ou 18 mois (Paula –Barbosa et al. 1989).
Tableau 3: Malnutrition chez le rat: Effets neuro-anatomiques 0: Naissance, E: période embryonnaire, P: période postnatale.
Manipulation Age du
test (jours)
Test Résultats Références
Malnutrition Type Temps Protéique, 6% caséine Prénatal P30 E12-E16-E20 Injection de thymidine tritiée
- Diminution des cellules granulaires à E20
- Aucun effet sur les cellules pyramidales de l’hippocampe Debassio et al. (1994) Protéique, 6% caséine Prénatal P30 P90 P8-P15-P30 Injection de thymidine tritiée
- Diminution des cellules granulaires à P8 - Pas d’effet à P15
- Augmentation des cellules granulaires à P30 Debassio et al. (1996) Protéique, 5% caséine Prénatal E0 - E15 Gestation
P15 Immuno-histochimie - Retard de l’astrogliogénèse
dans le cortex, l’hippocampe, Le cervelet et les ganglions de la base. - Différentiation cellulaire anormale - Synaptogénèse anormale Gressens et al. (1997) Protéique, 7% caséine Gestation Lactation P2, P15, P60 Marquage de la protéine Gliale acide
Augmentation des gliales dans le cortex cérébral et l’hippocampe Feoli et al. (2008) Protéique, 6% caséine Prénatal P15 P220
Golgi - Diminution de la taille
cellulaire - Diminution de la complexité des dendrites - Diminution de la densité synaptique Diaz-Cintra et al. (1991) Protéique, 8% caséine Adulte P60-P180 P60-P360 P60-P540 P180 P360 P540 Densité numérique Marquage à la “Toluidine blue”
- Perte progressive des neurones granulaires et des cellules pyramidales du CA3 de l’hippocampe
- Diminution de l’épaisseur de la couche pyramidale CA3 de l’hippocampe Paula-Barbosa et al. (1989) Protéique, 8% caséine Adulte P60- P240 P320 Estimation du nombre total de neurones et de synapses. Marquage « Giemsa »
Perte des cellules granulaires et pyramidales de la formation hippocampique et des synapses
Lukoyanov and Andrade
Tableau 4: Sous nutrition chez le rat: Effets Neuro-anatomiques.
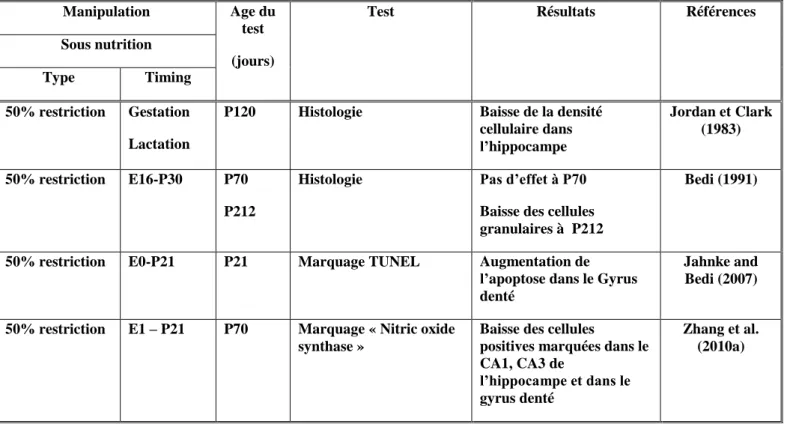
0: Naissance, E: période embryonnaire, P: période postnatale.
Manipulation Age du
test (jours)
Test Résultats Références
Sous nutrition
Type Timing
50% restriction Gestation Lactation
P120 Histologie Baisse de la densité
cellulaire dans l’hippocampe Jordan et Clark (1983) 50% restriction E16-P30 P70 P212
Histologie Pas d’effet à P70
Baisse des cellules granulaires à P212
Bedi (1991)
50% restriction E0-P21 P21 Marquage TUNEL Augmentation de
l’apoptose dans le Gyrus denté
Jahnke and Bedi (2007)
50% restriction E1 – P21 P70 Marquage « Nitric oxide
synthase »
Baisse des cellules
positives marquées dans le CA1, CA3 de
l’hippocampe et dans le gyrus denté
Zhang et al. (2010a)
Cette malnutrition induit une réduction du nombre de cellules granulaires et des cellules pyramidales du CA3 par rapport au témoin (Lukoyanov and Andrade, 2000 ; Paula – Barbosa et al., 1989) avec 30 % de perte des synapses entre les fibres moussues et les dendrites des cellules de l’hippocampe. Malgré une réhabilitation du régime alimentaire pendant 2 mois, la diminution du nombre total de neurones reste évidente chez des rats sous nourris réhabilités (Lukoyanov and Andrade, 2000). Cependant, la diminution du nombre de synapses observée à la suite de la malnutrition protéique est rétablie à la suite de cette période de renutrition suggérant ainsi qu’un régime alimentaire adéquat pourrait contrebalancer l’effet de la malnutrition sur les changements synaptiques (Lukoyanov and Andrade, 2000).
b. Sous nutrition
A notre connaissance, aucune étude ne traite les effets d’une sous nutrition chez l’adulte.
En conclusion, d’après l’analyse des données des paragraphes précédents et celles des tableaux 3 et 4, la malnutrition protéique prénatale comme la malnutrition protéique postnatale induit une perte des cellules granulaires du gyrus denté mais seule la malnutrition protéique postnatale affecte la genèse des cellules pyramidales. Ceci proviendrait de la différence du moment de développement de ces deux types cellulaires. La récupération semble concerner seulement le nombre de synapses et non pas le nombre de cellules de l’hippocampe, indépendamment de la période de malnutrition.
La malnutrition aussi bien que la sous nutrition a pour résultat une perte cellulaire des cellules granulaires quand la privation a lieu au cours de la gestation ou de la lactation. Les différences entre les études concernant l’incidence de la malnutrition ou de la sous nutrition sur la perte cellulaire des cellules granulaires pourraient provenir d’un retard dans la genèse de ce type cellulaire chez les sujets sous nourris. Ce retard pourrait être compensé par une neurogénèse plus tardive. Un tel mécanisme compensatoire serait mis en place au cours des phases les plus précoces du développement du cerveau mais pas chez l’adulte. Peu d’études se sont intéressées aux effets de la sous nutrition prénatale ainsi que la sous nutrition chez l’adulte. Il est donc difficile de comparer malnutrition et sous nutrition en terme d’importance des effets histologiques et en terme de durée de ces effets.
III- Effets comportementaux de la Malnutrition et de la Sous nutrition
La malnutrition précoce affecte la morphologie de la formation hippocampique. Cette structure est connue comme étant impliquée dans les fonctions cognitives comme l’apprentissage et la mémoire, spécialement celles ayant des caractéristiques spatiales (Morris et al., 1982). De ce fait, les études comportementales se sont intéressées surtout aux effets de la malnutrition ou de la sous nutrition en utilisant des tests d’apprentissage dans des tests tels que le labyrinthe radial (Jordan et al., 1981), l’alternation spatiale (Goodlett, 1986) et le labyrinthe aquatique de Morris (Castro et Rudy, 1987 ; Fukuda et al., 2002 ; Laus et al., 2011, Lukoyanov et Andrade, 2000, Souza et al., 2008, Tonkiss et al., 1994). Un résumé exhaustif des études traitant les effets comportementaux est illustré dans les tableaux 5 et 6. Ces tableaux indiquent respectivement les effets de la malnutrition et de la sous nutrition en fonction du type, du moment de la restriction alimentaire, du test comportemental, et de l’âge du rat au moment du test.
A. Malnutrition et Sous nutrition prénatale
a.Malnutrition
Après malnutrition protéique prénatale, l’analyse de l’apprentissage dans un labyrinthe de type Morris de la navigation dirigée par des informations visuelles proximales et distales, ne montre pas d’atteinte de ces deux types de navigation par la malnutrition. Les rats mal nourris présentent les mêmes performances d’acquisition de la tâche au moment du sevrage et chez l’adulte (Tonkiss et al. 1994). Cependant Bronzino et al. (1991) montrent une augmentation de l’inhibition de la formation hippocampique chez des rats soumis à un protocole de stimulation. Ces auteurs décrivent une difficulté des sujets mal nourris à induire et à maintenir une potentiation à long terme (Bronzino et al., 1996, 1997). Ces études suggèrent que la malnutrition protéique altère l’excitabilité des cellules du gyrus denté chez des rats libres de tout mouvement au cours des stades les plus précoces du développement du cerveau (15 et 30 jours) mais pas chez l’adulte (90 jours) après stimulation de la voie perforante médiane (Bronzino et al., 1996, 1999).
La malnutrition prénatale induit aussi une augmentation des réponses à la récompense (Tonkiss et al., 1990a) et perturbe la réponse dans un test d’apprentissage de discrimination visuelle (Tonkiss et al., 1990a) chez des rats testés à l’âge adulte. Par ailleurs, la malnutrition prénatale affecte les interactions sociales entre les rats juvéniles (Almeida 1996c, Almeida and De Araujo, 2001). De tels changements peuvent jouer un rôle déterminant dans l’expression de différences comportementales décrites chez l’adulte (Almeida et al. 1996c). Des études ont montré les effets de la malnutrition protéique sur la diminution de l’anxiété chez des rats. Ceux-ci présentent plus de passage dans le bras ouvert dans le labyrinthe élevé en forme de plus (Almeida et al.1996b) et une moins grande latence dans un test d’évitement dans un labyrinthe en T (Almeida et al., 1996b ; Hernandes et al., 2005). Les rats mal nourris présentent une anxiété moins importante (Hernandes et al., 2005, Françolin-Silva et al., 2006). Ces auteurs ont suggéré que la malnutrition à court terme peut affecter les systèmes neuronaux et neurochimiques sous jacents à une expression anxiogénique au niveau du
comportement. Par ailleurs, dans le cas d’une malnutrition prénatale associée à un stress au 9e
jour post natal (isolation), aucune modification de la synthèse de corticostérone plasmatique n’est observée chez le sujet mal nourri contrairement à une augmentation importante qui est mise en évidence chez le rat témoin (Kehoe et al., 2001).
b.Sous nutrition
Après sous nutrition prénatale, la déprivation maternelle affecte les variables physiologiques à l’âge adulte. Une déprivation de 12h par jour de J1 à J7 induit une augmentation de libération basale et de la libération induite par le stress de corticostérone plasmatique. Au moment du sevrage, leur rythme circadien est inversé en absence de lumière (Yamazaki et al., 2005). Ces auteurs montrent que les effets de la déprivation maternelle sur l’horloge circadienne dépend de la durée de la privation : plus longue étant cette période plus le shift du rythme circadien induit est important.
Smart et al. (1975) ont montré qu’un faible stimulus produit une plus grande réactivité des rats ayant subit une sous nutrition prénatale et immédiatement post natale. Ces résultats suggèrent que les sujets sous nourris sont plus réactifs aux stimuli non plaisants ou aversifs. De plus, la restriction calorique de 50% au cours de la période périnatale pendant la gestation et la lactation a mis en évidence des altérations hormonales (Levay et al., 2010). Dans cette étude, la concentration basale de l’hormone adrenocorticotropique (ACTH), de la corticostérone et de la concentration plasmatique d’adrénaline sont réduites de 33 à 49 %. Ces données seraient en faveur du probable effet anxiolytique de la sous nutrition périnatale. De plus Zhang et al. (2010b) ont testé l’effet d’une restriction de 50% de l’apport calorique journalier au cours de la gestation et de l’allaitement sur la croissance et le comportement. Ce type de restriction induit un retard dans la poussée du poil, de l’éruption des incisives et de l’ouverture des yeux ainsi que de certains réflexes.
Une sous nutrition périnatale, avec restriction alimentaire de 50% au cours de la dernière semaine de gestation et pendant l’allaitement, provoque une altération des différentes composantes de l’axe corticotrope avec altération de la sécrétion de l’ACTH et de la corticostérone plasmatiques. De plus, cette étude a décrit une atténuation de l’expression de nombreux gènes tels que celle des récepteurs minéralocorticoïdes et glucocorticoïdes au niveau de l’hippocampe, une augmentation dans l’expression de l’arginine vasopressine dans l’hypothalamus et des prohormones convertases dans l’adénohypophyse (Sebaai, 2003). Après un stress de déshydratation de 72h, la réponse de l’axe corticotrope est atténuée et les âgés de 8 mois ne parviennent pas à accroitre leur corticostéronémie mettant ainsi en évidence une vulnérabilité de l’axe corticotrope à la sous nutrition périnatale qui semble avoir des effets délétères à long terme sur la capacité adaptative des animaux au stress de déshydratation (Sebaai, 2003 ; Sebaai et al., 2004).
Dans le cas d’une sous nutrition périnatale par réduction des protéines et des acides gras au cours de la gestation, de l’allaitement et jusqu’à 70 jours d’âge, les rats présentent des déficits de l’apprentissage spatial dans un labyrinthe de type Morris (Souza et al., 2008, 2011). Ces déficits sont en partie compensés par une alimentation normale introduite au moment du sevrage chez des rats réhabilités. Aucun déficit n’est observé dans le test d’évitement passif dans le cas de ce protocole de sous nutrition qui correspond au régime alimentaire d’une région du nord du Brésil (Souza et al., 2008).
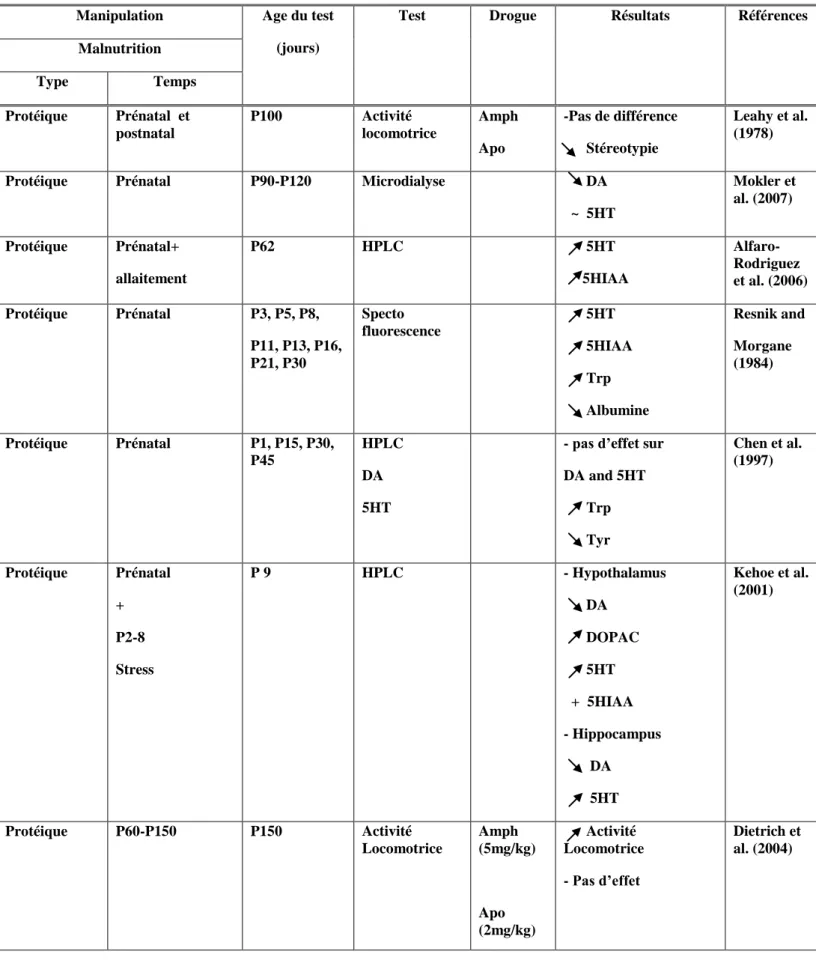
Table 5: Malnutrition chez le rat: Effets comportementaux.
0: Naissance, E: période embryonnaire, P: période postnatale.
Manipulation Age du
test (jours)
Test Résultats Références
Malnutrition
Type Temps
Protéique Prénatal P91 Test de « Visual
discrimination »
- Plus d’erreurs - Plus de temps pour l’apprentissage Tonkiss et al. (1991) Protéique Prénatal P125 P225 Récompense « Food reward » Saccharin-reward Augmentation de la réponse à la récompense Tonkiss et al. (1990b)
Protéique Prénatal P45 Comportement Social - Diminution du
comportement social - Augmentation de l’exploration verticale « rearing » Almeida et al. (1996c) Protéique P0-P21 P0-26,36,46, P56,66,76 P26,36,46 P56,66,76
Jeu Social - Diminution du
comportement “pinning” - Augmentation du
“wrestling”, “walk over” et
du “rearing” Camargo &
Almeida (2005)
Protéique Prénatal P130 Champ ouvert « Open
field »
Moins d’exploration de la zone centrale
Trzcinska et al. (1999)
Protéique Prénatal P70 Labyrinthe en T Réduction de l’anxieté Almeida et al.
(1996b)
Protéique Prénatal
P0-P21
P70 Labyrinthe en T (élevé) Réduction de l’anxieté Hernandes et
Protéique Prénatal P35 Labyrinthe en T (élevé) + stimulation environnementale Effet anxiolytique de la stimulation environmentale Pereira da Silva (2009)
Protéique Prénatal P90 « Kindling » Pas d’effet Schultz et al.
(1995)
Protéique Prénatal P160 DRL operant task Troubles de la performance
«acquisition » Tonkiss et al (1990b) Protéique Prénatal P16-20 P20-27 P70-71 P220- 221
Morris maze Pas d’effet dans le test avec
discrimination proximale ou distale
Tonkiss et al. (1994)
Protéique P0-P50 P70 Morris maze Troubles de l’apprentissage
dans la version distale mais pas proximale Fukuda et al. (2002) Protéique P25-P60 P60 P109 Open field Passive avoidance - Augmentation de l’activité - Pas d’effet sur l’évitement passif.
Bengelloun (1990)
Protéique P60-P240 P320 Morris maze
Open field
-.Pas d’effet sur l’acquisition - Déficits de Rétention - Réduction de la réactivité émotionnelle Lukoyanov & Andrade (2000)
B. Malnutrition et Sous nutrition postnatale a. Malnutrition
La malnutrition protéique post natale au cours de la période de lactation jusqu’à l’âge de 49 jours n’affecte en rien l’acquisition et la rétention dans un test de navigation spatiale avec utilisation des informations visuelles proximales dans un labyrinthe de type Morris. Cependant, ce type de malnutrition perturbe l’apprentissage dans le même test quand la navigation dépend des informations distales (Fukuda et al., 2002). De plus, les rats mal nourris présentent plus de difficultés à reprendre la navigation après 24 h ce qui sous entend un déficit de rétention. Cette difficulté pourrait être le résultat d’altérations au niveau de la formation hippocampique suite à la malnutrition protéique prénatale ou serait le reflet d’une plus grande réactivité à une stimulation aversive comme l’eau froide du labyrinthe Morris (Fukuda et al., 2002).
Une malnutrition imposée après sevrage induit une augmentation des niveaux de l’activité dans un champ ouvert, effet qui disparait après 7 semaines de renutrition (Bengelloun, 1990).
La malnutrition au cours de la période de lactation et 3 semaines après sevrage chez des rats juvéniles diminue le comportement social de jeu. Une réhabilitation nutritionnelle à partir du sevrage inverse ces changements comportementaux (Almeida and De Araujo, 2001). De façon similaire, une malnutrition postnatale induit chez l’adulte une diminution du comportement social chez le rat mal nourri et augmente le niveau du comportement exploratoire (rear) (Camargo and Almeida, 2005). Ces études suggèrent qu’une malnutrition au cours de la période de lactation jusqu’au moment du sevrage pourrait affecter le développement des mécanismes sous tendant le comportement social chez le rat adulte.
Une malnutrition protéique précoce induit un changement de comportement des rats adultes testés dans un labyrinthe élevé en forme de + ; plus précisément, le pourcentage d’entrées dans les bras ouverts et de temps écoulé dans ces bras augmente (Almeida et al., 1996b ; Santucci et al., 1994). De plus, il existe en parallèle un changement de réactivité aux drogues agissant à travers des récepteurs GABAa après une malnutrition postnatale (Almeida et al., 1996a ; Brioni et al., 1989). Une différence de réactivité aux effets anxiolytiques du Diazépam est aussi observée.
Une baisse du nombre d’entrées dans les bras ouverts du labyrinthe ainsi que du temps écoulé dans ces bras sont des indices d’une grande anxiété. Quand les rats bien nourris montrent une diminution de leur exploration des bras ouverts au cours de leur maturation, les rats mal nourris maintiennent un haut niveau d’exploration chez l’adulte (Almeida et al., 1992), ce qui suggère un effet permanent de la malnutrition chez l’adulte sur la réponse à une situation anxiogénique expérimentale (Almeida et al., 1992). La malnutrition protéique précoce, même pour une période courte altère le comportement des animaux dans le labyrinthe élevé en forme de plus. Une nutrition déficiente en protéine pour une courte période semblerait suffisante pour induire un effet anxiolytique à long terme similaire à celui observé chez des animaux exposés à des régimes déficients en protéines pendant de longues périodes (Françolin-Silva et al., 2006).
Des rats soumis à un régime alimentaire les privant de toutes les protéines pendant 3 jours sont actifs de façon continue au cours de la phase d’obscurité contrairement aux rats
témoins recevant une diète à 18 % de protéines, actifs à intervalles irréguliers (Chield et Wurtman, 1981).
Dans le cas de la malnutrition protéique chez l’adulte débutant à deux mois d’âge sur une durée de 6 mois, les rats mal nourris présentent des performances similaires à ceux de sujets témoins testés dans un labyrinthe aquatique au cours de l’apprentissage mais présentent un déficit dans la rétention et dans l’habituation dans un espace ouvert «open field». Cependant, la mémoire de travail, les capacités sensori-motrices et le comportement d’évitement passif ne sont pas touchés par la malnutrition protéique (Lukoyanov et Andrade, 2000). Après une période de deux mois de renutrition, la performance du groupe réhabilité est similaire à celle des sujets témoins. Ainsi, après malnutrition protéique, le système nerveux adulte présente donc un potentiel de récupération fonctionnelle (Lukoyanov et Andrade, 2000).
b. Sous nutrition
Une sous nutrition précoce au cours de la période de lactation par la procédure de séparation afin de priver les petits, ne montre pas d’effet sur la navigation qui utilise les informations visuelles proximales dans un labyrinthe de type Morris. Ces rats ne réussissent pas, par contre à utiliser les informations distales, cet effet dépend de l’âge et n’apparait pas avant 30 jours (Castro et Rudy, 1987). D’autres auteurs ont décrit, après une sous nutrition périnatale, des difficultés d’apprentissage et de mémorisation chez l’adulte (Ranade et al., 2008 ; Zhangh et al. 2010a). Par ailleurs, la sous nutrition postnatale précoce induit une hyper activité mise en évidence par une augmentation du nombre de crossing dans un open field après une restriction alimentaire imposée au moment de la naissance (Masur et Ribiero, 1981). Une sous nutrition imposée au moment du sevrage et maintenue pendant une durée de 30 semaines provoque un accroissement de l’exploration dans un open field avec une augmentation de l’expression du neuropeptide Y dans le noyau arqué hypothalamique ; les neurones de ce noyau pourraient à travers leur projection sur l’amygdale médier un effet anxiolytique (Doukkali, 2007)
Table 6: Sous nutrition chez le rat: Effets comportementaux
0: Naissance, E: période embryonnaire, P: période postnatale.
Manipulation Age du
test (jours)
Test Résultats Références
Sous nutrition
Type Temps
Sous nutrition Prénatal-P25 P105 Choc Electrique Baisse du seuil de réponse Smart et al.
(1975)
Sous nutrition P2-P18 P22 Labyrinthe Morris Trouble d’apprentissage
dans le cas du guidage dépendant des informations visuelles distales et pas proximales
Castro and Rudy (1987)
Sous nutrition E1-P21 P70 Labyrinthe Morris Troubles de
l’apprentissage et de la mémoire
Zhang et al. (2010a)
La sous nutrition chez l’adulte induite par restriction de 25 ou 50% de l’apport calorique normal induit une diminution de l’anxiété de rats testés dans un open field, mise en évidence par une augmentation du crossing des rats sous nourris qui passent plus de temps dans la zone centrale de l’enceinte. Aucune différence comportementale n’est observée entre les sujets restreints à 25% et ceux restreints à 50%. Ainsi 25% de restriction calorique serait suffisante pour induire les effets anxiolytiques de la restriction alimentaire et aucun effet dose n’est par conséquent observé (Levay et al., 2007, 2008). Par ailleurs, d’autres auteurs ont mis en évidence une augmentation de l’activité spontanée dans un open field chez des rats âgés de 30 mois ayant subit une restriction alimentaire de 40% débutant à l’âge de 3 mois (Alberto Del Arco et al., 2011).
En conclusion, indépendamment du type, de l’âge, de la période ou de la durée, la malnutrition et la sous nutrition induit une plus grande réactivité aux stimuli (déplaisant ou non), une hyperactivité avec augmentation de l’activité exploratoire qui pourrait être liée à une diminution de l’anxiété chez les sujets mal nourris. Par ailleurs, contrairement à la malnutrition prénatale, la malnutrition et la sous nutrition postnatale perturbe l’apprentissage dépendant des informations visuelles distales.