République Algérienne Démocratique et Populaire يوـلعـلا تـحبــلاو يلبعلا نـيلــعتلا ةرازو
Ministère de l’Enseignement Supérieur et de la Recherche Scientifique تعـهبج يداىلا رضخل توح ذيهشلا
Université Echahid Hamma Lakhdar -El OUED ةبيحلاو تعيبطلا مىلع تيلك
Faculté des Sciences de la Nature et de la Vie تيئيسجلاو تيىلخلا بيجىلىيبلا نسق
Département de biologie Cellulaire et Moléculaire
MEMOIRE DE FIN D'ETUDE
En vue de l'obtention du diplôme de Master Académique en Sciences
biologiques
Spécialité : Toxicologie
THEME
Présenté Par :
Mr : BEN AOUDA Salah Eddine Mr: CHOUIKH Salah
Devant le jury composé de :
M.A.A. Université d’El Oued. ZAIME .S
Melle Présidente :
M.C.B. Université d’El Oued.
Examinatrice : Melle GUEMMOUDA .M
M.A.A. Université d’El Oued. AOUIMEUR .M
Mme Promotrice :
Année universitaire :
Etude épidémiologique de maladie de la
rougeole dans la région d'El-oued
Remerciements
Avant tout nous remercions le bon Dieu le tout puissant de je avoir donné le
courage, la force et la patience qui je a permet de réaliser ce modeste travail. Merci de je avoir éclairé le chemin de la réussite.
Nous tenons tous particulièrement à adresser nos remerciements les plus vifs d’abord à mon promotrice MmeAOUIMEUR Meriem, qui je a fait l’honneur de diriger mon mémoire
sur un sujet passionnant et je a bien voulu prendre en charge etje a guidés tout au long de son élaboration, nous lui sommes très reconnaissants pour ces conseils, sa disponibilité et son sérieux dans le travail.
Nos sincères considérations et remerciements sont également exprimés aux membres de jury : Melle ZAIME Sihem. qui je a fait l’honneur par sa présence en qualité de présidente de
jury, Mr GUEMMOUDA Messaouda qui a accepté de faire partie de ce jury et d’examiner
ce travail et consacré de son temps pour son évaluation.
Nous tenons à remercier chaleureusement l’ensemble du personnel travaillant au laboratoire du département biologie, qu’il veuille bien recevoir ici l’expression de notre gratitude et de notre profond respect.
Dédicaces
Tout au début, je tiens à remercier le bon Dieu de m’avoir donné du courage et de patience afin de réaliser ce modeste travail que
je dédie à :
Mes très chers parents pour leur soutien et leur sacrifice tout au long
de mon parcours et qui ont cru en moi, que Dieu leur accorde une longue vie, encore une fois
Merci !! Mes chers amies
Ma grande famille, mes oncles, tantes, paternels et maternels, mes
cousins et cousines ;
Mon beau père et mes belle mère ;
et mes beaux frères ;
Mon cher promotrice AOUIMEUR Meriem . Mes amies et à tous ceux qui me sont chers.
ARN : Acide Ribonucléique ARS : Agence Régionale de Santé EEG : Électroencéphalogramme
EPI INF : Epidémiologique Informatique FNU : Fondation pour les Nations Unies HCSP : Haut Conseil de la Santé Publique IgG : Immunoglobuline type G
IgM : Immunoglobuline type M IL : Interleukines
OMS : Organisation Mondiale de la Santé PACA : Provence Alpes Côte d’Azur PCR : Polymerase Chain Reaction
PESS : Panencéphalite Subaiguë Sclérosante ROR : Rougeole - Oreillons - Rubéole
RTPCR : Reverse Transcription Polymérase Chain Réaction SA : Semaines d’aménorrhée
SLAM : Signalling Lymphocyte Activation Molecule SME : Secteur mère-enfant
UCDCP : United States Centers for Diseases Control and Prevention UE : Union Européenne
UNICEF : United Nations Children ’s Fund VAR : Vaccin Anti Rougeole
VEV : Programme Elargi de Vaccination VIH : Virus de l’Immunodéficience Humaine VIH : Virus de l’immunodéficience humaine WHO : World Health Organization
Résumé
L’objectif de ce travail est d’étudier la maladie de rougeole et l’efficacité de sa riposte. Il s’agit d’une étude épidémiologique transversale descriptive qui a porté sur tous les cas de rougeole par lien épidémiologique durant la période de octobre 20 7 à juin 2018 dans El-oued (Alegria) damnais aussi sur l’efficacité de la riposte mise en œuvre. Les résultats ont montrés que 781 cas confirmés de rougeole, un peu moins du tiers soit 20 % ont été confirmés au laboratoire et le reste des cas a été sur la base de l’existence d’un lien épidémiologique avec un ou d’autres cas confirmés. L’âge minimal était de 4 mois et le maximum était de 65 ans. Les enfants âgés de moins de 5 ans représentaient 70 % des rougeoleux. La population masculine était la plus touchée (70 %). La majorité des enfants touchés n’étaient pas vaccinés (88,5 %) . La campagne de riposte a permis de vacciner 68.05 % enfants âgés de 9 à 59 mois répartis sur les différentes zones à risque et de basse couverture soit un taux de couverture de 55,9 %. Au terme de cette étude, il est recommandé : ) de continuer de sensibiliser les parents sur l’intérêt de la vaccination ; 2) de combiner la vaccination de routine à des activités de supplémentassions (Vitamine A par exemple) ; 3) d’organiser des campagnes nationales de vaccination avec le ciblage des groupes spécifiques (recrues, étudiants, réfugiés, etc.) ; et 4) d’instaurer une deuxième dose de vaccin qui permettrait de rattraper les enfants ayant échappé à la première vaccination et aussi de corriger les échecs primaires de vaccination chez ceux qui ont été vaccinés.
Mots-clés : Epidémiologie, Rougeole, El-oued, Vaccin
فدهلا نم اذه لمعلا وه ةسارد ضرم ةبصحلا هتٌلاعفو . هذه ةسارد ةٌفصو ةضرعتسم ةٌئابولا ًتلا تزكر ىلع عٌمج تلااح ةبصحلا نع قٌرط ءابولا ًئابولا للاخ ةرتفلا نم ربوتكا 1027 ىلإ ناوج 1028 ًف يداولا ( رئازجلا ) كلذكو ىلع ةٌلاعف ةباجتسلاا اهذٌفنت . . ترهظأ جئاتنلا هنأ نم نٌب 782 ةلاح ةدكؤم نم ةبصحلا ، مت دٌكأت ام لقٌ الاٌلق نع ثلثلا وأ 10 ٪ ًف ربتخملا ، متو دٌكأت ةٌقب تلااحلا ىلع ساسأ دوجو ةلص ةٌئابو عم ةدحاو وأ تلااحلا ةدكؤملا ىرخلأا . ناك دحلا ىندلأا نسلل 4 رهشأ دحلاو ىصقلأا 65 ةنس . لثمت لافطلأا نود نس ةسماخلا 70 ٪ نم ةبصحلا . ناكو ناكسلا روكذلا رثكلأا اررضت ( 70 .)٪ مل متٌ مٌعطت ةٌبلاغ لافطلأا نٌررضتملا ( 88.5 .)٪ تنكمت ةلمح ةباجتسلاا نم نٌصحت 68.05 ٪ نم لافطلأا نٌذلا حوارتت مهرامعأ نٌب 9 ىلإ 59 ا ارهش نٌرشتنم ًف فلتخم قطانملا ةضرعملا رطخلل ةٌطغتو ةضفخنم ، لدعمب ةٌطغت 55.9 .٪ ًف ةٌاهن هذه ةساردلا ، ىصوٌ امب ًلٌ : 2 ) ةلصاوم ةٌعوت ءابلآا دئاوفب مٌعطتلا ؛ 1 ) عمجلا نٌب مٌعطتلا ًنٌتورلا ةطشنلأاو ةٌلٌمكتلا ( لثم نٌماتٌف أ ) ؛ 3 ) مٌظنت تلامح مٌعطتلا ةٌنطولا عم فادهتسا تاعومجم ةددحم ( نٌدنجملا بلاطلاو نٌئجلالاو ، امو ىلإ كلذ ) ؛ و ( 4 ) مٌدقت ةعرج ةٌناث نم حاقللا نم اهنأش نأ لعجت نم نكمملا قاحللا لافطلأاب نٌذلا اوجن نم مٌعطتلا لولأا كلذكو حٌحصتل تلااح لشف مٌعطتلا ةٌلولأا ًف كئلوأ نٌذلا مت مهحٌقلت . تاملكلا ةيحاتفملا : ابولا ةٌئ , ةبصحلا , يداولا , حاقل
Sommaire
Liste des abréviations………..
Sommaire ... Liste Des Figures ... Liste des tableaux ...
INTRODUCTION ...
INTRODUCTION ...
Partie théorique ... chapitre I MALADIE DE LA ROUGEOLE ...
I.1. Rappel historique ... I.2. Virus pathogène ... I.2.1. Classification du virus ... I.2.2 Les Caractéristiques du virus ... I.2.4. Contamination par le virus de rougeole ... I. . Phases d’apparition... I. . . Période d’incubation ... I. .2. Phase d’invasion ... I. . . Phase d’éruption l’exanthème ... I.3.4. Phase de desquamation ... 2 I.4. Signes cliniques ... 2 I.5.1. Réponse spécifique ... I.5.1.1. Réponse humorale ... I.5.1.2. Réponse à médiation cellulaire ... I.6. Complications ... I. . Risques la rougeole sur l’organisme ... I.7.1. Cas de grossesse... I.7.2 Immunodépression ... I.8. Diagnostiques ... I.9. Prévention de la rougeole ... I.9.1. Vaccination ... I.9.1.1 .Composition du vaccin de la rougeole ... I.9.1.2.Conservation du vaccin ...
PARTIE ... PRATIQUE ... CHAPITRE I Matériels et méthodes ...
I.2. Zone étudiée... 2
I.3. Méthodologie ... I.4. Analyse des données ... CHAPITRE II-Résultats et discussion ... II.1.Résultats ... II.1.1.Etude descriptive ... II. .2.Etude statistique pendant la période d’octobre 2 à juin 2 ... II. .2. . Répartition des cas selon le sexe et l’âge ... II.1.2.2 Répartition des cas selon le statut vaccinal ... II.1.2.2.1. Stratégies utilisées ... III.1.2.2.2 Supervision ... III.1.2.2.3 Sources de financement ... II. . . Etude statistique pendant la période d’octobre 2 à juin 2 ... II. . . . Répartition des cas selon le sexe et l’âge... II.1.3.2 Répartition des cas selon le statut vaccinal ... II. .4. . Répartition des cas selon le sexe et l’âge ... II.1.4.2. Répartition des cas selon le statut vaccinal ... Tableau 6 : Taux de couverture vaccinale 2 4-2 -2 ... II-2. Discussion... II.2. . Limites de l’étude ... II.2.2 Sex et la classe d’âge des enfants touchés ... II.2. . Statut vaccinal des cas confirmés et taux d’abandon ... 4
II.2.4. Couverture en Vaccin Anti Rougeole (VAR) ... 4
II.2. . Période de survenue de l’épidémie ... 42
II.2. . Statut vaccinal des cas confirmés et taux d’abandon ... 42
II.2.7. Couverture en Vaccin Anti Rougeole (VAR) ... 42
CONCLUSION GENERALE ...
CONCLUSION ... 4
Bibliographie ... Annexes ...
Figure . Cycle d’infection par le virus ... .تفّرعه ريغ تيعجرولا ةربشلإا !أطخ
Figure 2. Chronologie des signes cliniques et biologiques ... Figure 3. Périodes de positivité des tests biologiques pour la confirmation de la rougeole ... Figure 4. Patiens de la région d’El-oued ... 2 Figure 5. Prévalence da la rougeole chez les populations pendant la période d'octobre 2017 au juin 20 8 . ... Figure 6. Prévalence da la rougeole chez les populations dans la période d'octobre 2018 au juin 2019 . ... Figure 7. Prévalence da la rougeole chez les populations dans la période d'octobre 2014 au juin 2016. ... Figure 8. Nombre des cas dans les diffirentes périodes étudiées (octobre-juin) ... 4
Liste des tableaux
Tableau 1: Prévalence da la rougeole chez les populations dans la période d'octobre 2017 au juin 2018 ... 6 Tableau 2: Taux de couverture vaccinale (20 4-20 5-20 6) ... 7 Tableau 3: Prévalence da la rougeole chez les populations dans la période d'octobre 2018 au juin 2019 . ... 8 Tableau 4: Taux de couverture vaccinale (20 6-20 7-20 8) ... 8 Tableau 5: Prévalence da la rougeole chez les populations dans la période d'octobre 2014 au juin 2016. ... 8 Tableau 6: Taux de couverture vaccinale (20 4-20 5-20 6) ... 9 Tableau 7: Nombre des cas dans les diffirentes périodes étudiées (octobre-juin) ... 4
INTRODUCTION
La rougeole est une maladie infectieuse extrêmement contagieuse dite infantile. Ses complications peuvent être gravissimes, nécessitant de nombreuses hospitalisations. Une prévention par la vaccination a été rendue possible en 1962 et introduite dans le calendrier vaccinal français en 1983(Anne-Marie, .
La rougeole est redevenue une maladie à déclaration obligatoire depuis le 24 juin 2005, comme c’était le cas de 945 à 985. En effet, la diminution du nombre de cas (de 300000 en 986 à 5200 en 2002) rendait l’estimation de l’incidence beaucoup moins précise et l’identification des zones de transmission impossible. Le diagnostic clinique, moins fréquent, perdait donc sa valeur prédictive positive comme l’a démontré l’épidémie en PACA de 200 .
Depuis, d’autres foyers sont apparus sur le territoire et depuis 2008, c’est une véritable épidémie qui touche l’ensemble de notre pays (Anne-Marie, .
Après plusieurs années d’accalmie et dans un contexte de contre-performance du Programme Elargi de Vaccination (PEV), en période (octobre a juin) été marquée par la survenue d’une épidémie de rougeole dans la région de El-oued.
La rougeole continue de tuer principalement dans les pays en voie de développement. L’Organisation Mondiale de la Santé a fixé son élimination en objectif pour 2020 pour cinq de ces six grandes régions.
Cette maladie est théoriquement radicale puisqu’à seule transmission interhumaine et à prévention vaccinale.
Comment est-il possible d’endiguer l’épidémie dans la région d’el-oued ? Dans une première partie, nous parlerons sur la maladie, on étudie sa prévention et son épidémiologie. Ensuite, Etude statistique de l'épidémie de la maladie de la rougeole dans la région d’el-oud en plusieurs périodes,de début d’octobre à la fin de juin de l'année suivante .
L’objectif de ce travail de faire une étude statistique des cas touchées par cette maladie dans la région d’El-oued pour trouver des solutions afin de réduire cette épidémie.
chapitre I
MALADIE DE LA
I.1. Rappel historique
La première description scientifique de la maladie est attribuée à un médecin perse du Xème siècle, Abu-Bakr-Mohammed-ibn-zakaria al-Razi (860-932), connu en Occident sous le nom de Rhazès et auteur d’un ouvrage intitulé « Al-Jadri wa al Hasbeh », traduit par
«Traité de la variole et de la rougeole », resté célèbre en Europe jusqu’au XIXe siècle, tant
ses observations contribuant à la distinction des deux maladies sont précises (Medarus,2012).
Ce n’est cependant qu’à partir du XVIIe siècle qu’elle est décrite en tant que maladie épidémique distincte dans le registre de décès à Londres en 1629, et par John Hall à Boston en 1657. En 1675 le médecin anglais Thomas Sydenham la différencia de la scarlatine.
De nombreuses épidémies ont décimé la population européenne au cours du Moyen Age et de la Réforme (Schaechter et al .
Lors des colonisations, les explorateurs ont été vecteurs du virus de la rougeole et responsables du contage des populations indigènes non immunisées à l’origine de dramatiques épidémies. Ainsi, en 1851, les quatre milles habitants des iles Féroé, sauf cinq, contractèrent la maladie. Il en fut de même pour les hawaïens et d’autres populations isolées.
Devant des phénomènes d’une telle ampleur, les chercheurs s’intéressèrent à la transmission de la maladie. Au milieu du XVIIIe siècle, Home démontra que le virus était transmis par le sang contaminé des individus atteints au cours de tentatives de vaccination par scarification. En 1911, Goldberger et Andersen apportèrent la preuve de la transmission par un agent filtrant en injectant à des singes un filtrat issu de malades atteints de rougeole.
La rougeole est décrite pour la première fois au Xème siècle par le médecin et philosophe persan Abu Bakr Mohammad Ibn Zakariya al-Razi, plus connu sous le nom de Rhazes. En 1757, un médecin écossais du nom de Francis Howe démontre que la rougeole est causée par un agent infectieux présent dans le sang des patients atteints. En 1954, le virus responsable de la rougeole est isolé pour la première fois à Boston, sur un échantillon du sang d’un patient nommé David Edmonston, par John F. Enders et Thomas C. Peebles (PMAR, ).
I.2. Virus pathogène
Le virus de la rougeole fait partie du genre des Morbillivirus, appartenant à la famille des Paramyxoviridae. C’est un virus enveloppé à ARN monocaténaire non-segmenté (Moss ).
Chapitre I Maladie La Rougeole
Sa maturation et la réplication de son génome s’effectuent dans le cytoplasme des cellules infectées (Borderon et al. .
Il existe un seul sérotype viral et l’Homme constitue son seul réservoir. L’infection confère une immunité durable.
La transmission est essentiellement aérienne, par aérosolisation de fines gouttes d’eau contenant le virus (gouttelettes de Flugge), émises en parlant ou en toussant. Elle peut aussi se faire par contact direct avec du matériel récemment souillé par des sécrétions nasopharyngées.
Le virus est rapidement inactivé par la chaleur et est très sensible à de nombreux Dés infectants.
I. . . Classification du virus
Très proche du virus de la peste bovine, il est probablement issu de l’évolution d’un virus transmis par le bétail dans une communauté ancestrale où humains et bovins cohabitaient. Il se serait développé il y a 5000 à 10 000 ans au Moyen Orient, lorsque lataille des populations a été suffisante pour maintenir sa transmission. Toutefois, une analyse phylogénétique suggère une plus récente mutation du virus de la peste bovine au XI ou XIIe siècle (Furuse et al., _Il appartient à la famille des Paramyxoviridae divisée en deux sous-famille :
Celle des Pneumovirinae qui comprend les genres Pneumovirus (Virus Respiratoire Syncitial humain A et B) et Metapneumovirus et celle des Paramyxovirinae constituée des genres Rubulavirus (Para Influenza Virus 2 et 4a/b), Paramyxovirus (Para Influenza Virus 1 et 3), et du genre Morbillivirus (Gouarin S, .
Ce dernier inclut de nombreux virus pathogènes pour les animaux, mais seul celui de la rougeole est pathogène pour l’Homme.
Cependant depuis une vingtaine d’années, plusieurs observations conduisent à penser que cette famille de virus est une source potentielle de nouveaux virus pathogènes pour l’Homme, puisque des hôtes inhabituels d’un Morbillivirus, tels les dauphins, chevaux, porcs, phoques, ont été contaminés et que le franchissement de labarrière d’espèce entrainant des cas humains a déjà été observé (Mccormach, ; O’sulliran et al., .
I.2.2 Les Caractéristiques du virus
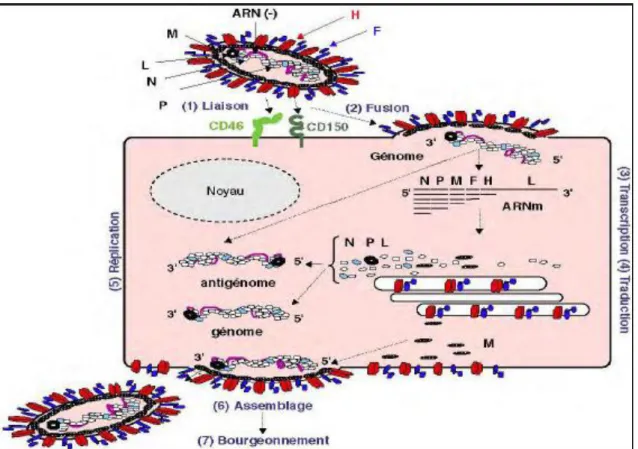
Figure . Cycle de l’infection par le virus de rougeole (Gerlier et al.,
C’est un virus à ARN polymorphe de 20 à 250 nm de diamètre. L’ARN monocaténaire linéaire est non segmenté et de polarité négative et code pour 8 protéines, dont six se retrouve dans le virion (Griffin, 2012).
L’enveloppe est hérissée de spicules de glycoprotéines H et F sur sa face externe et est tapissée sur sa face interne de la protéine non glycosylée de matrice M. L’hémagglutinine H reconnait les sites récepteurs des cellules cibles et s’y lie à pH neutre et la protéine F permet la fusion de l’enveloppe du virus à la membrane plasmique des cellules (Borderon et al., .
La nucléocapside hélicoïdale contenue dans l’enveloppe est formée à partir de l’ARN entouré de la nucléoprotéine N et maintenue en forme de bobine par la phosphoprotéine régulatrice P qui est le cofacteur de la grande protéine polymérase.
Ces deux protéines constituent le complexe de transcription. Les protéines C et V, non structurales, également codées par le gène de P, sont des protéines de régulation des réponses des cellules hôtes.
Chapitre I Maladie La Rougeole
I.2.3. Réplication du virus
La réplication du virus est sensible à l’interféron. Le virus inhibe à la fois l’induction de la synthèse d’interféron et la reconnaissance par les cellules infectées.
Les protéines V et C interviennent pour ces interactions, avec des effets différents selon les souches du virus, mais leur rôle ainsi que celui de l’interféron reste encore à préciser.
Les virus de type sauvage se répliquent efficacement dans les cellules activées du système immunitaire exprimant le récepteur SLAM et sont probablement capturés et transportées par les cellules dendritiques pulmonaires immatures ou par les macrophages alvéolaires jusqu’aux ganglions lymphatiques proches où la réponse immunitaire est initiée et la dissémination facilitée (Lemon et al., .
Il y a donc plusieurs cycles réplicatifs, correspondant chacun à une virologie en lien avec la clinique décrite plus loin.
Il existe 24 génotypes du virus classés en huit groupes de A à H, chacun divisé lui-même en plusieurs sous-types. Les plus courants en Europe sont D4 et D5 (Mortamet et al., .
I. . . Contamination par le virus de rougeole
Extrêmement contagieux le Morbillivirus est transmis par voie aérienne, contenu dans les gouttelettes de Flügge émise par le sujet malade ou plus rarement par des objets contaminés (DGS, .
Son taux de reproduction R0, c’est-à-dire le nombre de cas secondaires induit par un sujet porteur, est élevé : de 15 à 17. (Levy et al, ) Restant actif dans l’air ou sur les surfaces pendant deux heures (OMS, il infecte l’épithélium des voies respiratoires supérieures depuis sa lumière, se multipliant dans les cellules de la muqueuse avant de se répandre dans les cellules lymphatiques, puis dans les autres organes par virémie (Moss, . Trois récepteurs des cellules hôtes ont été identifiés : CD46, protéine de régulation largement répandue dans l’espèce humaine qui se trouve à la surface de toutes les cellules nucléées, CD150 aussi appelé SLAM (Signalling Lymphocyte Activation Molecule) qui s’exprime à la surface des lymphocytes T et B activés et des cellules présentatrices d’antigènes et la nectine-4 ou PVRL nectine-4 (poliovirus receptorrelated nectine-4)(Griffin, .
L’attachement via la protéine H à la cellule cible permet l’action de la protéine F et donc l’entrée du matériel génomique dans cette cellule (Schechter et al., .
La réplication du génome viral et la maturation du virus ont lieu dans le cytoplasme de la cellule infectée. Cette cellule exprime alors les glycoprotéines virales à sa surface et peut fusionner avec des cellules saines, formant aussi une cellule géante multinucléée ou syncitia, et causant la mort de la cellule initiale. Ainsi le tissu lymphoïde est détruit et une leucopénie marquée apparait (Borderon et al., .
Ces cellules géantes furent découvertes par Hecht en 9 0 et c’est Whartin qui en 1931 montra leur importance et leur donna son nom. De taille variable, pouvant comporter plus de cent noyaux, ces cellules contiennent parfois des corps d’inclusion intranucléaires et intracytoplasmiques. Les observations in vivo montrent que les syncitia se forment uniquement dans les tissus des poumons, de la peau et lymphatiques, et pas dans le système nerveux central. Dans les infections aigues, les cellules endothéliales, épithéliales et du système immunitaire sont infectées. Au cours des infections persistantes, les neurones et cellules gliales deviennent des cibles importantes (Griffin, 2007).
I.3. Phases d’apparition
L’infection aiguë est presque toujours symptomatique. Ces symptômes permettent de repérer chaque maillon de la chaine de transmission.
Le virus est extrêmement contagieux, présents dans les sécrétions respiratoires dès la fin de l’incubation et jusqu’au 4eme jour de l’éruption. Il est également retrouvé dans les urines, le sang et les sécrétions conjonctivales (Gouarin .
Classiquement, plusieurs phases sont décrites dans la forme typique de la maladie.
Figure . Chronologie des signes cliniques et biologiques (Mortamet et al., I. . . Période d’incubation
Estimée en moyenne à 12,5 jours (IC 95% 11,8-13,2) par Lessler et al en .
Elle peut varier de 7 à 18 jours. Elle est cliniquement muette. Néanmoins, une fièvre modérée et de discrets signes respiratoires peuvent apparaitre.
Chapitre I Maladie La Rougeole
I. . . Phase d’invasion
D’une durée de 2 à 4 jours, son début peut être brutal, marqué par une fièvre à 9-40° C, une asthénie, une anorexie et des malaises, ou bien progressif, avec des céphalées, des troubles du sommeil, et des modifications du comportement (Borderon et al., .
Dans les 24 heures se manifeste le catarrhe, caractérisé par :
- une rhinite ou coryza : l’écoulement est séreux puis mucopurulent, accompagné d’éternuements voire d’épistaxis
- une conjonctivite d’abord localisée puis diffuse (larmoiement, gonflement des paupières et rougeur des yeux)
- une photophobie
- une toux rauque, pénible, avec enrouement attestant l’atteinte trachéopharyngée - parfois une diarrhée
À la 6eme heure, soit 2 jours avant le début de l’éruption, un énanthème apparait à la face interne des joues, en regard des dernières molaires (Gouarin, .
Il s’agit d’un signe décrit par Koplick en 9 6, qui porte son nom et est pathognomonique de la maladie. L’examen buccal montre de petits éléments blancs-bleuâtres punctiformes, reposant sur une base érythémateuse brillante en nombre variable et s’accroissant en quelques heures. Fréquemment, on retrouve un érythème ou un piqueté purpurique du voile et de la partie postérieure du palais et des piliers amygdaliens.
Une éruption fugace urticairienne ou maculeuse disparaissant avant l’éruption, une polyadénopathie, des signes nerveux tels qu’une insomnie, des convulsions chez le jeune enfant, voire un syndrome méningé, sont inconstamment retrouvés.
I. . . Phase d’éruption l’exanthème
Il apparait 4 jours après le contage et souvent lors d’une recrudescence de fièvre ou du catarrhe. C’est une éruption non prurigineuse de macules érythémateuses, aux contours irréguliers, mesurant moins de cm de diamètre, bien distinctes et séparées d’intervalles de peau saine, s’effaçant à la pression et prenant parfois l’aspect de papules (ce relief étant très utile pour le diagnostic dans la population noire).
Commençant derrière les oreilles, à la racine des cheveux, et à la partie supérieure du cou, il gagne la face dès le premier jour, puis s’étend au cou, thorax et membres supérieurs. Au eme jour, il atteint l’abdomen et les cuisses et est diffus au 4eme jour, les maculo-papules confluant en plaques sur le visage et le tronc. L’éruption dure à 6 jours et s’estompe de la même manière qu’elle est apparue.
2
Cette éruption peut être boutonneuse, parfois eczématoïde avec des grands placards légèrement squameux et prurigineux. Rarement, elle est biphasée, avec une accentuation aux 5-6ème
jours. Chez les sujets immunodéprimés, l’éruption est inconstante et la sérologie négative (Mortamet et al., .
L’exanthème est la manifestation de la réponse immunitaire spécifique à médiation cellulaire avec l’infiltration des CD4+ et CD8+ dans les sites de réplication du virus et l’initiation de l’élimination de celui-ci.
I. . . Phase de desquamation
Des taches bistre apparaissent à la place des maculo-papules, avant une desquamation furfuracée qui accompagne une courte convalescence.
I. . Signes cliniques
Les malaises, exacerbés au début de l’exanthème, s’atténuent aux 3-4ème
jours, à l’instar de la fièvre. Cette dernière, qui habituellement diminue la veille de l’éruption, augmente à 39-40°C et demeure élevée durant l’extension des lésions cutanées puis disparait, souvent brutalement. Toute réaugmentation doit faire craindre une complication.
En parallèle, les signes respiratoires, digestifs ou nerveux persistent fréquemment jusqu’à régression de l’exanthème. Les radiographies pulmonaires montrent alors souvent, en dehors de toute complication, des anomalies à type d’élargissement des ombres hilaires et une accentuation de la trame périhilaire. Dans le cas d’une rougeole normale, l’EEG présente également des anomalies marquées par un ralentissement classiquement asymétrique du rythme postérieur alors que l’enregistrement des déviations antérieures est normal. Une lymphocytose modérée peut être observée dans le LCR.
Les prodromes, c’est-à-dire les expressions du virus au niveau des muqueuses oculaires et buccales, maximaux au 3eme jour, disparaissent après.
Elle est caractérisée par l’apparition d’une fièvre élevée associée à une altération de l’état général, d’un catarrhe diffus avec des signes oculaires (conjonctivite), respiratoires supérieurs (rhinorrhée) et trachéobronchiques (toux) et de signes digestifs (douleurs abdominales, diarrhée).
L’énanthème, inconstant mais pathognomonique, survient 24 à 48 heures après le début du catarrhe ; il est fait de semis de petites papules blanchâtres reposant sur un fond érythémateux à la face interne des joues, en général en regard des prémolaires (signe de Köplik). Apparaît ensuite l’exanthème composé de maculo-papules non prurigineuses, parfois confluentes mais respectant des intervalles de peau saine (morbilliforme) et
Chapitre I Maladie La Rougeole
disparaissant à la vitropression. L’éruption cutanée débute derrière les oreilles, s’étend de la tête aux pieds pour se généraliser en à 4 jours et peut être suivie d’une desquamation. Elle disparaît, avec la fièvre, en 1 semaine environ. Des adénopathies ainsi qu’une splénomégalie peuvent faire partie du tableau. Les principaux diagnostics différentiels sont la rubéole, la scarlatine, l’infection par le virus herpès de type 6 et la maladie de Kawasaki.
I. . Réponse immunitaire I. . . Réponse spécifique I. . . . Réponse humorale
Si le sujet infecté développe des anticorps contre l’ensemble des protéines virales, seuls ceux dirigés contre les glycoprotéines H et F permettent l’élimination du virus et la protection durable.Ces anticorps apparaissent au cours de la deuxième semaine après le début de l’éruption, puis décroissent après un pic à la 4eme ou 6eme semaine.
Ainsi, la réponse primaire est marquée par l’apparition des IgM puis des IgG. La présence de ces IgM spécifiques est la preuve d’une infection récente puisqu’elles ne persistent guère après neuf semaines. Les IgG demeurent à long terme : leur existence permet de confirmer un antécédent de rougeole. Des IgA sécrétoires spécifiques sont également sécrétés. Du titre des anticorps dépend le degré de protection. Des seuils minimum ont ainsi pu être décrits. (Borderon et al.,
I. . . . Réponse à médiation cellulaire
Au cours de l’infection par le Morbillivirus, des lymphocytes T auxiliaires CD4+ et suppresseurs CD8+ sont présents au niveau des tissus épithéliaux touchés, en rapport avec une éruption cutanée. Après l’infection, des cellules mémoires de ces types restent, assurant l’immunité à long terme (Borderon et al., .
I.6. Complications
Dans la majorité des cas, l’évolution est favorable. Par dissémination le virus de la rougeole peut atteindre tous les organes et entraîner une immunodépression (Atabani et al., .
Les complications sont plus fréquentes chez les enfants de moins de 5 ans et les adultes. Le risque de complications augmente en cas de malnutrition, d’immunodépression, de déficit en vitamine A et de surpopulation (Clements et al., 2004 ; Orenstein et al., .
Les otites moyennes aiguës sont les complications les plus fréquentes. Des laryngotrachéobronchites peuvent être causées par le virus lui-même ou résulter d’une surinfection bactérienne ; elles touchent surtout les nourrissons (Orenstein et al., .
4
Les atteintes digestives se traduisent essentiellement par des douleurs abdominales ou une diarrhée. Des complications oculaires à type de conjonctivite surinfectée peuvent être responsables de cécité, surtout dans les pays en développement.
Des pneumopathies peuvent être dues au virus lui-même (pneumonies interstitielles à cellules géantes très graves survenant chez les sujets immunodéprimés) ou à une surinfection virale ou bactérienne. Elles représentent les complications les plus pourvoyeuses d’hospitalisations et de décès (Orenstein et al., ).
Les complications neurologiques sont rares mais graves car elles sont à l’origine de séquelles psychomotrices lourdes et de décès. On distingue trois types d’atteinte (Reinert ,2005) : l’encéphalite aiguë post-éruptive, l’encéphalite subaiguë à inclusions du sujet immunodéprimé et la panencéphalite subaiguë sclérosante de Von Bogaert (PESS): -L’encéphalite aiguë apparaît en moyenne à 7 jours après le début de l’éruption et
associe une fièvre à un syndrome méningé, des troubles de la conscience (jusqu’au coma plus ou moins profond) et des convulsions généralisées ou partielles. Sa fréquence est de 1/1000 rougeoles (Reinert, et elle touche le plus souvent l’adolescent et l’adulte. Son mécanisme est auto-immun et il n’y a, à ce jour, aucun traitement à l’efficacité prouvée (Buchanan, . L’issue est fatale dans 0 à 5% des cas et les séquelles à type d’épilepsie, de retard mental isolé et de puberté précoce touchent environ 40% des enfants. - L’encéphalite subaiguë du sujet immunodéprimé est très rare mais le décès survient dans tous les cas, en 2 à 3 semaines. Elle associe une détérioration mentale progressive, des convulsions avec déficits moteurs et myoclonies et des troubles de la conscience allant jusqu’au coma. Le diagnostic est difficile, souvent posé par l’examen histologique cérébral post-mortem et la pathogénie est encore mal connue.
- La PESS est elle aussi rare et mortelle. Elle est due à la persistance du virus de la rougeole dans le système nerveux central (Liebert, sous une forme mutée (défectif). Ses principaux facteurs de risque de survenue sont la rougeole congénitale et l’infection par le virus de la rougeole avant l’âge de an. Elle affecte principalement les enfants et les jeunes adultes. Les principaux symptômes surviennent 3 à 7 ans après une rougeole bénigne et associent des troubles du comportement, des myoclonies rythmées, une ataxie et une régression intellectuelle allant jusqu’à la démence.
L’évolution se fait le plus souvent en à ans vers la grabatisation et le décès ; il existe de très rares cas de rémission spontanée avec des séquelles motrices et cognitives persistantes. Son diagnostic repose sur la connaissance de l’histoire médicale du sujet, l’examen clinique et l’aspect typique et pathognomonique du tracé électroencéphalographique
Chapitre I Maladie La Rougeole
(ondes lentes symétriques à intervalle de répétition long). L’examen du LCR retrouve une sécrétion intrathécale d’anticorps anti-rougeole (Gutierrez, .
I.7. Risques la rougeole sur l’organisme I. .1. Cas de grossesse
L’infection par le virus de la rougeole durant la grossesse entraîne un risque élevé de complications maternelles, fœtales et néonatales. Le virus de la rougeole traverse la barrière placentaire, induisant une dysfonction placentaire, mais n’est pas responsable de malformation foetale. Il existe un risque important de mort foetale in utero, de fausse couche spontanée du er trimestre, de fausse couche tardive et d’accouchement prématuré (Anselem et al., ).
Une étude rétrospective portant sur 55 cas de rougeole pendant la grossesse, survenus en Namibie lors de l’épidémie de 2009-2010, retrouvait un risque accru de mortalité maternelle, d’avortement spontané et de mort foetale in utero (Ogbuanu et al., . Dans cette étude, des complications maternelles étaient retrouvées dans 71% des cas avec des diarrhées, des pneumonies et trois encéphalites dont une fatale ; cinq patientes sont décédées. Une étude réalisée chez des femmes enceintes hospitalisées avec une infection de la rougeole à Lyon en 2011 retrouvait comme principales complications maternelles des pneumonies et des hépatites (Casalegno et al., ). Le risque de complication grave, en particulier pulmonaire et neurologique (PESS), est accru en cas de rougeole congénitale. I.7.2 Immunodépression
La rougeole survenant chez les sujets immunodéprimés donne lieu à des complications souvent très graves comme le Syndrome de Détresse Respiratoire Aiguë (avec ou sans surinfection bactérienne) compliquant les pneumopathies interstitielles ou l’encéphalite subaiguë à inclusions (Rafat, ). L’infection par le Virus de l’Immunodéficience Humaine (VIH) est associée à un risque accru de décès par rougeole (Le Roux et al., ).
I. . Diagnostiques
Le diagnostic de la rougeole doit être confirmé par des tests biologiques. Ces tests reposent soit sur la recherche d’anticorps (diagnostic indirect) soit sur la recherche du virus ou de ses constituants (diagnostic direct). En pratique courante, la confirmation diagnostique repose sur la détection d’anticorps antirougeoleux sur un prélèvement sanguin ou salivaire. Elle doit se faire en l’absence de vaccination contre la rougeole dans les deux mois précédant le prélèvement. La sérologie sur prélèvement sanguin périphérique est l’approche
recommandée par l’OMS (WHO, ) en médecine de ville. La détection des anticorps de classe Immunoglobuline M (IgM) ou G (IgG) est réalisée à l’aide de techniques immuno-enzymatiques de capture par ELISA disponibles dans tous les laboratoires biologiques. Les résultats sont donnés en quelques jours.
Les IgM apparaissent à peu près au moment de l’éruption cutanée et persistent environ 60 jours mais elles sont le plus souvent positives du 3ème au 28ème jour suivant le début de l’éruption (figure ). Un prélèvement réalisé au cours des trois premiers jours de l’éruption et négatif en IgM ne permet pas d’éliminer formellement le diagnostic et doit être suivi d’un second prélèvement. Les IgG apparaissent au même moment que les IgM ; une élévation d’au moins quatre fois leur titre sur deux prélèvements espacés de 10 à 20 jours permet le diagnostic.
Le diagnostic par prélèvement salivaire est l’approche alternative si l’on ne dispose pas d’un laboratoire pouvant rendre un résultat dans les 3 jours. Le prélèvement est réalisé par écouvillonnage buccal à l’aide d’un kit salivaire fourni par l’ARS et est transmis par voie postale au Centre National de Référence de la rougeole qui centralise les informations à l’échelle nationale (Centre National de Référence de la Rougeole et des Paramyxoviridae respiratoires humains.
Il permet la recherche de l’Acide Ribonucléique (ARN) viral par RTPCR (reverse transcription-polymerase chain reaction) et des IgM et IgG en cas de PCR négative. Les résultats peuvent être obtenus en quelques heures. En cas de PCR positive, le génotype viral est obtenu par séquençage.
La technique de RT-PCR est coûteuse, réalisable par seulement quelques laboratoires spécialisés et présente une variabilité de sensibilité entre laboratoires. Elle n’est pas adaptée à une utilisation en diagnostic de routine et semble mieux convenir pour des études épidémiologiques (WHO, ). Cependant, dans les formes graves ou atypiques, il est quand même recommandé de procéder à la recherche de l’ARN du virus.
Chapitre I Maladie La Rougeole
Figure . Périodes de positivité des tests biologiques pour la confirmation de la rougeole ( MSSC ).
Le virus de la rougeole peut être isolé sur des cultures cellulaires à partir de prélèvements rhinopharyngés, urinaires ou de lymphocytes du sang périphérique. Cela permet l’isolement de souches virales, l’analyse de leur génome et l’identification de leur origine géographique, dans un but épidémiologique.
I. . Prévention de la rougeole
Il n’existe à ce jour aucun traitement spécifique. Des mesures d’hygiène simples (lavage des mains, jeter les mouchoirs dans une poubelle à couvercle, aérer la chambre, ne pas embrasser un enfant malade, ne pas échanger la vaisselle,etc..) permettent de limiter la propagation (AM, . En cas de maladie identifiée, il s’agit de traiter les symptômes et de mettre en place une antibiothérapie en cas de complications infectieuses (Boraeron, . Dans les pays en développement, un apport en vitamine A en deux doses est recommandé diminuant notamment les complications oculaires (OMS, 2012 ; Yang et al, Ainsi, la seule mesure efficace à appliquer est la prévention primaire par la vaccination
I. .1. Vaccination
Le premier vaccin antirougeoleux, obtenu à partir de la souche Edmonston, a été autorisé en 1963 aux États-Unis et combiné aux valences rubéole et oreillons en 1971 (Borderon, ). Au Royaume- Uni, cette vaccination a été recommandée à partir de 1968. En France, le premier vaccin antirougeoleux (souche Schwartz) a été disponible à partir de 1966 (première autorisation de mise sur le marché). Il est entré au calendrier vaccinal pour la première fois en 1983, dans la vaccination associée rougeole-rubéole et a été associé aux
valences rubéole et oreillons en 1986 (Antona, ). En 1996, une seconde dose de vaccin trivalent a été recommandée à l’âge de -13 ans puis cet âge a été abaissé à 3-6 ans en 1997. Depuis 2013, le calendrier vaccinal simplifié recommande une première dose à 12 mois et la deuxième dose entre 16 et 18 mois (HCSP, ) pour protéger le plus tôt possible les nourrissons.
Les différents vaccins utilisés sont issus de souches différentes, de plus en plus atténuées. Il s’agit de vaccins vivants atténués, préparés à partir de cultures sur cellules d’embryons de poulet ou diploïdes humaines (Borderon, ).
La séroconversion a lieu 2 à 4 semaines après l’injection et l’immunité acquise est de longue durée. La seconde injection permet un rattrapage pour les enfants n’ayant pas séroconverti après la première injection.
Les trois vaccins actuellement commercialisés en France sont le Rouvax® (vaccin monovalent), le M-M-RVaxPro® et le Priorix® (vaccins trivalents ROR). Ils sont pris en charge à 00% par l’Assurance Maladie.
I. . . .Composition du vaccin de la rougeole
De nos jours, les vaccins sont toujours composés de virus vivants atténués de diverses souches. Ainsi, en France, la forme simple Rouvax® contient la souche Schwarz, tout comme le vaccin trivalent Priorix®, alors que le trivalent M-M-R Vax Pro® contient la souche Edmonston Enders (DGS, . D’autres souches sont utilisées à traversle monde : AIK-C et Edmonston-Zagreb, Moraten aux États-Unis, et les souches atténuées Leningrad 16 et Shanghai 6 en Europe de l’Est et en Chine.
I. . . .Conservation du vaccin
Une forme quadrivalente associant aussi le vaccin contre la varicelle a reçu l’AMM européenne, mais n’est pas disponible sur le marché français. Si certains excipients diffèrent, toutes les spécialités commercialisées en France contiennent de la néomycine. Les vaccins doivent être conservés entre +2 et +8°C à l’abri de la lumière. Ils ne supportent pas la congélation. La suspension vaccinale est reconstituée par addition de solvant dans le flacon de poudre du vaccin, l’injection se faisant par voie sous-cutanée (D G S, .
I. . . . Effets indésirables du vaccin de la rougeole
Des réactions locales peuvent se produire, à type d’érythème ou de douleur et oedème au point d’injection. Une fièvre ou une éruption cutanée peuvent apparaître 7 à 2 jours après la vaccination mais ne sont pas systématiques. Les réactions graves telles que hypersensibilité
Chapitre I Maladie La Rougeole
immédiate (anaphylaxie, urticaire) sont très rares (Borderon & Goudeau, ). Les cas de convulsions fébriles et de thrombocytopénie sont rares (Mantadakis et al., ).
Aucune association avec l’autisme (Uno et al., ) ni avec les maladies démyélinisantes et les maladies inflammatoires intestinales (Demicheli et al., ) n’a été démontrée. Les contre-indications sont : l’hypersensibilité à la néomycine ou à l’un des excipients, les déficits immunitaires humoraux ou cellulaires (hypo- ou dysgammaglobulinémie, SIDA, transplantation d’organes). Cette vaccination est contre-indiquée en cas de grossesse (mais elle ne doit pas en constituer un motif d’interruption) et toute grossesse doit être évitée dans le mois qui suit l’administration du vaccin (MASS, ).
Des précautions sont à prendre chez les sujets ayant présenté une réaction sévère anaphylactoïde suite à l’ingestion d’oeuf. L’injection doit être différée en cas maladie aiguë sévère (Demicheli et al., ) ou d’administration d’immunoglobulines intraveineuses dans les neuf mois qui ont précédé. Le vaccin trivalent peut être administré simultanément avec les vaccins diphtérie-tétanoscoqueluche acellulaire-poliomyélitique inactivé, Haemophilus influenzae type b, hépatites A et B, méningococcique groupe C, varicelle et pneumococcique 10-valent.
I. . . Programmes d’éradication de la rougeole
Pour éliminer la rougeole il faudrait, d’une part, augmenter et maintenir la couverture vaccinale mondiale à un niveau élevé et, d’autre part, vacciner les personnes réceptives à la maladie (générations non vaccinées et n’ayant pas contracté la rougeole) qui sont susceptibles de la propager. En 974, l’OMS en partenariat avec le Fonds des Nations Unies pour l’enfance (UNICEF) lançait son programme élargi de vaccination qui avait pour but la vaccination universelle des enfants à l’aide de six vaccins essentiels, dont le vaccin antirougeoleux. Depuis, plusieurs plans stratégiques pour la lutte et l’élimination de la rougeole se sont succédé. En 1989- 990, l’Assemblée Mondiale de la Santé prenait pour résolution de réduire respectivement de 90% et 95%, par rapport aux niveaux avant la vaccination, l’incidence et la mortalité de la rougeole à l’horizon 995 (OMS, ). Par la suite, des dates cibles pour l’élimination de la rougeole ont été fixées à l’année 2000 pour la région Amériques de l’OMS, 2007 pour la région Europe et 20 0 pour la Méditerranée orientale. Dans les régions Afrique, Pacifique occidental et Asie du Sud-est, l’objectif était de réduire la mortalité par rougeole. En 2000, on estimait à 9,9 millions de cas l’incidence
2
mondiale de la rougeole et on dénombrait encore 777 000 décès imputables à cette maladie (Stein et al., ) (dont 84% concernaient les régions Afrique et Asie du Sud-est).
La couverture vaccinale mondiale pour 1 dose de vaccin antirougeoleux a augmenté entre 990 et 997 (environ 80%) puis elle a diminué jusqu’à un taux de 74% en 999. Plusieurs pays des régions Afrique et Méditerranée orientale déclaraient un taux de couverture vaccinale inférieur à 50% (OMS, ).
Les principales causes de la persistance d’une importante morbi-mortalité liée à la rougeole étaient l’impossibilité de vacciner tous les nourrissons dans le monde et l’absence d’injection de rattrapage pour les enfants qui n’auraient pas pu être vaccinés auparavant ou qui n’auraient pas répondu à une première injection. Le plan de lutte mondiale contre la rougeole a alors été actualisé en 2001 (OMS, ). Ses objectifs étaient de « diviser par deux le nombre de décès par rougeole » à l’horizon 2005 et d’ « interrompre la transmission autochtone de la rougeole » dans les régions ayant pour objectif son élimination. Les pays devaient obtenir une couverture vaccinale élevée (au moins 90%) par le biais de la vaccination systématique des nourrissons et permettre une seconde possibilité de vaccination à tous les enfants en intégrant dans leur calendrier vaccinal une deuxième dose de vaccin. Le plan prévoyait aussi de renforcer la surveillance et le diagnostic biologique de la rougeole.
De 1999 à 2004, environ 500 millions d’enfants ont été vaccinés contre la rougeole dans le monde entier. Le nombre de décès dus à la maladie a considérablement diminué. La baisse la plus importante a été enregistrée dans la région Afrique (diminution de 75%). Mais en 2003, ce nombre était encore estimé à 500 000, dont la moitié était survenue en Afrique et 90% concernaient des enfants de moins de 5 ans (OMS, ).
En 2005, lors de la consultation mondiale, le plan stratégique 2006-2010 a alors été proposé, ciblant les 47 pays (africains pour la grande majorité) où étaient enregistrés 98% des décès dus à la rougeole dans le monde (OMS, ).
La stratégie était la même (vaccination de tous les nourrissons à partir de l’âge de 9 mois et rattrapage avec une deuxième dose) et l’objectif était de réduire de 90% le nombre de décès par rougeole dans le monde en 2010, par rapport à 2000 (WHO/UNICEF, ).
En 2008, cette couverture vaccinale était encore inférieure à 80% dans les régions Afrique, Asie du Sud-est et Méditerranée orientale (CDC, ).
Sur les centaines de milliers de nourrissons et enfants non vaccinés, environ 58% résidaient en Inde, au Nigéria, en Chine, en République démocratique du Congo, au Pakistan ou en Éthiopie. Toutes les régions OMS avaient atteint l’objectif de réduction de 90% de la mortalité par rougeole sauf la région Asie du Sud-est (diminution de 46% seulement entre
Chapitre I Maladie La Rougeole
2
2000 et 2008) (OMS, ). En 2011, le nombre de nourrissons ne recevant pas le vaccin antirougeoleux était estimé à 20 millions, pour la plupart en Afrique sub-saharienne et en Asie du Sud-est.
Devant ces échecs de vaccination et la résurgence de la rougeole sous forme d’épidémies en Afrique, en Asie, et en Europe, un nouveau plan stratégique a été élaboré pour la période 2012-2020 (OMS, ).
Il repose essentiellement sur l’amélioration de la couverture vaccinale afin de réduire d’au moins 95% la mortalité mondiale par rougeole d’ici à 20 5 et parvenir à éliminer cette maladie à l’horizon 2020 dans au moins cinq régions OMS. Sa stratégie consiste en une couverture vaccinale élevée avec l’administration de deux doses de vaccin, une surveillance en laboratoire pour le suivi de la propagation de la maladie, une prise en charge des cas de rougeole et une action en cas de flambée et un développement de la recherche.
La couverture vaccinale mondiale des enfants de 2 ans par une dose de vaccin antirougeoleux était de 84% en 2013 (OMS/UNICEF, ).
Une deuxième dose de vaccination a été offerte dans 148 pays cette même année et la couverture vaccinale était de 53% pour deux doses. Cette même année, le taux de couverture vaccinale par une et deux doses de vaccin à valence rougeole était, respectivement, de 74% et 7% dans la région Afrique et de 78% et 53% en Asie du Sud-Est (WHO, ).
En 2014, la région des Amériques avait éliminé la rougeole et maintenait ce statut depuis 2002 mais devait encore faire face à de nombreux cas importés tandis que la région du Pacifique occidental approchait de ce but.
Les régions Afrique, Méditerranée orientale et Europe n’étaient pas susceptibles d’éliminer la maladie dans les délais fixés (OMS, ).
Dans la région Europe, on dénombrait encore plus de 26 000 cas en 2013 et près de 13 000 cas ont été rapportés dans 37 pays (sur 53 au total) durant le premier semestre 2014, malgré une bonne couverture vaccinale globale. Ces chiffres cachent de grandes disparités et les taux de couverture vaccinale varient considérablement d’un pays à un autre mais aussi à l’intérieur d’un même pays. De janvier à juin 20 4, 86% des cas rapportés concernaient six pays (WHO, ) : la Géorgie (2 %), la Russie (2 %), l’Ukraine ( 6%), la Bosnie Herzégovine ( 4%), l’Italie ( %) et la Turquie (4%). Les taux de couverture vaccinale pour une dose de vaccin à valence rougeole en 2013 étaient estimés à 98% pour la Russie et la Turquie, 96% pour la Géorgie, 94% pour la Bosnie Herzégovine, 90% pour l’Italie et 79% pour l’Ukraine (WHO/UNICEF, ).
22
I. .Traitement de la rougeole
Le traitement est essentiellement symptomatique : désinfection rhinopharyngée, antipyrétiques, antalgiques. Une antibiothérapie est nécessaire en cas de surinfection bactérienne. L’éviction scolaire est prolongée jusqu’à guérison clinique. Dans les pays en développement, l’OMS recommande une supplémentation en vitamine A chez tout enfant pour lequel le diagnostic est posé. Ces doses de complément vitaminique (200 000 UI/j pendant 2 jours) semblent efficaces dans la réduction de la mortalité due à la rougeole chez les enfants de moins de 2 ans et ont peu d’effets indésirables associés (Huiming et al., ). Il n’existe pas de traitement antiviral spécifique. La ribavirine (analogue nucléosidique antiviral de synthèse) est active in vitro sur le virus de la rougeole. Elle a déjà été utilisée dans des formes graves mais il n’existe pas d’étude qui permette de conclure (Borderon & Goudeau ,2007).
Les immunoglobulines intraveineuses sont recommandées, en cas de contage, chez le sujet immunodéprimé quelque soit son statut vaccinal et ses antécédents de rougeole, chez la femme enceinte non vaccinée et sans antécédent de rougeole, chez les enfants âgés de 6 à 1 mois non vaccinés dans les 72h suivant l’exposition, chez le nouveau-né d’une mère ayant contracté la rougeole en péri-partum ou d’une mère non vaccinée et n’ayant pas d’antécédent de rougeole (Afssaps-HAS, ).
Il faudra respecter un délai d’au moins neuf mois entre l’administration d’immunoglobulines et la réalisation de la vaccination ROR (HCSP, ).
Pour les personnes n’entrant pas dans ces catégories, sans antécédent certain de rougeole ou n’ayant pas reçu 2 doses de vaccin par le passé et exposées à un cas de rougeole (clinique ou confirmé biologiquement pour les contacts proches, confirmé biologiquement pour les autres collectivités), une prévention vaccinale est recommandée pour éviter la survenue de la maladie. Cette vaccination est recommandée dans les 72h suivant le contage mais reste préconisée même au-delà de ce délai (MASS, ).
Selon les recommandations vaccinales 2014 :
- Les enfants âgés de 6 à 11 mois devraient recevoir, dans les 72h suivant le contact présumé, une dose de vaccin monovalent antirougeoleux (puis 2 doses de vaccin trivalent à 12 et 16-18 mois).
- Pour les personnes âgées de plus d’ an et nées après 1980, leur calendrier vaccinal devrait être mis à jour afin qu’elles aient reçu 2 doses de vaccin trivalent au total.
Chapitre I Maladie La Rougeole
2
- Quel que soit leur année de naissance, les personnels travaillant avec la petite enfance et les professionnels de santé, n’ayant pas reçu 2 doses de vaccin trivalent et sans antécédent de rougeole, devraient recevoir 1 dose de vaccin trivalent.
Ces recommandations sont aussi valables en situation de cas groupés. Dans ce contexte, la vaccination des sujets contacts est préconisée même avant confirmation biologique et toutes les personnes, quelque soit leur année de naissance, devraient compléter leur vaccination pour recevoir 2 doses au total (MASS, ).
PARTIE
CHAPITRE I
2
Notre objectif de la partie pratique de l'application statistique : -Valeurs de période évaluées pour toutes les périodes étudiées
-Étude approfondie du nombre les cas de maladie au début de l'épidémie d étude la statistique maladie la rougeole selon les plans sexes et âge de cette région.
- D’évaluer l’état de leurs connaissances sur la prévention vaccinale anti rougeoleuse, a double dose
- De reconnaître leurs sources principales d’information au sujet de la santé de leurs Enfants.
- D’identifier les éléments intervenant dans leur choix dans la vaccination de leurs Enfants.
-Donnez une durée de transfert complète de la campagne de vaccination. I.1. Zone étudiée
El Oued ,également appelée Souf ou Oued Souf, est une ville située dans le nord-est du Sahara algérien et au sud du Chott Melrhir, à 79 km à l'est-nord-est de Touggourt, à 212 km au nord-est de Ouargla et à 512 km au sud-est d'Alger. Elle constitue une commune appartenant à la wilaya d'El Oued.
Figure . Patiens de la rigion d’El-oued (PDAU,
I. . Zone étudiée
Toutes les données épidémiologiques concernant la Rougeole (le nombre de cas suspects, le nombre de cas confirmés biologiquement, ainsi que leur répartition selon les tranches d’âges, selon leur statut vaccinal.
Chapitre I Matériels et méthodes
Sont collectées à partir des fichiers Excel extraits des bases de données de la Direction de la sante et population da région d'El-oued (DSP) durant octobre in 2014 a juin 20 9.
- Questionnaire (Annexe ) été distribué à l'habitant tachant à la rougeole d’El-oued.
I. . Méthodologie
Il s’agit d’une étude épidémiologique transversale et descriptive exhaustive sur tous les cas de rougeole confirmes par lien épidémiologique déclarés à la Division de la Surveillance épidémiologique (DES) du Ministère de la Santé Publique durant la période de octobre 2018 à juin 20 9 et sur l’efficacité de la riposte mise en œuvre.
Il a été procédé à une revue documentaire complète prenant en compte tous les cas confirmés de rougeole, résidant dans la région d’El-oued et notifiés à la Division de la Surveillance épidémiologique et les données sur la riposte apportée face à cette épidémie. Les informations collectées ont été saisies sur Epi Info dans un a effort.
Les critères de définition des cas selon l’OMS ont été utilisés pour définir le cas de rougeole. Sont considérées comme « cas suspects de rougeole », toutes les personnes présentant une éruption généralisée maculo-populaire et fièvre, plus un des signes suivants : toux, coryza (nez qui coule), conjonctivite (yeux rouges) ou toutes personnes pour lesquelles un clinicien suspecte la rougeole.
Les « cas confirmés de rougeole » concernent les cas confirmés par le laboratoire : c’est-à-dire les cas qui ont été investigués, incluant la collecte de spécimen de sang adéquat et ayant eu une confirmation sérologique d’une infection récente par le virus de rougeole (IgM rougeole positif) et n’ayant pas reçu de vaccin contre la rougeole dans les 0 jours précédant la collecte du spécimen.
Par ailleurs, certains cas peuvent être « confirmés par lien épidémiologique ». Il s’agit de cas suspects de rougeole qui n’ont pas eu de spécimen de sang collecté pour la confirmation sérologique mais qui sont liés (en lieu, personne et temps) à des cas confirmés (par le laboratoire ou déjà par lien épidémiologique) , c’est-à-dire, vivant dans le même district ou dans des districts adjacents avec un cas confirmé (par le laboratoire ou par lien épidémiologique) avec une probabilité de transmission (la durée entre l’éruption des deux cas devant être inférieure à 30 jours).
Les cas suspects de rougeole qui ont été complètement investigués, y compris la collecte de spécimen de sang adéquat, sans évidence sérologique d’infection récente par le virus de la rougeole, sont considérés comme cas de rougeole écartés.
Les cas suspects de rougeole qui n’ont pas eu de spécimen de sang collecté pour la confirmation sérologique et qui ne sont pas liés épidémiologique ment à aucun cas confirmé sont considérés comme « cas de rougeole compatibles ». Des cas suspects de rougeole qui n’ont aucune preuve définie de l’infection récente (test d’IgM de rougeole indéterminé plusieurs reprises) peuvent également être classés comme compatibles. Masque conçu .
I. . Analyse des données
Les bases de données de la surveillance de la rougeole pour période octobre 2014 a juin 2019 ont été exploitées et analysées avec le logiciel Epi info.
Il a été procédé ensuite à une étude descriptive des résultats avec le calcul des fréquences pour les variables qualitatives avec leur intervalle de confiance (IC) à 95 %, le calcul des moyennes pour les variables quantitatives.
CHAPITRE
II.1.Résultats
II. . .Etude descriptive
Au total, l’étude a porté sur 78 cas de rougeole confirmés, rapportés et saisis, soit un taux d’attaque de 2 74 pour 900 000 habitants.
II.1. .Etude statistique pendant la période d’octobre 2017 à juin II.1.2.1. Répartition des cas selon le sexe et l’âge
L’âge médian était à 9 ans, le mode à 4 ans. L’âge minimal était de 4 mois et le maximum était de 65 ans. Les enfants âgés de moins de 5 ans représentaient 80 % des rougeoleux.
Tableau : Prévalence da la rougeole chez les populations dans la période d'octobre 2017 au juin 2018
Age (année) - 2-4 - 4- 4- 2 -44 44-
Homme 2 2 4 2
Femme 2 2 2
Figure . Prévalence da la rougeole chez les populations dans la période d'octobre 2017 au juin 2018
II. . . Répartition des cas selon le statut vaccinal
Plus de la majorité des rougeoleux (≈ 0%) n’ont jamais été vaccinés contre la rougeole. une dose de Vaccin Anti Rougeole (VAR). Personne parmi les rougeoleux n’a reçu 2 doses ou plus de a 5 ans VAR. Pour une personne (37.20 %), aucune information n’a pu être retrouvée. Ancien calendrier 9 mois
0 500 1000 1500 homme femme
Chapitre II résultats et discussion
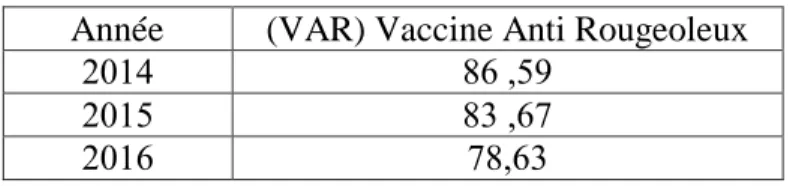
Tableau : Taux de couverture vaccinale (20 4-20 5-20 6) Année (VAR) Vaccine Anti Rougeoleux
20 4 86 ,59
20 5 8 ,67
20 6 78,6
II. . . Stratégies utilisées
Les stratégies avancées et mobiles ont été les plus utilisées :
– vaccination en stratégie avancée : au niveau des quartiers. Le rabattage des enfants aux lieux de vaccination se faisait par les relais à travers les visites à domicile. Tous les jours, l’équipe de vaccination en stratégie avancée changeait de site afin de toucher le plus grand nombre d’enfants ;
– vaccination en stratégie mobile : avec la location de véhicules. Chaque équipe mobile était composée de 3 vaccinateurs.
III. . . . Supervision
La supervision des unités de vaccination sur le terrain a été assurée par la région et les équipes cadres de district. Elle a permis de veiller au respect des directives notamment sur la qualité de la mobilisation sociale, la bonne misée œuvre des stratégies, la qualité des services.
III. . . . Sources de financement
Le financement de cette riposte a été possible grâce à l’appui financier du Ministère de la Santé et de la Prévention et de ses partenaires au développement (OMS et UNICEF). Les comités de Santé ont également contribué au financement de cette activité notamment les ripostes sectorielles.
Au total, la campagne de riposte a permis de vacciner au VAR 54 793 enfants âgés de 9 à 59 mois répartis sur les différentes zones à risque et de basse couverture soit un taux de couverture de 55,9 %.
II. . . Etude statistique pendant la période d’octobre à juin II. . . . Répartition des cas selon le sexe et l’âge
Tableau : Prévalence da la rougeole chez les populations dans la période d'octobre 2018 à juin 2019. Age (année) 0- 2-4 9-5 4- 0 9 20-44 44-65 homme 0 0 0 0 0 0 0 Femme 0 0 0 0 0
Figure . Prévalence da la rougeole chez les populations dans la période d'octobre 2018 à juin 2019
II. .3.2 Répartition des cas selon le statut vaccinal
Tableau : Taux de couverture vaccinale (20 6-20 7-20 8)(Nouveau calendrier Rougeole Oreillon Rubéole)
Année ROR 11 mois ROR 18 mois
20 6 0 0
20 7 5,5 ,26
20 8 68,05 7 , 6
II. .4.Etude statistique pendant la période d’octobre à juin II.1. . . Répartition des cas selon le sexe et l’âge
Tableau : Prévalence da la rougeole chez les populations dans la période d'octobre 2014 à juin
20 6. Age (année) 0- 2-4 9-5 4- 0 4- 9 20-44 44-65 65 homme 0 0 0 0 0 Femme 0 0 0 0 0 0 0 0 0 0.2 0.4 0.6 0.8 1 homme femme
Chapitre II résultats et discussion
Figure . Prévalence da la rougeole chez les les populations dans la période d'octobre 2014 à juin
20 6.
II. . . . Répartition des cas selon le statut vaccinal
Tableau : Taux de couverture vaccinale (20 4-20 5-20 6) Année (VAR) Vaccin Anti Rougeoleux
20 4 86 ,59
20 5 8 ,67
20 6 78,6
II-2. Discussion
II. . . Limites de l’étude
Les données sur la riposte ne sont pas disponibles en ce qui concerne le district sanitaire de Rufisque au sein duquel une rétention des informations sanitaires était observée pour raison de grève, durant la période d’étude. Par conséquent, la couverture de 55,9 % ne représente pas toute la région d’El-oued.
En revanche, la fiabilité des données n’a pas posé de problème étant donné que la DSE faisait des visites régulières sur le terrain pour les vérifier.
De plus, c’est à l’Institut Pasteur de Constantine Laboratoire régional de Référence, qu’étaient envoyés tous les prélèvements pour confirmation
II.2. Sex et la classe d’âge des enfants touchés
Le sex ratio observé dans notre étude est de 1,09 proche de celui observé lors de l’épidémie de rougeole en 2018 à El-oued (Ortenzio et al., ).
L’analyse de la proportion des cas de rougeole par groupe d’âge a mis en évidence le fait que plus de la moitié des cas étaient âgés de moins de 5 ans.
0 0.2 0.4 0.6 0.8 1 homme femme