O
pen
A
rchive
T
OULOUSE
A
rchive
O
uverte (
OATAO
)
OATAO is an open access repository that collects the work of Toulouse researchers and makes it freely available over the web where possible.This is an author-deposited version published in : http://oatao.univ-toulouse.fr/ Eprints ID : 6254
To cite this version :
Farbos, Marion. Toxicocinétique comparée du bisphénol A chez
cinq espèces et extrapolation de l'animal à l'homme. Thèse
d'exercice, Médecine vétérinaire, Ecole Nationale Vétérinaire de Toulouse - ENVT, 2012, 101 p.
Any correspondance concerning this service should be sent to the repository administrator: staff-oatao@inp-toulouse.fr.
ANNEE 2012 THESE : 2012 – TOU 3 – 4025
TOXICOCINÉTIQUE COMPARÉE DU BISPHÉNOL
A CHEZ CINQ ESPÈCES ET EXTRAPOLATION DE
L’ANIMAL A L’HOMME
_________________
THESE
pour obtenir le grade de DOCTEUR VETERINAIRE
DIPLOME D’ETAT
présentée et soutenue publiquement devant l’Université Paul-Sabatier de Toulouse
par
FARBOS Marion
Née, le 16 Septembre1987 à CONDOM (32)
___________
Directeur de thèse : Mme Nicole HAGEN-PICARD ___________
JURY
PRESIDENT :
M. Jean PARINAUD
ASSESSEURS :
Mme Nicole HAGEN-PICARD Mme Véronique GAYRARD
MEMBRE INVITE :
Mme Catherine VIGUIE
Professeur à l’Université Paul-Sabatier de TOULOUSE Professeur à l’Ecole Nationale Vétérinaire de TOULOUSE Professeur à l’Ecole Nationale Vétérinaire de TOULOUSE Professeur à l’Ecole Nationale Vétérinaire de TOULOUSE
Minis tère de l' Agriculture et de la Pê che ECOLE N ATION AL E VETERIN AIRE DE TOULOUSE
Directeur : M. A. MILON
Directeurs honoraires M. G. VAN HAVERBEKE. M. P. DESNOYERS
Professeurs honoraires :
M. L. FALIU M. J. CHANTAL M. BODIN ROZAT DE MENDRES
NEGRE
M. C. LABIE M. JF. GUELFI M. DORCHIES M. C. PAVAUX M. EECKHOUTTE
M. F. LESCURE M. D.GRIESS M. A. RICO M. CABANIE M. A. CAZIEUX M. DARRE Mme V. BURGAT M. HENROTEAUX
PROFESSEURS CLASSE EXCEPTIONNELLE
M. AUTEFAGE André, Pathologie chirurgicale
M. BRAUN Jean-Pierre, Physique et Chimie biologiques et médicales
M. CORPET Denis, Science de l'Aliment et Technologies dans les Industries agro-alimentaires
M. ENJALBERT Francis, Alimentation
M. EUZEBY Jean, Pathologie générale, Microbiologie, Immunologie
M. FRANC Michel, Parasitologie et Maladies parasitaires
M. MARTINEAU Guy, Pathologie médicale du Bétail et des Animaux de Basse-cour
M. PETIT Claude, Pharmacie et Toxicologie
M. REGNIER Alain, Physiopathologie oculaire
M. SAUTET Jean, Anatomie
M. TOUTAIN Pierre-Louis, Physiologie et Thérapeutique
PROFESSEURS 1° CLASSE
M. BERTHELOT Xavier, Pathologie de la Reproduction
Mme CLAUW Martine, Pharmacie-Toxicologie
M. CONCORDET Didier, Mathématiques, Statistiques, Modélisation
M DELVERDIER Maxence, Anatomie Pathologique
M. SCHELCHER François, Pathologie médicale du Bétail et des Animaux de Basse-cour
PROFESSEURS 2° CLASSE
Mme BENARD Geneviève, Hygiène et Industrie des Denrées alimentaires d'Origine animale M. BOUSQUET-MELOU Alain, Physiologie et Thérapeutique
Mme CHASTANT-MAILLARD Sylvie, Pathologie de la Reproduction M. DUCOS Alain, Zootechnie
M. FOUCRAS Gilles, Pathologie des ruminants
Mme GAYRARD-TROY Véronique, Physiologie de la Reproduction, Endocrinologie M. GUERRE Philippe, Pharmacie et Toxicologie
Mme HAGEN-PICARD Nicole, Pathologie de la Reproduction M. JACQUIET Philippe, Parasitologie et Maladies Parasitaires
M. LEFEBVRE Hervé, Physiologie et Thérapeutique
M. LIGNEREUX Yves, Anatomie
M. PICAVET Dominique, Pathologie infectieuse
M. SANS Pierre, Productions animales
Mme TRUMEL Catherine, Pathologie médicale des Equidés et Carnivores
N. PROFESSEURS CERTIFIES DE
L'ENSEIGNEMENT AGRICOLE
Mme MICHAUD Françoise, Professeur d'Anglais M SEVERAC Benoît, Professeur d'Anglais
O. MAITRES DE CONFERENCES HORS
CLASSE
M. BAILLY Jean-Denis, Hygiène et Industrie des Denrées alimentaires d'Origine animale
M. BERGONIER Dominique, Pathologie de la Reproduction
Mle BOULLIER Séverine, Immunologie générale et médicale
Mme BOURGES-ABELLA Nathalie, Histologie, Anatomie pathologique
M. BRUGERE Hubert, Hygiène et Industrie des Denrées alimentaires d'Origine animale
Mle DIQUELOU Armelle, Pathologie médicale des Equidés et des Carnivores
M. JOUGLAR Jean-Yves, Pathologie médicale du Bétail et des Animaux de Basse-cour
M MEYER Gilles, Pathologie des ruminants.
Mme LETRON-RAYMOND Isabelle, Anatomie pathologique
MAITRES DE CONFERENCES (classe normale)
M. ASIMUS Erik, Pathologie chirurgicale
Mme BENNIS-BRET Lydie, Physique et Chimie biologiques et médicales M. BERTAGNOLI Stéphane, Pathologie infectieuse
Mle BIBBAL Delphine, Hygiène et Industrie des Denrées alimentaires d'Origine animale
Mme BOUCLAINVILLE-CAMUS Christelle, Biologie cellulaire et moléculaire Mle CADIERGUES Marie-Christine, Dermatologie
M. CONCHOU Fabrice, Imagerie médicale
M. CORBIERE Fabien, Pathologie des ruminants
M. CUEVAS RAMOS Gabriel, Chirurgie Equine
M. DOSSIN Olivier, Pathologie médicale des Equidés et des Carnivores
Mlle FERRAN Aude, Physiologie
M. GUERIN Jean-Luc, Elevage et Santé avicoles et cunicoles
M. JAEG Jean-Philippe, Pharmacie et Toxicologie
Mle LACROUX Caroline, Anatomie Pathologique des animaux de rente
M. LIENARD Emmanuel, Parasitologie et maladies parasitaires M. LYAZRHI Faouzi, Statistiques biologiques et Mathématiques
M. MAILLARD Renaud, Pathologie des Ruminants M. MATHON Didier, Pathologie chirurgicale
Mme MEYNAUD-COLLARD Patricia, Pathologie Chirurgicale M. MOGICATO Giovanni, Anatomie, Imagerie médicale
M. NOUVEL Laurent, Pathologie de la reproduction
Mle PALIERNE Sophie, Chirurgie des animaux de compagnie
Mme PRIYMENKO Nathalie, Alimentation
Mme TROEGELER-MEYNADIER Annabelle, Alimentation
M. VOLMER Romain, Microbiologie et Infectiologie (disponibilité à cpt du 01/09/10)
P. MAITRES DE CONFERENCES et AGENTS CONTRACTUELS
M. BOURRET Vincent, Microbiologie et infectiologie
M. DASTE Thomas, Urgences-soins intensifs
ASSISTANTS D'ENSEIGNEMENT ET DE RECHERCHE CONTRACTUELS
Mlle DEVIERS Alexandra, Anatomie-Imagerie M. DOUET Jean-Yves, Ophtalmologie Mlle LAVOUE Rachel, Médecine Interne Mlle PASTOR Mélanie, Médecine Interne M. RABOISSON Didier, Productions animales
Mle TREVENNEC Karen, Epidémiologie, gestion de la santé des élevages avicoles et porcins
A Monsieur le Professeur Jean PARINAUD
Professeur des Universités Praticien hospitalier
Biologie de la reproduction
Qui m’a fait l’honneur d’accepter la présidence de mon jury de thèse. Hommage respectueux.
A Madame le Professeur Nicole HAGEN-PICARD
Professeur de l'Ecole Nationale Vétérinaire de Toulouse
Pathologie de la reproduction
Qui m’a fait l’honneur de diriger et d’encadrer ma thèse.
Sincères remerciements pour le temps et les conseils si précieux que vous m’avez accordés tout au long de l’élaboration de cette thèse.
A Madame le Professeur Véronique GAYRARD
Professeur de l'Ecole Nationale Vétérinaire de Toulouse
Physiologie et thérapeutique
Qui m’a fait l’honneur de m’aider dans ce projet et de participer à mon jury de thèse. Sincères remerciements.
A Madame le Docteur Catherine VIGUIE
Docteur Vétérinaire
Chargée de recherches UMR 181 INRA ENVT
Qui m’a fait l’honneur de participer à mon jury de thèse en tant que membre invité. Sincères remerciements.
A Séverine,
Un grand merci pour ta gentillesse, ta patience, ton aide et tes explications qui m’ont été précieuses pour la rédaction de cette thèse.
A tout le service de physiologie de l’ENVT,
Un grand merci de m’avoir si gentiment accueillie dans votre équipe et de m’avoir permise de participer à un si beau projet de recherche.
A mes parents, ma famille et mes amis, pour leur soutien durant toutes ces années d’étude.
11
Table des matières
1. Introduction ... 17
2. Etude bibliographique ... 18
2.1 Le Bisphénol A, un perturbateur endocrinien très répandu ...18
2.1.1 Présentation de la molécule ...18
2.1.2 Marché du polycarbonate et des résines époxy ...19
2.1.3 Effets du BPA ...21
2.2 La DJA/NOAEL est-elle pertinente ? ...22
2.2.1 DJA/NOAEL du BPA ...22
2.2.2 Exposition externe de l’Homme au BPA ...23
2.2.3 La remise en cause de la DJA/NOAEL par les études scientifiques ...26
2.2.4 Réactions des agences réglementaires et des politiques face à ces études ...27
2.3 La pharmacocinétique du BPA, un outil essentiel pour évaluer l’impact réel de l’exposition au BPA sur la santé humaine ...31
2.3.1 Exposition externe vs exposition interne ...31
2.3.2 L’exposition interne du BPA chez l’Homme : encore beaucoup d’inconnues ...31
2.3.3 Les connaissances actuelles sur la toxicocinétique du BPA chez l’Homme et les animaux ...36
2.3.4 Incohérence bibliographique ...41
2.4 Objectifs de l’étude ...44
3. Matériels et méthodes ... 45
3.1 Identification du matériel test ...45
3.2 Préparation du matériel test ...45
3.2.1 Préparation du BPA pour l’administration intraveineuse (IV) ...45
3.2.2 Préparation du BPA pour l’administration orale (PO) ...46
3.3 Animaux...46
3.3.1 Description des animaux ...46
12
3.4 Plan expérimental ...47
3.4.1 Plan en cross Over ...47
3.4.2 Plan en parallèle ...48
3.5 Modalités d’administration et de prélèvement ...49
3.5.1 Modalités d’administration ...49
3.5.2 Prélèvements sanguins ...50
3.5.3 Prélèvements urinaires ...51
3.6 Traitements et dosage des prélèvements ...54
3.6.1 Traitement des prélèvements ...54
3.6.2 Dosage du BPA et du BPA-G ...54
3.6.3 Les limites de quantification (LOQ) ...56
3.7 Analyse des données...57
3.7.1 Analyse non compartimentale des données plasmatiques ...57
3.7.2 Ajustement des données plasmatiques et urinaires par une approche modélisatrice chez la brebis, le porc et le chien ...57
3.7.3 Chez les rongeurs ...62
3.7.4 Approche allométrique ...63
4. Résultats ... 64
4.1 Description par espèce de l’évolution des concentrations plasmatiques en BPA et BPA-G au cours du temps ...64
4.1.1 Administration IV de 5 mg/kg de BPA ...64
4.1.2 Administration orale de 100 mg/kg de BPA ...67
4.2 Comparaison interspécifique des concentrations plasmatiques en BPA et BPA-G ....71
4.3 Analyse non compartimentale des données plasmatiques : paramètres pharmacocinétiques ...72
4.4 Analyse compartimentale des données plasmatiques et urinaires chez les brebis, les porcs et les chiens ...73
4.4.1 Ajustement des données plasmatiques et urinaires par le modèle ...73
13 4.5 Comparaison interspécifique des mécanismes d’absorption, de métabolisation et
d’élimination du BPA et du BPA-G...78
4.5.1 Absorption, biodisponibilité systémique et effet de premier passage hépatique ...79
4.5.2 Métabolisation du BPA et élimination du BPA-G et du BPA ...80
4.6 Relation allométrique entre la clairance plasmatique du BPA et le poids vif ...81
5. Discussion ... 82
5.1 Comparaison interspécifique de l’exposition interne au BPA et BPA-G ...82
5.1.1 Après une administration orale ...82
5.1.2 Après une administration IV ...83
5.2 Métabolisation du BPA ...84
5.3 Comparaison interspécifique de l’absorption, de la distribution et des voies d’élimination du BPA ...84
5.3.1 Absorption, distribution et élimination du BPA ...84
5.3.2 Elimination du BPA-G ...86
5.4 Intérêts de l’étude pour l’extrapolation à l’homme ...87
5.4.1 Détermination de la Clairance plasmatique du BPA chez l’Homme ...87
5.4.2 Quel risque pour la santé humaine ? ...89
6. Conclusion ... 93
14
Table des illustrations
Figures
Figure 1 : Formule semi-développée du BPA ... 18
Figure 2 : Les différentes applications du BPA ... 19
Figure 3 : Répartition des domaines d’utilisation du polycarbonate ... 20
Figure 4 : Répartition des domaines d'utilisation des résines époxy ... 20
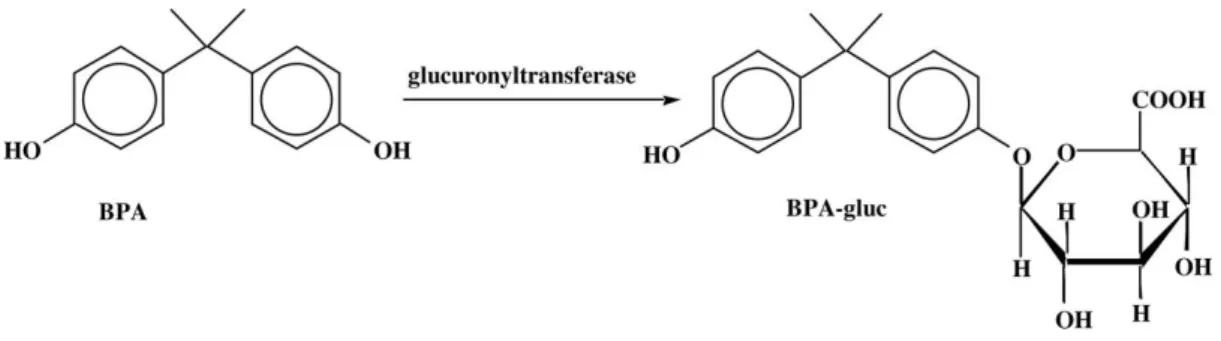
Figure 5 : Métabolisation du BPA en BPA-Glucuronide par l’UDP-glucuronyltransferase ... 28
Figure 6 : Loi n°2010-729 votée le 30 Juin 2010 ... 29
Figure 7 : Projet de loi voté le 12 Octobre 2011 ... 31
Figure 8 : Métabolisation du BPA en BPA-Sulfate chez le fœtus. ... 36
Figure 9 : Plan expérimental en "Cross Over" (brebis, porcs, chiens) ... 48
Figure 10: Plan expérimental en parallèle pour les souris ... 49
Figure 11 : Schématisation du tripode de quadripôles ... 56
Figure 12 : Modèle semi-physiologique ... 58
Figure 13 : Evolution des concentrations plasmatiques de BPA et BPA-G au cours du temps suite à l’administration IV de 5 mg/kg de BPA à cinq espèces animales (brebis, porc, chien, rat, souris). ... 66
Figure 14 : Evolution des concentrations plasmatiques de BPA et BPA-G au cours du temps suite à l’administration orale de 100mg/kg de BPA à cinq espèces animales (brebis, porc, chien, rat, souris). ... 70
Figure 15 : Comparaison interspécifique de l’évolution temporelle des concentrations plasmatiques moyennes en BPA et BPA-G suite à l’administration orale (100mg/kg) et IV (5mg/kg) de BPA. ... 71
Figure 16 : Evolution au cours du temps des concentrations plasmatiques et des quantités cumulées urinaires de BPA et BPA-G après administration IV de BPA (5 mg/kg). ... 75
Figure 17 : Evolution au cours du temps des concentrations plasmatiques et des quantités cumulées urinaires de BPA et BPA-G après administration orale de BPA (100 mg/kg). ... 77
15 Figure 18 : Relation allométrique entre la clairance plasmatique du BPA (L/min) et le poids vif (kg). ... 81 Figure 19 : Relation allométrique entre la clairance plasmatique du BPA (L/min) et le poids vif de l’espèce considérée (kg). ... 88
Tableaux
Tableau 1 : Propriétés physiques et chimiques du BPA ... 18 Tableau 2 : NOAEL et DJA du BPA déterminées par les agences réglementaires européennes ... 22 Tableau 3 : Niveau d’exposition alimentaire au BPA en fonction de l’âge et des habitudes alimentaires ... 24 Tableau 4: Niveaux d'exposition externe au BPA calculés à partir des concentrations urinaires observationnelles en BPA et ses métabolites. ... 25 Tableau 5 : Concentrations sériques ou plasmatiques de BPA observées chez des individus soumis à des conditions naturelles d’exposition au BPA. Ces données proviennent d’études de biosurveillance. ... 32 Tableau 6 : Association des paramètres pharmacocinétiques aux processus physiologiques impliqués. ... 37 Tableau 7 : Paramètres pharmacocinétiques du BPA évalués chez l'Homme. ... 39 Tableau 8 : Paramètres pharmacocinétiques du BPA estimés chez différentes espèces animales suite à l’administration intraveineuse d’une dose de BPA comprise entre 0.1 et 10mg/kg. ... 41 Tableau 9 : Modalités de préparation des solutions de BPA administrées en IV ... 45 Tableau 10 : Modalités de préparation des solutions de BPA administrées par voie orale... 46 Tableau 11 : Race, sexe, âge, poids moyen et nombre des animaux utilisés ... 47 Tableau 12 : Temps et volumes de prélèvement par espèce ... 50 Tableau 13 : Temps des prélèvements sanguins selon la voie d’administration chez le rat... 50 Tableau 14 : Récapitulatif des plans expérimentaux par espèce ... 52 Tableau 15 : Présentation des LOQ's par espèce et par matrice en µg/mL puis en µmol/L ... 56 Tableau 16 : Définition des constantes de transfert du modèle ... 59
16 Tableau 17 : Paramètres pharmacocinétiques du BPA (analyse non compartimentale) ... 72 Tableau 18 : Paramètres primaires ... 78 Tableau 19 : Absorption, biodisponibilité systémique et effet de premier passage hépatique du BPA ... 79 Tableau 20 : Métabolisation du BPA et élimination du BPA et du BPA-G ... 80
17
1.
Introduction
Le Bisphénol A (BPA) constitue l’une des préoccupations sanitaires importantes et fait actuellement l’objet de polémique qui inquiète les Français. Le Bisphénol A est un perturbateur endocrinien, c'est-à-dire une substance exogène capable d’altérer les équilibres hormonaux. Pourrait-il être responsable d’effets néfastes sur la santé humaine aux niveaux d’exposition auxquels nous sommes soumis ?
Afin de répondre à cette problématique, de nombreux scientifiques ont étudié cette molécule durant les dix dernières années. Notre travail s’inscrit dans ce contexte et a pour objectif de documenter la toxicocinétique du BPA chez l’Homme afin de décrire de manière qualitative et quantitative le devenir du BPA au sein de notre organisme. En effet, la toxicité d’une substance est déterminée par les concentrations au site d’action (exposition interne) et non pas par la dose (exposition externe).
La première partie de ce manuscrit fera une synthèse des connaissances bibliographiques relatives au Bisphénol A. Puis, nous présenterons les objectifs de notre travail ainsi que la méthode expérimentale que nous avons choisie pour documenter la toxicocinétique du BPA chez l’Homme. Nos résultats seront ensuite présentés et discutés.
18
2.
Etude bibliographique
2.1 Le Bisphénol A, un perturbateur endocrinien très répandu 2.1.1 Présentation de la molécule
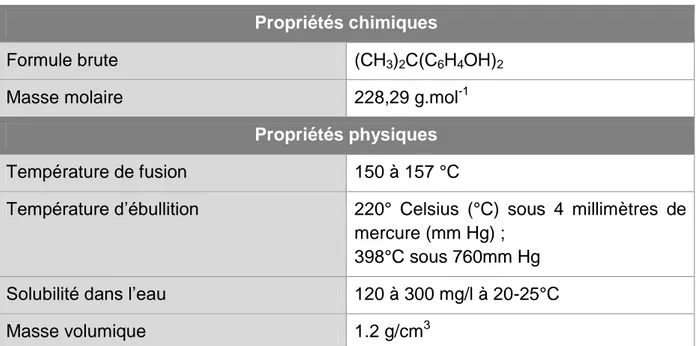
Le Bisphénol A (BPA), découvert à la fin du XIXème siècle, est composé de deux cycles aromatiques reliés par un pont carbone. Il est issu de la réaction entre deux équivalents de phénol et un équivalent d’acétone. Sa formule semi-développée ainsi que ses propriétés physiques et chimiques sont présentées dans la figure 1 et le tableau 1.
Tableau 1 :Propriétés physiques et chimiques du BPA (STAPLES CA, 2000)
Propriétés chimiques
Formule brute (CH3)2C(C6H4OH)2
Masse molaire 228,29 g.mol-1
Propriétés physiques
Température de fusion 150 à 157 °C
Température d’ébullition 220° Celsius (°C) sous 4 millimètres de mercure (mm Hg) ;
398°C sous 760mm Hg
Solubilité dans l’eau 120 à 300 mg/l à 20-25°C
Masse volumique 1.2 g/cm3
Le BPA est utilisé principalement comme monomère dans la polymérisation de deux matières plastiques : le polycarbonate et les résines époxy (figure 2).
19 Figure 2 : Les différentes applications du BPA (PLASTICS EUROPE, 2007)
Le polycarbonate et les résines époxy disposent de remarquables propriétés : transparence, solidité, résistance à la chaleur, bonne stabilité dimensionnelle, bonnes propriétés d'isolation électrique, inertie biologique et facilité de recyclage.
2.1.2 Marché du polycarbonate et des résines époxy
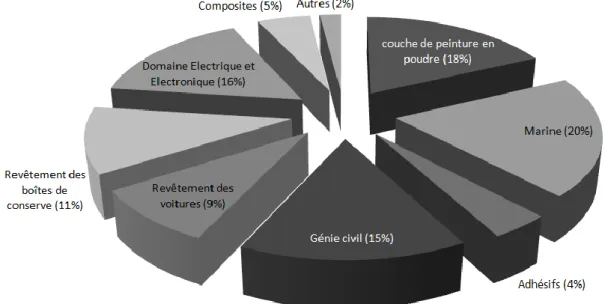
Grâce à leurs propriétés, ces deux matériaux ont été utilisés dans les emballages de l’industrie agro-alimentaire ainsi que dans les revêtements intérieurs des canettes, des boîtes de conserve et des couvercles métalliques.
Leur production et leur utilisation n’ont cessé de croître d’année en année. Entre 2003 et 2006, la consommation de BPA a augmenté chaque année d’environ 10% (ANSES, 27 Septembre 2011). Actuellement, les polycarbonates sont très largement utilisés dans des produits de consommation courants depuis les lunettes de soleil et les CD jusqu’aux récipients pour l’eau et la nourriture. L’utilisation des résines époxy est également très répandue : on en retrouve dans les résines composites d’obturation utilisées pour les soins dentaires, dans le revêtement des boîtes de conserve… (INSERM, 2 Juin 2010). Les figures 3 et 4 présentent les différents domaines qui utilisent le polycarbonate et les résines époxy.
Epoxy résine 30% Autres résines 2% Tetrabromo bisphenol A 2% Polycarbonate 66%
20
Figure 3 : Répartition des domaines d’utilisation du polycarbonate (PLASTICS EUROPE, 2007)
Figure 4 : Répartition des domaines d'utilisation des résines époxy (PLASTICS EUROPE, 2007) Par conséquent, le BPA est l’une des substances chimiques la plus fabriquée dans le monde. Selon l’industrie « Plastic Europe » la production annuelle mondiale est supérieure à 3 millions de tonnes. Au sein de l’Union Européenne, 1,15 millions de tonnes de BPA sont utilisés annuellement (INSERM, 2 Juin 2010). Aucune production de BPA n’est répertoriée en France (ANSES, 27 Septembre 2011).
21
2.1.3 Effets du BPA
Le BPA est un xéno-œstrogène, c'est-à-dire une substance exogène capable d’exercer une activité œstrogénique. Le BPA est par conséquent un perturbateur endocrinien. Il se lie aux récepteurs aux œstrogènes avec une affinité relative 7 fois supérieure pour les ERβ que pour les ERα (MATTHEWS JB, 2001). Cette liaison est
génératrice de modifications cellulaires mises en évidence dans des études in vitro. Par exemple, sur des cellules de type PR1 (une lignée de cellules hypophysaires du rat) il induit une prolifération des cellules et il stimule la sécrétion de prolactine (CHUN TY, 2000).
Certains auteurs suggèrent l’implication du BPA dans l’apparition de cancers du tractus génital (testicules, prostate, utérus, ovaires…) et de problèmes de fertilité (RICHTER CA, 2007). Une population serait particulièrement à risque : il s’agit des fœtus et des nouveaux nés. En effet, les organismes en développement sont très sensibles aux modifications induites par les perturbateurs endocriniens. Cette sensibilité accrue pourrait s’expliquer par l’inefficacité des mécanismes de réparation de l’ADN, l’immaturité des systèmes immunitaires et du métabolisme, une barrière hémato méningée plus perméable…(NEWBOLD RR, 2006). Les études sur les rongeurs suggèrent que les conséquences d’une exposition in utero au BPA ne s’expriment pas forcément à la naissance. Il peut exister un décalage entre l’exposition et l’apparition des premiers signes cliniques (RICHTER CA, 2007). De plus, sachant que les œstrogènes causent des altérations génétiques et épigénétiques au niveau de leurs tissus cibles, il est possible que l’exposition à des xéno-œstrogènes in utero soit génératrice d’anomalies transmissibles à la descendance (NEWBOLD RR, 2006).
Malgré tous ces faits, il est difficile à l’heure actuelle de déterminer le rôle exact du BPA sur la santé humaine. Les connaissances actuelles ne permettent pas de démontrer une relation de cause à effet entre l’exposition au BPA et l’apparition d’un processus pathologique. Les publications existantes ne sont pas représentatives : le nombre d’individus est limité, les critères de sélection non détaillés… De plus, il s’agit généralement d’études observationnelles. Or les hommes sont exposés à divers xéno-œstrogènes en même temps. Il est donc difficile d’attribuer au BPA un rôle spécifique dans un contexte où plusieurs molécules sont capables d’induire différents
22 effets. La présence d’autres xéno-œstrogènes pourrait également interférer avec les mécanismes d’action du BPA in vivo.
D’après les Saisines « 2009-SA-0331 » et « 2010-SA-0197 » publiées par l’ANSES1
, le BPA est « suspecté d’avoir des effets sur la maturation ovocytaire chez la femme
dans un contexte de procréation médicalement assistée ainsi que sur les pathologies cardiovasculaires (maladies coronariennes) et le diabète ». De nouvelles
études doivent donc être menées afin de mieux comprendre l’impact du BPA sur la santé humaine.
2.2 La DJA/NOAEL est-elle pertinente ? 2.2.1 DJA/NOAEL du BPA
Les agences réglementaires (ANSES et EFSA2) ont défini des doses en deçà desquelles le BPA n’aurait pas d’effet néfaste chez l’homme, à partir d’études expérimentales réalisées chez les rongeurs.
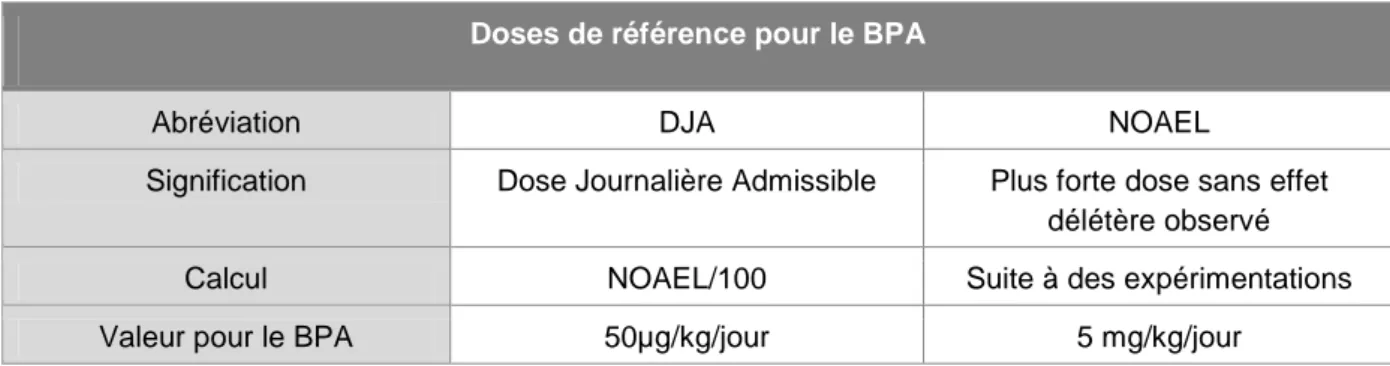
La Dose Journalière Admissible (DJA) est une estimation de la quantité par kg de poids vif qui peut être consommée quotidiennement et à vie sans risque pour la santé. Cette valeur est obtenue en divisant la plus forte dose sans effet délétère observable (NOAEL) par un facteur de sécurité (SF = Safety Factor) de 100 qui prend en compte des différences interspécifiques et interindividuelles de pharmacocinétique ou de pharmacodynamie (tableau 2).
Tableau 2 : NOAEL et DJA du BPA déterminées par les agences réglementaires européennes
Doses de référence pour le BPA
Abréviation DJA NOAEL
Signification Dose Journalière Admissible Plus forte dose sans effet délétère observé
Calcul NOAEL/100 Suite à des expérimentations
Valeur pour le BPA 50µg/kg/jour 5 mg/kg/jour
Dans le cas du BPA, la NOAEL a été estimée suite à des études menées sur deux ou trois générations de rats (TYL RW, 2002) (TYL RW, 2008). Ces derniers reçurent par voie orale différentes doses de BPA de 0, 0.001, 0.003, 0.02, 0.03, 0.3, 5, 50 et
1 ANSES : Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail 2
23 600mg/kg/j. Comme la toxicité systémique du BPA n’a été mise en évidence que pour des doses supérieures à 5mg/kg/j, une NOAEL de 5mg/kg/jour a été déterminée. La DJA actuelle pour le BPA est donc de 50µg/kg/jour.
2.2.2 Exposition externe de l’Homme au BPA
De nombreuses études de biosurveillance ont mis en évidence des niveaux détectables de BPA dans les urines et le sang. Elles suggèrent une exposition ubiquitaire au BPA (VOLKEL W, 2008) (DEKANT W, 2008).
2.2.2.1 Les voies d’exposition
La principale voie d’exposition au BPA pour l’Homme est la voie alimentaire. Deux sources ont été identifiées : les aliments/boissons en contact avec du polycarbonate ou des résines epoxy et les résines d’obturation dentaires (VANDENBERG LN, 2007). La contamination des denrées alimentaires est due à la migration dans les aliments de monomères de BPA résiduels ou libérés par hydrolyse du polymère (INSERM, 2 Juin 2010). Cette hydrolyse survient dans des conditions particulières telles que le chauffage ou la présence d’huile (VANDENBERG LN, 2007). Concernant les résines d’obturation dentaires, des études ont montré la présence de BPA dans la salive durant les quelques heures suivant la pose (VANDENBERG LN, 2007). Les quantités de BPA retrouvées varient en fonction de la composition de la résine.
Il existe d’autres modalités d’exposition par voie aérienne ou transcutanée telles que la manipulation de papiers thermosensibles ou l’inhalation de poussières contaminées. Ces voies d’exposition sont considérées à l’heure actuelle comme négligeables (EFSA, 2006).
2.2.2.2 Détermination des doses d’exposition
Deux techniques peuvent être utilisées pour calculer le niveau d’exposition de la population humaine au BPA.
La première consiste à l’estimer à partir des quantités retrouvées dans les aliments/boissons et l’environnement. Les chercheurs ont essayé d’évaluer la quantité de BPA présente dans les denrées contenues dans des récipients estimés à risques tels que les bouteilles en plastique, les Tupperware, les boîtes de conserve
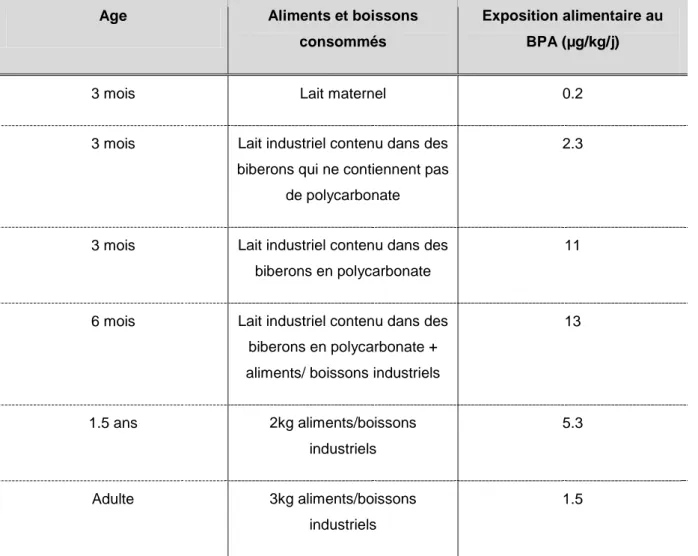
24 recouvertes intérieurement de résine époxy et les biberons en polycarbonate. La plupart des études ont mis en évidence des niveaux détectables de BPA dans les aliments de l’ordre du µg/kg d’aliment (VANDENBERG LN, 2007). D’autres auteurs ont estimé le niveau de contamination de l’environnement. Sur 12 maisons testées, Volkel et al. (VOLKEL W, 2008) trouvèrent du BPA dans 100% des échantillons de poussière prélevés à une concentration allant de 117 à 1486µg/kg. Cette contamination peut s’expliquer par un recyclage limité des matières plastiques et l’intégration du BPA au sein des particules de l’air au cours de la production de polycarbonate ou résine époxy étant donné le large volume annuel produit (VANDENBERG LN, 2007). Etant donné que la voie orale est la principale voie d’exposition au BPA, l’EFSA a estimé des niveaux d’exposition alimentaire au BPA compris entre 1 et 13µg/kg/j. Le tableau 3 les présente en fonction de l’âge et des habitudes alimentaires.
Tableau 3 : Niveau d’exposition alimentaire au BPA en fonction de l’âge et des habitudes alimentaires (EFSA, 2006)
Age Aliments et boissons
consommés
Exposition alimentaire au BPA (µg/kg/j)
3 mois Lait maternel 0.2
3 mois Lait industriel contenu dans des biberons qui ne contiennent pas
de polycarbonate
2.3
3 mois Lait industriel contenu dans des biberons en polycarbonate
11
6 mois Lait industriel contenu dans des biberons en polycarbonate + aliments/ boissons industriels
13 1.5 ans 2kg aliments/boissons industriels 5.3 Adulte 3kg aliments/boissons industriels 1.5
25 Une deuxième technique vise à déterminer le niveau d’exposition externe au BPA à partir des quantités urinaires évaluées sur un échantillon représentatif de la population humaine. Trente heures après l’ingestion orale de 5 mg de BPA marqué au deutérium chez 3 femmes et 3 hommes en bonne santé, la totalité de la dose administrée est retrouvée dans les urines (VOLKEL W, 2002). Ces données suggèrent une élimination rapide et totale du BPA par voie rénale. L’urine est donc le fluide corporel le plus pertinent pour estimer le niveau d’exposition. Elle présente l’avantage d’être facile à collecter (DEKANT W, 2008).
Le prélèvement isolé d’une miction urinaire d’un individu ne donne aucune information sur le niveau d’exposition à long terme. Les concentrations urinaires en BPA et ses métabolites varient selon la fréquence des repas, le temps écoulé depuis la dernière collation et la dernière miction, la production urinaire… Pour calculer des niveaux d’exposition représentatifs, il faut soit plusieurs prélèvements urinaires d’une seule personne sur 24 heures, soit plusieurs échantillons individuels (DEKANT W, 2008).
Le tableau 4 présente les niveaux d’exposition au BPA calculés à partir de données urinaires de plusieurs individus.
Tableau 4: Niveaux d'exposition externe au BPA calculés à partir des concentrations urinaires observationnelles en BPA et ses métabolites (VOLKEL W, 2008).
Volkel et son équipe se basent sur le fait que l’Homme adulte dont le poids moyen est 60 kg produit 1.5 litre d’urines par jour. Dans le cas des enfants, le poids moyen est 36 kg et la production d’urines 0.6 litre par jour.
Les niveaux d’exposition calculés montrent que les enfants (entre 6 et 8 ans) sont les plus exposés (VOLKEL W, 2008). Aucune étude sur le niveau d’exposition des bébés ou des très jeunes enfants âgés de moins de 6 ans n’est disponible. Or cette
26 population est peut être plus à risque que les adultes compte tenu de leur moindre poids vif et de leur comportement infantile : consommation d’aliments à risque, déplacements au ras du sol en contact avec les poussières, grignotage de nombreux objets en plastique … (VANDENBERG LN, 2007).
D’après l’EFSA, la moyenne d’exposition externe quotidienne au BPA chez l’Homme est inférieure à 13µg/kg/j. Cette valeur est inférieure à la DJA établie par l’EFSA (50µg/kg PV/j). Si la NOAEL est bien estimée, ce niveau d’exposition externe ne devrait donc pas avoir d’effet néfaste sur la santé humaine.
2.2.3 La remise en cause de la DJA/NOAEL par les études scientifiques
Plusieurs centaines d’études sur les rongeurs ont montré que l’exposition à des doses inférieures à la DJA est délétère. Les effets néfastes décrits dépendent du moment de l’exposition.
Si elle a lieu au cours du développement, des anomalies dans l’organisation de l’organisme surviennent de manière irréversible. De nombreux organes peuvent être altérés (RICHTER CA, 2007) :
La structure et le fonctionnement du cerveau,
L’appareil génital mâle avec pour conséquence après la puberté une diminution quantitative de la production de sperme,
Les activités enzymatiques aboutissant à des processus métaboliques anormaux.
Si elle a lieu à l’âge adulte, les effets sont souvent réversibles et concernent la partie fonctionnelle de l’organisme (RICHTER CA, 2007).
Pour illustrer cette partie, nous proposons de détailler une étude de Cabaton et son équipe (CABATON NJ, 2011). Des souris femelles CD-1 ont été exposées au BPA aux doses de 0, 25ng, 250ng ou 25µg/kg/j par le biais d’une pompe sous cutanée à partir du 8ème jour de gestation et jusqu’au 16ème jour de lactation. La mise à la reproduction des femelles exposées durant la période périnatale au BPA a mis en évidence une diminution du nombre cumulé de souriceaux et une réduction de la fécondité et de la fertilité lors d’exposition périnatale au BPA à des doses inférieures à la DJA.
27
2.2.4 Réactions des agences réglementaires et des politiques face à ces études
2.2.4.1 Dans le courant de l’année 2010
Dans un premier temps, les agences réglementaires n’ont pas pris en compte ces études. Elles ont avancé principalement deux arguments pour se justifier.
1er argument
Les agences réglementaires ne se basent que sur des études réalisées selon les bonnes pratiques de laboratoire. Dans le cas du BPA, elles se sont appuyées essentiellement sur deux expérimentations (TYL RW, 2008)(TYL RW, 2002) pour montrer l’absence d’effet néfaste du BPA à faibles doses. Ces recherches ont consisté en l’administration continue via l’alimentation de différentes doses de BPA à 3 générations de rats. Les niveaux d’exposition étaient les suivants : 0 ; 0.001 ; 0.003 ; 0.02 ; 0.03 ; 0.3 ; 5 ; 50 et 600mg/kg/j. Ces études ont montré une toxicité systémique du BPA pour des doses supérieures à 5mg/kg/j. Les premiers effets néfastes du BPA sur l’appareil reproducteur ne surviennent que pour des expositions supérieures à 600mg/kg/j. Cependant, compte tenu des fortes doses d’œstradiol nécessaires pour induire des effets chez le témoin positif, la souche de rat utilisée (CD 1) parait relativement insensible aux œstrogènes exogènes et donc peu appropriée pour étudier les effets induits par le BPA suite à une exposition à faible dose. De plus, les méthodes utilisées sont anciennes et peu sensibles. Elles consistent à des évaluations macroscopiques de l’évolution du poids corporel, du poids des organes et de la cyclicité ovarienne appréciée par l’examen de la composition de frottis vaginaux. Elles ne sont donc pas capables de mettre en évidence la plupart des effets néfastes et plus subtiles reportés par des études qui mettent en œuvre des méthodes sophistiquées et plus sensibles (MYERS JP, 2009).
2e argument
La toxicocinétique du BPA est différente entre l’Homme et les rongeurs.
Chez les rongeurs et les primates, suite à une administration orale, le BPA est transformé majoritairement en BPA glucuronide (BPA-G) par l’UDP-glucuronosyl transférase présente dans la paroi intestinale et le foie (figure 5).
28 Figure 5 : Métabolisation du BPA en BPA-Glucuronide par l’UDP-glucuronyltransferase Il s’agit de la principale voie de détoxification du BPA étant donné que le BPA-G ne peut pas se fixer sur les récepteurs aux œstrogènes (MATTHEWS JB, 2001). Cette transformation est très efficace chez les deux espèces (DOERGE DR, 2010a) et explique les concentrations plasmatiques peu élevées en BPA suite à une administration orale. En effet, 90% du BPA retrouvé dans le sérum est sous forme de BPA-G alors que moins d’1% est sous forme de BPA non conjugué (DOERGE DR, 2010a).
Une fois formé, le BPA-G est éliminé de manière différente chez les rongeurs et les primates. Il est préférentiellement excrété par voie biliaire chez le rat et par voie urinaire chez l’homme. Cette différence interspécifique s’explique par la capacité du rat à éliminer par voie biliaire des substances dont le poids moléculaire est supérieur à 350 daltons alors que le seuil est de 500 daltons chez l’homme (DEKANT W, 2008) (TOUTAIN PL, 2010). Les bactéries ainsi que les β-glucuronidases intestinales des rongeurs déconjuguent le BPA-G qui peut être ensuite réabsorbé. La présence d’un cycle entéro-hépatique (DOERGE DR, 2010a) serait responsable d’une exposition interne plus longue chez les rongeurs que chez les primates suite à une même administration (même dose, même voie). Cet argument avancé par les autorités réglementaires pour réfuter les études scientifiques n’est pas tout à fait satisfaisant. Chez les mammifères, la β-glucuronidase est présente dans un grand nombre de tissus. Il est donc très probable qu’il existe localement dans certains tissus des cycles de conjugaison/déconjugaison du BPA-G chez l’homme mimant le cycle entéro-hépatique des rongeurs (GINSBERG G, 2009).
Dans un premier temps, pour l’ANSES, le BPA a été considéré comme une préoccupation plutôt qu’une urgence sanitaire. En Avril 2010, elle a demandé aux industriels d’étiqueter les produits contenant du BPA afin d’informer au mieux le
29 consommateur. L’agence a alors estimé que des données supplémentaires étaient nécessaires pour évaluer le risque lié à l’exposition humaine au BPA.
Les politiques n’ont pas réagi tout à fait de la même manière et ont appliqué le principe de précaution. Depuis plus de deux ans, l’exposition au BPA préoccupe les esprits. L’inquiétude des Français a commencé en Octobre 2008, date où les biberons en plastique ont été retirés du marché canadien. Une loi a été votée le 30 Juin 2010 (LOI n° 2010-729) tendant à suspendre la commercialisation de biberons produits à base de bisphénol A (figure 6).
Article 1 : La fabrication, l'importation, l'exportation et la mise sur le marché à titre gratuit ou onéreux de biberons produits à base de bisphénol A sont suspendues jusqu'à l'adoption, par l'Agence française de sécurité sanitaire des aliments, d'un avis motivé autorisant à nouveau ces opérations.
Article 2 : dans les deux mois qui suivent la publication par l'Institut national de la santé et de la recherche médicale de son expertise collective sur les perturbateurs endocriniens et au plus tard le 1er janvier 2011, un rapport présentant les mesures déjà prises et celles envisagées pour diminuer l'exposition humaine à ces produits est adressé par le Gouvernement au Parlement.
Figure 6 : Loi n°2010-729 votée le 30 Juin 2010 (LEGIFRANCE)
2.2.4.2 En 2011
Dans un deuxième temps, l’ANSES est revenue sur sa position.
Le 4 Juin 2009, la Direction Générale de la Santé a saisi l’ANSES en vue de demander une expertise sur les risques sanitaires liés à l’exposition au BPA du consommateur. Le 18 Février 2010, la Direction Générale de la Prévention de Risques a précisé de prendre en compte dans le cadre de cette expertise tous les types d’effets toxiques et de ne pas se cantonner aux effets reprotoxiques. En réponse à ces demandes, le 27 Septembre 2011, l’ANSES a publié deux rapports : l’un relatif aux effets sanitaires du BPA, l’autre à ses usages. Ils se sont fondés sur les publications pré-existantes pour lesquelles le niveau de fiabilité était le plus satisfaisant. Ce travail a mis en évidence des effets délétères suspectés chez l’Homme (ANSES, 27 Septembre 2011) et avérés chez les animaux (effets sur la
30 reproduction, effets sur la glande mammaire, effets sur le métabolisme, le cerveau et le comportement) pour des niveaux d’exposition inférieurs à la DJA. D’après l’ANSES, ces informations sont suffisantes pour limiter dès à présent l’exposition au BPA des populations les plus à risque (nourrissons, jeunes enfants et femmes enceintes). La voie d’exposition majeure étant la voie orale, l’ANSES lance un appel à contribution pour recueillir toutes les données relatives à des produits de substitution au BPA afin de réduire au maximum la contamination des denrées alimentaires.
Suite à ces rapports, l’assemblée nationale a voté le 12 Octobre 2011 un projet de loi
visant à la suspension de la fabrication, de l'importation, de l'exportation et de la mise sur le marché de tout conditionnement à vocation alimentaire contenant du bisphénol A (figure 7).
La loi n° 2010-729 du 30 juin 2010 tendant à suspendre la commercialisation de biberons produits à base de bisphénol A est ainsi modifiée :
1° À l'intitulé, les mots : « biberons produits à base de bisphénol A » sont remplacés par les mots : « tout conditionnement comportant du bisphénol A et destiné à recevoir des produits alimentaires » ;
2° L'article 1er est ainsi rédigé :
« Art. 1er. - La fabrication, l'importation, l'exportation et la mise sur le marché à titre gratuit ou onéreux pour un usage alimentaire de tout conditionnement, contenant ou ustensile comportant du bisphénol A sont suspendues à compter du 1er janvier 2014 jusqu'à ce qu'un avis de l'Agence nationale de sécurité sanitaire de l'alimentation, de l'environnement et du travail autorise la reprise de ces opérations. Si ces conditionnements, contenants ou ustensiles sont destinés à recevoir des produits alimentaires pour les nourrissons et enfants en bas âge au sens des a et b de l'article 2 de la directive 2006/141/CE de la Commission, du 22 décembre 2006, concernant les préparations pour nourrissons et les préparations de suite et modifiant la directive 1999/21/CE, cette suspension prend effet à compter du 1er janvier 2013. » ;
31
3° L'article 2 est ainsi rédigé :
« Tout conditionnement comportant du bisphénol A et destiné à recevoir des produits alimentaires doit comporter un avertissement sanitaire déconseillant son usage aux femmes enceintes et aux enfants de moins de trois ans du fait de la présence de bisphénol A.
« Un rapport d'étape élaboré par l'Agence nationale de sécurité sanitaire de l'alimentation, de l'environnement et du travail sur les substituts au bisphénol A ainsi que leur innocuité et leur adaptation pour l'utilisation dans la fabrication des plastiques et résines à usage alimentaire est communiqué par le Gouvernement au Parlement au plus tard le 31 octobre 2012. »
Figure 7 : Projet de loi voté le 12 Octobre 2011 (LEGIFRANCE)
2.3 La pharmacocinétique du BPA, un outil essentiel pour évaluer l’impact réel de l’exposition au BPA sur la santé humaine
2.3.1 Exposition externe vs exposition interne
L’exposition externe, autrement dit la dose, comprend une composante pharmacocinétique qui détermine le profil des concentrations plasmatiques (exposition interne) et une composante pharmacodynamique qui étudie l’action de ces concentrations sur l’organisme. Il existe deux types de raisonnement pour expliquer les effets biologiques observés : établissement d’une relation dose-effet ou d’une relation concentration plasmatique-effet. Cette dernière permet de s’affranchir des différences interspécifiques de pharmacocinétique. L’extrapolation des données animales à l’Homme n’est donc limitée que par les différences interspécifiques relatives à la pharmacodynamie.
2.3.2 L’exposition interne du BPA chez l’Homme : encore beaucoup d’inconnues
Le tableau 5 présente l’exposition interne humaine dans des conditions d’exposition naturelle, selon plusieurs études de biosurveillance.
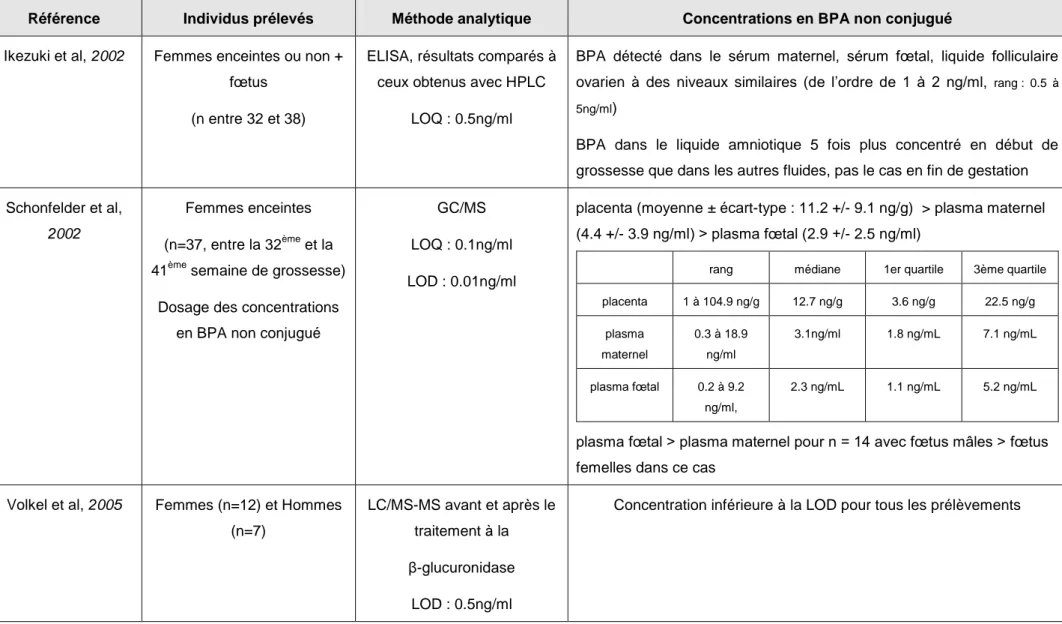
32 Tableau 5 : Concentrations sériques ou plasmatiques de BPA observées chez des individus soumis à des conditions naturelles d’exposition au BPA. Ces données proviennent d’études de biosurveillance.
Référence Individus prélevés Méthode analytique Concentrations en BPA non conjugué
Ikezuki et al, 2002
(IKEZUKI Y, 2002)
Femmes enceintes ou non + fœtus
(n entre 32 et 38)
ELISA, résultats comparés à ceux obtenus avec HPLC
LOQ : 0.5ng/ml
BPA détecté dans le sérum maternel, sérum fœtal, liquide folliculaire ovarien à des niveaux similaires (de l’ordre de 1 à 2 ng/ml, rang : 0.5 à
5ng/ml)
BPA dans le liquide amniotique 5 fois plus concentré en début de grossesse que dans les autres fluides, pas le cas en fin de gestation
Schonfelder et al, 2002 (SCHONFELDER G, 2002) Femmes enceintes (n=37, entre la 32ème et la 41ème semaine de grossesse)
Dosage des concentrations en BPA non conjugué
GC/MS
LOQ : 0.1ng/ml
LOD : 0.01ng/ml
placenta (moyenne ± écart-type : 11.2 +/- 9.1 ng/g) > plasma maternel (4.4 +/- 3.9 ng/ml) > plasma fœtal (2.9 +/- 2.5 ng/ml)
rang médiane 1er quartile 3ème quartile
placenta 1 à 104.9 ng/g 12.7 ng/g 3.6 ng/g 22.5 ng/g plasma maternel 0.3 à 18.9 ng/ml 3.1ng/ml 1.8 ng/mL 7.1 ng/mL plasma fœtal 0.2 à 9.2 ng/ml, 2.3 ng/mL 1.1 ng/mL 5.2 ng/mL
plasma fœtal > plasma maternel pour n = 14 avec fœtus mâles > fœtus femelles dans ce cas
Volkel et al, 2005 (VOLKEL W, 2005) Femmes (n=12) et Hommes (n=7) LC/MS-MS avant et après le traitement à la β-glucuronidase LOD : 0.5ng/ml
33 Sajiki et al, 1999 (SAJIKI J, 1999) Femmes (n=12) et Hommes (n=9) HPLC avec détection électrochimique LOD : 0.2 ng/ml
0.33 +/- 0.54 ng/ml pour les femmes (rang : 0-1.6 ng/ml)
0.59 +/- 0.21 ng/ml pour les hommes (rang : 0.38 à 1 ng/ml)
Inoue et al, 2000
(INOUE K, 2000)
Individus en bonne santé (n=5)
HPLC avec détection électrochimique
LOD : 0.01 ng/ml
0.32 ng/ml (moyenne des 5 mesures)
Kaddara et al, 2009
(KADDARA N, 2009)
Patients d’un hôpital français (n=207)
RIA
LOD : 0.08 ng/ml
Inférieure à la LOD dans 17% des cas, entre 0.08 et 1ng/ml dans 58% cas, entre 1 et 2 ng/ml dans 13% des cas et supérieure à 2 ng/ml dans 12 % des cas.
34 Avant de commenter les valeurs observationnelles, il est important d’avoir un avis critique sur les modalités de dosage. En effet, compte tenu des faibles concentrations plasmatiques en BPA et BPA-G, leur dosage nécessite des méthodes précises et robustes.
Une technique de dosage est pertinente si elle présente une bonne sensibilité et spécificité. Un standard interne sous forme d’un isotope stable capable d’être ajouté directement dans les échantillons sanguins permet d’évaluer le pourcentage d’extraction du BPA (DEKANT W, 2008).
La spectrométrie de masse en tandem (MS-MS) est la technique qui répond au mieux à ces exigences (DEKANT W, 2008) et présente plusieurs avantages : la détection des molécules d’intérêt est très sélective, le standard interne est sous forme d’un isotope stable et les LOD3
et LOQ4 sont faibles (Cf 3.6.2). Une autre méthode de dosage qui possède une bonne sensibilité est la chromatographie en phase liquide à haute performance (HPLC) couplée à un détecteur électrochimique (DEKANT W, 2008). La chromatographie en phase liquide est une technique de séparation. Elle est dite à haute performance à cause de sa rapidité et de sa très bonne résolution. Au sein du détecteur électrochimique, il se produit des réactions d’oxydoréduction produisant un courant proportionnel à la concentration du soluté.
Les autres méthodes sont moins performantes. Parmi elles, se trouve la méthode ELISA. Il s’agit d’un dosage immuno-enzymatique sur support solide. Elle présente deux principaux désavantages : les réactions croisées et l’absence de standard interne. Cette technique met en évidence des concentrations plasmatiques ou sériques plus élevées : jusqu’à 10ng/ml avec des moyennes aux alentours de 2 ou 3 ng/ml (DEKANT W, 2008).
Compte tenu de ces observations, quelques commentaires peuvent être réalisés sur le tableau 5. Les concentrations plasmatiques en BPA pourraient être influencées par le sexe et le statut hormonal de l’individu prélevé. En effet, il semble que les concentrations plus élevées soient retrouvées dans les organes ou fluides biologiques provenant de femmes enceintes. Par ailleurs, l’homme parait plus exposé au BPA libre que la femme.
3
LOD (en anglais, Limit of detection) : Limite de détection
4
35 Les concentrations sériques ou plasmatiques en BPA chez la femme enceinte sont particulièrement élevées (VANDENBERG LN, 2007). Lors de la grossesse, de nombreux mécanismes physiologiques sont modifiés et interfèrent avec le métabolisme des xénobiotiques. Par exemple, chez les rongeurs, la glucuronidation hépatique du BPA est moins intense durant la gestation. Elle pourrait être associée à une réduction de l’expression des gènes codant pour les glucuronyltransferases hépatiques (INOUE H, 2005). Par analogie aux rongeurs, la réduction de la glucuronidation hépatique pourrait être à l’origine des concentrations plasmatiques de BPA plus élevées chez la femme enceinte.
Diverses études ont comparé les concentrations en BPA du placenta, du plasma/sérum maternel et du plasma/sérum fœtal. Le placenta présente les concentrations les plus élevées. Il possède une activité β-glucuronidase et une activité Aryl sulfatase (COLLIER AC, 2009) qui pourraient être à l’origine de la déconjugaison des métabolites inactifs en BPA.
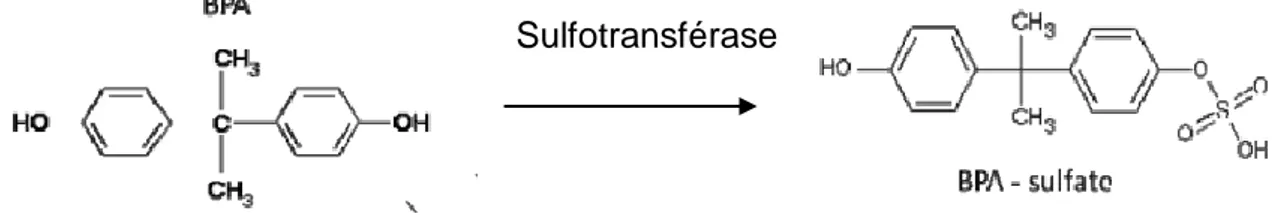
Le BPA passe à travers la barrière placentaire (TAKAHASHI O, 2000). Il n’existe que peu de données concernant la toxicocinétique du BPA chez le fœtus. Une étude menée par Ikezuki (IKEZUKI Y, 2002) suggère une maturation du métabolisme hépatique du fœtus au cours de la grossesse. Le liquide amniotique prélevé en début de gestation est 5 fois plus concentré en BPA que d’autres liquides biologiques tels que le sérum maternel, le liquide folliculaire ovarien… Or ces différences de concentrations ne se retrouvent pas durant les 4 mois précédant l’accouchement. Ceci peut s’expliquer par l’acquisition de la déglutition et le développement fonctionnel du système hépatique du fœtus durant la deuxième partie de grossesse. La plupart des systèmes enzymatiques à l’origine de la détoxification des xénooestrogènes chez l’adulte ne fonctionnent pas bien chez le fœtus. Il existe cependant une exception : la sulfatation. En effet, Richard et son équipe ont mis en évidence l’activité de certaines enzymes de la famille des sulfotransférases (SULT1A1 et SULT1A3) à partir de 32 jours post ovulation (RICHARD K, 2001). Il semblerait donc que chez le fœtus, le BPA soit transformé en BPA-sulfate plutôt qu’en BPA-G (figure 8).
36 Figure 8 : Métabolisation du BPA en BPA-Sulfate chez le fœtus.
La sulfatation n’est pas considérée comme un mécanisme de détoxification définitive. Le BPA-sulfate est un réservoir circulant de BPA étant donné la présence d’arylsulfatases effectives dans de nombreux tissus fœtaux (GINSBERG G, 2009). De plus, le fœtus présente des β glucuronidases qui seraient responsables localement de la déconjugaison du BPA-G en BPA actif.
2.3.3 Les connaissances actuelles sur la toxicocinétique du BPA chez l’Homme et les animaux
2.3.3.1 Définition des paramètres pharmacocinétiques
La toxicocinétique a pour but de déterminer le devenir du BPA au sein d’un organisme. Elle étudie l’absorption, la distribution, le métabolisme et l’élimination du BPA. L’absorption est l’ensemble des étapes qui conduisent le BPA de l’endroit où il est administré jusqu’à la circulation générale. La distribution est la manière dont le BPA administré se répartit dans tous les tissus de l’organisme une fois qu’il a atteint la circulation générale. Le métabolisme est la transformation du BPA en ses métabolites généralement inactifs. L’élimination englobe tous les processus qui entraînent la disparition de l’activité du BPA. Elle peut avoir lieu de 2 manières : la métabolisation et l’excrétion. Lors de la métabolisation, le BPA est toujours dans l’organisme mais son activité oestrogénique a disparu (exemple : transformation du BPA en BPA-G). Lors de l’excrétion, le BPA a quitté anatomiquement l’organisme (excrétions urinaire et fécale par exemple).
Ces différents processus physiologiques sont évalués au travers des paramètres pharmacocinétiques (tableau 6).
37 Tableau 6 : Association des paramètres pharmacocinétiques aux processus physiologiques impliqués.
Paramètres Pharmacocinétiques
Action de l’organisme sur le toxique
Paramètre pharmacocinétique
Absorption Biodisponibilité
Distribution Volume de distribution
Métabolisme Clairance
Elimination Temps de demi-vie
La biodisponibilité du BPA notée F est le pourcentage de la dose donnée qui atteint la circulation générale et sa vitesse d’accès au secteur vasculaire. La vitesse d’absorption est objectivée par la concentration plasmatique maximale (Cmax) de BPA
et le temps, Tmax, auquel cette concentration est atteinte.
Le volume de distribution (Vd) du BPA est une constante de proportionnalité entre la
quantité de BPA présente dans l’organisme et sa concentration plasmatique. Il s’agit d’un volume virtuel exprimé en litres.
La clairance du BPA se définit par la mesure de la capacité de l’organisme ou d’un organe à éliminer le BPA après qu’il ait atteint la circulation générale.
Le temps de demi-vie d’élimination du BPA est le temps nécessaire pour diviser les concentrations plasmatiques de BPA par 2 lorsque l’équilibre de distribution est atteint.
La pharmacocinétique est indispensable pour évaluer l’éventuelle toxicité du BPA et pour extrapoler les données toxicologiques de l’animal à l’Homme. Les paragraphes ci-dessous exposent les connaissances actuelles en matière de toxicocinétique du BPA chez l’Homme et les animaux.
38
2.3.3.2 La toxicocinétique du BPA chez l’Homme
Suite à une administration orale, le BPA est rapidement absorbé et métabolisé en BPA-G par des enzymes de biotransformation présentes dans le foie et la paroi intestinale. Il s’agit d’une voie d’inactivation du BPA étant donné que le BPA-G est dépourvu d’activité œstrogénique (MATTHEWS JB, 2001). Volkel et son équipe ont administré 5 mg de BPA marqué au deutérium par voie orale à 4 adultes volontaires en bonne santé. Les échantillons sanguins prélevés à différents temps post administration ont été analysés en LC-MS/MS5 et GC-MS6 après hydrolyse à la β-glucuronidase. Les concentrations plasmatiques totales (BPA et ses métabolites) ont atteint leur maximum (environ 800 nmol/L) 80 minutes après l’administration. Le BPA circulant était principalement sous forme de BPA-G (VOLKEL W, 2002) suggérant que les concentrations plasmatiques en BPA non conjugué sont peu élevées suite à une administration orale à cause de l’effet de premier passage hépatique.
L’élimination du BPA et du BPA-G est rapide, presque totale et se fait par voie urinaire. Chez 6 sujets volontaires, entre 75% et 85 % de la dose administrée (25µg/personne dans 50 ml d’eau, voie orale) sont retrouvés sous forme de BPA-G dans les urines en moins de 5 heures (VOLKEL W, 2005).
Les études pharmacocinétiques ont permis d’évaluer quelques paramètres pharmacocinétiques du BPA chez l’Homme (Tableau 7).
5
LC-MS/MS : Chromatographie liquide associée à la spectrométrie de masse en tandem
6
39 Tableau 7 : Paramètres pharmacocinétiques du BPA évalués chez l'Homme.
Paramètre Valeur (unités) Références
Temps de demi-vie du BPA 4 (heures) (VOLKEL W, 2002) (VOLKEL W, 2005) 1.5 (heure) (TSUKIOKA T, 2004) Volume de distribution du BPA 5.2 (L/kg) (YOO SD, 2000) 0.6 (L/kg) (UPMEIER A, 2000) Clairance plasmatique du BPA
30 (mL/kg/min) (CHO CY, 2002)
28 (mL/kg/min) (SHIN BS, 2004)
Débit sanguin hépatique 35 (mL/kg/min) (BOXENBAUM, 1980)
Le débit sanguin hépatique a été estimé à l’aide de l’équation allométrique de Boxenbaum (BOXENBAUM, 1980) suivante : Qh =0.0555*P^0.894 avec P en kg et Qh en L/min.
Afin de quantifier l’effet de premier passage hépatique, le coefficient d’extraction hépatique ( ) a été calculé à l’aide de la clairance hépatique du BPA ) et du
débit sanguin hépatique ( ) selon l’équation suivante :
Équation 1
La clairance plasmatique du BPA est proche de la clairance hépatique étant donné que le BPA est majoritairement métabolisé par le foie (VOLKEL W, 2002). Le coefficient d’extraction hépatique pour l’homme est donc compris entre 0.8 et 0.85 ce qui signifie que 80 à 85 % du BPA qui arrivent au foie sont métabolisés par ce dernier. Le temps de demi vie rapporté par Volkel est peut être surestimé. Il a été calculé à partir d’une administration orale de 5 mg/personne de BPA. L’élimination de la molécule pourrait être limitée par son absorption gastro-intestinale. Ce phénomène appelé flip-flop pourrait être à l’origine d’une augmentation artefactuelle du temps de demi-vie. Les différences des valeurs du volume de distribution observées entre les études sont inexpliquées.
40
2.3.3.3 La toxicocinétique du BPA chez les animaux
La toxicocinétique du BPA a été essentiellement étudiée chez les rongeurs (rat, souris) et les primates non humains.
Suite à une administration orale, le BPA est rapidement absorbé et métabolisé par le foie chez toutes les espèces. Doerge et son équipe ont administré 100µg/kg de BPA par voie orale à des rats femelles Sprague Dawley et des singes adultes (DOERGE DR, 2010b) (DOERGE DR, 2010a). Les concentrations plasmatiques maximales de BPA non conjugué ont été atteintes durant les premières minutes suivant l’administration orale, suggérant une absorption intestinale rapide. La biodisponibilité du BPA calculée (0.028% chez le singe et 0.77% chez la ratte) a mis en évidence un effet de premier passage hépatique intense. Le principal métabolite du BPA est le BPA-G chez le singe (KUREBAYASHI H, 2002) et le rat (POTTENGER LH, 2000).
Les modalités d’élimination du BPA et de ses métabolites présentent des différences interspécifiques. Chez le rat, la dose administrée a été majoritairement retrouvée dans les fèces (52% à 83%) sous la forme de BPA non conjugué. L’excrétion urinaire de BPA-G a été limitée (13% et 34%) (POTTENGER LH, 2000). Au contraire chez le singe, l’excrétion rénale a contribué de manière plus importante (79 et 86%) à l’élimination du BPA que l’excrétion fécale (1.8% et 3.1%) (KUREBAYASHI H, 2002). Cette différence s’explique par la présence d’un cycle entéro-hépatique chez les rongeurs qui n’existe pas chez les primates non humains. En effet, le poids moléculaire seuil à partir duquel l’élimination biliaire est possible dépend des espèces. Il est de l’ordre de 200-300g/mol chez le rat et de 500-600g/mol chez l’homme. Le principal métabolite du BPA, le BPA-G de poids moléculaire 404g/mol, est donc préférentiellement éliminé dans la bile chez le rat et par les urines chez les primates (SHIN BS, 2010).
Le tableau 8 présente les paramètres pharmacocinétiques du BPA estimés dans différentes espèces suite à l’administration intraveineuse de BPA à des doses comprises entre 0.1 et 10 mg/kg.
41 Tableau 8 : Paramètres pharmacocinétiques du BPA estimés chez différentes espèces
animales suite à l’administration intraveineuse d’une dose de BPA comprise entre 0.1 et 10mg/kg. Espèce (Référence) Dose Clairance plasmatique du BPA Temps de demi-vie du BPA Volume de distribution du BPA Débit hépatique Coefficient d’extraction hépatique mg/kg ml/kg/min h L ml/kg/min Singe rhésus (DOERGE DR, 2010a) 0.1 7.6 3.6 2.3 45 0.16 Rat (CHO CY, 2002) 1 109 0.62 1.3 64 1.7 (DOERGE DR, 2010b) 0.1 75 0.66 1.1 1.1 (UPMEIER A, 2000) 10 10 38.5 Non évalué 0.15 Souris (CHO CY, 2002) 2 208 0.67 0.1 107 1.94
Le débit sanguin hépatique a été estimé à l’aide de l’équation allométrique de Boxenbaum (BOXENBAUM, 1980) suivante : Qh =0.0555*P^0.894 avec P en kg et Qh en L/min et le coefficient d’extraction hépatique avec l’équation 1.
Chez les rongeurs, il existe un autre métabolisme du BPA que le métabolisme hépatique comme en témoignent les coefficients d’extraction hépatique supérieurs à 1. Le temps de demi-vie du BPA est relativement court dans la plupart des études (entre 0.6 et 3.6h) excepté dans une étude sur les rats où il a été estimé à 38.5 heures.
2.3.4 Incohérence bibliographique
Comme nous l’avons vu précédemment, la clairance plasmatique du BPA se définit comme la capacité de l’organisme à éliminer le BPA après qu’il ait atteint la circulation générale. Elle se calcule en divisant la dose administrée par les concentrations plasmatiques de BPA à l’état d’équilibre (équation 2). Il s’agit donc d’un paramètre qui permet de relier un niveau d’exposition externe à un niveau d’exposition interne, correspondant au véritable marqueur du niveau de risque.
42
Équation 2 : La clairance plasmatique, un paramètre qui relie un niveau d’exposition externe au BPA à un niveau d’exposition interne, le véritable marqueur du niveau de risque.
Selon la littérature, la clairance plasmatique du BPA de l’Homme est d’environ 30ml/kg.min (MIELKE H, 2009) (CHO CY, 2002) et l’exposition externe au BPA est comprise entre 1 et 13µg/kg/j (EFSA, 2006). A l’aide de l’équation 2, les concentrations plasmatiques de BPA sont de l’ordre du pg/ml. La comparaison de cette valeur estimée à celles observées chez l’Homme dans des études de biosurveillance (tableau 5) montre une incohérence. Diverses hypothèses ont été émises pour l’expliquer.
Hypothèse 1 : L’exposition externe au BPA de l’homme serait bien plus importante que la DJA
Des études ont mis en évidence que la voie alimentaire est la voie d’exposition majeure au BPA. Parmi elles, une étude menée sur 257 enfants non scolarisés a montré que 99% de l’exposition au BPA provenait de sources alimentaires (WILSON NK, 2007). Cependant, certains auteurs supposent qu’il existe d’autres sources d’exposition non négligeables telles que l’inhalation de poussières contaminées ou l’absorption transcutanée de BPA. Les concentrations de BPA relevées dans les échantillons de poussière ménagère sont peu élevées (Cf 2.2.2.2) et ne peuvent pas être à l’origine de niveaux d’exposition supérieurs à la DJA. L’exposition au BPA par contact via les papiers thermiques a été envisagée. Zalko et son équipe ont montré à l’aide d’un modèle de peau d’oreille de porc que le BPA est très bien absorbé et métabolisé par la peau. La biodisponibilité du BPA après application cutanée serait comprise entre 10% et 60% mais cette voie d’exposition contribuerait de façon mineure à l’exposition humaine (ZALKO D, 2011) (MIELKE H, 2011).
Hypothèse 2 : Les concentrations sanguines de BPA rapportées par les études de biosurveillance sont surestimées.
Suite à une administration orale de BPA et de BPA marqué au deutérium chez un Homme sain (5µg/personne/molécule), Volkel a retrouvé dans les urines des niveaux faibles de BPA (<LOQ) alors qu’aucune trace de BPA marqué au deutérium n’a été détectée (VOLKEL W, 2008). Cette observation suggère qu’une contamination des