1 FACULTÉ DE MÉDECINE D’AMIENS
ANNÉE 2016-2017 N° 2017-64
Infiltrats lymphocytaires dans les cancers de souche
folliculaire de la thyroïde
THÈSE
POUR LE DOCTORAT DE SPECIALITE D’ENDOCRINOLOGIE, DIABETOLOGIE ET MALADIES METABOLIQUES (DIPLOME D’ÉTAT)
PRESENTÉE ET SOUTENUE PUBLIQUEMENT LE VINGT SIX JUIN 2017
PAR
SHEHATA ARIZA ANGIE
PRÉSIDENT DU JURY : Monsieur le Professeur Jean-Daniel LALAU
JUGES : Monsieur le Professeur Henri SEVESTRE
Madame le Docteur Isabelle EL ESPER
Madame le Docteur Sandrine JEANNE
2
Remerciements
A mon président du Jury,
Monsieur le Professeur Jean-Daniel LALAU Professeur des Universités-Praticien Hospitalier (Nutrition)
Chef du Service Endocrinologie, maladies métaboliques et nutrition
Pôle "Médico-chirurgical digestif, rénal, infectieux, médecine interne et endocrinologie" (D.R.I.M.E)
Je vous remercie d’avoir accepté d’être le président de mon jury de thèse et pour votre soutien ces dernières années.
3 A ma directrice de thèse,
Madame le Professeur Rachel DESAILLOUD Professeur des Universités-Praticien Hospitalier
(Endocrinologie, Diabétologie et Maladies Métaboliques)
Je vous remercie pour tout ce temps que vous m’avez accordé depuis notre première rencontre en salle des thèses il y a de cela 5 ans.
4 A mes membres du jury,
Monsieur le Professeur Henri SEVESTRE
Professeur d'Anatomie et de Cytologie Pathologiques à l'UFR de Médecine d'Amiens Chef du Service d'Anatomie et Cytologie Pathologiques du CHU d’Amiens Picardie Adjoint au chef de l’Oncopôle
Je vous remercie pour ce travail avant tout et pour autre chose. Madame le Docteur Isabelle EL ESPER
Maître de Conférences des Universités – Praticien Hospitalier (Médecine nucléaire)
Je vous remercie d’avoir accepté de siéger à mon jury. Madame le Docteur Sandrine JEANNE
Chef de service de diabétologie au GHPSO
Merci pour votre présence et votre accueil dans votre service pendant les 6 derniers mois. Merci de m’accueillir dans votre équipe.
5 Aux premiers : à mes parents
A mon papa, mon héros qui par son histoire et ses actes est la définition de l’intelligence et de la force. Pour cet amour et cette complicité, pour ces références cinématographiques partagées, pour les longs discours philosophiques appréciés, pour l’amour de la belle phrase et
de l’argumentation bien menée. Pour avoir joué à la poupée, écouté ma musique, regardé mes dessins animés, m’avoir écouté raconté mes journées d’école puis mes journées de fac puis
mes journées de travail et avoir finalement tout partagé. Pour cette confiance que tu m’as donnée et ce soutien de tous les instants. En espérant que cette complicité se transmette de
génération en génération.
A ma maman, présente à chaque moment. Pour cet amour et cette patience que tu m’as montré. Parce que tu as été celle que j’ai malgré moi la plus malmené mais que tu m’as toujours soutenue et cajolée. Je comprends aujourd’hui ce qu’est la maternité et j’espère que
nos 3 générations passeront encore de bons moments ensemble.
A mes parents : je vous aime. Et comme on ne dit pas merci, je dirai simplement « Je… je ne sais pas quoi dire »
“It's the eye of the tiger It's the thrill of the fight Rising up to the challenge of our rival And the last known survivor” Survivor
A mon amour,
A mon contraire qui m’a apporté stabilité. A mon amoureux qui est devenu mon mari qui m’impressionne tous les jours par sa patience, son optimisme, sa douceur. Parce que je rêvais du Dr Carter et que la vie me l’a fait rencontrer et aimer. Pour ce soutien, ces moments passés,
le silence, les discussions et les épreuves. Parce que j’espère que nous vivrons nos rêves ensembles même si notre routine que j’aime ne nous apportera probablement pas d’oscar (Out
La La Land). Au papa de ma fille en qui j’ai pleine confiance et tu sais qu’il n’y aura jamais de message plus fort…
A mon mari : je t’aime.
« Well maybe i don’t give up easily and I know this is hard to see but I wish time would slow down so I could keep your heart around” For you Gavin James.
“When I see you it's a beautiful world But when you're gone, I want you in my arms I'm telling you the last time Baby you, you got what I need
Baby you, you got my sunshine” Joshua radin
A ma fille,
A Diane, Artémis, ma déesse, mon bébé, mon bonheur. Depuis le 10 Janvier 2016 je suis comblée. Chaque jour avec toi me fait découvrir des sentiments nouveaux. Ta présence a rendu ma vie palpitante et te voir grandir est un bonheur sans nom. Je t’aime et j’ai toute confiance en toi ma petite Ariza Shehata. Tes choix seront les bons tant qu’ils te rendront
6 « I know everything is gonna be alright » Joshua radin. “If you think of me If you miss me once in a while Then I'll return to you I'll return and fill that space in your heart” The promise
Tracy Chapman. A Marina et Mayron
Qui m’impressionnent par leur courage. A ma sœur
Que ce texte n’a pas pu aider A mes amis,
A Rémi pour sa gentillesse qui n’a d’égal A Soheila pour sa bonne humeur
A CCP,
Marianne, Héloise, Céline et Anne merci pour votre présence et votre écoute.
Parce que nous avons trouvé un moyen de lutter contre la distance et que nous n’avons jamais été aussi proches. Et merci à Jean-Philippe, Vincent, Vignon et Quentin de supporter cette
intrusion numérique.
A Yann et Deborah et nos battles de folie. A Sophie, Geoffrey, Paul pour les vacances et les projets partagés et bienvenue à Circé.
A mes cointernes,
A Franklin et nos péripéties à Saint Quentin DANS L’AISNE, aux anciennes devenues cheffes Mathilde, Iléana, Claire, Julie, Sarra et Hélène, aux actuelles Marine, Ornella, Soumaya, Amina, Nacera, Imane, Noémie et Thomas. A mes cointernes de médecine générale
Charline, Stéphanie, Mihai, Shehata bis et Antoine. Entre congrès et hôpitaux, beaucoup de temps partagé ensemble.
A mes mentors,
A Mr Zaraidi, Mme François et Mme Thoirain : j’espère que ma fille rencontrera des professeurs aussi impliqués qui l’aideront à réaliser ses rêves.
Au Dr Canaple et au Dr Malpaux qui m’ont accueilli en Picardie. Au Dr Houpe et à son stéthoscope, au Dr Hamid et à ses sardines,
Aux Dr Cimino, Dr Chiah, Dr Haddad, Dr Hourdin et Dr Billig pour mon premier stage en diabétologie.
Aux Pr Lalau, Pr Desailloud, Dr Fendri Dr Vaidie, Dr Saraval, Dr Karaca et à l’équipe paramédicale du CHU d’Amiens même si décidément j’ai du mal à y finir mes semestres !! Au Dr Barjon, à Etienne et Jennifer parce que j’ai adoré mon semestre avec vous et que vous
m’avez donné envie d’un potager, d’un bébé et de rire (en travaillant quand même). A l’équipe d’anatomie pathologique pour m’avoir adoptée pendant un semestre. Au Dr Jeanne, au Dr Loric et à l’équipe de Creil, encore un beau semestre, en espérant vous
retrouver bientôt.
7
Table des matières
RESUME
ABSTRACT
INTRODUCTION
1) Les cancers de souche folliculaire de la thyroïde
1.1) Définition et épidémiologie
1.2) Physiopathologie
1.3) Thérapeutiques actuelles
2) Les thyroïdites
3) Les lymphocytes infiltrants les tumeurs (TILs)
3.1) Définition, modèles et implications thérapeutiques
3.2) TILs et thyroïde
4) L’immunothérapie
4.1) Théories
4.2) Bases immunologiques
4.3) Les « Immune Checkpoints »
4.3.1) CTLA-4
4.3.2) Programmed Cell Death-1
4.4) Applications thérapeutiques
5) Autoimmunité, BRAF et immunothérapie
8
1) Type d'étude
2) Période d’inclusion
3) Critères d’inclusion
4) Critère de non inclusion
5) Population d’étude
6) Déroulement de l’étude
6.1) Sélection des blocs tissulaires 6.2) Immunomarquage
6.3) Recueil des données
7) Analyse statistique 7.1) Comparaison cas-témoins 7.2) Analyses en sous-groupes 8) Ethique 9) Financement
RESULTATS
1) Patients inclus2) Description de la population d’étude (cf Tableau 1)
3) Comparaison des clusters lymphocytaires entre les deux groupes 4) Expression de BRAF, caractéristiques de l’infiltrat lymphocytaire
5) Comparaison de l’infiltrat lymphocytaire et des différents clusters en fonction de l’expression de BRAF (Annexe 1)
6) Comparaison des clusters lymphocytaires des lames de CFT et de la thyroïdite adjacente (Annexe 2)
7) Comparaison des clusters lymphocytaires entre les CFT multifocaux (Annexe 3)
DISCUSSION
CONCLUSION
ANNEXES
9
RESUME
Introduction : Les cancers de souche folliculaire de la thyroïde (CFT) sont fréquents. Malgré
leur pronostic favorable, certains sont iodorésistants et nécessitent des thérapies ciblées. La thyroïdite autoimmune est elle aussi fréquente. Le rôle anti ou pro tumoral de la thyroïdite autoimmune n’est pas établi.
Objectif : Décrire l’organisation architecturale et phénotyper les TILs des CFT et des
maladies de Basedow (MB) afin de déterminer s’il existe un profil autoimmun ou antitumoral. Comparer les infiltrats lymphocytaires (TILs) des CFT afin de déterminer le rôle de la mutation BRAF sur la réponse immunitaire. Rechercher la présence de parvovirus B19 dans les CFT.
Matériel et Méthode : Etude observationnelle, rétrospective avec analyse immunohistochimique prospective. 95 patients ayant un CFT et 29 patients ayant une MB ont été inclus. Un immunomarquage des LB, LTh1, LTh2, cellules NK, LTreg et LT CD8 a été réalisé. Les marqueurs PD1, PDL1, CTLA4, BRAF ont été recherchés. L’architecture des TILs a été décrite. Une comparaison des MB et des CFT a été réalisé grâce à un test de Mann Whitney.
Résultats : Les TILs était présent dans 50 % des CFT, était multifocal dans 56.52 % et
péritumoral dans 75 % des cas. Tous les sous types lymphocytaires étaient significativement plus abondants dans le groupe MB. PD1, PDL1 et CTLA4 n’étaient pas exprimés par les cellules tumorales. Ils étaient significativement plus représentés dans le groupe MB. 62.39% des CFT exprimaient BRAFV600E ce qui n’influençait pas les TILs.
Conclusion : L’immunohistochimie n’a pas permis de discriminer TILs et thyroïdite. Le
facteur de mauvais pronostic qu’est la présence de BRAFV600E ne dépend pas de son action sur les TILs. L’immunothérapie n’est pas à exclure.
10
ABSTRACT
Introduction: Thyroid follicular strain (CFT) cancers are common. Despite their favorable
prognosis, some are iodine-resistant and require targeted therapies. Autoimmune thyroiditis is also common. The anti-tumor role of autoimmune thyroiditis is not established.
Objective: To describe the architectural organization and phenotype TILs of CFTs and
Graves' disease (MB) to determine whether there is an autoimmune or anti-tumor profile. Compare the lymphocyte infiltrates (TILs) of CFTs to determine the role of the BRAF mutation on the immune response.
Material and method: Observational study, retrospective with prospective immunohistochemical analysis. 95 patients with CFT and 29 patients with MB were included. Immunolabeling of LB, LTh1, LTh2, NK, LTreg and LT CD8 cells was performed. The labels PD1, PDL1, CTLA4, BRAF were searched. The architecture of the TILs has been described. A comparison of MB and CFT was performed using a Mann Whitney test.
Results: TILs were present in 50% of CFTs, was multifocal in 56.52% and peritumoral in
75% of cases. All lymphocyte subtypes were significantly more abundant in the MB group. PD1, PDL1 and CTLA4 were not expressed by the tumor cells. They were significantly more represented in the MB group. 62.39% of the CFTs expressed BRAFV600E which did not influence the TILs.
Conclusion: Immunohistochemistry did not discriminate TILs and thyroiditis. The poor
prognostic factor that is the presence of BRAFV600E does not depend on its action on the TILs. Immunotherapy can not be excluded.
11
Introduction
1) Les cancers de souche folliculaire de la thyroïde (CFT)
1.1) Définition et épidémiologie
Les cancers thyroïdiens différenciés de souche folliculaire (cancers papillaires, vésiculaires et folliculaires) sont les cancers thyroïdiens les plus fréquents (1). Les cancers papillaires et vésiculaires sont des cancers de bon pronostic avec une survie à 5 ans de 99% et 95% respectivement (2). Ils étaient plutôt rares en France il y a 30 ans mais l'incidence a augmenté entre 1980 et 2005, en particulier pour les cancers papillaires (3). Cette augmentation semble être liée à l'amélioration des pratiques diagnostiques en particulier au développement du recours à la cytoponction pour tout nodule suspect (4).
1.2) Physiopathologie
Les mécanismes moléculaires mis en cause sont une activation permanente de la voie des MAP Kinase par réarrangements des gènes RET/PTC ou par mutations ponctuelles sur les gènes RAS et BRAF(5). Les facteurs de risques des cancers papillaires sont un antécédent de radiothérapie dans l'enfance et la carence iodée (3).
Dans le cancer vésiculaire, il existe une activation préférentielle de la voie des PI3 kinase (5).
La protéine BRAF est une protéine kinase participant à la voie de signalisation des MAP
KINASE, voie ayant un rôle dans la différenciation et la prolifération cellulaire. Environ 45% des cancers papillaires de la thyroïde (PTC) présentent la mutation V600E de BRAF. La valeur diagnostique et pronostique de cette mutation a été largement étudiée et est de mauvais pronostic. Dans le cancer papillaire thyroïdien, l’approche transcriptomique retrouve une corrélation entre l’existence de mutation BRAFV600E et une diminution des transcrits codant des protéines comme le R de la TSH, la thyroglobuline mais aussi impliquées à la fois dans la biogenèse des hormones thyroïdiennes (Pax8, TTF1, TTF2…) et la captation iodée (symporteur NIS) (6).
12
Figure 1 : Schématisation de la tumorigenèse thyroïdienne selon Buffet et Groussin, MCED 2015 (5)
Bien qu’ayant une cancérogénèse différente, les cancers papillaires et vésiculaires de la thyroïde répondent aux mêmes recommandations thérapeutiques.
1.3) Thérapeutiques actuelles
Le traitement actuel du cancer papillaire de la thyroïde est la chirurgie par thyroïdectomie totale associée à un curage ganglionnaire non systématique et éventuellement complété par une dose d'iode 131 selon des critères précisés par les recommandations des sociétés savantes (4) .Certains de ces cancers sont cependant de moins bon pronostic et peuvent être iodo résistants ; les traitements sont alors les inhibiteurs des tyrosines kinases tels que le SORAFENIB. Cependant, ces traitements présentent des effets indésirables importants allant de l’hypocalcémie ou du syndrome pied-main à l’apparition de néoplasies secondaires comme décrit dans l’étude DECISION (7).
2) Les thyroïdites
La thyroïdite auto-immune est fréquente et se caractérise par la présence d’infiltrats
lymphocytaires. De nombreuses études aux résultats contradictoires ont discuté l’existence d’une thyroïdite auto-immune comme facteur prédisposant au cancer papillaire (8,9). La description d’un infiltrat lymphocytaire par les anatomopathologistes ne permet pas d'en préciser sa nature auto-immune ou réactionnelle anti-tumorale. De ce fait une confusion existe sur l’infiltrat, facteur causal de la carcinogenèse ou conséquence de la réponse immunitaire
13 adaptée antitumorale (10). Par exemple, une étude comparant un polymorphisme de l’IL-18 et de l’IL-10 a retrouvé un meilleur pronostic dans certains cancers thyroïdiens lorsque ce dernier était présent et augmentait la quantité d’IL-10. Celui-ci étant associé à la présence d’une thyroïdite lymphocytaire contrairement au polymorphisme de l’IL-18 (8). Alors qu’en parallèle ont été découvert des lymphocytes B induisant une tolérance du système immunitaire via l’IL-10 : les lymphocytes B10 (11).
3) Les lymphocytes infiltrants les tumeurs (TILs)
3.1) Définition, modèles et implications thérapeutiques
La présence de TILs a été étudiée dans de nombreux modèles carcinologiques comme les cancers ORL (12), les cancers de la vessie (13), les cancers du sein (14) mais aussi dans le mélanome (15).La valeur pronostique des TILs a été retrouvée dans certains sous types histologiques de cancer du sein, dans le mélanome et le cancer de la vessie. Leur présence indique le plus souvent un pronostic favorable en particulier pour le mélanome (16,17).
L’importance de l’étude des TILs est reconnue et a motivé la création de l’International Working TIL Group qui a permis d’établir un consensus pour caractériser les TILs dans le cancer du sein (18) par l’anatomopathologiste en pratique courante grâce à la coloration usuelle par Hémateine, Eosine, Safran (HES). Ainsi ils ont défini les TIL intratumoraux (it-TIL), stromaux (s-TIL) et les lymphocytes formant des structures lymphoïdes tertiaires au sein des tumeurs.
D’autres modèles de classification des TILs ont été décrits. En 1989, Clark et al. définissait l’infiltrat lymphocytaire dans le mélanome en tant que « Brisk », « Unbrisk » ou « Absent » (19) et en 2012 Azimi et al. préférait définir l’infiltrat par sa densité et sa distribution focal, multifocal ou diffuse (20).
Cependant, ces classifications semblent être difficilement reproductibles pour tous les cancers.
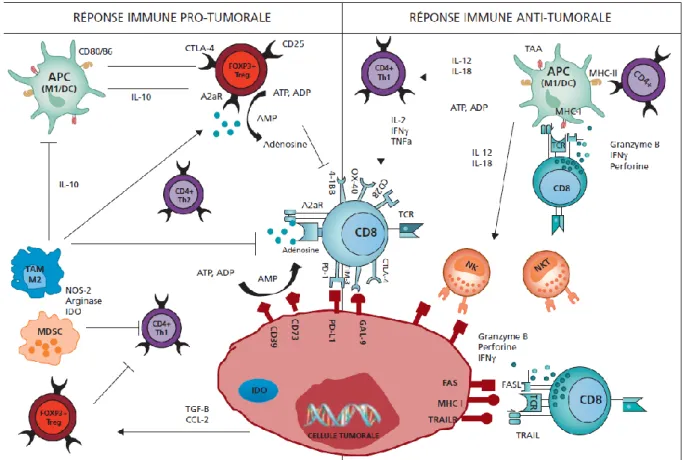
Pour ce qui est de la composition des cellules immunitaires infiltrant la tumeur, la littérature s’accorde sur le caractère antitumoral des LtCD8+ stimulés par les inhibiteurs de BRAF, LtCD4+ auxiliaire type Th1, les Lymphocytes B via leur rôle de présentation de l’antigène, les cellules NK et récemment les LcNKT(21) ainsi que les LcTγδ(22).
14 Les LcNKT sont reconnus comme ayant un rôle dans l'immunité anti-tumorale par leur capacité à réguler les cellules Natural Killer et leur action directe sur les cellules tumorales. Les LcTγδ à l'opposé des Tαβ représentés par les lymphocytes CD4+ et CD8+, ont été retrouvés dans différents cancers solides (sein,colon,rein) et auraient un rôle dans l'immunité anti-tumorale. Les lymphocytes Tγδ ne sont pas restreints par le CMH et la reconnaissance antigénique est donc différente des lymphocytes traditionnels. Ils représentent habituellement environ 3% des lymphocytes T. Des essais ont déjà tenté d'étudier leur caractère anti-tumoral avec des résultats prometteurs (23).
En ce qui concerne les lymphocytes ayant des caractéristiques pro tumorales, on retrouve les lymphocytes T régulateurs, ce qui semble admis d'un point de vue immunologique (24) mais aussi les LcTCD4+ Th2.
(cf figure 2).
Figure 2 : Interactions entre le système immunitaire et les cellules tumorales dans le cancer du sein. D’après Dushyanthen et al.(25)
15 Si leur importance pronostique a été étudiée, leur possible rôle thérapeutique l’a aussi été via l’induction d’une réponse immunitaire par l’Interleukin-2(IL-2)(26) ou le transfert adoptif de cellules (27,28).
Indirectement, l’immunothérapie par anti-CTLA-4 ou anti-PD1 repose aussi sur le phénotype de l’infiltrat anti-tumorale dans les cancers.
3.2) TILs et thyroïde
La présence d'un infiltrat lymphocytaire péri-tumoral dans les cancers papillaires de la
thyroïde est fréquente, de plus de 30% (29) que dans d'autres cancers thyroïdiens (29,30). La présence de ces infiltrats est un facteur de bon pronostic témoignant de la réponse immunitaire anti-tumorale avec une diminution de la récidive (31).
L’infiltrat lymphocytaire a été observé dans différents types de cancers : poumon, sein, colon.
La présence d’un infiltrat n’est cependant pas systématique. Certaines tumeurs développent un microenvironnement antigénique favorable à la néogenèse d’infiltrats lymphocytaires. Le pronostic de ces cancers avec infiltrat est meilleur ; cette observation a aussi été faite pour les mélanomes (32).
Certaines études ont montré, en comparant un tissu normal aux tissus présentant un cancer différencié de la thyroïde, une expression significativement plus importante de LcTCD3, LcTreg CD4+/FOXP3+,LcBCD20 et IL17 (produites par les lymphocytes Th17) dans les cancers différenciées de la thyroïde que dans le tissu normal (10) ;
D’autres études ont montré la présence de Treg et de lymphocytes double négatif (CD4- et CD8-) dans les cancers papillaires (33) en comparaison aux thyroïdites d'Hashimoto. La présence de lymphocytes Natural Killer (NK) ou de lymphocytes T régulateurs étaient respectivement associée à un meilleur ou à un moins bon pronostic chez les patients (34).
4) L’immunothérapie
4.1) Théories
L’immunothérapie est actuellement en plein essor. Même si la théorie de l’immunosurveillance (35) sur laquelle cette thérapeutique se base a été exposée il y a environ 50 ans par F.M Burnet, son application reste novatrice.
16 La théorie de l’immunosurveillance suggérait que les modifications des cellules tumorales pouvaient induire l’expression de nouvelles molécules antigéniques entrainant une réponse immunitaire et donc une régression tumorale. Robert Schreiber a adapté cette notion avec sa théorie des 3E selon laquelle l’interaction entre le système immunitaire et la cellule tumorale peut conduire à l’Elimination de la tumeur, à un Etat d’équilibre ou à un Echappement de la cellule tumorale au contrôle immunologique (36).
Aujourd’hui, l’immunothérapie est envisagée dans de nombreux cancers tels que le lymphome de Hodgkin, les cancers de la vessie et des AMM ont été obtenus pour les carcinomes à petites cellules du poumon et les mélanomes.
4.2) Bases immunologiques
La réaction immunitaire nécessite l’activation des lymphocytes T naïfs. Cette activation se fait grâce à la présentation de peptides antigéniques par les cellules présentatrices d’antigènes.
La présentation peut se faire via le CMH I qui activera les lymphocytes CD8+ ou le CMH II qui activera les lymphocytes CD4+.
Le premier signal activateur correspond à la liaison du TCR et du peptide. Le deuxième signal se fait grâce à la liaison de CD80 ou CD86, présents sur les cellules présentatrices d’antigène et de CD28 présent sur le lymphocyte T.
Cette liaison permet la production d’IL- 2 induisant la différenciation et la prolifération des lymphocytes T effecteurs.
Une fois ces lymphocytes activés un mécanisme de régulation entre en jeu grâce aux « immune checkpoint ».
4.3) Les « Immune Checkpoints »
Afin d’éviter toute prolifération inadaptée, des mécanismes inhibiteurs tels que la liaison CTLA-4 à CD80 ou CD86 ou la liaison PD-1 à PDL-1 ou PDL-2 entrent en jeu.
4.3.1) CTLA-4
CTLA-4 est un membre de la superfamille des immunoglobulines et présente des homologies avec CD28. La molécule est initialement intracellulaire puis, suite à l’activation des
17 lymphocytes, migre vers la membrane cellulaire, permettant ainsi la liaison avec la cellule présentatrice de l’antigène.
CTLA-4 se lie avec CD80 et CD86 avec une affinité supérieure au CD28. Cette compétition de liaison permet d’interrompre le second signal et donc d’inactiver le lymphocyte (37). Ce mécanisme permet d’éviter une prolifération incontrôlée et une auto-immunité.
CTLA-4 est donc impliqué dans un mécanisme nécessaire à la régulation lymphocytaire. Les souris KO pour CTLA-4 présente une prolifération lymphocytaire anormale entraînant une mort précoce.
4.3.2) Programmed Cell Death-1
PD1 fait aussi parti de la superfamille des immunoglobulines. Il est exprimé par les cellules T et B activées, son ligand principal est PD-L1 lui-même exprimé par les macrophages mais aussi après stimulation cytokinique sur différents tissus. L’autre ligand de PD-1 est PDL-2 qui est exprimé par les macrophages et les cellules dendritiques.
Lors de la liaison de PD-1 avec PD-L1, il existe une diminution de l’activité des cellules T activées. Contrairement au KO pour le CTLA-4, le KO de PD-1 n’entraine pas le décès chez la souris mais une autoimmunité en association avec un autre signal favorisant (38).
4.4) Applications thérapeutiques
En cancérologie, ces systèmes de régulation sont des voies thérapeutiques intéressantes. Il existerait un phénomène d’échappement des cellules tumorales au système immunitaire par l’activation de ces points de contrôles immunologiques. L’expression de CTLA-4 et de PD-L1 par les cellules tumorales permettraient l’inactivation des lymphocytes.
Parmi les cancers ciblés par l’immunothérapie tels que les cancers pulmonaires à petites cellules ou le lymphome, le mélanome reste le modèle néoplasique le plus étudié.
L’immunothérapie se discute pour les mélanomes métastatiques non résecables (stade IIIc, IV). Les traitements à ce jour disponibles sont les anticorps anti-PD1 comme le NIVOLUMAB, le PEMBROLIZUMAB, le PIDILIZUMAB et les anticorps anti-CTLA-4 comme l’IPILIMUMAB. D’autres molécules sont à l’étude telles que les anticorps anti-PDL1.
18 On note des similitudes dans la tumorigenese du mélanome et du cancer papillaire de la thyroïde telles que la présence d’une mutation BRAFV600E mais aussi la présence d’un infiltrat lymphocytaire important dans ces deux tumeurs.
Ainsi, l’étude de l’immunothérapie en traitement des cancers réfractaires à l’iode en prenant pour modèle le mélanome semble cohérent.
5) Autoimmunité, BRAF et immunothérapie
La présence de la mutation BRAF conduit à la moindre synthèse de certaines protéines
habituellement immunogéniques ; la présence de BRAF pourrait donc rendre les cellules tumorales moins immunogènes et l’absence d’infiltrat réactionnel pourrait concourir au mauvais pronostic. Cela a été retrouvé dans les mélanomes présentant une mutation BRAF : les inhibiteurs de BRAF permettaient d'augmenter les lymphocytes cytotoxiques CD8+, laissant supposer une meilleure reconnaissance tumorale (39,40).
Les TILs semblent avoir un rôle pronostic favorable majeur selon les cellules qui constituent
l’infiltrat (41) mais ne semblent pas à eux seuls être un marqueur de réponse à l’immunothérapie (42).
Les thyroïdites auto-immunes sont décrites soit comme étant associées à une réponse
favorable et à l’absence de mutation BRAFV600E (43) soit comme étant le lit du cancer papillaire de la thyroïde. L’étude des sous types phénotypiques de l’infiltrat lymphocytaire intra ou péritumoral et de la thyroïdite n’a cependant pas été réalisée.
L’expression de PD-1 par les cellules lymphocytaires ou tumorales et la réponse à
l’immunothérapie n’est pas établie. Une association entre l’expression tumorale ou des
cellules immunes de PD-L1 et la réponse à l’immunothérapie est quant à elle discutée et a
déjà été retrouvée (42). Ainsi PDL-1 semblerait être un marqueur prédictif plus approprié, bien qu’imparfait. Effectivement, il existerait une variabilité d’expression selon l’échantillon étudié et pourrait être augmenté localement par des phénomènes inflammatoires ou par certaines mutations génétiques.
L’expression de CTLA-4 par les cellules tumorales et immunitaires a aussi été étudié comme
marqueurs de réponse à l’immunothérapie (44). Ce qui ressortait de cette étude était que l’expression importante de CTLA-4 par les lymphocytes était un marqueur de réponse positive à l’immunothérapie si l’expression de CTLA-4 était faible dans les cellules tumorales du cancer du sein.
19 Les objectifs de cette étude sont :
1-Décrire et phénotyper les infiltrats lymphocytaires présents chez les patients opérés d’un cancer de souche folliculaire de la thyroïde pour différencier la thyroïdite autoimmune de l’infiltrat antitumoral par l’étude de
a/ l’organisation architecturale des lymphocytes b/ l’étude des marqueurs de surface lymphocytaire
c/l’expression de PD1,PDL1 et CTLA4 par les cellules immunitaires
Les pièces opératoires de cancer de souche folliculaire de la thyroïde seront comparées aux pièces opératoires de maladie de Basedow. Les phénotypes des TILs seront comparés, en cas de thyroïdite dans les pièces opératoires des cancers de souche folliculaire, aux phénotypes de thyroïdite lymphocytaire chronique.
2-Etudier l’influence de la mutation BRAF sur la présence d’un infiltrat lymphocytaire en comparant la prévalence de l’infiltrat chez les patient BRAF - vs BRAF+, l’organisation architecturale et les profils lymphocytaires.
3-Comparer l’expression des marqueurs lymphocytaires entre les CFT et la thyroïdite adjacente
4- Comparer l’expression des marqueurs lymphocytaires entre les CFT provenant de deux localisations thyroïdiennes disctinctes
20
Matériel et méthodes
1) Type d'étude
Etude observationnelle, rétrospective avec recueil prospectif des données permettant la comparaison de pièces opératoires de patients ayant bénéficié d'une thyroïdectomie pour cancer thyroïdien de souche folliculaire à celles d’un groupe témoin de patients ayant bénéficié d'une thyroïdectomie totale pour maladie de Basedow.
L’étude s’est déroulée au CHU d’Amiens, dans le service d'Anatomie et de Cytologie Pathologiques (ACP) dirigé par le Pr Sevestre entre Mai et Novembre 2016.
2) Période d’inclusion
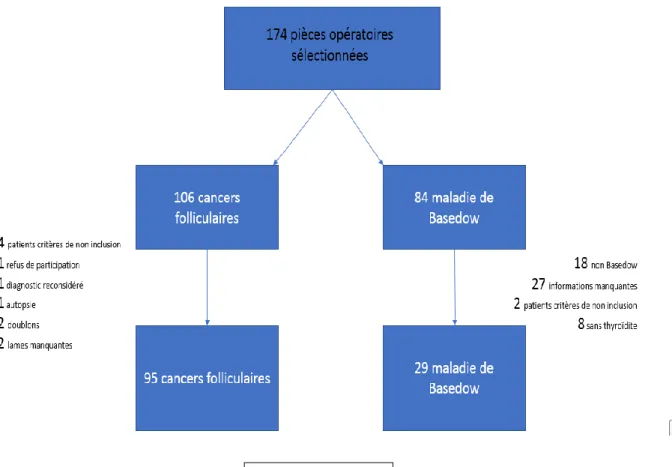
Les pièces opératoires ont été incluses du 01/01/2010 au 01/04/2016 permettant de retrouver 102 cas de cancers papillaires de la thyroïde, 4 cas de cancers vésiculaires de la thyroïde et 68 cas de maladie de Basedow. Afin d’obtenir un groupe de Basedow satisfaisant, les données cliniques manquantes ont été récolté auprès des endocrinologues de ville et l’inclusion a été étendue jusqu’au 01/07/2016 retrouvant un cas exploitable (3 patients retrouvés dont 2 sans thyroïdite) et à l’année 2009 où sur 13 cas, 3 patients ont pu être inclus (4 non basedow, 4 informations manquantes et 2 cas sans thyroïdite en HES).
Les pièces opératoires ont été incluses de façon consécutive à partir du logiciel du service d’Anatomie et de Cytologie Pathologique DIAMIC et du thesaurus ADICAP. Les données cliniques ont été récupérées grâce au logiciel DxCARE du CHU d’Amiens. Les termes du thesaurus ADICAP sélectionnés ont été « thyroïde » (ET), « maladie de Basedow » (0240), « adénocarcinome papillaire » (A7D0-A7D1-A7D2-A7D3-A7D4-A7D6-A7D7-A7D8-A7D9) et « adénocarcinome vésiculaire » (A6G1-A7G1-A7G2-A7G3-A7G4-A7G6-A7G7-A7G8-A7G9).
3) Critères d’inclusion
Ont été inclus, pour les cas, les pièces opératoires des patients ayant été opérés entre le 01/01/2010 et le 01/04/2016 d’une thyroïdectomie totale ou partielle pour toutes causes avec un diagnostic de cancer papillaire ou vésiculaire de la thyroïde posé après étude anatomopathologique.
21 Ont été inclus, pour les témoins, les pièces opératoires des patients ayant été opérés entre le 01/01/2009 et le 01/07/2016 d’une thyroïdectomie totale pour maladie de Basedow.
Le diagnostic de maladie de Basedow était vérifié dans les dossiers médicaux informatisés des patients, sur la base de données DXCARE ou dossiers médicaux papiers des endocrinologues de ville et était défini comme :
- une hyperthyroïdie avec TSH inférieure aux normes du laboratoire, anticorps anti récepteur de la TSH positifs et/ou profil basedowien sur l’échographie ou la scintigraphie.
4) Critère de non inclusion
Les patients présentant une maladie de Basedow et un cancer de souche folliculaire étaient exclus.
5) Population d’étude
Parmi les 106 patients du groupe cancer folliculaire, 95 ont été inclus et parmi les 84 maladie de Basedow, 29 ont été inclus (cf. diagramme de flux).
22 6) Déroulement de l’étude
6.1) Sélection des blocs tissulaires
Une relecture de toutes les pièces opératoires a été réalisée par la thésarde et un anatomopathologiste expérimenté. La relecture a permis de confirmer le diagnostic initial de cancers thyroïdiens de souche folliculaire dans un premier temps puis d’étudier l’infiltrat lymphocytaire de la thyroïde saine et de la zone tumorale.
Ont été différenciés l’infiltrat lymphocytaire en zone saine traduisant une thyroïdite (T) sous-jacente et les lymphocytes infiltrant la tumeur (TILs). Les lymphocytes infiltrant la tumeur ont été définis par la présence de lymphocytes dans le stroma tumoral, en intra tumoral et en périphérie de la tumeur.
Les lymphocytes infiltrant la tumeur ont été classés en plusieurs sous-groupes : M pour multifocal, D pour diffus, F pour focal et C lorsque des centres clairs étaient présents.
Pour chaque patient, ont été sélectionnées les lames contenant un cancer thyroïdien de souche folliculaire et le nombre de lymphocytes infiltrant la tumeur le plus important, ainsi qu’une lame correspondant à un ganglion métastatique et à une thyroïdite lorsque cela était possible.
Cette étape a permis de définir la présence ou non de thyroïdite, de lymphocytes infiltrant la tumeur ainsi que leur caractérisation architecturale et leur quantification.
Les lames sélectionnées ont ensuite permis de récupérer les blocs tissulaires inclus en paraffine correspondants.
6.2) Immunomarquage
Les blocs tissulaires, correspondant aux cancers thyroïdiens de souche folliculaire, ont été répartis en 2 groupes selon la présence ou non de lymphocytes infiltrant la tumeur.
Lorsque ceux-ci étaient absents, les immunomarquages étaient réalisés sur la tumeur et correspondaient à :
- Ac anti-BRAFV600E Clone : VE1 (Eurobio) ; Ac anti-PDL1 Clone : SP142 (Ventana, Roche) et Ac anti-PD1 Clone : Nat 105 (Ventana, Roche); CTLA-4 Clone : BSB 88 (Diagomics).
23 En plus des immunomarquages précédant, lorsque les lymphocytes infiltrant la tumeur étaient présents, étaient effectués :
Ac CD3 Clone : f7.2.38 (Dako) ; Ac CD4 Clone : SP35 (Ventana, Roche); Ac anti-CD8 Clone: 1A5 (Tebu); Ac anti-GATA3 Clone: L50-823 (Ventana, Roche); Ac anti-TBET Clone: MRQ-46 (Ventana, Roche); Ac anti-CD20 Clone:L26 (Dako); Ac anti-HLA DRa Clone: EP96 (Diagomics); Ac anti-CD25 Clone: 4C9 (Microm) ; Ac anti-FoxP3 Clone: Poly (Ventana, Roche) ; Ac anti-CD16 Clone: SP175 (Ventana, Roche) ; Ac anti-CD56 Clone: 123C3 (Dako);
En ce qui concerne le groupe témoin, les blocs tissulaires ont tous été étudiés pour les différents marqueurs décrit ci-dessus (à l'exception de BRAFV600E).
Les immunomarquages ont été réalisés sur un automate Benchmark Ultra (Ventana ; Roche). 6.3) Recueil des données
Les renseignements cliniques que sont l’âge, le sexe, un tabagisme actif, la présence d’Ac anti TPO ou anti TG ont été récoltés pour les cas et les témoins. Le recueil du stade TNM, du statut à distance (la rémission) et de la réalisation d’un traitement par iode ont été ajoutés pour les cas.
Ont été étudiés pour chaque pièce opératoire de cancers de souche folliculaire sélectionnées, la localisation des lymphocytes infiltrant la tumeur, leur quantité, leur architecture, la présence d’une thyroïdite sous-jacente, la taille du carcinome, le nombre de ganglions atteints, le type de cancer ainsi que l’expression des marqueurs immuno histochimiques testés.
7) Analyse statistique
7.1) Comparaison cas-témoins
Les variables quantitatives de densité de marqueurs sont exprimées en pourcentage moyen +/- écart-type et sont comparées par un test non paramétrique de MannWhitney. Les pourcentages des sous types lymphocytaires sont des sommes des pourcentages des densités des différents marqueurs définissant ces sous types lymphocytaires.
Les variables qualitatives sont décrites par leur fréquence. Les variables qualitatives sont comparées à l'aide d'un test du Khi-2 ou d'un test exact de Fisher.
24 Pour l'objectif principal, le risque de première espèce est fixé à 5%. Il en est de même pour les objectifs secondaires.
L'analyse des objectifs secondaires a été effectuée sur l'ensemble des cas complets. Tous les patients inclus à l’exception de ceux ayant fait objection de l’utilisation de leurs données, sont inclus dans les analyses statistiques.
7.2) Analyse en sous-groupes
Les cancers de souche folliculaire ont donc été classés, après analyse immunohistochimique en deux groupes, selon la présence d’une mutation V600E de BRAF. Une comparaison concernant la présence, la quantité, le type de lymphocytes infiltrant la tumeur entre les groupes BRAFV600E+ et BRAFV600E- a été réalisée.
8) Ethique
Les patients ont tous reçu une lettre d’information concernant la recherche afin de s’assurer de leur non opposition au projet.
L’étude a bénéficié d’un avis favorable par le CPP Nord-Ouest II n° 2016/39 du 08/09/2016.
9) Financement
Les immunomarquages ont été financés par l'UF Tuthyref dont les fonds sont donnés aux centres affiliés au réseau national Tuthyref (Tumeurs de la Thyroïde Réfractaires, référent Pr Desailloud). La thésarde a bénéficié d’une bourse année recherche subventionnée par l’ARS PICARDIE et du soutien du service d’anatomie et de cytologie pathologiques du CHU d’Amiens.
25
RESULTATS
1) Patients inclus
Au total, sur les 174 pièces opératoires sélectionnées nous avons inclus 95 patients présentant un cancer folliculaire de la thyroïde et 29 patients présentant une maladie de Basedow.
2) Description de la population d’étude (cf Tableau 1)
L’âge moyen des patients dans le groupe CFT était de 52 +/- 14 ans contre 40 +/- 15 années dans le groupe MB. La population était principalement féminine dans les deux groupes (80 et 82 % respectivement). Dans les groupe CFT, il s’agissait principalement de microcarcinome (54 %) majoritairement classé T1 soit < 2 cm et intra thyroïdiens. La présence ou non de ganglions atteints ou de métastases étaient rarement connu lors de la RCP qui nous a servi de référence.
26
Tableau 1: Caractéristiques des patients
Caractéristiques CFT (N=95) MB (N=29)
Age (moy +/- écart-type) 52 +/- 14 40 +/- 15 données manquantes = 1
Sexe feminin 76 (80 %) 23 (82 %) données manquantes = 1
Tabagisme connu données manquantes = 81 8 (53 %) NA
Ac anti TPO positif 4 (20 %) données manquantes = 77 12 (92 %) données manquantes = 16
Ac anti TG positif 6 (12 %) données manquantes = 45 4 (57 %) données manquantes = 22
Présence d'une ophtalmopathie NA 9 (39 %) données manquantes = 6 Rémission données manquantes = 3
OUI 66 (71 %) NA
NON 8 (9 %) NA
Perdu de vue 19 (20%) NA
Durée en mois (moy +/- ecart-type) données manquantes = 31 29 +/- 20 NA
TNM NA T données manquantes = 2 T1 51 (54 %) NA T1a 7 (7%) NA T1b 2 (2 %) NA T2 9 (10%) NA T3 18 (19 %) NA T4 7 (7 %) NA N données manquantes = 2 N- 1 (1 %) NA N0 18 (19 %) NA N1a 16 (17 %) NA N1b 11 (12 %) NA Nx 48 (51%) NA M données manquantes = 4 M0 3 (3 %) NA M1 4 (4 %) NA Mx 85 (92 %) NA
Irathérapie données manquantes = 3 59 (66 %) NA
Nombre de doses d'iode si > 1 (moy +/- ecart-type) 2 +/- 1 NA
Microcarcinome 61 (54 %) NA
27 3) Comparaison des clusters lymphocytaires entre les deux groupes
Une lame de chaque patient ayant un CFT a été retenue pour la comparaison. La comparaison individuelle des différents clusters lymphocytaires conclut à une différence significative entre les deux groupes pour tous les clusters recherchés (cf tableau 2).
Tableau 2 :
Cluster (moy +/- ecart-type)(%) CFT (N=95) MB (N=29) P<0.05
PD1 données manquantes = 2 5,29 +/- 10,05 données manquantes = 1 21,54 +/- 16,80 < 0,0001 PDL1 données manquantes = 32,92 +/- 7,06
7,93 +/- 9,31
données manquantes = 1 0,0002
CTLA4 données manquantes = 3 5,12 +/- 6,24 données manquantes = 1 9,54 +/- 7,90 0,0043
CD3 données manquantes = 121,87 +/- 24,28 35,52 +/- 15,49 0,0003 CD20 données manquantes = 1 34,53 +/- 32,76 68,62 +/- 16,42 <0,0001 CD4 données manquantes = 1 38,96 +/- 36,45 68,28 +/- 14,66 0,0001 CD8 données manquantes = 115,44 +/- 15,75 31,72 +/- 14,66 <0,0001 CD16 7,34 +/- 11,39 données manquantes = 110,64 +/- 12,30 0,0108 CD56 données manquantes = 20,24 +/- 1,34 3,86 +/- 15,12 0,0065 FOXP3 données manquantes = 12,90 +/- 5,34
3,41 +/- 4,06
données manquantes = 2 0,0005
TBET 2,97 +/- 5,35 9,45 +/- 12,46 <0,0001
GATA3 15,36 +/- 20,36 données manquantes = 235,15 +/- 18,11 <0,0001 CD25 données manquantes = 1 11,23 +/- 15,63 données manquantes = 1 13,93 +/- 16,92 0,0023 HLA Dra données manquantes = 113,02 +/- 20,64
23,93 +/- 22,33
données manquantes = 1 <0,0001
En couplant les clusters afin d’obtenir les sous types lymphocytaires nous retrouvons une nouvelle fois une différence significative pour tous les sous types lymphocytaires (cf tableau 3).
28 Tableau 3 :
Sous types
lymphocytaires (%)
(moy +/- ecart type) CFT (N=95) MB (N=29) P<0.05
Lymphocyte B données manquantes = 257,36 +/- 59,70
128,21 +/- 25,54
donnée manquante = 1 <0,0001
Lymphocyte Th2 donnée manquante = 170,36 +/- 76
134,37 +/- 26,24
donnée manquante = 1 0,0002
Lymphocyte Th1 donnée manquante = 1 58,24 +/- 60,83 113,24 +/- 23,34 0,0001 Lymphocyte T CD8 donnée manquante = 1 35,00 +/- 37,96 67,24 +/- 20,16 0,0002 Lymphocyte T régulateur donnée manquante = 146,62 +/- 49,67
85,26 +/- 28,31
données manquantes = 2 0,0014
Cellule NK 41,64 +/- 43,87 manquantes = 2données
83,21 +/- 22,55
donnée manquante = 1 0,0001
4) Expression de BRAF, caractéristiques de l’infiltrat lymphocytaire
Pour cette analyse nous avons utilisé les lames de CFT comme précédemment mais aussi les lames correspondant à une seconde localisation cancéreuse dans un lobe thyroïdien différent. Nous avons retrouvé 62.39 % lames de CFT exprimant BRAF. L’infiltrat lymphocytaire était présent dans la moitié des CFT et était majoritairement multifocal (56.52 %) et péritumoral (75 %). Une thyroïdite était associée dans ¼ des cas (24.56 %).
29 Tableau 4 :
Caractéristiques CFT(N=117)
BRAF positif données manquantes = 4 73 (62,39 %) Présence d'un infiltrat lymphocytaire 48 (50 %) Type d'infiltrat données manquantes = 2
Diffus 6 (13,04 %)
Focal 8 (17,39 %)
Multifocal 26 (56,52 %)
Centre clair 6 (13,04 %)
Localisation de l'infiltrat lymphocytaire
Intratumorale 7 (14,58 %)
Péritumorale 36 (75 %)
Intratumorale et péritumorale 5 (10,42 %) Présence d'une thyroïdite associée 28 (24,56 %)
5) Comparaison de l’infiltrat lymphocytaire et des différents clusters en fonction de l’expression de BRAF (Annexe 1)
La comparaison des différents clusters lymphocytaires entre les CFT exprimant BRAF et ceux ne l’exprimant pas ne retrouve pas de différence significative (PD1, p=0.959 ; PDL1, p=0.418 ;CTLA4,p=0.584 ;CD3,p=0.091 ;CD8,p=0.398 ;CD4,p=0.083 ;GATA3,p=0.168 ;CD 56;p=0.581 ;FoxP3,p=0.566 ;CD25,p=0.073 ;CD20,p=0.500 ;tbet,p=0.721 ;CD16,p=0.545 ;H LA Dra, p=0.954).
Il n’est pas non plus retrouvé de différence significative entre la présence ou non d’un infiltrat lymphocytaire (p = 0.378), le type d’infiltrat lymphocytaire (p = 0.146), la localisation de l’infiltrat lymphocytaire (p = 0.587) et la présence d’une thyroïdite (p = 0.934) selon l’expression de BRAF.
6) Comparaison des clusters lymphocytaires des lames de CFT et de la thyroïdite adjacente (Annexe 2)
Afin de voir si les TILs différaient de la thyroïdite adjacente, nous avons comparé les clusters lymphocytaires des TILs et des lames de thyroïdite. Ces lames étaient sélectionnées en même temps que la lame CFT et appartenaient au même patient.
Il a été retrouvé une différence significative pour tous les clusters (PD1,p=0.0005 ; PDL1,p=0.039 ;CD3,p=0.042 ;CD8,p=0.031 ;CD4,p=0.002 ;GATA3,p=0.014 ;FoxP3,p=0.04 8 ;CD25,p=0.025 ;CD20,p=0.002 ;TBET,p=0.003 ;CD16,p=0.024 ;HLA Dra,p=0.001) sauf
30 CTLA4 (p=0.422) et CD56 (p=0.159). Le seul sous type lymphocytaire ne présentant pas de différence significative était les lymphocytes T CD8.
7) Comparaison des clusters lymphocytaires entre les CFT multifocaux (Annexe 3)
Afin de savoir si les CFT étaient tous de même composition lymphocytaire nous avons comparé les lames de CFT des patients présentant des cancers multifocaux. Il n’a pas été retrouvé de différence significative entre ces 2 sous-groupes pour les différents clusters (PD1,p=0.628 ;CTLA4,p=0.194 ;CD3,p=0.482 ;CD8,p=0.727 ;CD4,p=0.447 ;GATA3,p=0.98 6 ;CD56,p=0.390 ;FoxP3,p=0.690 ;CD25,p=0.993 ;CD20,p=0.718 ;TBET,
31
DISCUSSION
Sélection des patients
L’intérêt de l’étude de l’infiltrat lymphocytaire des cancers folliculaires de la thyroïde est thérapeutique et prédictif. S’agissant d’un cancer de bon pronostic les patients ciblés par ces nouvelles thérapeutiques seraient donc ceux présentant un cancer réfractaire à l’iode. L’une des limites de notre étude est la faible représentation de ce type de patient. Effectivement, compte tenu de la rareté de cette résistance seul un patient dans notre cohorte présentait un cancer réfractaire à l’iode. Les conclusions de notre étude seront donc difficilement attribuables à ces patients en particulier. Une durée de recueil plus importante aurait pu être intéressante, la méthodologie restant adaptée. Cependant, on peut supposer le bénéfice d’un traitement précoce par immunothérapie lorsque la pathologie est décelée précocement. De plus, en dehors de l’intérêt thérapeutique, nous recherchions un intérêt prédictif de la présence de TILs ou d’une thyroïdite associée. En étudiant les sous types lymphocytaires de ces deux entités nous pensions les associer à des lymphocytes anti ou pro tumoraux, ce que nous n’avons pas pu réaliser. De nouveau, compte tenu du faible effectif de patients iodorésistants nous n’avons pas pu associer la présence de TILs à la rémission même si la littérature nous oriente vers cette hypothèse (31) . En ce qui concerne la thyroïdite auto-immune la question reste entière.
Définition et classification des TILs
Les données de la littérature concernant les TILs sont limitées. Les cancers où ils ont été le plus étudiés sont le mélanome et le cancer du sein. Les lymphocytes infiltrant la tumeur sont considérés comme tels pour le cancer du sein lorsqu’ils se trouvent dans le stroma tumoral, en intra tumoral mais aussi en périphérie au contact direct de la tumeur dans le mélanome. Les données concernant les cancers thyroïdiens et en particulier folliculaires sont inexistantes. Nous avons donc choisi une définition large des TILs incluant les lymphocytes stromaux, intra tumoraux et au contact de la tumeur.
L’étude architecturale de ces TILs est aussi peu détaillée. Nous avons pris pour modèle la classification utilisée par Clark qui fut le premier à décrire les TILs dans le mélanome. Cependant, il existe de grandes différences entre ces deux types de cancer. Nous avons donc repris une classification qui nous semblait plus facilement applicable au cancer folliculaire de la thyroïde décrite par Azimi (20).
32 L’absence de consensus anatomopathologique sur la définition et l’étude architecturale des TILs de façon globale ou propre à chaque cancer limite la reproductibilité de notre travail et les conclusions que nous pouvons en retirer.
Choix des TILs
Les sous types lymphocytaires à explorer ont été choisis en fonction des données de la littérature. Une sélection des lymphocytes ayant un rôle anti tumoral et pro tumoral admis a été réalisée. Les lymphocytes T ont été choisis en recherchant les lymphocytes orientés Th2 et Th1, les premiers ayant un rôle dans la tolérance immunitaire et les seconds ayant plutôt un rôle antitumoral. Les lymphocytes B ont été recherchés pour leur capacité de présentation d’antigène et leur état d’activation a été étudié grâce à la recherche de HLA Dra (marqueurs de différenciation tardif des lymphocytes B). Une recherche de T régulateurs (pro tumoraux) et de lymphocytes T NK (anti tumoraux) a été réalisée ce qui avait d’ailleurs déjà été effectué (34). Le caractère pro et anti tumoral des sous types lymphocytaires reste cependant hypothétique et le choix des sous types lymphocytaires reste discutable.
Certains lymphocytes auraient été intéressants à étudier tels que les lymphocytes T gamma delta et NKT cependant l’étude anatomopathologique de ces cellules n’est actuellement pas réalisable devant l’absence d’anticorps spécifiques et fiables disponibles. Une autre méthode d’analyse par cytométrie de flux serait plus adaptée pour rechercher ces lymphocytes et à réaliser pour poursuivre cette étude. Nous n’avons donc pas pu étudier tous les sous types lymphocytaires discriminants le caractère pro ou anti tumoral.
Par ailleurs, la recherche de l’expression de CTLA-4 et PD1 est parfois utilisée dans le mélanome ou le cancer pulmonaire cependant nous avons peu de recul concernant ces marqueurs. On ne peut ainsi exclure totalement la présence de faux positifs ou de faux négatifs intrinsèques à la qualité de l’anticorps utilisé.
Sélection des anticorps pour l’étude immuno-histochimique
Pour chaque sous types lymphocytaires à étudier, une sélection de marqueurs phénotypiques discriminants a été élaborée grâce aux immunologistes du CHU d’Amiens. A l’heure actuelle, il n’existe pas de document officiel reconnu permettant d’établir les marqueurs à rechercher pour caractériser les sous types lymphocytaires. L’absence de référence peut induire un défaut de reproductibilité. De plus, certains marqueurs sont aussi exprimés par d’autres cellules immunitaires, nous imposant une recherche couplée de certains marqueurs phénotypiques
33 compliquant la lecture des pièces opératoires. La recherche des anticorps commercialisés pour étude immuno histochimique sous paraffine a été réalisée par la suite. Les anticorps ont été sélectionnés parmi ceux spécifiquement étudié sur lame paraffinée et en fonction de leur utilisation dans la littérature. Pour certains anticorps récents nous n’avions cependant pas de recul et de données de littérature tel que pour l’anticorps anti PDL1.
La qualité de l’anticorps utilisé, l’absence de consensus concernant les marqueurs phénotypiques à rechercher pour chaque sous type lymphocytaire constituent une limite à notre recherche. L’étude de marqueurs couplés aurait pu être réalisé sur une même lame grâce à différents fluorochromes mais aurait entrainé un cout démultiplié.
Lecture des prélèvements en HES et immunohistochimie
Le diagnostic de cancer folliculaire a été confirmé par un anatomopathologiste expérimenté. La lame du cancer de type folliculaire était sélectionnée en fonction de la quantité de lymphocytes présents. Cependant, il ne s’agissait pas forcément de la lame la plus représentative. Une surestimation de l’infiltrat lymphocytaire attribué à un cancer folliculaire a donc été possible par un biais de sélection. Cette surestimation n’a pas eu de conséquences statistiques aux vu des résultats.
La découpe des blocs et l’analyse immuno histochimique a été réalisé par les techniciens du laboratoire d’anatomopathologie limitant les erreurs pré analytiques.
La lecture des lames d’immuno histochimie n’a été réalisée que par la thésarde non anatomopathologiste pouvant induire des erreurs d’interprétation au niveau des lames.
Par ailleurs, l’étude quantitative des sous types lymphocytaires s’est faite par estimation visuelle pouvant expliquer une variabilité des valeurs opératrice dépendante.
Population d’étude
Les deux groupes présentaient une population majoritairement féminine ce qui était attendu compte tenu de la prévalence des dysthyroïdies chez les femmes. Dans le groupe CFT, la majorité des patients présentait des microcarcinomes (66%) et peu nécessitaient une irathérapie répétée (5 patients). Ces caractéristiques sont représentatives de l’évolution des CFT en général. Cependant, notre étude a pour but d’argumenter la prescription de l’immunothérapie dans les cas de cancer thyroïdien réfractaire à l’iode. Les cancers, dans notre étude, nécessitant une irathérapie répétée n’étaient pas des microcarcinomes et
34 présentaient pour 3 cas sur 5 patients un infiltrat lymphocytaire. La population étudiée ne semble pas être la population ciblée par ce traitement ce qui impose de modérer les conclusions de ce travail. Une sélection des cancers réfractaires à l’iode serait probablement plus adaptée mais compte tenu de leur rareté aurait été compliqué. Une comparaison statistique afin de rechercher une différence entre l’infiltrat lymphocytaire des cancers nécessitant une irathérapie répétée et les autres n’aurait par ailleurs aucune valeur compte tenu du faible effectif. Cependant la prise en charge des CFT est actuellement discutée. L’évolution naturelle d’un microcarcinome serait dans un tiers des cas l’évolution vers un cancer évolutif, dans un tiers des cas la stabilité et dans un tiers des cas la régression. Cependant, la thyroïdectomie est actuellement en première ligne thérapeutique. Il s’agit donc d’une prise en charge chirurgicale pouvant avoir des effets secondaires importants. La place de l’immunothérapie pourrait donc à terme se discuter plus tôt dans la prise en charge oncologique. La population de notre étude pourrait nous aider à conclure sur une prise en charge précoce.
Comparaison des cellules immunitaires entre CFT et MB
Un infiltrat lymphocytaire était présent dans 50% des cas de CFT. Ce qui est plus important des 30 % décrit dans la littérature (29) Il a été retrouvé une différence significative entre les deux groupes pour toutes les cellules immunitaires étudiées en faveur du groupe MB. Qu’il s’agisse de lymphocyte pro ou anti tumoral. Ce résultat témoigne d’un biais d’analyse lors de la lecture des lames d’immunohistochimie. La richesse de l’infiltrat immunitaire étant plus important, une surestimation du nombre de marqueurs phénotypiques a dû apparaitre compte tenu de la méthode visuelle. Une pondération au nombre de lymphocyte aurait permis d’atténuer ce biais. Il semble ainsi difficile de conclure sur le caractère pro ou anti tumoral de la thyroïdite autoimmune.
Comparaison PD1, PDL1 et CTLA4 entre CFT et MB
Une différence significative a été retrouvé entre l’expression de PD1, PDL1 et CTLA4 entre les deux groupes. Un biais identique au précédent semble de nouveau en cause. Cependant, il n’a pas été retrouvé d’expression tumorale de ces marqueurs. Dans le groupe CFT, ces marqueurs phénotypiques ont toujours été retrouvé sur les TILs et non les cellules cancéreuses.
35 La mutation BRAF V600E était présente dans 62.39 % des CFT étudié, ce qui correspond à la prévalence attendue. La présence d’une mutation V600E de BRAF n’a pas modifié l’infiltrat lymphocytaire des CFT que ce soit dans son organisation, son abondance ou sa qualité. Nous nous attendions à un infiltrat moins abondant en présence de la mutation. Le marqueur de mauvais pronostic qu’est la présence de cette mutation ne semble pas passer par une moindre réponse du système immunitaire par défaut de présentation antigénique. L’étude de Bastman (45) a elle retrouvée des TILs plus abondants en présence d’une mutation V600E de BRAF avec cependant toujours une absence de différence entre l’expression de marqueurs phénotypiques type FoxP3,CD8,PD1 et PDL1.
Comparaison entre TILs et thyroïdite dans les CFT
En comparant les TILs et la thyroïdite lorsqu’elle était présente dans le CFT on retrouve une différence significative pour la plupart des sous types lymphocytaires en dehors des Lt CD8 et de CTLA4. La différence significative sur les différents sous types lymphocytaires peut de nouveau être en lien avec une surestimation visuelle des marqueurs puisque ces derniers sont tous plus importants dans le groupe thyroïdite. Pour le CTLA4 et les lymphocytes T CD8, l’absence de différence significative semble être lié à l’effectif.
Comparaison entre CFT
Nous avons ensuite comparé les CFT multifocaux entre eux afin de savoir si la nature de l’infiltrat pouvait être différente selon la localisation du cancer pour un même patient et savoir si l’infiltrat retrouvé était représentatif et non une erreur d’échantillonnage. Comme attendu, nous n’avons pas retrouvé de différence significative pour les différents sous type lymphocytaire : seul le PDL1 variait. Il semble que la qualité de l’anticorps et l’interprétation visuelle soit en cause.
36
CONCLUSION
Le cancer de souche folliculaire de la thyroïde est un cancer ayant un infiltrat intra tumoral fréquent. Cet infiltrat a très peu été étudié. Nous n’avons pas retrouvé d’expression tumorale de PD1, PDL1 et CTLA4. Ces marqueurs ne sont pas plus riches dans les CFT que dans les MB en ce qui concerne les cellules immunitaires. Aucune typologie d’infiltrat lymphocytaire des CFT n’a pu être faite du fait des limites d’interprétation immunohistochimiques. La fréquence de l’infiltrat lymphocytaire nous laisse penser que l’utilisation de l’immunothérapie reste une option pour les patients réfractaire à l’iode même si nous n’avons pas pu faire ressortir la présence préférentielle d’un infiltrat anti tumoral. Le rôle de la thyroïdite comme lit du cancer ou comme facteur antitumoral reste débattu dans la littérature.
37 Annexe 1 : Comparaison des marqueurs en fonction de la présence d’une mutation BRAF V600E
Clusters (%) (moy +/-ecart-type) BRAF V600E + (N=73) BRAF V600E - (N=44) p < 0,005
PD1 4,24 +/- 9,44 donnée manquante = 1 4,69 +/- 9,61 données manquantes = 2 0,959
PDL1 2,14 +/- 6,36 donnée manquante = 1 3,00 +/- 6,89 données manquantes = 2 0,418 CTLA4 5,14 +/- 6,56 données manquantes = 2 4,81 +/- 5,38 donnée manquante = 1 0,584 CD3 24,93 +/- 26,82 données manquantes = 3 16,50 +/- 23,81 données manquantes = 4 0,091 CD20 32,61 +/- 32,25 données manquantes = 4 27,95 +/- 35,03 données manquantes = 5 0,5
CD4 40,87 +/- 36,85 données manquantes = 4 29,50 +/- 35,22 données manquantes = 4 0,083 CD8 15,65 +/- 15,67 données manquantes = 4 13,00 +/- 16,36 données manquantes = 4 0,398 CD16 6,78 +/- 10,77 données manquantes = 4 6,83 +/- 11,85 données manquantes = 3 0,545 CD56 0,09 +/- 0,51 données manquantes = 5 0,33 +/- 1,64 données manquantes = 4 0,581 FOXP3 2,91 +/- 5,14 données manquantes = 3 2,55 +/- 5,12 données manquantes = 4 0,566 TBET 2,10 +/- 4,56 données manquantes = 2 3,22 +/- 5,82 données manquantes = 3 0,721 GATA3 16,70 +/- 22,36 données manquantes = 3 10,63 +/- 15,70 données manquantes = 4 0,168 CD25 11,59 +/- 15,43 données manquantes = 3 4,90 +/- 8,98 données manquantes = 4 0,073 HLADRa 9,57 +/- 17,69 données manquantes = 4 10,00 +/- 19,75 données manquantes= 3 0,954
Sous types lymphocytaires (%)
(Moy +/- écart-type) BRAF V600E + (N =73) BRAF V600E - (N=44) p < 0,005
Lymphocytes B 62,00 +/- 59,48 données manquantes = 8 51,54 +/- 60,50 données manquantes = 5 0,541
Lymphocytes Th2 78,55 +/- 78,47 51,48 +/- 68,48 0,061
Lymphocytes Th1 64,58 +/- 62,59 44,82 +/- 58,81 0,094
Lymphocytes CD8 38,70 +/- 38,86 26,86 +/- 36,65 0,098
Cellules NK 45,12 +/- 43,27 33,48 +/- 43,13 0,182
38 Annexe 2 : Comparaison des CFT et de leur thyroïdite adjacente
Clusters (%) (Moy +/- ecart-type) CFT (N=95) Thyroïdite des CFT (N=14) p<0,005
PD1 4,47 +/- 9,54 données manquantes = 2 14,18 +/- 11,46 données manquantes = 3 0,005
PDL1 2,94 +/- 7,21 données manquantes = 3 6,79 +/- 10,30 0,039
CTLA4 5,11 +/- 6,11 données manquantes = 3 6,08 +/- 6,56 donnée manquante = 1 0,422
CD3 20,22 +/- 24,81 donnée manquante = 1 29,29 +/- 15,42 0,042 CD20 30,33 +/- 33,66 donnée manquante = 1 63,57 +/- 22,40 0,002 CD4 35,22+/- 36,05 donnée manquante = 1 67,86 +/- 20,82 0,002 CD8 14,78 +/- 16,34 donnée manquante = 1 25,00 +/- 10,19 0,031 CD16 6,68 +/- 10,87 8,86 +/- 9,83 0,024 CD56 0,21 +/- 1,17 données manquantes = 2 0,79 +/- 2,67 0,149
FOXP3 2,43 +/- 4,69 donnée manquante = 1 5,00 +/- 7,23 0,048
TBET 2,78 +/- 5,42 1,70 +/- 7,15 donnée manquante = 1 0,003
GATA3 14,92 +/- 21,40 donnée manquante = 1 26,50 +/- 18,54 0,014
CD25 8,97 +/- 13,88 donnée manquante = 1 21,50 +/- 21,71 0,025
HLA Dra 7,93 +/- 15,30 donnée manquante = 1 31,43 +/- 27,42 0,001
Sous types lymphocytaires (%) (Moy
+/- ecart-type) CFT (N=95) Thyroïdite des CFT (N=14) p<0,005
Lymphocytes B 56,22 +/- 59,03 données manquantes = 3 126,15 +/- 45,38 donnée manquante = 1 0,0001
Lymphocytes Th2 69,60 +/- 75,94 123,64 +/- 43,37 0,012
Lymphocytes Th1 57,62 +/- 60,79 103,79 +/- 34,81 0,019
Lymphocytes CD8 34,62 +/- 37,92 54,29 +/- 20,65 0,054
Cellules NK 41,72 +/- 43,46 77,50 +/- 25,73 0,006
39 Annexe 3 : Comparaison des marqueurs dans les CFT multifocaux
Clusters (%) (moy +/- ecart type) CFT N=95 CFT controlatéral N=23 p<0,05
PD1 4,47 +/- 9,54 données manquantes= 2 4,00 +/- 9,66 données manquantes = 2 0,628
PDL1 2,94 +/- 7,21 données manquantes = 3 0,45 +/- 2,13 donnée manquante = 1 0,023
CTLA4 5,11 +/- 6,11 données manquantes = 3 4,57 +/- 6,59 données manquantes = 2 0,194
CD3 20,22 +/- 24,81 donnée manquante = 1 26,76 +/- 31,47 données manquantes = 6 0,482
CD20 30,33 +/- 33,66 donnée manquante = 1 27,50 +/- 31,52 données manquantes = 7 0,718
CD4 35,22 +/- 36,05 donnée manquante = 1 40,00 +/- 39,37 données manquantes = 6 0,447
CD8 14,78 +/- 16,34 donnée manquante = 1 12,94 +/- 14,04 données manquantes = 6 0,727
FOXP3 2,43 +/- 4,69 donnée manquante = 1 2,47 +/- 5,29 données manquantes = 6 0,69
TBET 2,78 +/- 5,42 0,65 +/- 1,22 données manquantes = 6 0,431
GATA3 14,92 +/- 21,40 donnée manquante = 1 11,24 +/- 13,59 données manquantes = 6 0,986
CD16 6,68 +/- 10,87 4,19 +/- 9,99 données manquantes = 7 0,493
CD56 0,21 +/- 1,17 données manquantes = 2 0,00 +/- 0,00 données manquantes = 6 0,39
HLADRa 7,93 +/- 15,30 donnée manquante = 1 7,65 +/- 15,62 données manquantes = 6 0,992
Sous types lymphocytaires (%)
(Moy +/- ecart-type) CFT N= 95 CFT controlatéral N=23 p<0,05
Lymphocytes B 56,22 +/-59,03 données manquantes= 3 54,67 +/- 62,09 données manquantes = 8 0,933
Lymphocytes Th2 69,60 +/- 75,94 57,65 +/- 75,26 0,598
Lymphocytes Th1 57,62 +/- 60,79 49,83 /- 65,45 0,602
Lymphocytes T CD8 34,62 +/- 37,92 29,35 +/- 40,74 0,503
Cellules NK 41,72 +/- 43,46 32,48 +/- 42,58 0,388
40
REFERENCES BIBLIOGRAPHIQUES
1. Leenhardt L, Bernier MO, Boin-Pineau MH, Devolx BC, Marechaud R, Niccoli-Sire P, et al. Advances in diagnostic practices affect thyroid cancer incidence in France. Eur J Endocrinol. 2004 Feb 1;150(2):133–9.
2. Colonna M, Bossard N, Guizard A-V, Remontet L, Grosclaude P. Descriptive epidemiology of thyroid cancer in France: Incidence, mortality and survival. Ann Endocrinol. 2010 Mar;71:95–101.
3. Agnès Rogel, Marc Colonna, Zoé Uhry, Brigitte Lacour, Claire Schvartz, Laurence Pascal, et al. Evolution de l’incidence du cancer de la thyroïde en France métropolitaine. Bilan sur 25 ans. Institut de veille sanitaire; 2011.
4. Borson-Chazot F, Bardet S, Bournaud C, Conte-Devolx B, Corone C, D’Herbomez M, et al. Guidelines for the management of differentiated thyroid carcinomas of vesicular origin. Ann Endocrinol. 2008 Dec;69(6):472–86.
5. Groussin L, Buffet C. Les grands acteurs de la tumorigenèse thyroïdienne et leurs conséquences en pratique. MCED. 2015 Jan;74.
6. Montero-Conde C et al. Relief of feedback inhibition of HER3 transcription by RAF and MEK inhibitors attenuates their antitumor effects in BRAF-mutant thyroid carcinomas. Cancer Discovery 2013 ; 3(5):520-33.
7. Marcia S Brose, Christopher M Nutting, Barbara Jarzab, Rossella Elisei, Salvatore Siena, Lars Bastholt, Christelle de la Fouchardiere, Furio Pacini, Ralf Paschke, Young Kee Shong, Steven I Sherman, Johannes W A Smit, John Chung, Christian Kappeler, Carol Peña,, István Molnár, Martin J Schlumberger, on behalf of the DECISION investigators*. Sorafenib in radioactive iodine-refractory, locally advanced or metastatic differentiated thyroid cancer: a randomised, double-blind, phase 3 trial. Lancet Lond Engl. 2014 Aug 26;384(9940):319–28.
8. Cunha LL, Tincani AJ, Assumpção LVM da, Soares FA, Vassallo J, Ward LS.
Interleukin-10 but not interleukin-18 may be associated with the immune response against well-differentiated thyroid cancer. Clin São Paulo Braz. 2011;66(7):1203–8.
9. Jeong JS, Kim HK, Lee C-R, Park S, Park JH, Kang S-W, et al. Coexistence of chronic lymphocytic thyroiditis with papillary thyroid carcinoma: clinical manifestation and prognostic outcome. J Korean Med Sci. 2012 Aug;27(8):883–9.
10. Cunha LL, Morari EC, Guihen ACT, Razolli D, Gerhard R, Nonogaki S, et al. Infiltration of a mixture of different immune cells may be related to molecular profile of
differentiated thyroid cancer. Endocr Relat Cancer. 2012 Jun;19(3):L31–6.
11. DiLillo DJ, Yanaba K, Tedder TF. B Cells Are Required for Optimal CD4+ and CD8+ T Cell Tumor Immunity: Therapeutic B Cell Depletion Enhances B16 Melanoma Growth in Mice. J Immunol. 2010 Apr 1;184(7):4006–16.
12. Uppaluri R, Dunn GP, Lewis JS. Focus on TILs: prognostic significance of tumor infiltrating lymphocytes in head and neck cancers. Cancer Immun. 2008;8:16.