SESSION 2020
______
CONCOURS BLANC
PSI
______
EPREUVE DE PHYSIQUE-CHIMIE
______
DUREE : 4 H
______
L’UTILISATION D’UNE CALCULATRICE EST AUTORISEE
______
Aucun document ni autre matériel, quel qu'il soit, n'est autorisé. Les téléphones portables doivent être éteints et placés sur le bureau du surveillant de salle.
Si au cours de l'épreuve, un candidat repère ce qui lui semble être une erreur d'énoncé, il le signalera sur sa copie et devra poursuivre sa composition en expliquant les raisons des initiatives qu'il a été amené à prendre. L'énoncé (deux sujets) comporte 30 pages.
Merci d’indiquer sur votre copie si vous souhaitez connaître votre classement.
Les candidats sont invités à porter une attention particulière à la rédaction : les copies illisibles ou mal présentées seront pénalisées. Toute application numérique ne comportant pas d'unité ne donnera pas lieu à attribution de points.
Le candidat devra choisir entre deux sujets : Sujet 1 :
• Étude thermique d'un bâtiment & Eau de Javel (CCP MP 2016). Les deux problèmes du sujet sont indépendants. Un document réponse doit être rendu avec la copie. Sujet 2 (plus difficile):
• Problème A: Physique en Arctique (Mines-Pont PSI 2019)
• Problème B: Expérimenter avec un morceau de scotch (Centrale MP 2017) Pour faciliter la correction, les parties de chimie ("Eau de Javel" pour le sujet 1, "Problème B" pour le sujet 2) devront être rédigées sur des copies séparées.
PROBL `
EME I -
PHYSIQUE
´
Etude thermique d’un bˆatiment
Avec les nouvelles normes environnementales et les diagnostics de performance ´energ´etique des bˆatiments, la cartographie thermique permet de localiser les zones de d´eperdition thermique les plus importantes.
On peut ensuite cibler les travaux d’isolation `a effectuer en toute connaissance de cause. L’isolation peut s’effectuer par l’int´erieur ou l’ext´erieur avec des mat´eriaux ad´equats.
On pourra alors v´erifier, `a r´eception des travaux, l’efficacit´e de ces derniers.
FIGURE 1 – Thermographie infrarouge.
Mur extérieur à forte inertie Intérieur chaud Extérieur froid Isolant intérieur a) b) Extérieur
froid Intérieur chaud
Flux thermique Flux thermique
Isolant
extérieur Mur intérieurà forte inertie
FIGURE 2 – Isolation a) par l’int´erieur ou b) par l’ext´erieur.
SUJET 1
Pr´eambule
I.1. Mod´elisation de la pi`ece
On ´etudie une pi`ece parall´epip´edique de longueur a= 8 m, de largeur b = 5 m, de hauteur h = 2, 5 m et poss´edant un radiateur ´electrique de puissance maximale P= 2 kW. Dans l’ensemble du probl`eme, la pi`ece sera suppos´ee parfaitement isol´ee au niveau du sol et du plafond. La capacit´e thermique volumique de l’air est Cv= 1, 25 · 103SI. On suppose ici que la pi`ece est parfaitement calorifug´ee.
I.1.a. Quelle est l’unit´e de la capacit´e thermique volumique ? Quelle est la valeur de la capacit´e thermique C de la pi`ece ?
I.1.b. `A l’aide d’un bilan d’´energie thermique appliqu´e `a la pi`ece, ´etablir l’´equation diff´erentielle r´egissant l’´evolution de la temp´erature T(t) dans la pi`ece en fonction de C et de P.
I.1.c. R´esoudre l’´equation sachant que la temp´erature initiale de la pi`ece est T0= 10◦C. Tracer T(t).
D´eterminer la dur´ee n´ecessaire pour atteindre la temp´erature finale Tf = 20◦C.
I.1.d. Proposer un mod`ele ´electrique simple conduisant `a une ´equation diff´erentielle du mˆeme type.
Pr´eciser quelles sont les grandeurs ´electriques associ´ees aux grandeurs thermodynamiques que sont T(t), C et P.
Dessiner le montage ´electrique analogue. I.2. Influence des murs
La pi`ece est constitu´ee d’une enceinte en b´eton d’´epaisseur L = 15 cm et de masse volumique ρ = 2, 2 · 103 kg.m−3
. On note c= 1, 0 · 103 J.kg−1 .K−1
sa capacit´e thermique massique et λ sa conductivit´e thermique (λ = 1, 5 SI).
I.2.a. Exprimer l’aire Spde la surface en contact avec la pi`ece en fonction de a, b et h, en n´egligeant l’´epaisseur des murs. Faire l’application num´erique.
I.2.b. Exprimer le volume de b´eton Vb et la capacit´e thermique Cmur de l’enceinte en b´eton en fonction de Sp, L,ρ et c.
Comparer num´eriquement Cmur `a la capacit´e thermique de la pi`ece C.
Par rapport `a ces premiers r´esultats, quels commentaires pouvez-vous faire sur la dur´ee de mont´ee en temp´erature de la pi`ece en prenant en consid´eration l’influence de la capacit´e thermique du mur ?
Premi`ere partie : ´equation de la chaleur
On ´etudie la conduction thermique dans le mur mod´elis´e par une barre de section S, de longueur L en contact avec deux thermostats de temp´eratures Tint et Text (voir figure 3, page 4).
T
extT
int0
x
x + dx
L
x
Mur
Section S
FIGURE 3 – Mod´elisation du mur. I.3. G´en´eralit´es
I.3.a. Rappeler la loi de Fourier. Interpr´eter son signe. Donner une signification physique de j(x,t) et pr´eciser son unit´e. Quelle est la dimension de la conductivit´e thermique ? En d´eduire son unit´e dans le syst`eme internationnal.
I.3.b. `A l’aide d’un bilan d’´energie thermique sur la tranche comprise entre les abscisses x et x+ dx du mur, ´etablir l’´equation de diffusion thermique c’est-`a-dire l’´equation diff´erentielle r´egissant l’´evolution de la temp´erature T(x,t) `a l’int´erieur du mur en fonction deρ, c, etλ.
I.4. ´Etude du r´egime stationnaire
I.4.a. Rappeler la signification de “r´egime stationnaire”.
I.4.b. Les temp´eratures de surface seront prises ´egales `a celles des thermostats. R´esoudre l’´equation de la diffusion thermique et d´eterminer alors T(x) la temp´erature `a l’int´erieur du mur `a l’abscisse x. Tracer T(x).
I.4.c. D´efinir et exprimer la temp´erature moyenne du mur not´ee Tmoy.
Indiquer la position particuli`ere xpo`u la temp´erature est ´egale `a la temp´erature moyenne. I.4.d. Exprimer la densit´e de flux j(x) qui traverse le mur. Que remarquez-vous ?
I.4.e. Calculer la puissance P que le radiateur doit fournir afin de maintenir la temp´erature int´erieure `a 20◦
C pour une temp´erature ext´erieure de 10◦
C. Commenter ce r´esultat par rapport au radiateur ins-tall´e.
I.5. R´esistance thermique
On d´efinit en ´electricit´e la r´esistance d’un conducteur ohmique en convention r´ecepteur par R= ∆V I o`u∆V est la diff´erence de potentiels aux bornes de la r´esistance et I l’intensit´e du courant ´electrique qui traverse le conducteur (figure 4).
I R
∆V
I.5.a. Rappeler l’expression de la loi d’Ohm locale pour un conducteur de conductivit´e ´electriqueγ. En faisant l’analogie entre la loi d’Ohm et la loi de Fourier, indiquer `a quelles grandeurs thermo-dynamiques sont analogues la conductivit´e ´electrique, la densit´e de courant ´electrique, le potentiel ´electrique et l’intensit´e du courant. Donner cette r´eponse sous la forme d’un tableau r´ecapitulatif.
I.5.b. Par analogie, donner l’expression de la r´esistance thermique Rmur du mur ´etudi´e. Pr´eciser son unit´e et calculer sa valeur.
Deuxi`eme partie : mod´elisation ´electrique
Dans cette partie, on travaillera avec la temp´erature moyenne du mur. On mod´elise l’ensemble du syst`eme, compos´e de la pi`ece, du mur et du radiateur, par un r´eseau ´electrique. Le but est d’´etudier le comportement dynamique de ce syst`eme via sa fonction de transfert.
I.6. Circuit ´electrique
Dans l’approche ´electrique, la mod´elisation du syst`eme conduit au circuit ´electrique donn´e figure 5.
R
1R
2C
2C
1u
1(t)
u
2(t)
i
(t)
FIGURE 5 – Mod`ele ´electrique.
I.6.a. Justifier cette mod´elisation ´electrique par rapport `a notre ´etude thermique de la premi`ere partie. Expliciter les valeurs de I, R1, R2,C1,C2, u1(t) et u2(t), en fonction des grandeurs P, Rmur, C, Cmur, la temp´erature de la pi`ece T(t), la temp´erature moyenne du mur Tmoy(t) et la temp´erature ext´erieure Text.
I.6.b. Que devient ce circuit ´electrique en r´egime permanent continu ? Exprimer alors la tension u2(t −→ ∞). Quelle valeur attribueriez-vous `a R1et `a R2en fonction de Rmur?
I.7. ´Etablissement de l’expression d’une imp´edance
Afin d’´etudier le comportement du circuit en r´egime variable, on se place en r´egime sinuso¨ıdal forc´e x(t) de pulsationω dont la grandeur complexe associ´ee est not´ee x(t) et l’amplitude complexe est X avec :
x(t) = X0cos(ωt+φ) = Re(x(t)) , x(t) = X0ej(ωt+φ )= X ej(ωt),
X= X0ej(φ ).
La r´ef´erence de phase sera prise sur la grandeur i(t) d´elivr´ee par le g´en´erateur de courant : i(t) = I0cos(ωt) .
I.7.a. Exprimer l’imp´edance Z2relative `a l’association de la r´esistance R2avec le condensateur de capacit´e C2.
I.7.b. Exprimer l’imp´edance Z1relative `a l’association de la r´esistance R1avec l’imp´edance Z2. I.7.c. Exprimer le lien i(t), u1(t), Z1, C1etω.
I.7.d. En d´eduire que la relation reliant U1( jω) `a I0est donn´ee par :
U1( jω) = 1+ j R1R2 R1+R2C2ω 1+ j((R1+ R2)C1+ R2C2)ω−R1R2C1C2ω2 (R1+ R2)I0. (1) I.8. Exploitation
I.8.a. V´erifier la coh´erence entre la fonction donn´ee par (1) et les comportements du circuit pour les hautes et basses fr´equences.
Exprimer en fonction des donn´ees, U10, la valeur de U1( jω) pourω = 0.
I.8.b. V´erifier les comportements limites lorsque C2tend vers z´ero puis vers l’infini. I.8.c. On appelle fonction de transfert H( jω) =U1( jω)
U10
. Quelle est la nature du filtre ?
I.8.d. Exprimer la fonction de transfert H( jω) dans le cas o`u R1= R2= 12Ret C2=αC1=αC. I.9. Diagramme de Bode
I.9.a. ´Etablir les expressions des asymptotes de H( jω) en basse fr´equence et haute fr´equence. Tracer le diagramme de Bode asymptotique en pr´ecisant bien le point d’intersection.
I.9.b. En pratique, pourα = 200, on obtient le diagramme de Bode de la figure 10 du document r´eponse. Mettre clairement en ´evidence, sur le diagramme de la figure 10 du document r´eponse, des zones rectilignes. Interpr´eter ces zones et placer trois pulsations particuli`eresω1<ω2<ω3.
I.9.c. Sous quelle forme pourrait-on mettre H( jω) en fonction deω,ω1,ω2et ω3?
I.9.d. D´efinir la pulsation de coupure du filtre et donner sa valeur. Estimer la dur´eeτ du r´egime transitoire.
Troisi`eme partie : isolation
Afin de limiter sa consommation ´energ´etique, le propri´etaire d´ecide d’isoler la pi`ece. I.10. Importance de l’isolation
Le propri´etaire peut disposer l’isolant `a l’int´erieur ou `a l’ext´erieur du mur. Pour cela, il recouvre les murs d’un isolant de faible capacit´e thermique, de conductance thermiqueλi= 0, 05 SI et d’´epaisseur e= 5 cm.
I.10.a. Calculer la r´esistance thermique Rirelative `a l’isolation de la pi`ece. Comparer cette valeur `a Rmur. Par la suite, on prendra Ri=βRmuravecβ = 10.
I.10.b. Modifier le sch´ema ´electrique de la figure 5 (page 5) et proposer les deux montages cor-respondants.
I.10.c. D´eterminer la puissance n´ecessaire Pminafin de maintenir une temp´erature dans la pi`ece de 20◦
C pour une temp´erature ext´erieure de 10◦ C. I.11. Isolation int´erieure ou ext´erieure
I.11.a. Choisir un type d’isolation int´erieure ou ext´erieure en pr´ecisant clairement votre choix sur la copie.
I.11.b. D´eterminer, en r´egime permanent, les diff´erents tensions U10 et U20 en fonction deβ, R et I0.
I.11.c. Donner la nouvelle expression de H( jω) en fonction deα,β, R, C et I0.
I.11.d. On obtient, comme diagrammes de Bode, les figures 11a) et 11b) du document r´eponse. Indiquer sur la copie et encadrer sur le document r´eponse celle qui correspond `a votre choix d’isola-tion.
Relever la pulsation de coupure correspondant `a ce choix et en d´eduire le temps de r´eponseτide votre syst`eme.
Commenter ce r´esultat par rapport au cas sans isolation et analyser votre choix sur le placement de l’isolant.
Quatri`eme partie : prise en compte des ´echanges `a la surface
On prend en consid´eration les ´echanges thermiques `a la surface en contact avec l’air ext´erieur par la loi de Newton. On prendra pour le coefficient de transfert thermique de surface k= 10 SI.
I.12.
I.12.a. Quelle peut eˆtre l’unite´ du coefficient k ?
I.12.b. ´Etablir la relation en x= L entre le flux sortant de l’habitation Φ et les donn´ees k, S, Text et T(L).
I.12.c. Mod´eliser l’´echange thermique en x= L par une r´esistance thermique not´ee Re. Comparer num´eriquement Re `a Rmuret `a Ri.
I.12.d. Quelle est la cons´equence principale de Re sur l’installation ? Calculer la nouvelle puis-sance `a d´elivrer afin de maintenir la temp´erature int´erieure `a 20 ◦
C pour une temp´erature ext´erieure de 10◦
C.
I.12.e. Comment mod´eliser la prise en consid´eration du sol de la pi`ece ? Comment traduire l’influence de la pr´esence d’une fenˆetre dans la pi`ece ?
´
Elaborer un mod`ele ´electrique plus complet de la pi`ece.
I.12.f. En revenant sur les photographies de la figure 1, page 2, quel ph´enom`ene avons nous n´eglig´e ?
Loi de Newton: la puissance thermique dP d'échange par conducto-convection par la surface dS entre un solide à la température T et un fluide à la température Tf est donnée par dP=k(T-Tf)dS (transfert
PROBL `
EME II -
CHIMIE
L’eau de Javel
Toutes les donn´ees n´ecessaires se trouvent au d´ebut de chaque partie. Tous les gaz seront consid´er´es comme parfaits, les solutions id´eales et les solides id´eaux.
Premi`ere partie : g´en´eralit´es
´
Etudi´ee particuli`erement `a partir de 1775 par le chimiste franc¸ais Claude Louis Berthollet, dont la manufacture de produits chimiques a ´et´e construite dans le quartier de Javel `a Paris, l’eau de Javel est une solution aqueuse d’hypochlorite de sodium (Na+(aq.)+ ClO−
(aq.)) et de chlorure de sodium (Na+(aq.)+ Cl−
(aq.)), compos´e r´esiduel du processus de fabrication, en pr´esence d’un exc`es de soude. L’eau de Javel est donc oxydante et caustique (11,5 < pH < 12,5) : sa composition varie en fonction du pH d’utilisation et du temps ´ecoul´e depuis sa fabrication. Des esp`eces minoritaires chlor´ees, chlorite de sodium (Na+(aq.)+ ClO−
2(aq.)) et chlorate de sodium (Na +
(aq.)+ ClO −
3(aq.)), issues du processus de d´ecomposition de l’eau de Javel peuvent ˆetre aussi pr´esentes.
Donn´ees :
— num´eros atomiques :
Atome Oxyg`ene Chlore
Num´ero atomique 8 17
— masses molaires atomiques :
Atome Sodium Chlore
Masse molaire atomique (g.mol−1
) 23,0 35,5
II.1. Autour des ´el´ements chlore et oxyg`ene
II.1.a. Donner les configurations ´electroniques des atomes d’oxyg`ene O et de chlore Cl et des ions oxyde O2− et chlorure Cl−
dans leur ´etat fondamental.
II.1.b. Donner une repr´esentation de Lewis des ions hypochlorite ClO−
, chlorite ClO−
2 et chlorate ClO−
3 (Cl est l’atome central pour les trois ions), de l’acide hypochloreux HClO (O ´etant l’atome central) et de la mol´ecule de dichlore Cl2.
II.1.c. Quels sont les nombres d’oxydation du chlore dans les compos´es cit´es ? Donner cette r´eponse en recopiant et compl´etant le tableau 1.
Esp`ece chimique Cl− Cl2 HClO ClO− ClO− 2 ClO − 3 Nombre d’oxydation du chlore
II.2. D´ecomposition de l’acide hypochloreux HClO en phase gazeuse Donn´ees : — R = 8,314 J.K−1 .mol−1 ; — tables thermodynamiques `a 298 K : Esp`eces HClO(g) Cl2O(g) H2O(g) ∆fH◦ (kJ.mol−1 ) - 80,3 −241, 3 S◦ m(J.K −1 .mol−1 ) 236,6 266,1 188,7 o`u∆fH◦ et S◦
m sont respectivement l’enthalpie molaire standard de formation et l’entropie molaire standard des corps consid´er´es `a 298 K.
En phase gazeuse, l’acide hypochloreux, de pression partielle pHClO= 0, 060 bar, peut se d´eshydrater en formant de l’h´emioxyde de chlore Cl2O et de l’eau, en phase gazeuse dans ces conditions, suivant la r´eaction (1) d’´equation :
2 HClO(g)= Cl2O(g) + H2O(g) de constante d’´equilibre K◦
1(298 K) = 11, 1 (1)
II.2.a. Calculer, `a 298 K, l’entropie standard ∆rS◦
1(298 K) de la r´eaction (1) et l’enthalpie libre standard∆rG◦
1(298 K) de la mˆeme r´eaction. Le signe de ∆rS ◦
1(298 K) ´etait-il pr´evisible ? II.2.b. En d´eduire la valeur de l’enthalpie standard∆rH◦
1(298 K) de la r´eaction (1). Commenter le r´esultat obtenu. D´eterminer enfin la valeur de l’enthalpie standard de formation de l’acide hypochlo-reux∆fH◦
(HClO) en phase gazeuse `a 298 K.
II.2.c. Calculer, `a 298 K, l’enthalpie libre de la r´eaction ∆rG1 dans le cas o`u initialement on dispose d’un syst`eme ferm´e de volume V contenant de l’acide hypochloreux HClO pur sous une pression partielle pHClO= 0,060 bar. Pr´eciser alors le sens d’´evolution du syst`eme.
II.2.d. Pr´eciser la composition du syst`eme obtenu `a l’´equilibre.
II.2.e. Quelle est l’influence d’une augmentation de pression sur l’´equilibre de d´eshydratation de l’acide hypochloreux `a 298 K ? Justifier la r´eponse.
II.3. Structure cristallographique du chlorure de sodium NaCl
Donn´ees :
— masses molaires atomiques :
Atome Sodium Chlore
Masse molaire atomique (g.mol−1
) 23,0 35,5
— rayons ioniques :
Ions Na+ Cl−
Rayons ioniques (pm) 102 184 — masse volumique du chlorure de sodiumρNaCl= 2 160 kg.m−3
; — nombre d’Avogadro NA = 6,02 × 1023mol−1
Le chlorure de sodium NaCl, compos´e r´esiduel du processus de fabrication de l’eau de Javel, cristal-lise dans une structure o`u les ions chlorure Cl−
forment un r´eseau cubique `a faces centr´ees alors que les ions sodium Na+ occupent les interstices octa´edriques.
II.3.a. Donner une repr´esentation de la maille conventionnelle de chlorure de sodium. II.3.b. D´efinir, puis pr´eciser la coordinence de chaque ion.
II.3.c. Exprimer la masse volumique ρNaCl de ce solide ionique en fonction du param`etre de maille a. En d´eduire une valeur approch´ee de a et la comparer `a la double somme des rayons ioniques.
Deuxi`eme partie : quelques propri´et´es chimiques des ions hypochlorite dans
l’eau de Javel
Donn´ees :
— constante d’acidit´e `a 298 K du couple HClO/ClO−
: Ka= 10−7,5 ; — produit ionique de l’eau `a 298 K : Ke= 10−14
; — on prendra RT
F ×ln 10 ≈ 0,06 V.
Document n◦
1 - Stabilit´e des ions hypochlorite
La d´ecomposition de l’eau de Javel avec formation de dioxyg`ene O2 est favoris´ee par l’ajout de sels m´etalliques qui catalysent cette r´eaction, par une diminution du pH, une augmentation de la force ionique et une augmentation de la temp´erature. Cette d´ecomposition, produisant un gaz, conduit dans des r´ecipients ferm´es `a une augmentation de la pression au-dessus du liquide et est donc `a ´eviter pour des raisons de s´ecurit´e. L’eau de Javel est donc vendue dans des contenants en plastique ´etanches `a la lumi`ere et non contamin´es par des ions m´etalliques.
En l’absence de catalyseurs, la d´ecomposition de l’ion hypochlorite en ion chlorate ClO−
3(aq.) est beaucoup plus rapide que l’oxydation de l’eau (d’un facteur 10, ce qui correspond approximativement `a 95 % de la perte d’ions hypochlorite ClO−
). Les ions chlorate ClO−
3(aq.)pr´esents dans le milieu ne poss`edent aucune propri´et´e bact´ericide.
Document n◦
2 - Superposition de diagrammes potentiel - pH
La figure 6 (page 11) est la superposition des droites relatives au couple O2(g)/H2O et d’un diagramme simplifi´e de l’´el´ement chlore, c’est-`a-dire dans une situation chimique sans pr´esence d’ions chlorate. Les seules esp`eces `a envisager sont donc celles des couples du tableau 2 (page 12) pour lesquelles on indique la valeur du potentiel standard E◦
par rapport l’E.S.H. (Electrode Standard `a Hydrog`ene). La figure 7 (page 11) superpose au diagramme simplifi´e du chlore pr´ec´edent les segments de droites traduisant les lois de Nernst de deux couples o`u intervient l’ion chlorate conform´ement aux donn´ees du tableau 3 (page 12).
0 0,2 0,4 0,6 0,8 1,0 1,2 1,4 1,6 1,8 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 A B C D O2 H2O pH E(V)
FIGURE 6 – Superposition des diagrammes potentiel-pH du chlore simplifi´e et de l’eau. La concen-tration des esp`eces dissoutes est de 1 mol.L−1
. 0 0,2 0,4 0,6 0,8 1,0 1,2 1,4 1,6 1,8 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 A B C D ClO− HClO ClO− 3 pH E(V)
FIGURE 7 – Superposition des diagrammes potentiel-pH du chlore simplifi´e et des deux couples faisant intervenir les ions chlorate. La concentration des esp`eces dissoutes est de 1 mol.L−1
Couples O2/H2O Cl2/Cl− HClO/Cl2 HClO/Cl− ClO− /Cl− E◦ (V/E.S.H.) 1,23 1,36 1,63 1,49 1,73
TABLEAU 2 – Potentiel standard des couples d’oxydor´eduction.
Couples ClO− 3/HClO ClO − 3/ClO − E◦ (V/E.S.H.) 1,43 1,32
TABLEAU 3 – Potentiel standard des couples d’oxydor´eduction.
II.4. Fabrication de l’eau de Javel
L’eau de Javel est commercialis´ee sous deux niveaux de dilution dans des bouteilles `a 2,6 % de chlore actif (masse volumique ρ1 = 1,03 g.cm−3
) et dans des berlingots `a 9,6 % de chlore actif (masse volumique ρ2 = 1,15 g.cm−3
). On d´efinit le pourcentage de chlore actif par la masse de dichlore form´e (suite `a une acidification du m´elange ´equimolaire d’ions hypochlorite et chlorure) pour 100 g de solution.
II.4.a. Indiquer, pour chacun des domaines (A, B, C, D) pr´esents dans les diagrammes potentiel -pH du document n◦
2, l’esp`ece chimique correspondante.
II.4.b. Pr´eciser alors le principe de fabrication de l’eau de Javel `a partir du dichlore Cl2. ´Ecrire l’´equation de la r´eaction mise en jeu pour une mole de dichlore Cl2not´ee (2).
II.4.c. Calculer alors la concentration molaire volumique en ions hypochlorite dans les solutions `a 2,6 % et 9,6 %.
II.4.d. Pourquoi est-il n´ecessaire de refroidir le m´elange r´eactionnel ? On donne∆rH2◦
(298 K) = −103 kJ.mol−1 .
II.4.e. ´Ecrire l’´equation des r´eactions, not´ees (3) et (4), responsables de la d´ecomposition des ions hypochlorite. On utilisera les plus petits coefficients stœchiom´etriques entiers dans les r´eactions (3) et (4).
II.4.f. Calculer les constantes d’´equilibre K◦ 3 et K
◦
4 des deux r´eactions de d´ecomposition des ions hypochlorite ClO−
.
Troisi`eme partie : suivi de la d´ecomposition du bleu brillant en pr´esence
d’hypochlorite de sodium
L’eau de Javel est une solution `a base d’ions hypochlorite capable de d´ecomposer de nombreuses substances organiques comme le bleu brillant (E133), colorant alimentaire fr´equemment rencontr´e dans les boissons et les sucreries de couleur bleue.
La cin´etique de la d´ecomposition du bleu brillant en pr´esence d’ions hypochlorite d’´equation : E133(aq.)+ ClO−
(aq.)= Produits incolores1
est suivie par spectrophotom´etrie en mesurant l’absorbance A de la solution au cours du temps `a une longueur d’onde donn´ee. On suppose que la vitesse de la r´eaction v peut se mettre sous la forme :
v= k × [E133]α×[ClO−]β
o`u α est l’ordre partiel par rapport au bleu brillant (E133), β l’ordre partiel par rapport aux ions hypochlorite ClO−
et k la constante de vitesse de la r´eaction. Cette r´eaction, qui admet un ordre global entier, est r´ealis´ee dans les conditions suivantes : temp´erature constante et ´egale `a 298 K, milieu r´eactionnel homog`ene, r´eaction quantitative et volume constant.
Document n◦
3 - Spectre d’absorption du bleu brillant
La figure 8 trace l’absorbance A du bleu brillant en fonction de la longueur d’ondeλ.
Longueur d’onde λ (nm)
A
0, 0, 0,35 0,30 0,25 0,20 0,15 0,10 0,05 400 500 600 700 800FIGURE8 – Absorbance A du bleu brillant en fonction de la longueur d’ondeλ exprim´ee en nm.
Document n◦
4 - Pr´eparation de la gamme de la solution ´etalon de bleu brillant
Une gamme ´etalon est r´ealis´ee : `a partir d’une solution m`ere de bleu brillant commercial de concen-tration molaire volumique connue c0= 4,72 × 10−6
mol.L−1
, des solutions filles sont pr´epar´ees en utilisant une verrerie adapt´ee. On obtient alors une s´erie de solutions de bleu brillant de concentra-tions c connues. L’absorbance A de chaque solution est mesur´ee dans une cuve en plastique de 1 cm d’´epaisseur `a une longueur d’onde λ adapt´ee. Les valeurs obtenues sont report´ees dans le tableau 4 page 14.
A 0 0,234 0,347 0,456 0,582 c(10−6
mol.L−1
) 0 1,89 2,83 3,78 4,72
TABLEAU 4 – Absorbances et concentrations des solutions.
Document n◦
5 - Absorbance d’une solution
Lorsqu’une solution est travers´ee par un rayonnement polychromatique, elle peut att´enuer l’intensit´e des radiations `a certaines longueurs d’onde : on dit qu’elle absorbe ces radiations.
I
0,λI
T,λFIGURE9 – Repr´esentation d’une cuve travers´ee par un faisceau incident d’intensit´e I0,λ. Un faisceau transmis IT,λ en ´emerge. La longueur de la cuve ℓ travers´ee est de 1 cm.
II.5. Suivi spectrophotom´etrique de la r´eaction
Un faisceau de lumi`ere monochromatique (de longueur d’ondeλ) d’intensit´e incidente I0,λ traverse une longueur ℓ de solution limpide (ph´enom`ene de diffusion n´egligeable) plac´ee dans une cuve (fi-gure 9). Une partie de la radiation est absorb´ee par la solution, l’autre est transmise et son intensit´e est not´ee IT,λ.
II.5.a. D´efinir l’absorbance A d’une solution.
II.5.b. Quelle longueur d’onde de travailλ faut-il choisir pour r´ealiser les mesures d’absorbance lors de la r´ealisation de la gamme de solutions ´etalons ? Quel lien existe-t-il entre cette longueur d’onde et la couleur d’une solution de bleu brillant ?
II.5.c. D´etailler le protocole exp´erimental `a mettre en place pour pr´eparer, `a partir de la solution m`ere de bleu brillant, un volume V = 25,0 mL d’une solution de bleu brillant de concentration molaire volumique c = 1,89 × 10−6
mol.L−1 .
II.5.d. Rappeler la loi de Beer-Lambert en pr´ecisant les diff´erents termes et leurs unit´es respec-tives. Cette loi est-elle v´erifi´ee ?
II.5.e. Avant de r´ealiser des mesures d’absorbance, il est n´ecessaire de r´ealiser le blanc. Expliquer la n´ecessit´e d’un telle op´eration.
II.6. ´Etude cin´etique
Protocole exp´erimental- `A l’instant t= 0 min, on place dans un b´echer de 50 mL un volume V1= 25, 0 mL d’une solution aqueuse de bleu brillant de concentration molaire volumique c1 = 4,54 × 10−6
mol.L−1
et un volume V2 = 1,00 mL d’une solution aqueuse d’hypochlorite de sodium (ClO−
(aq.)+ Na+(aq.)) de concentration molaire volumique c2= 1,33 × 10 −2
mol.L−1 . II.6.a. Montrer que les conditions initiales utilis´ees vont permettre de d´eterminer la valeur de l’ordre partiel par rapport au bleu brillant (E133). Dans quelle situation cin´etique se trouve-t-on ?
II.6.b. Montrer alors que la vitesse de r´eaction v peut se mettre sous une forme simplifi´ee. On notera kapp la constante apparente de vitesse.
II.7. ´Etude exp´erimentale
Les r´esultats de l’´etude exp´erimentale men´ee `a 298 K sont rassembl´es dans le tableau 5 ci-dessous.
t (min) 0 2,5 5 7,5 10 15
A 0,582 0,275 0,138 0,069 0,034 0,009 TABLEAU 5 – Absorbance A mesur´ee `a divers instants t.
II.7.a. Montrer que si la r´eaction est d’ordre 1 par rapport au bleu brillant (E133), l’´equation ci-dessous est v´erifi´ee :
ln A
A0 = −kapp×t
o`u A et A0 repr´esentent respectivement les valeurs de l’absorbance `a l’instant t et `a l’instant initial t= 0 min. kappest la constante apparente de vitesse de la r´eaction.
II.7.b. D´eterminer la valeur de kapp `a 298 K.
II.8. Afin de d´eterminer l’ordre partiel β, suppos´e non nul, par rapport aux ions hypochlorite ClO−
, on r´ealise le mˆeme protocole exp´erimental que pr´ec´edemment en utilisant toutefois une so-lution aqueuse d’hypochlorite de sodium (ClO−
(aq.)+ Na+(aq.)) de concentration molaire volumique c3 = 6,65 × 10−3
mol.L−1
. Les r´esultats de l’´etude exp´erimentale men´ee `a 298 K sont rassembl´es dans le tableau 6 ci-dessous.
t (min) 2,5 5 7,5 10 12,5 15
A 0,389 0,275 0,195 0,138 0,097 0,069 TABLEAU6 – Absorbance A `a diff´erents instants t.
II.8.a. Montrer alors que ces nouvelles conditions initiales s’av`erent suffisantes pour d´eterminer la valeur de l’ordre partiel β par rapport aux ions hypochlorite.
II.8.b. En de´duire la valeur de la constante de vitesse k de la re´action de de´composition du bleu brillant en pre´sence d’ions hypochlorite.
RIE
N
ATION
ALE
Académie : Session :
Examen ou Concours : Concours Communs Polytechniques Série* :
Spécialité/option* : Repère de l’épreuve :
Épreuve/sous-épreuve : Physique - Chimie
NOM : Prénoms : N° du candidat Né(e) le DANS CE CADRE NE RIEN ÉCRIRE
(le numéro est celui qui figure sur la convocation ou la liste d’appel) (en majuscules, suivi, s’il y a lieu, du nom d’épouse)
Examen ou Concours : Concours Communs Polytechniques Série* : Spécialité/option :
Repère de l’épreuve :
Épreuve/sous-épreuve : Physique - Chimie
(Préciser, s’il y a lieu, le sujet choisi)
Note :
20
Appréciation du correcteur* :
* Uniquement s’il s’agit d’un examen.
Si votre composition comporte plusieurs feuilles, numérotez-les et placez les intercalaires dans le bon sens.
DOCUMENT RÉPONSE
B MPPC003 MP MPNE RIEN ÉCRIRE DANS LA PARTIE BARRÉE
Document r´eponse `a rendre avec la copie
Question I.9.b
FIGURE10 – Diagramme de Bode sans isolation
Question I.11.d
a)
b)
FIGURE 11 – Diagrammes de Bode avec isolation. Il s’agit de d´eterminer `a quels choix d’isolation correspondent les courbes a) ou b).
Physique I, ann´ee 2019 — fili`ere PSI
Physique en arctique
Ce sujet aborde diff´erentes questions relatives aux propri´et´es physiques particuli`eres aux r´egions polaires. Les notations, valeurs des constantes fondamentales et les autres donn´ees num´eriques n´ecessaires `a la r´esolution du probl`eme ainsi qu’un formulaire sont regroup´es `a la fin de l’´enonc´e. Les exemples seront tous trait´es dans le cas des r´egions polaires nord (´egalement appel´ees arctiques ou bor´eales). Les notations g´eographiques usuelles sont ´egalement rappel´ees en fin d’´enonc´e. Les applications num´eriques comporteront au plus 2 chiffres significatifs.
Les deux parties sont ind´ependantes.
I. — Pˆ
oles g´
eographiques et magn´
etiques
Les pˆoles g´eographiques sont assez proches des pˆoles magn´etiques ; dans tout ce qui suit, on pourra confondre les deux axes reliant les pˆoles oppos´es de chaque type. La recherche des pˆoles magn´etiques s’est d’abord appuy´ee sur la mesure du champ magn´etique terrestre (ou champ g´eomagn´etique), et en particulier de sa direction. L’intensit´e croissante du champ g´eomagn´etique `a l’approche des pˆoles contribue enfin `a expliquer un ph´enom`ene optique spec-taculaire : les aurores polaires. Les parties I.A et I.B sont ind´ependantes entre elles.
La partie I.A est consacr´ee `a la description dipolaire du champ g´eomagn´etique (le dipˆole dispos´e au centre de la Terre et mod´elisant des courants ´electriques dans le noyau de la plan`ete). Enfin, la partie I.B d´ecrit quelques propri´et´es des mouvements des particules charg´ees `a l’ap-proche du pˆole nord.
I.A. — Boussole, champ g´
eomagn´
etique et dipˆ
ole central
N S ( )¢ / ! N S E W NE SE SW NW
Figure 1 – Boussole de navigation
Une boussole est form´ee d’un aimant permanent, solide en forme d’aiguille ´equivalente `a un petit dipˆole magn´etique
⃗
m de norme constante m, la
direction du vecteur ⃗m ´etant
suppos´ee indiquer le nord. Cette aiguille aimant´ee peut librement tourner autour d’un axe vertical (∆) dirig´e par le
vecteur ⃗er local et formant un pivot `a faible frottement (cf. fig. 1).
1 — Pourquoi la boussole `a l’´equilibre indique-t-elle le nord ? Cet ´equilibre est-il stable ? On note I le moment d’inertie de l’aiguille aimant´ee relativement `a son axe de rotation (∆) ; l´eg`erement ´ecart´ee de sa position d’´equilibre (cf. fig. 1), l’aiguille aimant´ee oscille avec une
pseudo-p´eriode τosc.
2 — Montrer que la connaissance de m, τoscet I permet de d´eterminer une des composantes
du champ g´eomagn´etique. Laquelle ?
On ´etudie un mod`ele de champ g´eomagn´etique cr´e´e par un dipˆole magn´etique ⃗M = M0⃗ez dispos´e
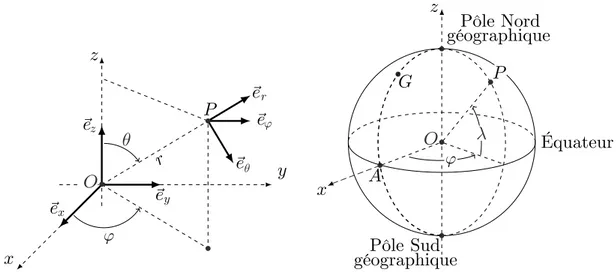
au centre O de la Terre (assimil´ee `a une sph`ere de rayon RT), l’axe (Oz) ´etant l’axe polaire
g´eographique dirig´e du pˆole sud de cet axe vers son pˆole nord (cf. fig. 5). On rappelle d’une part
qu’un point de la surface est caract´eris´e par ses coordonn´ees g´eographiques ϕ (longitude) et
λ = π
2−θ (latitude) et d’autre part qu’`a l’´equateur le champ magn´etique terrestre est horizontal,
dirig´e vers le pˆole nord g´eographique et y a pour intensit´e BE.
3 — Exprimer, en un point de la surface de la Terre et en coordonn´ees sph´eriques, le champ
g´eomagn´etique en fonction de µ0 (perm´eabilit´e du vide), M0 et RT.
SUJET 2
Physique I, ann´ee 2019 — fili`ere PSI
4 — Pr´eciser le signe de M0 puis estimer sa valeur num´erique. Quelles sont la direction et
l’intensit´e du champ g´eomagn´etique aux pˆoles magn´etiques nord et sud ?
En un point P de la surface terrestre, on appelle nord magn´etique local la direction ⃗eN du
champ g´eomagn´etique ⃗B, projet´e dans le plan horizontal, et d´eclinaison magn´etique l’angle D
form´e par ⃗B avec le nord magn´etique local ; la d´eclinaison magn´etique est positive si ⃗B est
dirig´e vers le haut (vers le ciel) et n´egative s’il est dirig´e vers le bas (vers le sol).
5 — Dans l’h´emisph`ere nord, quel est le signe de D ? Calculer tan(D) en fonction de la latitude λ puis tracer l’allure de la courbe donnant D en fonction de λ pour toutes les valeurs de
λ du pˆole sud au pˆole nord. Pourquoi lisait-on parfois que les boussoles ≪s’affolent `a proximit´e
des pˆoles≫? Peut-on d´eterminer, au moyen d’une boussole, si on se trouve dans l’h´emisph`ere
nord ou dans l’h´emisph`ere sud ?
I.B. — Aurores polaires
Les aurores polaires sont des ph´enom`enes lumineux spectaculaires observables sur le fond du ciel nocturne des r´egions polaires : des particules charg´ees issues du vent solaire et guid´ees vers les pˆoles le long des lignes de champ du champ g´eomagn´etique y interagissent avec la haute atmosph`ere. On n’´etudie que quelques caract´eristiques du mouvement de ces particules `a l’approche du pˆole nord.
On ´etudie d’abord le mouvement circulaire de centre O′ d’une particule de charge q et de masse
m sous la seule influence d’un champ magn´etostatique uniforme ⃗B0 = −B0⃗ez, avec B0 > 0. On
pourra utiliser des coordonn´ees polaires (r, θ) dans le plan du mouvement.
6 — Montrer que le mouvement est uniforme et exprimer la vitesse angulaire ωc du
mou-vement. Le cercle est-il parcouru dans le sens direct ou r´etrograde ?
Ce mouvement est ´equivalent, pour des dur´ees nettement sup´erieures `a 2π/ωc, `a une boucle
de courant circulaire de rayon r parcourue par un courant (moyen) i associ´e `a la rotation
p´eriodique de la charge q. Il s’agit donc d’un dipˆole magn´etique de moment ⃗M .
7 — Montrer que l’´energie cin´etique Ec du mouvement v´erifie Ec = − ⃗M · ⃗B0. Pour la suite
de cette partie, on consid´erera que ce r´esultat reste applicable, mˆeme si ⃗B0 n’est plus exactement
uniforme.
On ´etudie maintenant le mouvement d’un proton dans un champ non uniforme, ⃗B0 = −B0(z)⃗ez;
on notera Gm(z) = dBdz0 l’intensit´e du gradient associ´e. On admet l’expression de la r´esultante
des forces exerc´ees sur cette particule, en fonction du moment magn´etique ⃗M ´equivalent `a son
mouvement moyen : ⃗F = ! ⃗M ·−grad−→" ⃗B0 soit aussi ⃗F = −MzdBdz0⃗ez. Le proton, issu du vent
solaire, s’approche du pˆole terrestre nord.
8 — `A l’approche du pˆole nord et en justifiant votre r´eponse, pr´eciser la direction et le sens
des trois vecteurs ⃗B0, ⃗M et ⃗F . Le proton est-il frein´e ou acc´el´er´e ?
9 — L’hypoth`ese Gm(z) ̸= 0 est-elle compatible avec l’´equation de Maxwell assurant la
conservation du flux magn´etique le long d’un tube de courant ?
10 — Compte tenu du caract`ere dipolaire du champ g´eomagn´etique, ´evaluer Gm(z) puis
l’acc´el´eration d’un proton d’´energie Ec = 0,50 keV `a l’approche imm´ediate du pˆole ; comparer
aux effets de la pesanteur. Que peut-on en conclure ?
II. — La glace de la banquise
L’existence de couverts de glace de grande ´epaisseur au-dessus des oc´eans polaires est bien
sˆur une caract´eristique remarquable des r´egions polaires. On ´etudie ici deux propri´et´es de ces
couverts de glace :
Physique I, ann´ee 2019 — fili`ere PSI
— un mod`ele simple de croissance de l’´epaisseur de la glace en hiver (partie II.B).
II.A. — Un traˆıneau sur la glace
Un traˆıneau `a chiens est un dispositif de masse totale M (le pilote, ou musher, est compris dans cette masse) qui peut glisser sur la surface de la glace avec des coefficients de glissement
statique (avant le d´emarrage) µs et dynamique (en mouvement) µd.
11 — Les chiens sont reli´es au traˆıneau par des ´el´ements de corde tendus, de masse n´egligeable et inextensibles. Montrer qu’un tel ´el´ement de corde transmet les tensions et que celles-ci sont colin´eaires `a la corde.
12 — Le trajet se fait soit `a l’horizontale, soit sur une faible pente ascendante caract´eris´ee par l’angle α avec l’horizontale. Montrer que, dans ce dernier cas, tout se passe comme dans
un mouvement horizontal sous r´eserve de remplacer µd par µ′d, que l’on exprimera.
L’intensit´e de la force de traction totale F exerc´ee par l’ensemble des chiens d´epend de leur
vitesse v et on adoptera le mod`ele F = F0 −βv o`u F0 et β sont des constantes positives. On
prendra les valeurs M = 5,0 × 102kg, α = 0, µ
d = 5,0 × 10−2 et µs = 8,0 × 10−2.
13 — D´eterminer la valeur minimale de F0
permet-tant le d´emarrage du traˆıneau.
14 — La vitesse du traˆıneau en r´egime stationnaire
est v0 = 3 m · s−1, atteinte `a 5% pr`es au bout d’un temps
t1 = 5 s. Exprimer d’une part β en fonction de M et t1 et
d’autre part F0 en fonction de β, v0, µd, M et g. Calculer
leurs valeurs respectives.
Toujours `a vitesse constante v0, le traˆıneau aborde une
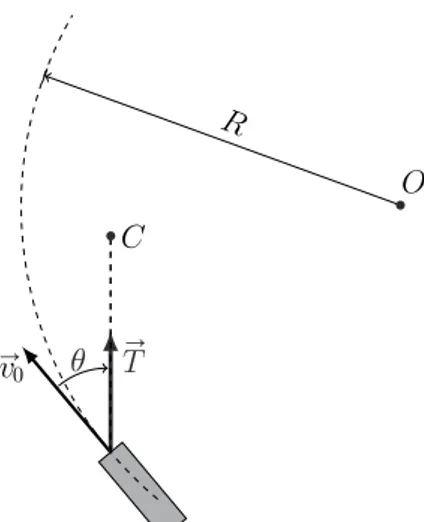
courbe `a plat qu’on assimilera `a un cercle de centre O et de rayon R (cf. fig. 2). Les chiens (mod´elis´es ici en un seul point C) doivent donc tirer vers l’int´erieur du cercle.
15 — D´eterminer en fonction des donn´ees la tension ⃗
T de la corde et l’angle θ entre la force de traction et la trajectoire. " #0 $ / % / ! &
Figure2 – Trajectoire circulaire du
traˆıneau
II.B. — Croissance hivernale de l’´
epaisseur de glace
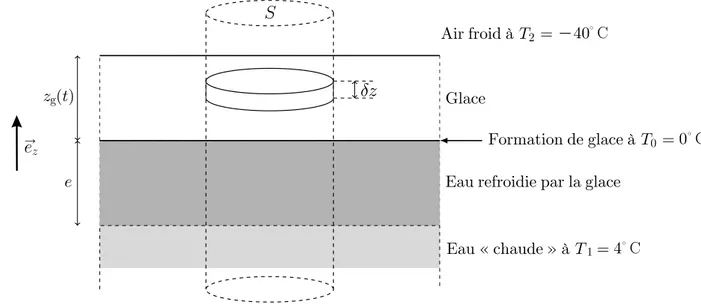
Pour ´etudier la croissance de la couche de glace en hiver, on mod´elise l’oc´ean sous la banquise en formation de la mani`ere suivante (cf. fig. 3) : en profondeur, la temp´erature de l’eau est
maintenue constante `a T1 = 4◦C par les courants oc´eaniques. Sur une hauteur constante e
sous la banquise, l’eau se refroidit progressivement jusqu’`a atteindre T0 = 0◦C `a l’altitude
z = 0 de formation de la glace (on n´eglige tout effet de salinit´e de l’eau). La couche de glace
a une ´epaisseur croissante zg(t) qu’il s’agit de d´eterminer ; au-dessus de celle-ci, l’air est `a la
temp´erature constante T2 = −40◦C. On notera λe et λg les conductivit´es thermiques et ce et cg
les capacit´es thermiques massiques de l’eau liquide et de la glace, ρg et lf la masse volumique
et l’enthalpie massique de fusion de la glace ; toutes ces grandeurs sont des constantes.
L’´epaisseur de glace zg(t) augmente r´eguli`erement du fait de la cristallisation de l’eau refroidie
Physique I, ann´ee 2019 — fili`ere PSI
Eau refroidie par la glace
Eau « chaude » à "1 Glace Air froid à "2= K40 #g( )$ % Formation de glace à " ' &# ºC 0= 0ºC = 4ºC () /
Figure 3 – L’oc´ean sous la banquise en formation
syst`eme d´efini par un cylindre vertical de surface S unit´e (cf. fig. 3) au sein duquel les transferts thermiques unidimensionnels sont r´egis par la loi de Fourier.
16 — Par une ´etude des ´echanges thermiques de l’´epaisseur δz prise `a l’int´erieur de la
glace, ´etablir une ´equation aux d´eriv´ees partielles v´erifi´ee par la temp´erature Tg(z,t) au sein de
la glace.
17 — D´eterminer une expression donnant l’ordre de grandeur de la dur´ee ∆t de la diffusion thermique au sein de la glace sur une hauteur ∆z. Quelle dur´ee doit-on attendre afin de pouvoir
consid´erer que, pour des ´evolutions assez lentes, la temp´erature Tg ne d´epend pratiquement plus
du temps ? Pr´eciser ce que l’on entend par ≪assez lentes≫.
On se place dans ce cas dans toute la suite : dans l’eau comme dans la glace, les r´epartitions
de temp´erature seront suppos´ees quasi–statiques.
18 — D´efinir et exprimer les r´esistances thermiques Rg et Re, pour une aire donn´ee S, des
couches de glace et d’eau refroidie sous la glace.
Les transferts thermiques `a travers la surface sup´erieure de la banquise sont d´ecrits par la loi de Newton des transferts pari´etaux (radiatifs et convecto–conductifs) : la puissance ´echang´ee
par unit´e d’aire de cette surface v´erifie |Pu| = h|Ts−T2| o`u Ts est la temp´erature au sommet
de la couche de glace ; le coefficient h > 0 de la loi de Newton est suppos´e connu et constant.
19 — Exprimer la r´esistance thermique Ri, pour une aire S, de l’interface entre l’air et la
glace.
20 — Montrer que le r´egime quasi–permanent de croissance de la couche de glace peut ˆetre
d´ecrit par le sch´ema ´electrique ´equivalent de la figure 4 et pr´eciser l’expression du≪courant≫Φ
du ≪g´en´erateur de courant≫ en fonction notamment de lf, ρg et de la vitesse de croissance
vg =
dzg
dt de la couche de glace.
21 — En ´electricit´e, connaissez-vous un dispositif D permettant d’assurer une diff´erence de potentiel nulle sans appel de courant ? Si oui, comment faut-il le brancher ? En thermody-namique, pour quelle raison la diff´erence de temp´erature aux bornes de D est-elle maintenue nulle ?
22 — ´Etablir l’´equation diff´erentielle v´erifi´ee par zg(t). On suppose que pour toutes les
valeurs de t consid´er´ees on a e
λe
≫ zg
λg +
1
h, en d´eduire la loi d’´evolution de l’´epaisseur de la
Physique I, ann´ee 2019 — fili`ere PSI D 'e 0 0 'g 'i © "0= 0ºC "2= K40ºC "1= 4ºC
Figure 4 – Circuit ´electrique ´equivalent `a la croissance de la couche de glace
fonction des param`etres du mod`ele. L’instant t = 0 correspond au d´ebut de la formation de la banquise.
23 — Tracer et commenter l’allure de la courbe donnant zg en fonction de t. On montrera
notamment l’existence de deux r´egimes successifs.
Donn´
ees et formulaire utiles pour l’ensemble du sujet
Donn´ees num´eriques et constantes fondamentales
Champ magn´etique terrestre `a l’´equateur BE = 3,0 × 10−5T
Charge ´el´ementaire e = 1,6 × 10−19C
Dur´ee du jour solaire moyen T0 = 24 h = 8,6 × 104s
Intensit´e du champ de pesanteur g0 = 9,8 m · s−2
Masse du proton mp = 1,7 × 10−27kg
Masse volumique de l’eau liquide `a 4◦C ρ
e= 1,0 × 103kg · m−3
Perm´eabilit´e magn´etique du vide µ0 = 4 π × 10−7H · m−1
Rayon terrestre RT = 6,4 × 103km
Viscosit´e dynamique de l’eau liquide `a 4◦C η
e= 1,6 × 10−3kg · m−1· s−1
Logarithme n´ep´erien du nombre 20 ln(20) ≃ 3,0
Lois de Coulomb du glissement
Lors du glissement d’un solide `a la vitesse ⃗v sur un support, la r´eaction du support se d´ecompose
en une composante tangentielle ⃗T colin´eaire et oppos´ee `a ⃗v et une composante ⃗N normale au
support. Dans le mod`ele de Coulomb, le coefficient de glissement dynamique correspond au
rapport µd= % % %T⃗ % % % / % % %N⃗ % % %.
Lorsque cette vitesse est nulle, le solide adh`ere au support et l’on a %%
%T⃗ % % % ≤ µs % % %N⃗ % % % o`u µs est
Physique I, ann´ee 2019 — fili`ere PSI
Coordonn´ees sph´eriques et g´eographiques
On notera (Oxyz) les axes cart´esiens associ´es `a la base orthonorm´ee et directe (⃗ex, ⃗ey, ⃗ez). Les
coordonn´ees sph´eriques d’un point P sont not´ees (r, θ, ϕ) avec la base locale associ´ee (⃗er, ⃗eθ, ⃗eϕ),
cf. fig. 5 `a gauche. On note aussi ϕ (longitude) et λ la latitude d’un point P de la surface terrestre ; le point A est situ´e sur l’´equateur dans le m´eridien origine (ϕ = 0) ; celui-ci passe par l’observatoire de Greenwich G, cf. fig. 5 `a droite.
# ( ) * + , -%# -%, Pôle Nord Pôle Sud Équateur . / -%( -%) ! -%+ -% ! , 0 * géographique géographique ! ! ( #
Figure 5 – Coordonn´ees sph´eriques et g´eographiques
Donn´ees et formules relatives aux dipˆoles magn´etiques
Le champ magn´etique cr´e´e par un dipˆole de moment dipolaire ⃗M plac´e `a l’origine O des
coordonn´ees est donn´e au point P par : ⃗ B(P ) = µ0 4π 3 ⃗R! ⃗M · ⃗R"−R2M⃗ R5 o`u ⃗R = −→ OP et R = ∥ ⃗R∥
Les interactions d’un dipˆole magn´etique rigide de moment dipolaire ⃗m soumis `a un champ
magn´etique ext´erieur ⃗B sont d´ecrites par l’´energie potentielle Ep = − ⃗m · ⃗B et par le couple des
actions ´electromagn´etiques ⃗Γ = ⃗m ∧ ⃗B.
FIN DE L’´EPREUVE
II Préparation du substrat préalablement à l’essai de pelage
Quel que soit le type de colle à déposer (y compris celle présente sur le ruban adhésif) et le type de surface ciblée, on ne peut obtenir une force d’adhérence élevée et stable dans le temps qu’après un traitement chimique préalable. Cela est particulièrement vrai pour les métaux pour lesquels le défaut de force d’adhérence provient généralement de la fine couche d’oxyde ou bien de lubrifiants, d’huile de coupe, de graisse d’étirage, etc. dus au procédé de fabrication, présente à la surface de la plupart des métaux.
Un traitement particulièrement simple et encore très souvent utilisé consiste à attaquer le métal avec un acide. Ainsi, les atomes de surface sont oxydés et partent en solution entrainant avec eux les oxydes et autres impuretés.
II.A – Comparaison de différents acides minéraux
Dans cette partie on va comparer trois acides forts : les acides chlorhydrique (HCl en solution dans l’eau), sulfurique (H2SO4en solution dans l’eau) et nitrique (HNO3en solution dans l’eau) en vue de décaper localement une surface métallique. Les données numériques utiles sont regroupées à la fin de l’énoncé.
II.A.1) Donner les structures de Lewis de HCl et de H2SO4sachant que l’élément soufre est situé en dessous
de l’élément oxygène dans la classification périodique.
II.A.2) On souhaite décaper une surface de cuivre (c’est-à-dire éliminer une partie des atomes de cuivre
Cu(s)à la surface du métal). Parmi les trois acides présentés ci-dessus, expliquer quel(s) acide(s) il est possible
d’utiliser et le(s)quel(s) il n’est pas possible d’utiliser.
II.B – Étude d’une étape de la synthèse de l’acide sulfurique
L’acide sulfurique est très souvent utilisé dans l’étape de décapage (parfois en combinaison avec de l’acide nitrique, du sulfate ferrique…). Il est obtenu industriellement par hydratation du trioxyde de soufre SO3obtenu
par oxydation de SO2, lui-même issu du traitement du soufre.
On considère la réaction, à l’équilibre thermodynamique, d’équation : SO2 (g)+1
2O2 (g)= SO3 (g) (II.1) Le taux de conversion 𝛼 de cette réaction est défini par :
𝛼 = 𝑛SO3 𝑛SO3+ 𝑛SO2
Expérimenter avec un morceau de Scotch
®
Conditionné sous forme de rouleau, un ruban adhésif (généralement désigné par le terme « Scotch® ») est
constitué de deux couches solidaires l’une de l’autre : une couche « molle » sur la face interne (celle qui colle) et une couche « dure » sur la face externe du rouleau (qui parait néanmoins souple car très fine). L’épaisseur de l’ensemble est de l’ordre de quelques dizaines de micromètres. On propose d’étudier dans ce problème quelques expériences mettant en jeu les propriétés — adhésives ou autres — des rubans adhésifs.
Certaines questions, repérées par une barre en marge, ne sont pas guidées et demandent de l’initiative de la part du candidat. Les pistes de recherche doivent être consignées ; si elles sont pertinentes, elles seront valorisées. Le barème tient compte du temps nécessaire pour explorer ces pistes et élaborer un raisonnement.
Des données numériques sont regroupées en fin d'énonccé.
La composition du système est systématiquement donnée en fraction molaire.
II.B.1) Optimisation des conditions expérimentales
Les figures 4, 5 et 6 présentent l’évolution du taux de conversion en fonction de la température pour différentes conditions opératoires. En analysant chacune de ces figures, proposer un ensemble de conditions opératoires permettant d’optimiser le taux de conversion de la réaction d’oxydation du dioxyde de soufre.
400 450 500 550 600 650 0,5 0,6 0,7 0,8 0,9 1 1 2 4 6 8 bar Température (°C) Taux de con version O2 (g) N2 (g) SO2 (g) 9% 79% 12% Composition initiale
Figure 4 Influence de la pression
400 450 500 550 600 650 0,5 0,6 0,7 0,8 0,9 1 III II I Température (°C) Taux de con version Courbe O2 (g) N2 (g) SO2 (g) I 14% 79% 7% II 12% 79% 9% III 9% 79% 12% Compositions initiales
Figure 5 Proportion initiale de N2 (g)et pression fixées
400 450 500 550 600 650 0,5 0,6 0,7 0,8 0,9 1 III II I Température (°C) Taux de con version Courbe O2 (g) N2 (g) SO2 (g) I 12% 79% 9% II 10,5% 80,5% 9% III 8,5% 82,5% 9% Compositions initiales
II.B.2) Choix de la température – Approche théorique
Dans la suite de cette partie, on se place dans l’approximation d’Ellingham, c’est-à-dire que les variations de l’enthalpie standard de réaction et de l’entropie standard de réaction avec la température sont supposées négligeables.
a) Montrer que la constante d’équilibre 𝐾 de la réaction (II.1) vérifie la loi ln 𝐾 = 𝑘1+ 𝑘𝑇2 où 𝑇 est la
température du milieu exprimée en kelvin.
b) Préciser les valeurs numériques de 𝑘1 et 𝑘2.
c) Confronter l’expression de ln 𝐾 au choix des paramètres d’optimisation du processus discuté précédemment.
II.B.3) Choix de la composition du système – Approche théorique
a) Exprimer le taux de conversion 𝛼 en fonction de la pression partielle en dioxygène du milieu 𝑃O2, de la
constante d’équilibre de la réaction 𝐾 et de la pression standard 𝑃∘.
b) Confronter l’expression obtenue au choix des paramètres d’optimisation du processus discuté précédem-ment.
II.B.4) Pour déterminer s’il est préférable de travailler en présence de dioxygène pur ou d’air, on considère un
système à l’équilibre auquel on ajoute une quantité d𝑛𝑁2 de diazote, tous les autres paramètres étant inchangés.
Le système se retrouve alors dans un état hors équilibre caractérisé par un quotient de réaction 𝑄.
a) Exprimer 𝑄 en fonction de la pression totale 𝑃, de 𝑃∘, des quantités de matière à l’équilibre et de d𝑛 N2.
b) En déduire le sens d’évolution du système hors équilibre suite à l’ajout de diazote à 𝑇 et 𝑃 fixés. Confronter ce résultat au choix des paramètres d’optimisation du processus discuté précédemment.
c) Dans la pratique, le dioxygène pur n’est jamais utilisé. Proposer une explication.
La partie III a été retirée du sujet d'origine. Merci de tourner la page pour la suite du sujet.
IV Obtention de graphène par le procédé d’exfoliation « au Scotch
®»
Le graphène est un cristal bidimensionnel, constitué d’atomes de carbone répartis régulièrement sur un réseau hexagonal en forme de nid d’abeille. En appliquant un simple morceau de Scotch® sur un cristal de graphite,
les physiciens Konstantin Novoselov et Andre Geim ont réussi, en 2004, à isoler et à observer une unique feuille de graphène. Ils ont reçu le prix Nobel de physique en 2010 pour ces travaux. Le graphène s’est avéré être un matériau fascinant, aux propriétés électroniques exceptionnelles et donne lieu, depuis 2004, à des recherches variées à la fois en physique fondamentale et en physique appliquée.
IV.A – Diagramme de phases du carbone
Le carbone solide existe sous deux variétés allotropiques aux propriétés physico-chimiques très différentes : le
diamant (dur, cassant, transparent, isolant) et le graphite (mou, noir, conducteur). On donne sur la figure 8 le
diagramme d’état du carbone.
0 1000 2000 3000 4000 5000 6000 105 106 107 108 109 1010 1011 graphite diamant gaz liquide température (K) pression (P a)
Figure 8 Diagramme de phases du carbone
IV.A.1) Quelle est la forme stable du carbone à 0 °C sous 1 bar ?
IV.A.2) Sous quelles pressions le graphite peut-il se transformer en diamant ? Où peut-on rencontrer de
telles pressions ?
IV.A.3) Comment expliquer que des diamants puissent être achetés dans des bijouteries ?
IV.B – Structure cristallographique du diamant
Le diamant cristallise dans une structure cubique telle que les atomes de carbone forment un réseau cubique à faces centrées et occupent un site tétraédrique sur deux en alternance.
IV.B.1) Dessiner la maille du diamant.
IV.B.2) Quelle est la compacité de l’édifice en supposant qu’il y a tangence entre atomes de carbone les plus
IV.B.3) La masse volumique du diamant vaut 3520 kg⋅m−3. En déduire la distance séparant deux atomes
de carbone.
IV.C – Structure cristallographique du graphite et comparaison
Le graphite présente une structure en feuillets superposés de type ABAB. Au sein d’un même feuillet, les carbones ont une géométrie trigonale plane avec des angles de 120° et des longueurs de liaison de 141 pm. La maille hexagonale associée à la structure est représentée figure 9.
Figure 9 À gauche : représentation schématique des feuillets du graphite vus de
dessus. À droite : maille hexagonale du graphite
IV.C.1) Déterminer le nombre d’atomes en propre par maille.
IV.C.2) La densité du graphite étant comprise entre 2,09 et 2,23, en déduire une fourchette pour la distance
entre deux feuillets.
IV.C.3) En comparant les différentes distances entre atomes de carbone rencontrées dans cette partie,
discuter la nature des liaisons C-C dans le diamant, dans les feuillets du graphite et entre les feuillets du graphite. Commenter.
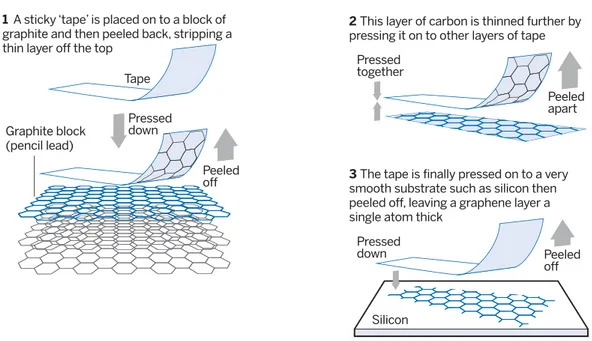
IV.D – Du graphite au graphène
Le graphène correspond à un unique feuillet d’atomes de carbones constituant le graphite. La figure 10 explique comment obtenir un tel feuillet à partir d’un bloc de graphite (tiré d’une mine de crayon par exemple) et d’un morceau de ruban adhésif.
won- equip-Graphite block (pencil lead) Pressed down Peeled off
1 A sticky ‘tape’ is placed on to a block of
graphite and then peeled back, stripping a thin layer off the top
Tape indefi- proper- elec-conductivity, corpo-Pressed together Peeled apart
2 This layer of carbon is thinned further by
pressing it on to other layers of tape
corpo- proper- Nov- Uni-electronics, Pressed down Peeled off
3 The tape is finally pressed on to a very
smooth substrate such as silicon then peeled off, leaving a graphene layer a single atom thick
Silicon
Figure 10 Illustration extraite de l’article Faster, stronger, bendier de Clive Cookson, publié
dans Financial Times du 28 janvier 2013
IV.D.1) À partir d’arguments qualitatifs uniquement, justifier la faisabilité d’un tel procédé.
IV.D.2) Dans le domaine de la recherche, le graphène est particulièrement étudié pour ses propriétés
électroniques exceptionnelles. Comment expliquer simplement les propriétés conductrices du graphène ? • • • FIN • • •
Données numériques
Divers
− Constante des gaz parfaits : 𝑅 = 8,314 J⋅mol–1⋅K–1
− Constante d’Avogadro : 𝒩A= 6,02 × 1023mol–1
− L’air est considéré comme un mélange gazeux dont les fractions molaires sont 20% de O2et 80% de N2
− Masse volumique de l’eau liquide : 𝜌 = 1,0 × 103kg⋅m–3
Extrait du tableau périodique
Numéro atomique 1 6 8 16 17
Symbole H C O S Cl
Masse molaire atomique (g⋅mol−1) 1 12 16 32,1 35,5
Potentiels rédox standard à 298 K
Les espèces non attachées à un couple rédox seront supposées électro-inactives dans les conditions de l’énoncé. Fe2+
(aq)/Fe(s) H+(aq)/H2 (g) Cu2+(aq)/Cu(s) NO−3 (aq)/NO(g) O2 (g)/H2O(ℓ)
𝐸∘ (V) −0,44 0 0,34 0,96 1,23 Grandeurs thermodynamiques à 298 K S(α) O2 (g) N2 (g) SO2 (g) SO3 (g) Δf𝐻∘ (kJ⋅mol−1) 0 0 0 −297 −396 𝑆∘ m (J⋅mol−1⋅K−1) 31,8 205 192 248 257