UNIVERSITÉ MOHAMMED V AGDAL FACULTÉ DES SCIENCES RABAT N° d’ordre……….. THÈSE DE DOCTORAT Présentée par Amzal Hassane Discipline : Biologie Spécialité : Biochimie-Pharmacologie
Titre : Étude de l’activité antioxydante des saponines du tourteau
de l’arganier.
Soutenue le 24 /04/2010
Devant le jury,
Pr. ESSASSI El Mokhtar: Président :
Professeur de l’Enseignement supérieur (UM5a/FSR)
Pr. ALAOUI Katim
Professeur de l’Enseignement supérieur (UM5s/FMP)
Pr. AMZAZI Saaid
Professeur de l’Enseignement supérieur (UM5a/FSR)
Pr. BAKRI Youssef Examinateurs
Professeur habilité (UM5a/FSR)
Pr. BENJOUAD Abdelaziz
Professeur de l’Enseignement supérieur (UM5a/FSR/CNRST)
Pr. TAGHZOUTI Khalid
Professeur de l’Enseignement supérieur (UM5a/FSR)
Faculté des Sciences, 4 Avenue Ibn Battouta B.P. 1014 RP, Rabat.
Avant propos :
Les travaux présentés dans cette thèse ont été effectués au laboratoire de biochimie immunologie dans l’unité de formation et de recherche biochimie immunologie de la faculté des sciences de rabat sous la direction du Professeur A. Benjouad.
En premier lieu, je remercie vivement, Monsieur le Professeur Benjouad A., directeur de ma thèse, responsable de l’UFR "Biochimie-Immunologie", de l’attention et du soutien qu’il a portés à mon travail de doctorant.
Je remercie vivement Madame la Professeure Alaoui K. du Laboratoire de Pharmacologie et Toxicologie à la Faculté de Médecine et de Pharmacie de Rabat et DG de la Fondation Mohammed VI pour la recherche et la sauvegarde de l’arganier, qui m’a fait l’honneur de me proposé ce sujet.
Je remercie vivement Monsieur le Dr. Errachidi A. et Monsieur le Dr. Charof R du Laboratoire de Biochimie et d’Hématologie à l’Institut National d’Hygiène.
Je remercie également Madame le Dr. Brahimi-Horn M. C. (CNRS UMR6543 Nice, France) pour sa lecture critique des articles.
J’aimerais également remercier Monsieur le Pr. Bakri Y. qui a bien voulu accepter d’être le rapporteur de cette thèse.
Les remerciements vont aussi aux membres du jury Messieurs le Pr. Essassi E., Pr. Amzazi S. et Pr. Taghzouti K., qui donneront à mon travail une valeur ajoutée à travers leurs recommandations et leurs remarques si importantes, dont je serai très reconnaissant.
i
Table des matières
Table des matières... i
Abbréviations ... iii
Liste des illustrations... iv
Liste des tableaux... vi
Remerciements... vii
Glossaire... viii
Introduction ...1
Chapitre I. Revue bibliographique ...5
1. Plante étudiée: ...6
1.1 Présentation de la plante: ...6
1.2 Distribution géographique: ...8
1.3 Saponines:...9
1.3.1 Distribution de saponines: ...13
1.3.2. Propriétés biologiques et pharmacologiques des saponines: ...13
2. Radicaux libres et peroxydation lipidique: ...23
2.1. Définitions des radicaux libres: ...23
2.2. Les sources de radicaux libres:...27
2.3 Les réactions radicalaires de l'oxygène: ...31
2.4 Peroxydation lipidique: ...33
2.4.1 Peroxydation non-enzymatique: ...35
2.4.2 Peroxydation enzymatique: ...37
2.5 Oxydation des protéines: ...38
2.6 Accumulation de protéines oxydées: ...40
2.7 Pathologies impliquant des métabolites réactifs d’oxygène: ...41
2.7.1 Les mécanismes de réactions des radicaux dans les cellules tumorales:...42
2.7.2 Athérosclérose: ...43
2.7.3 Mécanismes de médiation des radicaux libres dans l’inflammation:...44
2.7.4 Arthrite rhumatoïde:...45
2.7.5 Le vieillissement et les radicaux libres:...46
ii 3.1 Définition: ...48 3.2 Antioxydants intracellulaires: ...52 3.2.1 Systèmes enzymatiques:...53 3.2.2 Antioxydants nonenzymatiques: ...56 4. Buts du travail:...61
Chapitre II. Matériel et méthodes...62
1. Produits chimiques et réactifs: ...63
2. Matériel végétal:...63
3. Mesure de la libération de l’hémoglobine par les globules rouges (GR): ...64
4. Mesure de la perte en potassium par les GR:...65
5. Mesure de l’oxydation d'hémoglobine: ...65
6. Oxydation de la BSA: ...65
7. Oxydation d’une émulsion lipido-protéique: ...67
8. Hydroperoxydes de protéine: ...67
9. Diènes Conjugués: ...68
10. Analyses statistiques:...68
Chapitre III. Résultats et discussions: ...69
1. Activité hémolytique des saponinnes d’Argania spinosa: ...70
2. Oxydation de l’hémoglobine: ...75
3. Oxydation de la BSA et de LnMe:...78
4. Discussion: ...85
7. Conclusions: ...89
Bibliographie...91
Annexes: ...109
iii
Abbréviations
AAPH 2,2' azo-bis-hydrochlorure (2-amidinopropane),
EDTA acide éthylène diamine tétra acétique
iv
Liste des illustr ations
1. Photographie d’Argania spinosa.
2. Photographie du fruit d’Argania spinosa. 3. Distribution d’Argania spinosa.
4. Structure chimique des saponines.
5. Structures chimiques des saponines d’Argania spinosa.
6. Origine des différents radicaux libres oxygénés et espèces réactives de l’oxygène impliqué en biologie.
7. Lésions cellulaires induites par les radicaux libres.
8. Mécanisme en chaîne de la peroxydation des acides gras polyinsaturés et nature des produits terminaux formés.
9. Les différentes étapes de la peroxydation des lipides.
10. Les espèces réactives, le dommage oxydatif et les réponses cellulaires au stress oxydatif. 11. Conséquences des effets des diverses espèces réactives sur le fonctionnent des protéines et leur destin.
12. Structure de quelques antioxydants regroupés en fonction de leur caractère hydrophile ou lipophile.
13. Les différents mécanismes d’actions possibles des antioxydants. 14. Antioxydants intracellulaires.
15. Mode d’action des principaux systèmes enzymatiques antioxydants et de leurs cofacteurs métalliques.
16. Effet hémolytique des saponines d'Argania spinosa évalué quantitativement par la libération d'HbO2 (absorbance à 540 nm) en absence d'H2O2 avec un lissage par un modèle logistique à quatre paramètres.
17. Effet des différents traitements sur l’absorbance à 540 nm induite par H2O2 à des temps divers d’incubation (1 heure, 2 heures et 3 heures).
18. Effet des divers traitements sur la perte en potassium cellulaire induite par H2O2 après 1 heure.
v
19. Spectre absorption d'oxyhémoglobine du contrôle après l'incubation de 7 heures à 37 °C avec un lissage de Savitzky-Golay.
20. Effet des différents traitements sur l’absorption d’oxyhémoglobine à 540 nm après incubation de 7 heures à 37 °C.
21. Effet de différents systèmes d’oxydant sur la solubilité BSA (quantifié avec la méthode de folin-phénol) après incubation durant 6 heures.
22. Effet de différents agents incluant les saponines d'A. spinosa sur la solubilité BSA (quantifié avec la méthode de folin-phénol) après 4 heures dans le système oxydant:.Cu2 +/H2O2
23. Effet des saponines d'A. spinosa et du trolox sur les hydroperoxydes protéine produite (mM/mg BSA), (a ; 2,2' azo-bis-(2-amidinopropane) hydrochloride, i ; Fe2+ /H2O2, + ; plus linolenic acid methyl ester, - ; absence of linolenic acid methyl ester) pendant une heure ou une période d'incubation de quatre heures.
24. Effet des saponines d'A. spinosa et du trolox sur la formation de diènes conjugués par l'émulsion de la BSA et du linoleate de méthyle ester après 1 et 6 h avec AAPH et Fe2+/H2O2 (a ; 2,2' azo-bis-(2-amidinopropane) hydrochloride (AAPH), i ; Fe2+ /H2O2).
vi
Liste des tableaux
Tableau 1. Quelques propriétés biologiques et pharmacologiques des saponines (d’après Pubmed).
Tableau 2. Les espèces réactives d'oxygène (ROS) et les espèces réactives d'azote (RNOS).
vii
Remerc ieme nts
En premier lieu, je remercie vivement, Monsieur le Professeur Benjouad A., directeur de ma thèse, responsable de l’UFR "Biochimie-Immunologie", de l’attention et du soutien qu’il a portés à mon travail de doctorant.
Je remercie vivement Madame la Professeure Alaoui K. du Laboratoire de Pharmacologie et Toxicologie à la Faculté de Médecine et de Pharmacie de Rabat et DG de la Fondation Mohammed VI pour la recherche et la sauvegarde de l’arganier, qui m’a fait l’honneur de me proposé ce sujet.
Je remercie vivement Monsieur le Dr. Errachidi A. et Monsieur le Dr. Charof R du Laboratoire de Biochimie et d’Hématologie à l’Institut National d’Hygiène.
Je remercie également Madame le Dr. Brahimi-Horn M. C. (CNRS UMR6543 Nice, France) pour sa lecture critique des articles.
J’aimerais également remercier Monsieur le Pr. Bakri Y. qui a bien voulu accepter d’être le rapporteur de cette thèse.
Les remerciements vont aussi aux membres du jury Messieurs le Pr. Essassi E., Pr. Amzazi S. et Pr. Taghzouti K., qui donneront à mon travail une valeur ajoutée à travers leurs recommandations et leurs remarques si importantes, dont je serai très reconnaissant.
viii
Glossaire
Saponine. Glucoside qui mousse lorsqu’il est agité en solution aqueuse.
Antioxydant. Molécule qui ralentit ou empêche l’oxydation, la dégradation des aliments, de certains composés organiques ou de certains matériaux.
Ischémie. Arrêt ou insuffisance localisée de la circulation sanguine.
Cardioplegique. Caractère d’une solution qui provoque la paralysie du myocarde.
Molluscicide. Caractère d’un produit létal pour les limaces et les escargots.
1
Introduction
L’oxygène est essentiel pour la vie de tous les organismes eucaryotes. Cependant, même dans les réactions métaboliques fondamentales se produisant dans les cellules, les formes réactives de l’oxygène (ros : reactive oxygen species) sont capables d'endommager diverses biomolécules telles que les protéines, les acides désoxyribonucléiques (l'ADN) ou des acides gras polyinsaturés (Halliwell & Gutteridge 1984a, Halliwell & Gutteridge 1984b, Halliwell & Gutteridge 1986, Gutteridge & Halliwell 1990, Eze 1992, Gruber et al. 2008). En plus de la production normale de radicaux libres dans la cellule durant la respiration et le métabolisme, les quantités excessives de ros peuvent se former et leurs taux sont élevés durant le stress oxydatif en raison de l’inflammation, l’activité physique intensive, l’ischémie ou un traumatisme (Halliwell & Gutteridge 1984a). La carence en substances nutritives protectrices nécessaires ou en d'autres substances antioxydantes dans le régime alimentaire ou dans certaines conditions héréditaires pathologiques peuvent aussi affecter négativement l’équilibre entre les prooxydants et les antioxydants dans le corps. Si la quantité de radicaux libres et le stress oxydatif excèdent la capacité du système de défense antioxydant du corps, des dégâts oxydatifs peuvent en résulter. En effet, l’oxydation des lipides, des hydrates de carbone, des protéines et des acides nucléiques a été associée à des maladies cardiovasculaires et neurologiques, l’inflammation chronique et le cancer (Halliwell & Gutteridge 1984a, Halliwell & Gutteridge 1984b, Butterfield et al. 2002, Butterfield 2002). Bien que la relation entre le stress oxydatif et les maladies demeure imprécise (Gruber et al. 2008), les radicaux libres sont produits en plus grandes quantités lors de certaines maladies degeneratives.
2
Pour maintenir l'équilibre antioxydant-prooxydant, le corps humain est protégé contre le stress oxydatif par un système d’antioxydant complexe (Buettner & Schafer 2000).
Des mécanismes protecteurs dans le corps humain bloquent la production de radicaux libres, les dérivés réactifs, permettent la chélation des métaux de transition nécessaires pour convertir les espèces peu réactives en d'autres, plus réactives, réparent des dégâts des molécules cibles ou détruisent des molécules endommagées (Halliwell & Cross 1994). Le système de défense antioxydant consiste en un réseau enzymatique et non enzymatique aussi bien endogène qu'exogène, agissant synergiquement (Masella et al. 2005). Des facteurs enzymatiques, par exemple, la superoxyde dismutase (sod), la catalase et la glutathion peroxydase neutralisent les résidus oxydant, tandis que des protéines comme l’albumine, la ceruloplasmine et la transferrine participent à la défense antioxydante par la fixation des ions de cuivre et de fer (Halliwell & Gutteridge 1984a). Un autre type de défense antioxydante est la détoxification secondaire ou la neutralisation des produits des réactions des ros avec les macromolécules (Halliwell & Gutteridge 1984a). L’antioxydant non enzymatique, le tocophérol a une importance cruciale dans la protection de molécules lipophiles (Halliwell 1993). En raison de son radical stable et de ses propriétés moléculaires, il protège efficacement les membranes cellulaires contre l’oxydation. L’ubiquinol-q10 et probablement les caroténoïdes ont aussi un rôle antioxydatif dans l’organisme humain.
Dans le sérum humain et dans les liquides extra-cellulaires, les antioxydants hydrophiles participent à la protection contre les dégâts oxydatifs. L’acide ascorbique, aussi appelé vitamine C, agit comme un piégeur de radical libre et il est souvent couplé au tocophérol. D’autres systèmes couplés existent tels que l’acide urique/urate et la bilirubine contribuent à la capacité antioxydante du plasma. Les vitamines C et E et les caroténoïdes ne peuvent pas être synthétisés dans le corps
3
humain, et doivent provenir du régime alimentaire. Les antioxydants sont très variables de point de vue chimique et mécanismes d’actions.
L'arganier (Argania spinosa (L.) Skeels) est un arbre appartenant à la famille des sapotacea. Il est endémique du Maroc (région du sud-ouest et en particulier la plaine du Souss) et de l'Algérie (dans la région de Tindouf sud-ouest du pays). Son huile est utilisée depuis des siècles par les femmes berbères pour ses propriétés cosmétiques et alimentaires. Cette huile est riche en acides gras essentiels oméga-6 et en tocophérols, antioxydants recommandés pour prévenir le dessèchement prématuré de la peau. Elle ralentit le vieillissement cutané, et améliore l'hydratation. Son pouvoir hydratant et antioxydant compense la dénutrition de la peau. Les qualités organoleptiques font de l'huile d'argan une huile appréciée dans l'art culinaire.
L'huile d'argan contient 43% d’acide oléique (Oméga-9), 36% d’acide linoléique (Oméga-6) et le reste étant leurs formes mono-glycérique respective (Khallouki et al. 2003). Elle contient, en plus de ces acides gras, des tocophérols (vitamine E), du squalène, des stérols et des polyphénols. Même si l’huile (Drissi et al. 2004, Berrougui et al. 2006) et les saponines extraites de l’arganier ont des propriétés antioxydantes (Alaoui et al. 1998b), aucune étude ne s’est intéressée à la synergie qui peut exister entre les antioxydants et les saponines, ni à leur effet sur la peroxydation lipidique et l’oxydation des protéines.
4
Buts
La majorité des médicaments actuels dans leur majorité proviennent à leur origine des plantes médicinales.
Une meilleure valorisation des plantes médicinales marocaines passent par leurs études scientifiques. La plante étudiée Argania spinosa est certes endémique du Maroc, elle est généralement connue et elle est utilisée dans l’alimentation animale et humaine, mais cela n’empêche pas sa régression. Or cette plante par ces multiples vocations therapeutique et alimentaire permet une augmentation de la biodiversité et le maintient du sol nécessaire pour la pérennité de cette espèce et de son utilisation.
5
6
1. Plante étudiée:
1. 1 Pré sentation de la p lante:
L'arganier est un arbre aux rameaux épineux de 8 à 10 m de haut, aux feuilles atténuées en un court pétiole, très résistant et ayant une longévité de 150 à 200 ans (Figure 1).
Figure 1. Photographie d’Argania spinosa (Lieu : Maroc, Anti Atlas).
L'arganier est un arbre thermophile et xérophile, de bioclimat aride chaud et tempéré (le long du littoral et dans les plaines), à semi-aride chaud et tempéré (flancs du
7
Haut-Atlas et de l'Anti-Atlas). Les fleurs blanches à jaune verdâtre sont hermaphrodites, gamopétales à tube très court et sont réunies en glomérules. La période de floraison se situe durant mai-juin. Le fruit, l’affiache, est une fausse drupe ovale, fusiforme de 30 mm de long environ, jaune-brun à maturité contenant une noix dure protégeant deux ou trois « amandons » (Figure 2). Un arbre en produit approximativement 8 kg par an.
Plusieurs effets biologiques de cette plante ont été rapportées (Berrougui et al. 2003, Berrougui et al. 2004, Drissi et al. 2004, Drissi et al. 2006, Samane et al. 2006, Berrougui et al. 2006), elle possède une multitude de propriétés, parmi lesquelles,
• Anti-inflammatoire
• Analgésique et antiœdémateux • Hypoglycémique
• Antiradicalaire et antioxydante • Antitumorale et cytotoxique
• antiproliférative (cancer de la prostate humaine)
8
Figure 2. Photographie du fruit d’Argania spinosa (affiache)
Son système racinaire est particulièrement profond, mais dépourvu de poils absorbants (racines « magniloïdes»). Il bénéficie d'une symbiose avec différents champignons qui pallient les déficiences nutritives.
1. 2 Dist ribution géog raphique:
Aujourd'hui, la plus grande concentration d'arganiers se trouve dans la région du Souss où elle couvre près de 800 000 hectares, soit 14,25 % de la forêt du Maroc (figure 3). Dans cette région, l'aire de l'arganier s'étend de l'oued Tensift au nord, à Tiznit et Tafraout au sud, et aux abords du djebel Siroua à l'est. L'arganier pousse depuis le niveau de la mer jusqu'aux environs de 1 500 m d'altitude.
9
Figure 3. Distribution d’Argania spinosa (d’après Msanda et al., 2005).
1. 3 Saponines:
Argania spinosa est riche en saponines (Charrouf et al. 1992a), un groupe important de glycosides, largement distribué dans les plantes supérieure. Elles sont considérées responsables de nombreuses propriétés pharmacologiques (Sparg et al. 2004).
Les saponines constituent une importante classe de métabolites secondaires d’origine végétale et animale, de masse moléculaire entre 600 à 2000 Daltons et de structure complexe. Ce n’est que dans les années 70 avec l’aide des techniques de dégradation chimiques que leurs structures furent déterminées.
Les saponines sont des hétérosides complexes, appartenant aux terpènes cycliques (nom générique donné aux hydrocarbures saturés cycliques ou acycliques ayant pour motif de base le terpène) ou aux stéroïdes, se trouvant chez de nombreux végétaux (salsepareille, saponaire, quinoa, etc.) sous forme d'hétérosides (saponosides). Les
10
Saponines ont été recherchées comme des détergents (Sparg et al. 2004) comme le fut la Saponaire (Saponaria officinalis L.), qui a été largement employée pendant des siècles. Les saponines ont aussi été recherchées par l’industrie pharmaceutique parce qu’elles forment le point de départ de l’hémi-synthèse des médicaments stéroïdiens. Elles présentent plusieurs propriétés pharmacologiques et sont employées dans la phytothérapie et dans l'industrie cosmétique. Elles formeraient les principaux constituants de plusieurs remèdes issus des plantes et elles sont considérées responsables de nombreuses propriétés pharmacologiques (Estrada et al. 2000). Les saponines et les polyphénols sont considérés des éléments clefs dans la pharmacopée traditionnelle chinoise et sont responsables de la plupart des effets biologiques observés (Liu et al. 2002b). Ainsi, la racine de ginseng (Panax ginseng, Araliaceae) est l’un des plus importants remèdes traditionnel oriental, souvent utilisé dans les asthénies fonctionnelles, elle est utilisée dans le monde entier (Fukuda et al. 2000). Les saponines peuvent être classées en deux groupes en se basant sur la nature de leur squelette aglycone. Le premier groupe est constitué par des saponines stéroïdiennes, qui se rencontrent presque exclusivement dans les monocotylédones angiospermes. Le deuxième groupe est les saponines triterpenoides, qui sont le plus commun et on le rencontre chez les dicotylédones angiospermes (Sparg et al. 2004). Quelques auteurs distinguent un troisième groupe appelé amines stéroïdiennes, qui est classé par certains auteurs comme des alcaloïdes stéroïdiennes (Sparg et al. 2004). Les saponines stéroïdiennes consistent en aglycone stéroïdien, un squelette C27 spirostane et généralement avec l'inclusion aussi d'une structure à six cycles (Figure 4, structure A). Dans quelques cas, dans les matériaux frais des plantes, le groupe hydroxyle situe à la position 26 et s’engage dans une liaison glycosidique ainsi la structure de l’aglycone reste pentacyclique. Cela a été mentionné comme un squelette furostane (Figure 4, structure B). Les saponines triterpenoides consistent en un aglycone triterpenoide, formé d’un squelette C30, et l'inclusion d'une structure pentacyclique (Figure 4, structure C).
11
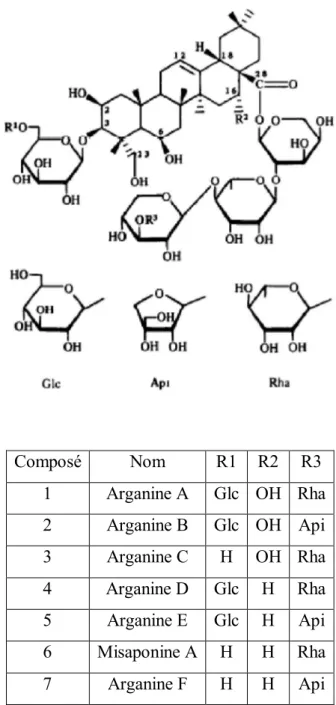
Figure 4. Structure chimique des saponines. Squelette aglycone (A), spirostane stéroïdien, (B) furostane stéroïdien et saponines triterpenoides(C). R = sucre.
12 Composé Nom R1 R2 R3 1 Arganine A Glc OH Rha 2 Arganine B Glc OH Api 3 Arganine C H OH Rha 4 Arganine D Glc H Rha 5 Arganine E Glc H Api 6 Misaponine A H H Rha 7 Arganine F H H Api
Figure 5. Structures chimiques des saponines d’Argania spinosa (d’après (Charrouf et al. 1992b).
13 1.3.1 Distribution de saponines:
Les Saponines sont distribuées dans une large variété de produits alimentaires et dans plusieurs familles de plantes différentes incluant l'asperge, les haricots, les mûres sauvages, les pois, les pommes de terre, la betterave sucrière et le thé (Dini et al. 2001).
1.3.2. Propriétés biologiques et pharmacologiques des saponines:
Compte tenu de leur diversité chimique, les saponines présentent de multiples propriétés biologiques et pharmacologiques (voir tableau 1)
Tableau 1. Quelques propriétés biologiques et pharmacologiques des saponines (d’après Pubmed).
Effet sur le système de transport du glucose Diurétique Effet sur le système adrénocorticotrope Cholérétique
Régulateur de la croissance des plantes Analgésique,Sédative Effet sur la fragilité des capillaires Anti exsudatif, Expectorant
Spermicide et contraceptive Répulsif
Réduction du cholestérol Hémolytique
Réduction de l’alcoolisme Anti-inflammatoire, Antiœdémateux Antileshmanien, Molluscicide Insecticide
Antivirale , Antifongique Anti protozoaire
Antiulcéreux, Immuno-modulateur Effet cardiovasculaire Antitumoral et cytotoxique Antivieillissement
14 1.3.2.1 Activité antioxydante et antiradicalaire:
Les saponines du ginseng vietnamien (Panax vietnamensis, Araliaceae) présentent une action protectrice à la dose de 0.05-0.5 mg/ml contre les radicaux libres in vivo et in vitro (Huong et al. 1998). Cependant, l'activité est attribuée aux composants mineurs.
Certains ginsenosides utilisés comme des agents additifs dans des solutions cardioplegiques, peuvent diminuer la toxicité des radicaux libres d'oxygène dans un modèle expérimental d’ischémie-reperfusion, en augmentant la concentration de la SOD dans le myocarde (Gulcin et al. 2004). L'acide arjunolique possède la capacité de réduire la toxicité oxydative induite par l’arsenic dans le cerveau murin et cela est en raison probablement de son activité antioxydante et de sa capacité de normaliser les indices de stress oxydatif (superoxyde dismutase, catalase, glutathion-S-transférase, glutathion peroxydase, glutathione réduit, thiols totaux, glutathione oxyde,…) par un traitement avec l’acide arjunolique à la dose de 20 mg/kg par poids du corps durant 4 jours (Sinha et al. 2008).
L’alpha-hederin, l’hederasaponin-C, l’hederacolchisides-E et F présentent une forte activité antioxydante totale (Gulcin et al. 2004). À la concentration de 75 pg/mL, ces saponines ont montré respectivement 94, 86, 88 et 75% de l’inhibition de la peroxydation de l’émulsion de l’acide linoléique.
Les saponines d'argania spinosa inhibent la dégradation du liquide synovial par les radicaux hydroxyles (IC20 ≥ 6 microM), et ont une action antiradicalaire contre les radicaux diphenylpicrylhydrazyles (DPPH) (IC25 = 85 mM) et contre les radicaux .
15 1.3.2.2 Activité anti-inflammatoire :
Aux doses orales de 50 à 300 mg/kg, les saponines d'Argania spinosa ont une action analgésique périphérique équivalente à celle de l’acide acétyle salicylique. La protection maximale a été obtenue à la dose de 500 mg/kg per os. Une diminution de l’œdème (œdème induit par la carragénine ou le trauma expérimental chez les rats) a été observée aux doses de 10 mg/kg per os. Aux doses de 50 à 100 mg/kg per os, l'effet antiinflammatoire était semblable à celui de l’indométacine aux doses de 10 à 20 mg/kg per os (Alaoui et al. 1998b).
Just et al. ont montré qu’une saponine bidesmosidique, la Fruticesaponine B isolée de Bupleurum fruticescens L. (Apiaceae), avait l'activité anti-inflammatoire la plus importante de toutes les saponines évaluées dans les essais d'œdème chez la souris (Just et al. 1998). Ils ont suggéré que l'activité anti-inflammatoire des saponines isolées de Bupleurum fruticescens est liée à leurs structures chimiques (Just et al. 1998). In vivo, les saponines isolées de Bupleurum rotundifolium L. (Apiaceae) ont montré une activité anti-inflammatoire contre l'oedème d'oreille induit par 12-O-tetradecanoylphorbol-13-acetate (TPA) et l'inflammation chronique de la peau (Navarro et al. 2001). Des sept saponines évaluées, cinq étaient assez actives dans la réduction de l'œdème d'oreille induit par le TPA. Les saponines ont produit une réduction dose dépendante de l’oedème. Seulement deux saponines étaient actives dans la réduction de l’inflammation chronique de la peau et ont aussi causé une diminution parallèle de l'infiltration des neutrophiles. Aescin, un mélange de saponines triterpenoides qui forme le principal actif d'Aesculus hippocastanum L. (pocastanaceae) responsable de l'activité anti-inflammatoire, possède des propriétés anti-œdémateuses et veinotonique (Sirtori 2001).
Une saponine stéroïdienne isolée des feuilles d'Agave attenuata (Agavaceae) inhibe l'augmentation de la perméabilité vasculaire causée par l'acide acétique (da Silva et al. 2002). Cependant, elle n'a pas été accompagnée par un effet hémolytique
16
indésirable. La saponine triterpenoide loniceroside C isolée des parties aériennes de Lonicera japonica (Caprifoliaceae), une plante médicinale connue comme agent anti-inflammatoire pendant des siècles, a montré une activité anti-anti-inflammatoire lorsqu'elle est évaluée in vivo par le test de l'œdème d'oreille de la souris provoqué par l’huile de croton (Kwak et al. 2003). Le Loniceroside C a inhibé l’oedème d'oreille (15-31 %) à des concentrations de 50-200 mg/kg.
Ahn et al. ont examiné l'activité anticomplémentaire des saponines du ginseng (Panax ginseng, Araliaceae) (Ahn et al. 1998). Parmi les saponines évaluées, Le Ginsenoside Ro et l'acide oléanolique ont montré la plus importante activité anticomplémentaire (Ahn et al. 1998). Kim et al. (Kim et al. 1998) ont suggéré que l'activité anti-inflammatoire des saponines serait probablement liée à l'activité anticomplémentaire de la voie classique d'inflammation.
1.3.2.3 Activité hémolytique:
Les saponines ont la capacité de lyser les érythrocytes (Ahn et al. 1998, Sindambiwe et al. 1998, Estrada et al. 2000, Molgaard et al. 2000, Woldemichael & Wink 2001). Cela a permis le développement d’essais hémolytiques pour détecter leur présence dans des médicaments ou dans les extraits de plantes. Un mélange de saponines oléanoliques a montré une activité hémolytique plus importante qu'un mélange dialysé de saponines Merck (Voutquenne et al. 1998) , ce qui laisse suggérer la diversité des mécanismes impliqués.
Quelques études de relations entre l’activité et la structure ont conclu que dans le cas des maesa-saponines isolées de Maesa lanceolata (Apers et al. 2001), les substitutions à la position C-22 semblent être une particularité structurelle essentielle qui influe l’activité hémolytique.
Les propriétés hémolytiques sont généralement attribuées à l'interaction entre les saponines et les stérols de la membrane érythrocytaire (Sparg et al. 2004). Les
17
recherches ont montré que les dégâts de saponines à la bicouche lipidique sont irréversibles. Oda et al. ont indiqué que l’activité adjuvante n’est pas liée à l'activité hémolytique (une molécule est dite adjuvante si elle augmente l'activité du composé actif en sa présence) (Oda et al. 2000). Le niveau d’activité hémolytique a été attribué au type d'aglycone et la présence de chaînes de sucre. Les Saponines avec un résidu acyles ou un cycle oxyde ont montré une activité hémolytique, à part le lablaboside D, qui en n'a pas montré malgré la possession d'un résidu acyle. L’Escin, des saponines d’Aesculus hippocastanum L. (Hippocastanaceae) et jujuboside, une saponine de Zizyphus jujuba (Rhamnaceae) ont une forte activité hémolytique (Oda et al. 2000).
Ahn et al. ont examiné l'effet inhibiteur des saponines de Bupleurum falcatum L. (Apiaceae) sur l'activité d'adhésion d'anti-cellulaire et sa relation avec l'effet hémolytique (Ahn et al. 1998). Les Saikosaponines D et E isolées, présentent des activités adhésives anticellulaires et hémolytiques très importantes. Ces résultats laissent suggérer que le mécanisme d'activité adhésive anticellulaire est similaire à l'effet hémolytique (Ahn et al. 1998).
1.3.2.4 Activité molluscicide:
Bien qu’elles soient toxiques vis-à-vis des espèces poïkilothermes, les saponines en prise orale le sont faiblement pour les espèces homéothermes (Sparg et al. 2004), ce qui est probablement lié à leurs faibles absorptions. Les saponines sont très toxiques pour les mollusques (Sindambiwe et al. 1998, Molgaard et al. 2000, Treyvaud et al. 2000, Apers et al. 2001, Huang et al. 2003) et elles ont été testées comme des molluscicides dans le contrôle des schistosomiases (Sindambiwe et al. 1998).
Molgaard et al. ont examiné la biodégradabilité des extraits aqueux des baies de Phytolacca dodecandra et ont montré que les saponines de l'extrait aqueux de
18
Phytolacca dodecandra sont moluscicides et aisément biodégradables (période de demi-vie de 15.8 h) (Molgaard et al. 2000).
Les saponines triterpenoides, hederagenin isolées de Sapindus mukorossi Gaertn (Sapindaceae) ont des effets molluscicides contre l'escargot du pommier (Pomacea canaliculata) qui est devenu l'un des principaux parasites du riz et d'autres récoltes aquatiques partout dans le Taiwan et dans des parties de l'Asie (Huang et al. 2003). Les sept saponines isolées, sont des hederagenines, incluant une nouvelle saponine hederagenine, ont abouti à une mortalité de 70-100% à 10 ppm contre les escargots parasitant les pommes (Huang et al. 2003). Les saponines Hederagenin comportant trois fragments de sucre ont une activité molluscicide plus importante que les saponines triterpènes avec un seul fragment de sucre (Huang et al. 2003).
1.3.2.5 Activité antimycotique:
Bader et al. ont montré que l'activité antimycotique de saponines contre Candida albicans peut être sous l'influence de la variation des unités hétéroglycosidiques et les acyles glycosidique liés au carbone C-28 de l'aglycone (Bader et al. 2000).
Une fraction des saponines, contenant principalement des saponines monodesmosidiques, ont été évaluées l’effet contre la levure et l'activité antimycotique. La fraction contenant des saponines a montré une activité inhibitrice sur la croissance de plusieurs levures, aussi bien que sur quelques moisissures dermatophytiques (la valeur de la CMI est comprise entre 31.3 et 125 ug/ml). Certaines saponines monodesmosidiques ont été isolées de Hedera colchica (Araliaceae), et ont été évaluées pour leur activité antimycotique et anti-protozoaire (Mshvildadze et al. 2000). Bien que les composés aient montré une activité antimycotique inférieure que ceux des agents antimycotiques de référence. Cette activité serait liée à la structure de ces saponines. Les saponines triterpenoides des graines de Chenopodium quinoa Willd (Chenopodiaceae) n'ont montré qu'une faible
19
activité antimycotique sinon aucune (Woldemichael & Wink 2001). Alors que le mélange brut de saponines a empêché la croissance de Candida albicans à 50 ug/ml. Les composés purs n’ont montré qu’une faible activité sinon aucune, ce qui suggère un effet de synergie possible entre ces molécules.
1.3.2.6 Activité antimicrobienne et antiparasitaire:
Les Saponines peuvent avoir une activité antimicrobienne (Killeen et al. 1998). Trois saponines 5-spirostan-3-ol ont montré une activité antimicrobienne, aussi bien sur des organismes procaryotes qu’eucaryotes, mais seulement à des faibles densités cellulaires. Trois nouvelles saponines triterpenoides, Nudicaucins A, B et C et une saponine guaiacin D connue ont été isolées d'Hedyotis nudicaulis (Rubiaceae) et évaluées contre Bacillus subtilis (Sparg et al. 2004). Les saponines isolées ont présenté une faible activité antibactérienne. Les résultats ont indiqué que la saponine tetraglycoside a une activité plus importante que la saponine triglycoside. Une saponine, jujubogenin, isolée de Colubrina retusa L. (Rhamnaceae), a montré une activité antimycobacterienne avec une CMI de 10 ug/ml (ElSohly et al. 1999).
Trois saponines isolées de Hedera helix L. (Araliaceae), l’hederin et hedeacolchiside A1, ont montré une activité antileishmaniale (Delmas et al. 2000). Les résultats ont montré que ces saponines présentent une forte action antiproliférative à toutes les étapes de développement du parasite Leishmania infantum. L'action des saponines était due aux changements dans l'intégrité de la membrane et du potentiel membranaire. L’hederacolchiside A1 avait l'activité la plus forte, contre la forme promastigote (IC50 de 1.2 ± 0.1 uM) et amastigote du parasite (IC50 de 0.053 ± 0.002 uM). Ces observations suggèrent que ces saponines peuvent être considérées comme des médicaments potentiels anti-leishmanial.
20 1.3.2.7 Activité antitumorale et cytotoxicité:
De nombreuses études mettent en évidence le caractère fortement cytotoxique de plusieurs saponines. Cependant, elles n'ont pas toujours des propriétés anti-tumorales.
Mimaki et al. ont évalué l’activité cytotoxique de neuf saponines triterpènes isolées des racines de Pulsatilla chinensis (Bunge) (Ranunculaceae) (Mimaki et al. 1999). Toutes les saponines évaluées présentent une activité cytotoxique modérée avec des valeurs de IC50 de 2.3 à 7.8 ug/ml, à l'exception d’une saponine qui n'avait aucun substituant au C-2 du fragment arabinosyle attachée à l'aglycone. Les résultats suggèrent que le fragment glycoside attaché au C-3 de l'aglycone serait essentiel pour l'activité cytotoxique des saponines testées.
Des saponines triterpenoides cytotoxiques ont été isolées d'un extrait méthanolique des parties aériennes de Trevesia palmata (Araliaceae) (De Tommasi et al. 2000). Six nouvelles saponines bisdemosidiques, et deux saponines triterpenoides connus, ont été évaluées pour leurs activités antiproliférative contre trois lignées de cellule (J774, HEK-293 et WEHI-164). Les résultats de cette étude ont montré que le groupe hydroxyle et le saccharide estérifié liés à C-28 jouent un rôle important dans l'activité antiproliférative.
Mimaki et al. (Mimaki et al. 2001) ont systématiquement examiné les activités cytotoxiques de quelques saponines stéroïdiennes isolées des plantes de la famille des Liliaceae. Quelques saponines ont montré une activité cytotoxique importanate contre les cellules cancereuses HL-60. L'activité cytotoxique semble être liée, aussi bien à la présence, l’ordre des fragments mono-saccharidiques, qu'à la structure de l'aglycone.
Les saponines triterpènes isolées de Silene fortunei (Caryophyllaceae) augmentent l'accumulation cellulaire et l'activité cytotoxique de l'anticancéreux la cisplatine (Gaidi et al. 2002). Seules, les saponines n'ont pas d’activités cytotoxiques
21
significatives. Quatre nouvelles saponines stéroïdiennes ont été isolées des rhizomes de Tacca chantrieri (Taccaceae) (Yokosuka et al. 2002). Les composés isolés ont été évalués pour leur activité cytotoxique contre les cellules cancéreuses HL-60. Un de ces composés a montré une cytotoxicité considérable (IC50 de 1.8 uM). Deux autres saponines, qui ont été structurellement proches de la saponine active, n'ont pas montré d'activité inhibitrice de la croissance cellulaire à 10 ug/ml. Ces données suggèrent que la structure de l'aglycone et les fragments de sucre contribuent à l'activité cytotoxique des saponines, et des différences structurelles même légères peuvent affecter cette activité.
Trois nouvelles saponines, isolées des fruits d'Acacia concinna (Leguminosae), ont été évaluées pour l'activité cytotoxique contre des cellules HT-1080 de fibrosarcome humain (Tezuka et al. 2000). Toutes les trois saponines, kinmoonosides A, B et C ont montré une cytotoxicité significative avec les valeurs d'ED50 de 0.7, 0.91 et 2.83 uM, respectivement. Il a été suggéré que le fragment ester liée au carbone 21 de l'aglycone n'est pas crucial pour la cytotoxicité, mais peut plutôt l’augmenter (Tezuka et al. 2000).
Les saponines d’Argania spinosa ont une activite antiproliferative contre la lignée celullaire PC3 (cancer de la prostate) avec une GI50 de 18 microg/ml (Drissi et al. 2006).
1.3.2.8 Activité antivirale:
Les saponines triterpenoides isolées de plantes brésiliennes et chinoises présentent des activités antivirales différentes (Simoes et al. 1999). Les saponines de type oleanane empêchent la synthèse de l’ADN du virus de l’herpès du type 1, tandis que saponine de type ursane empeche la synthèse de protéines capsidaires. Les saponines triterpenoides de la famille des Fabaceae ont montré une activité anti-herpètique (Kinjo et al. 2000) et leur structure influerait sur cette activité. Ainsi, les Saponines
22
contenant un sucre montrent une plus grande activité anti-herpètique. Les saponines triterpenoides isolées des feuilles de Maesa lanceolata (Myrsinaceae) ont été évaluées pour des études de la relation activité et structure moléculaire contre HSV-1 (pour l'activité virucide extra-cellulaire) et des virus HIV (Apers et al. 2001). Ils ont conclu que l’hydroxyle situé au carbone 16 et l’acylation de l’hydroxyle situé au carbone 22 semblent être essentiels pour l'activité antivirale (Apers et al. 2001). Arganine C, une saponine isolée des fruits de Tieghemella heckelii (Sapotaceae) qu’on retrouve auusi dans Argania spinosa présente une activité antivirale (Gosse et al. 2002). Cette saponine, a fortement empêché l'entrée du virus HIV dans des cellules dans un essai de fusion de cellule et n'a montré aucune cytotoxicité significative contre des cellules HeLa-CD4+ .
23
2. Radic aux libres et per oxydation lipidique :
2. 1. Définitions de s radi cau x lib re s:
Un radical est une molécule possédant un ou plusieurs électrons non appariés sur ses orbitales électroniques externes. La présence d'un électron célibataire confère souvent à ces molécules, une grande instabilité, elles ont la possibilité de réagir avec de nombreux composés dans des processus le plus souvent non spécifiques, et que, donc, leur durée de vie en solution est très courte (Halliwell 1993). Ce caractère chimique rend les radicaux libres fortement réactifs. La réactivité varie d'un radical libre à un autre et dépend de l’environnement où ils sont présents. Les dérivés réactifs de l'oxygène (dro) (reactive oxygen species, ros) (Tableau 2 et figure 6) sont pour la plupart des radicaux chimiques dérivés de l'oxygène.
24
Figure 6. Origine des différents radicaux libres oxygénés et espèces réactives de l’oxygène impliquées en biologie.
25
Tableau 2. Les espèces réactives d'oxygène (ROS) et les espèces réactives d'azote (RNOS)
Espèces réactives Propriétés
O2•
anion Superoxyde
Produit par la chaine de transport d’électrons et d’autres sites. Ne peut pas diffuser du site d’origine. Génère les ROS.
H2O2
Peroxyde d’hydrogène
N’est pas un radical libre, mais peut en générer en réagissant avec des métaux de transitons, peut diffuser à travers les membranes.
• OH
Radical Hydroxyles
L’espèce la plus réactive dans l’attaque des molécules biologique, produit à partir de H2O2 dans la réaction de fenton en présence de Fe2+ or Cu2+. RO•, R•, R-S•
Radicaux organiques
Radical organique libre (R correspond au substituant) Produit à partir de ROH, RH (e.g. au carbone d’une double liaison dans un acide gras) ou de RSH par une attaque de •OH
RCOO•
Radical peroxyle
Un radical organique peroxyle, produit durant la dégradation lipidique (nommé aussi LOO•)
HOCl
acide Hypochloreux
Produit dans les neutrophiles durant le sursaut respiratoire pour détruire les organismes invasifs. La toxicité s’effectue à travers des réactions d’halogénations et d’oxydations. L’espèce réactive est OCl
1 O2
oxygène Singulet
Oxygène avec des spins antiparallèles. Produit à des pressions importantes en oxygène sous l’effet de l’absorption des rayons UV. Il disparait trop vite pour être toxique in vivo.
NO
Nitrique oxyde
RNOS. Un radical libre endogène produit par l’oxyde nitrique synthétase. Se lie aux ions métalliques, se combine avec O2 ou aux autres radicaux contenant l’oxygène pour produire RNOS
ONOO -Peroxynitrite
RNOS. Un agent oxydant puissant qui n’est pas un radical libre. Il peut générer NO2 (dioxyde de nitrogène), qui est un radical.
26
Certains dérivés réactifs de l'oxygène (dro), comme le peroxyde d'hydrogène (H2O2) n’est pas un radical au sens chimique. En effet, cette molécule, bien que réactive et toxique, n'a pas de caractère radicalaire. Les dro sont des espèces chimiques à très forte réactivité capables d'oxyder les protéines, l'ADN et les membranes des cellules (attaque des lipides constitutifs) (peroxydation lipidique): c'est une des théories actuelles du vieillissement (sénescence). Ils sont associés à plusieurs pathologies (tableau 3).
Tableau 3. Quelques pathologies associées aux dommages des radicaux libres
Athérogenèses Bronchite et emphysème
Dystrophie musculaire du type Duchenne Vieillissement Maladie d'Alzheimer Fibroplasie rétrolentale Maladies neurodégénératives Maladie d’Alzheimer Syndrome de down
Sclérose amyotrophique latérale (Maladie de Lou Gehrig’)
Hémodialyse Sclérose en plaques multiple
Grossesse/ pré-éclampsie Maladies du foie induit par d'alcool
Echec rénal aigu Dommages d'ischémie/reperfusion
Désordres cérébrovasculaires Cancer cervical
Maladie d’Oxphos (mutation de l’ADN mitochondrial et/ou nucléaire affectant la phosphorylation oxydative)
27 2. 2. Les sou rce s de radic au x lib re s:
Le métabolisme aérobique de chaque organisme produit des ros. Ils sont principalement formés d’une manière endogène, comme des sous-produits des chaînes de transport des électrons de la respiration cellulaire dans les mitochondries (Halliwell 1993). Les ros sont aussi produites dans différentes réactions enzymatiques par la nicotinamide adénine dinucléotide phosphate (NADPH), les oxydases et d'autres enzymes d'oxydation localisées dans les phagocytes, les fibroblastes, les cellules musculaire lisse et les cellules endothéliales (Halliwell & Cross 1994). La NADPH oxydase des phagocytes source de la production du radical superoxyde est la production la plus significative des dro dans le système vasculaire; la xanthine oxydase, la myeloperoxidase et l'oxyde nitrique synthétase entre autres produisent des dro et les dra (dérivées d’oxygène réactif et dérivées d’azote réactif respectivement) dans le corps humain. Les réactions d’auto-oxydation de molécules comme les catécholamines, tétrahydrofolates, quinones, thiols ou les flavines produisent aussi des radicaux libres capables d’initier des réactions oxydatives (Halliwell & Cross 1994). La lipoxygénase et la cyclooxygénase sont impliquées dans la synthèse des leucotriènes et des prostaglandines, qui ont des fonctions par exemple dans la médiation de l’inflammation et la régulation de la tonicité vasculaire et l’accumulation de plaquettes sanguines ; certains d'entre eux sont capables d'oxyder les LDL (low density lipoproteins) (Stocker et al. 1991). Les métaux de transition comme le fer et le cuivre catalysent des réactions oxydatives dans l’organisme humain même si le les quantités d'ions de métal de transition libres dans le corps sont faibles, ils sont stockés dans l’hème, de plus l'hémoglobine ou la myoglobine peuvent amorcer des réactions oxydatives (Halliwell 1993, Halliwell & Cross 1994).
28
L’exposition à l’ischémie, aux infections et l'exercice excessif peuvent provoquer une production accrue de ros. La production exogène des ros résultent de l’exposition , aux rayons ionisants (ultra-violet [uv], visible, thermal, gamma, x), aux métaux de transition ou a l’oxygène en quantité excessive, a certaines médicaments (par exemple le paracétamol), aux produits chimiques toxiques (Freeman & O'Neil 1984, Bus & Gibson 1984, Burdon et al. 1990, Mason et al. 1994, Fukushima et al. 1995). La production endogène des radicaux est considérée significativement plus importante en comparaison à celle d’origines exogènes. L’espèce réactive la plus fréquente dans l’organisme est le radical superoxyde, O2·- . La source primaire de ros, dans sa forme superoxyde, est le complexe NADPH oxydase qui catalyse la réduction à un électron de l’oxygène moléculaire (équation 1). Les électrons nécessaires pour la production d'o2-· sont fournis par le NADPH (équation. 2) :
O2 + e- → O2•- (1)
2 O2 + NADPH → 2 O2•- + NADP+ + H+ (2)
O2•- lui-même a une réactivité plutôt faible, mais il est capable de réagir plus loin en dismutant en H2O2 (équation 3) :
2O2•- + 2 H+ → H2O2 + O2 (3)
Bien que H2O2 lui-même ne soit pas fortement réactif, il peut diffuser, provoquer la formation de radicaux en présence des métaux de transition (cuivre ou le fer) dans des tissus ou dans des liquides et former les radicaux hydroxyles (OH·), selon la réaction fenton (équation 4):
29
Fe2+ + H2O2 + H+ → Fe3+ + OH• + H2O (4)
La formation d'OH• dépend ainsi de la disponibilité d’ions Fe2+. Il est possible que les produits de cette réaction réagissent plus loin (équation 5), aboutissant à la formation d'ion ferryl réactif:
Fe3+ + OH• → Fe2+-O + H+ (5)
Une autre réaction aboutissant à la formation de radical hydroxyle a lieu entre le peroxyde superoxyde et l’hydrogène en présence de catalyseurs de métal de transition (cuivre, fer,…) (réaction de haber-weiss, équation 6) :
O2•- + H2O2 + H+ → O2 + OH• + H2O (6)
Les ions de métal de transition oxydés (fe3 +, cu2 +) peuvent aussi réagir avec O2•- et être réduit (équations 7 et 8) :
Fe3+ + O2•- → Fe2+ + O2 (7)
Cu2+ + O2•- → Cu+ + O2 (8)
Cette capacité d’O2•- de réduire le fer et le cuivre aux formes qui catalysent les réactions oxydatives sont la cause principale de son effet délétère. Le radical OH• est extrêmement réactif et il est capable de réagir avec pratiquement n'importe quelle biomolécule, et il est extrêmement toxique (Halliwell & Gutteridge 1995). Il oxyde
30
les lipides dans les membranes de la cellule affectant leurs caractères de perméabilité et les lipoprotéines, aboutissant à des changements de la structure et modifiant ainsi leur métabolisme dans le corps.
L’action radicale est souvent perçue seulement comme l'oxydation, transfert d'un électron simple d'une molécule non radicalaire. Les radicaux peuvent, cependant, aussi agir comme des agents de réduction, en cédant un électron simple à un non-radical (Stocker & Keaney, Jr. 2005). Un des paramètres principaux régissant l'action des radicaux est leur potentiel de réduction, la facilité d'une molécule de réduire chimiquement un autre composé.
Les potentiels de réduction ont été quantifiés pour quelques composés biologiques appropriés pour prévoir la direction de réactions d’oxydation (Buettner 1993). Les différences de valeurs de ce paramètre thermodynamique expliquent sommairement la réutilisation du radical tocopheryl et la régénération de sa forme active par l’ascorbate (équation 9) :
H+ + ascorbate- + α-TO• → ascorbyl radical + α-TOH (9)
Initialement, on a considéré que les radicaux libres et d'autres espèces réactives ont un rôle clef dans la défense contre les microbes. Cependant, on sait maintenant qu'ils sont aussi produits dans le corps dans d'autres contextes liés à des processus cellulaires physiologiques normaux et en particulier comme facteur de signalisation cellulaire.
Le rôle de ses ros dépend de la molécule en question ; les radicaux OH· sont extrêmement nocifs aux biomolécules tandis qu'au moins H2O2 et O2•- agissent comme des facteurs de signalisation cellulaire. La NADPH oxydase a été d'abord
31
isolée des neutrophiles produisant des radicaux superoxydes O2·- comme une réponse à une attaque microbienne. Mais plus récemment, ces ros ont été isolés dans des cellules sans aucun rôle dans la défense de l’hôte (Hancock et al. 2001), comme les cellules endothéliales (Jones et al. 2000), les cellules mésangiales (Jones et al. 1995) et les ostéoclastes (Steinbeck et al. 1994). Dans des cellules restantes, aucune activité NADPH n'est détectée et l'activité est étroitement contrôlée par plusieurs mécanismes (Jones et al. 2000). Cela renforce l'hypothèse que les ros ont un rôle clef dans la cascade de signalisation (Hancock et al. 2001).
2. 3 Les réaction s radica lai re s de l' o xyg ène:
Les radicaux hydroxyles sont abondants dans des conditions physiologiques et réagissent aisément avec pratiquement tous les types de molécules composant les cellules vivantes, telles que les sucres, les acides aminés, les phospholipides et les nucléotides (Wolff & Dean 1986, Davies & Goldberg 1987, Hunt et al. 1988, Kirkland 1991, Dean et al. 1991a, Sandhu et al. 1992, Nakamura et al. 1993, Minetti et al. 1993, Akagawa & Suyama 2002). (figure 7).
Des preuves des dommages des radicaux libres ont été décrites dans plusieurs états pathologiques. Dans certains d'entre eux, le dommage des radicaux libres est la cause primaire de la maladie; dans d’autres, cela aggrave les complications de la pathologie. L’oxydation disproportionnée des membranes cellulaires peut contribuer à l’initiation et la progression de plusieurs maladies dégénératives, incluant aussi bien certains cancers, les maladies cardiovasculaires que le vieillissement (Matteucci & Giampietro 2000, Lyons et al. 2003, Tam et al. 2003, Klaunig & Kamendulis 2004, Mobley & Brueggemeier 2004, Stefek et al. 2005, Bowman et al. 2005).
Les formes réactives d'oxygène peuvent induire la péroxydation des lipides des organes biologiques contenant des acides gras polyinsaturés (PUFA), comme les acides, linoléique et arachidonique. Ils causent le mauvais fonctionnement des
32
membranes en modifiant sa fluidité et en perturbant la structure et la fonction des enzymes et des récepteurs membranaires. Une telle oxydation peut être interrompue par des antioxydants (Gutteridge & Halliwell 2000).
Il a été montré que les protéines modifiées oxydées s’accumulent pendant le vieillissement et dans certaines conditions pathologiques (Squier 2001, Sayre et al. 2005). L’exposition des protéines à .OH et a l’O2 entraine des modifications structurelles. Ces protéines modifiées peuvent subir une fragmentation spontanée et des trans-liaisons ou montrer une augmentation substantielle dans la proteolyse (Squier 2001). les Dommages oxydatifs entrainent un dysfonctionnement de protéines comme les enzymes, les protéines transport et les récepteurs (Gutierrez-Correa & Stoppani 1995, Hashimoto et al. 2000, Khan & Khan 2004). La modification de protéine par les espèces d'oxygène réactives (ROS) est un phénomène bien établi comme sont les produits de réaction caractérisés d'actions réciproques de protéine avec la formation de .OH et O2. Cela cause finalement la production d’alkyle, d’alkoxyle et les intermédiaires radicaux alkylperoxyl, qui préparent la rupture des liaisons peptides. Une large variété de réactions entre les ROS et les chaînes d'aminoacide se produit et tous les aminoacides dans les protéines sont susceptibles à des changements (Amici et al. 1989, Villiere et al. 2005, Baron et al. 2006).
L'albumine du sérum humain (HSA) est la principale protéine dans le sang et est largement distribuée dans le corps. À part le maintien de l’osmolarité, l'albumine est aussi impliquée dans la fixation et le transport de plusieurs ligands incluant de métaux (12 à 18 % du cuivre dans le plasma sanguin humain), les acides gras et les médicaments (Quinlan et al. 2005).
33 2. 4 Pe ro xydation lipid ique:
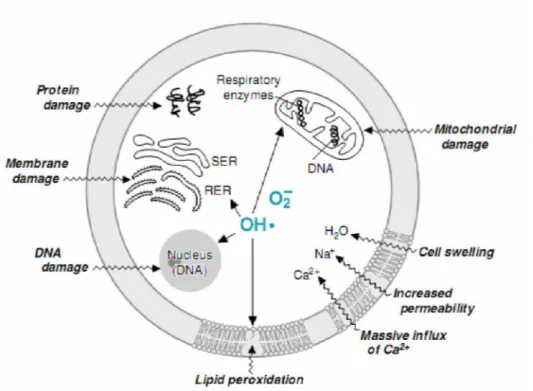
Les réactions radicalaires en chaine forment les radicaux lipidiques, libèrent les peroxydes lipidiques dans les membranes et causent d’importants dommages et modifications (Figure7).
Figure 7. Lésions cellulaires induites par les radicaux libres.
Les radicaux superoxydes et les radicaux hydroxyles initient la peroxydation lipidique dans les membranes cellulaires, mitochondriales, nucléaires, et du réticulum endoplasmique. L’augmentation de la perméabilité cellulaire entraine un influx des ions calcium qui cause plus de lésions mitochondriales. Les groupes cystéine sulfhydryle et d’autres acides amines sont oxydés et dégradés. L’ADN mitochondrial et nucléaire peuvent être oxydés aboutissant à une rupture des doubles brins et a d’autres types de dommages. Les RNOS (NO, NO2, et peroxynitrite) ont des effets similaires.
Un initiateur (comme le radical hydroxyle produit localement durant la réaction de fenton) amorce une réaction en chaine. Il capte un atome hydrogène, de préférence une liaison double d'un acide gras polyinsaturé dans une membrane lipidique. Ces
34
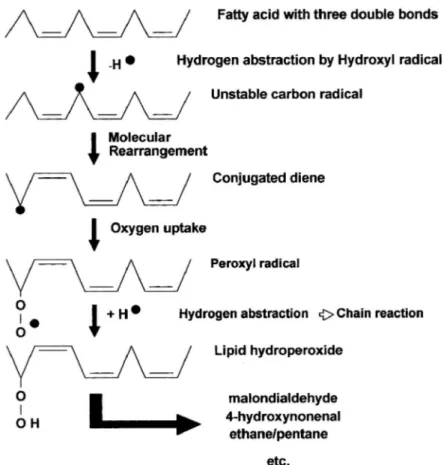
réactions en chaine sont propagées quand l’O2 est ajouté et forment les radicaux lipides peroxyles et les lipides peroxydes. Finalement, la dégradation de lipide se produit, et entraine la formation de produits tels que le malondialdéhyde (des acides gras avec au moins trois liaisons doubles) et l'éthane et le pentane. Le malondialdéhyde apparaît dans le sang et l'urine et est utilisé comme un indicateur de dommages des radicaux libres (figure 8).
Figure 8. Mécanisme en chaîne de la peroxydation des acides gras polyinsaturés et nature des produits terminaux formés.
35
La peroxydation de molécules lipidique change inévitablement les structures moléculaires. En plus de la nature autodestructrice de la peroxydation des lipides des membranes, les aldéhydes formés peuvent polymériser des protéines. Quand les lipides modifiés sont des constituants de membranes biologiques, l'arrangement et l'organisation structurelle des bicouches est perturbée (Figure 11). En plus, la perturbation de l'intégrité membranaire mitochondriale peut entrainer une production supplémentaire de radicaux libres.
La peroxydation lipidique est une importante réaction des acides gras insaturés. Une des réactions caractéristique des lipides ; est la formation de peroxydes, induite par les radicaux d'oxygène.
La peroxydation lipidique peut procéder tant par des voies enzymatiques que par des voies non-enzymatiques. Les initiateurs de cette oxydation sont des radicaux libres physiologiques en particulier les radicaux superoxydes et nitrique oxyde.
L'oxydation des lipides peut se dérouler suivant deux voies différentes,
2.4.1 Peroxydation non-enzymatique:
La peroxydation lipidique est un processus complexe qui se produit en présence d'oxygène et des ions de métal de transition ou des enzymes. Il y a d'habitude trois stades dans le processus d'oxydation, comme décrit ci-dessous (voir figure 9).
36
Figure 9. Les différentes étapes de la peroxydation des lipides.
1. Stade d'amorce
Un atome d’hydrogène est arraché d'un groupe méthylène (-CH2-) d’un PUFA (polyunsaturated fatty acids) par une espèce réactive comme le radical hydroxyle (•OH) en laissant un électron non apparié sur le carbone (-CH- ou le radical lipide). Le radical de carbone est stabilisé par un réarrangement moléculaire pour former un diène conjugué qui peut se combiner avec l'oxygène pour former un radical peroxy ROO• ou RO2•.
RH→ R• H• (1) 2. Stade de propagation
37
Le radical peroxy peut arracher un autre hydrogène d'une autre molécule lipidique et cela cause une réaction en chaine autocatalytique par laquelle l'oxydation lipidique procède. Les radicaux peroxy peuvent se combiner avec l'hydrogène qu’ils captent pour former des hydro-peroxydes lipidiques et des peroxydes cycliques. Vu que l’hydrogène transféré peut se produire à différents points de la chaine carbonée, la peroxydation de l’acide arachidonique par exemple produit six hydro-peroxydes lipidiques.
R• O2 →RO2• (2)
RO2• + RH →ROOH + R• (3) 3. Stade de terminaison
Les radicaux libres produits peuvent se combiner les uns aux autres ou aux protéines et arrêter les réactions en chaine. La dernière réaction qui cause la polymérisation et des dommages sévères aux protéines est représentée ci-dessous.
R• R• →R-R (4)
nRO2• →(RO2)n (5) RO2• + R• →RO2R (6)
2.4.2 Peroxydation enzymatique:
À la différence de la peroxydation non enzymatique, les enzymes suivantes, la lipooxygenase, la cyclooxygénase et la peroxydase catalyse une peroxydation contrôlée des acides gras et aboutit à des hydroperoxydes et des endoperoxydes qui sont stéréospécifiques. La lipooxygénase est communément rencontrée dans les
38
aliments, catalyse la peroxydation des PUFA en produits primaires et secondaires (Kanner et al. 1987).
La lipoxygénase contient un atome de fer par molécule et arrache un atome d’hydrogène d’un acide gras insaturé pour former des hydroperoxydes. Les réactions sont complexes, et les hydroperoxydes produits peuvent interagir avec l’enzyme en question. L’action de la lipoxygénase peut produire une cooxydation d’autres matériaux (caroténoïdes et protéines)
2. 5 Oxydation de s p rotéine s:
Les protéines sont extrêmement sensibles aux modifications oxydatives causées par les espèces réactives d'oxygène (ROS) et les espèces d'azote réactives (RNS). Ceux-ci incluent un certain nombre de radicaux primaires (•OH, O2•−, CO2•−, NO •), plusieurs espèces non radicalaires (H2O2,HOCl, O3, ONO2−, ONOCO2−, CO, N2O2, NO2,1O2) et libèrent aussi des radicaux (•C, RS •, RSO •, RSOO • , RSSR • −, R •, RO •, ROO •) produits par les réactions secondaires de ces espèces réactives d'oxygène avec les protéines, les lipides et les acides nucléiques. En plus, les protéines natives peuvent être modifiées par les aldéhydes extrêmement réactifs et les cétones produits pendant l'oxydation des lipides par les ROS (Uchida & Stadtman 2000) et les protéines glyquées (Uchida & Stadtman 2000, Boldyrev 2005). Les mécanismes chimiques fondamentaux impliqués dans l'oxydation provoquée par de radical libre de protéines ont été élucidés par Garrison (Garrison 1989) qui a exposé des solutions aqueuses de protéines au rayonnement ionisant (rayons X, rayons gamma) dans les conditions où seuls les radicaux •OH et/ou O2• − sont capables de se former. Ils ont démontré que ceux-ci, dans ces conditions, causent l'oxydation des chaînes latérales de résidus d'aminoacides, la fragmentation de la chaîne protéinique et entrainent la réticulation des protéines. Bien que la plupart des protéines ne subissent pas l’effet des ionisations. Les effets des rayonnements ionisants sont
39
similaires aux situations physiologiques où les réactions sont catalysées par des ions métalliques de transitions (Hensley et al. 1996).
Figure 10. Les espèces réactives, le dommage oxydatif et les réponses cellulaires au stress oxydatif.
Les oxydants sont produits par le métabolisme intracellulaire normal dans les mitochondries et les peroxysomes, aussi bien que d'une variété de systèmes d'enzymes cytosoliques. En plus, un certain nombre d'agents externes peut déclencher la production des ROS/RNS. Un système de défense antioxydant enzymatique et non enzymatique sophistiqué contrent et régulent les niveaux des ROS/RNS pour maintenir l’homéostasie physiologique. La surproduction de ROS/RNS et/ou les niveaux faible et/ou l'activité faible des antioxydants entraine un stress oxydatif. La tension oxydative importante peut être préjudiciable et causer la mort des cellules ou une accélération du vieillissement et des maladies en relation avec l'âge. On pense que l'affaiblissement important provoqué par les ROS/RNS provient des dommages causés aux protéines, aux lipides et à l'ADN (Halliwell & Gutteridge 1984a).
40 2. 6 Accumu lation de p rotéine s o xydé es:
Il est bien établi que le niveau de protéines oxydées augmente avec l'âge et dans le développement d'un certain nombre de maladies (Halliwell & Cross 1994). Les niveaux cellulaires de protéines oxydées dépendent de plusieurs facteurs, et donc les mécanismes responsables de l'accumulation de protéines oxydées sont extrêmement variables.
La génération des ROS et RNS varie selon la nature et la durée de l’exposition à différentes conditions de stress oxydatif incluant , les radiations (X, gamma et UV), l’inflammation initié par l’activation des neutrophiles et/ou macrophages, l’altération des voies de régulations impliquées dans la conversion de l’arginine en NO, l’autooxydation des transporteurs d’électrons, la variation du niveau des polluants toxiques, l’activation des oxydases et la mobilisation d’ions de métal impliqués dans les processus d’oxydation catalysée par des métaux.
Mais les niveaux cellulaires des ROS et RNS sont contrôlés par plusieurs enzymes antioxydantes (SOD catalase, peroxydase,…), métabolites (bilirubine, acide uriques,…), et les vitamines (vitamine C, E et A) qui sont capables directement ou indirectement de neutraliser leurs effets délétères. De plus, l’oxydation des protéines les prédispose à une plus grande dégradation protéolytique. Le niveau des protéines oxydées est dépendant de l’activité de plusieurs protéases (lysosomales, cathepsine,…). Et donc, l’accumulation des protéines reflète l’équilibre entre tous ces processus (Figure 11).
41
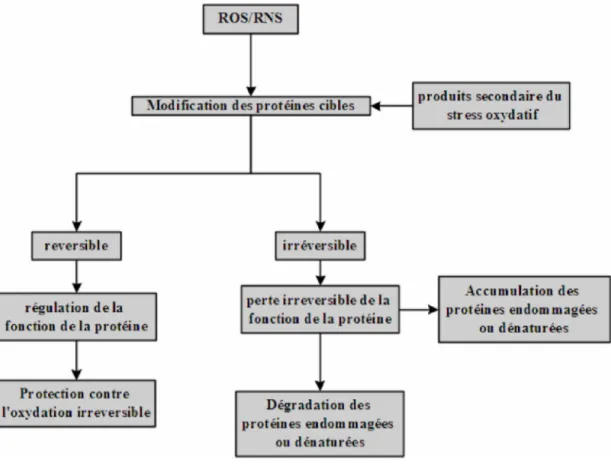
Figure 11. Conséquences des effets des diverses espèces réactives sur le fonctionnent des protéines et leur destin.
Les ROS/RNS peuvent provoquer des modifications oxydatives des protéines sensibles. Les modifications réversibles, d'habitude des Cys et les résidus rencontrés, peuvent avoir un rôle double de modulation de la fonction de protéine et de protection contre des modifications irréversibles. Les modifications irréversibles sont d'habitude associées à la perte permanente de la fonction des protéines et peut mener à la dégradation des protéines endommagées par le système proteasome et d’autres protéases ou à leur accumulation progressive (Amici et al. 1989).
2. 7 Patho logie s imp liqu ant des métabo li tes réa ctifs d’o xygèn e:
Pendant longtemps, la formation des radicaux libres et le développement du stress oxydatif dans la vie des organismes ont été considérés comme des événements exclusivement destructeurs, menant à divers effets pathophysiologiques. En effet, de