Faculté des Sciences, 4 Avenue Ibn Battouta B.P.1014 RP, Rabat-Maroc Tél : +212 (0) 37 77 18 34/35/38, Fax : +212 (0) 37 77 42 61, http://www.fsr.ac.ma
N° d’ordre : 2829
THESE DE DOCTORAT
Présentée par
Fatima Ezzahra JANATI IDRISSI
Discipline : Chimie
Spécialité : Chimie, Analyse et Environnement
Soutenue le : 26/12/2015
Devant le Jury :
Président :
EL KACEMI Kacem PES à la Faculté des Sciences, Rabat
Examinateurs :
EL HOURCH Abderrahim PES à la Faculté des Sciences, Rabat
EL ABBASSI Zoubida PES à la Faculté des Sciences, Rabat
DOUIRA Allal PES à la Faculté des Sciences, Kénitra
FILALI MALTOUF Abdelkarim PES à la Faculté des Sciences, Rabat
ISMAILI Lhassane Professeur à la Faculté de Médecine et de Pharmacie-
Université Franche-Comté, Besançon, France
CARACTERISATION CHIMIQUE, ACTIVITES BIOLOGIQUES DE
SUBSTANCES NATURELLES ISSUES DE PLANTES MEDICINALES ET
DE METABOLITES SECONDAIRES ISOLES DE CHAMPIGNONS
ENDOPHYTES
UNIVERSITE MOHAMMED V FACULTE DES SCIENCES
Dédicaces
A mon très cher père M. Elhassane JANATI IDRISSI
A ma très chère mère Mme Naima ELHAOUAT
A Mon très cher frère Mr. Mohammed JANATI IDRISSI
A Ma très chère sœur Mlle. Kawtar JANATI IDRISSI
A Ma très chère sœur Mlle. Amina JANATI IDRISSI
A Mon Cher Docteur M. Tarik OUCHBANI
A Monsieur le Professeur Docteur Said OUCHBANI
A ma très chère Mme. Fatima Alharras
A ma très chère grande famille
Ainsi qu’à tous mes amis et toute personne qui m’a soutenue et accompagnée
durant les moments les plus difficiles de la préparation de cette thèse.
Avant-propos
Les travaux présentés dans le mémoire ont été effectués dans le Laboratoire de Chimie Analytique et Electrochimie, à la faculté des sciences de Rabat, sous la direction du Professeur Abderrahim ELHOURCH, qu’il trouve ici toute ma reconnaissance pour son fructueux encadrement.
Je remercie vivement tous les membres du jury qui me font l’honneur de juger ce travail :
Monsieur le professeur Kacem EL KACIMI, responsable du Laboratoire de Chimie Analytique et Electrochimie qui me fait l’honneur de présider ce jury.
Madame le professeur Zoubida ELABBASSI de la faculté des Sciences de Rabat qui me fait l’honneur de participer au jugement de ce travail comme rapporteur et qui je remercie pour son soutien et ses précieux conseils. Qu’elle trouve ici mes sincères remerciements.
Je tiens à remercier également Monsieur le Professeur Allal DOUIRA directeur du laboratoire de Botanique, Biotechnologie et Protection des Plantes à la Faculté des Sciences de Kénitra, pour son accueil ainsi que les moyens et les facilités qu’il a fourni pour la réalisation de l’isolement la purification et la culture des champignons endophytiques. Professeur Allal DOUIRA me fait également un grand honneur et plaisir en acceptant de participer au jugement de ce travail comme rapporteur. Je lui suis très reconnaissante.
Je remercie également Monsieur le professeur Abdelkarim FILALI MALTOUF, directeur du Laboratoire de Microbiologie et Biologie Moléculaire à la Faculté des Sciences de Rabat, pour son accompagnement, son soutien scientifique et moral ainsi que sa contribution dans la réalisation des tests antibactériens. Je lui exprime toutes mes sincères reconnaissances d’avoir accepté de juger ce travail de recherche.
Je ne saurais oublier de remercier Monsieur le professeur Elhassane ISMAILI de la Faculté de Médecine et de Pharmacie de l’Université Franche Comté, Besançon, France, pour son aide et son soutien ainsi que l’honneur qui me fait en jugeant ce travail de recherche. Qu’il trouve ici toute ma reconnaissance.
La présente étude a bénéficié de la contribution de plusieurs institutions de recherche à l’échèle national et international. L’étude botanique des espèces végétales étudiées a été réalisée grâce aux facilités et à la contribution assurée par Monsieur le Professeur Said OUCHBANI, à l’Institut Scientifique de Rabat. L’isolement des métabolites secondaires des
plantes médicinales et des champignons endophytiques a été réalisé en partie, lors d’un séjour au sein de l’Institut de Biologie Pharmaceutique et Biotechnologie, à l’Université Heinrich Heine, Düsseldorf, Allemagne, sous l’Encadrement du Professeur Peter PROKSCH, directeur de l’Institut d’accueil. Les études analytiques et spectroscopiques ont été réaliséesà L’institut de Chimie des Substances Naturelles (ICSN), CNRS de Gif- Sur- Yvette, France, grâce à la contribution et l’accueil du Docteur Eric GUITTET, Directeur de recherche au sein de l’ICSN. La Partie isolement, purification et culture des Champignons endophytiques a été réalisé au Laboratoire de Botanique, de Biotechnologie et Protection des Plantes à la Faculté des Sciences, Université Ibn Tofail, Kénitra Sous la Direction du Professeur Allal DOUIRA. L’étude par Biologie Moléculaire des champignons endophytiques isolés a été réalisée en partie dans le Laboratoire de Biologie Moléculaire à l’UATRS, CNRST de Rabat. Les tests antifongiques ont été réalisés au Laboratoire de Physiologie et Biotechnologie Végétales, à la faculté des Sciences de Rabat. Les tests antibactériens ont été réalisés grâce à la contribution du Professeur Abdelkarim FILALI MALTOUF, directeur du Laboratoire de Microbiologie et Biologie Moléculaire à la Faculté des Sciences de Rabat.
Cette thèse constitue une riche expérience qui ne peut s’achever sans remercier les personnes qui m’ont encadré, aidé et soutenu au cours de ces dernières années. Pourtant il existe une difficulté, celle de n’oublier personne. C’est pourquoi je tiens à remercier par avance ceux dont le nom n’apparaît pas dans cette page.
Je tiens à remercier mes parents pour leur aide et leur son irremplaçable et inconditionnel soutien moral et matériel afin de m’assurer les conditions optimales qui m’ont permis sans aucun doute à atteindre le but souhaité. Qu’ils trouvent ici tous mes remerciements et ma sincère reconnaissance.
Un grand et spécial remerciement à mon très cher Docteur Tarik OUCHBANI pour sa présence et son soutien durant tout mon parcours afin de réaliser ce travail de recherche. Je lui suis très reconnaissante pour sa collaboration, ses précieux conseils et ses grands efforts dans la réalisation de cette étude. Je lui dédie, avec une pleine fierté, ce travail qu’on a réalisé ensemble.
Je remercie également Monsieur le Docteur Eric GUITTET, Directeur de recherche à l’Institut de Chimie des Substances Naturelles (ICSN), CNRS, Gif- Sur- Yvette, France, pour son accueil, sa collaboration et sa contribution efficace dans la réalisation de ce travail de recherche. Qu’il trouve ici toute ma sincère reconnaissance.
Un très grand Merci pour mon très cher Ami Docteur Philippe KAMALAPRIJA, International Regional Manager au sein de Chemical Abstracts Service (CAS) / ACS International, Ltd., Suisse, pour son aide, son engagement permanent et son soutien scientifique et moral durant les moments les plus durs de la préparation de cette thèse. Je lui exprime à travers ce manuscrit mes sincères remerciements et ma profonde reconnaissance.
Je tiens à remercier profondément et chaleureusement mon très cher ami Professeur George VARVOUNIS de l’Université IOANNINA, Grèce, pour son soutien scientifique et moral ainsi que sa disponibilité continue et ses précieux conseils qui m’ont permis de mener positivement ce travail de recherche. Qu’il trouve à travers ce manuscrit mes très grands et profonds remerciements.
Je souhaiterais aussi adresser ma gratitude au Professeur Peter PROKSCH, directeur de l’Institut de Biologie pharmaceutique et biotechnologie, Université Heinrich Heine, Düsseldorf, Allemagne, pour son accueil ainsi que l’aide qu’il m’a accordé lors mon séjour dans son institut.
Je tiens à remercier Monsieur Le Professeur Said OUCHBANI, de l’Institut Scientifique de l’Université Mohammed V de Rabat pour son aide et son soutien scientifique et moral tout au long de mes études et recherches doctorales. Je lui suis très reconnaissante.
Je remercie également Monsieur le Professeur LFERDE Mohamed, Directeur du Centre d’études Doctorales (CEDoc) à la Faculté des Sciences de Rabat pour son aide, son soutien ainsi que ses précieux conseils. Qu’il trouve ici ma profonde reconnaissance.
Un spécial remerciement à Docteur Imane BERRADA, pour son aide et son soutien lors de la réalisation de l’interprétation des résultats de la Biologie moléculaire ainsi que pour sa contribution dans la réalisation des tests antifongiques.Je lui suis très reconnaissante.
Je ne saurai oublier de remercier mon cher ami Anas NOUNSI, pour sa présence et son assistance lors des travaux réalisés sous la direction du Professeur Allal DOUIRA au sein du laboratoire de Botanique, Biotechnologie et Protection des Plantes à la Faculté des Sciences, Université Ibn Tofail à Kénitra. Je lui suis très reconnaissante.
Je tiens à remercier également Amina MANNI pour son aide généreuse et sa contribution dans la réalisation des tests antibactériens.Je lui suis très reconnaissante.
Je remercie également tous les professeurs qui m’ont marqué positivement durant mon parcours estudiantin ainsi que toute personne qui a contribué de près ou de loin dans la réalisation de ce travail.
Résumé :
La présente étude détaille l’isolement et l’identification par biologie moléculaire de quelques champignons endophytiques ainsi qu’une étude phytochimique et analytique des huiles essentielles et des métabolites secondaires ayant comme source les plantes aromatiques et médicinales ou encore les champignons endophytes de certaines espèces végétales d’origine marocaine. Ainsi à partir de l’espèce végétale Carpobrotusedulis, nous avons isolé et identifié par étude détaillée de biologie moléculaire, cinq espèces fongiques endophytiques
à savoir Penicillium radicum, Aspergillus fumigatus, Aspergillus flavus,
Fusariumchlamydosporum et Trichodermaasperellum. En parallèle, la composition chimique des huiles essentielles de Piper nigrum et Carpobrotusedulis a été étudiée par GC/MS tandis que les extraits obtenus à partir de l’espèce végétale Piper nigrum ou encore des champignons endophytiquesEmbellisiaeureka et Neonectriamacrodidyma ont subi une série de fractionnements par différentes techniques chromatographiques. Plusieurs métabolites secondaires ont été purifiés puis analysés par différentes techniques chromatographiques, spectrométriques et spectroscopiques à savoir l’HPLC analytique, la spectrométrie de masse haute résolution (HRMS/ESI) et La RMN (600 et 800Hz). Certains composés ont fait l’objet d’une étude cristallographique détaillée et d’une étude de fragmentation MS/MS. Les huiles essentielles, les extraits de plantes ainsi que les métabolites secondaires isolés et identifiés ont fait l’objet de tests antifongiques ou encore des tests antibactériens qualitatifs et quantitatifs. La plupart des produits testés ont donné un bon effet antifongique contre la croissance de la souche Botrytis cinerea. De même, les substances testées ont révélé des effets inhibiteurs intéressants contre la croissance de la plupart des souches bactériennes testées à savoir, E.coli, Agrobacteriumspp., Rhizobium sp., Bacillus subtilis et Basciluspumilus. Il est à noter que parmi les substances naturelles étudiées dans ce travail, certaines seraient testées pour la première sur ces souches fongiques et bactériennes.
Abstract :
The present study detailed the isolation and the molecular biology identification of some endophytic fungi as well as the phytochemical and the analytical study of essential oils and bioactive secondary metabolites produced by some medicinal plants and Moroccan endophytic fungi. Several fungi, considered as Carpobrotusedulisendophytes, were identified: Penicilliumradicum, Aspergillusfumigatus, Aspergillusflavus, Fusariumchlamydosporum and Trichodermaasperellum. The second part of the manuscript presents the phytochemical study of Piper nigrum and Carpobrotusedulis essential oils as well as the characterization and the structure elucidation of the bioactive secondary metabolites isolated from piper nigrum or from the endophytic fungi Embellisia eureka and Neonectriamacrodidyma extracts. In the experimental work, several chromatographic, spectrometric and spectroscopic techniques were deployed to characterize and identify the extracted, isolated and purified natural products: Analytical HPLC, High Resolution Mass Spectrometry (HRMS) and Nuclear magnetic resonance (NMR 600 and 800Hz). Some of the purified compounds were subject of a Crystallographic study or a MS/MS Fragmentation. The totality of the natural substances (essential oils, extracts and secondary metabolites) were subject of various antifungal and antibacterial essays. The majority of the tested substances revealed a very interesting activity against the Botrytis cinerea growth as well as the bacterial stainsE.coli, Agrobacterium spp., Rhizobium sp., Bacillus subtilis and Basciluspumilus. It is still important to consider that some of the studied natural products were tested for the first time with these fungal and bacterial strains.
Sommaire
INTRODUCTION GENERALE... 1
PARTIE I : ETUDE BIBLIOGRAPHIQUE Chapitre I : Etude Botanique Et Mycologique I. Étude botanique ... 5
1. Les plantes Médicinales et Aromatiques ... 5
2. Classification des espèces végétales étudiées ... 6
2.1. Famille des Piperaceae ... 6
2.2. Famille des Aizoaceae ... 7
II. Étude mycologique ... 8
1. Introduction ... 8
2. Définition du champignon endophytique ... 9
3. Classification des champignons filamenteux ... 9
3.1. Genre Aspergillus et Pénicillium... 9
3.1.1. Classification ... 9
3.1.2. Utilisation en Biotechnologie ... 10
3.1.3. Clés d’identification... 12
3.1.4. Description morphologique des genres Aspergillus et Pénicillium ... 12
3.2. Genre Fusarium... 13 3.2.1. Description macroscopique ... 13 3.2.2. Description microscopique... 14 3.3. Genre Trichoderma ... 15 3.3.1. Généralités... 15 3.3.2. Morphologie ... 15 4. Conclusion ... 16
Chapitre II : Étude chimique des substances naturelles I. Les huiles essentielles ... 17
1. Généralités ... 17
2. Localisation des huiles essentielles dans la plantes ... 17
3. Caractères physico-chimiques des Huiles essentielles ... 17
4. Composition chimique des Huiles essentielles ... 18
4.1. Les terpènes ... 18
4.2. La série aromatique ... 18
4.3. Les composés d’origine diverses... 19
5. Quelques applications et propriétés générales des huiles essentielles ... 19
5.1. Toxicité des Huiles essentielles ... 19
5.2. Activités biologiques des huiles essentielles ... 19
5.3. Autres utilisations des Huiles essentielles ... 22
6. Conclusion ... 22
II. Chimie des plantes médicinales (Phytochimie) ... 23
1. Les plantes médicinales comme source de médicaments ... 23
2. Les principales familles de métabolites secondaires issues des genres Piper et Carpobrotus ... 24
2.2. Les composés phénoliques ... 24
2.2.1. Généralités ... 24
a. Les acides phénoliques simples ... 25
* Les Acides Cinnamiques et hydroxycinnamiques ... 26
2.2.2. Les Terpenoides ... 26
a. L’Amyrine ... 27
2.3. Les alcaloïdes ... 27
2.3.1. Définition et généralités ... 27
2.3.2. Les alcaloïdes de type amides (Les Alkamides)... 27
a. La pipérine ... 28
2.4. Les flavonoïdes ... 29
2.4.1. Définition et Généralités sur les flavonoïdes ... 29
2.4.2. Classification des flavonoïdes ... 29
2.4.3. Les flavonoïdes du genre Piper ... 31
a. Les flavanones ... 31
III. Chimie des métabolites secondaires des champignons endophytiques ... 32
1. Importance des microorganismes dans la pharmacognosie ... 32
2. Champignons endophytiques comme source de métabolites secondaires bioactifs ... 32
3. Les principales classes de métabolites secondaires issues des champignons endophytiques ... 33
3.1. Métabolites secondaires des genres Aspergillus et Pénicillium ... 33
3.1.1. Exemples des métabolites secondaires de Pénicillium radicum ... 33
3.1.2. Exemples des métabolites secondaires d’Aspergillus flavus... 34
3.1.3. Exemples des métabolites secondaires d’Aspergillus fumigatus ... 35
3.2. Métabolites secondaires du genre Fusarium ... 35
3.2.1. Exemples des métabolites secondaires isolés à partir de l’espèce Fusarium chlamydosporum ... 36
3.3. Métabolites secondaires du genre Trichoderma ... 36
3.3.1. Exemples des métabolites secondaires isolés à partir de l’espèce Trichoderma asperellum ... 37
3.4. Autres exemples de métabolites secondaires issus des champignons endophytiques ... 38
3.4.1. Les Coumarines ... 38
a. Définition et Généralités ... 38
b. Propriétés et intérêt biologique des coumarines ... 39
3.4.2. Les polykétides (ou polycétones) ... 39
a. Définition et Généralités ... 39
b. Classification des polykétides ... 40
3.4.3. Les macrolides ... 42
PARTIE II : MATERIELS ET METHODES I. Matériel Végétal ... 43
II. Équipement Général du Laboratoire ... 43
III. Matériels chimiques ... 44
1. Produits chimiques généralement utilisés au laboratoire ... 44
2. Produits chimiques utilisés dans la préparation des milieux de culture ... 44
3. Produits chimiques de préparation du Gel d’agarose pour l’électrophorèse ... 45
4. Solvants ... 45
4.2. Solvants pour HPLC ... 45
4.3. Solvants pour RMN ... 45
5. Les phases stationnaires de La Chromatographie ... 46
IV. Matériel et procédés d’isolement, purification et identification des souches fongiques ... 46
1. Milieux de culture ... 46
1.1. Composition du milieu de culture Malt Agar (MA)... 46
1.2. Composition du milieu Wickerham pour cultures liquides ... 46
1.3. Composition du milieu de culture solide des champignons à base du riz ... 47
1.4. Composition du milieu de culture PDA (Potato Dextrose Agar) ... 47
2. Méthodes ... 47
2.1. Détermination des espèces ... 47
2.2. Méthodes d’isolement des souches fongiques ... 48
2.3. Purification des souches fongiques isolées ... 48
2.4. Stockage à courte durée des souches fongiques ... 49
2.5. Conservation à longue durée des souches pures ... 49
2.6. Identification des souches fongiques ... 49
2.6.1. Préparation des membranes cellophanes comme support de culture ... 50
2.6.2. Préparation du mycélium ... 50
2.6.3. Isolement de L’ADN ... 51
2.6.4. Amplification de l’ADN ... 52
2.6.5. Purification des produits de PCR et séquençage d’ADN ... 53
V. Matériels et techniques d’extraction des substances naturelles... 54
1. Procédés d’extraction ... 54
1.1. Préparation des huiles essentielles par hydro distillation ... 54
1.2. Préparation des extraits végétaux par macération à froid ... 56
2. Techniques de préparation des extraits issus des cultures fongiques ... 56
2.1. Culture des champignons sur milieu solide à base du riz ... 56
2.2. Méthode d’extraction à partir de la culture sur milieu solide à base du riz ... 57
2.3. Extraction liquide-liquide ... 58
VI. Matériel et techniques d’isolement et de purification des métabolites secondaires ... 60
1. La chromatographie liquide sous vide (VLC) ... 60
2. Colonne chromatographique ouverte sur résine échangeuse d’ions Diaion HP20/L ... 61
3. Chromatographie d’exclusion sur gel Sephadex LH-20 ... 61
4. La chromatographie liquide haute performance préparative et semi-préparative ... 64
VII. Matériel et méthodes d’analyses ... 66
1. Procédés d’analyse et d’identification des constituants des Huiles essentielles ... 66
1.1. Chromatographie en phase gazeuse (CPG) ... 66
1.1.1. Généralités ... 66
1.1.2. Le couplage Chromatographie phase gazeuse/ spectrométrie de masse (CPG/MS) ... 68
2. Chromatographie sur couche mince (CCM) ... 68
3. Chromatographie liquide haute performance HPLC analytique ... 69
4. La spectrométrie de masse ... 71
4.1. Définition et Généralités ... 71
4.2. La Chromatographie liquide couplée à la spectrométrie de masse (LC/MS) ... 72
4.3. La spectrométrie de masse en tandem (MS/MS) ... 73
4.4. La spectrométrie de masse haute résolution ... 73
5. Diffraction des rayons X ... 73
5.1. Généralités ... 73
6. La Résonance Magnétique Nucléaire (RMN) ... 74
6.1. Définition et généralités ... 74
6.2. Appareillage et protocole expérimental ... 74
6.3. Les Expériences R.M.N ... 76
6.3.1. Le spectre proton (1H) à une dimension ... 76
6.3.2. Les Spectres 13C ... 76
6.3.3. L’expérience Cosy homonucleaire 1H/1H ... 76
6.3.4. Expérience hétéro-nucléaire HMQC : Heteronuclear MultiQuantum Coherence ... 76
6.3.5. Expérience hétéro-nucléaire HMBC : Heteronuclear Multiple-Bond Correlation ... 76
VIII. Evaluation biologique des huiles essentielles, des extraits méthanoliques et des métabolites secondaires ... 77
1. Test antifongique ... 77
1.1. La souche fongique utilisée du champignon Botrytis cinerea ... 77
1.2. Méthodes ... 77
2. Test antibactérien... 78
2.1. Les souches bactériennes utilisées ... 78
2.2. Méthodes ... 79
2.2.1. Test qualitatif ... 79
2.2.2. Test quantitatif ... 80
PARTIE III : RESULTATS ET DISCUSSIONS Chapitre I : Etude botanique, mycologique et taxonomique I. Détermination des espèces végétales étudiées ... 81
1. Étude Botanique ... 81
1.1. Description morphologique ... 81
1.1.1. Espèce Piper nigrum ... 81
1.1.2 Espèce Carpobrotus edulis ... 81
II. Identification et classification des champignons endophytiques ... 82
1. Identification par biologie moléculaire des champignons endophytiques ... 83
1.1. Extraction et électrophorèse... 83
1.2. Résultat et interprétation du séquençage ... 85
1.3. Analyse des séquences d’ADN des espèces isolées ... 89
1.4. Comparaison des séquences ITS d’Aspergillus fumigatus ... 97
2. Classification des champignons endophytiques étudiés ... 98
2.1. Neonectria macrodidyma ... 98 2.2. Embellisia eureka ... 99 2.3. Trichoderma asperellum ... 99 2.4. Fusarium culmorum ... 99 2.5. Penicillium radicum ... 100 2.6. Aspergillus flavus ... 100 2.7. Aspergillus fumigatus ... 100
Chapitre II : Etude chimique et spectroscopique des substances naturelles et de métabolites secondaires
I. Les huiles essentielles ... 101
1. Rendements d’extraction ... 101
2. Résultats d’analyse des huiles essentielles par chromatographie en phase gazeuse couplée à la spectrométrie de masse (CPG/MS) ... 101
2.1. Analyse chromatographique de l’huile essentielle de Piper nigrum ... 101
2.2. Analyse chromatographique de l’huile essentielle de Carpobrotus edulis ... 103
2.3. Résultats et discussions ... 104
II. Identification et caractérisation des métabolites secondaires ... 105
1. Les métabolites secondaires isolés de l’extrait méthanolique de Piper nigrum ... 105
Composé 1 ... 107
Composé 2 ... 116
Composé 3 ... 125
Composé 4 ... 133
Composé 5 ... 140
2. Les métabolites secondaires isolés de l’extrait organique de l’espèce fongique Embellisia eureka ... 146
Composé 6 ... 148
Composé 7 ... 155
Composé 8 ... 164
3. Les métabolites secondaires isolés de l’extrait organique de l’espèce fongique Neonectira macrodidyma ... 171
Composé 9 ... 173
Chapitre III : Evaluation biologique des huiles essentielles, des extraits méthanoliques et des métabolites secondaires Tests biologiques des huiles essentielles, des extraits organiques et des métabolites secondaires ... 184
I. Test antifongique qualitatif ... 184
II. Test antibactérien qualitatif ... 188
III. Test antibactérien quantitatif... 194
CONCLUSION GENERALE ET PERSPECTIVES ... 209
Liste Des Abréviations
HE : Huile Essentielle
OMS : Organisation Mondiale de la Santé
DL50: Dose Létale médianeDL50 est un indicateur quantitatif de la toxicité d'une substance ADN: Acide Désoxyribonucléique
ARN: Acide Ribonucléique
RNAse : Enzyme de la lyse d’ARN PDA: Potato Dextrose Agar
MA : Malt Agar
NaCl: Chlorure de Sodium NaOH: Hydroxyde de Sodium HCl: Acide Chloridrique
TBE-buffer: Tris/Borate/EDTA- Buffer
bp : paire de bases (Unité de mesure de la longueur des molécules d’ADN et ARN PCR : polymerase chain reaction (Réaction en chaîne par polymérase)
DMSO : diméthyle-sulfoxyde MeOH : Methanol
EtoAc : Acétate d’éthyle Hex : Hexane
Ext : Extrait
K : coefficient de distribution H3PO4 : acide phosphorique HCOOH : acide formique
CCM : chromatographie sur couche mince
HP20 :Diaion : matériel chromatographique échangeur d’ion VLC : chromatographie liquide sous vide
LH 20 : Gel de Sephadex
HPLC : Chromatographie liquide haute performance
HPLC semi-prép : Chromatographie liquide haute performance semi- préparative CPG /MS: Chromatographie en Phase Gazeuse couplée à la spectrométrie de masse E.I: Electronic Impact.
ESI : Electrospray Impact (ionisation chimique) Uma : Unité de masse atomique
UV : Ultra violet
λmax: absorbance maximale en UV nm : nanomètre
MS/MS : La spectrométrie de masse en tandem HRMS : spectre de masse haute résolution
RDX: La Diffraction des Rayons X sur monocristal RMN: la résonance magnétique nucléaire
RMN 1D : Expérience RMN monodimensionnel RMN 2D : Expérience RMN di-dimensionnel RMN 1H : RMN du proton
RMN 13C : RMN du carbone 13
COSY : L’expérience RMN di-dimensionnelle mononucléaire 1H/1H HMQC: Heteronuclear MultiQuantum Cohérence
HMBC: Heteronuclear Multiple-Bond Corrélation : Déplacement chimique
ppm : parties par million Hz : Hertz J : constante de couplage TMS : tétraméthylsilane s: singulet d: doublet dd: doublet dédoublet t: triplet. DO : Densité Optique
CMI : concentration minimale inhibitrice CMB : concentration minimale bactérienne E. coli : Escherichia coli
ZON : la zéaralénone DON : le deoxynivalenol NIV: le nivalénol
ITS: internal transcribed spacer ABI: Applied Biosystems
LISTE DES TABLEAUX
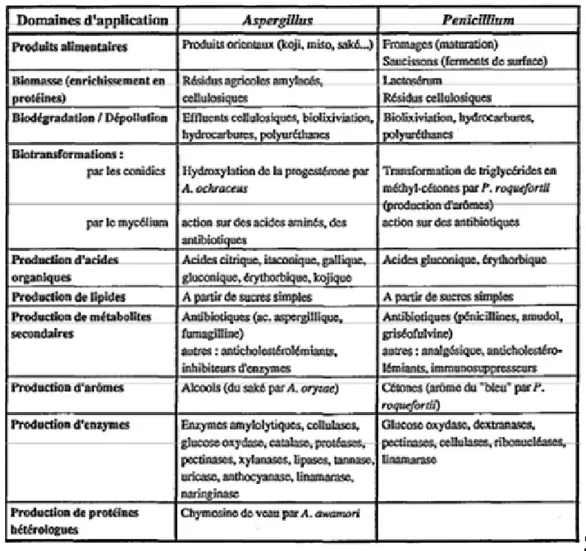
Tableau 1: Principaux domaines d’application des champignons filamenteux appartenant aux genres Aspergillus et Pénicillium.
Tableau 2: Activités biologiques des composés polyphénoliques.
Tableau 3: Principaux acides hydroxycinnamiques.
Tableau 4: Principales classes des flavonoïdes.
Tableau 5: Dérivés de Naphthalénone isolés à partir des champignons.
Tableau 6: Classification des macrolides.
Tableau 7: Réactifs utilisés dans l’amplification de l’ADN par PCR.
Tableau 8: Programme utilisé en HPLC Analytique.
Tableau 9: Liste des champignons endophytiques isolés et étudiés
Tableau 10: Résultats de dosage par Nanodrop 8000 de l’ADN fongique
Tableau 11: Liste des Champignons endophytiques identifiées par biologie moléculaire Tableau 12: Rendements des huiles essentielles étudiées
Tableau 13: Composition chimique de l’huile essentielle de Senecio leucanthemifolius poiret identifiée par GC/MS
Tableau 14: Composition chimique de l’huile essentielle Carpobrotus edulis identifée par GC/MS
Tableau 15: Données RMN du Composé 1 Tableau 16: Données RMN du Composé 2 Tableau 17: Données RMN du Composé 3 Tableau 18: Données RMN du Composé 4
Tableau 19: Données RMN du Composé 5
Tableau 20: Récapitulatif des métabolites secondaires caractérisés de Piper nigrum Tableau 21: Données RMN du Composé 6
Tableau 22: Données spectrales de la RMN 1H et 13C du composé 7
Tableau 23: Données cristallographiques et détails de la de la détermination de la structure du 3,4-dihydro-3,4,8-trihydroxy-1[2H]-naphthalenone (composé 7)
Tableau 24: Liaisons hydrogènes (Å, °) du 3, 4-dihydro-3, 4, 8-trihydroxy-1[2H]-naphthalenone (composé 7)
Tableau 25: Données RMN du Composé 8
Tableau 26: Récapitulatif des métabolites secondaires caractérisés d’Embellisia eureka
Tableau 27: Données cristallographiques et Détails de la Détermination de la structure Brefeldin A Tableau 28: Caractéristiques des liaisons hydrogènes Bonds (Å, °) Brefeldin A
Tableau 29: Données spectrales RMN 1H et 13C NMR Brefeldin A (Composé 9) Tableau 30: Effet des produits testés sur la croissance de Botrytis cinerea Tableau 31: Antibiogramme du test qualitatif
Tableau 32: Effet des concentrations testées sur la croissance de Bacillus subtilis
Tableau 33: Effet du produit Hce sur la croissance de Bacillus subtilis
Tableau 34: Effet du produit Pce sur la croissance de Bacillus subtilis
Tableau 35: Effet du produit Hpn sur la croissance de Bacillus subtilis
Tableau 36: Effet du produit Epn sur la croissance de Bacillus subtilis
Tableau 37: Effet du composé 1 sur la croissance de Bacillus subtilis
Tableau 38: Effet du composé 2sur la croissance de Bacillus subtilis
Tableau 39: Effet du composé 5 sur la croissance de Bacillus subtilis Tableau 40: Effet du composé 9 sur la croissance de Bacillus subtilis
Tableau 41: Effet des produits sur la croissance de Rhizobium sp
Tableau 42: Effet du produit Hce sur la croissance de Rhizobium sp
Tableau 43: Effet du produit Ece sur la croissance de Rhizobium sp
Tableau 44: Effet du produit Hpn sur la croissance de Rhizobium sp
Tableau 45: Effet du produit Epn sur la croissance de Rhizobium sp
Tableau 46: Effet du composé 1 sur la croissance de Rhizobium sp
Tableau 47: Effet du produit composé 2 sur la croissance de Rhizobium sp
Tableau 48: Effet du composé 5 sur la croissance de Rhizobium sp
Tableau 49: Effet du composé 9 la croissance de Rhizobium sp
LISTE DES FIGURES
Figure1: Zones de culture du poivre (délimitées par les deux tracés rouges).
Figure2: Schémas des structures reproductrices des champignons filamenteux appartenant au genre Aspergillus (A) et au genre Pénicillium (B).
Figure3: Image d’une observation microscopique du Mycélium et des spores du genre Fusarium (x2500).
Figure 4: Structures des α-amyrine et β-amyrine
Figure 5: Structure des alkamides dimères [2+2] isolés à partir de Piper nigrum.
Figure 6: la molécule de pipérine : Il s’agit de la (2E,4E)-5-(benzo[d][1,3]dioxol-5-yl)-1-(piperidin-1-yl)penta-2,4-dien-1-one en nomenclature officielle.
Figure 7:Structure tri-cyclique commune aux flavonoïdes Figure 8: Exemples de flavanones C-alkylées.
Figure 9: Structures de quelques métabolites secondaires isolés à partir de Pénicillium radicum.
Figure 10: Structures de quelques métabolites secondaires de l’espèce Aspergillus flavus. Figure 11: Structure de quelques métabolites secondaires isolés à partir d’Aspergillus fumigatus.
Figure 12: Structure de quelques métabolites secondaires isolés à partir de Fusarium chlamydosporum.
Figure 13: Structure des nouveaux Peptaibols (peptides acide α-amino iso butyrique amino alcool) nommés Asperilines A-F (1-6).
Figure 14: Squelette de coumarine.
Figure 15:Quelques exemples de polykétides.
Figure 16: Exemple de technique d’isolement des champignons endophytiques. Figure 17: Incubation des cultures fongiques.
Figure 18: Préparation des membranes cellophanes.
Figure 19: Exemple de culture fongique sur papier cellophane.
Figure 20: Traitement et purification de l’ADN par colonne de type « ISOLATE II Plant DNA Spin Column »
Figure 21: Schéma basique de montage de l’entrainement à la vapeur d’eau.
Figure 22: Appareillage type Clevenger modifié utilisé pendant l’hydrodistillation de l’huile essentielle.
Figure 23: Montage du Rotavapor.
Figure 24: Culture des champignons sur milieu solide à base du riz. Figure 25: Extraction de la culture solide sur riz.
Figure 26: Schéma général de l’extraction liquide/ liquide à partir d’un extrait fongique d’acétate d’éthyle.
Figure 27: Colonne de chromatographie liquide sous vide (VLC).
Figure 28: Schéma de colonne de chromatographie liquide échangeuse d’ions.
Figure 29: Schéma de colonne de Chromatographie d’exclusion sur gel Sephadex LH-20. Figure 30: Colonne de séphadex LH 20.
Figure 31: Schéma de L’HPLC semi- prép.
Figure 32: Chromatographie liquide haute performance semi-préparative (HPLC semi- prép). Figure 33: Schéma de chromatographe en phase gazeuse (CPG).
Figure 34: Schéma principal de la chromatographie en phase liquide à haute performance. Figure 35: Chromatographie en phase liquide à haute performance (HPLC).
Figure 36: La Chromatographie liquide couplée à la spectrométrie de masse (LC/MS). Figure 37: Schéma du montage de la Diffraction des Rayons X (DRX) sur monocristal. Figure 38: La Résonance Magnétique Nucléaire (RMN).
Figure 39: Electrophorèse sur Gel agarose des différents produits PCR.
Figure 40: Alignement des séquences ITS de FZ20 avec celle de Trichoderma asperellum. Figure 41: Alignement des séquences ITS de FZ19 avec celle de Fusarium culmorum. Figure 42: Alignement des séquences ITS de FZ10 avec celle de Penicillium radicum. Figure 43: Alignement des séquences ITS de FZ17 avec celle d’Aspergillus flavus. Figure 44: Alignement des séquences ITS de FZ18 avec celle d’Aspergillus fumigatus. Figure 45: Alignement des séquences ITS de FZ16 avec celle d’Aspergillus fumigatus. Figure 46: Alignement des séquences ITS de FZ15 avec celle d’Aspergillus fumigatus. Figure 47: Alignement des séquences ITS de FZ14 avec celle d’Aspergillus fumigatus. Figure 48: Alignement des séquences ITS de FZ13 d’Aspergillus fumigatus.
Figure 49: Alignement des séquences ITS de FZ12 avec celle d’Aspergillus fumigatus. Figure 50: Alignement des séquences ITS de FZ8 avec celle d’Aspergillus fumigatus. Figure 51: Alignement des séquences ITS de FZ2 avec celle d’Aspergillus fumigatus. Figure 52: Arbre phylogénique pour les huit souches et des souches de référence.
Figure 53: Les regroupements de ressemblance des isolats d’Aspergillus fumigatus à partir de l’arbre phylogénique.
Figure 54: Structures chimiques des constituants majoritaires de l’huile essentielle de Piper nigrum
Figure 55: Extraction, Fractionnement, isolement et purification des métabolites secondaires de piper nigrum
Figure 56: Structure du Composé 1
Figure 57: Données HPLC/UV et LC/MS du Composé 1 Figure 58:Corrélations HMBC du Composé 1
Figure 59:Spectre RMN du proton 1H du Composé 1 Figure 60: Spectre RMN COSY du Composé 1 Figure 61: Spectre RMN HMQC du Composé 1 Figure 62: Spectre RMN HMBC du Composé 1 Figure 63: Spectre HMBC zoomé du Composé 1 Figure 64: Structure du Composé 2
Figure 65: Données HPLC/UV ; LC/MS et HRMS du Composé 2 Figure 66: Corrélations HMBC du Composé 2
Figure 67:Spectre RMN du proton 1H du Composé 2 Figure 68: Spectre RMN 13 C du Composé 2
Figure 69: Spectre RMN COSY du Composé 2 Figure 70: Spectre RMN HMBC du Composé 2 Figure 71: Structure du Composé 3
Figure 72:Données obtenues par HPLC/UV ; LC/MS et HRMS Figure 73: Corrélations en HMBC du Composé 3
Figure 74: Spectre RMN 1H du Composé 3
Figure 75: Spectre RMN 1H de la partie hexose du Composé 3 Figure 76: Spectre RMN COSY du Composé 3
Figure 77: spectre RMN COSY de la partie hexose du Composé 3 Figure 78: Spectre RMN HSQC du Composé 3
Figure 79: Spectre RMN HMBC du Composé 3 Figure 80: Structure du Composé 4
Figure 81: Données HPLC/UV ; LC/MS et HRMS du Composé 4 Figure 82: Corrélations en HMBC du Composé 4
Figure 84: Spectre RMN COSY du Composé 4 Figure 85: Spectre RMN HSQC du Composé 4 Figure 86: Spectres RMN HMBC du Composé 4 Figure 87: Structure du Composé 5
Figure 88: Données HPLC/UV ; LC/MS et HRMS du Composé 5 Figure 89: Spectre RMN H du Composé 5
Figure 90: Spectre RMN COSY du Composé 5 Figure 91: Spectre RMN HMQC du Composé 5 Figure 92: Spectre RMN 13C du Composé 5
Figure 93: les étapes de fractionnement et purification des métabolites secondaires isolés à partir de l’extrait Acétate d’éthyle (EtOAc) de la souche fongique Embellisia eureka
Figure 94: Structure du Composé 6
Figure 95: les données HPLC/UV ; LC/MS et HRMS du composé 6 Figure 96: Corrélations HMBC du Composé 6
Figure 97 (A ; B ): Spectres RMN du proton 1H du Composé 6 Figure 98: Spectre RMN COSY H-H du Composé 6
Figure 99: Spectre HMBC du Composé 6 Figure 100: Structure du Composé 7
Figure 101: Données HPLC ; UV et LC/MS du Composé 7
Figure 102: ORTEP du 3,4-dihydro-3, 4,8-trihydroxy-1[2H]-naphthalenone
Figure 103: Liaisons hydrogènes intermoléculaires du 3,4-dihydro-3, 4,8-trihydroxy-1[2H]-naphthalenone
Figure 104: Spectre RMN 1H du Composé 7 Figure 105: spectre RMN 13C du Composé 7 Figure 106: Spectre RMN DEPT du Composé 7 Figure 107: Spectre RMN COSY du Composé 7 Figure 108: Spectre RMN HMQC du Composé 7 Figure 109: Spectre RMN HMBC du Composé 7 Figure 110: Structure du Composé 8
Figure 111: Données HPLC/UV ; LC/MS et HRMS du Composé 8 Figure 112: Corrélations HMBC du Composé 8
Figure 113: Spectre RMN 1H du Composé 8 Figure 114: Spectre RMN COSY du Composé 8 Figure 115: Spectre RMN HSQC du Composé 8
Figure 116: Spectre RMN HMBC du Composé 8
Figure 117: Schéma de fractionnement et de purification des métabolites secondaires isolés à partir de l’extrait EtOAc de Neonectria macordidyma
Figure 118: Structure du Composé 9
Figure 119: Données HPLC ; UV et LC/MS du Composé 9 Figure 120: ORTEP de la Brefeldin A
Figure 121: a) centres asymétriques des molécules Brefeldin A liés aux dimères par des liaisons hydrogènes. b) dimères liés entre eux par des liaisons hydrogènes parallèles au plan (ab).
Figure 122: Processus de la fragmentation de l’ion moléculaire protoné BrefeldinA Figure 123: Spectres de masse de la fragmentation MS-MS de la Brefeldin A Figure 124: Spectre RMN H du Composé 9
Figure 125: Spectre RMN 13C du Composé 9 Figure 126: Spectre RMN DEPT du Composé 9 Figure 127: Spectre RMN COSY du Composé 9 Figure 128: Spectre RMN HSQC du Composé 9
Figure 129: Présentation comparative de l’effet antagoniste des substances naturelles étudiées sur la croissance de Botrytis cinerea
Figure 130: Test in vitro de l’effet antagoniste contre la croissance de Botrytis cinerea Figure 131: Effet antibactérien sur la souche E. coli
Figure 132: Effet antibactérien sur la souche Agrobacterium sp. Figure 133: Effet antibactérien sur la souche Rhizobium sp. Figure 134: Effet antibactérien sur la souche Bacillus subtilis Figure 135: Effet antibactérien sur la souche Bacillus pumilus
Figure 136: Pourcentage d’inhibition de Bacillus subtilis par le produit Hce Figure 137: Pourcentage d’inhibition de Bacillus subtilis par le produit Pce Figure 138: Pourcentage d’inhibition de Bacillus subtilis par le produit Hpn Figure 139: Pourcentage d’inhibition de Bacillus subtilis par le produit Epn Figure 140: Pourcentage d’inhibition de Bacillus subtilis par le composé 1 Figure 141: Pourcentage d’inhibition de Bacillus subtilis par lecomposé 2 Figure 142: Pourcentage d’inhibition de Bacillus subtilis par le composé 5 Figure 143: Pourcentage d’inhibition de Bacillus subtilis par le composé 9 Figure 144: Pourcentage d’inhibition de Rhizobium sp par le produit Hce Figure 145: Pourcentage d’inhibition de Rhizobium sp par le produit Ece
Figure 146: Pourcentage d’inhibition de Rhizobium sp par le produit Hpn Figure 147: Pourcentage d’inhibition de Rhizobium sp par le produit Epn Figure 148: Pourcentage d’inhibition du Rhizobium sp par le composé 1 Figure 149: Pourcentage d’inhibition du Rhizobium sp par le composé 2 Figure 150: Pourcentage d’inhibition du Rhizobium sp par le composé 5 Figure 151: Pourcentage d’inhibition de Rhizobium sp par le composé 9
1
INTRODUCTION GENERALE
Depuis toujours, les plantes ont constitué la source majeure de médicaments grâce à leur richesse en métabolites secondaires. Elles ont été utilisées comme l’élément essentiel de la médecine traditionnelle servant les gens partout dans le monde depuis des milliers d’années [1]. Dans les dernières décennies il y a eu un intérêt croissant pour l'étude des plantes médicinales et leur utilisation traditionnelle dans différentes régions du monde [2].
En effet, les substances naturelles, dont les plantes constituent la source principale, représentent près de 60% des médicaments dont nous disposons. Les 40% restants ou médicaments de synthèse sont souvent nés de la modification chimique de molécules ou de parties de molécules naturelles prises comme ‘têtes de séries’. Globalement, au moins 119 composés dérivés de 90 espèces de plantes peuvent être considérés comme des médicaments importants. 74% de ces composés ont été trouvés par des études chimiques de l'isolement des composés bioactifs à partir de plantes utilisées en médecine traditionnelle [3].
Au Maroc, des études sont menées depuis quelques années par des chercheurs et des étudiants universitaires. Les huiles essentielles de ces plantes ou leurs extraits subissent des tests d’activité biologique et sont également analysés chimiquement. L’activité biologique varie en fonction de la composition chimique qui elle-même fonction de plusieurs paramètres [4].
Ainsi l’activité thérapeutique de chaque plante dépend de son équipement enzymatique particulier qui est commandé génétiquement afin d’orienter la biosynthèse vers la production préférentielle d’un constituant chimique. L’ensemble des molécules bio-synthétisées constitue un chémotype caractéristique de chaque espèce ou variété. Dernièrement ce chémotype est considéré comme critère de classification des espèces végétales à côté de la biologie moléculaire et la systématique morphologique traditionnelle.
A l’heure actuelle, la recherche de nouveaux médicaments d’origine naturelle passe par l’inventaire des plantes et l’examen systématique de leur activité biologique. Il y a environ près de 240 000 à 300 000 espèces de plantes à fleur sur terre. Moins de 10% de ces espèces auraient été étudiées scientifiquement pour leurs propriétés pharmacologiques [4]. Les végétaux constituent donc un potentiel chimique très important. A travers l’histoire et ce depuis l’antiquité l’homme s’est intéressé aux plantes et à leurs usages surtout en tannerie,
2
cosmétique et en médecine. Les manuscrits d’Hippocrate, de Gallien et de Dioscorides ont ajouté leurs propres observations.
Dans ces dernières décennies les chercheurs à l’échelle mondiale se sont intéressés à d’autres sources naturelles de métabolites secondaires bioactifs à côté des plantes médicinales et aromatiques. Il s’agit de l’étude des champignons endophytiques et des éponges marines qui sont considérés, de nos jours, comme une source inépuisable et très riche de molécules nouvelles et bioactives. La plupart, si ce n'est toutes les plantes étudiées dans les écosystèmes naturels sont infestées par des champignons microscopiques sans pour autant qu'elles ne développent de symptômes pathogènes. Ces microorganismes appelés endophytes colonisent les espaces inter et intracellulaires des tissus de végétaux vivants. Plusieurs centaines d'espèces de ces microorganismes peuvent être isolées à partir d'une seule plante.
Les champignons ont été reconnus comme l'une des ressources les plus importantes de la biodiversité à partir de sources terrestres et aquatiques. À l'heure actuelle, les estimations du nombre total d'espèces fongiques sont d'environ 1,5 millions d'espèces, alors que le nombre de champignons décrits dans le monde est à peu près 7% [5].
À partir de ces champignons, beaucoup de métabolites secondaires ont été isolés, caractérisés, élucidés et testés comme de potentiels agents d’activité biologique. Un récent sondage en littérature a montré que plus de 1500 métabolites secondaires issus de champignons endophytiques caractérisés entre 1993 et 2001, ont montré une activité anticancéreuse et antibiotique importantes. Ces statistiques seraient détaillées d’avantage dans la partie bibliographique.
L’objectif de ce travail est de caractériser, identifier et valoriser les substances naturelles et les métabolites secondaires bioactifs produits par des organismes vivants à l’échelle macroscopique et microscopique d’origine naturelle à savoir, les plantes médicinales et les champignons endophytiques.
On représentera cette étude sous trois parties :
Dans une première partie nous résumerons une étude bibliographique sur les connaissances botaniques et phytochimiques. Cette partie sera subdivisée en deux chapitres. Le Chapitre I, mettra en valeur une étude botanique et taxonomique des espèces végétales étudiées, et présentera des rappels mycologiques et une étude taxonomique appuyée par une classification et une description des espèces fongiques étudiées. Le chapitre II, sera consacré à la chimie des substances naturelles en général. Nous présenterons, d’une part, une synthèse bibliographique sur les huiles essentielles et d’autre part une introduction aux métabolites secondaires issus
3
des plantes médicinales et des champignons endophytiques considérés comme sources importantes dans la recherche et le développement de nouveaux médicaments.
Dans la deuxième partie, appelée « Matériels et Méthodes », nous allons présenter le matériel végétal et fongique étudié ainsi que les méthodes suivies pour identifier les espèces végétales et encore les techniques de biotechnologie et de biologie moléculaire qui nous permettent d’isoler et d’identifier les souches fongiques. Nous allons également donner un aperçu sur le matériel chimique, chromatographique et analytique utilisés durant ce travail de recherche ainsi que les méthodes suivies dans l’extraction comme l’hydro-distillation dans le cas des huiles essentielles, la macération à froid dans le cas des extraits végétaux et des extraits fongiques. Ces extraits organiques ont fait l’objet d’une série de fractionnement en utilisant une variété de colonnes chromatographiques comme par exemple la chromatographie liquide sous vide (VLC), les colonnes chromatographiques d’exclusion à base du gel Sephadex suivies par l’étape de la purification des produits par Chromatographie liquide haute performance semi-préparative (HPLC semi-prép).
Les extraits et les produits purs isolés ont fait l’objet d’analyses chimiques, chromatographiques et spectroscopiques afin de déterminer leurs structures et compositions chimiques. Des tests antifongiques et antibactériens ont été réalisés afin de valoriser l’activité biologique des substances naturelles étudiées.
Dans la troisième partie, appelée « Résultats et Discussions », nous rapporterons les résultats de l’identification par biologie moléculaire des espèces fongiques isolées ; les résultats chimiques : analyse et caractérisation des huiles essentielles, des extraits organiques et des métabolites secondaires purifiés et encore la valorisation de l’activité biologique : activités antibactérienne et antifongique de l’ensemble des substances naturelles étudiées. Une discussion bien détaillée de ces résultats sera établie en se basant sur la comparaison avec les résultats cités dans la littérature.
Deux espèces végétales font l’objet de la présente étude : Piper nigrum L. de la famille des Pipéracées et Carpobrotus edulis de la famille des Aizoaceae. En parallèle, plusieurs souches fongiques ont été isolées et identifiées par biologie moléculaire (séquençage, PCR). Il s’agit des espèces fongiques Embellisia eureka, Neonectria macrodidyma, Penicillium radicum, Aspergillus fumigatus, Aspergillus flavus, Fusarium chlamydosporum et Trichoderma asperellum, isolées respectivement à partir des espèces végétales Cladanthus arabicus, Mentha pulegium et Carpobrotus edulis.
4
L’originalité que présente l’étude phytochimique des champignons endophytiques est qu’à part l’étude réalisée par notre groupe de recherche, les deux souches fongiques Embellisia eureka et Neonectria macrodidyma n’auraient à notre connaissance jamais bénéficié d’une étude phytochimique que ça soit à l’échelle nationale ou internationale.
A la fin de la partie « Résultats et discussions », nous allons discuter les résultats des tests antifongique et antibactérien réalisés concernant les huiles essentielles et les extraits méthanoliques de Piper nigrum et de Carpobrotus edulis ainsi que les métabolites secondaires isolés. La plupart des produits testés ont donné un bon effet antifongique contre la croissance de la souche Botrytis cinerea. Pareil dans les tests antibactériens, les substances testées ont révélé des effets inhibiteurs intéressants sur la croissance de la plupart des souches testées à savoir, E.coli, Agrobacterium spp., Rhizobium sp. Bacillus subtilis et Bascilus pumilus.
Ces résultats ont été évalués selon le diamètre d’inhibition dans le cas des tests qualitatifs et selon la concentration minimale inhibitrice (CMI) dans le cas des tests quantitatifs. Il est à noter que parmi les substances naturelles étudiées dans ce travail, certaines seraient testées pour la première fois sur ses souches fongiques et bactériennes.
PARTIE I : ETUDE
BIBLIOGRAPHIQUE
Chapitre I : Etude Botanique
Et Mycologique
5 I. Etude Botanique
1. Les plantes Médicinales et Aromatiques
Les vertus de la plus grande partie des plantes médicinales encore utilisées aujourd’hui furent découvertes dès l’antiquité ou le moyen âge. Nombre d’entre elles sont même connues depuis la préhistoire [6]. Si une plante a des vertus médicinales, c’est parce qu’elle renferme des principes actifs permettant de soigner une affection déterminée. Les médecins de l’antiquité ou du moyen âge ne disposaient pas de moyens leur permettant de prouver l’efficacité d’une plante; ils s’appuyaient principalement sur l’aspect d’une espèce végétale donnée et sur l’expérience qu’avaient pu leur transmettre leurs ancêtres. C’est en Inde et surtout en Chine que les plantes médicinales sont les plus utilisées, les plus étudiées et font même l’objet d’une culture réglementée [7].
Les espèces végétales aromatiques sont définies comme étant des espèces ayant une odeur agréable et non toxique. Ces plantes sont commercialisées soit à l’état entier, soit leurs feuilles seulement dans des flacons industriels. D’autre part, elles sont utilisées indirectement par leurs extraits dans l’industrie agroalimentaire où elles sont utilisées comme arômes. Leurs huiles essentielles sont utilisées comme additif dans la cosmétique et la parfumerie. Beaucoup d’espèces aromatiques sont également des espèces médicinales, d’où leur utilisation à des fins phytothérapiques pour soigner et soulager certains maux [6, 7,8].
Les méthodes utilisées dans l’étude des plantes médicinales et aromatiques sont de trois sortes :
- Les travaux bibliographiques
- Les enquêtes sur le terrain auprès de populations (étude ethnobotanique) - Les travaux de Laboratoire.
Ces derniers reposent sur la pharmacologie, la pharmacognosie, la biologie pharmaceutique, la chimie, la biotechnologie, la toxicologie, la pharmacie clinique et la pharmaco-technique.
Au Maroc, des travaux de laboratoire sont menés par des chercheurs universitaires depuis quelques années. Cependant, les résultats de ces recherches doivent être rassemblés de temps en temps dans des recueils pour les mettre à la disposition des lecteurs et des chercheurs.
6 2. Classification des espèces végétales étudiées 2.1. Famille des Piperaceae
La famille des Piperaceae comprend entre 1400 et 3000 espèces réparties en une dizaine de genres dont les deux principaux représentants sont le genre Piper et le genre Peperomia [9].
Ce sont des plantes herbacées ou arbustes parfois épiphytes, présentant des nœuds enflés ou articulés. Les feuilles sont généralement entières, simples, alternes à nervation palmée ou pennée. Elles dégagent souvent par froissement une odeur forte et piquante. Le genre Piper comprend plus de 1000 espèces réparties dans les régions tropicales et subtropicales. Ce sont des arbres ou arbustes, rarement des lianes, fréquemment rencontrés dans les forêts humides des régions de l’hémisphère sud [10]. L’espèce la plus connue est le poivrier commun ou Piper nigrum L. C’est l’un des épices les plus anciennement connues. C’est une liane d’habitat forestier et de climat équatorial. Elle prospère idéalement dans une zone géographique située entre le 15ème degré de latitude Nord et le 15ème degré de latitude Sud. Piper nigrum peut être rencontrée aussi en climat tropical mais à saison sèche plus ou moins marquée [11]. Elle est originaire du sud-ouest de l’Inde (côte de Malabar) et cultivée maintenant en plusieurs zones citant par exemple [12]:
- L’Inde : dans l’état du Kerata
- L’Indonésie : à Kalimantan, Sumatra et sur l’ile de Bangke - La Malaisie : dans l’état de Sarawak
- Le Brésil : dans la province de Para
- La Chine : à Taiwan et dans les provinces du Sud - La Thaïlande : dans les districts de Thon et Buri - Le Sri Lanka : à Dunbara-Tal
- Le Cambodge - Le Laos - Le Vietnam - Madagascar - Les Antilles
7
Figure1: Zones de culture du poivre (délimitées par les deux tracés rouges).
2.2. Famille des Aizoaceae
La famille des Aizoaceae (Aizoacées) est une vaste famille de plantes dicotylédones principalement représentée dans les régions à climat sec d'Afrique australe. Selon Watson et Dallwitz, elle comprend plus de mille espèces réparties en plus de 100 genres [13].
Les plantes du genre Carpobrotus appartiennent à la famille des Aizoacées. Ce sont des plantes succulentes rampantes, qui forment des tapis denses. Originaires d'Afrique du Sud, différentes espèces ont été introduites sur les côtes méditerranéennes ou californiennes pour leur qualité à la fois ornementale et fixatrice du sable. Cependant, dans certains cas, elles ont révélé une menace pour la biodiversité des écosystèmes locaux en devenant des espèces invasives, notamment dans le Parc national de Port-Cros sur l'Île de Bagaud.
Les fleurs très colorées ont la forme de marguerites. Le nom fait référence aux fruits comestibles. Il vient du grec "karpos" (fruits) et "brota" (comestibles). Carpobrotus edulis est une espèce de plante grasse de la famille des Aizoaceae. En français, elle est appelée Croc de sorcière, Griffe de sorcière, Doigt de sorcière, Doigt de fée, Ficoïde comestible ou Figuier des Hottentots. Son fruit est comestible.
Originaire d'Afrique du Sud, elle fut importée en Amérique et en Europe au début du XXe siècle pour l'ornement et pour la stabilisation des sols. De nos jours, elle est considérée comme invasive dans un certain nombre de pays connaissant un climat méditerranéen comme le Maroc. Cette plante pousse sur les sols sableux, souvent sur les dunes littorales ou dans
8
l'arrière-dune, mais on peut aussi la trouver sur les falaises ou rochers du littoral. Elle forme souvent de grands tapis végétaux pouvant couvrir plusieurs mètres carrés [14]. En Afrique du Sud, les feuilles sont mangées par les tortues; le cobra du Cap tend des embuscades aux petits rongeurs attirés par les fruits. Les fleurs sont pollinisées par les abeilles solitaires, les abeilles charpentières, et de nombreuses espèces de coléoptères. Les fleurs sont mangées par les antilopes et les babouins. Les massifs offrent un abri pour les escargots et les lézards tels que les scinques. Les fruits sont consommés par les babouins, les rongeurs, les porcs-épics et les antilopes qui dispersent ainsi les graines via leurs excréments.
II. Etude Mycologique 1. Introduction
Les champignons ou mycètes ou mycophytes, sont des organismes eucaryotes dépourvus de chlorophylle. Ils ont subi une évolution particulière qui a conféré à beaucoup d’entre eux des caractères morphologiques ou biologiques végétatifs ou sexuels, souvent fort remarquables. L’absence de chlorophylle rend les champignons hétérotrophes pour le carbone [15]. Des mutations de gènes ont créé différents types d’hétérotrophies [16]. De ce fait, les champignons vivent comme :
- Saprophytes sur des débris et des substances organiques mortes - Parasites sur des plantes ou des animaux vivants [17]
- Associés en symbiose avec des plantes ou des animaux (cas des lichens : algues + champignons) [18, 19]
Les espèces saprophytes contribuent à la décomposition de la matière organique dont les éléments pourraient être réutilisés par les espèces autotrophes.
Les espèces parasites sont souvent pathogènes et provoquent des maladies pour des plantes cultivées : rouilles, charbons, cariés, Oïdie, anthracnoses, mildious, etc,…) [20, 21, 22].
Les espèces symbiotiques les plus remarquables sont celles qui forment des mycorhizes avec les racines d’arbres et herbes vivaces [23, 24] et aussi celles qui s’associent avec des algues pour former les lichens [25].
9 2. Définition du champignon endophytique
Plusieurs auteurs ont donné une ou plusieurs définitions aux champignons endophytiques mais on peut résumer toutes les définitions connues sous une seule globale et générale : les champignons endophytiques sont des champignons qui passent entièrement ou partiellement leur cycle de vie, comme parasites inter et/ou intracellulaire, à l’intérieur des tissus sains d’une plante dite hôte sans causer de manière évidente de symptômes délétères [17]. Il s'agit essentiellement d'Eumycètes qui peuvent envahir tous les organes de la plante: fleurs, feuilles, tiges et racines. Les hyphes peuvent être plus ou moins pigmentés, mais sont généralement incolores, ce qui rend la détection de ces champignons difficiles. Il existe cependant des techniques de coloration pour les mettre en évidence [26, 27, 28].
Selon Kogel et al. (2006) [29], un champignon endophytique est bénéfique pour la plante tans qu’il conserve le bon équilibre de ses besoins par rapport aux exigences de la plante hôte. Une fois cet équilibre est déstabilisé, l’endophyte devient pathogène.
Des études récentes ont montré que la production des métabolites secondaires par les champignons endophytiques est principalement liée à leur mode de vie. Ainsi, l’interaction métabolique du champignon endophytique avec son hôte, se développant sous différentes conditions d’environnement, favorise et implique la biosynthèse des métabolites secondaires bioactifs [18, 30,31].
3. Classification des champignons filamenteux
Les champignons filamenteux imparfaits appartiennent à la classe des Deutéromycètes. Quelques formes parfaites (sexuées) sont connues et appartiennent à la classe des Ascomycètes (Carpenteles, Eupenicillium, Talaromyces). Ce genre comprend entre 100 et 250 espèces.
3.1. Genre Aspergillus et Pénicillium 3.1.1. Classification
La taxonomie des champignons filamenteux est une science en évolution permanente, faisant appel le plus souvent à des critères descriptifs. Pour cette raison, elle a donné lieu à de nombreuses classifications, plus ou moins complexes et parfois divergentes [32-35]. Nous citerons les travaux d’ALEXOPOULOS et MIMS (1979) [33], qui situent les deux genres Aspergillus et Pénicillium dans la famille des EUROTIACEAE, selon le schéma suivant :
10 - Règne : MYCETEAE - Division : AMASTIGOMYCOTA - Sous-division : ASCOMYCOTINA - Classe : ASCOMYCETES - Sous-classe : PLECTOMYCETIDAE - Ordre : EUROTIALES - Famille : EUROTIACEAE
Un schéma très similaire a été proposé par AINSWORTH et coll. (1973) [32]. Cependant, d’autres auteurs situent ces deux genres dans la classe des DEUTEROMYCETES ou champignons imparfaits [35]. Celle-ci regroupe les microorganismes qui ne possèdent pas de reproduction sexuée, ou qui se rencontrent le plus souvent sous leur forme imparfaite (se multipliant au moyen de conidies), bien qu’ils soient capables de développer un type de reproduction sexuée. Dans leur ouvrage, ALEXOPOULOS et MIMS (1979) [33] n’avaient d’ailleurs pas écarté la possibilité d’attribuer les genres Aspergillus et Pénicillium à la classe des DEUTEROMYCETES, sous-classe des HYPHOMYCETIDAE, ordre des MONILIALES, famille des MONILIACEAE.
3.1.2. Utilisation en biotechnologie :
L’utilisation des genres Aspergillus et Pénicillium pour la transformation de denrées alimentaires est très ancienne. Depuis, de nombreuses études systématiques entreprises sur ces microorganismes ont permis d’élargir leurs champs d’application dans les domaines de l’agroalimentaire, de la pharmacologie et/ou de l’écologie. Cependant, ces deux genres de champignons filamenteux font également partie des contaminants fongiques les plus couramment rencontrés. Ils sont responsables de la bio-détérioration de nombreux produits : aliments, mais aussi papier, caoutchouc, cuir, peinture, métaux,... [35].
11
Tableau 1: Principaux domaines d’application des champignons filamenteux appartenant aux genres Aspergillus et Pénicillium.
Les exemples d’applications faisant intervenir des champignons filamenteux appartenant aux genres Aspergillus ou Pénicillium sont très nombreux. Ils ont été largement discutés par divers auteurs [35, 36-39]. Les principaux domaines d’application de ces microorganismes sont résumés dans le tableau 1.
A l’échelle industrielle, l’utilisation de ces champignons filamenteux reste encore limitée à quelques domaines (produits alimentaires traditionnels, production d’enzymes). Pourtant, ces microorganismes présentent une grande diversité et de nombreuses potentialités comme la possibilité de se développer en milieu solide ou en milieu liquide (surface ou submergé). Ainsi, les nombreuses études dont ils font l’objet, devraient permettre dans l’avenir une extension de leurs champs d’application.
12 3.1.3. Clés d’identification :
L’identification des deux champignons filamenteux est réalisée à l’aide des clés dichotomiques établies par PITT (1979) [40] pour le genre Pénicillium et par RAPER et FENNELL (1965) [41] pour le genre Aspergillus.
3.1.4. Description morphologique des genres Aspergillus et Pénicillium Genre Aspergillus
a. Description macroscopique
Colonies envahissantes, d’un diamètre de 8 cm après 7 jours d’incubation à 25°C. Ces colonies sont circulaires à bord régulier et légèrement aériennes (cotonneuses) sans être denses. Au centre de la boîte de Pétri, la colonie forme un caratère, recouvert des conidies les plus anciennes. En allant vers le bord de la colonie, on observe une alternance de zones de fructification plus ou moins dense de couleur jaune/ocre, et enfin une petite couronne translucide de mycélium sans fructification. Enfin, la colonie apparaît blanchâtre au verso de la boîte de Pétri.
b. Description microscopique
A partir des observations microscopiques, le genre Aspergillus présente un mycélium translucide, septé ramifié, rugueux et d’un diamètre compris entre 5 et 12 µm. Les formes de reproduction asexuées (conidiophores) sont terminées par des vésicules rondes à ovales, de 20 à 50 µm de diamètre (souvent inférieur à 40 µm), et généralement unisériées. A la surface des vésicules sont directement disposées les phialides. Celles-ci sont en forme de quille de 10 à 14 µm de longueur et de 5 à 8 µm de diamètre. Les phialides libèrent des conidies rondes, assez grosses, très ornementées, de couleur ocre/marron, et disposées en chaînettes assez longues (figure 2A).
Genre Pénicillium
a. Description macroscopique
Le genre Pénicillium donne généralement des colonies moyennement aériennes, à bord assez relié. La surface est homogène, recouverte de très nombreuses fructifications formant une croûte, ce qui donne une texture finement granuleuse (poudreuse). Le mycélium est peu dense et transparent. Les nombreuses fructifications apparaissent pigmentées en vert pistache pour les plus jeunes, à vert sombre pour les plus âgées (centre de la colonie). Enfin. Une fine couronne de mycélium seul se dessine en périphérie.
![Figure 5: Structure des alcamides dimères [2+2] isolés à partir de Piper nigrum.](https://thumb-eu.123doks.com/thumbv2/123doknet/2193128.11695/55.892.116.788.198.414/figure-structure-alcamides-dimeres-isoles-partir-piper-nigrum.webp)
![Figure 9: Structures de quelques métabolites secondaires isolés à partir de Pénicillium radicum [130-132]](https://thumb-eu.123doks.com/thumbv2/123doknet/2193128.11695/60.892.234.744.522.1031/figure-structures-metabolites-secondaires-isoles-partir-penicillium-radicum.webp)
![Figure 10: Structures de quelques métabolites secondaires de l’espèce Aspergillus flavus [133-135]](https://thumb-eu.123doks.com/thumbv2/123doknet/2193128.11695/61.892.122.721.270.914/figure-structures-metabolites-secondaires-l-espece-aspergillus-flavus.webp)
![Figure 11: Structure de quelques métabolites secondaires isolés à partir d’Aspergillus fumigatus [136-140]](https://thumb-eu.123doks.com/thumbv2/123doknet/2193128.11695/62.892.189.800.244.724/figure-structure-metabolites-secondaires-isoles-partir-aspergillus-fumigatus.webp)




