Par
Jean-François BEZIAU
DE L I L L E FLANDRES ARTOIS t
l
MEMOI
RE
Présenti, en vue d'obtenir le - - 7 - -
' 1>
DIPLOIiiIE
SUPERlEUR
DE
RECHER
CHE
Dissociation catalytique du méthanol appliquée au démarrage à froid des
J'adresse mes remerciements à Monsieur le Professeur J.M. LEROY, Directeur du Laboratoire de Chimie Analytique et Physico-chimie des Solides de 1'Ecole Nationale Supérieure de Chimie de LILLE, pour l'honneur qu'il me fait en jugeant ce travail.
J'exprime ma gratitude à Monsieur H. BAUSSART, Maître de Conférences
à l'Université des Sciences et Techniques de LILLE, pour l'aide constante qu'il m'a apportée et les conseils qu'il m'a prodigués.
Je remercie la Direction de PSA/ER et particulièrement
Monsieur B. LEHEUP, Chef d'unité Matériaux Organiques et Analyse du Département Assistance Technique Chimie-Métallurgie. Je voudrais lui exprimer ma reconnais-
sance pour m'avoir permis d'entreprendre ces travaux dans son laboratoire et I pour le soutien et la confiance qu'il m'a toujours témoignés.
1
Mes remerciements vont également à Monsieur M. LEBRAS, Ingénieur de Recherche et à Monsieur L. LECLERC, Maître de Conférencesà llE.N.S.C.L., pour avoir consenti à faire partie du Jury.
Enfin, je tiens à témoigner mes vifs remerciements à tous mes collègues de travail, ingénieurs, techniciens et personnel des ateliers et des laboratoires des Centres dtEtudes PEUGEOT-CITROEN, dont j'ai apprécié le soutien sympathique et spontané octroyé amicalement en maintes circonstances.
i
S O M M A I R E
rn
II
-
ETUDE BIBLIOGRAPKIQUE11.1
-
-de thermodynamique 711.2
-
Lee catalyseurs tmployds 1 O11.2.1
-
Catalyseurs du type oxydes métalliques11.2.2
-
Catalyseurs métalliquesIII
-
SYNTHESE DES CATALYSEURS111.1
-
CmactBrieation de8 supportsiII.1.1
-
Etude s t r u c t u r a l e111.1.2
-
Etude t e r f u r a l e111.2
-
Imprdgnatian des supporta 35111.2.1
-
Imprdgnatian prdalable des a p p o r t s 35 '111.2.1.1
-
Imprégnatian prdalable avec l e solvant 35111.2.1.2
-
h i p r d g n a t i m prdalable avec une s o l u t i o n acidel
ni t r i q u e
39
111.2.1.3
-
Imprégnatian préalable avec une eolution acidechlorhydrique 42
l
111.2.2
-
Imprégnation avec une s o l u t i o n chlorhydrique de palladium 46III,2.2,1
-
ïnîluence de l a concentration en palladium 4 6l
III.2.2.2
-
Iniluence de l a concentration des i o n s1
111.2.3
-
Imprégnation ~ v e c \me solution nitrique d e païladi\mi 57111.2.4
-
Imprégnation d'un eupport Aï O OeO23' 2 58
111.3
-
U c a l i s a t i a n du palladium, 111.4
-
ConclusionIV
-
DISSOCIATION CATALTTIQUE DU ldETBAlOOL 62IV.1
-
D i s p o s i t i f expérimental de d i s e o c i a t i o a du méthanol6
3
iV.l.1
-
I;e réacteur e t eon envFronnementIV.1.2
-
APalyeeeIV.2
-
Etude de l a réactionIV.2.1
-
Dissociation en phaae hamogbneIV.2.2
-
Performances catalytique8 des wipportsIV.2.2.1
-
Cinétique de désactivation 78IV.2.2.2
-
Etude des performances de l'alumine 1100 8 3IV.2.2.3
-
Conclusian 86fVe2m3
-
Performance8 catalytique8 des catalyeeure palladium a p p o r t é 87IV.2.3.1
-
Unetique de déeactivatianIVm2.3.2
-
Influence de l a teneur en p a l l a d l mIV.2.3.3
-
Innuence de l a températuree t
de l a r i t e e s e Impatiale 9 3 ,
IVm2.3,4
-
Znnuence du c é r i mV
-
APPLICATION DE LA DISSOCIATIONDU
METHANOL AU DEXME&IGE A FROIDD'mJ
YEHICITLE:99
V.1
-
Les paramhtres de fonctionnement 1 0 0V.1.1
-
Domaine d'innammabilité du gaz de dissociation 1 0 0V.1 .2
-
Enthalpie de combustion des carburantsV . 1 . 3
-
Calcul du &acteur catalytique "v6hiculenV. 1 . 3 . 1
-
DimensionnementV . l . 3 . 2
-
Puissance de chauffe n6cessaireV . 2
-
Description et essai du réacteur de catalyse destin6 au véhicule 1 0 8V.2.1
-
Description du réacteurV . 2 . 2
-
Mesures catalytiquesV . 3
-
Essai de démarrageA
froid d'un véhicule alimenté en gaz de dissociation 1 1 5V.3.1
-
Adaptation du montage sur v é h i d eV . 3 . 2
-
Essais de démarrage h la température de+
5O CV . 3 . 3
-
Essais de démarrage en chambre fioide(-
1 5 et-
20° C) .V.4
-
Conclusionl
VI
-
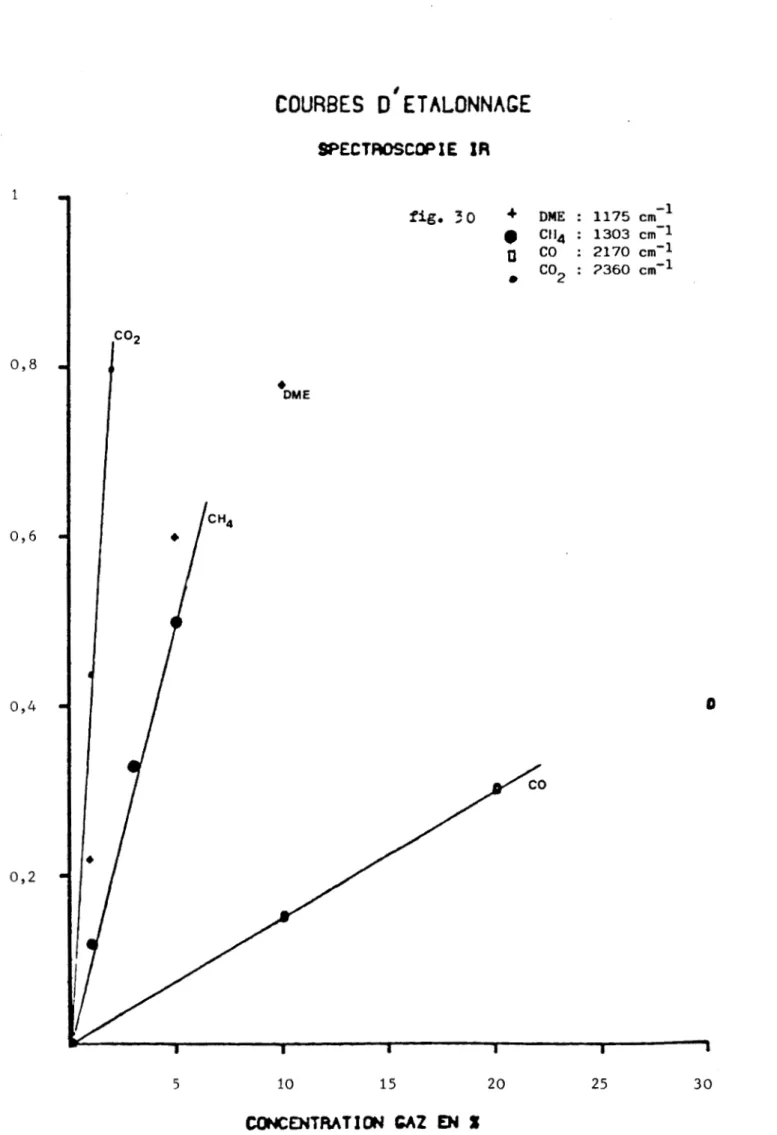
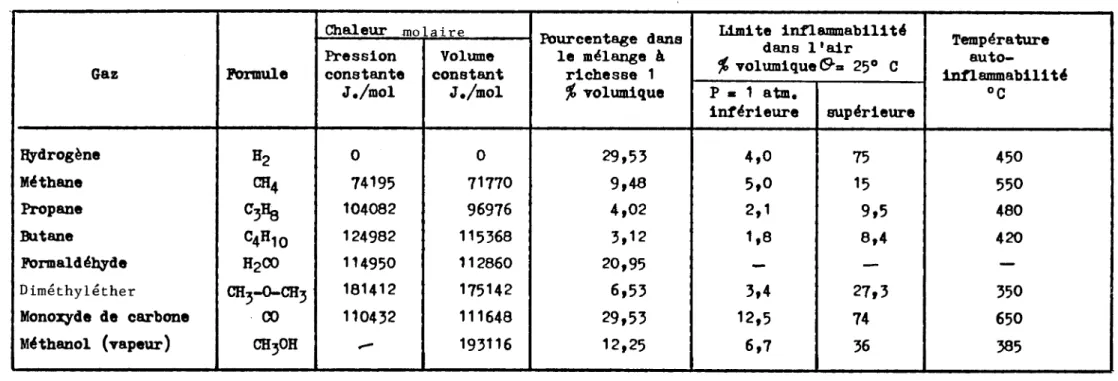
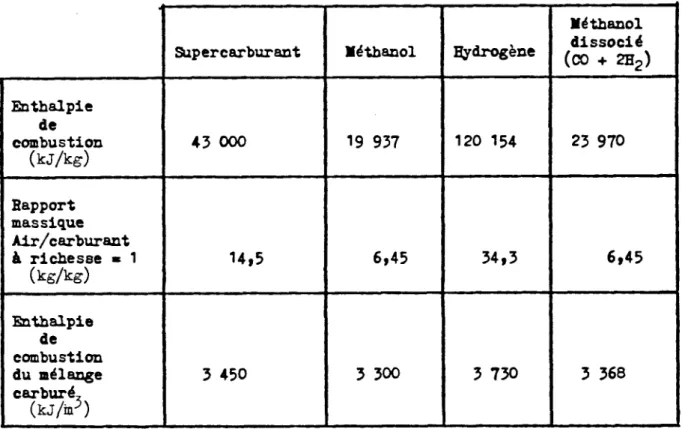
COBnUSIOBAbrhviationa mentionnées dans l e t e x t e : Taux de transformation g l o b a l Taux de t r a n s f onnation p a r t i e l V i t e s s e s p a t i a l e Diméthylé t h e r Volume poreux t o t a l I n f r a rouge
PERKIN
ELNEFIChromatographie en phase gazeuse
Chromatographie ionique h a u t e p e r f o m a n c e Ether méthyl t e r t i o - b u t y l i q u e
Acétate de t e r t i o - b u t y l i n d i c e d 9 o c t z n e "recherchen i n d i c e d'octane "moteur"
Depuis le début du siecle une mgmentatian c o n t h e de la consanmation des carburants se manifeste.
Ia
part des carburants dans l'ensemble des produits pétroliers évolue toutefois nettement. Alore qu'en 1973 l a part des carburants auto et du gasoil était descendue en dessou8 de 20 $9 elle est devenue de 38,7$
en 1985 et atteiadra 42 ou 47$
selon les prévisionnietesen
1990 (table= 1)(1).1
Ia rigidité de coneaeamation de ce eecteur elexplique par la prise en compte de nombreux facteurs eocio~conomiques et technologiques t (2)
-
La difficulté de changement de comportement envers les divers moyene de.
transport.
-
L'importance du eecteur de l'automobile pour l l d c m o m i e fkançaiee.-
La
limite des progres dans la diminution de la consommation apdcifique des moteurs.Actuellement aucune substitution notablepar d'autres sources d'énergie n'est
venue concurrencer le règne absolu des produits pétroliers (98,5
$
des carburants utilisés en 1985 provenaient du pétrole).Le
pétrole est une ressource énergétique limitée non renauvenable et coûteuse pour les pays importateurs.En
cas de crise g a v e dlapprwisionnement, ces pays seraient contraints dlutiliser des carburants de substitution.En
France,un
programme d'étude et d'expérimentation a été lancé eur les carburantede substitution, coordonné par le YUnietbrt de l'industrie, les Pétroliers et les
1
I Constructeurs Automobiles
(3).
Il a pour objectif essentiel de d-uerla deperdana,I 4nergétique du paye vis h vis du pétrole dans le secteur des transports. l
l
ïe Teme Qmpoefum international mm les carburants elcooli~ée tenu & Paris en Octobre 1986, a conclu aur un doute puant
A
llintérQt 6conaaique & court terme de ces produits.Mais h moyen ou long terme, une v i s e bergetique impliquerait la pr4psration'
l
de carburants tres distincts des essences claeeiques arec un rCseau de distribution1 sp4cial et des véhicules adaptds,
Le
méthanol eerait alors le produit de eubstitution le plue approprié en raison de ses aaractérietiques intrinsèques et de ses disponibilités potentiellee.
Le
seul obstacle technologique véritable & ean utilisation provient d'uneenthalpie de vaporisation élevée ( 1 1 0 0
XJ&
de méthanol contre 289KJ&
pour l'essence). Cette énergie calorifique est priseQ
l'air d'admission d'oùabaissement de la température et r i q u e de condensation du méthanol et de givrage du carburateur ou de8 collecteurs dladmiesion. Ainsi, sens moyen de préchauffage annexe, un moteur fonctionnant au méthanol ne peut pas dénarrer des températures inférieures
B
IO0 C (fige l),Pour permettre le démarrage du moteur, Il tet nécessalra
s
-
eoit d'apporter de l'énergieQ
l'air d'admission-
eoit d'utiliser un carburant classique pendant la phase de démarrage-
soit d'utiliser un mélange de méthanol et d'additifs volatils (par exemple Cthers),-
eoit enfin, de transformer par voie catalytique, le méthanol en un mélange combustible et explosif avec l'air. Il y a trois méthodes pour fransforner le méthanols
1) dissociation du méthanol meul2) dissociation en présence d'eau
3)
combustion partielle '% dépit des inconvénients que sont une température de rdaction élevée et une poeeibilité de production de coke, c'est la premihre méthode que nous avons choisie et qui fait l'objet de l'étude du présent mémoire,
h b l e m 1 8 ODneounatlon du w a h 6 lnthlur h ~ a i r e t p u t d e i b r n ~ ~ o r t r 6 . r u l m bilan pdtroUor
? r q r l r (Sour- CPDP
-
DCSIP) (1) A: Croieeance economique l e n t eB: C r o i e a m c e ecmomique s o u t m ~ e l #ml. C Rrt der trmasportr
(fl
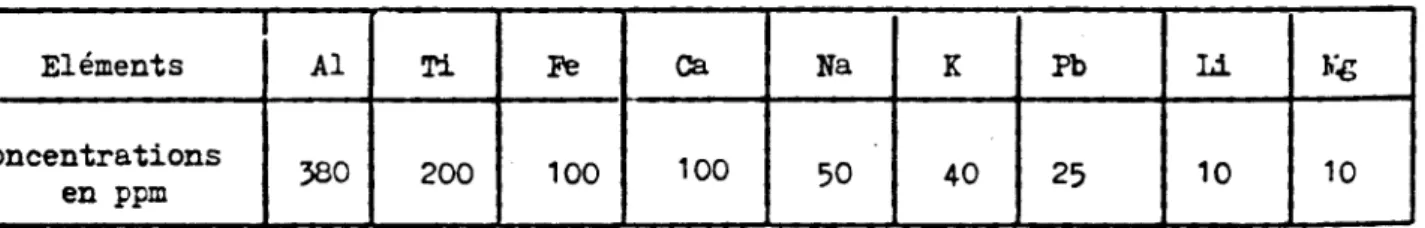
nombre 8 1 ~ q u i l i b r e ( r i p e u r ~ e t u r r ~ t e ) nomSre moles Aï3FIC 1 t
.b
moles CB30H en f o n c t i o n de l a t e a ? C r a t u n Nb moies AIX 1973 111 21.7 1978 105 n.2 1979 105.7 ??PB 1980 98.5 JO 1981me2
w.6 1982 8l.2 57.4 1983 79.7 %,5 19(W 76.6 40.8 l g m 7 4 ~ 7 42.2 1930 A 70.2 42 2000 B A 68.1 47.7 62.8 46.5 B 64,5 58.3*oh
t y p e r 6 c ~ d 8 ~ t h a ~be
d f ~ ~ o ~ i . t i mdu
~ d t b a n o l @ ~ l t4kd$&8ri
d i i uk
l i t t b r a h r e
rl
1 D'autres r é a c t i o n s sont p o s s i b l e s : eynthèse d'alcools eupérieure e t d'acides
Etude thermodynamique
La d i s s o c i a t i o n du m6thaaol en
m/H2
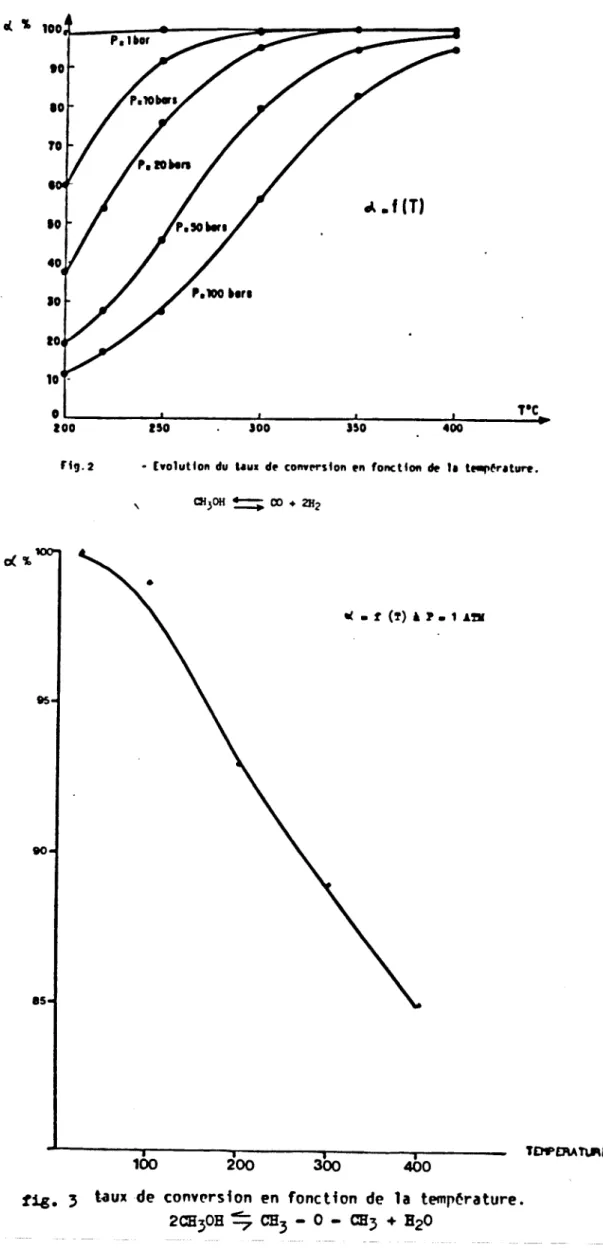
e s t une r é a c t i o n endothermique avec augmentation du nambre de molee. E l l e e s t donc favorisée p a r une température dlevde e t une basse pression (principe de Le CBA'PELLER), contrairement B l a plupart des a u t r e s r é a c t i o m citdes.Le tableau 2 rassemble l e s valeurs d e s constantes d'équilibre des d i f f é r e n t e s réactions. Ces constantes d'équilibre permettent de d d f i n i r l e s l o i s d ' h o - l u t i o n du taux de conversion
(()
en fonction d e l a tempdrature(T)
(a.
2e t
3 ) .
A l a tempdrature de 2û0° C e t B pression atmosphérique, l e taux de conversion en CO/% peut donc a t t e i n t i r e 100
$,
a l o r s que pour l a décomposition enO t I I I 1.C
200 290
.
300 390 400119.2
-
tvolutlon du taux de comrrslon en fonctlon k Ir CriipCrrtm.\ OI>'ni
-
,O0 + 2n2 d %- a5-
00- 1 1 85- 1 1~
l l l l 1 1 1 T D P m A h R t t e c j 100 200&
400 Ifig. g taux
de
conversion en fonctionde
la temperature. l2m3oB
7
CH3-
O-
CH3 + 820Les catalyseurs employés
Dans
la littérature, deux p a n d a types de catalyseurs sont citas t-
les catalyseurs du type oxydes métalliques-
les catalyseurs m6talliquesDans l'application au démarrage
A
fioid d'un vdhicule les auteurs recherchent des catalyseurs susceptibles r-
d'avoir une activité totale significativeA
basse température (si poesible B 200°c).
-
d'avoir une durée de vie la plus langue possible (holution de l'activitéen préeence des poisons Pb,
P,
s).
-
de ne pas tavoriser les dapbts de coke-
d'avoir une bonne rdsistance aux chocs thermiques-
d'etre sélectifs CO/
H2 c'estA
dire de privilégier la réactionCH3OH
-+
CO+
2H2.-
d'avoir un coût le plus faible possible. 11.2.1-
Catalyseur8 du type oxydes métalliquesIR
tableau3
rassemble les différents catalyseurs de ce type.k s catalyseurs
B.
base deQ~o/z&
avec ou sans Ai20g permettent la dissociation du méthanol avec un bon taux de conversion et une bonnesdlectivité en
CO/H~.
In8 o q d e s de terres rares sont trés sélectifs en
CO/B2
par contre U s n'ont pas d'activitd eigdficative h une tempdrature Inférieure h 250' CmLes autre8 systemes présentent un moindre intérêt de produits
Z 95 M 100 12 87 100 87 10 A 45 BCf. Blblio. 5 6 7 8 - 9 I O 11 11 15 14 15 16 17
-
18 e 1 4 i ~ ~ t i r i t d a 3 A 2 œAr b l l m C Z 9 3 8 4 93 98 94 64 TT C i t l l ~ e . u r i &lo-
a i 0 m0-
& 0 / u ,O 3 DOC ZoD-
Q ~ O / L ~ $ ~ prdirnce E20 -0-
0 9 3 C &O 1r.2 n i i o 6 -2 k D 6 b 2 fi Zao6 h o-
h o -02 *O2 I-='3 16203 a 2 0 3 5x3 mZo3 n ' 9 3 =O2 m o 2 / s 0 2 Zr0 %odu2'='3 *2“3 QiO L 000 mo - o o o / u p 3 -203 QiO-
Q 9 3 ? m p d r i w O C joo joo 550 rn joo 550 31 6 joo-
400 250-
310 4 20' 250 350-
4 0 3 400-
450 joo 500 250 400 250 400 no 400 no 200i
I 4 I I I j l I 3.70i
I 1 6601
(.*Pw) I 1 kitm. Wallt. 4 3 2 * a i 4 + p r t - s Z 43, + X 1 6 $ a i 4 + m 2 = 6 % 432 1.5 $ % + Q D z + M 2 ' 6 $ QL( + O 3 2 + & > O z 1 8 $ 432 Y 2 3 $ 4.8e
2 200. C a l d ~ h ~ d o f m r i ( u * produit. o q g b d e =2 + ,,,2 + + (- 1 * 1 S W O P ~ L ) 'IW h- 1 1 ,56 0,025 1.5 A 9.4 16 100 80 90 85 60 A 70 60 R 70 40 A 60 Z O A J O 100 0 1 8 O O 25 h 50 40 50 95 24 7 0 $ b m - 1 0 40 O 10 A 20 ald4hydm forripu*'a
E C4Wo-
C4Be '=%-
C A O32 IYE + H20 i 80 l m Z 1 0 0 $ ï U E + w Z 7 0 $ R r r i a t e 4. r d t h y l = 10 q + a 3 2 + D U E z 5 Ca, + c2% + cza6 ~ g * + m 2 % 4 0 b 50 ~ t + r m + m ~ DYE 3 1 0 0 acide acdtiqum11.2-2
-
Catalyseurs m é t a l l i q u e sLe8 métaux
( w ,
Pt, CU au a u t r e s elements d e t r a n s i t i o n e t des l a n t h a n i d e s ) eont d i s p e r s é s sur un inapport du type A 1 2 0 3 , Si02, &O, C e t z e o l i t h e s( a l m i n o - s i l i c a t e s de mdtaux d c a l i n s e t a l c a l i n o - t e r r e u x ) ,
L ' a c t i v i t é c a t a l y t i q u e e s t l i é e au choix du support d'où l ' b p o r t a n c e de l
c e l u i - c i (19
-
20). Une s é l e c t i v i t é (CO,H*) de l ' o r d r e de 100
$ p e u t e t r e a t t e i n t e avec un métal d i s p e r s é sur @O, ndanmoins l ' a c t i v i t é e s t r e l a t i v e m e n t f a i b l e e t l a tenue aux chocs thermiques l i m i t é e (6). De ce f a i t l e s s u p p o r t s l e s plusemployés eont l'alumine au l a s i l i c e .In Palladium
L ' a c t i v i t é e t l a s é l e c t i v i t é f o n c t i o n de l a n a t u r e du m p p o r t e t de l e teneur en palladium eont r a p p o r t é e s dans l e t a b l e a u 4.
L'addition des blements Li20 e t Ba20 dans l e s c a t a l y s e u r s palladium sur alumine augmente l a s é l e c t i v i t é C O / H ~ m a i s diminue l ' a c t i v i t é s u r t o u t a p r è s une é l é v a t i o n de t e ~ p é r a t u r e . L'addition de La203 ~ U Q U e n t e l a s é l e c t i v i t é CO/%, de p l u s c e t t e f o r a l e c a t a l y t i q u e p r é s e n t e l ' a v a n t a g e de bien s e coitporter après une é l é v a t i o n de t a p e r a t u r e .
PE3rORh'ANCES CATALYTIQUES
-
l 1 I 1 1 l l l l l l l l I I Supports f12°3 A1203 *2O3 + L i 2 0 7 % 203+
Ba20 9%
+ L8203 5%
C-
w
=O2$
Palladium massique O,5%
3%
35
3%
4%
0 , 2%
0 , 3P
0 , 3 4 l l S d l e c t i v i t e CO H2 86,2 88 9 1 IO0 9899 94,8 99,5 1 O0 98 99 T E Taux d e trans- f o r m a t i o n g l o b a l B WOO C uï $ 79,4 9897 6 5 57,8 9496 1,6 11,7 4297 16,
3 T EA
W0 C a p r è s d l e v a t i o n d e t m p 4 r a t u . e B 550' C 7394 9298 1,7 797 9296 1,2 2,5 14,5 19,3Le P l a t i n e
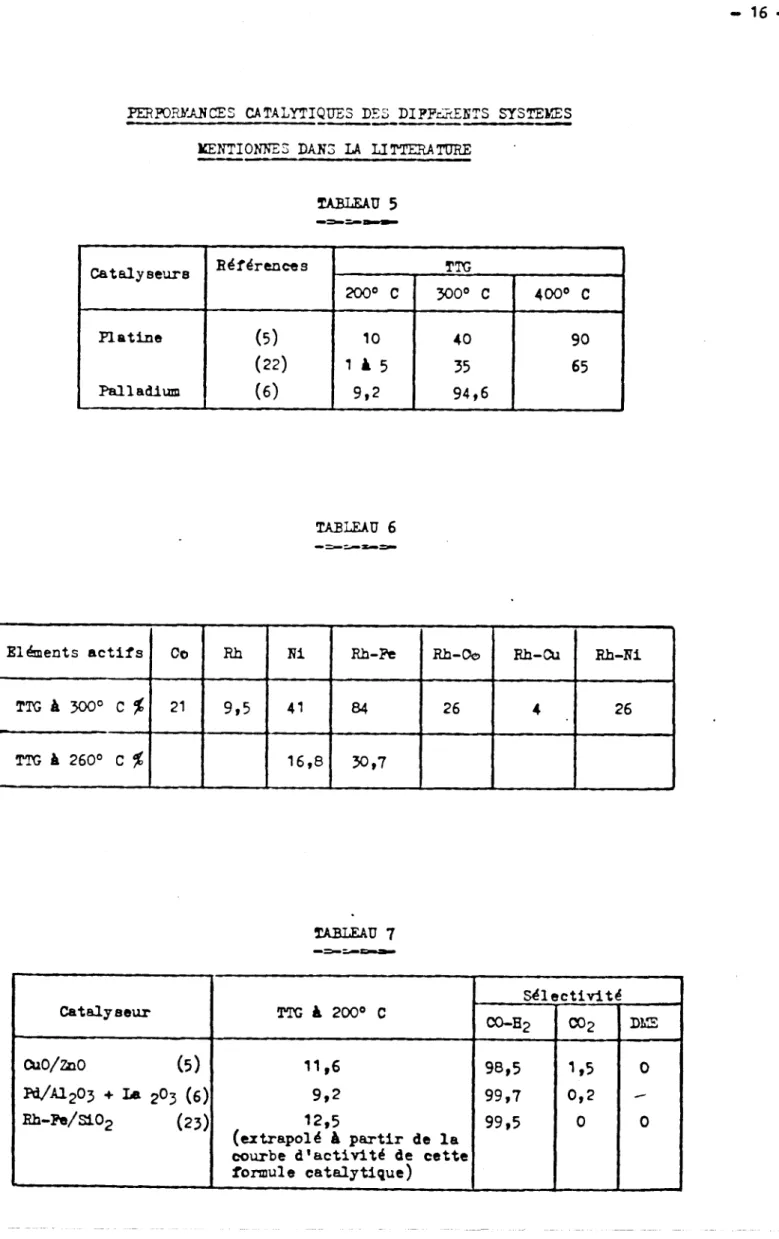
A taux de d i s s o c i a t i o n de méthanol i d e n t i q u e , l e p l a t i n e n e c e s s i t e une
temperature de travail beaucoup p l u s 6lev6e que l e palladium
(5
-
22). Cependant c e t t e d i f f é r e n c e s ' a t t é n u e pour l e s f a i b l e staux
de disso- c i a t i o n ( t a b l e a u 5).Le Cuivre
Sur support Mgû, l e cuivre p r é s e n t e une f a i b l e a c t i v i t é p a r c o n t r e il e s t extrêmement s d l e c t i f CO/H~.
Sur support A 1 2 0 3 , l e cuivre prdeente un peu moins d ' a c t i v i t é e t une f a i b l e s d l e c t i v i t d C O / H ~ p a r r a p p o r t au palladium (6).
Autres dléments du moupe VI11
numi l e s d l h e n t s a c t i f s pour d i s s o c i e r l e mdthanol, on c i t e :
Fe, Co, B i , Rh e t Ru.
Le Rhodium l o r s p u l i l e s t anploye s e u l e s t peu a c t i f p a r c o n t r e en a s s o c i a t i o n avec l e f e r , l l a c t i v i t é e s t p l u s Importante. Le Rhodium p r é s e n t e de p l u s une e x c e l l e n t e s é l e c t i v i t é (23).
Le Cobalt e t l e Nickel sont p l u s a c t i f s que l e Rhodium m a i s cependant l e u r a s s o c i a t i o n avec l e Rhodium ne f a v o r i s e pas l ' a c t i v i t é q u i r e s t e bien I n f é r i e u r e
B
c e l l e du R h-
Pe ( t a b l e a u 6).Le Ruthénium prdsente moins d l i n t d r ê t , il p r i v i l é g i e l a formation de méthane (24).
Parmi tous l e s catalyseurs rtcensds dans l a l i t t é r a t u r a , l e tableau 7
rassemble ceux q u i o n t l a plus grande activitt! & 200' C pour d i s s o c i e r l e mdthanol eoient r
1) CUO/Z~O avec ou sans oxydes de t e r r e s rares
2) Fd/h120j avec ou sans oxydes de t e r r e s rares
C'est plus particulièramerit l a formule no 2 c ' e s t & d i r e un catalyseur comportant un métal a c t i f ( ~ a l l a d i u m ) dispersé sur une alumine, avec ou sans présence d'un ou p l u s i e u r s oxydes de t e r r e s r a r e s que nous nous
TABLEAU 6 -->y.- Cataly seure PlatFne Pallahiun B6fdrences ( 5 ) (22) (6) Eldments a c t i f s T E
A
300'
C%
b Tn; B 260° C$
C Cateiy seur ~ U O / Z ~ O ( 5 w u 2 0 3 + La 203 (6) Bh-F8/SlO2 (23) 1. i-
TTC Rh9,5
Co 21 20O0 C 1 O 7 1 5 992 Tn; A 2 m 0c
11 ,6 9 , 2 1295 (extrapoleA
p a r t i r d e l a courbe dvactivit6 d e c e t t e formule c e t e l y t i q u e ) Ri 4 1 1698 300° C 40 35 9496 40O0 C 90 6 5 i S é l e c t i v i t é Rh-Fe 04 30p7 Rh-@ 2 6 Rh-Cu 4 D E O-
0 CeH2 98,5 99 97 99,5 , Rh-Ai 26 Co2 195 0 , 2 0Dans la littérature les protocoles de aynth&se des catalyseurs Ri/A1203 sont notre connaissance peu explicites. Parni les nombreuses possibilités dléla- ,boration de catalyseurs la succession d'opérations u n i t d z e e choisie est la
suivante :
-
imprégnation-
séchage-
calcination-
réductionChacune des opdrations unitaires peut faire l'objet d'une étude spécifique, nous avons limité notre étude
A
celle de llimpr~gnation (influence du support, Fnfluence de la phase liquide..,).
Les autres opérations unitaires sont eff'ectu4es selon un seul protocole :
-
Séchage dans une étuve ventilée sous airA
130° C pendant 12 heures.-
Calcination dans un four à moufle pendant 2 heuresA
6ûû0 C,-
Réduction sous courant d'hydrogène avec un débit de 50m/h
250° Cdirectement dan8 le réacteur de catalyse pendant 2 heures.
III. 1
-
Caractérisation des supports---
III.l,l-
Etude structuraleLa diffraction X est utilisée pour la détermination des phases cristallines.
Les spectres sont enregistrés par la méthode DEBYE-SCEfERRER
avec un diffractamktre SIEMEKS 33s 200 équipé d'une anti-cathode et un filtre nickel.
Le spectre de diffraction X donne les valeurs de 1 'angle (8) pour
chaque pic de diffraction. IR8 distances interreticulaires (d)
correspondantes sont ddterraindes B l'aide dee tables de diffraction X e
La structure de l'alumine est ensuite confirmee en comparant ces valeurs B celles rdpertorides dans le flchier AsTb",.
La figure 4 montxe le spectre de llalum.lne CRISTAL d e structure type 4 (origine IILCOA)
.
La figure
5
donne les spectres des supports F 1 0 , P200, EC6014,Fi821 et CPA137. Ce sont des alumines de structure
y.
(PI 00, F200, CPA137 r origine IILCOA)
-
.-
- -?j+. 4
-
Spectre de d i f i r i e t l m X dtunr dumjne.(
;..-
-- -
- - - - . - ------
-
--
-
(rCr. ~ S U ) I - i . -.
-. ' 1 . " '-
h i - - . - - - .---L - +.-t;
-.. ----
--- . ------
--
-
--.-_- I I ; ! , I . - . . .-
--- l ; !..;-
4-
! - ..---
;'. ,- .- 1 , . . . . . i :-
-
. . .5
- - -
1
----.--- --.- - - --- I ( , . ' . - l . - - 1 -;.'.
. - - - - . ---
- .-
--- . . 1 - -----
-..-
---
- . - -- -.--.--
--+-.---II
. - . ----
-
111.1.2
-
Etude t e x t u r a l eD é t e m i n a t i o n dee e u r i a c e s e p e c i f i q u e s
-
La methode B.E.T. (BR~UER-IBXET-TELLER) (25) e s t u t i l i s é e pour determiner l a m r f a c e s p é c i f i q u e des mapports d'alumine,
IB
mesure de l a eurface s p 4 c i f i q u e e s t r e a l i e e e de l a m d r es u i v a n t e :
L ' é c h a n t i l l o n adsorbe de l ' a z o t e l a température de l ' a z o t e liquide. Lorsque l a n a c e l l e contenant l l é c h a n t i l l o n e s t r e t i r e e de l ' a z o t e l i q u i d e , l ' a z o t e q u i a &té adsorbC physiquement
désorbe.
Cette methode e s t u t i l i s 4 e d a n s un domaine de preeeion c o r r e s - pondant
A
une couche moncnnol~culaire d ' a z o t e ( p r e s s i o n r e l a t i v eP / ~comprise e n t r e 0,05 e t 0,35) ; l ' a d s o r p t i o n v a r i e
linéairement avec l a p r e s s i o n e t e s t p r o p o r t i o n n e l l e
A
l a m f a c e .Le volune adsorbe e s t d6te1.miné
A
p a r t i r de l a fonmile BETm i v a n t e t
Po : p r e s s i o n
A
s a t u r a t i o nV M : volume adsorbe correspond a a t
A
une couche moncmol~culairec
r c o n s a t e dependant de l ' é n e r g i e d ' a d s o r p t i a n"a :volume de gaz adsorbé à la pression P
A part* de c e t t e equation, on t r a c e l a d r o i t e
Y
= m X+
b1
On détermine ainsi : Vm =
-
m + bConnaissant la section des molecules adsorbées dene les conditiaas d1exp4rience, on en deduit la surface.
Lee diffhentes valeurs dee surfaces epecifiques sont rapportées dans le tableau 8.
&termination de la distribution poreuse
L'exploitation des isothermes d'adsorption et de desorption de la technique BET, permet d'obtenir le volume poreux des a l a e s .
Cette méthode (mise au point par B/IRHETT, JOYNER et HALENDA en 1952,
n'est valable que pour les échantillons ayant une porosité comprise entre
5
et 3001.
(fig. 6 ) .Cette méthode de calcul (méthode BJB) repose sur l'hypothèse qu'A saturation, le volume poreux des billes d'alumine est totalement rempli par l'azote liquide.
A titre d'exemple la figure
7
présente les isothermee d'adsorption-
désorption pour les aliimines CRISTAL etP100.
La figure 8 présente les isothermes d'adsorption-dbsorption de l'alumine F200 ; les résultats étant exploités pour obtenir sa distribution poreuse.U
poroeimdtrie mtrcurt donne 1. d i s t r i b u t i m poreure d e s b i l l c e d l a l u m h e de l a m b e r a n i k r t que l a t e c h n l p u t W H , mais e l l e c m n etane garime d t d b e n s i a n d e p o r e r ksuccrup pl- Ctendue d ' i t r t r t part
e l l e n C c c ~ r i t e des ~ o t h b r e r e t d e r d h e l o p p m e n t r de calcula
iroiiu, camp lue^ que l ' d ~ o r p t i c m d e i o l ~ d a r , r i a i r e l l e a r t IiLitCe U- l a d d t t d t i o n de. p e t i t . pore.
i
d e m ~ a n ) .Paur
l e s pore8 d a n t l e rayonm i t
r u p ç r i a u rA
37 A a t w u ' &7 0 p .
Dn u t i l i s e donc o t t t e technique qul mst basCe mur & pénétraticin dumercure d m l e s pores, = l e o o n s i r t e
A
p k n C k e r m a u f o r t e p r e s e l a n l e mercureguide
nnn m o u i l l a n t )A
l ' i n t 4 r i e u r d et
p o r o s i t e du molide, & rayan d e s p o r e r
m i t
.ri r e l i t i a n aveck
p r e ~ s l c m de mercure ~ p p l i q u C e r9r l e ~ o l i b e e t o c t t e n l a t i m
8rt
donaCe par 1i l o i d e ' I A S B ü I U ï ,P:
Pressioz du mercure ( ~ a )Cr
T e n s i o n s u p e r f i c i e l l e du mercure ( l / m )4
t a l e de c o n t a c t e n t r e l a paroi du p o r e e t l e mercure (deg)rt rayan du pore
(i)
e l a n l e type d ' a p p a r e i l u t i l l r C , li p m s s l o a aeuimaïe mrt d e 2 10 8
8
ou 4 10 Pa
,
O. qui l i m i t e l a d ~ t e ~ t l a a d e er y c a r s
maxvaleurs r e s p e t t l r a r 37
et
'181.
O c t t e technique e r t 8ppllpuCe p a u rt-r l e volume pareur d e n o m
d c b a t l l l ~ ~ ~ ~ ~ a c r o p o r e u x , &B e s s a l s mont .ttetctaaCa
A
l 1 d d e b'uap o r o s i m b t n
A
mermm OUUlD WBA. &i 9 , 10m t
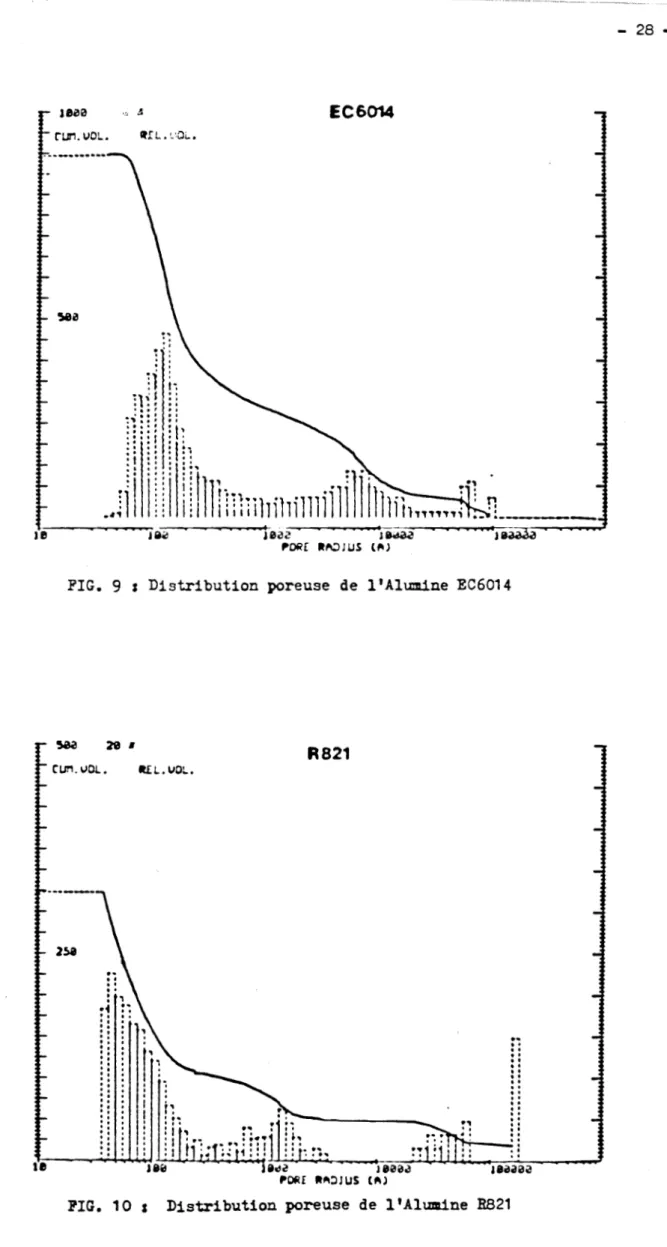
11 n p d -. e n t e n t l e r d i r t r i b u t i o n r , poreuser d e r &chantIll- ECdO14, Et821
e t C P A ~ J ~ . Les m p p o r t 8 lS06014 e t -A137 mt une u r c r o p o r o r i t h d u d n a r r t e ; le m p p o r t â821 Be c u a c t d r l . e pu l l r b s e n n de pore8
dont l e s r y a n ~ mmt W p r i r rntrr 4 000 a t X ) 000
1,
fr: b b l e a u 8 P e r ~ ~ e t de oaPiparrr le. d i a r ~ è t n t d e r porc# d e r d i f f d r e n t e r .luu&mr,
FIG. 9 t Distribution poreuse de l'Alumine 266014
PIC. 10 t Distribution poreuse d e l'Alumine R821
1 8 2 ~ ?e r CU?.UOi. SLL.UOL.
. .
. .
. ,.
..-
.
a s s,.
-
* I. .
a 0 .I.-
.,.
. >.
..
.
.
,
:,>-L
. . -., 10 J DL.' 12~32.' i ecz?: P O R I RP3 1 US t fi 1Détermination des d e n s i t d s e t du volume poreux t o t a l
A l ' a i d e de l a Pycnomdtrie, l e s f a c t e u r s l i é s au volume poreux d e s b i l l e s d'alumine s o n t determin6e.
LB détermination du volume poreux t o t a l e s t l i é e & l a mesure d e s d e n s i t é 8 de pains ((O&) e t s t r u c t u r a l e (Qe) d e s b i l l e s d'alumine.
Le volume poreux t o t a l V P T e s t ainsi dom4 p a r l a r e l a t i o n
La d e n s i t e s t r u c t u r a l e e s t ddterminée s e l o n l e p r o t o c o l e maivant :
-
i n t r o d u c t i o n d e s b i l l e s d'alumine dans l e p y c n m è t r e-
mise sous v i d e-
a j o u t de toluène ( d e m i t 6 d)La d e n s i t e s t r u c t u r a l e d e s b i l l e s d'alumine e e t c a l c u l é e
A
p a r t i r d e s d i f f é r e n t e s pesées (pycncanktre v i d e (ml), pycnomètre+
alumine(m2), py mamètre
+
alumine+
t o l u è n e (m3), p y c n m è t r e+
toluène (m4).q s
e s t ainsi déterminée s e l o n l a folPnile :m2
-
mlx d
(m4
-
m l )-
(m3-
m2)La d e n s i t é de g r a i n e p e u t e t r e s o i t ddtermlnée en plongeant l e s b i l l e s
,
dans un l i q u i d e non m o u i l l a n t c a m e l e mercure, e o i t estimée endéterminant l a d e n s i t é de lit t a s s é (Yt) e t en a p p l i q u a n t l a r e l a t i o n l p r a t i q u e s u i v a n t e t
1
Les d i f f é r e n t e s grandeurs s o n t r a p p o r t é e s dans l e t a b l e a u 8.
Détermination de la morphologie des billes d'alumine
Les échantillons eont observés en microecopie électronique & balayage B l'aide d'un microscope
JEOL
JSM35
d'une résolution de50
1.
Lesobservations sont effectuées
A
l'aide des électrons secondaires (faible énergie) ayant une énergie comprise entre O 50 eV, eur les échantillons massifs (billes d'alumine après métallisation l'or).Les 8upports sont observés et comparés entre eux avec des grossissements de 4 800 et 10 000 pour observer leur morphologie respective.
Les figures 12 et
13
montrent que les supports Pl00 et B821 présentent une granulométrie assez grossière (malgré une microporosité dominante)contrairement aux supports EC6014 et CPA137 qui présentent une granulométrie fine et homogène.
ALCOA
RHONE P( EC
111.2
-
Imprdgnation des supports111.2.1
-
In?,~.rk,qnation prkalable des eupportsPour réaliser une Imprégnation diffusionnelle, la porosité du départ doit etre préalablement remplie du solvant
d 'imprdgnation,
üne imprégnation prealable des billes d1al&e avec de l'eau distillée, de l'acide nitrique et de l'acide chlorhydrique est donc effectuée.
111.2.1.1
-
Imyrdgnationqr4alable - -. avec le eolvant---
D'après la loi de YD-LAPLACE (1) qui exprime la différence de pression
A P
entre 2 phases eépardes par une interface courbe (bulle d'air emprisonnée & l'intérieur d'un pore) et la loi de POISEUILLE (2) qui exprime le débit Qdensun
tube capillaire, on peut en déduire
(3)
le temps t que met la eolutim ( ~ ~ 0 ) pour parcourir la distancef-
d a n s uncapillaire (porositd des billes d 'alumine).
avec P r pression B l'intérieur de la bulle d'air (Pa)
Pl
r pressionB
l'extérieur de la bulle d'air (Fa)r) r riscosité dynamique
(B.
A)
h
r tension euperflciellr ( ~ / m )L
t longueur du capillcdre ( O )r
rayon des pore8 (m)Plue le rayon des pores est petit et plus le temps d'imprd- w t i a n est long. A b ~ i pour Imprégner casplbtement avec de l'eau les aimninee PlOO et BC6014 dont l e s rayon8 d e s pores les plus petits sont respectivement 10 et 40
1,
le tempeminimum néceseaire selon l a foxnniie
(3)
serait de 221 secondes pour llalimiine PlOO et 55 secondee pour ltaltnnine BC6014 (calcul.ur la baae de biilee de 2 man de diamètre av@c
Y)
et aelon letableau
9).
Dans le c m le p l u d&favorable, 1 1 h p r 8 g n a t i o n prhalable des billes d'alumine devrait etre terminee apree quelques ninutes.
En rdalite ce temps est beaucoup plue long et demende plusieurs
heuree. !kmp&rature O C 18 20 2 5
% effet el l'on considhre' le degr6 d'imprégnation
4
c a m e Ctantle rapport m/zf des maeses d'eau adsorbées par la porosite respec-
tivement B l'-tant t et tf, la relatian
(3)
montre que :L
C=e&
o
=
-
arec L etLf
longueur de pénétrationBf Zi
de H20 & l'intdrieur de 1. porositd ~ i e c o e i t é dynamique
k) en Pa.8
1
,OS
IO-'1,005
loo3
0,893 1oo3
respectivement auir Fnstaats t et tf.
Tension superficielle
r(
en ~ / m73.05 1 C T 3
7 2 ~ 7 5 1oo3
71,95
1o03
Ia +e 14 montre que la pente de cette droite depemi du
type de porosiîé de l'alumine (microporeuse au macroporeuee) et
qu'il existe
un
changement de pente attribué & la cinétique de disaolutian de l'air occlus etB
la dif'fu~ian vers l'ut&rieur de l'air dissous (26).-
De oe f d t , t o u t e s l e a imprdgpatioss préalablee mont affectu4ee
roua r i d e . Octte technique permet d'imprdgner l e s b i l l e e
d'alumine en quelques -tee en i l h h ~ ~ ~ t 1'- conterru dana l e s pores,
D'autre p a r t pendant lfl.uipr6gnation p r k a l a b l e a r e c H20, l e pH
d e 1s ~ o l u t i o n a u p e n t e
(m.
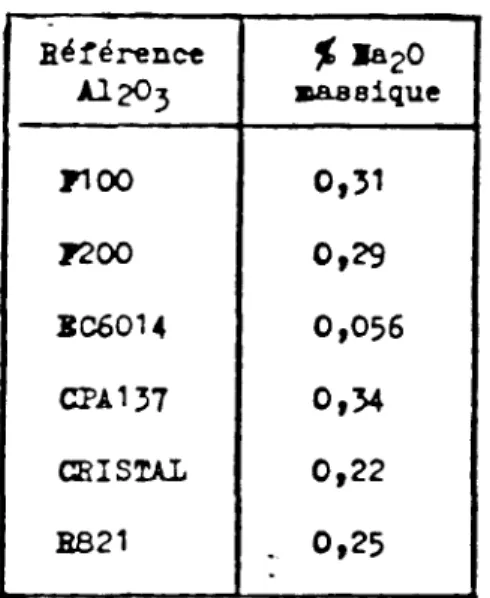
15). O t t t e 8ugmentation de pH e s t due & l'-de de ~ o d i u m prdeent d a n s l e s b i l l e s d ' a l m l n e( h b l e a u 10).
Tableau 10 :
$
massique d'oxyde de sodium dans l e s b i l l e s d'alumbe. Desage e f f e c t u h p a r spectroscopie d ' a b s o r p t i o natonique (32)
Lors de l'ircprégn a t i o n avec l e c h l o n r r e de palladium e t en présence d'oxyde de s o d i u c , il peut s e former l!hydrate d e palladium
q u i me treeefonne en =de l o r s du mechage puls d e l a calcl-
nation
.
Ott oxyde me c c a b i n tA
l'alumine pour former de8 du--tee de palladium, cauee de d d e a c t i ~ a t i u n d e s c a t a i y e e u r s en f a v o r i o a n t l e f r i t t a g e
(27
-
28-
2 9 ) .Br contre, l'oxyde de modium peut c o n t r i b u e r augmenter l a
m d l e c t i r i t C en modiYiant l e 8 p r o p r i é t é s acido-basiques
du aapport (30) raie î l 7 a une b a i s n e d e l l a c t i r i t é globale (6).
Pour l i m i t e r c e s inconvénients, nous avons donc chercher h
I(&
i.07 * 4
CINET
IPUE
D
'
1
WPREONATION
-
HE0
CIO0.@ g EC6OU
O w
a
1
111.2.1.2
-
I m p r e p a t i o n p r é a l a b l e avec une e o l u t i o n acide n i t r i q u e -------
---_
-
_
- - - -
--- LVlniprdgnation p r k a l a b l e avec de l ' a c i d e n i t r i q u e v i s eB dliminer l'oxyde de sodium sans a t t a q u e du support,
La f i g u r e 16 montre qu'une p a r t i e non ndgligeable du support e s t s o l u b i l i s é e pour d e s pH t r è s a c i d e s lorsque l a m o l a r i t é de l ' a c i d e n i t r i q u e e s t de 1 mole/litre.
Four lFmiter c e t t e a t t a q u e du support p a r l ' a c i d e tout en é l l n i n a n t l'oxyde de sodium, l e p r e t r a i t e m e n t a c i d e e s t donc e f f e c t u é avec de l ' a c i d e n i t r i q u e J- suiwst
l e mode o p e r a t o i r e suivant t 1 O
-
mise sous vide de l V d c h a n t i l l o n de b i l l e s d'alumine-
imprégnation avec de l ' a c i d e n i t r i q u e JJ- e t mise en c o n t a c t pendant 3 heures 10-
f i l t r a t i o n ~ u r v e r r e f r i t t é-
rinçage avec de l ' e a u d i s t i l l é eDans c e s conditions moins de 2
%
du support e s t s o l u b i l i s é ,LB
f i g u r e 17 permet de comparer l e s deux modalitbs d'impré- g n a t i o n c e l l e avec l ' e a u d i s t i l l é e élimine une p a r t i e eeulement de l l o q d e de sodium e t c ' e s t seulement a p r è s l'lmprbgnation a c i d e n i t r i q u e q u ' i l ne r e s t e pratiquement p l u s dloryde de sod.ium dans l e s supports.111.2.1.3
-
Lrnqré@ation e r e a l a b l e avec une s o l u t i o n d'acide c h l o r h @ r e e-
---_---
-- --- ---_----
--
L'action d'une e o l u t i o n d ' a c i d e chlorhydrique e s t d é c r i t edans l a l i t t é r a t u r e (33).
1. 1 6 / I \ Cette étude e s t f a i t e afin de comprendre e t de d t r i s e r
l ' i n t e r a c t i o n d e s i o n s c h l o r u r e s avec l'alumine, c a r ce phénomène i n t e m i e n t p a r l a s u i t e , l o r s de l'imprégnation d e s b i l l e s d'alumine avec l a s o l u t i o n acide de chlorure de palladium,
Ltimpr6gnation par l ' a c i d e chlorhydrique
A
d i f f é r e n t e s Ino-malités (0,1 I N ) e s t e f f e c t u é e de l a maniere
l
maivante 1
-
mise sous vide des é c h a n t i l l o n s-
impregnation avec l ' a c i d e chlorhydrique-
temps de contact 3 h e u r e s-
f i l t r a t i o n sur v e r r e f r i t t éLes i o n s c h l o r u r e s sont dosés avant e t après immersion des b i l l e s d'alumine par chromatographie d'échange d ' i o n s B
l ' a i d e d'un a p p a r e i l DIOREX 20001 sur une colonne BPIC, La
d é t e c t i o n s ' e f f e c t u e par conductirnétrie.
Le t a b l e a u 11 montre que l e s q u a n t i t d s d ' i o n s chlorures retenils sur l'alumine dépendent du type d1al\rmine ; il
semble que l ' a d s o r p t i o n d e s i o n s c h l o r u r e s s o i t fonction de l a s u r f a c e epécifique du support
(m.
18). La l i t t e r a t u r e donne un result-t analogue pour d e s a r g i l e s (34).D'autre p a r t , en milieu a c i d e f o r t , l e support d'alumine e s t attaqué. L'aluminium p r é s e n t dans l e s s o l u t i o n s d'acide
ciilorhydrique e s t dosé a p r & s 3 heures d ' h n e r s i o n des b i l l e s i
dans c e l l e s - c i . Pour l i m i t e r l e p l u s c e t t e a t t a q u e , il e s t n é c e s s a i r e d l a v o i r u n pH
>
1. Dans c e s conditions seulement~
f i g . 18 CORRELAT I O N C ~ / S U R F A C E S F S E C I F IGUE
CL- APS= 0 D 0 4 2 2 9 S U R F A C E , 0 . 1 1 6
111.2.2
-
Imprégnation avec une s o l u t i o n chlorhydrique de palladiumLes parametres pouvant i n f l u e n c e r l'imprégnation des b i l l e s avec l e palladium peuvent 8 t r e des paramètres l i é s au m p p o r t proprement d i t c t e s t d i r e l a s t r u c t u r e , l e volume poreux, l a
eurface s p é c i f i q u e , l a t a i l l e d e s grains
...
ou bien d e s paramktres concernant l a s o l u t i o n d'imprdgzation t e l s que l e volume de s o l u t i o n , l a concentration en palladium, l e pH ou encore d ' a u t r e s param&tres c m e par exemple l e temps dtimpré- gnation.Une &tude des paramètres s u s c e p t i b l e s de modifier l e t r a n s f e r t du palladium v e r s l'alumine e s t r é a l i s é e sur l e support EC6014 :
concentration du palladium, i n f l u e n c e d e s i o n s c h l o r u r e s e t pH de l a solution.
L'influence du r a p p o r t (R) messe de palladium en e o l u t i o n sur
l a masse d'alumine e s t é t u d i é e sur l e s 2 s u p p o r t s EC6014 e t
Pl 00.
111.2.2.1
-
Influence de l a concentration e n q a l l a d i u m ---Le protocole e s t l e s u i v a n t :
-
mise sous vide d e s é c h a n t i l l o n s-
impregnation avec l ' a c i d e n i t r i q u e ~ / 1 0 pendant 3 heures-
f i l t r a t i o n e t r i n ç z g e avec de l ' e a u d i s t i l l é e-
imprégnation avec une ~ o l u t i o n de c h l o r u r e de palladium pendant 72 heures.-
f i l t r a t i o n e t rinçhge avec H20 d i s t i l l b e-
sbchage, calci2lhtion p u i s r e d u c t i o n eelon l e protocole d é f i n i .Le t a b l e a u 1 2 montre que pratiquement t o u t l e p l l a d i u n e s t adsorbé par l'alumine p a r c o n t r e l a c i n é t i q u e e s t d i f f é r e n t e s e l o n l a concentration en palladium ( f i g . 20).
4 M a e M œ CU C- m a C- Qi .- M C- m O
'c
N C", ln Or ln ln m O CU U> C- t C3
aa
a +,1
BP:4
3
"
El*
al na+:
E
l
k8
4-sa
d La d 0 - O d 4-5
%
dg-
-
E-5
I O d a U ln O I.- Xk n
$ T ~
O d-g
e 0 ) m.- m o o - O LX a 4 8 2a
4w
0, d M a.-
C- '0, Or Or Or C-L
a O '0, N CU ln m ln \O..
~n M a d .- c', a\ mz
m O'?
rn d O."
F r O-
d a V\ 0, e5
.- d0
Or m t- M Cc œ O UI M CD, OR
E
N a NE
Z
8
8
s g a B g ,
rn ~n c œ e .- œ .- ln P; a\ 0 m O5
N Or \O F N m M m C- .- ln CU e N œ*
N \OC",
a3 a\ e M C- œ O 0, M % O .- œ .- .- a V\Ia
solution de concentratian1904
ppm de palladiun(PH
=
1) est donc choieie pour fabriquer lee catalyseurs.111.2.2.2
-
influence de la teneur en---
.----
I o n s-
chloruresL'acide chlorhydrique réagit avec l'alumine
(voir
111.2.1.2). Dans la littérature(35
-
36
-
37
)
l'adsorption du palladiumsur l'alumine est schématisée par leu équilibres wrivants t
+
2 cl-L'adsorption du palladium cl'accanpagne donc d'une libdratiun d'ions chlorures. Caamne pour tout équilibre la modification de la concentration d'un des cm~tituants déplace l'équilibre, nous avons cherché rdrifier l'innuence des ions chlonrres
sur
le rendement d'imprégnatim en ajoutant des quantitee croissantes de chlorure de eodium daas la eolutian d'impré- epatian.U
tableau 13montre
qu'eSfectivement le rendement dWiFppré- gnation diminue lorsque la concentration dtione chlorures augmente. Lors dela fabrication des catalpseure, la solutian dtimpr4gnation ne doit donc pas contenir d'ians chloruresen
ucbe.ZR
protocole utilise est le mirent r-
prétraitement acide nitrique de 2 cléries d'échantillon8 d9al\nnine (111.2.1.2).-
bprbgnation avec la solution de chlorure de palladium (1904PP).
-
variation du pH initial par addition soit d'acide nitrique pour la lbre série, soit d'acide chlorhydrique pour la 2eme série,-
temps de contact 72 heures I-
filtration, séchage, calcination et réduction selon le protocole d é j à defini....
/..Ot l ttt
ïes t a b l e a u x 14 e t 15 montrent l ' h f l u e n c e d e s paramktres PH e t c o n c e n t r a t i o n en c h l o r u r e sur l e taux dlimprégnation.
ï e s c a t a l y s e u r s s e r o n t donc f a b r i q u e s en Imprégnant avec des s o l u t i o n s pas t r o p a c i d e s (PH) 1 ) avec de f a i b l e 8 concentrations d ' i o n s c h l o r u r e s
((5
10-?nol/l).M l u e n c e du r a p p o r t R = masse Id en s o l u t i o n / ~ a s s e A l 2 1 O
-
Protocole expérimental t
-
mise sous vide des Cchantillons EC6014 e t FI00-
p r e t r a i t e m e n tA
l ' a c i d e n i t r i q u e s e l o n l e p r o t o c o l e déf'ini en 111.2.1.2.-
f i l t r a t i o n e t r i n ç a g e avec de l ' e a u d i s t i l l é e-
i m p r k p a t i o n avec d e s voluses c r o i s s a n t s contenant 1904 ppm deW B pHi = 1 ou 1,s pendant 72 heures.
-
f i l t r a t i o n e t r i n ç a g e avec H20 d i s t i l l é e-
sechage c a l c i n a t i o n e t r é d u c t i o n suivant p r o t o c o l e d é f i n i .11 f a u t remarquer que pendant l l i m p r e g n a t i o n , l e pH d e s s o l u t i o n s d'imprégnation évolue de l a v a l e u r i n i t i a l e v e r s une asymptote
( f i g . 21 e t 22).
Le t a b l e a u 16 montre que l a presque t o t a l i t e du palladium en s o l u t i o n e s t adsorbépar l t a l u s i n e pour l e s f a i b l e s v a l e u r s de B (9'100 $)a
Le type d'alumine e t l e pH de l a a o l u t i o n i n f l u e n t également e u r
9
( f i g e 23, 24).ïes p r é c u r s e u r s 0,5 e t 1,5
5
de palladium sur l e s s u p p o r t s EC6014 e t Pl00 s o n t f a b r i q u e s s e l o n ce protocole.Pour déposer
3
$
de palladium, lllmprdgnation eoue ride l'aide du rotavapeur est effectuée selon le mode opératoire suivant :-
protocole ci-dessus pour fabriquer les précurseur8 fusqu18 la saturation de l'échange.-
filtration sur verre fiittd-
traitement du precurseur dans un rotovapeur en présence d'une eolution de chlorure de palladium 1904 ppm. Les conditions opératoires sont les suivantes 1 ?O0 C, vide, évaporationA
eec.-
séchage, calcination et réduction eelon le protocole défini.i 3 ' l ? J E K C E Dü PEi DES SOLüTIORS DII~I,F-iEGHATIOB
-
SUFl LE TAUX D11h3flEGRhTION (AJOUT BRO?)
L- Masee A1203 EC6014 (g> 5,0055 . = -5,0046 C 4,9980 C 4,9930 4,9978
-
Masse A1203 EC601 ( g ).
5,0046 4,9970 5,0068 5,0038 5,001 6 p u 1 ,8 Volume iolutionb31
30 30 30 30 30 -PHI
4 12 195 W/Al203($1
O,= 096 0,35 O9
($1
99 9 6 91 93n , ~
22 99 6 18 Ib
(fl
100 3 0 9 8 op4,,
1 ,5 1 ~ 1 0,a
Om3 0 9 0 8 - 6 35 604 567 570 549(PPZ)
1 v 8 56 96 144 488 590(
a-
>
(X I O 5 ~ 0 1 ~ m l 5 9 6 O,? I S , ~ 49 ,O 8 2,
3(9
O 379 0,347 O ,293 0,087 O ,026 0923 O ,065 O ,060 6095 17,1 1597 J.
1 1e 4 fi0 fit
.
fir.
LI fia 4TABLEAU 1 6
--=-=-=-=
INFLüENCE DU RAPPORT (R = MASSE DE PALLADIUM DANS LA
---
SOLUTION D'IMPREGNATION/MASSE AL O ) SUR LE
---2 3---
TAUX D'IMPREGNATION
( 3
) DES ALUMINES---
---
i
PH1
Rapport R1
Alumine1
Alumine1
1
initial1
961
EC60141
F l O O1
111.2.3
-
--
Imprégnation avec une s o l u t i o n n i t r i q u e de p a l l a d i u nLes b i l l e s d'alumine s o n t p r é t r a i t é e s avec l ' a c i d e n i t r i q u e p u i s r i n c é e s avec l ' e a u d i s t i l l é e s e l o n l e protocole d é f i n i en 111.2.1. = l e s s o n t e n s u i t e mieesen contact avec une s o l u t i o n n i t r i q u e ( ~ / 1 0 )
de n i t r a t e de palladium.
Ia concentration en e e l de palladium de l a s o l u t i o n d'imprégnation r e s t e constante.
Le pH de l a s o l u t i o n augmentant progressivement, il y a a p p a r i t i o n brusque d 'un p r é c i p i t e brun rouge 7/ 3 ) avec d i s p a r i t i o n complète
du palladium en eolution.
En e f f e t l e n i t r a t e de palladium n ' e s t s t a b l e qu'en s o l u t i o n a c i d e ,
il p r é c i p i t e sous forme d'hydroxyde de palladium pour d e s pH s u p é r i e u r s
A
3. 11 n ' e s t donc pas p o s s i b l e de m a î t r i s e r l'imprégnation d e s b i l l e sd
'
alumine (annexe 5).
B u . c e t t e r a i s o n , l e s b i l l e s d'alumine s o n t imprégnées B eec s e l o n l e protocole suivant :
-
p r é t r a i t e m e n t a c i d e n i t r i q u e-
f i l t r a t i o n sur v e r r e f r i t t é p u i s r i n ç a g e B l ' e a u distillée-
séchage dans une étuve pendant 1 2 heures-
mise sous vide d e s b i l l e s d'alumine-
imprégnation B l ' a i d e d e l a s o l u t i o n ~ / 1 0 de n i t r a t e de palladium#d i f f é r e n t e s concentrations. i
IR
volume d'imprégnation correspondantau volume de r é t e n t i o n d e s b i l l e s d'alumine.
-
séchage dans une étuve sous air pendant 12 heures-
c a l c i n a t i o n p u i s réduction eelon p r o t o c o l e d e f i a i .Dans c e s conditions 3 c a t a l y s e u r s s o n t f a b r i q u e s contenant 0,5, 1,5 e t 3
$
de p a l l a d i 4 A l 2 O 3 .111.2.4
-
U p r d f l a t i o n d'un support A 1 2 0 j / ~ e 0 2C e 0 2 e s t une r e s e r v e dtoxgg&ne (38). Il empeche celui-ci de s e f i x e r BUT l e palladium. Il peut donc e x e r c e r un e f f e t
promoteur sur l a r é d u c t i o n du palladium m e t a l l i q u e e t de c e f a i t f a v o r i s e r l a d i s s o c i a t i o n s é l e c t i v e du methano1 en
l hydrogène.
Le n i t r a t e de c6riu.m e n s o l u t i o n dans l ' e a u d e s i o n i s é e e s t u t i l i s e de manière Q o b t e n i r un c a t a l y s e u r contenant 1,65
$
en masse de cérium sur lla.lunine FI00 microporeuse.Le c6rium e s t déposé sur l'alumine par évaporation sous v i d e dans l e rotavapeur a 70° C.
Le précurseur obtenu e s t e n s u i t e séché 8i 130° C pendant 12 heures p u i s c a l c i n é
A
600° C pendant 2 heures.Ltimpr6gnation des b i l l e s ~ 1 ~ 0 5 / ~ e 0 ~ e s t f a i t e s o i t avec l e s s o l u t i o n s de chlorure d e pàlladium en 8 0 l u t i o n chlorhydrique
( l e pH évoluant des v a l e u r s 1,7
A
4 , 8 en 72 h ) , s o i t avec l e s s o l u t i o n s n i t r i q u e de n i t r a t e de palladium s e l o n l e s mêmesp r o t o c o l e s d é f i n i s l o r s de l l i m p r i g n a t i o n d e s b i l l e s d'alumines seulea.
111.3
-
Localisation du palladiumSuite B la réduction, quelques billes de catalyseur eont observées selon le protocole suivant
r
-
prélèvement de quelques billes de catalyseur-
imprégnationA
l'aide d'une résine et attente de polymérisation de celle-ci.-
p o 1. i s s a g e d e 1 ' c n y e m b 1.e dc, manière il obtenir une coupe régulière des billes de catalyseur.-
observationA
l'aide d'un macroscope QILD M400A
des grossissements de l'ordre de 25.Les figures 25 et 26 représentent les photographies de principales fonrmles catalytiques testées dans la suite de notre Btude et montrent que quelque soit l'alumine, la concentration de palladium, la présence ou non de cérim, le palladiuc dépose
A
partir de nitrate de palladium se localise en couronne alors qu'il semble réparti d'une manière hoxcogène lorsqu'il est dépose a partir de chlorure de palladium.111.4
-
ConclusionLt6tude de l'imprégnation des supports d'alumine
A
l'aide de différents sels de palladium a mis en évidence deux catégories de phénomènes qui utilisent les propriétés chimiques du support.La premiere est ltutilisation des propriétés acides de l'alumine qui donne lieu des &changes ioniques. Le dép8t de palladium paraît homogène dans les billes d'alumine.
La seconde est l'utilisation des propriétés basiques de l'alumine qui donne lieu
A
des précipitations.IR
dép8t de palladium s'effectue en couronne.Ces résultats confirment ceux obtenus dans la litterature
(39). En
effet, en ce qui concerne l'échange cationique, W B O S proclame ce type d'inter- action. QuantA
l'imprégnationA
l'aide d'une solution de nitrate depalladium, cet auteur observe
un
dépbt en couronne et montre que ce dépbt Ik 6(j&
CATALYSEURS AU Pd SUPPORTE SUR ALUMINE MICROPOREUSE F 100
.-
0.5 % Pd ( A PARTIR DE CHI-ORURE) 0.5 % Pd (A PARTIR DE NITRATE)
3 % Pd (A PARTIR DE CHLORURE) 1.5 % Pd/A1203 F 1 0 0 + Cerium 1,65 % (A PARTIR DE CIILORUHF:) 3 % Pd (A PARTIR DE CHLORURE) 1.5% Pd/A1203F 100 i Cerium 1 , 6 5 % (A PARTTR DE NITRATE)
CATALYSEURS 1.5 % Pd/A1203 MACROPOREUSE (EC 6014)
ET MICROPOREUSE ( F 100)
F tOO (CHLORURE DE Pd) F 100 (NITRATE DE Pd)