I i
/3 3 7 7
THESEPRESENTEE
A L'ECOLE DES GRADUES DE L'UNIVERSITE LAVAL
POUR L'OBTENTION
DU GRADE DE MAITRE ES SCIENCES (M.SC.)
PAR
LUCIE BEAULIEU
BACHELIERE ES SCIENCES (B.SC.) DE L'UNIVERSITE LAVAL
MISE AU POINT D'UNE TECHNIQUE ENZYMATIQUE POUR DOSER LES IGE SERIQUES SPECIFIQUES
AVANT-PROPOS
Je désire remercier très sincèrement mon directeur de thèse, le docteur Jacques Hébert, pour son appui tout au long de mes travaux de recherche. Ses conseils judicieux et ses encouragements furent très appréciés.
Je tiens aussi à remercier tout le personnel de l'unité de recherche en Immunologie et Rhumatologie du CHUL pour leur aide inestimable ainsi que Mme Suzanne Bélanger pour la dactylographie soignée du présent texte.
RESUME
Parmi les nombreux radioimmunoessais utilisés pour mesurer des IgE spécifiques, le RAST demeure le plus fréquemment employé en clinique. Sa disponibilité commerciale permet la reproductibilité des valeurs à mesurer. Cette technique est simple et elle est l'outil clinique pour diagnostiquer un sujet allergique.
Le RAST révèle, au moyen d'un antisérum anti-IgE marqué radioactivement, les IgE spécifiques qui ont, au préalable, réagi avec les antigènes fixés à une matrice solide. Dans ce système, la présence d'IgG spécifiques peut fausser la mesure des IgE spécifiques parce qu'ils peuvent aussi réagir avec les antigènes fixés. Cette interférence IgG est problématique puisqu'elle nuit à l'étude de la régulation de la synthèse des IgE et l'effet de
1 'immunothérapie sur celle-ci.
Le présent travail fait état d'une étude comparative des résultats obtenus avec le REAST et le RAST , un immunoessai commercialement disponible, chez des sujets allergiques et des volontaires normaux.
Le REAST et le RAST détectent de façon significative plus d ' IgE spécifiques au phléole chez les sujets allergiques (3,04 + 3,94; 21,65 + 14,50) que chez
ceux non-allergiques (0,20 + 0,17; 1,48 + 1,68). Une corrélation significative est calculée entre le REAST et le RAST standard ( r = 0,61 ; p<0,001 ). La spécificité de la mesure des IgE est démontrée en chauffant les sérums avant de procéder au dosage. Ceci a pour effet de diminuer de 85% la valeur de la densité optique. La spécificité antigénique de la mesure des IgE spécifiques est démontrée par compétition entre l'antigène marqué et un antigène libre (non-marqué ) spécifique ou non-spécifique. Seul l'antigène libre spécifique inhibe la fixation du complexe antigène-peroxidase où l'on observe une diminution de la densité optique de plus de 97%. En remplaçant l'anti-IgE polyclonal par un anti-IgE monoclonal, la sensibilité du REAST est accrue.
TABLE DES MATIERES
PAGE
AVANT-PROPOS ... i
RESUME... ii
TABLE DES MATIERES... iv
LISTE DES FIGURES... vi
LISTE DES TABLEAUX... ix
CHAPITRE I . INTRODUCTION... 1
1.1 PHYSIOPATHOLOGIE DE L'ALLERGIE ... 3
1.2 IMPORTANCE DU DOSAGE DES IGE DANS LA MALADIE ALLERGIQUE ... 5
1.3 TECHNIQUES DE DOSAGE DES IGE SERIQUES SPECIFIQUES . 5 1.4 TECHNIQUE DU RAST... 6
1.5 SOLUTION APPORTEE ... 9
CHAPITRE II. DEVELOPMENT OF A REVERSE ENZYMOALLERGOSOR-BENT TEST (REAST) TO DETECT TIMOTHY SPECIFIC IGE ANTIBODIES: COMPARISON WITH RAST. ... 11
2.1 INTRODUCTION... 14
2.2 MATERIEL ET METHODES... 16
2.3 RESULTATS...
22
2.4 DISCUSSION... 25
2.5 REFERENCES... 36
CHAPITRE III. MESURE DES IGE SPECIFIQUES AU PHLEOLE AU MOYEN DU REAST UTILISANT UN ANTI-IGE MONOCLONAL... 41 3.1 INTRODUCTION... 42 3.2 MATERIEL ET METHODES... 42 3.3 RESULTATS... 45 3.4 DISCUSSION... 49 CONCLUSION GENERALE... 64 BIBLIOGRAPHIE... 66
LISTE DES FIGURES
PAGE
CHAPITRE 1
FIGURE 1 Représentation des événements responsables
de la réaction allergique ... 10
CHAPITRE II
FIGURE 2 Reference curve : A serum with high IgE antibody levels by RAST was used to
construct the reference curve... 28 FIGURE 3 Correlation between the two techniques :REAST
and Pharmacia RAST... 29 FIGURE 4 Correlation between REAST and Pharmacia
RAST... 30
FIGURE 5 Competition studies with specific and non
specific antigen... 31 FIGURE 6 IgG interference: Determination of sp IgE
levels by Pharmacia RAST (left) and REAST
(right) on serum from atopic patients. ... 32
CHAPITRE III
FIGURE 7 Illustration des 3 techniques utilisées pour le dosage des IgE spécifiques. A. RAST
B.ELISA standard C.REAST... 52 FIGURE 8 Courbe dose-réponse d'un sérum avec un
REAST au phléole très positif... 53 FIGURE 9 Spécificité antigénique du REAST au phléole
montrée par des études de compétition de 4 allergènes différents avec le complexe
phléole-peroxidase sur un sérum ayant un
REAST au phléole très positif... 54 FIGURE 10 Corrélation RAST-REAST au moyen de la
régression linéaire... 55 FIGURE 11 Corrélation RAST-REAST... 56
LISTE DES TABLEAUX
PAGE
CHAPITRE II
TABLEAU I Specific IgE levels by REAST and RAST. 33 TABLEAU II Correlation between RAST and REAST. . 34 TABLEAU III Correlation between clinical symptom
scores and specific IgE levels. ... 33
CHAPITRE III
TABLEAU IV Effet du chauffage sur la mesure des IgE
spécifiques par la technique du REAST. 37 TABLEAU V Reproductibilité de la mesure. Coeffi
cients de variation intra-essais et in
ter-essais ... 58 TABLEAU VI Dosage des IgE spécifiques par REAST et
par RAST chez des patients allergiques
et normaux... 59 TABLEAU VII Corrélation entre les mesures d1 IgE
spécifiques par REAST et RAST et la sévé rité de l'atteinte clinique ... 60 TABLEAU VIII Comparaison entre REAST et ELISA standard
pour le dosage des IgE spécifiques au phléole...61 TABLEAU IX Comparaison entre REAST et EL ISA standard
pour le dosage des IgE spécifiques à la phospholipase... 62 TABLEAU X Comparaison de l'anti-IgE polyclonal et
INTRODUCTION
L'hypersensibilité immédiate ou 1 'allergie est la conséquence directe de l'interaction entre un allergène tel pollens, épidermes d'animaux ou poussières et des anticorps particuliers appelés les immunoglobulines E (IgE). En effet, les IgE, une fois produits se fixent à la surface des mastocytes qui sont localisés au niveau des différentes muqueuses. L'interaction antigène-anticorps à la surface des mastocytes entraîne la libération d'une foule de médiateurs responsables des symptômes cliniques d'allergie. Ces symptômes se manifestent au niveau nasal par des éternuements, de 1'obstruction nasale, du prurit et de la rhinorrhée. Ils s'accompagnent souvent de manifestations oculaires ou pulmonaires.
Les allergies touchent 15 à 20 % de la population nord-américaine. Elles ont par conséquent un impact substantiel sur 1 ' individu et la société par l'importance de 1'absentéisme qui en résulte à l'école ou au travail (Young , 1980 ) .
Ce travail vise à la mise au point d'une nouvelle méthode pour le dosage des anticorps spécifiques de type IgE, ce qui est nécessaire pour le diagnostic d'une condition allergique de même que pour le suivi des patients.
1.1 PHYSIOPATHOLOGIE DE L'ALLERGIE.
Lorsqu'un antigène est introduit dans 1 ' organisme, il entraîne une réponse immune qui dans le cas de l'allergène, est la production d'anticorps de type IgE. Une fois produits, les IgE ont la propriété de se lier d'une façon spécifique aux récepteurs membranaires des mastocytes qui tapissent les différentes muqueuses respiratoires ou digestives ou de leur contre-partie circulante, les basophiles. Lorsqu'il y a réexposition à cet allergène, celui-ci se lie avec les IgE à la surface des mastocytes. Alors un nombre d ' événements biochimiques se succèdent à la membrane cellulaire et à 1 ' intérieur de la cellule pour aboutir à la libération de médiateurs (histamine, leukotriènes, prostaglandines, etc ...) qui sont directement responsables des symptômes allergiques. La réponse allergique tient donc à la synthèse des IgE d'une part et à la libération des différents médiateurs d'autre part. (Fig.1)
Les anticorps de type IgE, tout comme les autres immunoglobulines, sont produits par les lymphocytes B. Comme également toute réponse humorale, la production des IgE est régularisée par des sous-populations de lymphocytes T. En effet, il a été démontré au cours des années 1960 que la présence de sous-populations de lymphocytes T était
essentielle à la production optimale d'anticorps. Ces lymphocytes T ont été par la suite identifiés comme étant des lymphocytes amplificateurs ou "helpers". Plus tard, il est apparu évident que d'autres sous-populations de lymphocytes T contribuaient à diminuer la réponse humorale: les lymphocytes suppresseurs (Peters,1983). Actuellement, ces sous-populations sont mieux connues phénotypiquement grâce à la disponibilité des anticorps monoclonaux qui permettent de les identifier et de les étudier fonctionnellement. De plus en plus d'évidences suggèrent actuellement chez les patients atopiques, un déficit du système régulateur servant à maintenir la synthèse des IgE à un niveau minimum.Nous avons déjà rapporté une diminution de l'activité suppressive non spécifique médiée par les lymphocytes T chez les patients allergiques, lequel déficit a d'ailleurs été confirmé par la suite (Hébert,1980). Récemment, le groupe du Dr Rocklin de Boston a de montré l'existence d'un déficit spécifique de la fonction suppressive médiée par les T suppresseurs chez les patients allergiques à l'herbe à poux; de plus ce déficit semble se corriger à la suite d'un traitement spécifique de la condition allergique (Rocklin,1983).
En plus du contrôle de la synthèse par les sous-populations de lymphocytes T, d'autres modes de régulation pourraient aussi jouer un rôle encore mal défini. Quant aux médiateurs, l'histamine joue définitivement un rôle majeur dans la phase
évidences suggèrent qu'ils participent davantage aux événements tardifs de la symptomatologie allergique
(Bach,1983).
1.2 IMPORTANCE DU DOSAGE DES IGE DANS LA MALADIE ALLERGIQUE.
Les allergies sont donc médiées via les IgE spécifiques mais leur faible niveau sanguin par rapport aux autres immunoglobulines rend leur détection difficile. Cette limite a forcé la mise au point de techniques sensibles et spécifiques pour leur dosage.
1.3 TECHNIQUES DE DOSAGE DES IGE SERIQUES SPECIFIQUES.
Les premières épreuves de détection in vitro des IgE spécifiques proposées par Ishizaka (1967) et Coombs (1968) étaient complexes et ne permettaient qu'une mesure qualitative des IgE. Une méthode plus quantitative et sensible a été mise au point par Wide (1967) : le "radioallergosorbent test" (RAST) . Cette méthode s' est rapidement imposée sur le plan international comme la méthode de choix pour le dosage des IgE spécifiques en clinique. Les dosages ainsi obtenus corroborent la sévérité
clinique de la maladie ainsi que la sensibilité cutanée à l'allergène telle que mesurée par des tests cutanés.
1.4 TECHNIQUE DU RAST.
Le RAST comprend principalement une matrice solide sur laquelle un antigène spécifique a été fixé. Cette matrice est incubée avec le sérum à tester. Si des IgE spécifiques à 1 1 allergène sont présents dans le sérum, ils se fixeront sur l'allergène lié à la matrice et seront révélés à l'aide d'un antisérum anti-IgE marqué avec un isotope ou une enzyme.
Le dosage des IgE spécifiques par RAST a ouvert une nouvelle avenue à la recherche fondamentale sur 1'allergie.En effet, sa précision a permis une mesure quantitative des IgE spécifiques (Adkinson , 1980 ). Ceci a aussi rendu possible la détection d'une augmentation des IgE spécifiques pendant et à la suite d'une exposition saisonnière à un allergène (Lichtenstein, 1973 ) et de l'effet de la thérapie sur la production d ' IgE spécifiques. De plus , le RAST a été utilisé pour prédire 1 ' évolution immunologique de la maladie allergique dans des populations à haut risque (Frick, 1979). Finalement, le problème de standardisation des allergènes a été résolu grâce à cette
technique (Gleich 1974, Gleich 1976).
Plusieurs modifications techniques du HAST ont permis d 1 augmenter sa sensibilité et sa spécificité. Ainsi, Schellenberg (1975) et Gleich(1977 ) ont réussi à mesurer une quantité absolue d'IgE spécifiques.
Cependant Vervloet (1974) et Lynch (1975) soulignent un inconvénient majeur au RAST. Plusieurs facteurs sériques, en particulier les IgG spécifiques peuvent interférer avec le dosage des IgE par RAST. Comme les IgG spécifiques ont tendance a augmenter avec le traitement de désensibilisation, le RAST devient d'autant moins valable comme moyen de mesure itérative des IgE spécifiques en cours de traitement (Hamilton, 1982). Ainsi, une méthodologie différente s'imposait pour court-circuiter cette difficulté.
Il est alors apparu possible qu'en augmentant la quantité d'allergènes fixée sur la matrice l'effet bloquant des IgG serait minimum. C'est pourquoi certains ont utilisé une matrice fixant spontanément plus d ' allergènes tels les gels de Sépharose 2B ou 4B par rapport aux disques de cellulose commercialement disponibles. Cependant, ces immunoabsorbants sont difficiles d ' utilisation à cause de leur tendance à adhérer aux parois du tube.
Une autre façon de diminuer 1 1 interférence dans le dosage des IgE fut d'éliminer les IgG du sérum par absorption sur protéine A ou sur colonne anti-IgG. Cependant l'élimination des IgG sériques par chromatographie d'affinité est une étape laborieuse et coûteuse qui n'augmente pas le rendement du RAST. De plus, la protéine A peut réagir avec les IgE humaines et en éliminer une partie dans le sérum (Johansson, 1978). Les différentes modifications augmentent les temps de manipulation sans nécessairement résoudre complètement le problème de l'interférence. Des nouvelles techniques ont donc été mises au point pour parvenir à court-circuiter ce problème.
Une nouvelle technique de dosage des IgE spécifiques a été proposée par Zeiss (1973). C'est un radioimmunoessai qui utilise une matrice en phase solide, le polystyrène, qui lie successivement des IgE de myélomes et un antisérum anti-IgE. Cette matrice peut ensuite lier les IgE du sérum et les IgE spécifiques sont révélés par l'antigène marqué radioactivement. Cette technique nécessite des quantités importantes de myélomes humains IgE qui ne sont pas disponibles commercialement.
Cheung (1983) propose pour réduire l'interférence IgG de refaire la mesure en IgE spécifiques dans le surnageant recueilli du premier dosage. Pour un sérum, on double le temps de manipulation et parfois plus, si le sérum
est absorbé plus d'une fois. Ce procédé, de plus , amène une baisse de la sensibilité de la mesure des IgE.
1.5 SOLUTION APPORTEE.
Nous avons voulu simplifier le problème de l'interférence des anticorps bloquants dans le dosage des IgE spécifiques. Nous proposons le "reverse enzymo allergosorbent test" (REAST ) . C'est un essai enzymatique où la matrice solide est recouvert d'un anti-IgE humain. Les IgE du sérum peuvent se fixer à la matrice et les IgE spécifiques sont révélés au moyen de 1'allergène marqué à la peroxidase. La spécificité de la mesure des IgE spécifiques par le REAST a été évaluée et nous avons comparé le REAST au RAS T standard.
cFc?
Allergène (Antigène)i
Cellule immunocompétente °s§ Rencontre subséquente avec I antigène (Ag)1
Fixation de l'anticorps (Ac)
Réaction Ag-Ac
Libération des substances de l'allergie
FI G. 1
Représentation des événements responsables de la réaction allergique. La cellule B rencontre l'allergène et se transforme en plasmocyte qui sécrète l 1 IgE spécifique lequel peut se fixer au niveau du plasmocyte ou du basophile. L'allergène peut, dans un deuxième temps, interagir avec les IgE au niveau de la membrane et entraîner la libération des médiateurs de
DEVELOPMENT OF A REVERSE ENZYMOALLERGOSORBENT TEST (REAST) TO DETECT TIMOTHY SPECIFIC IGE ANTIBODIES: COMPARISON WITH
RAST
Texte intégral d'un manuscrit accepté à la Revue Oournal of Immunological Methods
Development of a reverse enzymoallergosorbent test (REAST ) to detect timothy specific IgE antibodies: comparison with RA5T .
Lucie Beaulieu, Beaudoin , B.Sc . , Lewis Perelmutter
B.Sc., Jean-Paul Valet, Ph.d., Jacqueline Andre Boulet, B.Sc., Marie Jobin, B.Sc., Ph.d.* and Jacques Hebert, M.D.
KEY WORDS: RAST - REAST - IgG interference
From the Unite de Recherche en Immunologie et Rhumatologie, Centre Hospitalier de 1'Université Laval, Quebec, Canada and *Health and Welfare Canada, Ottawa, Canada.
ABSTRACT
Radioallergosorbent test (RAST) for the measurement of IgE antibodies has been introduced more than 15 years ago and a number of technical modifications have since improved its sensitivity and reproducibility. The test has been applied to the diagnosis of allergy and to determine changes in the levels of IgE antibodies following immunotherapy. However, specific IgG antibodies are raised during such a therapy and can interfere with the RAST. We have developped a reverse enzymoallergosorbent test (REAST) where microtiter plates are first coated with a purified polyclonal anti-IgE antibody, then with the serum to test and finally with peroxydase-labelled antigen. This assay is antigen specific as shown by the significant inhibition of binding of the labelled antigen in presence of unlabelled specific antigen (> 95%) and the absence of inhibition in presence of irrelevant antigens. The values found in atopic patients (85 subjects) were significantly higher than in the non atopic donors (35 subjects) (1.14U+1.20 VS 0.OlUtO.02, p<0.0005) and there was a good correlation with the Pharmacia RAST (p<0.0005). The levels of specific IgE by both REAST and RAST correlated well with the clinical symptomatology.
INTRODUCTION
Since the introduction, 15 years ago, of the radioallergosorbent test (HAST ) for the in vitro measurement of IgE antibody (Wide, 1967 ), these tests have been found to correlate well with clinical symptomatology (Norman, 1973 ), in vitro leukocyte histamine release (Norman, 1973 ) and allergy skin tests (Ahlstedt, 1974 ; Ceska, 1972). Commercially available RAST kits use an antigen covalently bound to a solid phase matrix such as paper-disk (Ceska, 1972), Sephadex (Wide, 1967) or Sepharose beads (Adkinson, 1976 ) and others (Gleich, 1975 ; Schopfer, 1977). In recent years, technical modifications have increased the sensitivity and reproducibility of the assay. The test has been widely applied to the diagnosis of allergy (Gleich, 1978) and to determine changes in the levels of IgE antibody following immunotherapy (Lichtenstein, 1973 ; Evans, 1976 ; Yunganger, 197 3 ; Gleich, 1977 ). However, IgG antibodies against the allergen have been shown to raise luring ana after such a therapy. These IgG antibodies can inydrfere in solid phase system where the antigen matrix is relatively large in lowering the measurement of specific (sp.) IgE antibodies (Ab ) (Foucard, 1972 ; Aalberse, 1973 ; Vervloct, 1974; Lynch, 1975 ; Pauli, 197 8 ; Zeiss, 1981 ; Zimmerman, 19 80 ; Hamilton, 1982 ; Perelmutter, 1983 ). Several other techniques have been developped to reduce the IgG interference: (a) Saturation of solid sorbent with excess of
antigen to prevent IgG interference (Sobotka, 1978). (b) Depletion of interfering IgG have been tried by passage through Staphylococcus aureus protein A or anti-IgG columns. (c) Development of a solid phase radioimmunoassay that employed polystyrene tubes successively coated by myeloma IgE and anti-IgE (Zeiss, 1981 ; Zeiss, 1973). This matrix could bind IgE from human serum and specific IgE level is determined with a radiolabelled antigen. (d ) RAST elution technique (Schellenberg, 1975 ; Gleich, 1977). (e ) Development of modified microtiter solid phase radioimmunoassay where the IgG interference is believed to be decreased after serial supernatant transfers (Cheung, 1981; Reid, 1981 ; Nai Kong, 1983). These techniques which require material not commercially available (such as IgE myeloma ) , are expensive and time consuming. Furthermore, protein A could react with human IgE that could then be removed as well (Johansson, 1978).
We are reporting herein a solid phase, enzyme- linked immunosorbent assay where the microtiter plates are first coated with anti-human IgE antiserum. This matrix could bind human IgE, the levels of which are determined with an enzyme-labelled antigen. This work aims to evaluate the specificity of this reverse enzymo allergo sorbent test (REAST) and compare it to the standard RAST. It aims also to show the absence of IgG interference in the measurement of specific (sp) IgE by REAST.
MATERIAL AND METHODS
Subjects
This study includes non atopic normal volunteers and patients allergic to timothy with typical symptoms of allergic rhinitis in June and July and positive skin test to timothy antigen. Those were done by prick technique to mixed grasses and timothy (1:20 weight/volume, Omega, Montreal). The skin response is measured after 15 minutes : the sum of the longest diameter of wheal and its perpendicular one measured at one half of the longest diameter, divided by 2, represent the size of the skin reaction . The severity of the clinical condition was further evaluated for a subgroup of patients and for non atopic donors. Separate ratings were given for nasal congestion, itching and discharge, sneezing, ocular itching, conjunctival hyperhemia, eyelids swelling, cough or wheezing, chest discomfort and shortness of breath. Each symptom was scored as absent (0); mild, present but very tolerable (1); moderate, definitively present to patient and physician (2); severe, very marked causing extreme discomfort (3). Sums of the rating are reported. Serum was drawn from each subject for measurement of specific IgE. None of the patients had been on immunotherapy for the 5 previous years.
REA5T
Preparation of affinity chromatography purified anti- IgE.
Goat anti-human IgE antiserum (Atlantic Antibodies Inc, Scarborough, Maine ) was purified by passage through a affinity chromatography column prepared with myeloma IgE
(U.C.B., DES IgEk myeloma, Belgium) coupled to cyanogen bromide (CNB r ) Sepharose 4B (Pharmacia Fine Chemical, Piscateway N.3.) and eluted with 0.1 M glycine-HCl, pH 2.8. The anti-IgE antiserum purified was coupled to CNBr-Sepharose 4B and this immunosorbent column was used to purify human IgE from pooled sera of patients with hyper IgE syndrome (IgE>25,000 I.U./ml). After passage through an anti-IgE immunosorbent column, the human IgE was eluted and passed through anti-IgG, anti-IgM and anti-IgA immunosorbent columns to remove other contaminating immunoglobulins. A goat was immunized with an initial injection of 200 ug of this purified IgE preparation in Complete Freund Adjuvant intradermally followed 2 weeks later by injections with the same preparation intramuscularly (I.M.) and 3 weeks later by injection of 400 ug of the IgE preparation in incomplete Freund Adjuvant I.M.. Plasma was collected 10 days later. Goat anti-human IgE was purified by affinity chromatography on a purified IgE-Sepharose 4B immunosorbent. After elution, the anti-IgE was further purified by passage through
affinity chromatography columns made with myeloma IgG, IgM, IgA and with inactivated pooled normal sera (IgE exhausted ) coupled to CNBr Sepharose 4B. The concentration of the anti- IgE antiserum was 1.46 mg of antibody/ml.
Antigens
Purified timothy antigen (batch 19/25, kindly given by Dr H. Lowenstein), crude Ragweed antigens (40,000 PNU/ml, Omega Montreal), mixed tree antigens (40,000 PNU/ml, Omega Montreal), phospholipase A2 (P2509, Sigma) were used throughout this study. The timothy antigen was conjugated with horseradish peroxidase (HRP0) as previously described (Johansson, 1978). Briefly, 5 mg of HRP0 were incubated with fluorodinitrobenzene (1 hr, 22°C) before addition of 1 ml of 0.08 M NaI04 (30 min, 22°C) and 0.16 M ethylene glycol (lhr, 220 C) respectively. After dialysis, the treated HRP0 was added to 5 mg of timothy antigen for 3 hr (22°C) and 5 mg of NaBH^ were added
for 3 hr at 4°0 before dialysis.
REAST procedure
Microtiter plates (NUNC) were coated with optimal dilution (1:1000, after preliminary screening) of anti-IgE (0.146 ug/well) in phosphate buffered saline (PBS) pH 7.4
for 3 hr at 370C. Plates were then emptied and 200 ul of PBS with 2% bovine serum albumin (BSA ) were added to saturate the sites (2 hr, 37°C). Plates were then washed three times with PBS. Dilutions of the serum to be tested were then added in quadruplicates (100 ul/well ) and the plates incubated 18 hr at 22°C. The plates were then washed with PBS and peroxidase-labelled timothy antigen
(1:1000, 100 ul/well) was added and incubated for 1 hr at 37°C. After washes with PBS-Tween (0.1%), 100 ul of substrate (o-phenylenediamine 0.4 mg/ml 0.006% ^2^2 ^ in citrate buffer were added to the plates .
The reaction was allowed to proceed for 30 min at 37°C and stopped by the addition of 30 ul of H^SO^ 4N.
Absorbance was read at 492 nm with an automatic spectrophotometer (Titertek) . The results were expressed as units which represent the absorbance read at 492 nm X (1/dilution) of the serum used in the test.
Specificity of the assay
Antigen specificity of the assay was studied by measuring the effects of addition of unlabelled specific or unrelated antigen to the REAST procedure. Briefly, after the incubation with serum, 50 ul of uniabelled timothy antigen (2-2000 ug/ml), unrelated antigens (Ragweed, mixed trees, 200-20,000 PNU/ml), or PBS-BSA as control and 50 ul of labelled timothy antigen (1:500) were incubated together (1
hr, 37° C ) . The procedure was then carried out as described. The percentage of inhibition in presence of unlabelled antigen was determined. The isotypic specificity of the assay was assessed by measuring the sp IgE Ab levels by REAST before and after heat inactivation (36°, 1 hr).
RAST procedure
IgE antibodies to timothy antigen were measured by RAST using CNBr-activated cellulose filter paper discs, (Pharmacia) (Hamilton, 1982 ; Perelmutter , 1983 ). Briefly, 50 ul of patients serum were incubated with timothy-coated disc for 3hr at 22°C. Unbound immunoglobulins were washed off with PBS-Tween and the disc was further incubated with 5 ul of 12^1-radiolabelled anti- IgE at 22° C for 18 hr.
Unbound -*-25 I -anti- IgE was washed off before the residual radioactivity was counted in a LKB gamma counter for 1 minute. The results are stated as (counts bound/counts added) X 100.
Specific IgE Ab were also measured by enzymo assay using cellulose filter paper discs (Phadezym RAST Pharmacia). The procedure was carried as in RAST except that peroxydase labelled anti-IgE was used. After the reaction was stopped, the supernatant was transfered in microtiter plates and the absorbance read at 415 nm as described.
IgE interference
We used a human serum containing high titer of sp I g G antibody as determined by enzymo linked immuno sorbent assay (ELISA). Then, microtiter plates were coated with purified timothy allergen (3 hr, 37°) saturated with BSA
(2 hr, 37°) and allowed to react with the serum to test (18 hr, 22°). After washes, the peroxydase labelled anti-IgG was added (1 hr, 37°) and the assay carried as described for REAST. The serum was heat inactivated at 56°C for 4 h until no residual sp IgE could be measured (phadezym HAST : 0.007). This serum was diluted in PBS-BSA (dilutions^ 1:50, 1:100, 1:500 and 1 : 1000). The I g G content of each dilution (expressed in O.D.) was respectively 1.208, 0.869, 0.264 and 0.049. One volume of it was added to one volume of serum from atopic patients containing low and high level of sp IgE Ab (respectively 0.304 and 0.643). The sp IgE levels were measured by Phadezym RAST and REAST.
STATISTICAL ANALYSIS
Values obtained in allergic and non allergic subjects with the two techniques were compared with the non paired Student's t test. Correlations were made by Chi square analysis and linear regression analysis.
RESULTS
Measurement of IgE antibody to timothy by REAST
Serial dilutions of a high titer serum were used to construct a serum dilution curve (figure 2). Each point represents mean value ± SD for 7 determinations. A linear correlation is observed between O.D. and log serial dilutions between O.D. of 0.3 and 1.15. This serum was always run to calibrate the assay. To measure IgE anti-timothy antibody of an unknown serum, serial dilutions (1:2 - 1:20) were run; dilution that gave a O.D. falling in the linear range was used. The results are expressed in units which represent that O.D. X (1/serum dilution).
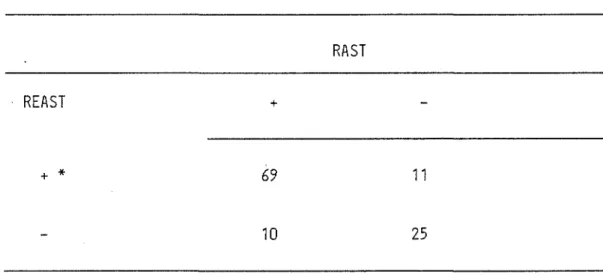
The REAS T detects significantly more timothy specific IgE in atopic patients (1.14U ± 1.20) than in non atopic donors (0.01U ± 0.02) (Table I). These results correlate those obtained by RAST. The correlation between the two techniques is shown in figure 3(P<0.005). The RAST and REAST were read as positive when the value obtained represented 3 S.D. over the mean of the group of non atopic donors i.e. RAST >4.25% and REAST >0.074U. With those criteria a significant correlation, as determined by the Chi square analysis, was observed between the two techniques
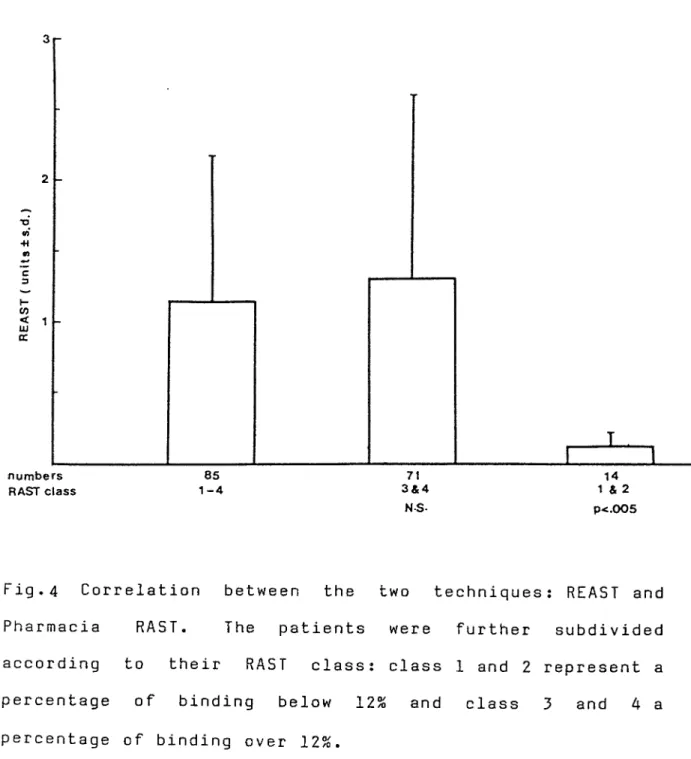
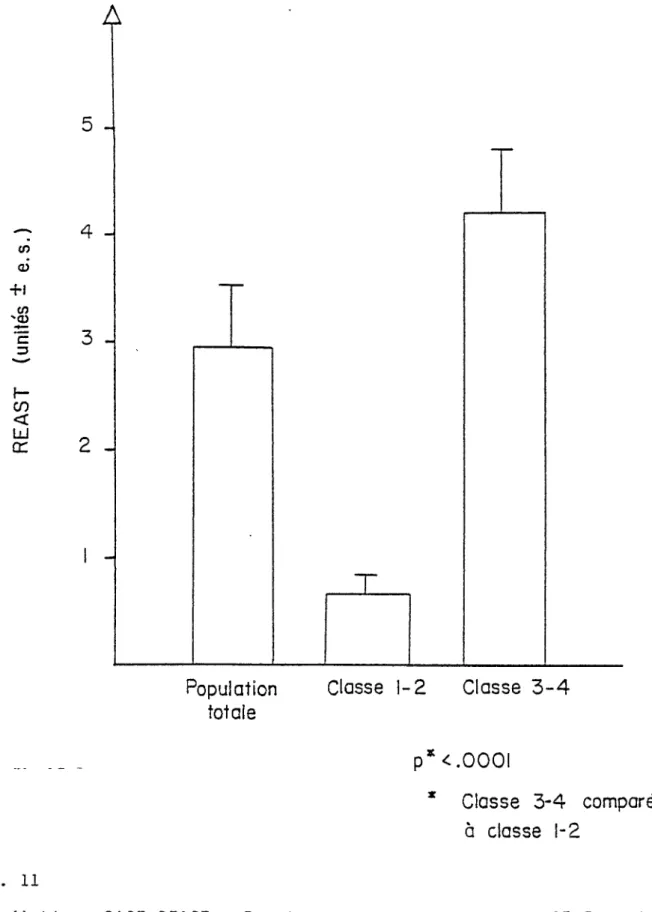
(Table II, P <0.0005). Allergie patients were further subdivided into 2 groups : those with a HAST over 12%- (Class 3-4 ) and those with a HAST between 2% and 12% (Class 1-2). Finally, the first group of patients with higher IgE antibodies as determined by HAST (over 12%) gave a value in the REAST significantly higher than the group with a RAST between 2-12% (P <0.005) (Figure 4).
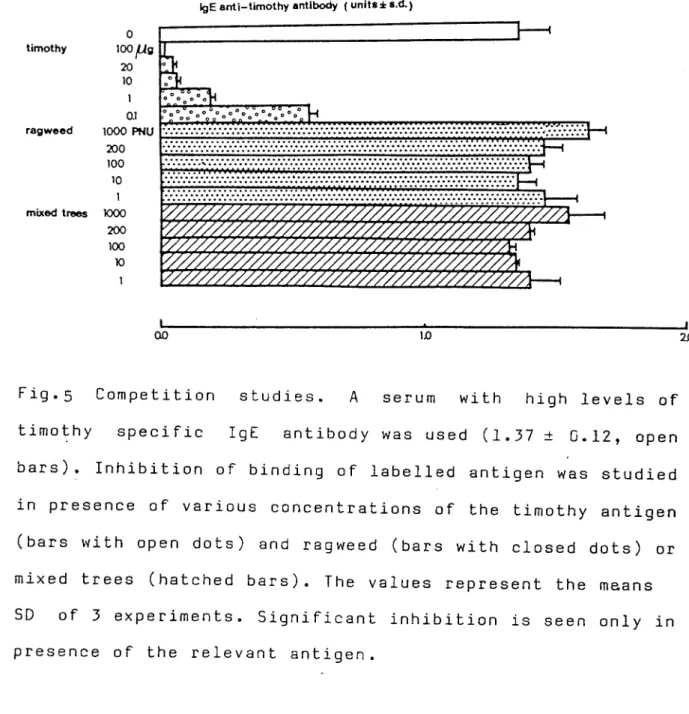
The antigen specificity of the assay was shown by a significant inhibition of the fixation of labelled timothy antigen in presence of unlabelled specific antigen but not in presence of unrelated antigen such as Ragweed or mixed trees extracts (Figure 5) or albumin (not shown ) and phospholipase (not shown). After heat inactivation, the values in units of all the sera tested were reduced by at least 8 5% of the initial value (not shown ) which suggest that our anti-IgE antiserum is mostly directed against the heat sensitive determinant of IgE (called E^).
Correlation between REAST and other parameters : clinical score index, total IgE, skin test.
The severity of the clinical condition was further evaluated in a subgroup of patients and controls. Each symptom was separately rated and the sum of the rating
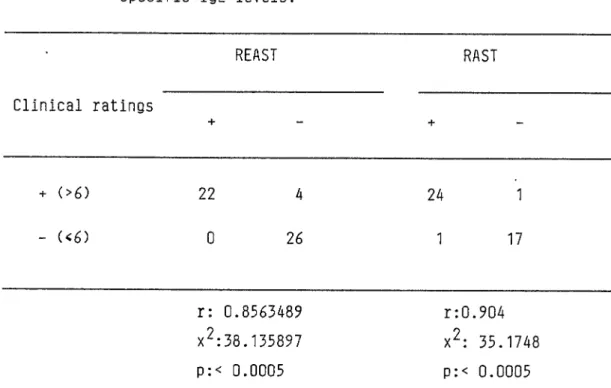
reported. The actual ratings did not correlate with the levels of specific IgE as measured by the two techniques (not shown). But specific IgE antibodies were found at significant levels in the patients with an allergic disease of moderate severity (sum of ratings over 6) (Table III). No correlation was seen between the measurement of anti-timothy IgE and the size of wheal reaction at the site of the skin test (not shown) and the serum total IgE (not shown).
IgG interference
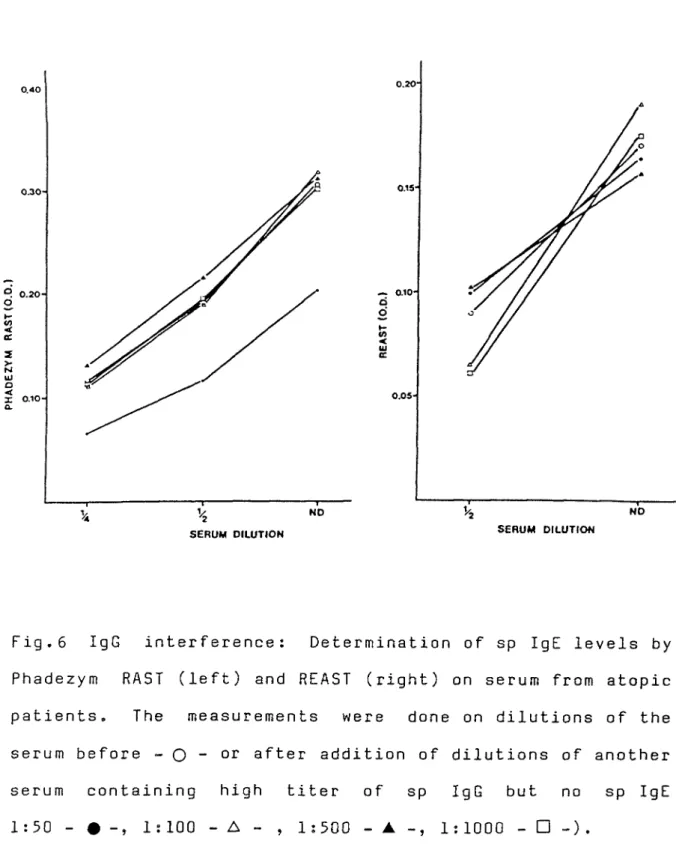
Addition of low quantities (dilutions 1:100) of sp IgG antibody to a serum containing low (figure 6) and high IgE titers (not shown ) does not interfere with the measurement of sp IgE by both techniques. But when larger amount of sp IgG Ab were added (dilution 1:50) a decrease of sp IgE level was observed when measured by Phadezym RA5T and not by REAST. This effect was not seen in sera containing high levels of sp IgE (not shown).
DISCUSSION
We are reporting herein a solid phase ELISA to detect IgE antibody. An affinity chromatography purified anti-IgE was allowed to fix to the solid phase before the successive addition of the serum to test and finally the peroxydase-labelled purified antigen . The technique is simple to perform and not time consuming. Measurement of IgE antibody levels was inhibited in presence of specific but not of unrelated antigens which confirms the antigen specificity of the assay. This procedure has several advantages over the standard RAST. First, the presence of an heat stable factor, presumably Ig G, in the sera of patients treated with injection of pollen extracts could produce as much as 50% reduction of the levels of IgE antibody. Such an interference by I g G antibody has been reported by most investigators using RAST (Johansson, 1971 ; Foucard , 1972 ; Aalberse, 1973; Vervloct, 1974 ; Lynch, 1975; Pauli, 1978; Zeiss, 1981 ; Zimmerman , 1980 ; Hamilton, 1982 ; Perelmutter, 1983). The REAST should short cut this difficulty by selecting out the IgE first. Indeed a similar solid phase radioimmunoassay using myeloma IgE and anti-IgE coated tubes, has been shown to reduce this interference (Zeiss, 1973; Zeiss, 1981). Preliminary results from our laboratory suggest higher IgE antibody values with REAST than RAST in sera from patients undergoing immunotherapy, which
presumably result from I g G interference in the RAST procedure. This point is currently under study. Second, the REAST measures the interaction of IgE antibody against allergen rather than the reaction of anti-IgE against IgE antibody as performed by the RAST. Therefore REAST allows the measurement of the antibody content as opposed to RAST (Zeiss, 1973). On the other hand, with RAST, specific IgE could be determined for a variety of crude antigens while REAST requires purified antigens. Furthermore labelling could present difficulties for small antigens.
The correlation between both techniques (figure 3) is not absolute and there are discrepancies which could be explained by the fact that the Pharmacia standard RAST does not use the same source of timothy antigen. A significant correlation has been already reported with RAST and clinical symptomatology and is confirmed herein . This correlation holds true for the REAST as well. No correlation was seen with the size of the wheal reaction after the prick. However this approach is not quantitative and it would have been preferable to use the end point titration technique (Wide, 1967 ; Norman , 1973 ; Ahlstedt, 1974).
The REAST appears to be a technique that could permit to measure specific IgE antibody without possible IgG interference especially when large amounts of sp IgG are present with low levels of sp IgE. In our study, this point
was clearly shown although larger amounts of IgG could have made it clearer. The procedure is at least as sensitive as the RA5T. Some studies have been initiated with a monoclonal anti-IgE antibody and preliminary results suggest an increase in sensitivity. REAST then could become promising in the measurement of IgE antibody produced by cultured cells in vitro.
a.
05-i.I M i 'T r
'i i 'i " i—r i T-ri—i—r
undiluted serum dilution
Fig.2 Reference curve for REAST: A serum with high IgE antibody levels was used to construct the reference curve. Each point represents the mean of 7 experiments standard error .
HAST (%binding)
Fig.3 Correlation between the two techniques : REAST and Pharmacia PAST. Correlation by linear regression analysis is significant (p<0.005).
HAST class 1-4 3&4 NS
1 & 2 p<.005
Fig.4 Correlation between the two techniques : REAST and Pharmacia PAST. The patients were further subdivided according to their HAST class : class 1 and 2 represent a percentage of binding below 12% and class 3 and 4 a percentage of binding over 12%.
IgE anti-timothy antibody ( units ± s.d.) timothy ragweed mixed trees 1000 200 100
Fig.5 Competition studies. A serum with high levels of timothy specific IgE antibody was used (1.37 ± 0.12, open bars). Inhibition of binding of labelled antigen was studied in presence of various concentrations of the timothy antigen (bars with open dots) and ragweed (bars with closed dots) or mixed trees (hatched bars). The values represent the means SD of 3 experiments. Significant inhibition is seen only in presence of the relevant antigen.
PHAOEZ YM R A S T ( O .O .) ~ 0.10 -0.06 -SERUM DILUTION 0.40 0.20-0.10 -SERUM DILUTION
Fig.6 IgG interference : Determination of sp IgE levels by Phadezym HAST (left) and REAST (right) on serum from atopic patients. The measurements were done on dilutions of the serum before -Q - or after addition of dilutions of another serum containing high titer of sp IgG but no sp IgE 1:50 - # -, 1:100 - A - , 1:500 - ▲ 1:1000 - □ -).
SUBJECTS
REAST
RAST
number
value
P
(units±sd)
number
(%binding±sd)
value
P
Atopic patients
85
1,14*1,20
85
27,3*13,5
<.0005
<.0005
Non atopic donors
35
0,014*0,020
30
1,25*1,00
TABLE II
Correlation between RASTand REAST
HAST
REAST
+
-+ *
69
11
-
10
25
* a positive test is defined as greater than 3 s.d. of the mean
r: 0.572
x%: 37.66
p:<.0005
TABLE III
Correlation between clinical symptom scores and
specific IgE levels.
REAST
RAST
Clinical ratings
+
-+
-+ (>6)
22
4
24
1
- (<6)
0
26
1
17
r: 0.8563489
r:0.904
x^:38.135897
x%: 35.1748
p:< 0.0005
p:< 0.0005
REFERENCES
Aalberse, R.C., E.E. Reerink-Brongers and E. Verneulen, 1972, Int. Arch. Allergy 45, 56.
Adkinson , N.F.Jr., 197 6, in: Manual of Clinical Immunology, eds. N.R. Rose, H. Friedman (A.S.M., Washington, D.C.) p. 590.
Ahlstedt, S., H. Eriksson, S. Lindgren and A. Roth, 1974, Clin. Allergy 4, 31.
Ceska, M., R. Eriksson and J.M. Varga, J. Allergy Clin. Immunol. 49, 1.
Cheung, N.V., M.J. Reid, A.R. Page and N.J. Lewiston, 1981, Ann. Allergy 46, 132.
Evans, R., H. Pence, H. Kaplan and R.E. Rocklin, 1976, J. Clin. Invest. 57, 1378.
Foucard, T. , S.G.O. Johansson, H. Bennich and T. Berg, 1972, Int. Arch. Allergy 43, 360.
Gleich, G.J. and R.T. Jones, 1975, J. Allergy Clin. Immunol. 55, 334.
Gleich, G.3., G. L. Jacob , J.W. Yunginger and L.L. Henderson, 1977, 3. Allergy Clin. Immunol. 60, 188.
Gleich, G.3., 3.W. Yunginger and 3.D. Stobo, 1978, in: Allergy principles and practice, Vol. 1, eds. E. Jr. Middleton, C.E. Reed and E.F. Ellis (St. Louis, Mo.) p. 231.
Hamilton, R.G. and N.F. Adkinson, 1982, 3. Allergy Clin. Immunol. 69, 111.
Johansson, S.G.O., H. Bennich and R. Bert, 1971, Int. Arch. Allergy 41, 443.
Johansson, S.G.O. and M. Inganas, 1978, Immunol. Rev. 41, 248.
Lichtenstein, L.M., K. Ishizaka, P.5. Norman, A.K. Sobotka and B.M. Hill , 1973 , 3 . Clin. Invest. 52, 472.
Lynch, N.R., P. Dunand, R.W. Newcomb, H. Chai and 3. Bigley, 1975, Clin. Exp. Immunol. 22, 35.
Nai-Kong, V., N.V. Cheung, 3. Blessing-Moore, M.I. Reid, N.J. Lewiston and G. Yang, 1983, 3. Allergy Clin. Immunol. 71, 283.
Norman, P.S., L.M. Lichtenstein and K. Ishizaka, 1973, 3 . Allergy Clin. Immunol. 52, 210.
Pauli, B.R., G.L. Jacob , 3 . V/. , Yunginger and G.3. Gleich, 1978, 3. Immunol. 120, 1917.
Perelmutter, L., M. Bergeron and F. Mandy, 1983, Ann. Allergy 50, 393.
Reid, M.J., N.V. Cheung and N.3. Lewiston, 1981, 3. Allergy Clin. Immunol . 67, 263.
Schellenberg, R.R. and N.F. Adkinson, 1975, 3. Immunol. 115, 1577 .
Schopfer, K., K. Baerlocher, P. Price, U. Kroch, P.G. Quie and S.D. Douglas, 1979, N. Engl. 3. Med. 300, 835.
Sobotka, A.K., N.F. Adkinson and M.D. Valentine, 1978, 3. Immunol. 121, 2477.
Vervloet, D., Y. Fujita, 3.1. Wypych, R.E. Reisman and C.E. Arbesman, 1974, Clin. Allergy 4, 359.
Wide, L., H. Bennich and 5.G.O. Johansson, 1967, Lancet ii, 1105.
Yunginger, 3. W. and G.3. Gleich, 1973, 3. Clin. Invest. 32, 1968.
Zeiss, C.R., 3.3. Pruzansky, R. Patterson and M. Roberts, 1973, 3. Immunol. 110, 414.
Zeiss, C.R., L.C. Grammer and D. Levitz, 1981, 3. Allergy Clin. Immunol. 67, 105.
Zimmerman, E.M., 3.W. Yunginger and G.3. Gleich, 1980, 3. Allergy Clin. Immunol. 69, 111.
FOOTNOTES
Supported by a grant from Medical Research Council of Canada (MA-6505).
Reprints request to: Jacques Hebert, m.d.
Departement d1 Immunologie Centre Hosp. Université Laval 2705, Boulevard Laurier
Ste-Foy, P.Q. CANADA
MESURE DES IGE SPECIFIQUES AU PHLEOLE PAR LA TECHNIQUE DU REAST UTILISANT UN ANTI-IGE MONOCLONAL
3.1 INTRODUCTION
Le présent chapitre a pour objet de présenter les résultats d'un REAST dans lequel nous avons remplacé 11anti-IgE polyclonal par un anti-IgE mon oclonal purifié. Cet essai est comparé au RAST Pharmacia suivant les mêmes critères utilisés au chapitre précédent. Par la suite, nous comparerons les résultats obtenus avec 1'anti-IgE polyclonal et monoclonal.
3.2 MATERIEL ET METHODES
3.2.1 PREPARATION DE L'ANTI-IGE MONOCLONAL (7H8).
L'anti-IgE monoclonal a été obtenu suivant la procédure décrite par Kohler et Milstein. Des souris Balb/c ont été immunisées avec une préparation d ' IgE isolées à partir d'un myélome humain . Au 21e jour suivant 1'immunisation, les souris subissent une injection de rappel. Cinq jours plus tard, les cellules B extraites de la rate de souris sont fusionnées avec des cellules de la lignée sp2/o. Les clones sélectionnés réagissent contre les portions Fc des IgE myélomiales et normales. L'anti-IgE monoclonal purifié (7H8 ) ne réagit pas avec aucune autre des classes d'immunoglobulines (I g G1, IgG2, IgG3, IgG4, IgM,
IgD, IgA). Cela a été prouvé en utilisant un radioimmunoessai (RIA ) en phase liquide.
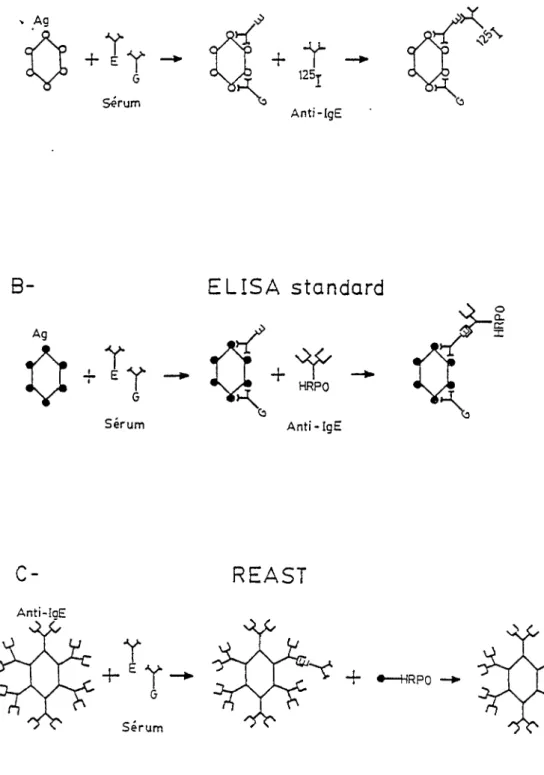
3.2.2 RAST, ELISA standard , REAST .
Les 3 techniques sont illustrées à la figure 7. L ' ELISA standard (7B) et le REAST (7 C) requièrent les mêmes réactifs, aux mêmes concentrations.
La technique de 1 1 ELISA standard est semblable à celle du RAS T (Fig.7A). Tout comme le RAST, 1 1 EL I SA standard est réalisé au moyen d'une matrice solide sur laquelle sont préalablement absorbés les antigènes. Ceux-ci vont réagir avec les anticorps spécifiques du sérum à tester . Les IgE spécifiques seront révélés en présence d'un anti-IgE marqué radioactivement dans le RAST et marqué avec une enzyme dans 1 'ELISA standard. Cependant, les antigènes et l'antisérum anti-IgE utilisés dans la technique du RAST sont ceux fournis avec la trousse commerciale et sont donc différents de ceux utilisés dans le REAST et 1'ELISA standard.
3.2.3 CONTROLES SUR LES MESURES DU REAST.
Lorsque la quantité sérique d'IgE spécifiques est déterminée par la technique du REAST, un contrôle positif (sérum d'un patient allergique) et un contrôle négatif (sérum d'un sujet normal) sont toujours faits. De plus, à chaque essai, les réactifs suivants : l'anti-IgE monoclonal, le sérum à tester ou les deux , sont remplacés par une
solution d'albumine dans le but de s'assurer de l'absence de réactivité non spécifique. Finalement, des sérums de patients allergiques au bouleau, à l'herbe à poux et au venin d ' abeilles se sont révélés négatifs en IgE spécifiques au phléole tel que mesuré par la technique du REAST.
3.2.4 SPECIFICITE ISOTYPIQUE DU REAST.
La spécificité isotypique du REAST a été vérifiée en mesurant la quantité d'IgE spécifiques par REAST avant et après avoir chauffé des échantillons de sérums à 56 C pendant 4 heures. Le chauffage des échantillons a pour but de détruire les IgE puisqu'elles sont thermosensibles.
3.2.5 SPECIFICITE ANTIGENIQUE DU REAST.
La spécificité antigénique du REAST est mesurée par compétition entre l'antigène marqué (phléole marqué ) et le même antigène non marqué ou un antigène différent (la phospholipase, un extrait de mélange d'arbres et l'herbe à poux). Les antigènes libres ont été utilisés à différentes concentrations (Fig. 9 ). Le pourcentage d'inhibition de la fixation du conjugué phléole-peroxidase (HRPO ) est calculé à partir de la formule suivante:
% inhibition = ( D.O. avec 11 antigène libre )
_________________________________ X 100 ( D.O. sans l'antigène libre ).
3.3 RESULTATS
3.3.1 DOSAGE DES IGE SPECIFIQUES AU PHLEOLE PAR LA TECHNIQUE DU REAST.
La figure 8 représente la courbe dose-réponse établie à partir du sérum d'un patient très allergique au phléole. Chaque point de la courbe résulte de la moyenne obtenue lors de 5 expériences différentes. La courbe de la densité optique en fonction du logarithme de la dilution montre une corrélation linéaire ( r = 0,99 ) pour des valeurs de densité optique se situant entre 0,2 et 1,2.
3.3.2 SPECIFICITE DE LA MESURE.
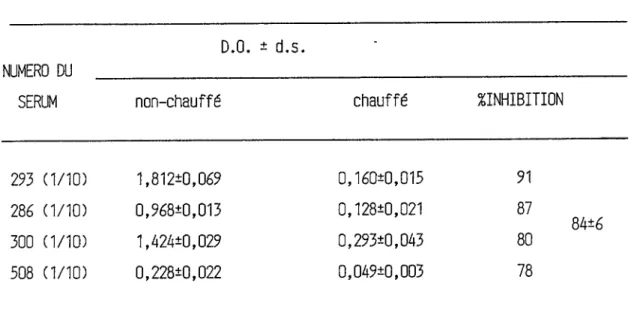
La spécificité isotypique a été vérifiée en mesurant les IgE spécifiques de sérums avant et après les avoir chauffé à 56 C. Nous observons une diminution significative de la mesure des IgE spécifiques, de près de 85 %, sur les échantillons de sérums préalablement chauffés
La spécificité antigénique de la mesure des IgE spécifiques a été démontrée. Nous avons mesuré une diminution de la valeur du dosage des IgE spécifiques d'un sérum donné lorsque le conjugué phléole-peroxidase est mis en compétition avec l'antigène spécifique non-marqué ( le phléole ) . Le pourcentage d ' inhibition de la mesure des IgE spécifiques augmente avec la concentration du phléole libre. Des quantités comparables d'autres antigènes ( herbe à poux, extraits de mélange d'arbres, phospholipase ) n'ont pas eu d'effet sur le dosage des IgE spécifiques au phléole (Fig.9).
Le coefficient de variation de la mesure des IgE spécifiques au phléole à 1 ' intérieur d'un même essai n'excède pas 6 %. En revanche, le coefficient de variation entre différents essais peut atteindre 20 %.
3.3.3 REAST VS RAST
Le REAST et le RAST mesurent de façon significative plus d'IgE spécifiques au phléole chez la population allergique (3,04 + 3,94 ; 21,65 + 14,50 ) comparativement à la population non allergique ( 0,20 + 0,17 ; 1,48 + 1,68 ) (Tableau VI).
avons subdivisé la population allergique au phléole en 2 sous-groupes. Le premier groupe est formé de personnes dont les valeurs du RAST sont inférieures à 12 % et appartiennent aux RAST de classe 1 et 2; le second, de celles chez qui les valeurs RAST sont supérieures à 12 % et dont les RAST se
retrouvent dans les classes 3 et 4. Le REAST nous a permis de détecter plus d'IgE spécifiques au phléole chez les personnes qui ont un RAST au phléole de classe 3 et 4 comparativement à celles des classes 1 et 2. (Fig. 11).
De plus, le REAST et le RAST permettent l'obtention de valeurs significativement supérieures dans la population allergique au phléole qui regroupe des individus présentant des symptômes modérés ou sévères (Tableau VII).
3.3.4 REAST VS ELISA STANDARD.
Différents sérums ont été testés en utilisant le REAST et 1'ELISA standard. Nous avons établi le niveau d'IgE sériques spécifiques respectifs de patients allergiques au phléole et d'autres à la phospholipase (Tableaux VIII, IX). Dans les 2 groupes, les valeurs de densité optique obtenues pour un même échantillon sérique sont plus élevées en utilisant la technique du REAST.
Dans un dernier temps, nous avons comparé 1'anti-IgE monoclonal à l'anti-IgE polyclonal. Le même échantillon sérique est dosé par REA5T utilisant l'anti-IgE polyclonal et monoclonal. Le taux des IgE spécifiques au phléole est toujours plus élevé lorsque le REAST est réalisé avec un anti-IgE monoclonal (Tableau X).
3.4 DISCUSSION
Le REAST est un essai enzymatique mis au point pour la mesure des IgE sériques spécifiques. Il s'agit d'une technique simple, économique, rapide et aussi sensible que le RAST.
Le REAST a cependant un avantage important. Il nous permet de mesurer 1'interaction directe entre l'antigène et son anticorps, ce qui est nécessaire pour quantifier un anticorps spécifique ( Hemady, 1983). Le RAST ne mesure que 1'interaction entre l'anticorps anti-IgE et 1 ' IgE.
La crainte d'une perte de 1 ' antigénicité de 1 ' allergène à la suite du couplage aurait pu être une limite à son utilisation. Toutefois, la spécificité du REAST (Figure 9 et Tableau IV) et sa sensibilité comparable à celle du RAST (Figure 10) ne nous permet pas de déceler une perte antigénique .
Nous avons aussi observé que les taux d ' IgE sériques spécifiques mesurés au moyen de 1'ELISA standard sont inférieurs à ceux mesurés avec le REAST. Ces résultats ont été obtenus avec le phléole et la phospholipase qui est un antigène responsable de 1 ' allergie au venin d ' abeilles.
réactif un anti-IgE polyclonal préparé et, purifié dans notre laboratoire. Pour améliorer la sensibilité de l'essai et assurer une meilleure reproductibilité, nous l'avons substitué dans un deuxième temps par un anti-IgE monoclonal préparé également dans notre laboratoire. L'utilisation de 1'anti-IgE monoclonal a eu comme effet d'accroître la sensibilité du REAS T (Tableau X) et aussi de rendre plus significative la corrélation avec le RAST (Figures 3 et
10
).
Les spécificités isotypique et antigénique de l'essai ont été clairement établies (Fig. 9, Tableau IV). La variabilité intra-essai du REAST s'avère très minime. Les coefficients de variation calculés d ' octoplicatas n'excèdent pas 6 %. La variabilité inter-essai est inférieure à 20 %,
ce qui est acceptable dans un immunoessai.
Ce test présente l'avantage potentiel de réduire et même d'éliminer 1'interférence des anticorps bloquants fréquemment décrite au cours du dosage des IgE spécifiques par le RAST (Gleich, 1975). L'anti-IgE sélectionne uniquement les IgE du sérum et non les anticorps des autres classes présentant une affinité pour l'allergène. Les différentes techniques qui ont été décrites dans le but d'éliminer l'interférence des IgG augmentent les temps de manipulation et, par conséquent, sont non utilisables dans un laboratoire clinique. Il y a plusieurs façons de montrer
que les IgG n1 interfèrent pas dans un REAST. Premièrement, 1'élimination des IgG sériques par chromatographie d'affinité sur colonne anti-IgG devrait altérer les valeurs mesurées par RA5T et non par REAST. Deuxièmement, l'enrichissement d'un sérum en IgG spécifiques par addition du sérum d'un patient ayant subi une immunothérapie devrait aussi avoir les mêmes effets (Zimmerman, 1980).
> Ag Serum
+
Ÿ
125j Anti-IgEB-
ELISA standard
C-
REAST
Anti-IaE FIG. 7Illustration des 3 techniques utilisées pour le dosage des IgE spécifiques. A. RAST de Pharmacia qui utilise un disque de Sépharose qui lie l ' antigène et un anti-IgE marqué à l'iode 125.
B. ELISA standard qui utilise du polystyrène pour lier le phléole et le complexe anti-IgE monoc lona l-HRPO et C. REAST emploie une matrice de polystyrène pour I'anti-IgE monoclonal et
non dilué
FIG. 8
Courbe dose-réponse d'un sérum REAST au phléole très positif. Chaque point représente la moyenne de 5 expériences différentes.
te ICO 2Q 10 1 0,1 1000200100 XD 1 1000200100 0 1 10020 10
Ag.
t—PHLEOLE.—I I--- MELANGE—I I—HERBE A—i PHOSPHOUPASE .
ÜAFSRES. POUX.
ug/puits Pnu/puits Pi u/puits uQ/puits
FIG. 9
Spécificité antigénique du REAST au phléole montrée par des études de compétition. Quatre allergènes différents sont mis simultanément en présence avec ce complexe phléole-péroxidase durant le dosage en IgE spécifiques au phléole par le REAST. Uniquement l 'allergène spécifique (phléole) inhibe la fixation du complexe ph léo le-HRPQ suivant une courbe dose-réponse.
R A ST l
% LIAISON )FIG. 10
Corrélation RAST-REAST utilisant la régression linéaire où r= 0,61 et p < 0,001.
<n <u
-H
'<o c 3f-cn
<
Ld
cr
Population Classe 1-2 Classe 3-4 totale
p
*<.0001
* Classe 3-4 comparée à classe 1-2
FIG. Il
Corrélation RAST-REAST. Population allergique de RAST 3 et 4 comparée à la population RAST 1 et 2 en fonction de leurs valeurs REAST. REAST détecte plus d'IgE spécifiques au phléole chez la population de RAST 3 et 4.
TABLEAU IV Effet du chauffage sur la mesure des IgE spécifiques
au phléole par la technique du REAST.
D.O. * d.s.
NUMERO DU _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _
SERUM
non-chauffé
chauffé
^INHIBITION
293 (1/10)
1,812*0,069
0,160*0,015
91286 (1/10)
0,968*0,013 0,128*0,021 87300
(1/10)
1,424*0,029 0,293*0,043 80INTER-ESSAI
INTRA-ESSAI
ECHANTILLON
UNITES REAST
C.V.
ECHANTILLON
UNITES REAST
C.V.
* D.S.
%
* D.S.
%A
1,292*0,223
18
1
1,715*0,030**
1.7
(19)*
B
0,759*0,170
22
2
0,210*0,007
3,1
(15)
C
0,415*0,101
24
3
1,080*0,063
5,8
(11)
4
0,498*0,010
2,1
5
0,547*0,011
1,9
* Le chiffre entre parenthèses: le nombre d'expériences qui ont été effec
tuées dans la période du 01-06-83 au 30-04-84.
TABLEAU VI Dosage des IgE spécifiques par REAST et par RAST chez des
patients alllergiques et normaux.
REAST
n*
unités±d.s.
r
%liaison±d.s.
RAST
NON-ALLERGIQUES
(23)
0,20±0,17
1,48±1,68
< 0,005
ALLERGIQUES
(86)
3,04±3,94
21,65*14,50
* Patients allergiques comparés aux personnes non-allergiques
P*
TABLEAU VII Corrélation entre 11 IgE spécifique par REAST et par
RAST et la sévérité de l'atteinte clinique.
EVALUATION CLINIQUE
REAST
unités±d.s.
P*
RAST
P*
%liaison±d.s.
+ > 6
4,62*1,03
28,25*2,54
<0,05
<,0005
—^6
0,61*0,17
3,30*1,26
* Test de student comparant la population cliniquement positive à la
population cliniquement négative.
TABLEAU VIII Comparaison entre REAST et ELISA standard pour le
dosage des IgE spécifiques au phléole.
REAST
ELISA standard
Echantillon Dilution
d.o.*d.s.
d.o.±d.s.
291
1/10 1,751*0,1540,598*0,028
1/20
1,482*0,092
0,186*0,012
418 1/21,266*0,071
0,918*0,010
1/10 1,080*0,0630,153*0,010
1/20
0,839*0,035
0,083*0,010
34 1/100,547*0,011
0,068*0,001
1/20
0,342*0,028
0,048*0,010
16 1/100,677*0,028
0,117*0,053 1/200,426*0,033
0,046*0,004
86
1/100,498*0,010
0,070*0,0361/20
0,334*0,048
0,022*0,005
TABLEAU IX Comparaison entre le REAST et 1'ELISA standard pour
le dosage des IgE spécifiques a la phospholipase.
Echantillon
dilution
D.O.* d.s.
REAST
ELISA standard
D.O.* d.s.
556
1/2 0,292*0,024 0,200*0,008 1/10 0,224*0,0100,220*0,006
2 1/2 0,141*0,0100,093*0,008
1/10 0,032*0,0050,035*0,007
461
1/20,235*0,009
0,180*0,009
1/10 0,110*0,0050,055*0,004
57 1/2 0,260*0,0040,135*0,008
1/10 0,113*0,0020,055*0,004
583
1/20,772*0,063
0,373*0,044
TABLEAU X Comparaison de l'anti-IgE polyclonal et monoclonal
dans le REAST.
ANTI-IGE
POLYCLONAL
ANTI-IGE
MONOCLONAL
ECHANTILLON
UNITES REAST
UNITES REAST
FACTEUR
D'AUGMENTATION
410,266
3,76
13235
1,026
1,81
0,6
183
0,0441,44
33 971,086
2,09
2246
1,0008,39
8CONCLUSION GENERALE
Le REAST ( Reverse Enzyme Allergosorbent Test ) est une technique simple de dosage des IgE sériques. Elle nécessite peu de temps de manipulation et, à l'inverse du RAST, a le potentiel d'éliminer le problème de l'interférence IgG. Et ce, en ne demandant pas d'étapes supplémentaires pour éliminer les IgG du sérum à tester. Elle pourra permettre de suivre la concentration en IgE spécifiques dans le sérum de patients sous immunothérapie et ainsi mieux analyser 1 ' efficacité du traitement.
Elle offre donc une perspective d'avenir pour l'approche thérapeutique des allergies. Par ailleurs, il est difficile d ' approfondir nos connaissances sur les mécanismes de régulation régissant la synthèse des IgE s'il n'existe pas une technique assez sensible pour mesurer des microquantités d ' IgE. Le REAST, dont il est encore possible d ' accroître la sensibilité, pourra être éventuellement utilisée pour mesurer une synthèse in vitro d'immunoglobulines E. Elle assurera probablement un avancement dans la compréhension des phénomènes impliqués dans la synthèse IgE.
Finalement, il est à espérer une standardisation de la technique pour qu'elle puisse profiter aux chercheurs cliniciens dans le domaine de l'allergie. Le RAST restera un
bien dans le domaine clinique que dans le domaine de la recherche médicale.
BIBLIOGRAPHIE
Adkinson, N.F. (1980) The radicallergosorbent test : Uses and Abuses . i.Allergy Clin. Immunol . 65 :1-4
Adkinson, N.F. (1976): Heausurement of total sérum immunoglobulin E and allergen-specific immunoglobulin E antibody in Rose N.R., Friedman H. Editors : Manual of Clinical Immunology. Washington, D.C. American Society for Microbiology p. 590.
Adkinson, N.F. (1981) The radioallergosorbent test in 1981-Limitations and refinements. 0.Allergy Clin. Immunol. 67:87-89
Bach,M.K.(1983): The leukotrienes : Their structure, Actions and Role in Diseases. Upjohn Company. 40 pages
Bach J . F . , Lesavre,P. (1981) : Immunologie Ed. Flammarion Medecine Sciences p. 248-259
Bier, O.G., Dias de Silva, W., Gotze,D., Mota, I. (1981): Fundamentals in Immunology Springer-Verlag N.Y., Heidelberg, Berlin . p.257-295
Buckley (1978) : Abnormalities in the regulation human IgE synthesis. Immunol. Rev . 41: 288.
Buisseret, P.D. (1982) Allergy Scientific American p.86-95. Cooke, R.A., Barnard, 3.H., Hebald, S., Stull, A. ( 1935 ): Serological evidence of immunity with coexisting sensitization in a type of human allergy (hay fever).
3
.Exp.Med . 62:733.Coombs,R.R.A. , Hunter,A.,Jonas,W.E. , Bennich,W . , Oohannsson,S.G.0., Panzani,R. (1968): Detection of IgE (IgND) specific antibody(probably reagin) to castor-bean allergen by the red-cell-linked-antigen-antiglobulin reaction. Lancet 1:1115
Cuevas,M., Moneo,I., Urena,V., Dominguez,]., Bootello,A. (1983): Reverse Enzyme Immunoassay for the determination of Lolium perenne IgE antibodies. Int.Archs. Allergy Appl. Immunol.72: 184-187.
Daguet,G.L.(1972) Eléments d1 immunologie médicale ( 2e édition ) Flammarion Medecine-Sciences p.117-131.
Dosch, H.M.,Gelfand,E.W. (1977) Generation of plaque-forming cells in culture : tissue distribution, antigenic and
cellular requirements. 3.Immunol.118 : 302-308.
Engrail,EPerlmann , P . (1972) : Enzyme-linked immunosorbent assay, ELISA. 111. Quantification of specific antibodies by enzyme-labeled anti-immunoglobulin in antigen-coated tubes. 3.Immunol.109:129-133.
Fadal,R.G., Nalebuff,0.3.(1979): Tools of the allergist : Old and New. Cont.Educ . (May) p.37
Fauci, A.S., Ballieux, R.(1979 ) Antibody production in man . In vitro Synthesis and Clinical Implications. Academic Press, New-York. Freedman, S.0.(1983): Immunology, Allergy and the environment. Medecine in North America Oct.1983 4:315-324.
Frick,O.L., German,D.F., Mills, 3 . (1979): Développement of allergy in children 1. Association with virus infections. 3.Allergy Clin. Immunol.63 : 229
Gleich,G . 3 . , 3acob,G.L.,Yunginger,3.W. , Henderson,L.L.(1977): Measurement of the absolute levels of IgE antibodies in patients with ragweed hay fever. 3.Allergy Clin . Immunol. 60 : 188.
Gleich,G.3. ,3ones,R.T.(1975): Measurement of IgE antibodies by the radioallergosorbent test 1. Technical considerations in the performance of the test. 3.Allergy Clin.Immunol.55:334.
Gleich, G.3.,3ones,R.T.(1975 ) : Measurement of IgE antibodies by the radioallergosorbent test. 11. Analysis of quantitative relationships in the test. 3.Allergy Clin .Immunol.55: 346.
Gleich,G.3.,Larson,3.B., 3ones,R.T., Baer,H.(1974): Measurement of the potency of allergy extracts by their inhibitory capacities in the radioallergosorbent test. 3.Allergy Clin.Immunol.53:158
Gleich,G.3.. Yunginger, 3.W.( 1976): Standardization of allergens in Rast, N.R.,Friedman,H. editors : Manual of Clinical Immunology. Washington,D.C. American Society for Microbiology Chap.77.p.575.
Guttman , R.D.,Bach,F.H.(1981) Immunology.A Scope Publication Upjohn.
Hamilton,R.G.,Adkinson,N.F.(1982): Factors influencing Ig G interference in the RAST. 3.Allergy Clin.Immunol.69:111.
Hébert,3.,Beaudoin,R., Aubin,M., Fontaine , M.(1980 ) : The regulatory effect of histamine on the immune response :
Characterization of the cells involved. Cell. Immunol. 54, p.49-57.
Hemady,Z.,Blomberg , F., Cellis,S., Rocklin , R.E. (1983 ) IgE production in vitro by human blood mononuclear cells : A comparison between atopic and nonatopic subjects. 3.Allergy Clin.Immunol.71:324-330.
Holborow,0. , Lessof,M.(1983): Immune mechanisms in health and disease MEDECINE in North America 4:292.
Hood,E.L.,Weissman,I.L.,Wood ,W.B.( 1978 ) : Immunology The Benjamin/Cumings Publishing Company Inc. p.145-148. 467 pages.
Ishizaka,K. (1976 ) : Cellular events in the IgE antibody response. Adv. Immunol.23:1.
Ishizaka,K. , Ishizada,T.(1967 ) : Identification of IgE antibodies as a carrier of reaginic activity. 3.Immunol. 99:1187.
Ishizaka,K. ,Ishizaka,!. ( 1978 ): Immunology of IgE-mediated hypersensitivity. ALLERGY Principles and Practice. Ed. E.Middleton,C.E.Reed,E.F. Ellis, p.52-78.
Ishizaka,K., Ishizaka, T. Hornbrook,M.M.(1967): Allergen-binding activity of E, G and A antibody in sera from atopic patients. In vitro measurements of reaginic antibody 98:490.
Ishizaka,!.,Soto,C.,Ishizaka,K. (1973): Mechanisms of passive sensitization. 111. Number of IgE molecules and its receptor sites on human basophil granulocytes. 3.Immunol 111:500.
3ohansson,S.G.0.,Inganas,M.(1978): Interaction of polyclonal human IgE with protein A from Staphylococcus aureus. Immunol.Rev.41:248.
Katz,D.H.(1980) Recent studies on the regulation of IgE antibody synthesis in experimental animals and man. Immunology 40:1-24.
Keller,R.(1966): Monographs in Allergy,2. Tissue mast cells in immune reactions. American Elsevier Publishing Company Inc. N.Y. Ed. P.Kallos, Helsinberg. H.C. Goodman, Geneva T.Inderbitzin,Boston.
Kishimoto , T. ( 1982 ): IgE class-specific suppressor T cells and regulation of the IgE response. Progress in Allerg y,vol . 32 p. 265-317.
Klein,Y.(1982): Immunology The Science of Self and Non-Self Discrimination. A Wiley-Interscience Publication p.531-556. Lichtenstein,L.M., Ishizaka,K, Norman,P.S., Sobotka,A.K . , Hill, B.H. ( 1973): IgE antibody measurements in ragweed hay fever. Relationship to clinical severity and the results of immunotherapy. 3.Clin.Invest.52:472.
Lynch,N.R., Dunand,P,Newcomb,R.W., Chai,H.,Bibley,3. (1975): Influence of IgG antibody and glycopeptide allergens on the correlation between the radioallergosorbent test (HAST) and skin testing or bronchial challenge with Alternaria Clin.Exp.Immunol.22:35.
Michaels , A.A.,Stevens,M.B.,Adkinson,N.F. 3r(1979): Detection of influenza vaccine-specific IgE. 3.Allergy Clin. Immunol . 63 : 169 (Abst.)
Minden,P.,Farr,R.S., in Immunological Diseases, 2nd Ed., p. 179, Little, Brown Co., Boston, 1971.
Nakane,P . K . , Kawaoi,A. (1974) Peroxidase-labelled antibody a new method of conjugation. The 3ournal of Histochemistry and cytochemistry, Vol. 22, No 12, p. 1084-1091.
Nisonoff,A. (1982) Introduction to molecular immunology. Sinauer Associates Inc., Suder land, Massachussets.
Nisonoff,A., Hopper,3.E., Spring,S.B. (1975) The antibody molecule Academic Press. Edited by F3. Dixon, 3r California, Henry G. Kuntel, New-York, 117-119.
Okumura,K., Tada,T.(1971): Regulation of homocytotropic antibody formation in the rat. VI. Inhibitory effect of thymocytes on the homocytotropic antibody response. 3.Immunol.107:1682-1689,
Perelmutter , L.,Bergeron,M., Mandy,F.( 1983 ): Assessment of the effect of IgG antibodies to ragweed and rye grass on the IgE antibody disc rast.Ann. of Allergy 50:393-397. Peters,M., Fauci,A.S. (1983) Antigen-specific human B-cell responses : modulation by immunoregulatory T-cell subsets. Cell.Immunol. 82:223-231.
Richter,M.A.(1980): A physician's guide to the theory and practice of clinical immunology p.138-156 (251 pages).