UNIVERSITE MOHAMMED V-AGDAL N° d’ordre : 2297 FACULTE DES SCIENCES
RABAT
Thèse de
DOCTORAT
Présentée par
Abdelilah LARAQUI
Discipline :
BiologieSpécialité :
BiochimieEtude des Facteurs Métaboliques et Polymorphismes
Génétiques Prédisposant à la Survenue de l’Athérosclérose Coronaire
Soutenue le 10 mars 2006 devant le jury :
Président :
Professeur Wail BENJELLOUN, Doyen de la Faculté des Sciences de Rabat
Examinateurs :
Abdelaziz BENJOUAD, Professeur à la Faculté des Sciences de Rabat Fatima BENKOUKA , Professeur à la Faculté des Sciences de Casablanca Seddik FELLAT, Médecin Biologiste, Ligue Nationale de Cardiologie, Rabat
M’hamed TIJANE, Professeur à la Faculté des Sciences de Rabat Jamel-Eddine SRAIRI, Professeur à la Faculté de Médecine de Rabat
A mes chers parents
Veuillez accepter ce modeste travail en reconnaissance des innombrables sacrifices et des efforts que vous avez consenti pour mon éducation et mon bien être. Aucune dédicace ne saurait exprimé l’estime, le dévouement et le respect que je vous porte. Que Dieu tout puissant vous procure longue vie, afin que je puisse vous combler à mon tour.
A ma femme
Quoique je dise et quoique je puisse écrire, mes mots ne pourraient contenir l’affection et l’amour que je te porte. Que ce travail soit un geste d’admiration et d’amour éternel. Que Dieu tout puissant t’accorde une vie pleine de santé et de bonheur.
A mes adorables enfants Rania et Mohamed Jad
Que Dieu me donne le pouvoir de réaliser le souhait d’un papa pour ses enfants; et ce que ses enfants attendent de lui.
A mes frères
Je ne saurais dire en quelques mots, mes sentiments d’amour, de gratitude, pour les sacrifices démesurés que vous n’avez cessé de déployer. Je vous souhaite beaucoup de succès dans votre vie et surtout beaucoup de joie et de bonheur.
A ma famille
Avec tout mon amour et toute ma tendresse. A ma belle-famille
Je saisis cette occasion pour vous exprimer tout mon attachement et ma tendre et profonde affection, et pour vous remercier pour l’amour que vous m’avez toujours réservé. A mes amis
Puisse ce travail vous assurer l’expression de ma sincère amitié avec mes souhaits de succès et de bonheur.
SOMMAIRE
SOMMAIRE ... 3
AVANT-PROPOS ... 6
LISTE DES PIBLICATIONS ... 9
LISTE DES ABREVIATIONS ... 10
INTRODUCTION ... 12
CHAPITRE I: REVUE BIBLIOGRAPHIQUE A . L’ATHEROSCLEROSE ... 15
I . Description de l’athérosclérose... 15
II . Complication de la plaque d’athérosclérose ... 16
III . Physiopathologie de la plaque d’athérosclérose... 16
IV . Epidémiologie et facteurs de risque ... 17
B . LA LIPOPROTEINE (a) ... 19 I . Caractéristiques physico-chimiques ... 19 II . Composantes structurales ... 20 II . 1 . L’apolipoprotéine B100 (apo B100)... 20 II . 2 . L’apolipoprotéine apo(a) ... 21 II . 2 . 1 . Composition et structure ... 21
II . 2 . 2 . Le domaine des kringles ... 21
II . 2 . 3 . Le domaine protéasique ... 22
III . Gène de l’apo(a) et polymorphisme de taille... 23
III . I . Structure du gène de l’apo(a) ... 23
III . 2 . Polymorphisme de taille... 23
IV . Métabolisme de la Lp(a) ... 24
IV . 1 . Biosynthèse ... 24
IV . I . I . Synthèse de l’apo(a)... 24
IV . I . 2 . Lieu d’assemblage de la Lp(a) ... 25
IV . 2 . Catabolisme... 26
V . Athérogènéicité de la Lp(a) ... 26
V . 1 . Mécanismes moléculaires pathogènes de la Lp(a) ... 26
V . 2 . Localisation de la Lp(a) dans la plaque d’athérome ... 27
V . 3 . Interaction de la Lp(a) avec les composants de la matrice extra-cellulaire ... 28
C . L’HOMOCYSTEINE ... 30
I . Origine et métabolisme de l’homocystéine ... 30
I . 1 . Voies de synthèse et de dégradation... 30
I . 2 . Régulation nutritionnelle du métabolisme de l’homocystéine ... 31
II . Déficits enzymatiques et pathogenèse de l’hyperhomocystéinémie... 33
II . 1 . Déficits enzymatiques constitutionnels ... 33
II . 1 . 1 . Mutation du gène de cystathionine β synthase (CβB) ... 33
II . 1 . 2 . Mutation du gène de la 5,10-méthyléne-tétrahydrofolate réductase (MTHFR)... 34
II . 1 . 3 . Mutation du gène de la méthylène-tétrahydrofolate deshydrogénase ... 35
II . 1 . 4 . Mutation du gène de la méthionine synthase (MTR) et la méthionine synthase réductase (MTRR) ... 35
II . 2 . Pathogenèse de l’hyperhomocystéinémie ... 36
II . 2 . 1 . Altération de la synthèse du N5-CH3 THF... 36
II . 2 . 2 . Altération de la reméthylation de l’homocystéine... 37
II . 2 . 3 . Cas de la transsulfuration défectueuse de l’homocystéine ... 37
III . 1 . Production d’un stress oxydant... 40
III . 2 . Production et métabolisme du NO ... 41
III . 3 . Prolifération cellulaire... 42
III . 4 . Matrice extracellulaire ... 42
D. L’ENZYME DE CONVERSION DE L’ANGIOTENSINE ... 44
I . Structure de l’enzyme de conersion de l’angiotensine (ACE) ... 44
II . Géne de l’ACE et son polymorphisme ... 45
II . 1 . Gène de l’ACE ... 45
II . 2 . Polymorphisme génétique de l’ACE... 45
III . Rôle de l’ACE dans le système rénine-angiotensine ... 47
III . I . Conception actuelle du système rénine angiotensine... 47
III . 2 . Rôle de l’ACE dans le système rénine-angiotensine. ... 47
IV . Lien entre polymorphisme de l’ACE et maladies cardiovasculaires ... 47
V . Mécanisme d’athérogénécité de l’ACE... 49
CHAPITRE II: MATERIEL ET METHODES I . Recrutement des patients ayant fait l’objet de cette étude ... 50
I . 1 . Critères d’éligibilité... 50
I . 1 . 1 . Groupe contrôle ... 50
I . 1 . 2 . Groupe pathologique ... 51
I . 2 . Critères de non-éligibilité ... 51
II . Examen clinique d’admission et détermination de facteurs de risque cardio-vasculaire ... 51
III . Prélèvements sanguins... 53
IV . Cathétérisme cardiaque et coronarographie ... 53
V . Dosages biochimiques ... 54
V . 1 . Automates ... 54
V . 2 . Réactifs... 55
V . 3 . Dosage du cholestérol total ... 55
V . 4 . Dosage des triglycérides ... 55
V . 5 . Dosage du cholestérol HDL... 56
V . 6 . Evaluation du cholestérol LDL... 56
V . 7 . Dosages des apolipoprotéines circulantes ... 56
V . 7 . 1 . Réactifs... 56
V . 7 . 2 . Mode opératoire ... 57
V . 8 . Dosage de la lipoprotéine (a) ... 57
V . 8 . 1 . Principe... 57 V . 8 . 2 . Contenu de l’emballage... 57 V . 8 . 3 . Réalisation du test ... 58 V . 8 . 4 . Caractéristiques du test... 59 V. 9 . Dosage de l’homocystéine ... 59 V . 9 . 1 . Principe... 59 V . 9 . 2 . Réactifs... 60 V . 9 . 3 . Protocole de réduction... 60
V . 9 . 4 . Réalisation de test immunoenzymatique... 61
VI . Extraction de l’ADN leucocytaire ... 62
VI . 1 . Echantillons biologiques ... 62
VI . 2 . Réactifs... 62
VI . 3 . 2 . Protéolyse... 62
VI . 3 . 3 . Extraction au phénol-chloroforme... 62
VI . 3 . 4 . Précipitation de l’ADN à l’éthanol absolu... 63
VI . 4 . Dosage de l’ADN et contrôle de qualité... 63
VII . Amplification des séquences nucléotidiques par PCR ... 63
VII . 1 . Réactifs utilisés... 64
VII . 2 . Analyse du polymorphisme A2756G de la MTR... 65
VII . 2 . 1 . Protocole de la PCR ... 65
VII . 2 . 2 . Contrôle du produit PCR ... 66
a) Préparation du gel de migration... 66
b) Electrophorèse... 67
VII . 2 . 3 . Digestion des fragments obtenus par HaeIII ... 67
VII . 3 . Analyse du polymorphisme A66G de la MTRR ... 67
VII . 3 . 1 . Réalisation de la PCR ... 68
VII . 3 . 2 . Digestion des fragments obtenus par AflIII... 68
VII . 4 . Analyse du polymorphisme A1298C de la MTHFR ... 69
VII . 4 . 1 . Réalisation de la PCR ... 69
VII . 4 . 2 . Digestion enzymatique par MboII ... 69
VII . 5 . Analyse du polymorphisme I/D de l’ACE... 70
VI . 5 . 1 . Réalisation de la PCR ... 70
VI . 5 . 2 . Vérification de l’amplification ... 71
VIII . Analyses statistiques ... 72
RESULTATS ET DISCUSSION a) Résultats... 76
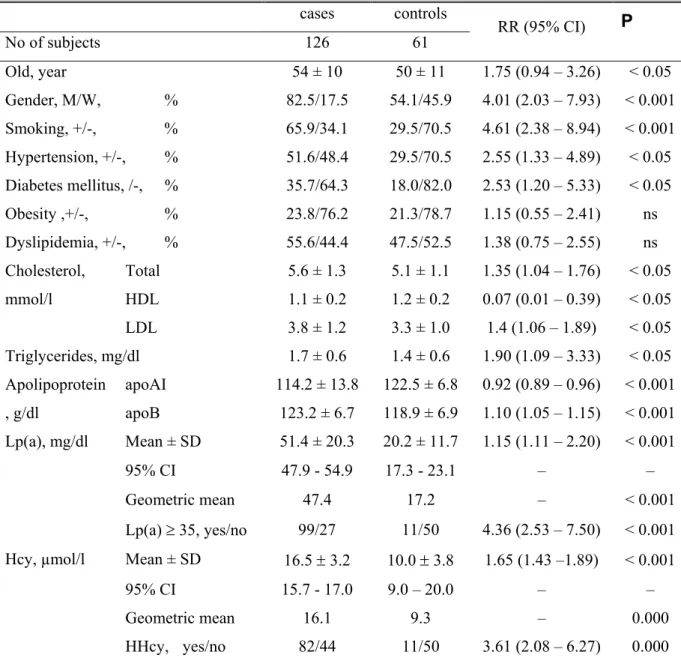
Résultats I : Recherche de l’Association entre l’Homocystéine, la Lipoprotéine (a) et l’Athérosclérose Coronarienne... 76
Résultats II : Influence du Polymorphisme A2756G de la Méthionine Synthase et A66G de la Méthionine Synthase Réductase sur la Concentration de l’Homocystéine et le Développement de l’Athérosclérose Coronarienne... 77
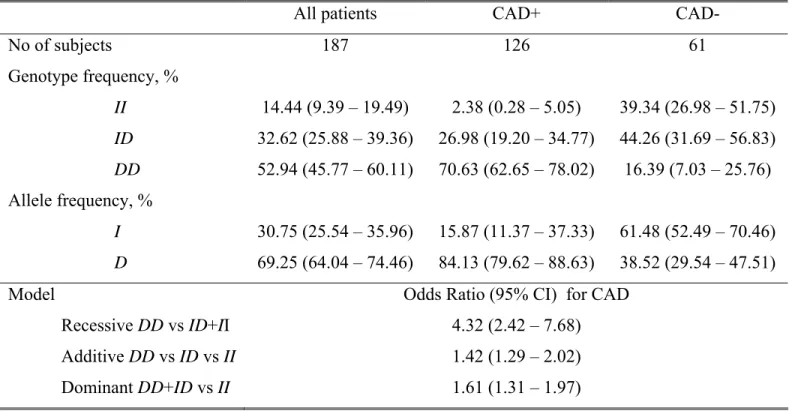
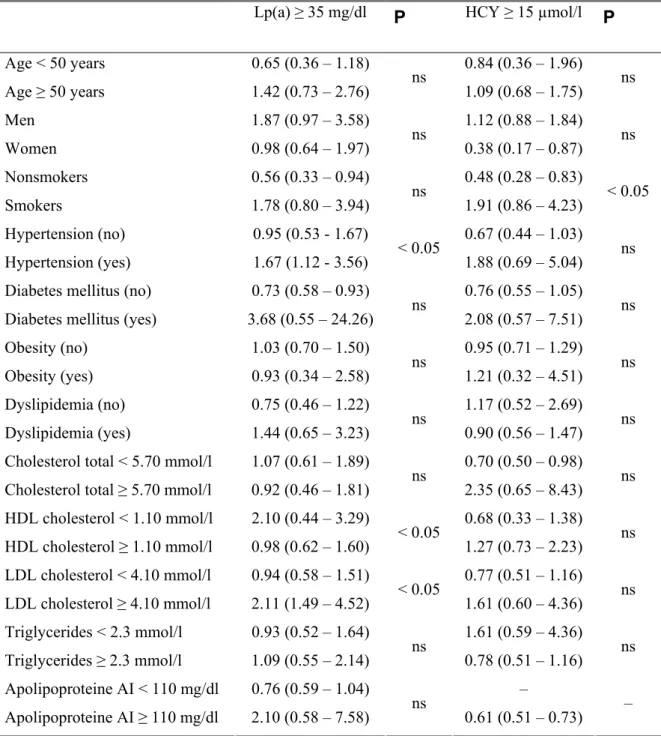
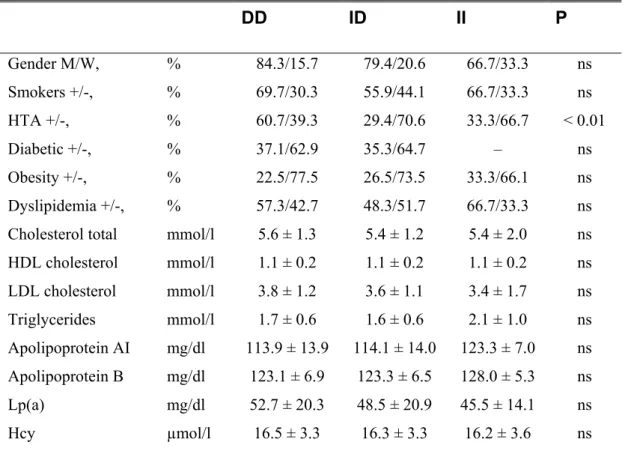
Résultats III : Lipoprotéine (a), Hyperhomocystéinémie, Polymorphisme I/D du Gène de l’ACE et Risque de l’Athérosclérose Coronarienne ... 78
Résultats IV : Anomalies de la Génétique Moléculaire de Reméthylation de l’Homocystéine : Etude des Polymorphismes A2756G de la MTR, A66G de la MTRR et A1298C de la MTHFR, et du Risque Coronarien ... 79
Résultats V : Implication du Polymorphisme Génétique de l’Apolipoprotéine E et de l’Enzyme de Conversion de l’Angiotensine dans l’Athérosclérose Coronarienne ... 80
b) Discussion ... 142
I) Recherche de nouveaux facteurs de risque de l’athérosclérose : La lipoprotéine (a) et l’homocystéine ... 144
II) Analyses des polymorphismes des gènes candidats de l’athérosclérose : polymorphisme du gène de la MTR, de la MTRR, de la MTHFR, et de l’ACE ... 157
CONCLUSIONS ... 175
RESUME... 179
AVANT-PROPOS
Les travaux présentés dans ce mémoire ont été réalisés dans le cadre d’une collaboration tripartite entre la Faculté des Sciences de Rabat, Université Mohamed V, la Ligue nationale de Cardiologie, et le Laboratoire de Biochimie Médicale, Unité de Génétique moléculaire, Groupe Hospitalier Pitié-Salpêtrière. Il a été mené sous la direction de Monsieur S. FELLAT, Médecin Biologiste, Responsable du Laboratoire de Biochimie et de Biologie Moléculaire de la Ligue Nationale de Cardiologie, de Madame F. BENKOUKA, Professeur de Biochimie avec la collaboration fructueuse et étroite de Monsieur A. RAISONNIER, Professeur Consultant auprès du Laboratoire de Biochimie Médicale, Unité de Génétique Moléculaire, Groupe Hospitalier Pitié-Salpêtrière.
Au terme de ce travail, il m’est très agréable de rendre hommage à tous ceux qui m’ont aidé, soutenu et supporté.
Qu’il me soit permis tout d’abord, d’adresser mes vifs remerciements à Monsieur le Professeur W. BENJELLOUN, Doyen de la Faculté des Sciences de Rabat, pour l’intérêt qu’il attache au développement de la recherche scientifique au sein de la Faculté. Je le remercie aussi de m’avoir fait l’honneur de présider cette thèse.
Je ne saurais jamais comment exprimer mon profond respect et toute ma gratitude envers Monsieur le Professeur M. BENOMAR, qui plus qu’un chef de service, fut pour moi un maître à penser. Il est toujours à l’écoute de celui qui cherche à s’instruire, à approfondir sa recherche intellectuelle et scientifique. Son humanisme n’est plus à prouver.
Je suis reconnaissant à Monsieur le Professeur A. BENJOUAD, Professeur de Biochimie à la Faculté des Sciences de Rabat, d’avoir accepté d’être l’un des rapporteurs de ce travail. Votre sérieux et votre modestie suscitent l’admiration. Vos qualités professionnelles et votre charisme m’ont beaucoup impressionnés. Je vous exprime ici, mes sentiments très respectueux et ma vive reconnaissance.
Listes des publications
Je remercie également et sincèrement Madame le Professeur F. BENKOUKA, Professeur de Biochimie qui m’a soutenu et guidé tout au long de ce travail. Sa compétence, son dynamisme et sa collaboration efficaces sont beaucoup dans la réalisation et l’aboutissement de ce travail. Je la remercie aussi pour avoir accepté d’être rapporteur de ce travail et de m’avoir honoré de sa présence dans mon jury.
Je tiens à remercier Monsieur le Docteur S. FELLAT, Responsable du Laboratoire Central de la Ligue Nationale de Cardiologie de m’avoir accueilli dans son laboratoire et confié le présent travail. Je souhaite lui exprimer ma reconnaissance pour la qualité de ses relations humaines et pour les discussions constructives que nous avons échangées tout au long de ce travail.
Je remercie très sincèrement Monsieur le Professeur M. TIJANE, Professeur de Biochimie à la Faculté des Sciences de Rabat, d’avoir aussi accepté de faire partie du jury de cette thèse. Je suis très sensible à l’honneur qu’il me fait aujourd’hui en acceptant de juger ce travail.
Je témoigne ma profonde reconnaissance à Monsieur le Professeur J-E. SRAIRI, Professeur de Cardiologie à la Faculté de Médecine, qui a bien voulu examiner mon mémoire de thèse puis me prodiguer conseils et suggestions très précieuses. Je le remercie aussi de bien vouloir accepter de faire partie du jury de cette thèse.
Mes vifs remerciements vont également à Monsieur le Professeur M-J. CHAPMAN, Directeur de l’unité 321 à l’INSERM; qui a bien voulu m’accueillir dans son laboratoire à Paris, pour un stage d’initiation aux techniques de Biologie Moléculaire. Sa disponibilité et sa clairvoyance scientifique ont beaucoup facilité la bonne marche de ce travail.
Je suis profondément reconnaissant à Monsieur le Professeur A. RAISONNIER, Professeur Consultant auprès du Laboratoire de Biochimie Médicale, Unité de Génétique Moléculaire, qui a dirigé une grande partie de ce travail, de la confiance qu’il a bien voulu m’accorder en m’accueillant dans ses laboratoires. Ses encouragements furent très
précieux et je ne saurais dire combien la perspective de la poursuite de cette collaboration me réjouit.
Je remercie Monsieur Le Docteur A. CARRIÉ, Responsable du Laboratoire de Biochimie Médicale A, Unité de Génétique Moléculaire, pour l’honneur qu’il m’a fait en acceptant de collaborer à ce travail mais également pour la confiance dont il m’honore. Son dynamisme et sa disponibilité m’ont beaucoup apporté. Je ne saurais assez dire l’honneur et le plaisir de travailler à ses côtés.
Je ne saurais oublier la collaboration technique de Monsieur J-P. LAGARDE, Ingénieur à l’INSERM, durant mon séjour au Laboratoire de Biochimie Médicale A, Unité de génétique Moléculaire, sa disponibilité et sa compétence m’ont beaucoup aidé, je lui exprime ici mes remerciements amicaux.
J’exprime ma vive reconnaissance à Mademoiselle A-S. COIFFARD pour son aide et sa participation à la mise au point des techniques de génotypage des enzymes de reméltylation de l’homocystéine au Laboratoire de Biochimie Médicale A, Unité de génétique Moléculaire.
Mes remerciements amicaux vont aussi à Madame le Professeur F. Saddiki, Docteur A. Benomar, Docteur N. El Kadiri, Docteur A. Jaffali, Docteur Y. Medkouri, Monsieur A. Allami et Mlle S. Benmoussa pour leurs conseils judicieux. Je leurs témoigne ma profonde gratitude.
Je ne peux oublier le soutien de mes amis et de mes collègues du service de Biochimie Médicale, Unité de Génétique Moléculaire et l’ensemble des techniciens du Laboratoire de Biochimie et de Biologie Moléculaire de la Ligue Nationale de Cardiologie, je leur exprime ici ma vive reconnaissance.
Listes des publications
LISTE DES PUBLICATIONS
Publications dans des revues internationales à comité de lecteur
LARAQUI A.; BENNOUAR N.; MEGGOUH F.; ALLAMI A.; EL KADIRI N.; BENKOUKA F.; AZEDDOUG H.; EL HAITEM N.; BENOMAR A.; FELLAT S.; BENOMAR M. (2002). Homocystéine, Lipoprotéine (a) : Facteurs de Risque de l’Athérosclérose Coronarienne. Ann Biol Clin 60 : 549-57.
LARAQUI A.; ALLAMI A.; CARRIE A.; COIFARD A-S.; BENKOUKA F.; BENJOUAD A.; BENDRISS A.; El KADIRI N.; BENNOUAR N.; BENOMAR A.; GUEDIRA A.; RAISONNIER A.; FELLAT S.; SRAIRI J-E.; BENOMAR M. (2005). Influence of Methionine Synthase (A2756G) and Methionine Synthase Reductase (A66G) Polymorphisms on Plasma Homocysteine Levels and Relation to Risk of Coronary Artery Disease. Acta Cardiol 60 (6) LARAQUI A.; ALLAMI A.; BENKOUKA F.; BENJOUAD A.; BENDRISS A.; El KADIRI N.; BENNOUAR N.; SRAIRI J-D.; BENOMAR A.; FELLAT S.; BENOMAR M. Hyperhomocystéinémie, Elevated Lipoprotein(a), and Angiotensin Converting Enzym (I/D) Gene Polymorphism Increase The Risk of CAD in Morocco. (soumis pour publication). LARAQUI A.; ALLAMI A.; CARRIE A.; COIFARD A-S.; BENKOUKA F.; BENJOUAD A.; BENDRISS A.; El KADIRI N.; BENNOUAR N.; BENOMAR A.; GUEDIRA A.; RAISONNIER A.; FELLAT S.; SRAIRI J-E.; BENOMAR M. Genetic Determinants of Plasma Homocysteine in Patients witn Angiographically Proven Coronary Artery Disease. (soumis pour publication).
BENNOUAR N.; ALLAMI A.; LARAQUI A.; AZEDDOUG H.; EL KADIRI N.; BENKOUKA F.; BENDRISS A.; GHANNAM R.; BENOMAR A.; FELLAT S.; BENOMAR M. (2004). Implication du polymorphisme génétique de l’apolipoprotéine E et de l’enzyme de conversion de l’angiotensine dans l’athérosclérose coronarienne. Ann Biol Clin 62 : 295-304
LISTE DES ABREVIATIONS
ACE Angiotensin Converting Enzyme ou enzyme de conversion de l’angiotensine
ADN Acide désoxyribonucléique ADNc ADN complémentaire
AGT1-RC Recpteur de l’angiotensinogène Ala Alanine
Alu 1 Séquences répétées Alu Apo Apolipoprotéine
Arg Arginine
Asp Acide aspartique
CβS cystathionine-β synthase c-fyn, c-myc,
c-jun, Homologue cellulaire de l’oncogène fyn, myc oujun ECTIM Etude Cas-Témoin de l’Infarctus du Myocarde EDRF Endothelium Derived Relaxing Factor
EDTA Ethylènediamine tétraacétate
EGF Epidermal Growth Factor ou facteur de croissance ET-1 Endothéline 1
FRCV Facteur de risque cardiovasculaire
HDL High Density Lipoprotein ou lipoprotéine de haute densité HDL-C HDL-cholestérol
HMGCoA Hydroxyméthylglutaryl coenzyme A HTA Hypertension artérielle
IEC Inhibiteur de l’enzyme de conversion de l’angiotensine LDL Low-Density Lipoprotein ou lipoprotéine de basse densité LDL-c LDL-cholestérol
Lp(a) Lipoprotéine (a) LPL Lipoprotéine lipase Lys Lysine
Listes des abréviations
MAP/ERK Mitogen Activated Kinase/Extracellular signal Regulated Kinase MTHFR Méthylène-tétrahydrofolate réductase
MTR Méthionine synthase
MTRR Methionine synthase reductase
NFкB Nuclear-factor кB (facteur de transcription) NO Monoxyde d’azote
NOS No-synthase
PAI Plasminogen Activator Inhibitor ou inhibiteur de l’activateur du plasminogène
PDGF Platelet Derived Growth Factor ou facteur de croissance des plaquettes SAM S-adénosyl méthionine
SAH S-adénosylhomocystéine SRA Système rénine-angiotensine SRF Serum Reponse Factor tHcy Homocystéine
TNF Tumor Necrosis Factor ou facteur tumorale nécrosant
t-PA Tissue Plasminogen Activator ou activateur du plasminogène tissulaire Val Valine
INTRODUCTION
Les maladies cardiovasculaires (MCV), au premier rang desquelles les cardiopathies ischémiques et les accidents cérébro-vasculaires, constituent la première cause de mortalité et de morbidité dans les pays occidentaux. L’Organisation Mondiale de la Santé (OMS) prédit qu’elles constitueront aussi la première raison d’handicaps et de décès dans de très nombreux pays à la fin de la décennie. Ce fléau représente l’une des conséquences directes de l’augmentation dramatique du diabète de type II et des syndromes métaboliques à travers le monde, et de nos difficultés à lutter efficacement contre les principaux facteurs de risque "environnementaux"- tabagisme et déséquilibre alimentaire pour ne citer que les plus importants.
L’athérosclérose est une composante-clé de ces maladies. C’est une maladie polygénique et multifactorielle accompagnée de deux complications graves, l’infarctus du myocarde et l’atteinte des artères cérébrales.
De nombreuses études ont actuellement très bien établi la pluralité des désordres pouvant entraîner l’apparition d’athérosclérose. Parmi ces facteurs, la lipoprotéine (a) [Lp(a)] a été identifiée comme un facteur de risque majeur et indépendant d’athérosclérose. Cette lipoprotéine a été considérée à l’origine comme une forme polymorphe des LDL. Elle est composée d’esters de cholestérol, d’une molécule d’apolipoprotéine B100 et de l’apolipoprotéine (a). La Lp(a) possède une forte homologie avec le plasminogène du fait de son marqueur protéique spécifique: l’apolipoprotéine (a). Le risque cardiovasculaire pourrait être lié à son activité antifibrinolytique par compétition avec le plasminogène.
L’observation des cas rares d’homocystinuries, associant hyperhomocystéinémie et hyperhomocystinurie a mis en évidence le rôle délétère d’une élévation de l’homocystéine
Introduction
en pathologie vasculaire. L’homocystéine, acide aminé soufré, est un produit intermédiaire du métabolisme de la méthionine. Elle est catabolisée par deux voies principales: transsulfuration et reméthylation. Un déficit génétique en certaines enzymes impliquées dans l’une ou l’autre de ces voies métaboliques peut être à l’origine d’une hyperhomocystéinémie d’importance variable. Ainsi, le profil génétique, en l’occurrence l’existence de polymorphismes génétiques des enzymes du métabolisme de l’homocystéine, semble jouer un rôle prédominant dans l’hyperhomocystéinémie et/ou dans l’étiologie de l’athérosclérose. La relation entre polymorphismes génétiques des enzymes de la reméthylation de l’homocystéine et l’apport alimentaire des vitamines cofacteurs est l’un des meilleurs exemples de l’effet interactif entre facteurs génétiques et facteurs environnementaux.
Le polymorphisme d’insertion/délétion (I/D) du gène de l’enzyme de conversion de l’angiotensine (ACE) serait lié à la coronaropathie ischémique dans notre population. L’ACE est une enzyme clé du système rénine angiotensine. Elle est impliquée dans le métabolisme de deux peptides vasoactifs: l’angiotensine (II) (un puissant vasoconstricteur ) et la bradykinine (à activité vasodilatatrice). L’ACE pourrait donc, en modulant la synthèse de l’angiotensine II et la dégradation de la bradykinine, participer activement au développement de l’athérosclérose, au contrôle de la vasomotricité et à la thrombose vasculaire.
Dans la première partie de notre travail, nous ferons une revue de la littérature sur l’athérosclérose coronarienne, la lipoprotéine (a), l’homocystéine ainsi que sur la génétique moléculaire de sa reméthylation, et l’enzyme de conversion de l’angiotensine. Nous analyserons plus longuement les travaux cliniques et expérimentaux menés au sein de populations souffrant d’athérosclérose. Enfin, nous ferons un bref rappel des facteurs de
risque cliniques et biologiques des MCV dont nous nous sommes servis pour définir les caractéristiques de notre population.
Dans la seconde partie de notre travail, nous décrirons les travaux réalisés ainsi que les résultats obtenus tout au long de ce travail.
Enfin une troisième et dernière partie sera consacrée à une discussion des résultats de nos travaux.
Athérosclérose
A . ATHEROSCLEROSE
L’athérosclérose est un processus pathologique dynamique qui se développe sur de nombreuses années. Elle est caractérisée par des lésions vasculaires inflammatoires et prolifératives. C’est une maladie focale et non diffuse de l’intima qui touche les artères de gros et moyen calibre, principalement au niveau des zones exposées à des forces de cisaillement importantes (courbures des artères, bifurcations vasculaires).
I . Description de l’athérosclérose
La formation de la plaque d’athérosclérose se divise schématiquement en plusieurs étapes (figure 1) : apparition de lésions minimes (stries lipidiques), progression silencieuse de la maladie vers l’athérome et enfin formation de plaques fibrolipidiques qui peuvent conduire à des complications aiguës et à des symptômes cliniques (rupture de la plaque et thrombose).
Les stries lipidiques sont caractérisées par la présence au niveau de l’intima de macrophages, dits spumeux. Des cellules musculaires provenant de la média, enrichies en cholestérol, sont également présentes. Ces stries lipidiques peuvent apparaître très tôt. Elles sont orientées dans le sens du flux sanguin et forment un léger épaississement dans la lumière de l’artère. La progression vers l’athérome se caractérise par l’accumulation de lipides extra-cellulaires au niveau des stries lipidiques. Enfin, l’athérome peut évoluer vers la formation de plaques fibrolipidiques où le noyau lipidique est recouvert d’une chape fibreuse. Cette chape est constituée de tissu conjonctif et de cellules musculaires lisses (CML). Le cœur de la plaque, constitué de lipides extra-cellulaires et entouré de cellules spumeuses gorgées de cholestérol, est séparé de la média par des CML qui ont proliféré. Le tout s’accompagne de phénomènes inflammatoires avec infiltration de lymphocytes et de
monocytes. L’athérome peut s’étendre en profondeur vers la média ou devenir protubérant dans la lumière artérielle lorsque les capacités d’adaptation de la média sont dépassées. Dans certaines lésions, le calcium remplace le noyau lipidique et rigidifie la déformation vasculaire. Ces lésions calcifiées apparaissent plus fréquemment chez les sujets âgés.
II . Complication de la plaque d’athérosclérose
Dans les cas les plus extrêmes, la plaque peut se fissurer, déclenchant ainsi une série d’évènements thrombotiques. Le thrombus formé peut être incorporé à la plaque et participer à sa croissance. Quand ce processus se répète, il peut entraîner un occlusion progressive des artères de moyen calibre. Enfin, dans certains cas, la rupture de la plaque peut entraîner une occlusion artérielle et donne lieu à des symptômes cliniques (infarctus, accident vasculaires cérébral).
La rupture de la plaque met le sang en contact avec l’espace sous-endothélial, permettant au facteur Von Willebrand plasmatique de se lier au collagène de la matrice extra-cellulaire. Les plaquettes vont ensuite se lier au facteur Von Willebrand par l’intermédiaire de leurs glycoprotéines membranaires. Les plaquettes s’accumulent alors autour de la lésion, s’agrègent et sont stabilisées par la formation d’un réseau de fibrine, qui se lie aux plaquettes par l’intermédiaire de leur glycoprotéines.
Parallèlement, la coagulation peut être activée par la liaison du facteur VII plasmatique au facteur tissulaire présent à la surface des macrophages et des cellules musculaires, très abondants au niveau de l’athérome.
III . Physiopathologie de la plaque d’athérosclérose
Athérosclérose
actuelle est d’essayer de rapprocher les deux hypothèses principales: l’hypothèse lipidique et l’hypothèse de la lésion endothéliale
L’élévation du taux des LDL serait capable d’entraîner une lésion fonctionnelle de l’endothélium elle-même à l’origine d’une augmentation de la perméabilité endothéliale avec pénétration accrue des LDL dans l’espace sous endothélial. Elle peut être à l’origine d’une adhésion et d’une agrégation plaquettaires avec synthèse de facteur de croissance plaquettaire (PDGF) et prolifération des cellules musculaires lisses qui migrent de la média vers l’intima, se multiplient et synthétisent les éléments de la matrice extra-cellulaire constituant la partie fibreuse de la plaque.
Les LDL subissent une oxydation à l’intérieur de la paroi artérielle. Ces LDL modifiées ou oxydées sont captées de façon préférentielle par les monocytes-macrophages à l’origine de cellules spumeuses. Les fibres musculaires lisses peuvent également se transformer en cellules spumeuses par captation de ces même LDL oxydées
Outre la concentration élevée de LDL dans le sang, les différents éléments pouvant être à l’origine de l’altération endothéliale, pourraient être :
- Le simple vieillissement de la paroi artérielle
- Différents types de traumatisme, comme l’hypertension artérielle, les turbulences sanguines pouvant expliquer la localisation préférentielle des lésions au niveau des bifurcations ou des courbures.
- Une agression inflammatoire, virale, ou immunologique. IV . Epidémiologie et facteurs de risque
Dans la mesure où l’épidémiologie de l’athérosclérose ne peut reposer que sur des études anatomo-pathologiques ou artériographiques, la plupart des données épidémiologiques dont nous disposons concernent plus les complications de
l’athérosclérose que l’évolution anatomique de lésions. Toutefois, toutes ces études n’ont pu mettre en évidence une cause univoque ni de la formation de la plaque d’athérosclérose ni du mécanisme de survenue des complications. Elles ont par contre permis d’individualiser un certain nombre de variables prédictives, variables qu’il est convenu d’appeler facteurs de risque de l’athérosclérose. Parmi les facteurs de risque identifiés pour l’athérosclérose, la lipoprotéine (a), l’homocystéine, l’enzyme de conversion de l’angiotensine. .
Lipoprotéine (a)
B . LIPOPROTEINE (A)
Les lipoprotéines plasmatiques humaines sont des assemblages plurimoléculaires de lipides et de protéines, appelées apolipoprotéines, ayant pour fonction d’assurer le transport et le métabolisme du cholestérol et des lipides. Les classes de lipoprotéines sont définies dans le tableau 1. Parmi celles-ci figure la lipoprotéine (a) ou Lp(a).
I . Caractéristiques physico-chimiques
Découverte par Berg en 1963 (Berg, 1963), la Lp(a) est une lipoprotéine dont la composition lipidique, très riche en ester de cholestérol, est semblable à celle des LDL. La Lp(a) contient également la protéine majoritaire des LDL, l'apolipoprotéine B100 (apoB100), mais se distingue de celles-ci par la présence d'une glycoprotéine de haut poids moléculaire, l'apolipoprotéine(a) [apo(a)]. Ces deux protéines sont liées de façon covalente par un pont disulfure.
Bien que la Lp(a) et les LDL soient des lipoprotéines de composition très voisine, on les distingue par un ensemble de propriétés physico-chimiques. Leur mobilité électrophorétique sur gel d'agarose est différente [migration β pour les LDL et pré-β pour la Lp(a)], ainsi que leur densité hydratée. Les LDL sont isolées par ultracentrifugation séquentielle dans le spectre de densité 1,019-1,063 g/ml, tandis que la Lp(a) est retrouvée dans la zone de densité 1,050 - 1,12 g/ml. Toutefois, l'apo(a) est une protéine dont la taille est très variable. Ce polymorphisme de taille influence le rapport protéine/lipide de la Lp(a) et la densité hydratée moyenne de celle-ci est légèrement variable. L'observation de la Lp(a) par cryomicroscopie électronique montre que cette particule est d'aspect plutôt sphérique, en conformité avec le modèle général des lipoprotéines (Sines et al., 1994). Son diamètre apparent
(220-270 Å) est légèrement supérieur à celui des LDL (200-250 Å).
Le traitement de la Lp(a) par des agents réducteurs, permet d’isoler l’apo(a) de la partie lipoprotéique contenant l’apoB100, appelée Lp(a-). L’apo(a) obtenue présente peu d’affinité pour les lipides. La particule Lp(a-) possède une composition chimique très proche de celle des LDL. Sa densité hydratée, sa mobilité électrophorétique sur gel d’agarose, son spectre de dicroïsme circulaire sont similaires à ceux des LDL. La composition en acides aminés ainsi qu’en sucres de l’apoB100 de la Lp(a-) est identique à celle de l’apoB100 des LDL (Gaubatz et al., 1987, Fless et al., 1984). Ces résultats présentent la Lp(a) comme une LDL à laquelle serait attachée l’apo(a). II . Composantes structurales
II . 1 . L’apolipoprotéine B100 (apo B100)
L’apoB100 est synthétisée et secrétée par le foie sous forme de VLDL. Sa structure fait apparaître de nombreuses régions hydrophobes permettant à l’apo B100 d’interagir fortement avec les lipides. La fonction physiologique majeure de l’apoB100 réside dans son interaction avec le récepteur apo B/E, qui joue un rôle essentiel dans l’épuration plasmatique des LDL. L’apoB100 est impliquée dans la liaison des VLDL et des LDL avec la lipoprotéine lipase (Choi et al., 1995).
Le gène de l’apoB100 est localisé dans la région p23-24 du chromosome 2 (Chan et al., 1985) et s’étend sur une longueur de 43kb (Blackhart et al., 1986). Ce gène code pour une protéine de 4536 acides aminés (PM = 513 kDa) qui après l’apo(a), est la plus grande des apolipoprotéines.
La conformation de l’apoB100 dans la Lp(a) présente certaines différences avec celle des LDL et est influencée par son association avec l’apo(a) (Chen et al., 1994; Galeano et al., 1994).
Lipoprotéine (a)
II . 2 . L’apolipoprotéine apo(a) II . 2 . 1 . Composition et structure
L’apo(a) est une glycoprotéine originale autant par sa structure primaire que par sa richesse en structures glycosidiques. L’analyse de la composition de l’apo(a) montre la présence de certains acides aminés en quantités très inhabituelles comparativement à l’apoB, particulièrement la richesse en arginine et en proline. Cette composition particulière en acides aminés explique d’ailleurs la richesse de l’apo(a) en structures secondaires de type désordonné et le faible taux de structure en hélice α et en feuillets β (Gaubatz et al., 1993).
Les premières informations concernant la séquence polypeptidique et la conformation spatiale de l’apo(a) ont été fournies par l’étude de l’ADN complémentaire (ADNc) de l’apo(a), réalisée en 1987 par McLean et al., (1987) (figure 3), révélant une très importante homologie de structure entre l’apo(a) et le plasminogène. L’apo(a) comporte un domaine formé de "kringles" et un domaine protéasique.
II . 2 . 2 . Le domaine des kringles
Les kringles sont des structures polypeptidiques de 110 à 120 acides aminés caractérisées par la présence de six résidus cystéine liés deux à deux sous forme de ponts disulfures, permettant à la séquence polypeptidique de prendre une forme en triple boucle. Ces kringles sont retrouvés dans la structure de protéines impliquées dans les processus physiologiques de la coagulation et de la fibrinolyse et particulièrement les protéases à sérine (Loscalzo et al., 1990) .
La majorité des kringles de l’apo(a) ont été appelés kringle 4 (K4) car ils présentent une très forte homologie de séquence avec le quatrième des cinq kringles du plasminogène. L’apo(a) contient également une copie du kringle 5 et du domaine
protéasique du plasminogène. Il existe dans l’apo(a) dix type de kringles K4 qui sont similaires, mais qui ne sont pas strictement homologues entre eux. Le premier est dit de type 1 (K4-1), suivi de 28 kringles 4 de type 2A et 2B (K4-2), puis de 8 kringles 4 différents (K4-3 à K4-10). Tous ces kringles précèdent le kringle 5 et le domaine protéasique. Les K4-2A et K4-2B différent l’un de l’autre par trois substitutions nucléotidiques silencieuses.
Les kringles 4 de l’apo(a) sont séparés les uns des autres par environ 36 résidus d’acides aminés. Ces régions dites inter-kringles sont très riches en proline ce qui introduit de nombreuses structures désordonnées dans l’apo(a).
II . 2 . 3 . Le domaine protéasique
La structure primaire de l’apo(a) indique également la présence d’un domaine protéasique de 236 aminoacides, présentant une homologie de plus de 85% avec celui du plasminogène: on y retrouve notamment les trois amino-acides constituant la triade catalytique spécifique des protéases à sérine. Cependant l’arginine (Arg4329), dont le clivage est indispensable à l’activation du plasminogène, est remplacée par un résidu sérine dans l’apo(a): cette substitution empêche l’activation du domaine protéasique de l’apo(a).
L’étude de la liaison de l’apo (a) à la lipoparticule de type lipoprotéine de faible densité a permis à Huby et al. (1997) de proposer l’existence de deux domaines fonctionnels distincts au sein de la Lp(a). le domaine C-terminal de l’apo(a) assurait la liaison à l’apo B par l’intermédiaire d’un pont disulfure mais également par des liaisons non covalentes établies entre les deux apolipoprotéines (Huby et al., 1997). Le second domaine , N-terminal, ne serait pas lié à l’apo B et serait de taille variable selon l’isoforme de l’apo(a).
Lipoprotéine (a)
III . Gène de l’apo(a) et polymorphisme de taille III . I . Structure du gène de l’apo(a)
Le gène de l’apo(a) est localisé dans la région télomérique q26-27 du chromosome 6(6q27) à proximité du gène du plasminogène (Frank et al., 1988). Il possède quatre domaines structuraux (figure 4): une séquence signal (S) pratiquement identique à celle du plasminogène, une région contenant de multiples copies de la séquence répétitive K4 permettant le codage des kringles de types 4, une copie unique du kringle 5 assurant le codage du K5, et la région codant pour le domaine protéasique. Tous les allèles de l’apo(a) contiennent au moins une copie de chaque K4, suggérant que ces différents types de K4 ne sont pas fonctionnellement identiques (Guevara et al., 1993; Scanu et al., 1993), mais seuls les K4-2 sont présents en nombre variable sur les différents allèles, conférant un polymorphisme à la molécule d’apo(a) (Lackner et al., 1993). Il est probable que l’association de recombinaisons homologues multiples et d’échanges inter- et intra-chromosomiques sont responsables de répétition de ces séquences au sein du gène.
III . 2 . Polymorphisme de taille
Uterman et al. (1987) furent les premiers à mettre en évidence le polymorphisme de taille de l’apo(a) au niveau protéique. Ils caractérisèrent six isoformes d’apo(a), de masses moléculaires apparentes allant de 400 à 700 kDa, par électrophorèse sur gels SDS-PAGE. L’enzyme de restriction Hpal clive le gène de l’apo(a) juste en amont du K4-1 et au milieu de la séquence codante pour le K4-4, libérant un fragment d’ADN génomique contenant le K4-1, les K4-2, le K4-3 et le premier exon du K4-4. L’analyse de ce fragment dans une population de 424 individus non reliés, par électrophorèse en champ pulsé, a montré que sa taille est variable par multiple de 5,5 kb et est comprise entre 28 et 250 kb (Lackner et al., 1991; Lackner et al., 1993). Les kringles
K4-1 et K4-3 à K4-10 sont présents en une copie unique dans chaque apo(a) (Lackner et al., 1993 ; Vanderhoek et al., 1993).
Le gène de l’apo(a) est donc de taille variable et ce polymorphisme de taille est dû à une variation du nombre de séquences codant pour les kringles répétés K4-2A et 2B.
La taille du fragment de digestion HpaI du gène de l’apo(a) est en étroite corrélation avec la mobilité de l’isoforme d’apo(a) en gel d’agarose. Le nombre variable de K4-2 au niveau génomique explique le polymorphisme de taille de l’apo(a) observé au niveau de la protéine (Marcovina et al., 1996). Comme au niveau protéique, un total de 34 allèles d’apo(a) de tailles différentes ont été caractérisés, l’allèle de plus petite taille codant pour 12 K4 (le K4-1, 3 K4-2 suivis de K4-3→K4-10) et le plus grand code pour 51 K4. Tous les allèles d’apo(a) ne sont pas représentés ou n’ont pas encore été identifiés puisqu’il existe un manque entre les allèles contenant de 43 à 51 K4 (Lackner et al., 1993).
Ce polymorphisme de taille fait de l’apo(a), l’une des protéines les plus polymorphes connues à ce jour.
IV . Métabolisme de la Lp(a) IV . 1 . Biosynthèse
IV . I . I . Synthèse de l’apo(a)
Le foie est le lieu principal de la synthèse d’apo(a) (Kraft et al. 1989). l’apo(a) est synthétisée sous forme d’un précurseur de faible masse moléculaire, qui subit d’importantes modifications post-traductionnelles. Le temps de séjour de l’apo(a) au sein du réticulum endoplasmique semble directement lié à la taille de l’isoforme synthétisée. Le temps de maturation est plus long pour les isoformes de plus grande
Lipoprotéine (a)
plus faible. Les formes non matures étant retenues et dégradées au niveau-même du réticulum, l’existence de ce processus de maturation partielle expliquerait la moindre sécrétion par les hépatocytes des isoformes d’apo(a) de grande taille, ainsi la relation statistique inverse observée entre la taille de l’apo(a) et la concentration sérique de la Lp(a). Rader a d’ailleurs montré chez des sujets hétérozygotes que le taux de production de la plus petite isoforme est en moyenne double de celui de la plus grande (Rader et al., 1994). Certaines variations de séquence de l’apo(a) liées à des mutations ponctuelles rendraient impossible l’étape de maturation au niveau du réticulum endoplasmique et la protéine néo-synthétisée serait alors immédiatement dégradée. Ce concept remet en cause l’hypothèse de l’allèle "nul" de l’apo(a) formulée par Utermann pour expliquer les concentrations indétectables de la Lp(a) chez certains sujets (Utermann et al., 1987).
IV . I . 2 . Lieu d’assemblage de la Lp(a)
Deux modes de formation de la particule Lp(a) sont proposés. L’apo(a) serait secrétée sous forme libre par les cellules hépatiques, puis s’associerait ensuite à l’extérieur de la cellule avec des LDL pour former une particule Lp(a) (assemblage extra-cellulaire). Le deuxième mode correspondrait à l’association de l’apo(a) à l’apoB100 de façon covalente à l’intérieur de la cellule, puis ce complexe serait sécrétée par l’hépatocyte sous forme d’un précurseur ou de Lp(a) mature (assemblage intra-cellulaire). L’hypothèse d’un assemblage extra-cellulaire de la Lp(a) est celle qui est étayée par le plus grand nombre de données expérimentales, aussi bien in vivo qu’in vitro et qui, à l’heure actuelle est la plus probable (Ernst et al., 1995; White et Lanford, 1994) . La figure 5 résume toutefois les différents modes d’assemblage décrits.
IV . 2 . Catabolisme
En raison de la présence d’une molécule d’apoB au sein de la Lp(a), l’implication de la voie du récepteur B/E dans le catabolisme de cette lipoprotéine a été très étudiée. Cependant, Les résultats de ces études sont contradictoires, indiquant soit l’absence d’interaction de la Lp(a) avec ce récepteur (Rader et al., 1995), soit une interaction avec une plus faible affinité que celle des LDL (Snyder et al., 1994), soit au contraire un rôle important des récepteurs B/E dans le catabolisme de la Lp(a) (Mims et al., 1994).
D’autres voies de catabolisme de la Lp(a) ont été proposées, impliquant la voie des fibroblastes (Kostner et Grillhofer, 1994). Un processus de pinocytose, permettant l’influx des lipoparticules de Lp(a) de la circulation systématique vers l’intima vasculaire où elle serait dégradée, a été suggéré. En fin, la lipoprotéine lipase pourrait également jouer un rôle dans le catabolisme de la Lp(a) (Williams et al., 1993).
L’élimination urinaire de fragments de l’apo(a), correspondant à sa partie N-terminale, a été montrée (Kostner et al., 1996).
V . Athérogènéicité de la Lp(a)
V . 1 . Mécanismes moléculaires pathogènes de la Lp(a)
Les mécanismes moléculaires par lesquels les LDL participent au développement de l’athérome sont assez bien décrits (Berliner et al., 1995). La Lp(a) ne différant des LDL que par la présence de l’apo(a), son effet pathogène peut s’exercer par des mécanismes similaires à ceux décrits pour les LDL. L’un des mécanismes les plus importants au cours des premières étapes de l'athérogénèse est l'infiltration des lipoprotéines plasmatiques à travers l'endothélium et surtout leur rétention au sein de la paroi artérielle (Schwenke et Carew, 1989). Leur influx dépend de leur concentration et de leur taille. Les LDL , une fois dans l'intima, se lient aux
Lipoprotéine (a)
glycoaminoglycanes et s'accumulent ainsi au niveau de la matrice extra-cellulaire. Non protégées par les anti-oxydants plasmatiques, elles subissent alors des modifications oxydatives de leurs lipides et de l'apo B100. Ces LDL oxydées vont contribuer à augmenter l'adhésion des monocytes circulants et des lymphocytes T à l'endothélium et leur infiltration dans l'espace sous-endothélial. Un site inflammatoire se crée, avec une accumulation lipidique intra-cellulaire et extra-cellulaire de plus en plus importante. L'épuration des LDL oxydées de l'intima est normalement assurée par le récepteur "Scavenger" (ou éboueur) des macrophages ou des cellules musculaires lisses activées (Dejager et al., 1993). Ce récepteur "Scavenger" n'est pas rétro-régulé par la charge intra-cellulaire de cholestérol (comme le récepteur LDL). Au niveau de l'athérome, les macrophages vont progressivement accumuler des lipides dans leur cytoplasme et se transformer en cellules spumeuses contenant des gouttelettes d'esters de cholestérol, puis après mort cellulaire par surcharge en cholestérol, vont participer à la formation du centre nécrotique de l'athérome.
V . 2 . Localisation de la Lp(a) dans la plaque d’athérome
La Lp(a), comme les LDL, est détectable dans la paroi artérielle, principalement associée aux lésions athérosclérotiques. Reblin et al., (1995) ont extrait une quantité de Lp(a) deux fois plus importante, à partir du tissu aortique, avec des lésions que d’aortes saines. L’analyse du contenu en apo(a) dans la paroi artérielle à différents stades de développement de l’athérome montre que l’apo(a) est présente dans les lésions dès les premiers stades (stries lipidiques) et en quantité supérieure par rapport à un tissu sans lésions. Au niveau des artères coronaires, plus la lésion est avancée, plus l’accumulation d’apo(a) est importante (Niendorf et al., 1990). La concentration d’apo(a) dans la paroi artérielle est corrélée à la concentration plasmatique de Lp(a) (Pepin et al., 1991; Smith et Cochran, 1990). Rath et al., (1989)
ont quantifié l’apo(a) dans 107 biopsies de tissu aortique. Ils ont montré que les patients ayant un taux de Lp(a) supérieur à 0,25mg/ml accumulent l’apo(a) ou l’apo(a) liée à l’apo B100 en quantité trois à quatre fois plus importante en moyenne que les individus avec une concentration de Lp(a) inférieure à 0,25mg/ml.
L’apo(a) s’accumule dans la paroi artérielle préférentiellement au niveau de l’intima. Elle n’est pas détectable au niveau de la média. Dans les lésions athérosclérotiques, l’apo(a) est associée principalement aux structures fibreuses extra-cellulaires, mais elle peut également être détectée dans les cellules spumeuses (Niendorf et al., 1990). Dans la paroi artérielle saine, la majorité de l’apo(a) peut être extraite sous forme de Lp(a), par contre l’extraction faite à partir d’artères présentant des lésions athérosclérotiques montre que l’apo(a) est présente à la fois sous forme de Lp(a) mais également sous forme libre non associée à la particule lipidique (Reblin et al., 1995). Dans certains cas, l’apo(a) extraite des lésions a été retrouvée sous forme dégradée (Hoff et al., 1994).
V . 3 . Interaction de la Lp(a) avec les composants de la matrice extra-cellulaire Plusieurs mécanismes peuvent contribuer à la rétention de la Lp(a) dans l’intima artériel et plus spécifiquement dans la plaque d’athérome. La Lp(a), comme cela est décrit pour les LDL, pourrait se lier aux glycoaminoglycanes (GAG) ou protéoglycanes (PG) de la matrice extra-cellulaire. La Lp(a) possède en effet une affinité pour ces composants, qui semble supérieure à celle des LDL. In vitro, la Lp(a) forme avec les PG ou les GAG des complexes insolubles en présence de calcium dans un rapport lipoprotéine/glycane 3-4 fois supérieur à celui obtenu avec les LDL.
In vitro, la Lp(a) se lie à la fibronectine par l’intermédiaire de son apo(a) (Ehnholm et al., 1990; Vanderhoek et al., 1994). La fibronectine est un des constituants importants de la matrice extra-cellulaire et pourrait également constituer
Lipoprotéine (a)
une voie de rétention de la Lp(a) dans l’intima. Au cours de la formation de la plaque d’athérome, la synthèse de la matrice extra-cellulaire par les cellules musculaires lisses est augmentée. Le collagène va s’accumuler dans les lésions ainsi que les différents types de protéoglycanes et la fibronectine. Cette synthèse accrue pourrait participer à l’accumulation progressive de la Lp(a) au sein de l’athérome.
Dans les plaques d’athéromes plus avancées, la Lp(a) peut se lier à la fibrine ou à ses produits de dégradation qui se sont accumulés au niveau de la plaque après l’incorporation d’un thrombus (appelés thrombi-muraux). Par immunohistochimie, une co-localisation de l’apo(a) et de la fibrine a notamment été mise en évidence au niveau d’une plaque fibreuse d’aorte humaine (Beisiegel et al., 1990). Par ailleurs, des quantités importantes de Lp(a) peuvent être éluées de thrombi muraux par l’acide ε-amino-n-caproïque (l’ε-ACA), suggérant une association spécifique de la Lp(a) à la fibrine (Smith et Crosbie, 1991).
C . HOMOCYSTEINE
I . Origine et métabolisme de l’homocystéine
L’homocystéine est un acide aminé soufré provenant de la déméthylation de la méthionine, elle-même apportée par les protéines alimentaires. L’homocystéine existe dans l’organisme sous différentes formes : homocystéine, homocystine (constitué de deux résidus d’homocystéine réunis par un pont disulfure), et disulfure mixte : homocystéine-cystéine (Jacobsen et al., 1998; Refsum et al., 1998).
Dans le plasma, 70% de l’homocystéine sont liés aux protéines par des ponts disulfures. L’homocystéine dite libre est essentiellement représentée par les disulfures mixtes.
I . 1 . Voies de synthèse et de dégradation
L’homocystéine est un métabolite intermédiaire issu de la déméthylation de la méthionine alimentaire. La première étape du métabolisme de la méthionine consiste en sa conversion par la méthionine-adénosyl-transferase en S-adénosyl-méthionine (SAM) qui est considérée comme étant le principal donneur de radicaux méthyls dans de nombreuses réactions. Toutes les transméthylations effectuées par la SAM aboutissent à la formation de S-adénosyl-homocystéine (SAH) qui est hydrolysée en homocystéine et adénosine grâce à l’action catalytique de la SAH hydrolase. L’homocystéine est ensuite reméthylée en méthionine par la voie de la reméthylation ou transformée en cystéine par la voie de la transsulfuration (figure 6).
La reméthylation de l’homocystéine est catalysée par la méthionine synthase qui requiert le 5-méthyltétrahydrofolate (5-CH3 THF) comme donneur de méthyle et la vitamine B12 comme cofacteur. La formation du 5-CH3 THF dépend de la N 5,10 méthylènetétrahydrofolate réductase (MTHFR) qui catalyse la réduction de 5,10-CH2
Homocystéine
folates et de la cobalamine utilise la conversion de la bétaїne en N,N-diméthylglycine sous l’action de la bétaїne homocystéine méthyl-transférase, principalement dans le foie. Cette voie permet de maintenir la concentration tissulaire en méthionine à un niveau suffisant pour assurer la synthèse de la SAM en cas d’une déficience en folates. La SAH, formée dans les réactions de méthylation, est ensuite hydrolysée en homocystéine, qui devient disponible pour démarrer un nouveau cycle de transfert de méthyle. L’hydrolyse de la SAH est une réaction réversible, préférentiellement orientée vers la synthèse de SAH et des concentrations cellulaires élevées de SAH précédent et accompagnent toutes les formes d’hyperhomocystéinémie.
Dans la voie de transsulfuration, l’homocystéine se condense avec la sérine pour donner la cystathionine sous l’action de la cystathionine β synthase (CβS), dépendente du pyridoxal 5’-phosphate (PLP), la forme active de la vitamine B6. La cystathionine est ensuite hydrolysée en cystéine et α-cétobutyrate par une enzyme dépendant du PLP, la γ-cystathionase.
I . 2 . Régulation nutritionnelle du métabolisme de l’homocystéine
Les études sur la régulation du métabolisme de l’homocystéine ont montré que l’orientation de l’homocystéine vers la voie de la reméthylation ou de la transsulfuration est sous le contrôle de la disponibilité en méthionine et de la S-adénosyl méthionine (SAM). La synthèse de novo de la méthionine dépend de la teneur de la ration en groupements méthyle labiles (méthionine, choline). Lorsque l’apport en méthionine est normal, la molécule d’homocystéine est recyclée environ deux fois par la voie de reméthylation avant d’être catabolisée par la voie de transsulfuration. Lorsque l’apport en méthionine diminue de moitié, le nombre de cycles par molécule d’homocystéine augmente deux fois. A l’inverse, lorsque l’apport en méthionine augmente, l’homocystéine utilise principalement la voie de la
transsulfuration. La capacité de l’organisme à adapter l’utilisation de l’homocystéine en fonction de l’apport en méthionine implique l’existence d’une régulation commune aux deux voies. Les données expérimentales obtenues principalement par la mesure in vitro de l’activité des enzymes suggèrent que cette coordination est réalisée par au moins deux mécanismes. Le premier mécanisme dépend de la capacité de la SAM à inhiber la méthylénetétrahyrofolate (MTHFR) et à activer la cystathionine β-synthase. La SAM bloque donc la synthèse du N-5-méthyltétrahydrofolate nécessaire à la reméthylation de l’homocystéine et favorise la réaction initiale de la transsulfuration. La concentration intracellulaire de la SAM détermine de ce fait le destin métabolique des molécules d’homocystéine. Le second mécanisme dépend de la régulation de la concentration intracellulaire de SAM. Les deux enzymes qui catalysent la synthèse de la SAM présentent une affinité différente pour la méthionine. La première, de poids moléculaire élevé, présente une affinité importante pour la méthionine et fonctionne dans les conditions physiologiques; la seconde, de poids moléculaire plus bas, a une affinité faible pour la méthionine et ne fonctionne de ce fait qu’en présence d’apports élevés en méthionine. Toute variation de la teneur intracellulaire de la méthionine modifie donc le taux de synthèse de la SAM. L’utilisation de la SAM est régulée spécifiquement par une réaction dans laquelle son groupement méthyle est transféré sur le groupement aminé de la glycine pour donner la méthylglycine ou sarcosine (figure 7). Cette réaction est catalysée par la glycine-N-méthyltransférase (GNMT) très abondante dans le foie et inhibée par la N-5-méthyltétrahydrofolate, de telle sorte que les folates régulent la teneur intracellulaire de la SAM. Lorsque l’apport en méthionine est élevé, l’enzyme de faible poids moléculaire va catalyser rapidement la transformation de la méthionine en SAM. L’augmentation de la concentration intracellulaire de la SAM va provoquer :
Homocystéine
- une inhibition de la MTHFR et de ce fait en un blocage de la synthèse du N5 -CH3THF qui entraîne l’activation de la GNMT,
- une activation de la cystathionine β-synthase.
A l’opposé, lorsque l’apport de la méthionine est faible, la concentration intracellulaire de SAM n’est pas suffisante pour inhiber la MTHFR et la concentration du N5-CH3THF augmente de telle sorte que la GNMT est inhibée. La voie de reméthylation est donc favorisée d’autant plus que la concentration de la SAM est trop basse pour stimuler la CβS.
II . Déficits enzymatiques et pathogenèse de l’hyperhomocystéinémie
La première cause d’hyperhomocystéinémie rapportée était liée à un déficit homozygote en cystathionine β synthase. Par la suite, il est apparu que les causes sont très nombreuses, concernant des déficits héréditaires de la voie de reméthylation, mais aussi de la voie de transsulfuration, ainsi que les anomalies héréditaires ou acquises du métabolisme des co-facteurs de ces enzymes, c’est-à-dire la vitamine B6, la vitamine B12 et l’acide folique.
II . 1 . Déficits enzymatiques constitutionnels
II . 1 . 1 . Mutation du gène de cystathionine β synthase (CβB)
Le gène codant pour la CβS est localisé sur le chromosome 21. Plusieurs mutations ont été identifiées dont deux majeures : la mutation Gly-ser, vitamine B6 non sensible, et la mutation Ile-Thr, vitamine B6 sensible. La transmission est autosomale récessive. Les formes homozygotes sont responsables de la gravité de l’homocystinurie congénitale, dont la prévalence est relativement plus élevée dans les groupes celtiques.
Beaucoup plus fréquentes sont les formes hétérozygotes, dont l’implication dans la pathogénie des affections vasculaire reste incertaine. Les déficits en CβS se
traduisent par une élévation des taux plasmatiques de l’homocystéine et de son précurseur, la méthionine.
II . 1 . 2 . Mutation du gène de la 5,10-méthyléne-tétrahydrofolate réductase (MTHFR)
La séquence d’ADN complémentaire (ADNc) de la 5,10-méthylène-tétrahydrofolate réductase a été caractérisée en 1994 (Goyette et al., 1994). Ce gène, localisé sur le chromosome l (lp36.3), est aujourd’hui le plus étudié des différents gènes codant pour les enzymes du métabolisme de l’homocystéine, du fait de l’existence d’une variante thermolabile qui résulte d’une translation C→T au niveau du nucléotide 677 (C677T), responsable, dans certaines conditions, d’hyperhomocystéinémie modérée (Frosst et al., 1995). La fréquence de la mutation 677C→T à l’état homozygote est de 5 à 28 % (7 à 40% pour la fréquence allèlique) selon la population étudiée (Schneider et al., 1998). Cette mutation correspond à une substitution de la cytosine en position 677 de la séquence d'ADNc (sur l'exon 4) par la thymine. Elle crée un site de restriction reconnu par l'enzyme de restriction Hinf l, dans une séquence de 198 pb amplifiée par le couple d'amorces 5'-TGA AGG AGA AGG TGT CTG CG-3’ (sens, exonique), 5'- AGG ACG GTG CGG TGA GAG TG-3’ (antisens, intronique). Elle entraîne le changement d'une alanine par une valine dans la séquence de l'enzyme et donne lieu à un polymorphisme. Elle a été associée à l’étiologie des maladies cardiovasculaires (Christensen et al., 1997) de la malformation du tube neural (Kirke et al., 1996; Van der Put et al., 1995) et aurait un effet protecteur vis à vis du cancer du côlon (Ma et al., 1997; Chen et al., 1997).
La nouveauté dans l'étude de ce gène est la caractérisation d'un deuxième polymorphisme sur l'exon 7 (Van der Put et al., 1998). Ce polymorphisme correspond à une substitution d'une adénine en position 1298 par une cytosine (1298A→C),
Homocystéine
abolissant ainsi le site reconnu par l'enzyme de restriction MboII dans une séquence de 163 pb, amplifiée par le couple d'amorces 5’-CTT TGG GGA GCT GAA GGA CTA CTAC (sens), 5’-CAC TTT GTG ACC ATT CCG GTT TG (antisens). Contrairement au cas du polymorphisme 677C→T, l'hyperhomocystéinémie n'a pas été observée chez les sujets porteurs de cette mutation 1298A→C à l'état homozygote.
II . 1 . 3 . Mutation du gène de la méthylène-tétrahydrofolate deshydrogénase Le gène de la méthylène-tétrahydrofolate déshydrogénase est localisé sur le chromosome 14 (14q24). Van der Put et al. (1998) ont détecté deux mutations ponctuelles. La première, caractérisée par la substitution d’une guanine en position 931 de l’ADNc par une adénine n’a été détectée que chez un des 38 patients atteints d’une malformation du tube neural familiale. La deuxième mutation, également une substitution G→A, localisée en position 2011, est probablement un polymorphisme bénin, puisqu’elle a été détectée à l’état homozygote chez 11.4 % des 38 patients atteints d’une malformation familiale du tube neural, chez 17.9 % des 79 patients atteints d’une malformation du tube neural sporadique et chez 18.8% des 300 sujets sains. Aucun cas d’hyperhomocystéinémie n’a été observé avec ce polymorphisme, détectable par l’action de l’enzyme de restriction NIaIII qui reconnaît l’allèle AA dans une séquence de 137 pb amplifiée par le couple d’amorces 5’-TGA TTG AAA TGG AGT GAC CTG (sens, intronique) et 5’-CCT GGC TTA AAT TTC TCC AGG ACA (antisens) (Van der Put et al., 1998).
II . 1 . 4 . Mutation du gène de la méthionine synthase (MTR) et la méthionine synthase réductase (MTRR)
La séquence ADNc de la méthionine synthase à été caractérisée indépendamment par Li et al. (1996) et Leclerc et al. (1996). Le gène est localisé sur le chromosome 1 (1q43). Un polymorphisme localisé sur l’exon 8 (2756A→G) a été
observé chez 5 à 15 % de la population générale. C’est une substitution d’un aspartate en position 919 de la séquence protéique par une glycine (919D→G). Ce polymorphisme a été suggéré comme étant potentiellement responsable d’une hyperhomocystéinémie, et donc facteur de risque des maladies vasculaire ou de la malformation du tube neural. Cette mutation est reconnue par l’enzyme de restriction HaeIII dans un fragment amplifié par le couple d’amorces 5’-CAT GGA AGA ATA TGA AGA TAT TAG AC (sens), 5’-GAA CTA GAA GAC AGA AAT TCT CTA (antisens, intronique). Les mutations rares de ce gène caractérisent les patients CbIG qui présentent une hyperhomocystéinémie moyenne ou sévère.
Le dernier gène dans cette panoplie est celui de la méthionine synthase réductase dont la séquence ADNc a été proposée par Leclerc et al. (1998). Il est localisé sur le chromosome 5 (5p15.2-15.3) et code pour une protéine de 698 acides aminés. Deux polymorphismes génétiques ont été détectés dont un majeur : Le polymorphisme 66A→G caractérisé par la substitution d’une isoleucine en position 22 par une méthionine (I22M). Cette mutation est reconnue par l’enzyme de restriction AflIII dans un fragment amplifié par le couple d’amorces 5’- CAG GCA AAG GCC ATC GCA GAA GAC AT-3’ (sense), et 5’- CAC TTC CCA ACC AAA ATT CTT CAA AG-3’ (antisense). Chez les patients Cb1E porteurs des mutations rares de ce gène, on note un défaut de synthèse de la méthionine cellulaire. Ce défaut paraît lié à l’interaction entre la vitamine B12 et la méthionine synthase.
II . 2 . Pathogenèse de l’hyperhomocystéinémie II . 2 . 1 . Altération de la synthèse du N5-CH3 THF
La synthèse de la méthionine dépend directement de la disponibilité en N5-méthyltétrahydrofolate. Une altération de la synthèse de ce vitamère du fait soit d’un apport insuffisant de folates soit d’une diminution de l’activité de la MTHFR, freine la
Homocystéine
synthèse de la méthionine. L’homocystéine qui devrait être reméthylée est donc orientée vers la voie de la transsulfuration. Mais cette voie ne peut prendre en charge la totalité de l’homocystéine pour deux raisons: l’inhibition de la synthèse de la méthionine conduit à une chute de la concentration intracellulaire de la SAM; le manque de N5-CH3 THF permet à la GNMT d’être active de manière optimale de telle sorte que la concentration de la SAM diminue encore et que la synthèse de l’homocystéine est stimulée. La voie de transsulfuration devient inefficace car la concentration de SAM est trop basse et l’homocystéine s’accumule dans les cellules. L’homocystéine non métabolisée diffuse dans le compartiment plasmatique et s’y accumule.
II . 2 . 2 . Altération de la reméthylation de l’homocystéine
Dans le cas d’une altération de la voie de reméthylation de l’homocystéine soit à cause d’une carence en vitamine B12 ou d’un défaut des enzymes synthétisant la méthyl-cobalamine, les conséquences sont différentes de celles observées lorsque la synthèse du N5-CH3 THF est bloquée. Selon l’hypothèse du piège à méthyle, le N5-CH3 THF s’accumule lorsque la voie de reméthylation est bloquée. De ce fait, bien que la synthèse de la SAM diminue, les concentrations intracellulaires de la SAM sont peu affectées car l’augmentation de la concentration intracellulaire du N5-CH3 THF réduit l’utilisation de la SAM dans la voie de méthylation de la glycine. De ce fait, une plus petite quantité d’homocystéine sera synthétisée à partir de la SAM et la C
β
S sera activée. La voie de transsulfuration étant plus active que dans le cas précédent l’hyperhomocystéinémie devrait être moins sévère.II . 2 . 3 . Cas de la transsulfuration défectueuse de l’homocystéine
Aucun métabolite formé par la voie de la transsulfuration n’affecte directement la voie de reméthylation. Cependant, lorsque la première voie est défectueuse comme
dans le cas d’un déficit homozygote de la CβS, l’homocystéine est métabolisée en plus grande proportion par la voie de reméthylation. La synthèse de la méthionine est stimulée et la concentration de la SAM dans les cellules augmente jusqu’à ce qu’elle soit suffisamment élevée pour inhiber la MTHFR et ainsi bloquer la voie de reméthylation. Il s’ensuit alors une accumulation de l’homocystéine conduisant à une hyperhomocystéinémie sévère. Lorsque la voie de transsulfuration fonctionne encore en partie comme dans le cas d’un déficit hétérozygote de la CβS ou d’une carence en vitamine B6, la voie de reméthylation et la voie de transsulfuration métabolisent normalement l’homocystéine tant que la quantité d’homocystéine à prendre en charge est faible. La charge métabolique d’homocystéine est faible lorsque l’entrée de méthionine dans la cellule est limitée. C’est le cas du jeûne. En revanche, à la suite d’un apport de méthionine, la concentration intracellulaire SAM augmente et (1) la synthèse du N5-méthylTHF est inhibée entraînant le blocage de la voie de reméthylation ; (2) l’activité de la GNMT est maximale résultant en une production accrue d’homocystéine par la méthylation de la glycine. Dans ces conditions, l’homocystéine s’accumule et une hyperhomocystéinémie est observée.
II . 2 . 4 . Preuves exérimentales
Chez le rat, la carence en folates et en vitamines B12 résulte en une augmentation très significative de l’homocystéinémie. Chez les rats carencés en vitamine B6, l’homocystéinémie mesurée à jeûn n’augmente pas. Lorsque les animaux sont gavés par la méthionine, l’homocystéinémie et la teneur du foie en SAM augmentent significativement. Chez le rat carencé en folates un apport de méthionine n’entraîne pas d’augmentation de l’homocystéinémie.
II . 2 . 5 . Hyperhomocystéinémie chez l’homme (Tableau 2)
Homocystéine
prévalence et de sa sévérité. Les cas les plus sévères (homocystéinémie totale > 100µmol/l) sont dus à un déficit des gènes codant pour la C