Faculté des Sciences, 4 Avenue Ibn Battouta B.P. 1014 RP, Rabat – Maroc Tel +212 (0) 37 77 18 34/35/38, Fax : +212 (0) 37 77 42 61, http://www.fsr.ac.ma
N° d’ordre 2851 THÈSE DE DOCTORAT Présentée par Asmae BOUZIANI Discipline : CHIMIE Spécialité : CHIMIE-PHYSIQUE
Synthèse, caractérisation et activité
photocatalytique des matériaux à base
de tungstène
Soutenue le : 26 Mars 2016 Devant le juryPrésident :
Mr. Abdallah ZRINEH PES - Faculté des Sciences - Rabat Examinateurs :
Mme. Souad EL HAJJAJI Mr. Abdelmalk DAHCHOUR Mme. Hafida MOUNTACER Mr. Abderrahim EL HOURCH Mr. Mohammed EL AZZOUZI
PES -Faculté des Sciences – Rabat PES - IAV Hassan II – Rabat
PES –Faculté des Sciences et Techniques– Settat PES - Faculté des Sciences - Rabat
PES - Faculté des Sciences - Rabat
DEDICACE
Louange et Gloire à Allah qui m’a accordé l’aboutissement de ce travail.
A mes très chers parents : Tous les mots du monde ne sauraient exprimer
l’immense amour que je vous porte, ni la profonde gratitude que je vous témoigne
pour tous les efforts et les sacrifices que vous n’avez jamais cessé de consentir
pour mon instruction et mon bien-être. J’espère avoir répondu aux espoirs que
vous avez fondés en moi. Je vous rends hommage par ce modeste travail en guise
de ma reconnaissance éternelle et de mon infini amour.
A mes frères et sœurs: Ismail, Houda, Mariam, Adnan et Ibrahim: Pour votre
amour et votre soutien Pour m’avoir remonté le moral, pour avoir été à l’écoute à
chaque fois que j’en ai eu besoin.
A mes amis qui m’ont soutenu pendant toutes mes années d’études.
A tous ceux et celles qui me sont chers
Avant Propos
Ce travail a été réalisé au laboratoire Matériaux, Nanomatériaux et Environnement de la Faculté des Sciences de Rabat sous la direction du Monsieur EL AZZOUZI et Monsieur EL HOURCH en collaboration avec le Laboratoire de Photochimie Moléculaire et Macromoléculaire de l’Institut de Chimie à Clermont-Ferrand, et le Laboratoire "Photocatalyse Hétérogène : Applications" de l’institut des Sciences des Matériaux de Séville (CISC).
A l'issue de la rédaction de cette recherche, je suis convaincue que la thèse est loin d'être un travail solitaire. En effet, je n'aurais jamais pu réaliser ce travail doctoral sans le soutien d'un grand nombre de personnes dont la générosité, la bonne humeur et l'intérêt manifesté à l'égard de ma recherche m'ont permis de progresser dans cette phase délicate de «l'apprenti chercheur».
J’adresse mes plus vifs remerciements à Monsieur Mohammed EL AZZOUZI et Monsieur Abderrahim EL HOURCH, Professeurs à la Faculté des Sciences de Rabat pour l’encadrement scientifique de cette thèse. Je tiens à leur exprimer toute ma reconnaissance pour la formation à la recherche qu’ils m’ont apportée et de m’avoir accompagnée. Merci pour votre aide précieuse et chaleureuse tout au long de la thèse.
Je remercie vivement Monsieur Abdallah ZRINEH, Professeur à la Faculté des Sciences de Rabat, de m’avoir fait l’honneur de présider ce jury.
Mes remerciements s’adressent également à Madame Souad EL HAJJAJI, Professeur à la Faculté des Sciences de Rabat, de m’avoir fait l’honneur d’en être rapporteur auprès de l’Université et d’avoir bien voulu être membre de jury.
Mes remerciements vont aussi à Madame Hafida MOUNTACER, Professeur à la Faculté des Sciences et Techniques de Settat, de m’avoir fait l’honneur d’en être rapporteur auprès de l’Université et membre de jury.
Je tiens à remercier Monsieur Abdelmalek DAHCHOUR, Professeur à l’Institut Agronomique Hassan II de Rabat, d’avoir bien voulu accepter d’être examinateur de cette thèse.
J’exprime mes remerciements à Monsieur Mohamed SARAKHA, Professeur à l’Université Blaise Pascal, pour m’avoir accueilli au sein de l’équipe photochimie de l’Institut de Chimie de Clermont-Ferrand et pour ses multiples conseils et les connaissances qu’il a pris le temps de me transmettre.
Je tiens à exprimer mes vifs remerciements au professeur Jose Antonio NAVIO
SANTOS, responsable de l’équipe "Photocatalyse Hétérogène : Applications" à l’institut des Sciences des Matériaux de Séville (CISC,) pour la confiance qu’il m’a accordé en
m’accueillant dans son laboratoire.
Je remercie également Romain PRULHO, Post-Doctorant à l’institut de chimie de Clermont-Ferrand, pour sa contribution aux analyses en chromatographie ionique.
Je tiens également à manifester ma gratitude à Cesar Jaramillo, doctorant à l’université de Séville pour son aide et sa disponibilité. Si mon séjour au CISC était un succès c’est grâce à tes conseils et ta patience. Merci pour les moments durant lesquelles on s’évadait en discutant de culture et de musique. GRACIAS
Je tiens à témoigner de mon amitié à Marie, pour les agréables moments passés à partager un petit thé et des gâteaux en parlant cinéma et livres. Merci de m’avoir fait sortir ma tête de mes fioles de temps en temps et de m’inviter à un bon repas ou une séance cinéma. Ce fut très agréable de travailler avec toi. Merci pour ton aide avec l’HPLC et MS-MS.
Cette thèse a aussi été une formidable aventure humaine. Je tiens donc à remercier profondément tous les personnes qui m’ont entourée du premier au dernier jour : ma famille et mes amis.
Sans ma famille je n’irai pas loin. Je pense bien sûr à mes parents. Si aujourd’hui j’ai réussi c’est pour vous et grâce à vous, merci de nous avoir donné tant de forces et d’avoir été toujours là pour nous. A mes frères et sœurs : Ismail mon grande frère qui se fait toujours de souci pour sa petite sœur merci pour ton soutien et pour être toujours là pour moi, A Houda et Adnan pour votre support ; A ma sœur Mariam, les mots ne seront te donner justice parce que je suis sûre que je ne serais pas arrivée où j’en suis sans toi. A mon frère Ibrahim, merci pour ton soutien quotidien et ta présence à mes côtés. Un grand merci à Amal pour tes précieux conseils lors de la rédaction des articles. A ma niece Oumama: my darling Oumama you are my sunshine, you always believed that I can do more and encouraged me to keep going. Thank you for sharing ice cream and chocolate in the moment of need.
Je suis infiniment reconnaissante à tous mes amis de m'avoir encouragé et soutenu pendant toutes ces années, sans jamais faillir. Tout d’abord je remercie Rim et Hicham (you are my persons) qui n’ont jamais arrêté de croire en moi et qui ont partagé toutes mes galères, mes doutes et mes angoisses, mais aussi mes joies et mes bonnes surprises. Je salue votre incroyable patience à mon égard. Merci de n’avoir pas pris la fuite. Je ne serais pas arrivée où j’en suis sans vous deux. Je remercie également Zoubida (Oum Badr) pour son soutien et sa tendresse, tu es une deuxième mère pour moi. Tu as toujours répondu présente quand j’en avais besoin.
Je remercie profondément tous mes compagnons de route qui m’ont apportés soutien, aide, encouragement et réconfort. A tous nos fous rires, nos angoisses, nos doutes…bref à tous les bons moments partagé. Merci Sayef pour ta disponibilité et ces moments de thé ou café au cours desquels tu m’as écouté râler. A Imane pour ta gentillesse et tes conseils depuis les jours du master. A Salma pour ton aide et tes conseils. Une petite pensée à Hakima pour les bons souvenirs lors de notre voyage à Madrid et Montréal. A vous tous, chez qui l’échange scientifique est un plaisir.
Résumé
Ce travail porte sur l’étude de la dépollution des eaux par les procédés d’oxydation avancées en particulier la photocatalyse en milieux hétérogène (photocatalyse à base de Bi2WO6) et
homogène (photocatalyse à base de W10O32) ainsi que du photo fenton hétérogène.
Dans le domaine de la photocatalyse en milieu hétérogène, de nouveaux photocatalyseurs à base de Bi2WO6 dopé par oxyde de zinc et platine ont été synthétisés par la méthode
hydrothermale ou sol- gel. Ils ont été caractérisés par diffraction des rayons X, BET, spectrométrie d’absorption en réflexion diffuse et microscop ie électronique à balayage. L’efficacité photocatalytique a été testée sur du méthylorange et phénol.
Le procédé photo fenton hétérogène a été utilisé pour l’élimination du méthylorange et phénol, en utilisant le Bi2WO6 incorporant Fe2O3 comme catalyseurs de l’oxydation de type
photo fenton hétérogène. La dégradation du méthylorange a été évaluée par la spectrophotométrie UV-visible alors que la disparition du phénol a été suivie par HPLC. L’effet de la concentration de H2O2, type d’incorporation du Fe2O3 et le rapport Bi2WO6 /
Fe2O3sur la dégradation du méthylorange ont été étudiés afin de trouver les meilleurs
conditions opératoires pour la réaction photo-fenton hétérogène.
En milieu homogène, le mécanisme de dégradation du triclosan et du chrome hexavalent par le système W10O32/UV a été étudié. Les différentes techniques analytiques telles que la
spectrophotométrie UV-visible, la HPLC, la HPLC couplée à la masse et la chromatographie ionique ont été utilisées. Le processus de dégradation met essentiellement en jeu un état excité très oxydant de W10O324-. Le système WO10O32 4-/UV est dépendant de l’oxygène.
Mots clés : Procédés d’oxydation avancés, Photocatalyse, Photo fenton hétérogène, Décatungstate de sodium, Bismuth tungstate, Chrome hexavalent, Méthylorange, Phénol, Triclosan.
Abstract
This study was carried out in the field of water treatment using advanced oxidation processes (AOPs), especially heterogeneous (using Bi2WO6), homogenous (using W10O32)
photocatalysis and heterogeneous photo fenton oxidation.
In the field of heterogeneous photocatalysis, new doped (Platinum and ZnO) - Bi2WO6
photocatalysts were synthesized by hydrothermal and sol- gel method. They were characterized by X-ray diffraction, BET, diffuse reflection spectra and SEM. Their photocatalytic efficiency was tested on the oxidation of methyl orange and phenol.
The heterogeneous photo fenton process was used for the removal of methyl orange and phenol, Bi2WO6 incorporating Fe2O3 was used as a heterogeneous photo fenton catalyst. The
degradation of methyl orange was evaluated by UV-visible spectrophotometer while the disappearance of phenol was followed by HPLC.
The mechanism of the oxidative degradation of triclosan and hexavalent chromium by W10O32/UV system was investigated in detail using several analytical techniques (UV-visible
spectrophotometer, HPLC, LC-MS, ion chromatography). The results show that the degradation process essentially involves a very excited state of oxidant W10O324-. The
W10O324- / UV system is oxygen dependent.
Keywords: Advanced Oxidation Processes, Photocatalysis, Heterogeneous photo fenton, Decatungstate of sodium, Bismuth tungstate, Hexavalent chromium, Methyl orange, Phenol, Triclosan.
6
SOMMAIRE
Introduction générale ... 15
Chapitre I : Synthèse bibliographique... 18
Introduction ... 19
I. Procédés d’oxydation avancée ... 19
II. Photocatalyse ... 20
1. Photocatalyse homogène ... 21
2. Photocatalyse hétérogène... 23
3. Oxydation Photo-Fenton hétérogène ... 29
III. Dopage de Bi2WO6 ... 33
1. Conséquences du dopage ... 33
2. Dopage par métaux nobles... 35
3. Semi-conducteurs composites ... 36
IV. Polluants persistants ... 37
1. Polluants organiques persistants ... 37
2. Polluants inorganiques ... 38
Conclusion ... 40
Chapitre II : Matériels et Méthodes... 41
Introduction ... 42
I. Synthèse des matériaux ... 42
1. Méthode hydrothermale ... 42
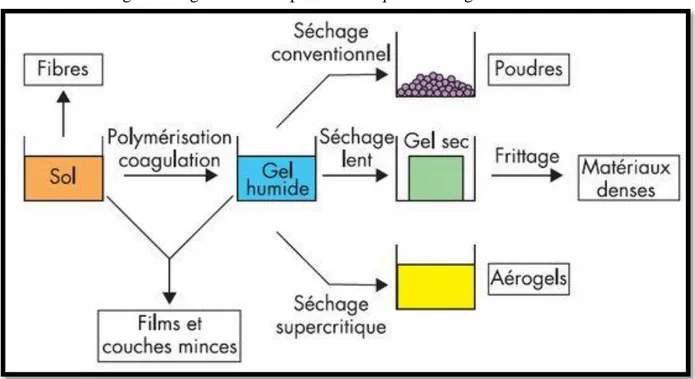
2. Synthèse par voie sol- gel ... 45
2. 1 .Définition ... 45
2. 2 Principe de la méthode... 46
2. 3 Paramètres influençant la cinétique des réactions ... 48
2. 4 Vieillissement des gels ... 48
7
II. Méthodes de caractérisations... 50
1. Diffraction des rayons X... 50
2. Brunauer- Emmett- Teller... 53
3. Spectroscopie de réflexion diffuse... 54
4. Microscope électronique à balayage... 55
III. Dispositifs d’irradiation ... 57
1. Irradiation à 320 nm... 57
2. Irradiation à 365 nm... 57
3. Lampe Osram Ultra Vitalux ... 57
IV. Techniques d’analyses ... 57
1. Spectrophotométrie d’absorption UV-visible ... 57
2. Méthodes chromatographiques ... 58 V. Produits ... 61 1. Triclosan ... 61 2. Mesotrione ... 62 3. Méthylorange ... 64 4. Phénol ... 65 5. Chrome hexavalent ... 66 6. Décatungstate... 66 7. Produits chimiques... 67
8. Préparation des solutions ... 67
Chapitre III : Résultats et Discussion ... 69
Introduction ... 70
Partie A: Synthèse et Caractérisation... 71
I. Synthèses des matériaux ... 71
1. Bismuth tungstène ... 71
2. Oxyde de zinc ... 71
8
4. Bi2WO6-ZnO... 71
5. Bi2WO6-Fe2O3 ... 72
6. Dopage des catalyseurs par du platine ... 72
II. Caractérisations des matériaux ... 72
1. Diffraction des rayons X... 72
2. Spectrométrie d’absorption en réflexion diffuse ... 73
3. Surface BET... 74
4. Microscope électronique à balayage... 74
Partie B : Photodégradation du méthylorange et phénol par photocatalyse hétérogène ... 76
I. Etude Spectrale du méthylorange et du phénol ... 76
1. Méthylorange ... 76
2. Phénol ... 77
II. Dopage du Bi2WO6 par ZnO ... 77
1. Cinétique de dégradation du méthylorange ... 77
2. Dégradation du phénol... 80
3. Discussion ... 83
III. Dopage par le platine ... 84
1. Photodégradation du méthylorange ... 84
2. Photodégradation du phénol ... 86
3. Discussion ... 88
IV. Influence du peroxyde d’hydrogène ... 90
1. Elimination du méthylorange ... 90
2. Dégradation du phénol... 93
3. Discussion ... 95
Partie C : Oxydation du méthylorange et phénol par photo-Fenton hétérogène .. 96
I. Oxydation par photo- fenton du méthylorange et phénol... 96
9
2. Cinétique de dégradation du phénol ... 99
3. Discussion ... 102
II. Facteurs influençant l’oxydation du méthylorange par photo –fenton hétérogène………...103
1. Influence du volume de H2O2 ... 104
2. Méthodes de synthèses ... 105
3. Effet du rapport Bi2WO6 / Fe2O3 ... 106
III. Dégradation d’un mélange méthylorange -phénol ... 108
Partie D : Dégradation photocatalytique du triclosan et de chrome hexavalent par le décatungstate de sodium. ... 109
I. Etude spectrale d´absorption du décatungstate ... 109
1. Spectre d’absorption du décatungstate ... 109
2. Cycle photocatalytique du décatungstate... 110
II. Réduction du Chrome hexavalent par le système Na4W10O324-/UV ... 111
1. Etude spectrale ... 111
2. Cinétique de disparition du CrVI... 112
3. Chrome III ... 115
III. Dégradation du triclosan par le système Na4W10O324-/UV... 116
1. Spectre d’absorption du Triclosan ... 116
2. Dégradation du triclosan en présence du décatungstate ... 116
3. Mécanisme de formation des photoproduits ... 118
IV. Suivi du triclosan et Chrome VI dans le système Na4W10O324-/UV... 121
1. Effet du triclosan sur la réduction du CrVI ... 121
2. Effet du CrVI sur la dégradation du triclosan... 123
V. Influence des ions chlorures ... 123
1. Influence des ions chlorures sur la dégradation du TCS ... 124
2. Influence des ions chlorures sur la réduction du CrVI ... 125
10
1. Spectre d’absorption ... 127
2. Photodégradation de la Mésotrione par le système W10O324- /UV 365... 127
3. Effet de la mésotrione sur la réduction du CrVI ... 129
Conclusion ... 130
Conclusion générale ... 131
11
Liste des figures
Chapitre I : Synthése bibliographique
Figure I.1: Structure cristalline de Bi2WO6………....26
Figure I.2: Structure cristalline du ZnO………...28
Figure I.3 : Schéma du piégeage des électrons par le platine………...35
ChapitreII : Matériels et Méthodes Figure II.1 : Autoclave et ces principaux composants………....47
Figure II.2 : Principales étapes de synthèse d’un matériau par la voie sol-gel………...59
Figure II.3 : Schéma de diffraction de rayons X par une famille de plans réticulaires. P1, P2, P3, sont les plans de cette famille ; θ est l’angle de Bragg………..…...53
Figure II.4 : Schéma d’un diffractomètre à compteur………..………..55
Figure II.5 : Schéma de montage de la sphère d'intégration………...………....57
Figure II.6 : Principe de fonctionnement du MEB………..……...58
Figure II.7: Schéma de principe d'un spectromètre………..……..60
Figure II.8: (A) Schéma source ESI-(B) schéma du mécanisme de formation d’ions dans ESI…...62
Figure II.9 : Structure du triclosan ………...………..……64
Figure II.10 : Réaction de photocyclisation du triclosan………...64
Figure II.11 : Structure de la mésotrione………...…...65
Figure II.12 : Biodégradation de la mésotrione ……….………....66
Figure II.13 : Structure du méthylorange………...67
Figure II.14 : Structure du phénol et photo de ses aguilles………...68
Chapitre III : Résultats et Discussion Figure III.1 : Diffractogramme de rayon X des matériaux obtenus………....…....78
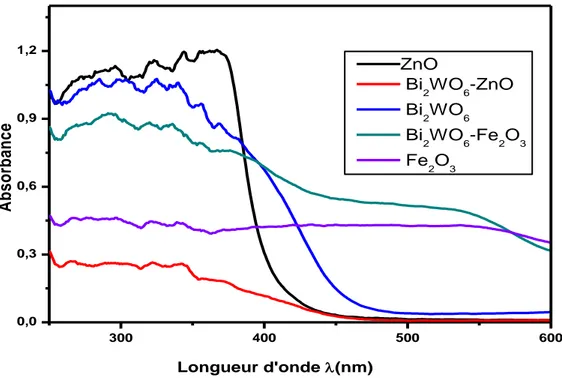
Figure III.2: Spectre d’absorption UV-visible en mode réflexion diffuse………...…...79
Figure III.3: Images MEB des échantillons...81
Figure III.4: Spectre d’absorption d’une solution aqueuse du méthylorange………...…...82
Figure III.5 : Spectre d’absorption d’une solution aqueuse du Phénol………...………….83
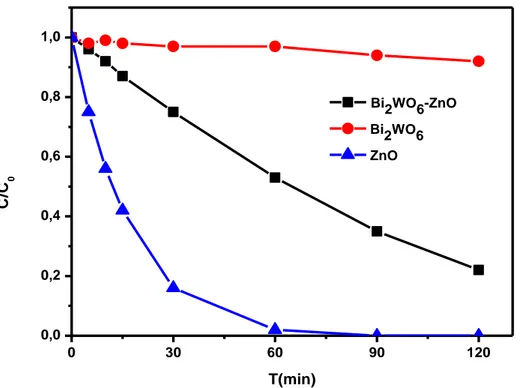
FigureIII.6:Elimination photocatalytique du MO par Bi2WO6; ZnO et Bi2WO6-ZnO ………...………....84
Figure III.7: Représentation ln(C/C0) en fonction de temps d’irradiation pour méthylorange, [cat]= 1g/L [MO]= 20 ppm...85
12
Figure III.8 : Elimination photocatalytique du phénol par Bi2WO6; ZnO et Bi2WO6
-ZnO………...……....87
Figure III.9: Représentation ln(C/C0) en fonction de temps d’irradiation pour Phénol, [cat]= 1g/L [ph]= 50 ppm... ...88
Figure III.10 : Dégradation du MO par PtBi2WO6 sous irradiation UV………...90
Figure III.11 : Représentation ln(C/C0) en fonction de temps d’irradiation pour MO, [PtBi2WO6]= 1g/L, [MO] = 20 ppm...91
Figure III.12: Dégradation du phénol parBi2WO6 et PtBi2WO6...………....…….92
Figure III.13: Représentation ln(C/C0) en fonction de temps d’irradiation pour phénol, [PtBi2WO6]= 1g/L [phénol]= 50 ppm...93
Figure III.14 : Schéma de la photocatalyse par Bi2WO6……...………...94
Figure III.15 : Schéma du piègeage des électrons par le platine………...95
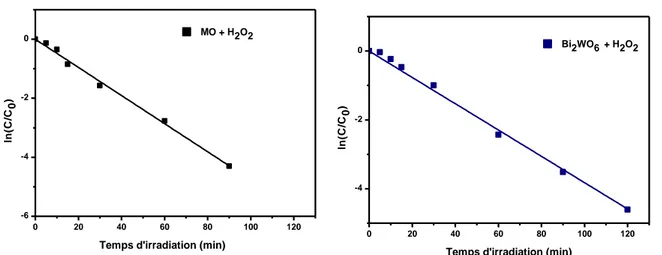
Figure III.16 : Elimination photocatalytique du MO par Bi2WO6 en présence du H2O2 (5%) ...96
Figure III.17 : Représentation ln(C/C0) en fonction de temps d’irradiation pour MO en présence d’H2O2 sous irradiation UV, [Bi2WO6]= 1g/L [MO]= 20 ppm...97
Figure III.18 : Représentation ln(C/C0) en fonction de temps d’irradiation pour MO en présence d’H2O2 sous irradiation vis, [Bi2WO6]= 1g/L [MO]= 20 ppm...98
Figure III.19: Elimination photocatalytique du phénol par Bi2WO6 en présence du H2O2 (5%)………...………..99
Figure III.20 : Représentation ln(C/C0) en fonction de temps d’irradiation pour phénol en présence d’H2O2, [Bi2WO6]= 1g/L, [phénol]= 50 ppm...100
Figure III.21 : Élimination photocatalytique du MO en présence et absence de H2O2 (5%) sous UV-vis et irradiation visible………..……..…...103
Figure III.22 : Etude cinétique du processus de dégradation de MO en présence d’H2O2, [Cat]= 1g/L, [MO]= 20 ppm...104
Figure III.23 : Élimination photocatalytique du phénol en présence et absence de H2O2 (5%) sous UV-vis et l'irradiation UV-visible………...106
Figure III.24 : Etude cinétique du processus de dégradation de phénol en présence d’H2O2, [Cat]= 1g/L, [phénol]= 50 ppm...107
Figure III.25 : Influence du H2O2 sur la dégradation du MO...110
Figure III.26 : Effet de la méthode d’incorporation du Fe2O3 sur la dégradation du MO……...112
Figure III.27 : Effet du rapport Bi2WO6/ Fe2O3 sur la dégradation du MO………...112
Figure III.28 : Elimination du méthylorange et phénol par Bi2WO6-Fe2O3 en présence de H2O2 sous irradiation visible………..114
13
Figure III.29 : Le spectre d’absorption d’une solution aqueuse de décatungstate...115
Figure III.30 : Cycle photocatalytique du DTA……….……...116
Figure III.31 : Spectre d'absorption de l'anion decatungstate et sa forme réduite obtenus par irradiation de l’ion decatungstate (2. 10-4 mol .L-1) à 365 nm dans une solution désoxygénée…...117
Figure III.32 : Transformation du chrome VI (UV-vis) ………...118
Figure III.33 : Chromatographe de disparition du chrome...119
Figure III.34 : Dégradation du Chrome VI par DTA (2 x 10-4 mol.L-1) à λ=320 nm ………...120
Figure III.35 : Dégradation du Chrome VI par DTA (2 x 10-4 mol.L-1) à λ=365 nm…………...…..121
Figure III.36 : Spectre d’absorption d’une solution aqueuse du triclosan………...…..122
Figure III.37 : Chromatographe de dégradation du triclosan...123
Figure III.38 : dégradation du Triclosan par DTAà λ=365nm...124
Figure III.39 : Réduction du chrome VI en présence et en absence du TCS………...….128
Figure III.40 : Effet du chrome VI sur la dégradation du TCS………...…..129
Figure III.41: Influence des ions chlorure sur la dégradation du TCS………...…..130
Figure III.42: La voie de dégradation du TCS en présence des ions chlorure………..…....131
Figure III.43: Influence des ions chlorure sur la réduction du Chrome VI………....…..132
Figure III.44 : Spectre d’absorption d’une solution aqueuse de Mésotrione………...….133
Figure III.45 : Influence de l’oxygène sur la dégradation de mésotrione………...…..134
Figure III.46 : Influence de la mésotrione sur la réduction du chrome VI………...………135
Liste des tableaux
Chapitre I : Synthése bibliographique Tableau I.1: Potentiel d'oxydation des oxydants utilisable en milieu aqueux ...18Tableau I.2:Métauxrencontrés dans l'environnement...39
ChapitreII : Matériels et Méthodes Tableau II.1 : Liste des produits chimiques utilisés...70
ChapitreIII : Résultats et Discussion TableauIII.1: Valeurs de l'énergie de la bande interdite des matériaux synthétisés...79
Tableau III.2 : Surface BET des matériaux synthétisés...80
14
Tableau III.4 : les paramètres cinétiques de Bi2WO6-ZnO, Bi2WO6 et ZnO...89
Tableau III.5 : les paramètres cinétiques de Bi2WO6 et Pt Bi2WO6 ...91
Tableau III.6 : Facteur d'amélioration de la dégradation du MO...92
Tableau III.7 : les paramètres cinétiques de Bi2WO6 et PtBi2WO6...93
Tableau III.8 : Facteur d'amélioration de la dégradation du phénol...94
Tableau III.9 : les paramètres cinétiques en présence de H2O2, et Bi2WO6 sous irradiation UV...97
Tableau III.10 : les paramètres cinétiques en présence de H2O2, du Bi2WO6 sous irradiation visible...98
Tableau III.11 : les paramètres cinétiques en présence de H2O2, et du Bi2WO6 sous irradiation UV...101
Tableau III.12 : les paramètres cinétiques en présence de H2O2, et Bi2WO6 sous irradiation visible...102
Tableau III.13 : les paramètres cinétiques du Fe2O3 et Bi2WO6- Fe2O3, en présence d’H2O2 sous irradiation UV...105
Tableau III.14 : les paramètres cinétiques du Fe2O3et Bi2WO6- Fe2O3, en présence d’H2O2 sous irradiation visible...105
Tableau III.15: les paramètres cinétiques du Fe2O3 et Bi2WO6- Fe2O3, en présence d’H2O2 sous irradiation UV...108
Tableau III.16: les paramètres cinétiques du Fe2O3 et Bi2WO6- Fe2O3, en présence d’H2O2 sous irradiation visible... ...108
Tableau III.17 : les paramètres cinétiques du Bi2WO6- Fe2O3...110
15
Introduction Générale
16
Les besoins en eau à l’échelle mondiale se font de plus en plus pressants due à l’accroissement de la population mondiale (9 milliards d’individus à l’horizon 2050) et à l’amplification de l’urbanisation, de l’industrialisation et de l’agriculture.
Les rejets ménagers, industriels et agricoles induisent des taux de pollution de l’air et des milieux aquatiques accrus ainsi que l’émergence de nouvelles pollutions, comme la pollution radioactive, qui présentent une toxicité pour l’homme et les écosystèmes [1–3]. Le traitement des eaux usées se fond sur des méthodes physiques (filtration, adsorption sur charbon actif), chimique (chloration) ou bien microbiologique (utilisation de bactéries) qu’il faut quelquefois les combiner pour aboutir à un degré de purification acceptable [4]. Cela nécessite du temps et plusieurs étapes de traitement ce qui implique également des coûts supplémentaires.
Durant la dernière décennie, plusieurs recherches ont porté sur une nouvelle technique d’oxydation : Procédé d’oxydation avancée (POA). Ces techno logies se sont montrées efficaces pour la destruction de polluants gazeux et aqueux. Ces procédés reposent sur la génération de radicaux hydroxyles OH ● qui possèdent un pouvoir oxydant supérieur à celui des oxydants traditionnels (H2O2, Cl2, ClO2, O3…) [5-7]. Ces radicaux peuvent minéraliser
partiellement ou totalement la majorité des composés organiques et organométalliques. Les POA incluent des procédés d’oxydation chimiques en phase homogène : Fenton, ozonation, péroxonation etc., et des procédés photoc himiques : photolyse, photocatalyse homogène, photo- fenton, photocatalyse hétérogène, photo-fenton hétérogène etc., des procédés électrochimiques (oxydation anodique, électro- fenton).
L’objectif de cette étude est de montrer l’intérêt des procédés d’oxydation avancée sur la dégradation du Triclosan, du Méthylorange, du phénol ainsi que la réduction du chrome hexavalent.
Ce manuscrit s’articule autour de trois chapitres :
Le premier chapitre de ce travail intitulé « Synthèse bibliographique » regroupe les travaux antérieurs publiés dans la littérature. Ce chapitre est composé de deux parties. La première contient une synthèse sur les procédés d’oxydation avancée (POA). La deuxième regroupe une définition sur les polluants organiques.
Introduction Générale
17
Le deuxième chapitre définit les méthodes de synthèse utilisées au cours de cette étude : méthode sol- gel et hydrothermale, ainsi que les produits et le matériel utilisés et les méthodes expérimentales.
Le chapitre 3 contient quatre parties : la première est consacrée à la synthèse et caractérisation des différents photocatalyseurs. La deuxième partie présente les résultats de la photodégradation du MO et phénol par photocatalyse hétérogène en utilisant le bismuth tungstène et l’oxyde de Zinc comme catalyseurs. La dégradation du MO et phénol en utilisant le bismuth tungstène dopé au fer comme catalyseur du photo-fenton hétérogène a été exposée dans la troisième partie. La photocatalyse homogène par le procédé W10O324- / UV était utilisé
pour la réduction du chrome hexavalent et la dégradation du triclosan ; les résultats obtenus sont donnés dans la quatrième partie.
18
Chapitre I : Synthèse bibliographique
Chapitre I : Synthèse bibliographique
19 Introduction
Les polluants organiques persistants sont des molécules toxiques et non biodégradable et ne sont pas détruits par les traitements physico-chimiques et biologiques classiques. De nouvelles techniques ont été développées au cours des deux dernières décennies, car elles peuvent conduire à une minéralisation complète de ces polluants, tels que les procédés d’oxydation avancée (POAs).
Dans ce chapitre, nous définissons les procédés d’oxydation avancée, leurs applications et leurs classifications, ainsi que les polluants organiques et inorganiques persistants et leurs impacts sur l’environnement.
I.
Procédés d’oxydation avancée
Les procédés d’oxydation avancée sont des techniques de traitement des effluents liquides et gazeux, ces méthodes reposent sur la formation des entités chimiques très réactives qui peuvent décomposer les molécules les plus récalcitrantes en molécules biodégradable ou en composés minéraux comme H2O ou CO2.Ces procédés reposent sur la formation in situ des
radicaux hydroxyles qui ont un pouvoir oxydant supérieur à celui des oxydants traditionnels tel que Cl2, ClO2 ou O3 (tableau I.1). Les radicaux OH● sont capable de minéraliser
partiellement ou totalement la plupart des composés organiques grâce à leur potentiel redox standard élevé de 2,8 eV.
Tableau I.1: Potentiel d'oxydation des oxydants utilisable en milieu aqueux [8]
Oxydant Réaction Potentiel standard,
E0 (V/ESH) Radical hydroxyle 2,80 Ozone 2,07 Peroxyde d’hydrogène 1,76 Ion permanganate 1,51 Dioxyde de chlore 1,50 Chlore 1,36 Oxygène 1,23
Chapitre I : Synthèse bibliographique
20
La souplesse d’utilisation des POA est liée à la possibilité de produire OH● par différentes techniques, mais puisque ces radicaux sont des espèces très réactives et instables, elles doivent être régénérer d’une façon continue au moyen de plusieurs réactions : chimiques, photochimiques, biologiques ou électrochimiques.
Les radicaux hydroxyles sont susceptibles d’être appliqués à la dépollution des eaux car ils répondent aux critères suivants :
- Ils n’induisent pas de pollution secondaire. - Ils ne sont pas toxiques
- Ils ne sont pas corrosifs pour les équipements, - Ils sont relativement simples à manipuler.
Les POA peuvent être regroupés en six grandes catégories :
Les procédés d’oxydation homogène : la formation des radicaux OH● se fait par une réaction chimique ; Fenton, Ozone à pH élevé ou O3/H2O2.
La photolyse homogène UV : ces procédés reposent sur la photolyse UV des H2O2 et/ou O3 pour générer les radicaux OH●.
La photocatalyse: repose sur l'excitation d'un semi-conducteur jouant le rôle de catalyseur tel que TiO2, ZnO….
La radiolyse : Les espèces OH●,H●,e
-aq sont produites par irradiation de forte
énergie (rayon-γ) des solutions à traiter.
Les procédés électrochimiques d’oxydation : produisent les oxydants directement dans le milieu par électrochimie, soit directement (oxydation anodique), soit indirectement via le réactif de Fenton.
Les procédés électriques et sonochimiques : sont des procédés basés sur une alimentation électrique en forte différence de potentielle, les radicaux sont formés à partir d’une décharge électrique (plasma) ou une irradiation ultrasonique.
II.
Photocatalyse
La photocatalyse est un procédé d’oxydation avancée mettant en jeu un photocatalyseur solide et un rayonnement ultraviolet. Ce procédé repose sur la formation des radicaux hydroxyles OH●, capables de minéraliser partiellement ou en totalité la plupart des
Chapitre I : Synthèse bibliographique
21
composés organiques. Il permet alors, la dégradation de molécules en phase aqueuse ou gazeuse. Il a déjà prouvé son efficacité pour la minéralisation complète de nombreux polluants des eaux.
Au cours de ces dernières années, la recherche dans le domaine de la photocatalyse a pris une partance considérable. Actuellement, elle se présente comme une technologie d’avenir, donnant lieu à des recherches et des applications dans le monde. Elle offre le grand avantage, par rapport à d’autres techniques en usage, de permettre la minéralisation totale des polluants, tout en respectant l’intégrité de l’environnement.
En réalité, le terme de photocatalyse est plus large, il ne repose pas sur une action catalytique de la lumière, mais plutôt sur une accélération de la photoréaction par la présence du catalyseur. Le terme de photoréaction est parfois remplacé par réaction photoinduite ou par réaction photoactivée [9].
1. Photocatalyse homogène
La photocatalyse homogène est une réaction qui se fait en présence d’un photocatalyseur de manière à avoir une solution homogène [9]. Parmi les photocatalyseurs homogènes on trouve le décatungstate de sodium.
1.1.Décatungstate de sodium
Le décatungstate de sodium (DTA) Na4W10O32 est un composé de la famille des
polyoxométalates (POMs). Son application dans le domaine de la photocatalyse a été proposée par Satari et Hill [10].
DTA possède des propriétés photocatalytiques captivantes, l’irradiation de ce composé au proche UV conduit à la formation d’un état excité extrêmement puissant [W10O324-]*de
potentiel d’oxydation (E0= 2,5 – 2,6 V), qui peuvent pratiquement dégrader n’importe quel
polluant organique, et de bande de gaps de 3,6 - 3,8 V similaire à celui de TiO2 (3,2 V). Son
application dans le domaine de la décontamination a été sérieusement explorée par Papaconstantino et ses collaborateurs pour la dégradation et la minéralisation photochimique des chlorophénols et de différents acides chloroacétiques [11-13].
Chapitre I : Synthèse bibliographique
22
1.2.Mécanisme
La voie photocatalytique primaire des POMs n’est pas claire. Yamasse, Papaconstantino et Hu [7,8] ont noté que la photooxydation des produits organiques avec les POMs est effectué par l’intermédiaire des radicaux OH●.
●
(I.3)
(I.4)
En outre, l'espèce O2●- /HO●2 formée pourrait jouer un rôle important dans la
dégradation et la minéralisation finale des intermédiaires [14].
Hill et al. [15] ont supposé que les polyoxotungstates solubles oxydent les substrats organiques par l’intermédiaire de l’état excité [W10O324-]*.
Cependant, A. troupis et al. [16] a postulé que la dégradation des produits organiques peuvent être opère par l’intermédiaire des radicaux OH● et l’état excité [W10O324-]* selon le
mécanisme suivant : ● ●
Chapitre I : Synthèse bibliographique
23
1.3.Synthèse du décatungstate de sodium dihydraté
Le décatungstate de sodium n’étant pas un produit commercial, sa synthèse se fait selon un processus reporté dans la littérature [17].
Le DTA se prépare en dissolvant le tungstate de sodium dihydraté dans l’eau distillée. Ensuite, la solution est portée à ébullition dans un ballon à reflux. Cette solution sera ajoutée à un volume équivalent d’acide chlorhydrique 1 molaire lui aussi sous reflux à ébullition. Le mélange obtenu sera laissé sous chauffage pendant 10 secondes supplémentaires puis refroidit rapidement à 30°C dans un bain de glace/ méthanol sous agitation. A cette température, on ajoute le NaCl solide et à refroidir jusqu’à 0°C.
Le ballon contenant le précipité formé sera laissé au congélateur pendant une nuit, puis filtré et séché sur verre fritté. Le précipité obtenu sera suspendu à chaud dans l’acétonitrile puis filtré sur verre fritté de nouveau. Le filtrat est placé au congélateur jusqu’au début de formation des cristaux pâles jaunâtres. La cristallisation est favorisée par évaporation de solvant par chauffage doux. Après plusieurs recristallisations, le produit obtenu sera laissé sécher à l’air libre.
2. Photocatalyse hétérogène
La photocatalyse hétérogène est parmi les méthodes photochimiques les plus étudiées dans le but d’atteindre la minéralisation des composés organiques. D’une manière générale, elle consiste à utiliser la lumière solaire ou artificielle et un semi-conducteur.
La photochimie des semi-conducteurs a été initiée par Becquerel en 1839. Il a mis en évidence la formation d’un courant électrique lors de l’irradiation solaire d’une électrode de chlorure immergée dans une solution d’électrolytes [18]. Un siècle plus tard, les propriétés photocatalytiques du pigment « titane blanc » utilisé dans les peintures ont été observées. En1972, Fujishima et Honda ont réalisé la première décomposition de l’eau sur des électrodes deTiO2 [19]. Quatre ans plus tard, Carey et al. réalisèrent la dégradation du biphényle et du
chlorobiphényle en présence de TiO2 [20]. Depuis, de nombreux travaux de recherche ont été
menés dans le domaine de la photocatalyse, essentiellement dans un but de dépollution.
2. 1 Principe de la photocatalyse hétérogène
Un semi-conducteur se distingue par une série de niveaux énergétiquement clos, en spécifique une bande interdite (BI ou « band gap »). La bande interdite est de quelques eV et
Chapitre I : Synthèse bibliographique
24
sépare la bande occupée la plus haute en énergie (la bande de valence, BV) de la bande de conduction (vide à l’état fondamental, BC.).
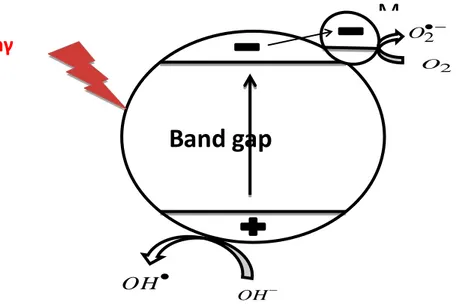
Sous excitation, un électron peut passer de l’orbitale la plus haute en énergie de la bande de valence à l’orbitale la plus basse libre de la bande de conduction. Il ya alors création d’une carence en électron au niveau de la bande de valence appelée « trou »et noté h+ « hole », et une surcharge électronique notée « e- » au niveau de la bande de conduction.
L’excitation peut être de nature électrique ou photochimique. Dans ce dernier cas, la différence d’énergie (E) entre la bande de valence et la bande de conduction définit la longueur d’onde d’irradiation.
2. 2 Réactions avec les substances adsorbées
Les trous et les électrons photo- induits formés à l’interface du photocatalyseur, peuvent respectivement oxyder et réduire des espèces chimiques à la condition que ces composés possèdent un potentiel redox thermodynamiquement compatible avec les niveaux énergétiques des bandes de valence et de conduction [21]. Le transfert des charges est plus efficace si les espèces sont pré-adsorbées à la surface du photocatalyseur [22].
Les ions-radicaux formés peuvent réagir chimiquement de différentes façons : réagir entre eux, réagir avec d’autres substrats adsorbés, transférer leur charge au semi-conducteur ou diffuser et réagir dans le milieu réactionnel.
2. 3 Recombinaison et piégeage des charges photo-induites
La recombinaison de la paire (e-, h+) peut avoir lieu à la surface ou à l’intérieur du volume du semi-conducteur s’accompagnant d’un dégagement de chaleur, et engendre ainsi une perte d’énergie. Etant donné que ce sont les réactions d’oxydation et de réduction qui sont intéressantes pour le domaine de la dépollution, cette recombinaison doit être empêchée le plus efficacement possible.
La recombinaison est un phénomène très rapide (quelques nanosecondes), la vitesse du piégeage doit être élevée [23] (une nanoseconde pour les électrons et 250 ns pour les trous).
Semi-conducteur (e-bc + h+)
Chapitre I : Synthèse bibliographique
25
La vitesse requise est plus rapide que celle de la diffusion, les pièges doivent être pré-associés à la surface du catalyseur avant la photoexcitation. Le piégeage des électrons et/ou les trous rend la photocatalyse plus efficace.
2. 4 Effet des paramètres opérationnels
Influence de la longueur d’onde
La longueur d’onde de la source lumineuse joue un rôle important dans la photocatalyse. La vitesse dépend de la longueur de l’onde. Afin d’activer une réaction photocatalytique avec un gap de 3,02 eV, la longueur d’onde doit être égale ou inférieur à 400 nm.
Influence de la nature du composé à oxyder
Les molécules organiques qui peuvent s’attacher à la surface du photocatalyseur seront plus susceptibles d’être oxydées.
L’adsorption des composés possédant des groupes attracteurs d’électrons est plus importante que celle possédant des groupes donneurs des électrons.
La dégradation photocatalytique des composés aromatiques dépend du groupe substituant. Bhatkhande et coll. (2004) ont montré que le nitrobenzène est adsorbé plus fortement que le phénol. Il est ainsi plus facilement dégradé par photocatalyse [24].Palmisano
et coll. [25] affirment que le phénol et le monochlorophénol sont dégradés plus rapidement
que les di et tri-chlorophénols. D’autre part, les molécules possédant des groupes fonctionnels attracteurs d’électrons, comme le nitrobenzène et l’acide benzoïque, sont moins réactifs avec le radical hydroxyle que les molécules possédant des groupes donneurs d’électrons [25].
Influence de la masse du catalyseur
La vitesse de dégradation des composés organiques dans le cas d’un catalyseur en suspension ou fixé, dépend de la masse du catalyseur.
Pourtant, au-dessus d’une certaine valeur, la vitesse devient indépendante de cette masse du catalyseur. En effet, au-dessus de cette valeur, la masse du catalyseur inhibe la transmission des photons [26].
Chapitre I : Synthèse bibliographique
26
Par ailleurs, les réactions sont plus efficaces avec des composés adsorbables sur le catalyseur. Par conséquence, la surface et la taille de catalyseur joueront un rôle très important dans le système photocatalytique.
Influence de la concentration initiale
La concentration initiale des composés joue un rôle important dans l’oxydation des composés organiques par photocatalyse. Si la concentration initiale est trop élevée, le catalyseur peut être saturé, ce qui est un facteur d’inhibition de formation des radica ux hydroxyles.
Influence du flux lumineux
La vitesse d’oxydation des composés organiques par photocatalyse dépend certainement de l’intensité de la source lumineuse [27-29].La littérature indique que l’augmentation de l’intensité d’irradiation conduit entièrement à une amélioration de la dégradation des composés polluants. Dans le cas de TiO2, il y a environ 5 % de l’énergie
solaire qui peut l’exciter pour des réactions de photocatalyse, le reste de l’énergie solaire contribue seulement à augmenter la température de la solution [30].
2. 5 Les semi-conducteurs actifs en photocatalyse
Les oxydes métalliques possédant une structure électronique à bande interdite large sont très utilisés pour la photocatalyse à cause de leur résistance à la photocorrosion. La stabilité et la non toxicité sont des critères importants pour le bon choix du photocatalyseur.
Les photocatalyseurs les plus répandus sont TiO2, ZnO et CdS. Des études pour
l’application solaire s’intéressent aux chalcogènes (CdS, CdSe) car ils ont de faibles bandes interdites. Malheureusement, ils se corrodent facilement même si l’ajout de sulfures et sulfites réduit en partie ce phénomène. De plus, le relarguage d’ions toxiques tels que Cd2+ en solution rend CdS inutilisable à des fins dépolluantes (Eq. I-12) [31].
De même, l’hématite (α-Fe2O3), qui possède une bande de valence très oxydante (2,3
eV) et une bande de conduction à grand pouvoir réducteur (0V) [32] et ZnO sont des photocatalyseurs de grand intérêt en raison de leur fortes activités dans le visible.
Chapitre I : Synthèse bibliographique
27
Dans cette étude, nous allons nous intéresser plus particulièrement à trois différents photocatalyseurs : ZnO, Fe2O3 et Bi2WO6.
2.5.1. Bismuth tungstène
Structure du Bi2WO6
Le bismuth tungstène (Bi2WO6) fait partie de la famille des oxydes de type
Auririvillus. En1999, ses propriétés photocatalytiques sous irradiation visible ont été découvertes pour la production de dio xygène par oxydation de l’eau [33 ]. Ensuite en 2003, ses propriétés ont été exploitées pour la minéralisation de molécules organiques [34].Son activité photocatalytique a depuis été largement mise à contribution pour dégrader une large gamme de molécules sous irradiation visible [35,36]. Bi2WO6 présente une structure
cristalline et électronique appropriée pour la photocatalyse sous lumière visible.
Le Bi2WO6 a une structure cristalline orthorhombique composée de feuillets de Bi2O2
alternés par des couches d’octaèdres WO6 joints entre eux par les sommets (Fig.I.1). Cet
assemblage des feuillets sont chargés alternativement + et – créant un champ électrique parallèle au plan (001) favorisant la mobilité des charges photogénérées dans le matériau et facilite l’adsorption des molécules à la surface [37,38]
Activité photocatalytique du Bi2WO6
Du point de vue théorique, la production du OH● dans le système Bi2WO6/ UV est
presque impossible. Généralement, les trous formés dans une bande de valence Bi3+par photoexcitation sont considérés comme Bi5+ (ou Bi4+).Bien que le potentiel d’oxydo-réduction
Chapitre I : Synthèse bibliographique
28
dans une solution aqueuse est différent de celui dans les solides, un potentiel standard d’oxydo-réduction de Bi2O4/BiO+ (BiV/BiIII)(E0= 1,59 V à pH=0) pourrait donner une
estimation approximative du potentiel d’oxydation du trou (Bi5+
) photogénéré dans Bi2WO6
[39]. Cependant, le potentiel standard d’oxydo-réduction BiV/BiIII est plus négatif que celui de OH●/OH- (+1,99V) [33], ce qui suggère que le trou photogénéré sur la surface de Bi2WO6
ne peut pas réagir avec OH-/H2O pour former OH●. Donc, la décomposition des composés
organiques par Bi2WO6pourrait être due à la réaction directe avec le trou photogénéré.
Bi2WO6 absorbe dans le visible proche UV, avec une limitation d’absorption de 440
nm [40,41] qui correspond à une largeur de bande interdite de 2,8 eV. 2.5.2. Oxyde de zinc
L’oxyde de zinc (ZnO) est un semi-conducteur de type II-VI à large bande interdite directe de 3,37 eV à température ambiante qui a été étudiés dans les années 70. Cependant l’étude et la croissance de ce matériau revient en force ces dernières années en raison de ses propriétés fondamentales attractives, de son large gap direct, de sa grande énergie de liaison d’excitation, de sa structure cristallographique et de sa non-toxicité [42,43].
Structure du ZnO
ZnO a une structure cristalline hexagonale dans laquelle des ions d’oxygène sont disposés suivant un réseau de type hexagonal compact, et ou les atomes de zinc occupent la moitié des positions interstitielles tétraédriques ayant le même arrangement que les ions d’oxygène (Fig.I.2) [44].
Chapitre I : Synthèse bibliographique
29
Propriétés catalytiques du ZnO
L’efficacité catalytique du ZnO dans un système spécifique dépend de son mode de préparation, au degré de perfection du réseau cristallin et aux propriétés semi-conductrices (lacunes, atomes en positions interstitiels…) [45]. ZnO peut être utilisé comme capteur chimique de gaz (H2S, CO2, H2, CH4) [46,47]. Dans une solution aqueuse, le ZnO peut jouer
le rôle d’un photocatalyseur pour un nombre de réactions comme l’oxydation de l’oxygène en ozone, l’oxydation de l’ammoniaque en nitrate, la réduction du bleu de méthylène, la synthèse du peroxyde d’hydrogène [48] et l’oxydation du phénol [49].
L’oxyde de zinc absorbe dans le domaine UV, dans un intervalle de 360-380, dépendant de différents paramètres comme la méthode de synthèse, température et méthode de cristallisation.
La dégradation photocatalytique des composés organiques par ZnO dans le domaine UV implique trois étapes :
- Quand l’énergie hγ d’un photon est supérieure ou égale à l’énergie de la bande interdite de ZnO (Eg), un électron est excité de la bande de valence à la bande
de conduction (CB) formant un trou dans la bande de valence (CV).
- Des radicaux hydroxyles (OH●) sont formés en piégeant les trous photogénérés par des groupes hydroxyles de surface ou l’eau absorbée. - Les composés organiques absorbés sont décomposés et généralement
minéralisés par les radicaux hydroxyles :
3. Oxydation Photo-Fenton hétérogène
3.1.Mécanisme
La réaction de Fenton homogène requière une concentration en ions ferreux (ou ferriques) de plusieurs dizaines ppm, ce qui est bien au-dessus des directives de l’Union Européenne en ce qui concerne les eaux de rejet, qui permettent seulement 2 ppm (EEC List of Council Directives 76/4647). En fin de traitement, le fer est précipité par addition de soude,
Chapitre I : Synthèse bibliographique
30
entraînant des coûts supplémentaires liés aux produits chimiques et à la gestion des boues ainsi formées, sans compter la perte de catalyseur. Afin d’éviter de précipiter le fer dissous, des systèmes homogènes plus complexes ont été préparés qui utilisent un ligand polymère de type polyacrylonitrile pour coordonner divers métaux de transition tels que Fe3+, Co2+, Ni2+ et Cu2+ [50]. Ensuite, le catalyseur peut être séparé facilement du système par nanofiltration.
De nombreuses études se sont aussi intéressées au recyclage du catalyseur par la mise en œuvre de la réaction avec un catalyseur hétérogène, soit un minerai de fer [51,52], soit un catalyseur préparé en stabilisant le fer (sous forme d'oxyde le plus souvent) à la surface de supports poreux : alumines et silices [53-55], mais aussi zéolithes [56,57] et charbons actifs [58,59].
L’oxydation Fenton hétérogène est un processus catalytique se produisant à la surface des sites actifs métalliques. Le mécanisme de décomposition de H2O2 dans la réaction de
Fenton hétérogène est encore bien moins connu qu’en système homogène. La plupart des auteurs considèrent que la décomposition de H2O2 suit un mécanisme radicalaire similaire à
celui postulé en homogène [51,52]. Selon le mécanisme radicalaire proposé par Lin et Gurol (1998) pour la goethite, la réaction est initiée par la formation d'un complexe précurseur entre le peroxyde d'hydrogène (H2O2) et les groupes ≡Fe(III)-OH à la surface de l’oxyde (équation
I.16), passant par un état excité (équation I.17). Sa dissociation conduit au radical hydroperoxyle qui va réagir immédiatement avec d'autres composés. Par conséquent, la réaction inverse de l'équation. I.18 peut être considérée comme négligeable. Le fer réduit peut réagir avec le peroxyde d'hydrogène ou l'oxygène, comme indiqué par les réactions I.19 et I.19a. La réaction I.19a est cependant plus lente que la réaction I.19. Les radicaux hydroxyles et hydroperoxyles générés par ces réactions peuvent à leur tour réagir avec les sites Fe(II) et Fe(III) en surface selon les réactions I.21 et I.22 ou avec les polluants. Ces radicaux libres peuvent aussi réagir avec H2O2 (réactions I.23 et I.24) et enfin avec eux-mêmes, par les
réactions de terminaison I.25 et I.26.
Chapitre I : Synthèse bibliographique
31L’irradiation UV d’un système Fenton favorise la régénération du fer(II) à partir du fer(III).C’est pourquoi, dans certains cas, le système de Fenton classique (Fe2+/H2O2) est mis
en œuvre en présence de rayonnements UV. Plus souvent, le fer(II) initial est remplacé par du fer(III) en quantités catalytiques. L’irradiation UV (λ> 300 nm) d’un tel système (Fe3+ /H2O2/UV) permet de générer in situ le fer(II), qui réagit alors de suite avec le peroxyde
d’hydrogène pour produire des radicaux hydroxyles, régénérant ainsi le fer(III) dans le milieu. On parle dans ce cas de procédé photo-Fenton. Ce système présente l’avantage de limiter les réactions de compétition qui consomment des radicaux et du fer(II).
3.2.Catalyseurs solides
Dans ce paragraphe sont détaillés les études portant sur les minerais de fer et le bismuth tungstène dopées au fer qui sont les catalyseurs hétérogènes utilisés dans ce travail.
Minerais de fer
Les minerais de fer, utilisés pour la décontamination des eaux usées peuvent être recouvrés et réutilisés, puisqu’ils sont quasiment insolubles dans l'eau. Certaines études ont montré que ces catalyseurs étaient actifs dans une gamme plus étendue de pH qu’en procédé Fenton homogène [60].
La concentration du peroxyde d'hydrogène, le type et la surface spécifique du minerai, le pH de la solution et les caractéristiques des polluants sont des facteurs influençant l'efficacité catalytique des minerais de fer dans la réaction de Fenton [61,62].
Chapitre I : Synthèse bibliographique
32
A des concentrations élevées de H2O2, la réaction est inhibée; due au piégeage des
radicaux hydroxyles par H2O2 entrainant la formation de radicaux hydroperoxyles, beaucoup
moins réactifs. C’est donc un phénomène très semblable à celui observé en Fenton homogène. Des études ont montré que les minerais contenant du Fe(II) sont des catalyseurs moins actifs que ceux incorporant du Fe(II) [52,61]. Ainsi, l’hématite (Fe2O3), la goethite
(α-FeOOH), la lepidocrocite (γ-FeOOH) et la ferrihydrite (Fe2(OH) 6) sont des catalyseurs qui
peuvent être utilisés pour dégrader les polluants organiques.
Le rapport Fe(II)/Fe(III) est aussi un paramètre important. La pyrite est associée à une constante de réaction par unité de surface ksurf = 0,177 L.min-1.m-2 à pH = 3 et la magnétite à
ksurf =1,47×10-3 L.min-1.m-2. Deux types de magnétite (nano et microstructurée) pour
l’oxydation de la rhodamine B à pH neutre [57], les vitesses de décomposition de H2O2 et du
polluant par unité de surface étaient plus élevées pour la magnétite microstructurée qui présentait une cristallinité et un rapport Fe(II)/Fe(III) plus élevés.
La surface spécifique des minerais du fer est un facteur important pour la dégradation des polluants organiques par la réaction de type Fenton, vo ire plus important que le paramètre précédent. L'efficacité d’oxydes mixtes du fer et du silicium à dégrader le rouge du méthyle à pH 5 diminue dans l'ordre suivant : quartz-goethite (Q4) > quartz-oxyde amorphe de Fe(III) (Q1) > quartz- maghémite (Q2) > quartz- magnétite (Q3) [63]. Cela correspond en fait à l’ordre de classement de leur surface spécifique : Q4 (148 m2.g-1) > Q1 (121 m2.g-1) > Q2 (11,5 m2.g
-1
) > Q3 (8,6 m2.g-1).
D’autres facteurs peuvent influencer la catalyse par les oxydes du fer, comme le pH de la solution et les propriétés chimiques du polluant. A pH acide, la dissolution des minerais de fer dans l’eau, conduisant à la promotion de la réaction de Fenton homogène, doit être prise en compte. L'augmentation de la vitesse d'oxydation à faible pH est donc attribuée à la meilleure solubilité des espèces Fe(III) à pH acide, conduisant à des réactions de type Fenton homogène. Dans ces conditions, la vitesse d’oxydation ne dépend quasiment pas de la quantité du catalyseur. En s’approchant d’un pH ne utre, la solubilité du minerai d u fer diminue beaucoup et la dégradation du composé organique n’implique que des réactions hétérogènes. Dans ces conditions, les interactions électrostatiques entre la surface du catalyseur et les composés organiques deviennent importantes. Kwan et Voelker [64] ont étudié l'effet de l'interaction électrostatique entre la surface d u catalyseur (goethite) et
Chapitre I : Synthèse bibliographique
33
plusieurs molécules (acide formique, nitrobenzène et 2-chlorophénol) sur leur oxydation par H2O2. A pH 4, seul l'acide formique (pKa = 3,7) est relativement dissocié et interagit avec la
surface de l'oxyde du fer chargée positivement où les radicaux OH● sont générés. Le rapport entre la constante de vitesse de dégradation et la constante de vitesse de réaction avec OH● est alors 50 fois supérieur pour l'acide formique par rapport aux deux autres molécules. Cette observation confirme l'hypothèse que les composés organiques adsorbés à la surface du catalyseur sont facilement accessibles aux radicaux OH●.
Bismuth tungstène incorporant le fer
Le bismuth tungstène est l’un des simples composés de la famille Aurivillius, il présente une performance photocatalytique par le solaire et lumière visible, en raison d’une bande interdite étroite de 2,69 eV et une structure en couche spécia l [65].
α-Fe2O3 est un semi-conducteur avec une bande interdite étroite de 2,2 eV et peut
répondre à la lumière visible jusqu’à 600 nm. L’hématite a d’autre avantages pratiques comme le faible cout et la non toxicité. La modification du Bi2WO6 par α-Fe2O3 peut élargir la
gamme de la réponse de la lumière visible et de prolonger la durée de vie du support photogénéré.
III.
Dopage de Bi
2WO
6Une stratégie pour éviter la recombinaison des charges photogénérées au sein d’un semi-conducteur est d’assurer une séparation physique efficace de ces charges en transférant les électrons ou les trous dans un composé voisin. Il s’agit alors de former une jonction entre Bi2WO6 et un composé qui peut être un conducteur ou un autre semi-conducteur.
L’utilisation du Bi2WO6 dans le domaine de la photocatalyse peut être optimisée en
modifiant les propriétés physico-chimiques. Ceci est possible en le dopant avec d’autres éléments (métaux nobles) ou en le combinant avec des matériaux différents.
1. Conséquences du dopage
Le dopage des semi-conducteurs peut induire trois effets : séparation spatial des charges, une meilleure absorption de la lumière et une modification de l’état de surface du semi-conducteur.
Chapitre I : Synthèse bibliographique
34
La séparation des charges photoinduites : c’est l’effet principal de la création d’une jonction entre deux matériaux. Les énergies de Fermi s’équilibrent à la jonction quand deux matériaux sont en contact, par diffusion des électrons d’un matériau à l’autre, faisant apparaître un champ électrique interne à l’interface entre les matériaux [66]. Dans le cas du couplage de Bi2WO6avec un métal comme le cuivre [67]
ou un matériau conducteur comme le graphène [68–70], le fullérène [71] ou la polyaniline (PANI) [72], ce dernier joue le rôle de collecteur d’électrons et ses propriétés conductrices favorisent la séparation et la mobilité des électrons.
Le couplage de Bi2WO6 avec un autre semi- conducteur, conduit à un transfert entre les bandes des différents semi-conducteurs : les électrons passent de la bande de conduction la plus basse en énergie à la bande de conduction la plus haute en énergie et les trous photo-induits passent de la bande de valence la plus énergétique à la bande de valence la plus basse en énergie. L’absorbance de l’irradiation par Bi2WO6 et le semi-conducteur, conduit à une migration simultanée des charges d’un matériau à l’autre.
L’amélioration des performances photocatalytiques de l’hétérostructure formée est due en grande partie au transfert de charges, limitant fortement la recombinaison des charges qui peuvent alors participer aux réactions catalytiques de surface.
Une absorption de l’hétérostructure plus étendue dans le visible , si le matériau auquel Bi2WO6 est couplé absorbe à des longueurs d’onde plus élevées, est un
autre effet du couplage.
Le couplage modifie les propriétés de surface du Bi2WO6, en particulier le
nombre de sites d’adsorption de surface.
Ces trois effets du couplage peuvent présenter des avantages pour les propriétés photocatalytiques de Bi2WO6. Toutefois, la quantité du matériau à introduire doit être
déterminée, afin d’éviter un trop grand nombre de jonctions qui induisent des défauts aux interfaces (centres de recombinaison ou d’immobilisation des charges) et un effet d’écrantage de la lumière incidente par le matériau déposé sur Bi2WO6 qui induit une diminution du
rendement quantique.
Parmi tous les matériaux évoqués pour former des hétérostructures avec Bi2WO6, les
Chapitre I : Synthèse bibliographique
35Band gap
hγ
OH OHM
2 O 2 O2. Dopage par métaux nobles
L’utilisation du Bismuth tungstène dans le domaine de la photocatalyse peut être améliorée en modifiant les propriétés physico-chimiques du matériau. Ceci est possible en le dopant avec d’autres éléments ou en le combinant avec des matériaux différents. Plusieurs recherches se sont consacrées à l’élargissement de la gamme spectrale d’absorption du bismuth tungstène.
A une concentration optimale (très souvent inférieure à 1%), les métaux nobles (Ag, Au,Rh, Pt) [73-75] améliorent les propriétés photocatalytiques. Ils agissent comme des pièges à électrons et des séparateurs de charges (Fig.I.3). Un tel dopage permet une diminution du taux de recombinaison des charges photo-induites selon les équations I.27 et I.28 :
Cependant, un taux de dopage trop élevé crée des centres de recombinaison. En effet, la réaction d’oxydation du métal réduit par les trous (Eq.I.29) entre en compétition avec les réactions des équations I.27 et I.28.
Chapitre I : Synthèse bibliographique
36
Afin de quantifier l’augmentation de la photoactivité des échantillons dopés, en calcule le "Facteur d’amélioration = Enhancement factor" (Ef) qui est le rapport entre la vitesse de la photo réaction des échantillons dopés par le métal et la vitesse pour le même échantillon non dopés.
La vitesse de dégradation :
Avec :
K : Constante de la réaction initiale [s-1]. Calculée à partir de la pente de la courbe concentration en fonction du temps.
C0 : Concentration du polluant (mol.L-1).
V : Volume (L).
3. Semi-conducteurs composites
Il s’agit de l’association du Bi2WO6 et d’un autre semi-conducteur dans le but de
séparer les charges photo- induites mais aussi d’élargir la gamme spectrale d’irradiation. Deux types de système sont possibles : les radiations incidentes sont absorbées par un matériau ou par les deux matériaux à la fois.
Dans le cas où les deux semi-conducteurs sont excités : il y a création de charges au sein des deux conducteurs. Tandis que l’électron de la bande de conduction du semi-conducteur ajouté est transféré à Bi2WO6, le trou formé dans Bi2WO6 est transféré dans la
bande de valence de l’autre semi-conducteur. Ce système permet donc une séparation des charges efficace et l’augmentation da la durée de vie des charges photoinduites. L’excès de trous à la surface du semi- conducteur ajouté oxyde les composés adsorbés.
Dans le cas où seulement le semi-conducteur à bande interdite la plus faib le est irradié, le transfert d’électrons dans la bande de conduction du titane est possible à des longueurs d’onde supérieures à la longueur d’onde d’absorption maximale du Bi2WO6.
Chapitre I : Synthèse bibliographique
37
Le couplage de Bi2WO6 avec TiO2 a permis d’obtenir une activité photocatalytique
dans le visible pour la dégradation du phénol et Rhodamine B [76,77].
Les semi-conducteurs sont choisis en fonction de la valeur de la largeur de leur bande interdite et aussi par rapport à la position énergétique de leurs bandes de conduction et de valence.
IV.
Polluants persistants
Les dangers chimiques pour l’environnement et pour l’homme sont très nombreux. Certaines substances ont en effet des propriétés intrinsèquement nuisibles pour ces cibles : caractère polluant, toxicité, nocivité, forte réactivité, caractère biocide, ...
Ces polluants chimiques peuvent se diviser en 2 groupes : organiques (carbonées) et inorganiques (minéraux).
1. Polluants organiques persistants
Les polluants organiques persistants (POP) comptent parmi les polluants les plus dangereux rejetés chaque année par l’homme dans l’environnement. Il s’agit de pesticides, de substances chimiques industrielles, ou de sous-produits involontaires des procédés industriels ou d’autres processus. Ils sont hautement toxiques, persistants et ont toute une série d’effets néfastes sur la santé humaine et animale, provoquant des maladies et des malformations congénitales. Les POP sont notamment à l’origine de lésions du système nerveux central et périphérique, de troubles des fonctions reproductives et de dérèglements du système immunitaire.
Les POP sont des molécules complexes qui, contrairement aux autres polluants ne sont pas définies en fonction de leur nature chimique mais à partir de quatre propriétés qui sont [78]:
Persistants : Substance se dégrade lentement,
Bioaccumulables : La substance s’accumule au sein des êtres vivants,
Toxiques : L’exposition à la substance est susceptible de provoquer des effets néfastes,
Mobiles sur de grandes distances : Mesure de concentration élevée loin d ue point de rejet