Les macrophages alvéolaires et les cellules
dendritiques, deux joueurs clés dans l’homéostasie
pulmonaire et la réponse asthmatique
Thèse
Jean-François Lauzon-Joset
Doctorat en Médecine Expérimentale
Philosophiae doctor (PhD)
Québec, Canada
Résumé
L’immunité pulmonaire est en constant équilibre entre le maintien de l’homéostasie et le développement d’une réponse inflammatoire. Plusieurs acteurs sont impliqués dans cette fine régulation, mais peu d’informations sont disponibles sur les mécanismes qui régulent l’activation de l’un ou l’autre de ces mécanismes. Différentes populations de cellules dendritiques sont activées lors de certaines réponses immunitaires, tandis que les macrophages alvéolaires sont davantage associés au maintien de l’homéostasie. De plus, lorsque l’homéostasie pulmonaire est dérégulée, une réponse inflammatoire exagérée se développe, comme dans le cas de l’asthme allergique. Cette thèse a pour objectif de mettre en lumière des mécanismes impliqués dans l’homéostasie pulmonaire et, plus particulièrement, d’identifier lesquels sont dérégulés dans l’asthme allergique.
Nous avons étudié l’activation des différentes populations de cellules dendritiques pulmonaires lors d’une réponse tolérogène et asthmatique. Lors d’une réponse tolérogène, nous avons observé l’activation spécifique des cellules dendritiques myéloïdes de type 2, tandis que la réponse asthmatique est accompagnée d’une augmentation de la maturation des cellules dendritiques myéloïdes de type 1.
Par la suite, nous avons investigué l’interaction entre les macrophages alvéolaires et les cellules dendritiques dans l’immunité pulmonaire. Dans cette étude, nous avons démontré que les macrophages alvéolaires naïfs contrôlent la capture de l’allergène par les cellules dendritiques, ce qui contribue au maintien de l’homéostasie pulmonaire. Finalement, nous avons déterminé que l’expression du CD200 (une protéine membranaire immunomodulatrice) présente sur les macrophages alvéolaires est dérégulée dans l’asthme et qu’il est possible d’inhiber certaines étapes de la cascade asthmatique en administrant de CD200
recombinant. À cet effet, l’administration de CD200 interfère avec le développement de l’hyperréactivité bronchique et réduit l’accumulation des cellules dendritiques myéloïdes et des lymphocytes Th2 dans le poumon.
En conclusion, cette thèse a fait la lumière sur des mécanismes immunologiques importants pour le maintien de l’homéostasie pulmonaire, en particulier que les macrophages alvéolaires et la voie du CD200 régulent l’activation des cellules dendritiques.
Abstract
Lung immunity is an ongoing equilibrium between homeostasis and inflammation. Many immune cells are involved in lung homeostasis, but little information is available on the mechanisms that regulate the development of either responses. Studies suggest that subsets of dendritic cells are differentially activated during a tolerogenic and asthmatic response, whereas alveolar macrophages are associated with the preservation of homeostasis. On the other hand, allergic asthma pathogenesis is triggered by the dysregulation of lung immunity. Thus, this thesis aim was to identify mechanisms responsible to maintain lung homeostasis and which ones are dysregulated in asthmatic response.
Hence, we investigated the activation of the multiple dendritic cell subsets in a tolerogenic and asthmatic response. The activation of the myeloid dendritic cell subset 2 was associated with tolerance, whereas the asthmatic response was associated with an increased maturation of myeloid dendritic cell subset 1.
We subsequently studied the interaction between alveolar macrophages and dendritic cell subsets in lung immunity. This study demonstrated that naïve alveolar macrophages inhibit dendritic cell capture of allergens and migration to the draining lymph nodes, which contributed to the restoration of lung homeostasis. Furthermore, we showed that asthmatic alveolar macrophages expressed less CD200, an immunomodulatory membrane protein, than naïve cells. The administration of a recombinant CD200 protein to asthmatic rats inhibited the development of airway hyperresponsiveness and reduced the accumulation of myeloid dendritic cells and inflammatory Th2 cells in the lungs.
In summary, this thesis identified multiple mechanisms that are crucial for lung homeostasis and show that alveolar macrophages and the administration of CD200 inhibit dendritic cell activation.
Table des matières
Résumé ... III Abstract ... V Table des matières ... VII Liste des tableaux ... X Liste des figures ... XI Liste des abréviations ... XIII Remerciements ... XV Avant-propos ... XVII CHAPITRE 1 : Introduction ... 1 1.1.Homéostasie pulmonaire... 2 1.1.1. Cellules épithéliales ... 2 1.1.2. Cellules dendritiques ... 3 1.1.3. Sous populations de DC ... 8 1.1.4. Macrophages alvéolaires ... 10 1.2.Le voie du CD200/CD200R ... 14 1.3.Asthme allergique ... 16 1.3.1. Généralités ... 17 1.3.2. Physiopathologie ... 20 1.3.3. Cascade inflammatoire ... 21
1.3.4. Dichotomie du rôle des AM ... 27
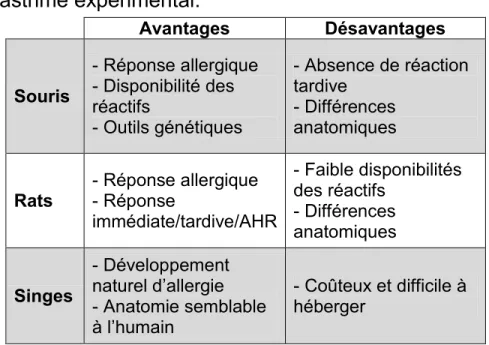
1.3.5. Modèles animaux d’asthme expérimental ... 29
CHAPITRE 2 : Problématiques, hypothèse et objectifs de recherche ... 33
2.1.Mise en contexte ... 34
2.2.Hypothèse et objectifs ... 35
CHAPITRE 3 : Lung mDC1 and mDC2 are differentially activated during a tolerogenic and asthmatic response ... 39
3.1.Page titre ... 40
3.2.Résumé ... 41
3.3.Abstract ... 42
3.4.Introduction ... 43
3.6.Results ... 46 3.7.Discussion ... 49 3.8.Acknowledgements ... 51 3.9.References ... 52 3.10.Figure legends ... 54 3.11.Figures ... 57
CHAPITRE 4 : Dysregulation of alveolar macrophages unleashes dendritic cell-mediated mechanisms of allergic airway inflammation ... 63
4.1.Page titre ... 64 4.2.Résumé ... 65 4.3.Abstract ... 66 4.4.Introduction ... 67 4.5.Results ... 69 4.6.Discussion ... 73 4.7.Methods ... 77 4.8.Disclosure ... 79 4.9.Acknowledgements ... 79 4.10.References ... 80 4.11.Figure legends ... 84 4.12.Figures ... 88
CHAPITRE 5 : Restoration of lung CD200 activity abrogates airway hyperresponsiveness in experimental asthma ... 97
5.1.Page titre ... 98
5.2.Résumé ... 99
5.3.Abstract ... 100
5.4.Introduction ... 101
5.5.Materials and Methods ... 103
5.6.Results ... 105
5.7.Discussion ... 107
5.8.Acknowledgements ... 111
5.9.References ... 112
CHAPITRE 6 : Discussion, conclusion et perspectives ... 125
6.1.Activation des populations de DC dans l’immunité pulmonaire ... 126
6.2.Mécanismes de l’homéostasie pulmonaire... 127
6.3.Conclusions et perspectives... 132
CHAPITRE 7 : Bibliographie ... 135
Liste des tableaux
CHAPITRE 1
Tableau 1.1 : Homologie des populations de DC. ... 8 Tableau 1.2 : Modèles animaux utilisés pour l’asthme expérimental. ... 30
Liste des figures
CHAPITRE 1
Figure 1.1 : Orientation de la réponse immunitaire par les DC. ... 6
Figure 1.2 : La plasticité des AM dans l’immunité pulmonaire. ... 13
Figure 1.3 : Option de traitement de l’asthme par étape. ... 19
Figure 1.4 : Biomarqueurs de l’asthme. ... 21
Figure 1.5 : Étapes importantes de la sensibilisation de l’asthme allergique. ... 23
Figure 1.6 : Cascade inflammatoire de l’asthme allergique. ... 25
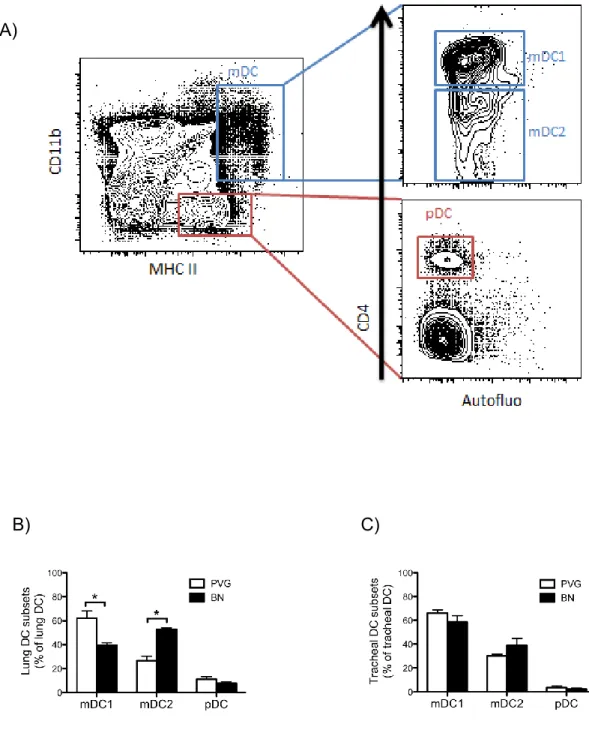
CHAPITRE 3 Figure 3.1 : The proportion of lung parenchyma mDC1 and mDC2 is different between naïve PVG and naïve BN. ... 57
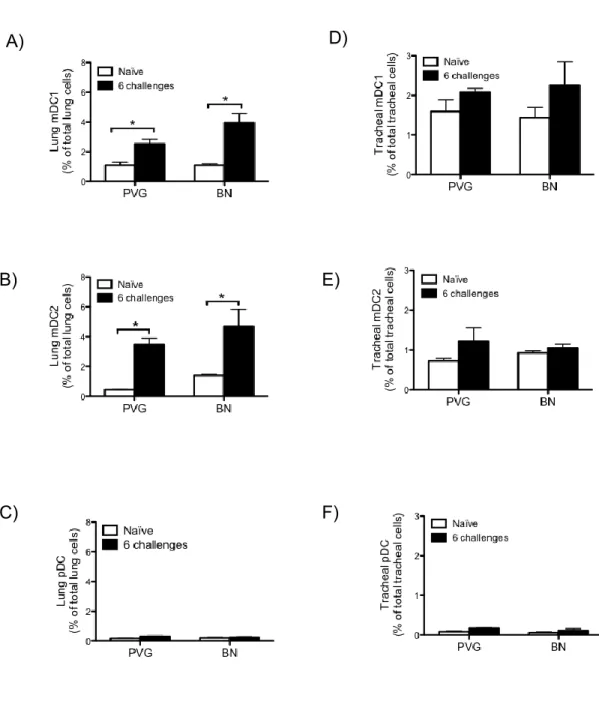
Figure 3.2 : Parenchymal mDC proportion is increased in both the tolerogenic and asthmatic response. ... 58
Figure 3.3 : The proportion of OVA+ mDC2 is increased in tolerogenic rats. ... 59
Figure 3.4 : OVA+ DC migration to the dLN is enhanced in tolerogenic rats... 60
Figure 3.5 : mDC1 maturation was increased in the dLN of asthmatic animals. ... 61
CHAPITRE 4 Figure 4.1 : Sensitization status of AM does not modulate early eosinophil recruitment in the airways ... 88
Figure 4.2 : DC recruitment in asthma is enhanced, but not modulated by AM .... 89
Figure 4.3 : DC allergen capture is decreased by AM from naïve rats ... 90
Figure 4.4 : DC accumulation in draining lymph nodes is not modulated ... 91
Figure 4.5 : OVA+ mDC accumulation in draining lymph nodes is inhibited by AM from naïve rats ... 92
Figure 4.6 : Th2 polarized cell accumulation is enhanced locally after allergen challenge and modulated by AM transfer ... 93
Figure 4.7 : AM allergen capture is enhanced in asthma, but is not modulated by adoptive transfer ... 94
Figure 4.8 : MHC II and CD23 expression are not modulated on AM early on asthma development ... 95
Figure 4.9 : AM withdrawal from the asthmatic environment restores their protective functions ... 96
CHAPITRE 5
Figure 5.1 : AM express the surface molecule CD200 and its expression is
dysregulated in asthma ... 119 Figure 5.2 : rCD200 reduces AHR, but does not modulate cell recruitment in
bronchoalveolar lavages ... 120 Figure 5.3 : mDC recruitment to the lung of asthmatic rats is inhibited by rCD200 ... 121 Figure 5.4 : rCD200 reduces the accumulation of Th2 cells in the lung of asthmatic animals ... 122 Figure 5.5 : rCD200 does not alter dLN DC and T cell numbers ... 123
Liste des abréviations
AHR : Hyperactivité bronchique / Airway hyperresponsiveness AM : Alveolar macrophage / Macrophage alvéolaire
ASM : Aiway smooth muscle B220 : Classe de CD45
BDCA : Blood dendritic cell antigen BN : Brown Norway
cAM : Macrophage alvéolaire « cultivé » CCL : Chemokine C-C motif Ligand CCR : C-C chemokine receptor
CD : Cluster of differenciation / Cluster de différenciation
CMH / MHC : Complexe majeur d’histocompatibilité / Major histocompatibility
complex
CXCL : Chemokine C-X-C motif Ligand CXCR : C-X-C chemokine receptor DALY : Disability-adjusted life year DC : Dendritic cells / Cellule dendritique DCImm : Cellule dendritique immature
DCmat : Cellule dendritique mature
dLN : Draining lymph node
DOK : Downstream of tyrosine kinase
ERK : Extracellular signal-Regulated kinases
FcR : FC receptor / Récepteur à immunoglobuline – portion FC GM-CSF : Granulocyte macrophage colony stimulating factor ICOSL : Inducible T cell CO-Stimulator Ligand
IFN : Interféron
IgE : Immunoglobuline de type E IL : interleukine / interleukin
ITIM : Immunoreceptor tyrosine-based inhibitory motif JNK : Jun N-terminal Kinase
LBA / BAL : Lavage broncho-alvéolaire / Bronchoalveolar lavage LT : Leucotriène
LyT : Lymphocyte T
LPS : Lipopolysaccharides
M1/M2 : Activation des macrophages de type 1/2 mDC : Cellule dendritique myéloide
nAM : Macrophage alvéolaire de rats naïfs NO : Oxide nitrique / Nitric oxide
OVA : Ovalbumine
p38 MAPK : p38 Mitogen-Activated Protein Kinase PD-L : Programmed cell Death Ligand
pDC : Cellule dendritique plasmacytoïde PG : Prostaglandine
PRR : Pattern recognition receptor / Récepteurs de reconnaissance de motifs moléculaires
PVG : Piebald Virol Glaxo rCD200 : CD200 recombinant
sAM : Macrophage alvéolaire de rats sensibilisés SIRP : Signal-regulatory protein alpha
TCR : T-cell receptor / Récepteur des lymphocytes T TGF : Transforming growth factor
Th : T helper / Lymphocyte T auxiliaire TLR : Toll-like receptor
TNF : Tumor necrosis factor Treg : Lymphocyte T régulateur
Remerciements
Le doctorat est une longue épreuve d’endurance qui n’aurait pu s’accomplir sans le soutien de mes directeurs de recherche, de l’équipe du laboratoire, ainsi que de ma famille et mes amis.
Tout d’abord, je voudrais remercier ma directrice de recherche Elyse Bissonnette pour toutes ces belles années qui seront la fondation de mon post-doctorat et de mes projets futurs. Merci d’avoir réussi à m’infuser un peu de ta sagesse et de ton organisation. Je tiens également à remercier mon co-directeur David Marsolais. Bien que ton arrivé au centre de recherche a presque coïncidé avec le début de mon doctorat, ton savoir et ton expertise ont grandement influencé la réalisation de mes études. Tes commentaires et tes conseils ont toujours permis d’améliorer mes projets.
J’aimerais également dire un gros merci à toutes mes assistantes de recherche, sans qui tout ce parcours n’aurait pu se réaliser. Je pense à Annie, à Véronique et, la dernière mais non la moindre, à Anick. Merci de m’avoir enduré, moi et mon désordre. Votre support et vos nombreux conseils m’ont permis de faire avancer mes projets. Je n’aurais pu passer au travers de toutes ces années sans les « sacrifices chantant », les diners sushi, les 5@7, sans oublier les nombreux cafés/diners, tous davantage ressourçant que scientifiques.
Avec les années, l’équipe Bissonnette n’a pas grandi, mais deux équipes sont venues s’y greffer, soit les équipes de Marie-Renée Blanchet et David Marsolais. Merci à vous tous d’avoir été mes collègues d’adoption et particulièrement, à EM pour toutes les pouliches / licornes / etc. qui ont rempli le lab. Merci également à la grande famille de pneumologie, notamment à Annick (ex), Marie-Josée, MEP, MET (ex) et Sophie. Merci à Laetitia pour ta bonne
humeur, ton support, tes « doux » et tes conversations toujours appréciées. Merci également à Marc pour toutes ces heures passées avec moi devant le cytomètre et à ces excellentes dégustations de bières. Merci également à mes prédécesseurs et anciens collègues de bureau : François, Marc-André, Mathieu. Vous avez été des modèles et sans vous, le bureau a perdu un peu de son âme.
Merci également à ma famille : mon père, ma mère et mon frère. Même si vous ne compreniez pas toujours (et ne comprenez peut-être pas encore) mes recherches, vous avez toujours été là pour moi. On se rend compte de l’importance de la famille lorsqu’on en a besoin et vous avez toujours répondu présent. Merci pour tout.
Finalement, je tiens à remercier mon amour, ma blonde et nouvellement, ma fiancée. J’ai passé à tes côtés les plus beaux moments de ma vie et nous avons traversé les pires épreuves. Sans toi, je n’aurais jamais réussi à être où j’en suis. Merci d’être à mes côtés et de m’endurer. Merci pour tout.
Junior, David, Ti-pou, tu as été le plus beau cadeau que l’on puisse avoir, mais tu nous as été enlevé beaucoup trop rapidement. Tu as été et tu seras toujours notre petite étoile filante...
Avant-propos
Cette thèse est constituée de 3 articles scientifiques qui abordent les mécanismes impliqués dans la régulation de l’immunité pulmonaire et l’asthme allergique. Dans un premier temps, l’introduction abordera le thème général de l’homéostasie pulmonaire, ainsi que celui de l’asthme allergique. Suivant cette dernière, trois chapitres aborderont les thèmes plus spécifiques du rôle des populations de cellules dendritiques dans l’immunité pulmonaire, celui des macrophages alvéolaires dans le maintien de l’homéostasie et finalement l’implication de la voie du CD200 dans la tolérance immunitaire.
Article 1 (chapitre 3) : Lung mDC1 and mDC2 are differentially activated during a
tolerogenic and asthmatic response
Cet article traite de l’activation différentielle des différentes populations de cellules dendritiques dans le développement d’une réponse tolérogène et asthmatique. Cette étude a été réalisée lors de mon stage doctoral dans le laboratoire du Dr Patrick Holt au Telethon Institute for Child Health Research à Perth, en Australie. Ce stage avait pour but d’apprendre de nouvelles techniques que Dre Bissonnette voulait intégrer à ses projets de recherche. Cette étude a été désignée et réalisée sous la supervision du Dr Patrick Holt. J’ai réalisé toutes les expériences présentées dans cet article avec la collaboration du Dre Deborah Strickland. Également, j’ai effectué l’analyse et l’interprétation des données avec la collaboration Dre Elyse Bissonnette et du Dr David Marsolais. J’ai également rédigé l’article avec leur collaboration. La Dre Anick Langlois a collaboré à la révision de l’article. Ce manuscrit est en préparation pour être soumis prochainement au journal Plos One.
Article 2 (chapitre 4) : Dysregulation of alveolar macrophages unleashes dendritic
cell-mediated mechanisms of allergic airway inflammation
Cet article aborde l’interaction entre les macrophages alvéolaires et les cellules dendritiques dans l’immunité pulmonaire. Cette étude a été réalisée sous la direction du Dre Elyse Bissonnette. J’ai réalisé les expériences en collaboration avec la Dre Anick Langlois. J’ai effectué l’analyse et l’interprétation des résultats ainsi que la rédaction du manuscrit en collaboration avec Dre Bissonnette et Dr David Marsolais. La Dre Anick Langlois a collaboré à la révision de l’article. Ce manuscrit a été publié dans le journal Mucosal Immunology.
Article 3 (Chapitre 5) : Restoration of lung CD200 activity abrogates airway
hyperresponsiveness in experimental asthma
Cet article investigue le rôle de la voie du CD200 dans la résolution de l’inflammation asthmatique allergique. Cette étude a été réalisée sous la direction du Dre Elyse Bissonnette et du Dr David Marsolais. J’ai réalisé les expériences en collaboration avec la Dre Anick Langlois. J’ai effectué l’analyse et l’interprétation des résultats ainsi que la rédaction du manuscrit en collaboration avec Dre Bissonnette et Dr Marsolais. La Dre Anick Langlois a collaboré à la révision de l’article. Ce manuscrit est soumis dans le journal American Journal of Respiratory
1.1. Homéostasie pulmonaire
Il est connu depuis longtemps qu’une réponse inflammatoire ne se développe pas aussi facilement dans certains organes que dans d’autres (1). En effet, il semble logique que le système immunitaire réponde rapidement à une particule étrangère dans un organe a priori stérile, tandis qu’un organe constamment exposé (tel que les intestins ou le poumon) n’ait pas le même seuil d’activation. Le poumon est un organe immuno-privilégié, en ce sens qu’il est constamment exposé aux antigènes présents dans l’air inspiré et que ces antigènes n’induisent pas d’inflammation. L’homéostasie pulmonaire est maintenue par deux grands mécanismes : l’ignorance immunitaire et la réponse tolérogène. La majorité des antigènes sont éliminés de façon silencieuse (sans se rendre dans les organes lymphoïdes secondaires pour activer une réponse immunitaire) (2). Cela peut être accompli, entre autre, par des méthodes physiques (e.g. la toux) et la dégradation de l’allergène (3). Le système immunitaire peut aussi développer une réponse tolérogène à l’antigène. En effet, lorsqu’un antigène est présenté au système immunitaire dans certaines conditions, les cellules immunitaires s’activent et produisent des médiateurs qui empêchent toute activation subséquente du système immunitaire envers cet antigène (2). Ceci s’explique en partie par une spécialisation des cellules résidentes pulmonaires, telles que les cellules épithéliales, les cellules dendritiques (DC) et les macrophages alvéolaires (AM).
1.1.1. Cellules épithéliales
Une des premières défenses de l’hôte contre son environnement est effectuée par les cellules épithéliales pulmonaires. Selon leur localisation dans le poumon, les cellules épithéliales bronchiques et alvéolaires ont des fonctions distinctes. Les premières ont davantage un rôle de barrière physique afin
d’empêcher les allergènes et les autres particules d’activer les cellules du parenchyme pulmonaire. De plus, l’épithélium bronchique sécrète du mucus et possède des cils, ce qui piège les allergènes et les élimine via les expectorations. De leur côté, les cellules épithéliales alvéolaires produisent une grande variété de médiateurs antimicrobiens afin de défendre les voies aériennes distales contre les infections (4). Toutes les cellules épithéliales expriment une grande quantité de récepteurs de reconnaissance de motifs moléculaires (pattern recognition
receptors; PRR) afin de détecter la présence de microorganismes ou de
médiateurs endogènes de danger. En plus d’avoir un rôle de détection, les cellules épithéliales jouent un rôle actif dans l’inhibition de la réponse inflammatoire (5, 6).
Les cellules épithéliales maintiennent les cellules immunitaires résidentes du poumon en état de quiescence via plusieurs mécanismes (5, 7). Elles sécrètent, entre autres, des protéines du mucus (les mucines) et des protéines du surfactant qui réduisent l’activation des cellules immunitaires, dont les AM. Il est intéressant de noter qu’à l’homéostasie, l’interaction entre les cellules épithéliales pulmonaires et les AM favorise la réponse anti-inflammatoire de ces dernières (voir section 1.1.3). En effet, les cellules épithéliales produisent de grande quantité d’interleukine (IL)-10 et de Transforming Growth Factor (TGF)- (5, 7) et expriment plusieurs protéines membranaires anti-inflammatoires, dont le CD200 (voir section 1.2) (8). Les cellules épithéliales sont donc des joueurs importants pour le maintien de l’homéostasie pulmonaire, ainsi que pour la surveillance pulmonaire.
(9)
1.1.2. Cellules dendritiques
La surveillance immunitaire du poumon est également assurée par les DC. Les DC sont des cellules immunitaires résidentes de tissus principalement retrouvées à l’interface entre le soi et l’environnement (e.g. la peau, les intestins et les poumons). Puisque les DC pulmonaires sont situées sous la membrane basale,
ainsi qu’au travers de l’épithélium, elles peuvent étirer leurs dendrites dans la lumière des voies aériennes et ainsi échantillonner les particules entrant dans le poumon. Les DC sont les principales cellules présentatrices d’antigènes et assurent le lien entre l’immunité innée (non spécifique) et l’immunité adaptative (reconnaissance spécifique des antigènes) au niveau pulmonaire (10). Ainsi, les DC forment un réseau de surveillance très étendu, dont les effectifs sont étroitement contrôlés. En effet, le nombre de DC pulmonaires est contrôlé par des cellules résidentes, telles les cellules épithéliales et les AM, et dépend de l’historique des infections (nombre, diversité et temps depuis la résolution de l’inflammation) (11, 12). Un autre facteur qui affecte leur fonction est leur localisation dans les compartiments pulmonaires. En situation homéostatique, les DC de la trachée ne se comportent pas comme les DC du poumon (ou des alvéoles) (13). En autre, le renouvèlement des DC de la trachée est plus rapide que celui des DC pulmonaires. Par contre, peu d’études se sont attardées à cette différence en situation inflammatoire. Le rôle des DC dans l’activation du système immunitaire est donc central, puisque celles-ci assurent la surveillance du poumon aussi bien en situation homéostatique que lors d’infection.
Homéostasie
En situation normale, les DC migrent de façon ininterrompue vers les ganglions lymphatiques afin d’assurer une surveillance immunitaire continue des voies aériennes (14, 15). Cette migration s’effectue rapidement, de sorte que la demi-vie des DC pulmonaires est de l’ordre de quelques jours. Le recrutement des DC pulmonaires et leur migration vers les ganglions lymphatiques sont contrôlés par de nombreuses chimiokines. Les cellules épithéliales pulmonaires et les AM sont les plus importants producteurs de chimiokines présentes dans le poumon et plusieurs d’entre elles sont reconnues pour affecter le recrutement des DC, dont le CCL (Chemokine C-C motif Ligand) 2, CCL3, CCL5 et le CXCL (Chemokine C-X-C
motif Ligand) 15 (16). L’expression de plusieurs des récepteurs pour ces
les DC est nécessaire pour leur recrutement au poumon (17). Lorsqu’aucun PRR n’est activé sur les DC avant la fin de leur « quart de travail », celles-ci migrent vers les ganglions lymphatiques tout en conservant un phénotype immature (faible expression des molécules de co-stimulation, telles que CD80 ou CD86) (18). La redirection des DC vers les ganglions s’effectue par un changement d’expression des récepteurs de chimiokines. En effet, les récepteurs assurant leur recrutement dans les poumons diminuent et les récepteurs favorisant leur migration dans les ganglions, comme le CCR7 et le CCR8, augmentent. (12, 17). Une fois dans les ganglions lymphatiques, les DC immatures présentent les antigènes capturés dans le poumon via les molécules du complexe majeur d’histocompatibilité (CMH) pour induire une réponse tolérogène (Figure 1.1 – panneau du haut) (19, 20). Ainsi, les DC immatures induisent, chez les lymphocytes T qui expriment le TCR (T Cell
Receptor) spécifique au complexe CMH/antigène, soit l’anergie des lymphocytes T
ou leur différentiation en lymphocytes T régulateurs (Treg). En revanche, lors d’une infection, les DC sont rapidement activés.
Inflammation
En situation inflammatoire, le réseau de DC est fortement altéré. Le nombre de DC pulmonaire augmente peu de temps après l’activation des PRR. En effet, les DC sont recrutées aussi rapidement que les neutrophiles (les premiers répondeurs du système immunitaire). L’origine de ces DC est encore matière à débat, mais certaines études suggèrent qu’en condition inflammatoire des monocytes circulants maturent en DC pulmonaires « inflammatoires » (17, 21). En plus d’augmenter le nombre de DC pulmonaires, la réponse inflammatoire pulmonaire module les fonctions et la production des précurseurs des DC dans la moelle osseuse (21, 22). Ainsi, en situation inflammatoire, le recrutement de DC débute rapidement avec l’arrivée de monocytes circulants et perdure sur une longue période avec la différenciation des DC « inflammatoires» de la moelle osseuse.
En plus d’affecter le renouvèlement des populations de DC, l’activation de PRR à la surface d’une DC induit sa maturation. Ce phénotype mature se caractérise par une réduction de sa capacité phagocytaire et une augmentation de sa capacité à présenter les antigènes, afin d’activer les lymphocytes et d’initier une réponse immune. Trois signaux émis par les DC sont nécessaires pour que les lymphocytes des ganglions lymphatiques développent une réponse spécifique à
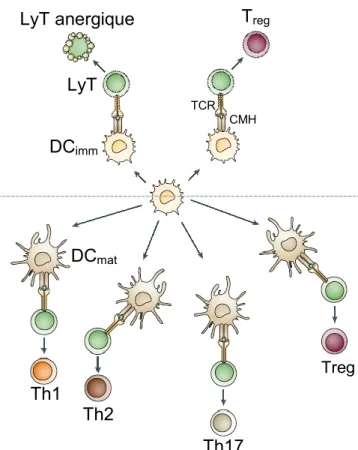
DCimm LyT Treg Treg CMH TCR LyT anergique DCmat Th1 Th2 Th17
Figure 1.1 : Orientation de la réponse immunitaire
par les DC.
Les DC immatures (panneau du haut) sont principalement impliquées dans l’induction de l’anergie des lymphocytes T (LyT) ou la polarisation en Treg. Lorsque matures, les DC orientent la réponse immunitaire principalement vers une réponse Th1, Th2, Th17 ou Treg.
DCimm : DC immatures; DCmat : DC matures; LyT :
lymphocytes T.
récepteurs à chimiokines spécifiques pour leur migration vers le poumon (23). Les DC commencent par surexprimer le CMH afin de faciliter la formation de synapses immunologiques entre eux et les lymphocytes T spécifiques à l’antigène échantillonné (signal 1). Ensuite, les molécules de co-stimulation (signal 2) présentes à la surface des DC modulent l’activation des lymphocytes (23). En effet, lors d’une réponse inflammatoire, les DC augmentent l’expression du CD80 et CD86, tandis qu’une réponse tolérogène est associée avec l’expression de l’ICOSL (Inducible T cell CO-Stimulator Ligand) et de PD-L (Programmed cell
Death Ligand) (23). Finalement, les cytokines produites par les DC (signal 3), ainsi
que celles présentes dans l’environnement immédiat, déterminent la nature de la réponse lymphocytaire (Figure 1.1 – panneau du bas). Malgré que les cytokines aient souvent de multiples fonctions et que celles-ci soient interconnectées, chaque réponse lymphocytaire est caractérisée par la présence d’une cytokine prototypique. En simplifiant, les Treg sont induits par la présence d’interleukine (IL)-10, tandis que l’IL-12, IL-4 et l’IL-23 polarisent vers des réponses inflammatoires de type T helper (Th) 1, Th2 et Th17, respectivement (24). En plus des signaux émis par les DC, la concentration d’antigènes présentée aux lymphocytes influence la nature de la réponse immunitaire. Cependant, une controverse existe à savoir si une réponse tolérogène est favorisée par une faible dose d’antigènes ou si c’est plutôt une forte dose d’antigène qui induit la tolérance. Aussi, certaines études suggèrent que la dose d’antigène à laquelle un individu est exposé favorise le développement d’une réponse immune Th1 ou Th2 (25).
En résumé, les DC jouent un rôle central dans la surveillance immunitaire du poumon, aussi bien à l’homéostasie qu’en présence de pathogènes, via l’éducation des lymphocytes soit vers une réponse anti-inflammatoire ou vers une réponse inflammatoire appropriée. L’activation des DC dépend également de leur localisation dans le poumon. En plus des nombreux signaux et facteurs, la nature de la réponse immunitaire est également modulée par le type de DC impliqué.
1.1.3. Sous populations de DC
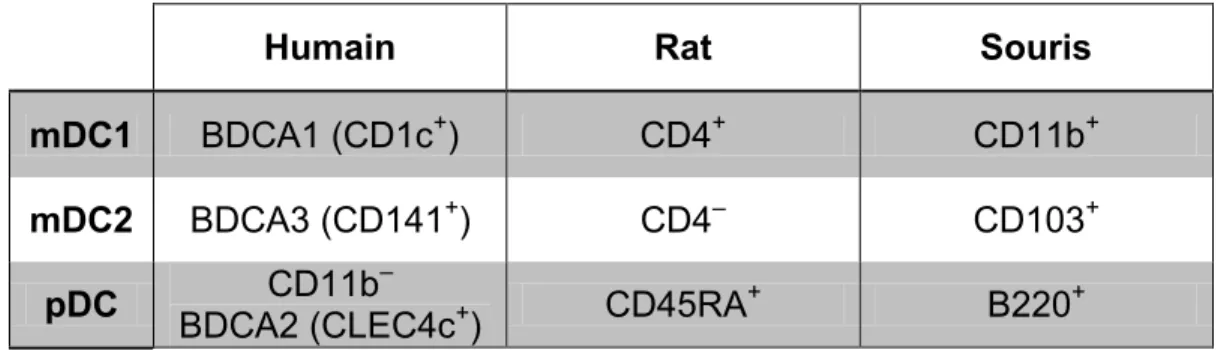
Pour assurer une surveillance efficace du poumon, les DC sont subdivisées en plusieurs populations avec des fonctions distinctes, permettant ainsi d’activer différentes voies de la réponse immunitaire. Dans les poumons, au moins deux populations de DC ont été décrites, soit les DC myéloïdes (mDC; ou DC conventionnelles) et les DC plasmacytoïdes (pDC) (28). Malgré la difficulté à déterminer l’homologie des populations de DC humaines et murines via l’expression de marqueur de surface (Tableau 1.1), l’étude de leurs fonctions a permis de contourner ce problème. En effet, la comparaison des profils d’ARN messagers, ainsi que la réponse des populations de DC à des stimuli de danger ont permis d’identifier les populations orthologues (26, 29).
DC myéloïdes
Les mDC représentent la majorité des DC pulmonaires et sont distribuées aussi bien dans les voies aériennes que dans le parenchyme pulmonaire (13, 30). Elles expriment grandement les molécules impliquées dans la voie du CMH de classe II (CMH II), ce qui leur permet d’activer les lymphocytes CD4+. De plus, la diversité de PRR à leur surface, tel que les Toll like receptor (TLR)-1 à -4 et -8, leur permet de détecter la présence d’une panoplie de bactéries et ainsi activer une
Tableau 1.1 : Homologie des populations de DC.
Humain Rat Souris
mDC1 BDCA1 (CD1c+) CD4+ CD11b+
mDC2 BDCA3 (CD141+) CD4– CD103+
pDC CD11b–
BDCA2 (CLEC4c+) CD45RA+ B220+
Identification simplifiée des différentes sous populations de cellules dendritiques à l’aide de marqueurs de surfaces selon l’espèce étudiée (26, 27).
réponse immune (31). Les mDC se subdivisent en deux sous-populations, soit les mDC1 et mDC2 (Tableau 1.1), chacune étant dotée d’un pouvoir d’activation distinct et qui conduit à un éventail plus large de réponses immunes.
Les mDC1 ont une plus grande expression des protéines de la voie phagocytaire que les mDC2, ce qui les spécialise dans la capture de particules solubles. En effet, les mDC1 sont majoritairement responsables du transport des allergènes du poumon vers les ganglions lymphatiques (11). De plus, les mDC1 sont importantes pour la défense contre les pathogènes extracellulaires en induisant la réponse humorale des lymphocytes CD4+ (27, 32). Quant à elles, les mDC2 sont spécialisées dans la présentation croisée (particules solubles présentées via la voie du CMH I) et dans la présentation d’antigènes provenant de cellules apoptotiques. Ainsi, les mDC2 activent aussi bien les lymphocytes CD4+ que CD8+ lorsqu’en présence de particules extracellulaires (e.g. virus libre ou allergène) que lors d’infection avec des pathogènes intracellulaires (27, 33). Par contre, la répartition des tâches pour induire une réponse tolérogène est encore mal définie entre les mDC1 et mDC2 pulmonaires (34). En effet, aucune étude n’a encore confirmé (ni infirmé) la capacité des mDC1 à polariser les lymphocytes T en Treg. Pour ce qui est des mDC2, plusieurs études suggèrent que, dans le poumon, elles aient un rôle actif dans l’activation des Treg. En effet, les mDC2 intestinaux sont importantes pour l’induction de Treg (35-37) et certaines évidences suggèrent que les mêmes mécanismes sont présents dans le poumon (11). Cependant, certains suggèrent que les pDC (voir plus bas) soient les DC impliquées dans l’homéostasie (38, 39). En résumé, les mDC sont divisées en deux sous-populations, mais leur implication dans le développement d’une réponse tolérogène pulmonaire est encore matière à débat.
DC plasmacytoïdes
Les pDC représentent un faible pourcentage des DC pulmonaires, mais sont très importantes pour combattre les infections virales (28, 40, 41). En effet, les
pDC ont tout d’abord été identifiées grâce à leur capacité à produire de grande quantité d’interféron (IFN) en réponse à une infection virale, via l’activation des PRR responsables de la reconnaissance des virus (TLR-7 et -9 ) (41). Pour ce qui est de leur capacité à activer les lymphocytes, les pDC sont moins efficaces que les mDC, mais peuvent activer aussi bien des lymphocytes CD4+ que CD8+ (42). De plus, plusieurs études suggèrent que les pDC sont impliquées dans l’activation d’une réponse Th17 (importante pour la défense contre les parasites). Du point de vue de l’homéostasie pulmonaire, certaines études suggèrent que les pDC, et non les mDC, jouent un rôle lors du développement d’une réponse tolérogène contre un allergène (38, 39). Par contre, chez l’humain, une étude suggère que les pDC sont incapables d’activer les Treg (43). Les pDC sont donc une sous-population minoritaire de DC pulmonaire, dont le rôle est diversifié, mais aussi controversé, allant de la réponse antivirale au combat des pathogènes extracellulaires.
En résumé, les DC sont des cellules clé de l’immunité pulmonaire, car elles sont responsables de la détection et de la capture des éléments exogènes, ainsi que de l’induction de la réponse immune appropriée. Par contre, l’implication des différentes populations de DC pulmonaires dans la réponse tolérogène est encore une question controversée.
1.1.4. Macrophages alvéolaires
Les AM sont des cellules immunitaires résidentes des alvéoles, ainsi que des bronches et de la trachée, et sont les plus abondantes en situation non-inflammatoire. Contrairement aux DC, les AM assurent la surveillance du poumon sans pouvoir activer directement les lymphocytes. En effet, les AM sont de mauvais présentateurs antigéniques, puisqu’ils expriment constitutivement de faible niveau de CMH et de molécules de co-stimulation (44). Par contre, les AM sont des phagocytes professionnels responsables d’éliminer aussi bien les cellules
apoptotiques que les pathogènes ou particules du non-soi (45). Pour ce faire, les AM expriment de nombreux récepteurs (entre autres, les récepteurs à immunoglobulines (FcR), à mannose et du complément) qui leur permettent de phagocyter une multitude de particules opsonisées ou non (44). Par exemple, lorsque des souris sont infectées avec des doses sublétales de Klebsiella
pneumonia, les AM phagocytent les bactéries et ce, sans déclencher de réponse
systémique (46). Inversement, lorsque les AM sont déplétés, les bactéries s’accumulent aux poumons et dans le sang, ce qui entraine la mort rapide des souris (46). De plus, les AM jouent un rôle important dans la détection de l’infection et la mise en place de la réponse adéquate. En fonction de la quantité de l’inoculum et de la nature de l’infection, soit les AM éliminent les bactéries de façon silencieuse, soit ils libèrent des cytokines et des chimiokines pour activer les cellules environnantes et recruter d’autres cellules immunitaires (comme les neutrophiles) (45, 47). La déplétion des AM lors d’une infection à Pseudomonas
aeruginosa entraine une réduction de la neutrophilie et de l’inflammation
pulmonaire, mais cette absence d’inflammation induit une mortalité accrue, qui est associée à une augmentation de la charge bactérienne (48). Donc, les AM sont des cellules résidentes du poumon qui jouent un rôle important dans la défense immunitaire pulmonaire.
Afin de surveiller l’environnement pulmonaire, les AM expriment de nombreux PRR, principalement les TLR-2 et -4, et libèrent un grand nombre de médiateurs inflammatoires (principalement le TNF (Tumor Necrosis Factor)- et le leucotriène (LT) B4) et de chiomiokines pour activer et recruter des cellules
immunitaires (44, 45). De plus, l’activation des AM entraine la libération de chimiokines pro-inflammatoires par les cellules épithéliales pulmonaires (49). La pluralité des réponses immunes que peuvent mettre en place les AM est en parti causée par sa grande plasticité (Figure 1.2). En effet, selon le signal de danger perçu, les AM se polarisent en plusieurs phénotypes, ce qui s’accompagne de profondes altérations de leur profil de médiateurs sécrétés, ainsi que de leurs protéines de surface (50). Bien que la polarisation des macrophages s’effectue
généralement de façon homologue à celle des lymphocytes Th1/Th2 (M1 et M2), plusieurs études suggèrent que cette identification ne s’applique pas parfaitement aux AM (51). À défaut de meilleures alternatives et puisque de nombreuses études emploient ce classement, ce sera celui utilisé dans cette thèse. L’activation classique des macrophages (M1) est induite lors de réponse immunitaire de type Th1, ainsi qu’en réponse à une infection bactérienne (52). Ainsi, les macrophages M1 augmentent leur capacité à présenter des antigènes et produisent aussi une grande quantité d’oxyde nitrique (NO), de TNF- et d’IFN afin de pouvoir combattre les infections. L’activation « alternative » des macrophages (M2) est connue depuis de nombreuses années, mais il est de plus en plus clair que cette réponse est aussi bien constituée de phénotypes pro-inflammatoires (M2a et M2b) qu’anti-inflammatoires (M2c) (52). Le phénotype M2a est induit par une réponse immunitaire de type Th2, ce qui favorisent la réparation tissulaire et l’élimination des parasites par les macrophages M2a (53). De son côté, la réponse pro-inflammatoire M2b est induite par l’activation de PRR (entre autres par les lipopolysaccharides (LPS)) et les complexes anticorps-antigène. Finalement, la réponse anti-inflammatoire M2c est induite, entre autres, par l’IL-10 et les corticostéroïdes (52). En résumé, les AM sont des cellules plastiques qui sont impliquées aussi bien dans la défense antibactérienne que dans la réponse anti-inflammatoire.
Plusieurs études démontrent que, malgré cette grande plasticité, les AM favorisent de façon constitutive la régulation et la résolution de l’inflammation pulmonaire (Figure 1.2) (48, 54). En effet, les AM sont essentiels pour inhiber le développement d’une réponse inflammatoire pulmonaire excessive, aussi bien contre des allergènes que des composés chimiques (55-58). De plus, les AM sont les macrophages qui expriment le plus fortement le CD200R, une protéine de surface anti-inflammatoire, dont l’activation est impliquée dans le maintien de l’homéostasie pulmonaire (voir section 1.3) (59, 60). Le rôle des AM dans l’homéostasie pulmonaire est également supportée par leur capacité à polariser les lymphocytes T en Treg via la libération d’une panoplie de médiateurs
anti-inflammatoires, tels que les prostaglandines (PG) E2, l’IL-10 et le TGF- (61).
Finalement, les AM interfèrent avec le développement de la réponse humorale en inhibant l’activation des DC, ainsi que celle des lymphocytes T et B (62, 63). Quoique les mécanismes impliqués dans ces processus soient encore mal définis, certaines évidences suggèrent que le NO et le TGF- soient impliqués (63, 64). En résumé, les AM sont donc des phagocytes professionnels qui contrôlent l’activation de plusieurs cellules pulmonaires, dont les DC. Bien que la régulation des DC par les AM soit connue, peu d’information est disponible sur les mécanismes qui sont responsables de cette interaction.
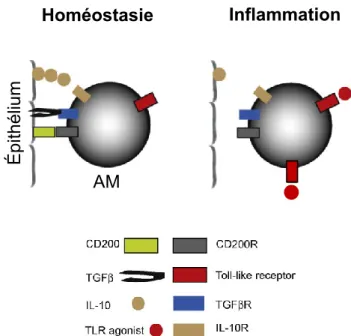
Homéostasie Inflammation É p ith é liu m AM
Figure 1.2 : La plasticité des AM dans l’immunité pulmonaire.
Les AM et l’épithélium pulmonaire interagissent afin de déterminer la réponse immunitaire à mettre en place. En situation homéostatique, les AM sont quiescents via les signaux émis par les cellules épithéliales pulmonaires. Par contre, lorsqu’un signal de danger est détecté par les AM via leurs PRR, les AM s’activent et ils initient une réponse inflammatoire. Finalement, lorsque le signal de danger n’est plus détecté, l’inflammation se résout et l’homéostasie se remet en place.Plusieurs cellules pulmonaires agissent en synergie pour préserver l’homéostasie pulmonaire et combattre l’entrée de pathogènes dans la circulation. Entre autres, les cellules épithéliales agissent comme barrière physique, tandis que les DC polarisent la réponse immunitaire et les AM préservent l’homéostasie pulmonaire. De plus, la communication intercellulaire via les protéines membranaires, dont la voie du CD200/CD200R, est essentielle dans la régulation de l’immunité pulmonaire et fera en partie l’objet de la présente thèse.
1.2. Le voie du CD200/CD200R
L’homéostasie pulmonaire est maintenue via la libération de nombreux médiateurs ainsi que par l’interaction de plusieurs cellules. Afin d’aviser les cellules avoisinantes de la réponse à mettre en place, les cellules expriment un certain nombre de protéines membranaires. Pour maintenir l’homéostasie pulmonaire et mettre en place une réponse anti-inflammatoire, la voie du CD200/CD200R occupe une place centrale. En effet, l’activation du CD200R par le CD200 inhibe l’activation de plusieurs cellules pro-inflammatoires.
Le CD200 est une protéine membranaire de la superfamille des immunoglobulines qui est impliquée dans l’induction d’une réponse anti-inflammatoire. Contrairement à la plupart des autres protéines membranaires, le CD200 ne possède pas de domaine de signalisation intracellulaire. Il induit donc une réponse anti-inflammatoire en inhibant l’activation des cellules exprimant son récepteur (le CD200R) (65).. Dans le poumon, le CD200 est présent à la surface de nombreuses cellules, incluant des cellules structurales (les cellules épithéliales et endothéliales) et des cellules immunitaires (les lymphocytes, les macrophages et les DC) (66). Chez les DC pulmonaires, l’expression du CD200 varie selon la
expression de CD200, suivi par les mDC1 et les pDC (67). De plus, l’expression du CD200 est très modulable. Entre autres, la surexpression du CD200 est observée sur des macrophages stimulés avec du LPS (68), ainsi qu’en réponse à certains médiateurs pro-inflammatoires, e.g. le TNF ou l’IFN (69). De plus, l’expression du CD200 est sous le contrôle de la voie des ERK (Extracellular signal-Regulated
kinases). En effet, une plus grande activité de ERK est liée à la surexpression de
CD200 dans certains types de tumeurs (70).
Le CD200R est, quant à lui, principalement exprimé par les cellules immunitaires myéloïdes, dont les macrophages et les DC. Contrairement à la plupart des récepteurs anti-inflammatoires, le CD200R ne possède pas de domaine de signalisation ITIM (Immunoreceptor Tyrosine-base Inhibitory Motif). Par contre, l’activation du CD200R entraine une cascade de phosphorylation impliquant les molécules adaptatrices DOK1/2 (Downstream Of tyrosine Kinase) (71, 72). Une fois les protéines DOK phosphorylés, il y a inhibition de plusieurs voies de signalisation, dont celles de ERK, JNK (Jun N-terminal Kinase) et p38 MAPK (p38 Mitogen-Activated Protein Kinase). Chez le mastocyte, l’activation de CD200R interfère avec la dégranulation, tandis que chez les macrophages, elle entraine une diminution de la production de cytokines pro-inflammatoire (dont le TNF, l’IFN et l’IL-8), tout en réduisant l’expression du CMH II (60, 71, 73, 74). De plus, l’expression du CD200R chez les macrophages est associée au phénotype anti-inflammatoire M2c (voir section 1.1.4) (65). L’expression du CD200R chez les AM est beaucoup plus élevée que chez d’autres macrophages tissulaires, ce qui suggère que les AM sont, par défaut, d’avantage orientés vers une réponse anti-inflammatoire (60). Cette forte expression de CD200R est sous l’influence de l’importante concentration locale d’IL-10 et de TGF-dans le poumon (8). Bien que le CD200R soit le récepteur le plus étudié, certaines études ont démontré l’existence de récepteurs homologues au CD200R (CD200RL), mais dont l’affinité au CD200 est questionnée (75, 76).
Le CD200/CD200R est important pour le maintien de l’homéostasie. Sa dérégulation est impliquée dans de nombreuses pathologies (69, 77). La surexpression de la voie CD200/CD200R est associée à la progression de plusieurs tumeurs, tandis qu’une faible expression de CD200 est impliquée dans plusieurs maladies auto-immunes, telles que l’arthrite (65, 69, 78). Dans le poumon, la perte de CD200 altère la réponse antivirale. En effet, des souris déficientes en CD200 infectées par le virus de l’influenza présentent une plus grande inflammation pulmonaire et une plus faible la charge virale, mais cela a pour conséquence néfaste d’entrainer une plus grande perte de poids et une morbidité plus sévère (60, 79). Quoiqu’aucune étude n’ait évalué l’expression de la voie CD200/CD200R dans l’asthme allergique, l’activation des mastocytes (cellules importantes dans la cascade asthmatique; voir section 1.3.3) est inhibée par le CD200 (72). De plus, une étude génétique a associé une diminution de l’expression de CD200 avec l’exacerbation de l’asthme (80).
En résumé, le CD200 et son récepteur sont impliqués dans le maintien de l’homéostasie et particulièrement dans le poumon (8). Par contre, le rôle de la voie du CD200/CD200R dans l’asthme allergique est encore inconnu.
1.3. Asthme allergique
L’homéostasie pulmonaire est importante afin de maintenir le statu quo face aux particules exogènes qui entrent dans le poumon. Lorsque ce mécanisme est défectueux, le seuil d’activation du système immunitaire est diminué et cela peut conduire au développement de maladies inflammatoires, telles que l’asthme (81, 82). En effet, chez les asthmatiques, le système immunitaire réagit de façon exagérée à un élément habituellement inoffensif. Bien que l’asthme ait plusieurs
grande proportion des asthmatiques sont allergiques. Pour cette raison, cette thèse se concentre uniquement sur la pathologie de l’asthme allergique.
Chez les asthmatiques allergiques, les fonctions respiratoires sont diminuées lors de l’exposition à un allergène. En outre, la pathologie de l’asthme allergique se caractérise par une bronchoconstriction réversible, une inflammation de type Th2, le développement d’une hyperactivité bronchique (AHR) et du remodelage bronchique. Afin de mieux définir l’asthme allergique, cette section sera divisée en trois parties, soit des informations générales, une description de la pathologie et un survol de la réaction inflammatoire.
1.3.1. Généralités
L’asthme allergique est une maladie hétérogène débutant aussi bien chez les enfants que les adultes et qui est présente dans les pays occidentaux et les pays en voie de développement. Mondialement, il y a environ 235 millions d’asthmatiques (83). Au Canada, la prévalence atteint presque les 10% (84). De plus, dans certaines régions du monde, 30 % des enfants sont asthmatiques et les deux tiers de ceux-ci le resteront à l’âge adulte (85). Malgré un indice DALY (indice de la mortalité et la morbidité) faible (25e position en 2001) (86), l’asthme entraine un fardeau économique important (les coûts associés à l’asthme sont d’environ 654 millions $ annuellement au Canada (87, 88)).
Bien que les facteurs induisant le développement de l’asthme ne soient pas encore totalement élucidés, plusieurs facteurs de risque lui sont associés. Les deux principales catégories de facteurs de risque sont les prédispositions génétiques et l’exposition environnementale; ceux-ci agissant en synergie. Beaucoup d’efforts ont été investis pour identifier des variations génétiques associées à l’asthme (ou un de ces composants, e.g. l’AHR), ce qui a généré une
longue liste de gènes liés à la susceptibilité de développer de l’asthme (89, 90). Malheureusement, plusieurs de ces gènes ont seulement été identifiés dans un nombre limité d’études et la plupart de ces gènes expliquent une faible portion de l’héritabilité de la maladie (89, 91). De plus, l’augmentation de la prévalence observée lors des dernières décennies est vraisemblablement causée par des facteurs environnementaux (ou l’interaction entre les gènes et l’environnement) et non par une « dérive » génétique (92, 93). En autres, plusieurs études ont démontré le rôle des infections virales (i.e. leur nature, fréquence et intensité) dans le développement de l’asthme (94, 95). Par contre, les thérapies proposées sont encore basées sur les connaissances classiques de l’asthme et tardent à inclure (et/ou identifier) de nouvelles cibles thérapeutiques.
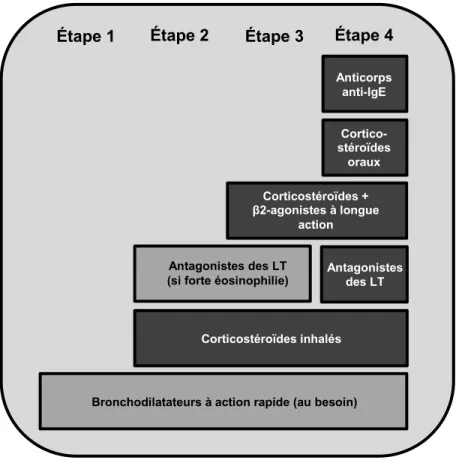
Deux catégories de médicaments sont utilisées pour traiter l’asthme : les bronchodilatateurs et les anti-inflammatoires (96, 97). Leur utilisation a comme objectif principal de prévenir l’apparition de symptômes, ainsi que de réduire le risque d’exacerbation (Figure 1.3) (97). Les 2-agonistes (bronchodilatateur) à action rapide ou à longue action ont simplement pour but de dilater les voies aériennes et ainsi, de prévenir ou de stopper la bronchoconstriction lors de la réaction immédiate (voir section 1.3.2). Si la fréquence des crises d’asthme est élevée (plus de deux par semaine) ou si l’asthme s’exacerbe, il est recommandé d’ajouter d’autres classes de médicaments (Figure 1.3). L’inhalation de corticostéroïdes permet de réduire l’inflammation pulmonaire de façon non-spécifique. L’utilisation d’antagonistes des LT peut être efficace chez les patients sévères ou ceux présentant une forte éosinophilie, car les LT sont entre autre impliqués dans le recrutement de ces cellules (Figure 1.3; étape 2). Une autre option est l’utilisation d’anti-IgE (Immunoglobuline E) (98, 99). Cette classe de médicament permet de bloquer la liaison des IgE avec leurs récepteurs, ce qui interfère avec la réaction asthmatique et particulièrement l’étape de sensibilisation (voir section 1.3.3). (97)
Malgré tout, une certaine portion d’asthmatiques n’arrive toujours pas à contrôler leurs symptômes avec les différentes options disponibles (98, 100), ce qui suggère que d’autres mécanismes sont impliqués dans l’immunité pulmonaire. Une meilleure compréhension de ces mécanismes permettrait de cibler différentes voies, telles que CD200/CD200R, pour mieux contrôler l’asthme. En somme, l’asthme est une maladie inflammatoire très répandue qui est partiellement contrôlée par l’utilisation de bronchodilatateurs et d’anti-inflammatoires.
Figure 1.3 : Option de traitement de l’asthme par
étape.
Shématisation simplifiées des étapes de traitements telles que recommandé par le Global initiative for Asthma en 2011 (97). Selon le niveau de contrôle et d’exacerbation du patient, il peut augmenter ou descendre d’une étape.
Étape 2 Étape 3 Étape 4 Étape 1 Corticostéroïdes inhalés Antagonistes des LT Corticostéroïdes + β2-agonistes à longue action Antagonistes des LT (si forte éosinophilie)
Bronchodilatateurs à action rapide (au besoin)
Cortico-stéroïdes
oraux Anticorps
1.3.2. Physiopathologie
L’asthme allergique est une maladie hétérogène qui possède plusieurs phénotypes et tout autant d’étiologies (101-103). En effet, l’asthme est de plus en plus considéré comme un syndrome regroupant plusieurs « sous pathologies ». La grande famille de l’asthme se caractérise principalement par l’obstruction réversible des voies aériennes, tandis que les sous-catégories sont distinguées à l’aide d’une multitude de biomarqueurs. Plusieurs marqueurs sont de plus en plus acceptés (tels que la concentration de NO exhalée et les niveaux d’éosinophiles dans les lavages broncho-alvéolaire (LBA) ou les expectorations induites), tandis que d’autres restent encore sous investigation (e.g. la concentration sérique d’IgE et le profil de cytokines des LBA) (Figure 1.4) (104-106). Malgré tout, l’asthme allergique est classiquement caractérisé par une contraction rapide, mais réversible, des voies aériennes lorsqu’exposées à un allergène, le développement d’une AHR, la mise en place d’une inflammation chronique de type Th2 et le remodelage des voies aériennes (85, 107, 108).
Lorsqu’un asthmatique est exposé à un allergène (provocation), il y a une réaction immédiate et une réaction tardive. La réaction immédiate se produit quelques minutes après la provocation et entraine une contraction des voies aériennes principalement causée par l’activation des mastocytes (109). La réaction tardive n’est pas présente chez tous les asthmatiques, mais lorsque présente, elle débute de 3 à 6 heures après la provocation et peut durer quelques jours si elle n’est pas contrôlée (107). Lors de la réaction tardive, il y a un rétrécissement des voies aériennes, mais celui-ci est principalement causé par une infiltration de cellules inflammatoires de type Th2 dans la muqueuse bronchique (110). Finalement, toutes les cellules inflammatoires ainsi que de nombreux médiateurs déclenchent des modifications structurelles qui aboutissent au développement de l’AHR, ainsi qu’au remodelage bronchique. Le remodelage bronchique est une série de modifications structurelles qui incluent la désorganisation de l’épithélium, l’épaississement de la membrane basale, l’hypersécrétion de mucus et la
prolifération des cellules musculaires lisses et des myofibroblastes (103). Bref, l’asthme est une maladie hétérogène, regroupant un certain nombre de caractéristiques communes, causée par l’activation d’une panoplie de cellules inflammatoires.
1.3.3. Cascade inflammatoire
Plusieurs cellules immunitaires jouent un rôle important dans le développement de l’asthme allergique. Comme son nom l’indique, l’asthme allergique est une réponse immune contre un allergène, substance normalement non-immunogène. L’inflammation observée chez les asthmatiques, aussi bien
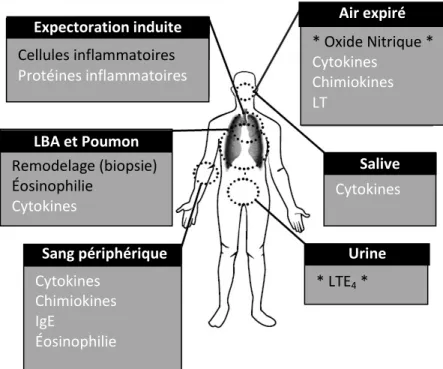
Figure 1.4 : Biomarqueurs de l’asthme.
Afin de distinguer les différentes catégories d’asthme, certains biomarqueurs sont acceptés (texte noire), en voie d’être accepté (flanqué de *) et ceux qui sont encore sous investigation (texte blanc).
LBA : Lavage broncho-alvéolaire; IgE : Immunoglobuline E; LT : Leucotriène. Modifié de Vijverberg et al (105). * LTE4 * Cytokines * Oxide Nitrique * Cytokines Chimiokines LT Cellules inflammatoires Protéines inflammatoires Remodelage (biopsie) Éosinophilie Cytokines Cytokines Chimiokines IgE Éosinophilie Expectoration induite LBA et Poumon Sang périphérique Air expiré Salive Urine
dans le LBA que les biopsies, se caractérise principalement par une accumulation de lymphocytes, d’éosinophiles et de mastocytes (103, 110, 111). Il est important de noter que plusieurs facteurs, mentionnés plus haut (section 1.2.1), sont impliqués dans le développement de l’inflammation en réponse aux allergènes, mais le rôle exact de chacun est encore mécompris. Néanmoins, l’activation du système immunitaire dans l’asthme se divise en deux sections principales, soit l’étape de sensibilisation et celle d’amplification de l’inflammation.
Sensibilisation
La sensibilisation survient lorsque les allergènes qui pénètrent dans les voies aériennes sont capturés par une cellule présentatrice d’antigènes (Figure 1.5). Dans l’asthme, les DC sont les principales cellules présentatrices d’antigènes, mais les cellules épithéliales, les lymphocytes B et les macrophages peuvent également effectuer ce rôle (112). Plusieurs études suggèrent que les mDC sont responsables d’échantillonner les voies aériennes à la recherche d’allergènes, tandis que les pDC jouent un rôle secondaire en favorisant la mise en place d’un environnement Th2 (11, 113-115). L’activation des DC via les PRR est nécessaire pour leur maturation et leur migration vers les ganglions lymphatiques. Quoique plusieurs allergènes activent directement les PRR (soit en liant directement le PRR soit en libérant des ligands pour les PRR via leur activité protéolytique), certains allergènes sont dépourvus de cette capacité (116, 117). Dans ces cas, il est probable que la présence concomitante (ou préexistante) d’une infection virale ou bactérienne, ou encore, simplement de composantes de paroi bactérienne, telles les LPS, soit nécessaire pour activer pleinement les DC.
Les DC matures migrent ainsi vers les ganglions lymphatiques afin de présenter l’allergène via le CMH II à des lymphocytes CD4+. Afin de polariser les lymphocytes vers une réponse Th2, il faut que l’activation des lymphocytes soit effectuée dans un microenvironnement riche en IL-4 (3e signal important pour polariser les Th2). Contrairement à d’autres 3e signaux, l’IL-4 ne peut être produite
par les DC. Les basophiles/mastocytes ou les AM seraient des sources alternatives (118, 119). Bref, les premières étapes de la sensibilisation sont principalement effectuées par les DC qui capturent l’allergène.
Une fois les lymphocytes Th2 polarisés, ceux-ci vont à leur tour activer la production d’IgE par les lymphocytes B (Figure 1.5). Pour ce faire, les lymphocytes Th2 produisent deux signaux. Ils sécrètent des cytokines, dont l’IL-4, et expriment des molécules de co-stimulations, telles que le CD40L (120). Les lymphocytes B ainsi activés sécrètent des IgE qui se lient aux récepteurs à faible (CD23) et à haute affinité (FcRI). Quoique le CD23 ait un rôle secondaire dans la réponse allergique, il participe à l’activation de plusieurs leucocytes, tels que les MA, et facilite la présentation antigénique (120, 121). Quant à lui, le FcRI est exprimé principalement sur les basophiles et les mastocytes et a un rôle essentiel dans la réaction allergique (122). En effet, la liaison d’IgE à la surface des mastocytes est
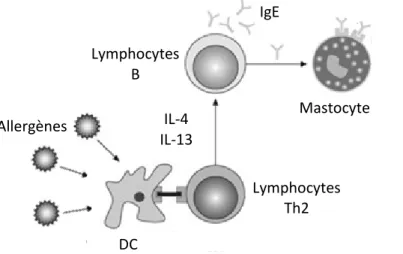
Figure 1.5 : Étapes importantes de la sensibilisation de
l’asthme allergique.
Interaction des principales cellules impliquées dans l’initiation de la cascade inflammatoire dans l’asthme allergique. Les DC capturent l’allergène et activent les lymphocytes T, qui à leur tour activent les lymphocytes B. Les lymphocytes B s’activent et sécrètent des IgE qui se lient aux mastocytes. Lorsqu’exposé de nouveau à l’allergène, tout le système immunitaire est prêt à induire la cascade inflammatoire.
Modifié de Holgate et al (103). DC Lymphocytes Th2 IL-4 IL-13 Lymphocytes B Allergènes Mastocyte s IgE
un signal de survie et de production de cytokines et permet l’activation des mastocytes lors d’une seconde rencontre avec l’allergène (123, 124). Quoiqu’illustré en un processus continu et ponctuel dans le temps, la sensibilisation s’effectue habituellement en plusieurs cycles. Ces cycles peuvent être plus ou moins rapprochés dans le temps et se superposent partiellement avec l’étape suivante, la cascade inflammatoire.
Cascade inflammatoire
Une fois la sensibilisation établie, i.e. lorsque le système immunitaire est suffisamment activé par les expositions à l’allergène, la prochaine exposition à l’allergène entraine une réponse immunitaire rapide et multifactorielle (Figure 1.6). La cascade inflammatoire est divisée en deux grandes étapes, soit la réaction immédiate et la réaction tardive (voir section 1.2.2). (125)
La réaction immédiate est déclenchée par l’activation des mastocytes et d’autres cellules inflammatoires résidentes des poumons (120). Les mastocytes sont dispersés dans le parenchyme pulmonaire, aussi bien au travers de l’épithélium bronchique que parmi les cellules musculaires lisses. L’activation des mastocytes s’effectue par la multimérisation des FCRI par l’allergène, ce qui induit la dégranulation des mastocytes. Donc, les mastocytes s’activent rapidement après l’entrée de l’allergène dans le poumon et libèrent principalement de l’histamine, des protéases, ainsi que certaines cytokines emmagasinées dans leurs granules (e.g. du TNF et un peu d’IL-4). L’histamine a comme principal effet d’induire la contraction des cellules musculaires lisses (ce qui induit la bronchoconstriction) et augmente également la perméabilité de l’endothélium et la sensibilité des terminaisons nerveuses. Quant à elles, les protéases sont impliquées dans la désorganisation de l’épithélium et favorisent la bronchoconstriction. En plus de libérer le contenu de leurs granules, les mastocytes synthétisent rapidement des médiateurs lipidiques, tels que le LTC4 et
la PGD2, qui participent à la bronchoconstriction, ainsi qu’au recrutement et à
l’activation de nombreuses cellules inflammatoires (103).
En plus de leur rôle dans la réaction immédiate, les mastocytes participent également à la réaction tardive. Ils produisent une panoplie de médiateurs inflammatoires, tels que l’IL-4, l’IL-5 et le TNF (126). Ces cytokines participent, entre autre, au recrutement des lymphocytes Th2 et des éosinophiles, ainsi qu’à
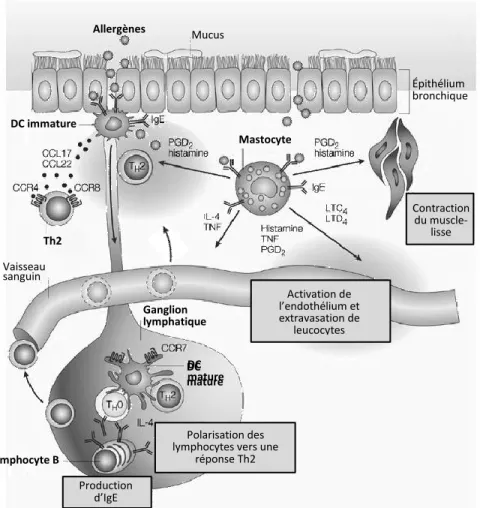
Figure 1.6 : Cascade inflammatoire de l’asthme allergique.
Représentations schématiques des principaux évènements impliqués dans le développement de la réponse inflammatoire asthmatique. Suite à la sensibilisation, l’exposition à l’allergène entraine l’activation des mastocytes qui dégranulent et libèrent plusieurs médiateurs Th2. De plus, les DC capturent l’allergène et activent les lymphocytes dans le poumon et dans les ganglions. Cette cascade induit une inflammation pulmonaire éosinophilique et initie le remodelage pulmonaire.Modifié de Lambrecht et al (125). DC mature s Mucus Épithélium bronchique Contraction du muscle-lisse Activation de l’endothélium et extravasation de leucocytes Polarisation des lymphocytes vers une
réponse Th2 Production d’IgE Vaisseau sanguin Ganglion lymphatique Th2 DC mature DC immature Mastocyte Allergènes Lymphocyte B
leur activation. En plus des mastocytes, les DC sont essentielles pour la mise en place de l’inflammation pulmonaire (112, 127). En effet, la déplétion des DC chez des souris sensibilisées inhibe le développement d’AHR et d’inflammation pulmonaire, tandis que l’injection de DC rend les animaux de nouveau suceptibles au dévelopement de l’asthme (128). Tout comme dans l’étape de sensibilisation, les DC sont importantes pour échantillonner les allergènes présents dans les voies aériennes. Par contre, à cette étape, les DC activent les lymphocytes aussi bien dans le poumon qu’aux ganglions lymphatiques (129, 130). Ces rôles sont davantage associés aux mDC, mais les pDC peuvent également participer à cette étape. En effet, le nombre de pDC augmente dans l’asthme suite à une exposition à l’allergène (131, 132), mais leur rôle est controversé (voir section 1.1.3) (38, 43, 114). Donc, les DC jouent un rôle important dans cette étape en capturant l’allergène et amplifiant la réponse Th2 (120). Cependant, il existe une controverse à savoir quelle population de DC est impliquée dans la cascade inflammatoire de l’asthme allergique.
L’activation des lymphocytes Th2 est la pierre angulaire de la cascade inflammatoire asthmatique et la sévérité de la maladie corrèle avec le niveau de lymophocytes Th2 (117). De plus, ceux-ci sont impliqués dans toutes les facettes de la maladie, aussi bien dans le maintien de l’AHR, que dans l’inflammation chronique et le remodelage bronchique (117, 120, 133). En effet, les lymphocytes sont la principale source d’IL-4, ainsi que d’IL-5, d’IL-9 et d’IL-13, des cytokines prototypiques de l’asthme allergique (117, 134). Tous ces médiateurs participent entre autres à la désorganisation de l’épithélium et de l’endothélium, ainsi qu’à l’activation des cellules musculaires lisses. De plus, les lymphocytes Th2 sont très importants pour le recrutement des autres cellules inflammatoires au poumon, dont les éosinophiles. L’association de l’éosinophile dans l’asthme allergique est connue depuis presque 100 ans, mais son rôle est encore débattu. L’éosinophilie est typiquement associée au développement d’AHR (110), mais de récentes études suggèrent que chez certains type d’asthme, l’AHR n’est pas associé au nombre d’éosinophiles (135-138). Malgré tout, les éosinophiles sont considérés